Method Article
تقييم مخاطر الإصابة بسرطان القولون والمستقيم وانتشاره عن طريق الكشف عن سلامة الحمض النووي البراز
In This Article
Erratum Notice
Summary
مجموعة FL-DNA التشخيصية المقدمة هي طريقة موفرة للوقت وسهلة الاستخدام لتحديد الاحتمال الموثوق بوجود آفات سرطان القولون والمستقيم.
Abstract
في الوقت الحاضر، يمكن عزل الحمض النووي البراز وتحليلها بعدة طرق. يمكن الكشف عن الأجزاء الطويلة من الحمض النووي في البراز عن طريق فحص qPCR ، مما يوفر احتمالًا موثوقًا به لوجود آفات القولون والمستقيم قبل النيوبلاستيك أو النيوبلاستيك. هذه الطريقة، تسمى الحمض النووي الطويل فلورسينس (FL-DNA)، هي إجراء سريع وغير جراحي يعد تحسينًا على نظام الوقاية الأولي. وتستند هذه الطريقة إلى تقييم سلامة الحمض النووي البرازي عن طريق التضخيم الكمي لأهداف محددة من الحمض النووي الجينومي. على وجه الخصوص ، فإن تقييم شظايا الحمض النووي لفترة أطول من 200 bp يسمح بالكشف عن المرضى الذين يعانون من آفات القولون والمستقيم مع خصوصية عالية جدا. ومع ذلك، فإن هذا النظام وجميع اختبارات الحمض النووي البراز المتاحة حاليا ً تعرض بعض القضايا العامة التي تحتاج إلى معالجة (على سبيل المثال، وتيرة إجراء الاختبارات والعدد الأمثل من عينات البراز التي يتم جمعها في كل نقطة زمنية لكل فرد). ومع ذلك ، فإن الميزة الرئيسية لFL-DNA هي إمكانية استخدامه بالاقتران مع اختبار يستخدم حاليًا في برنامج فحص CRC ، المعروف باسم اختبار الدم الغامض البرازي القائم على البيوكيميائية المناعية (iFOBT). في الواقع ، يمكن إجراء كلا الاختبارين على نفس العينة ، مما يقلل من التكاليف ويحقق تنبؤًا أفضل بوجود آفات القولون والمستقيم في نهاية المطاف.
Introduction
سرطان القولون والمستقيم (لجنة حقوق الطفل) مستمد من عملية متعددة الخطوات التي يتطور الظهارة الصحية ببطء إلى أورام غدية أو الاورام الحميدة ، والتي تتطور إلى الأورام السرطانية الخبيثة مع مرور الوقت1،2. وعلى الرغم من ارتفاع معدل الإصابة في اتفاقية حقوق الطفل، لوحظ اتجاه تنازلي في النسبة المئوية للوفيات على مدى العقد الماضي3. في الواقع، أدت أدوات التشخيص المبكر المعتمدة في برامج الفحص إلى الكشف المبكر وإزالة الأورام الحميدة قبل النيوبلاستيك أو الاورام الحميدة4. ومع ذلك ، نظرا لاختلاف الحدود التقنية ، لا شيء من هذه الأساليب هو الأمثل. في الواقع، من أجل تحسين الحساسية والتحديد، وقد اقترح العديد من اختبارات الحمض النووي البراز وحدها أو في تركيبة مع الاختبارات التشخيصية الروتينية الحالية5,6.
عادة ، يلقي الغشاء المخاطي الصحي في الخلايا القولونية المبرئة في تيار البراز ، في حين أن الغشاء المخاطي المريض يقشر الخلايا القولونية غير المبرمجة. أجزاء من 200 نقطة بريتيش بتروليوم أو أكثر في الطول تميز الحمض النووي غير المبرمج. يسمى هذا الحمض النووي الحمض النووي الطويل (L-DNA) وأصبح علامة بيولوجية قابلة للاستخدام للتشخيص المبكر للجنة حقوق الطفل. يمكن عزل L-DNA من عينة البراز وكميا من قبل qPCR باستخدام في7المختبر التشخيص FL-DNA عدة7,8,,9,,10,,11,,12.
يتكون الاختبار من اثنين من المقالات للكشف عن شظايا FL-DNA تتراوح بين 138 نقطة أساس إلى 339 نقطة بالثانية. كل فحص يسمح تضخيم FL-DNA (FAM) وكذلك ارتفاع في الحمض النووي (HEX). لضمان التضخيم الأمثل لجميع الشظايا، تم تقسيم الاختبار إلى قسمين (اسمه "A" و "B"). يكتشف الناياج A منطقتين من exon 14 من جين APC (NM_001127511) وجزء من exon 7 من جين TP53 (NM_001276760). يكتشف المنازى B جزءًا من exon 14 من جين APC (NM_001127511) ومنطقتين من الطاردات 5 و 8 من جين TP53 (NM_001276760). لا تميز المقالات بين المناطق المكتشفة. يتوافق الحمض النووي للارتفاع في الحمض النووي لحمض هونورينتشوس كيتا السلمون الحمض النووي ويمكّن من التحقق من أن الإجراء قد تم بشكل صحيح ويتحقق من الوجود المحتمل للمثبطات ، والتي قد تسفر عن نتائج سلبية كاذبة. يتم تقييم تركيز FL-DNA عن طريق التحديد الكمي المطلق باستخدام طريقة المنحنى القياسي ويتم التعبير عنه على أنه نانوغرام /رد فعل.
طريقة FL-DNA هي اختبار الحمض النووي البراز غير الغازية وغير مكلفة التي، جنبا إلى جنب مع اختبار الدم الخفي البرازي القائم على المناعة الكيميائية (iFOBT)، ويستخدم حاليا في برامج فحص لجنة حقوق الطفل ويسمح لتنبؤات أفضل من CRC و / أو آفات الورم الحميد عالية الخطورة12.
Protocol
تم تعيين المرضى في Istituto Scientifico Romagnolo per lo Studio e la Cura dei Tumori (IRST) من Meldola (FC, Italy) بين عامي 2013 و 2015. وكان المرضى المسجلون في البروتوكول IRSTB002، الذي وافقت عليه لجنة الأخلاقيات في IRST - IRCCS AVR (25/10/2012، في ر. 1). وقد تم تنفيذ جميع الأساليب وفقا للمبادئ التوجيهية واللوائح ذات الصلة. وتم الحصول على موافقة خطية مستنيرة من جميع المرضى.
1. استخراج الحمض النووي من البراز
- استخدام عدة لإعداد عينات البراز (انظر جدول المواد).) حدد وعالج مواد البراز عن طريق إجراء عملية الاستخراج وفقًا لتعليمات الشركة المصنعة. تضخيم الحمض النووي النقي مباشرة أو تخزينها في -20 درجة مئوية للتحليل اللاحق.
2. إعداد السيطرة الإيجابية، والمعايير، وارتفاع في الحمض النووي، والعينات السريرية
- إعداد المعايير والعينات
- لإعداد السيطرة الإيجابية، والمعايير، وارتفاع في الحمض النووي، وجميع العينات السريرية، وأجهزة الطرد المركزي aliquot من السيطرة الإيجابية، والمعايير، وارتفاع في الحمض النووي، ثم إعادة تعليق كل كاشف عن طريق إضافة الكمية الصحيحة من المياه المقدمة (انظر أدناه). ثم، دوامة بعناية السيطرة الإيجابية، القياسية، وارتفاع في الحمض النووي، ثم الطرد المركزي لمدة 10 s. لتحقيق إعادة تعليق كامل من الكواشف الجافة، وتخزين الكواشف السائلة في درجة حرارة الغرفة (RT) لمدة 30 دقيقة قبل الاستخدام.
- التحكم الإيجابي هو الحمض النووي البشري في شكل جاف. إعادة تعليق كل aliquot مع 750 ميكرولتر من الماء.
- الحمض النووي الالارتفاعي هو سمك السلمون(Oncorhynchus keta)DNA ، والذي يستخدم كتحكم داخلي خارجي للتحقق من احتمال وجود مثبطات في عينات الحمض النووي المستخرجة من البراز. إعادة تعليق كل aliquot مع 100 ميكرولتر من الماء.
- لإعداد المنحنى القياسي، قم بإنتاج أربعة تخفيفات 1:5 بدءًا من محلول المخزون. يجب أن تكون النقاط القياسية 10 نانوغرام / رد فعل ، 2 نانوغرام / رد فعل ، 0.4 نانوغرام / رد فعل ، و 0.08 نانوغرام / رد فعل.
- لإعداد السيطرة الإيجابية، والمعايير، وارتفاع في الحمض النووي، وجميع العينات السريرية، وأجهزة الطرد المركزي aliquot من السيطرة الإيجابية، والمعايير، وارتفاع في الحمض النووي، ثم إعادة تعليق كل كاشف عن طريق إضافة الكمية الصحيحة من المياه المقدمة (انظر أدناه). ثم، دوامة بعناية السيطرة الإيجابية، القياسية، وارتفاع في الحمض النووي، ثم الطرد المركزي لمدة 10 s. لتحقيق إعادة تعليق كامل من الكواشف الجافة، وتخزين الكواشف السائلة في درجة حرارة الغرفة (RT) لمدة 30 دقيقة قبل الاستخدام.
- إعداد 1x ارتفاع في الحمض النووي
- إعداد ارتفاع في السيطرة على الحمض النووي مباشرة قبل الاستخدام.
- إعداد 1x ارتفاع في السيطرة على الحمض النووي عن طريق خلط 5 ميكرولتر من ارتفاع FL-DNa مع 20 ميكرولتر من الماء المعقم. وسيتم إعداد عدد عينات التحكم في الحمض النووي ذات الارتفاع الحاد 1x وفقا لعدد العينات التي سيتم تحليلها، بالإضافة إلى التحكم الإيجابي.
- إعداد العينات
- مزيج 75 ميكرولتر من العينات (عينات سريرية أو التحكم الإيجابي) مع 25 ميكرولتر من 1x ارتفاع في الحمض النووي، مما أسفر عن حجم إجمالي قدره 100 ميكرولتر.
3. تضخيم وتحديد قيمة FL-DNA باستخدام qPCR Easy PGX
ملاحظة: يتم توفير خلائط التضخيم الكامل التي تحتوي على أجهزة تمهيدية محددة وتحقيقات تستهدف الحمض النووي البشري والرقابة الداخلية في شكل lyophilised في 8 شرائط بئر لـ FL-DNA Mix A و FL-DNA Mix B. Standards، والضوابط الإيجابية والسلبية، ويجب تضخيم العينات مع كل من الخلطات lyophilized. يجب فقط تضخيم العينات السريرية في مكررة مع كل من يمزج lyophilized.
- انظر جدول المواد لأداة qPCR وبرامج التشغيل.
- افتح برنامج التشغيل واضبط اللوحة والملف الحراري:
- إعداد اللوحة كما هو موضح في الجدول 1.
- تعيين نوع البئر لجميع المواضع الثمانية في العمود 1 كمعيار.
- تعيين نوع البئر لآبار A2 و B2 كما NTC.
- تعيين نوع البئر لC2 و D2 (عناصر التحكم الإيجابية) كما غير معروف.
- تعيين نوع البئر لكافة المواضع الأخرى كـ غير معروف.
- حدد جميع المراكز الـ 96، وأضف Dyes FAM و HEX. انقر فوق لوحة المزامنة.
- تعيين التشكيل الحراري وفقا للجدول 2.
- إعداد اللوحة كما هو موضح في الجدول 1.
- الطرد المركزي العدد اللازم من شرائط ل10 ق لجلب محتويات إلى الجزء السفلي من الأنبوب.
- إزالة بلطف الأختام من شرائط، مع إيلاء الاهتمام للاحتفاظ محتويات، وإضافة إلى شرائط ذات الصلة: التحكم السلبي: 20 ميكرولتر من الماء؛ العينة: 20 ميكرولتر من الحمض النووي. منحنى قياسي: 20 ميكرولتر من المعيار 1 أو 2 أو 3 أو 4؛ التحكم الإيجابي: 20 ميكرولتر من التحكم الإيجابي.
- إغلاق بعناية جميع شرائط باستخدام 8 شريط القبعات البصرية المسطحة والدوامة لبضع ثوان.
- طرد مركزي شرائط لمدة 10 s وتحميلها في الصك. ثم ابدأ التشغيل.
- افتح برنامج التشغيل واضبط اللوحة والملف الحراري:
4 - تحليل البيانات
ملاحظة: يمكن إجراء تحليل البيانات تلقائيًا أو يدويًا اعتمادًا على البرنامج (انظر جدول المواد).
- في نهاية الشوط ، حدد الأعمدة A و C و E و G لـ"FAM: FL-DNA-A" و"HEX: IC"، والأعمدة B و D و F و H لـ"FAM: FL-DNA-B" و"HEX: IC".
- تعيين ما يلي لكمية بدء الكميات القياسية:10 نانوغرام/ رد فعل لآبار A1 و B1، 2 نانوغرام/رد فعل لـ C1 و D1، 0.4 نانوغرام/رد فعل لـ E1 وF1، و0.08 نانوغرام/رد فعل لـ G1 وH1.
- تعيين قيم الفلورسينس عتبة إلى 150 لكل من FAM (FL-DNA A و FL-DNA B) وHEX (IC) القنوات.
- في جدول نتائجالمربع، انقر فوق خيارات العمود | حدد الكل | موافق للحصول على النتائج في كلتا القناتين مع كل من Cq (R) والقيم الأخيرة.
ملاحظة: يتم توفير هذه القيم بواسطة برنامج أداة PCR الوقت الحقيقي. آخر مرة يتوافق مع قيمة الفلورسينس التي تم تطبيعها إلى دورة التضخيم الأخيرة. - في جدول النتائج في المربع، انقر بزر الماوس الأيمن على الجدول لفتح قائمة السياق وانقر فوق إرسال إلى Excel لتصدير البيانات الخام.
- تحقق من قيم المعايير للتحقق من ملاءمة المنحنى القياسي.
- لكل مزيج FL-DNA، تحقق من R2 ["R² (-R)" العمود] والكفاءة ["الكفاءة (%)" عمود] القيم. إذا كانت في نطاق مقبول ، فمن الممكن المضي قدما في التحليل وفقا لتعليمات الشركة المصنعة(الجدول 3).
- إذا لم تكن نتائج قناة FAM في النطاق المتوقع، قم بحذف نقطة واحدة من المنحنى القياسي وإعادة تحليل التشغيل.
- تحديد قيم عناصر التحكم السلبية والإيجابية مع الصيغة التالية، مع الأخذ في الاعتبار قيم "لا Cq" كصفر:

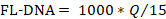
- قارن القيم التي تم الحصول عليها مع تلك التي تم الإبلاغ عنها في الجدول 4.
- إذا كانت عناصر التحكم في التفاعل في نطاق القيم المتوقعة، فتابع تحليل العينات.
ملاحظة: تحقق من أن قيم Cq التي تم الحصول عليها يتم إنشاؤها من تفاعل تضخيم حقيقي (منحنى الفلورسينس) وليس من قطعة أثرية (منحنى الفلورسينس الخطي). - لتحليل مدى ملاءمة العينة لكل مزيج FL-DNA، قارن قيم Cq لقناة HEX. إذا كانت القيمة ≥ 16، والمضي قدما في تحليل العينات. إذا كانت القيمة <16 أو لم يكن هناك Cq، فمن المحتمل أن يكون ذلك بسبب خطأ في الاستغناء عن FL-DNA Spike. لذلك، لا يمكن تحليل العينات.
- حساب متوسط قيم CQ في قناة "HEX" للتحكم الإيجابي باستخدام الصيغة التالية:
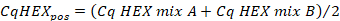
- حساب متوسط قيم CQ في قناة "HEX" من العينة ينسخ باستخدام الصيغة التالية:
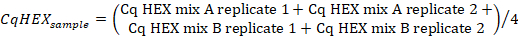
- حساب قيم CqHEX وفقا للصيغة التالية:

- قارن قيم CqHEX للعينات مع تلك الواردة في الجدول 5.
- لكل مزيج (ميكس A وMix B)، قارن قيم Cq لقناة FAM مع تلك الواردة في الجدول 6.
- لتحديد قيمة FL-DNA لكل عينة مناسبة، استخدم الصيغة التالية، مع الأخذ في الاعتبار قيم "لا Cq" كصفر:
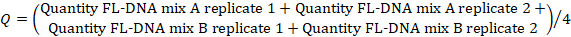
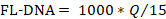
ملاحظة: خطر الإصابة بسرطان القولون والمستقيم وانتشاره هو وظيفة من التقييمات iFOBT وFL-DNA وفقا لنتائج نومغرام فاغان التي حصلت عليها Rengucci وآخرون12 (الجدول 7).
النتائج
يظهر سير عمل هذا البروتوكول في الشكل 1. يوفر سير العمل خطوتي تحكم وإجراءات مختلفة وفقًا لنتائج الخطوة هذه. أولاً، إذا كانت العينة تقدم عناصر تحكم غير مناسبة، يجب تكرار التضخيم. ثانياً، إذا تم تثبيط التضخيم، يجب إعادة معالجة العينة من البداية أو تصنيفها على أنها غير قيّمة.
ويبين الشكل 2 منحنيات الفلورسينس التي تنتجها عينات إيجابية وسلبية. (أ)هو مبين مثال على عينة إيجابية مناسبة. إشارة العينة على قناة HEX ضمن النطاق المقبول. الإشارة الإيجابية فوق العتبة على قناة FAM. (ب)هو مثال على عينة سلبية / غير إيجابية مناسبة. إشارة العينة ضمن النطاق المقبول على قناة HEX. إشارة التحكم السلبية أقل من العتبة على قناة FAM. (C)هو مثال على عينة غير مناسبة. إشارة العينة ليست ضمن النطاق المقبول على قناة HEX. وبالتالي ، يمكن افتراض تثبيط المحتملة. يجب تكرار هذه العينة، بدءًا من الاستخراج.
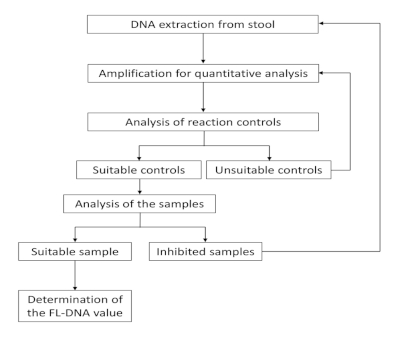
الشكل 1: سير العمل للقياس الكمي لـ FL-DNA. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
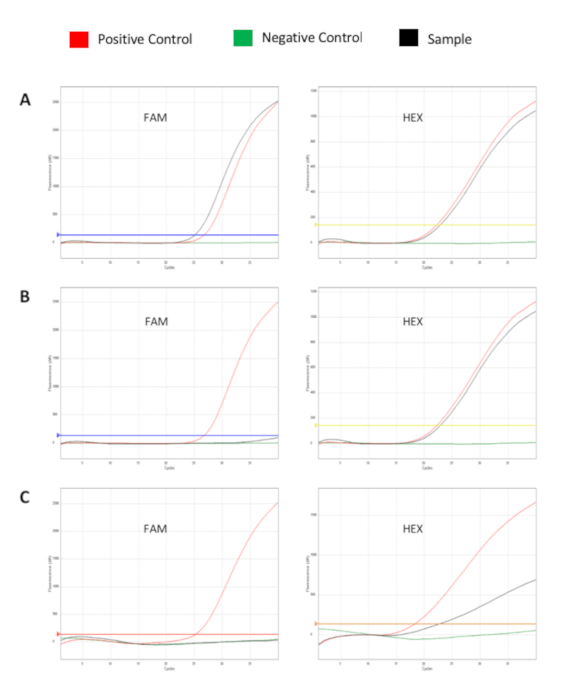
الشكل 2: منحنيات الفلورسية التي تبين تضخيم الجينات المستهدفة للمزيج A (أو Mix B) (القناة FAM) والرقابة الداخلية (القناة HEX). (أ) عينة إيجابية FL-DNA. (ب) عينة سالبة FL-DNA. (ج) تثبيط تضخيم العينة. منحنى أحمر: التحكم الإيجابي; منحنى أخضر: التحكم السلبي؛ منحنى أسود: عينة سريرية. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | X | |||
| أ | المعيار 1 | المياه | الحمض النووي2 | الحمض النووي4 | الحمض النووي6 | الحمض النووي8 | الحمض النووي10 | الحمض النووي12 | الحمض النووي14 | الحمض النووي16 | الحمض النووي18 | الحمض النووي20 | 1 | FL-DNA ميكس A | |
| ب | المعيار 1 | المياه | الحمض النووي2 | الحمض النووي4 | الحمض النووي6 | الحمض النووي8 | الحمض النووي10 | الحمض النووي12 | الحمض النووي14 | الحمض النووي16 | الحمض النووي18 | الحمض النووي20 | 2 | FL-DNA ميكس B | |
| ج | المعيار 2 | Pos | الحمض النووي2 | الحمض النووي4 | الحمض النووي6 | الحمض النووي8 | الحمض النووي10 | الحمض النووي12 | الحمض النووي14 | الحمض النووي16 | الحمض النووي18 | الحمض النووي20 | 3 | FL-DNA ميكس A | |
| د | المعيار 2 | Pos | الحمض النووي2 | الحمض النووي4 | الحمض النووي6 | الحمض النووي8 | الحمض النووي10 | الحمض النووي12 | الحمض النووي14 | الحمض النووي16 | الحمض النووي18 | الحمض النووي20 | 4 | FL-DNA ميكس B | |
| ه | المعيار 3 | الحمض النووي1 | الحمض النووي3 | الحمض النووي5 | الحمض النووي7 | الحمض النووي9 | الحمض النووي11 | الحمض النووي13 | الحمض النووي15 | الحمض النووي17 | الحمض النووي19 | الحمض النووي21 | 5 | FL-DNA ميكس A | |
| و | المعيار 3 | الحمض النووي1 | الحمض النووي3 | الحمض النووي5 | الحمض النووي7 | الحمض النووي9 | الحمض النووي11 | الحمض النووي13 | الحمض النووي15 | الحمض النووي17 | الحمض النووي19 | الحمض النووي21 | 6 | FL-DNA ميكس B | |
| ز | المعيار 4 | الحمض النووي1 | الحمض النووي3 | الحمض النووي5 | الحمض النووي7 | الحمض النووي9 | الحمض النووي11 | الحمض النووي13 | الحمض النووي15 | الحمض النووي17 | الحمض النووي19 | الحمض النووي21 | 7 | FL-DNA ميكس A | |
| ح | المعيار 4 | الحمض النووي1 | الحمض النووي3 | الحمض النووي5 | الحمض النووي7 | الحمض النووي9 | الحمض النووي11 | الحمض النووي13 | الحمض النووي15 | الحمض النووي17 | الحمض النووي19 | الحمض النووي21 | 8 | FL-DNA ميكس B |
الجدول 1: لوحة إعداد مع توزيع التحكم والمنحنى والعينات. يشير العمود X إلى الرقم المطبوع على الجزء العلوي من الشريط.
| خطوه | درجة الحرارة والوقت |
| بداية ساخنة (دورة واحدة) | 95 درجة مئوية لمدة 5 دقيقة |
| التضخيم (40 دورة) | 95 درجة مئوية لـ 15 سنة 54 درجة مئوية لـ 15 سنة 60 درجة مئوية لمدة 45 سنة (جمع البيانات) |
الجدول 2: التشكيل الحراري لتضخيم الحمض النووي.
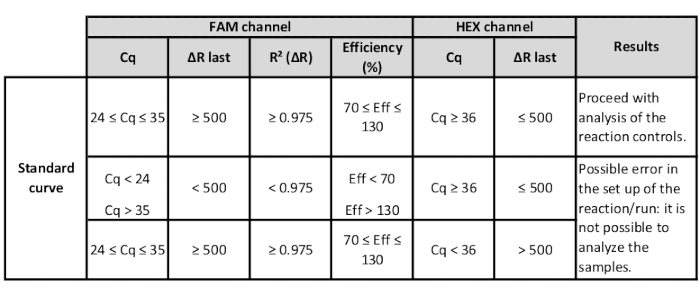
الجدول 3: نطاق قيم قناة HEX و FAM للمعايير للتحقق من ملاءمة المنحنى القياسي.

الجدول 4: نطاق قيم قناة HEX و FAM من عناصر التحكم السلبية والإيجابية للتحقق من ملاءمة التشغيل.

الجدول 5: نطاق قيم قناة HEX وFAM للعينات للتحقق من مدى ملاءمة تحليل العينة.

الجدول 6: مزيج A و Mix B Cq القيم من قناة FAM للتحقق من مدى ملاءمة تحليل FL-DNA.
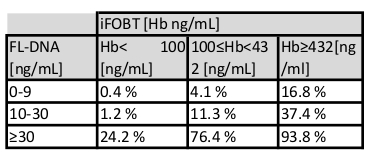
الجدول 7: تقييم مخاطر السرطان كدالة لقيم iFOBT وFL-DNA. وفقا للعلاقة بين قيم iFOBT وFL-DNA، يقدر الجدول احتمال الآفات البلاستيكية النيوية القولونوية.
Discussion
وقد أظهرت الدراسات السابقة أن تحليل سلامة الحمض النووي من البراز المستخرجة من النهج اليدوية وشبه التلقائية يمكن أن تمثل أداة بديلة للكشف المبكر عن آفات القولون والمستقيم7،8،9,،10،11،12. وقد وضعت اختبارات الفحص الجزيئية غير الباضعة على مر السنين للكشف عن سرطان القولون والمستقيم، ولكن الانتشار الواسع النطاق لهذه الأساليب محدود بسبب النهج المستهلكة للوقت وضعف فعالية التكلفة مقارنة باختبارات الفحص الأخرى.
وهذا النهج رخيص نسبيا ولا يستغرق وقتا طويلا. كما أنه زاد من الدقة في الكشف عن آفات القولون والمستقيم بسبب إجراء جديد يتطلب بضع خطوات يدوية. النهج الموصوف هنا سريع مع عدد أقل من الخطوات اليدوية ، ويمكن أن يتم تنفيذه بسهولة على العديد من العينات في الأسبوع. استخراج الحمض النووي لا يقدم قضايا معينة ويمكن القيام به من خلال خطوات يدوية سهلة أو استخدام أداة أوتوماتيكية. في الحالة الأخيرة ، من الضروري تحديد أداة استخراج الحمض النووي التلقائي ، مما يسمح بالنتائج الأكثر قابلية للتكرار. الخطوة الأكثر أهمية لاستخراج الحمض النووي هو جمع البراز وطريقة تخزينه قبل استخراج الحمض النووي. فمن المستحسن للحفاظ على البراز المجمدة والمضي قدما في استخراج في أقرب وقت ممكن.
وتتمثل قضية أخرى حاسمة من قبل مثبطات محتملة من ردود فعل التضخيم. استخراج البراز غير قادر على تنقية الحمض النووي الجينومي ، حيث أن الشوائب تعرض رد فعل التضخيم الصحيح للخطر. في هذا الصدد ، يتطلب البروتوكول استخدام الحمض النووي للتحقق من وجود / عدم وجود مثبطات التفاعل.
حتى وقت قريب ، اختبار الدم الخفي البراز هو النهج الرئيسي المستخدم للكشف عن آفات القولون والمستقيم في برامج الفحص . على الرغم من أنه يقدم بعض الحدود من حيث الدقة. استراتيجية بديلة لتشخيص سرطان القولون والمستقيم تقوم على تحليل الحمض النووي من الخلايا مقشر تفرز في البراز. وقد تم تقييم عدة نُهج في العام الماضي، ولكن لا توجد أي نُهج متاحة للاستخدام في برامج الفحص.
يمكن أن تكون قيمة سلامة FL-DNA بديلاً مفيداً ، والذي بالاقتران مع قيمة اختبار iFOBT القياسية ، يمكن التنبؤ بوجود الأورام و / أو الأورام الغدية عالية الخطورة11،12 من قبل نهج Fagan Nomogram10 (الجدول 7). يقدر هذا النهج احتمال الاختبار المشترك لوجود آفة من البلاستيك النيوplastic ، مما يحسن الدقة التشخيصية مقارنة بالنهج القياسي المستخدم وحده.
قد تساعد هذه المعلومات الأطباء في تخطيط الاختبارات التشخيصية بالإضافة إلى تنظير القولون المناسب وتخصيص مراقبته. في الواقع ، فإن مجموعة FL-DNA تبسط الخطوات اليدوية وتضمن نتائج مستقرة ومتسقة. ومع ذلك، لا تزال هناك بعض المسائل التي يتعين توضيحها لتحسين الدقة التشخيصية للطريقة. فعلى سبيل المثال، ينبغي اختيار تواتر إجراء الاختبارات وعدد عينات البراز التي تحتاج إلى تحليل في نقاط زمنية محددة لكل فرد اختياراً دقيقاً. وبالنظر إلى أن هذا الاختبار يجب أن يتم بالتزامن مع iFOBT، فإن الطريقة التي تتطلب جمع كل عامين، كما هو معتاد في العديد من بروتوكولات الفحص، ضرورية للتحقق من فعالية هذا الاختبار كبديل أو بديل لاختبارات الفحص الحالية.
Disclosures
مورا منغي هي موظفة بدوام كامل في شركة Diatech Pharmacogenetics srl.
Acknowledgements
وليس لدى أصحاب البلاغ أي إقرارات.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL and 2 mL polypropylene twist-lock tubes (DNase-, RNase-, DNA-, PCR inhibitor-free) | Consumables required for DNA extraction and Real Time PCR | ||
| Absolute Ethanol (quality of analytical degree) | Reagent required for DNA extraction | ||
| Benchtop centrifuge | Maximum speed of 20000 x g. Instrument required for DNA extraction | ||
| EasyPGX analysis software version 2.0.0 | Diatech Pharmacogenetics | RT800-SW | Analysis software |
| EasyPGX centrifuge/vortex 8-well strips | Diatech Pharmacogenetics | RT803 | Instrument recommended for the Real Time PCR assay |
| EasyPGX qPCR instrument 96 | Diatech Pharmacogenetics | RT800-96 | Instrument recommended for the Real Time PCR assay |
| EasyPGX ready FL-DNA | Diatech Pharmacogenetics | RT029 | Kit required for the Real Time PCR assay |
| Micropipettes (volumes from 1 to 1.000 µL) | Consumables required for DNA extraction and Real Time PCR | ||
| Powder-free disposable gloves | Consumables required for DNA extraction and Real Time PCR | ||
| QIAamp Fast DNA Stool | Qiagen | 51604 | Kit recommended for the DNA extraction and purification from stool |
| Sterile filter tips DNase-, RNase-free (volumes from 1 to 1.000 µL) | Consumables required for DNA extraction and Real Time PCR | ||
| Thermal block e.g. EasyPGX dry block | Diatech Pharmacogenetics | RT801 | Instrument required for DNA extraction |
| Vortex e.g. EasyPGX centrifuge/vortex 1.5 ml | Diatech Pharmacogenetics | RT802 | Instrument required for DNA extraction |
References
- Fearon, E. R. Molecular Genetics of Colorectal Cancer. Annual Review of Pathology. 6, 479-507 (2011).
- Sears, C. L., Garrett, W. S. Microbes, Microbiota, and Colon Cancer. Cell Host and Microbe. 15, 317-328 (2014).
- Levin, B., et al. Screening and Surveillance for the Early Detection of Colorectal Cancer and Adenomatous Polyps, 2008: A Joint Guideline From the American Cancer Society, the US Multi-Society Task Force on Colorectal Cancer, and the American College of Radiology. Gastroenterology. 134, 1570-1595 (2008).
- Bosch, L. J., et al. Molecular tests for colorectal cancer screening. Clinical Colorectal Cancer. 10, 8-23 (2011).
- Ahlquist, D. A. Molecular detection of colorectal neoplasia. Gastroenterology. 138, 2127-2139 (2010).
- Calistri, D., et al. Fecal multiple molecular tests to detect colorectal cancer in stool. Clinical Gastroenterology and Hepatology. 1, 377-383 (2003).
- Calistri, D., et al. Detection of colorectal cancer by a quantitative fluorescence determination of DNA amplification in stool. Neoplasia. 6, 536-540 (2004).
- Calistri, D., et al. Quantitative fluorescence determination of long-fragment DNA in stool as a marker for the early detection of colorectal cancer. Cellular Oncology. 31, 11-17 (2009).
- Calistri, D., et al. Fecal DNA for noninvasive diagnosis of colorectal cancer in immunochemical fecal occult blood test-positive individuals. Cancer Epidemiology Biomarkers and Prevention. 19, 2647-2654 (2010).
- De Maio, G., et al. Circulating and stool nucleic acid analysis for colorectal cancer diagnosis. World Journal of Gastroenterology. 20, 957-967 (2014).
- Rengucci, C., et al. Improved stool DNA integrity method for early colorectal cancer diagnosis. Cancer Epidemiology Biomarkers and Prevention. 23, 2553-2560 (2014).
Erratum
Formal Correction: Erratum: Evaluation of Colorectal Cancer Risk and Prevalence by Stool DNA Integrity Detection
Posted by JoVE Editors on 9/28/2020. Citeable Link.
An erratum was issued for: Evaluation of Colorectal Cancer Risk and Prevalence by Stool DNA Integrity Detection. An affiliation was updated.
The first affiliation was updated from:
Istituto Scientifico Romagnolo per lo Studio e la Cura dei Tumori (IRST)
to:
Istituto Scientifico Romagnolo per lo Studio e la Cura dei Tumori (IRST) IRCCS, Meldola, Italy
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved