Method Article
Murin Glomerüler Mezanjiyal Hücrelerin İzolasyonunu ve Saflaştırılmasını Optimize Etmek
Bu Makalede
Özet
Bu çalışma, murin mezanjiyal hücrelerinin (MC'ler) ve bunların ex vivo hücre kültürlerinin izolasyonu için optimize edilmiş bir protokol geliştirmiştir. Bu hücreler, hücre büyümesinden veya protein ekspresyonundan ödün vermeden birden çok kez pasajlanabilir, dondurulabilir, canlandırılabilir ve kültürlenebilir.
Özet
Mezanjiyal hücreler (MK'ler), glomerulsun orta boşluğunda yer alan ve glomerüler homeostazda önemli işlevlere sahip stromal hücrelerdir. Glomerüler MC'lerin izole edilmesi, saflaştırılması ve kültürlenmesi için yöntemler, 1980'lerden beri biyomedikal araştırmalarda, özellikle nefroloji alanında kullanılmak üzere geliştirilmiş ve optimize edilmiştir. Fareler, böbrek hastalıkları ile ilgili araştırmalarda en sık kullanılan deney hayvanı modelleridir. Bu çalışmada, murin MC'lerin izolasyonu ve ex vivo hücre kültürü için optimize edilmiş bir protokol geliştirdik. Bu hücreler, hücre büyümesinden veya protein ekspresyonundan ödün vermeden birden çok kez pasajlanabilir, dondurulabilir, canlandırılabilir ve kültürlenebilir. Bu optimize edilmiş yaklaşım, araştırmacılar için çalışma süresini önemli ölçüde azaltır ve uzun süreli hücre korumasını sağlar. Prosedürler için gerekli ekipmana temel bir biyomedikal laboratuvarda kolayca erişilebilir ve prosedür adımları basittir. Hedef hücrelerin elde edilmesi sadece 2-3 hafta gerektirir, bu da mevcut yöntemlere kıyasla en az 1 haftalık bir azalma gerektirir.
Giriş
Glomerulus, idrar1 oluşturmak için kanı filtrelemenin temel görevini yerine getiren bir kılcal damar ağıdır. Mezanjiyal hücreler (MC'ler), glomerüler kılcal damarlar arasında yer alan mezanjiyal matris içine gömülüdür ve çeşitli işlevleri aracılığıyla glomerüler dinamikleri etkilemek için benzersiz bir şekilde konumlandırılmıştır2. MC'ler, glomerüler gelişim, glomerüler kılcal damarlar için yapısal destek, fagositoz ve glomerüler bazal membran matrisi3'ün üretimi dahil olmak üzere glomerulusta çok önemli roller oynar. Mezanjiyal hücrelerin incelenmesi, böbrek fizyolojisi ve patolojisi hakkındaki anlayışımızı ilerletmek için çok önemlidir.
Mezanjiyal hücrelerin patolojik durumlarda tutulumu da dikkat çekicidir. Diyabetik nefropati veya glomerülonefrit gibi glomerüler yaralanma veya hastalığa yanıt olarak, mezanjiyal hücreler çoğalabilir ve aşırı hücre dışı matris bileşenlerini salgılayabilir, bu da glomerüloskleroza ve böbrek fonksiyonunun bozulmasına yol açabilir 4,5. Bu nedenle, mezanjiyal hücrelerin işlevlerini ve düzenleyici mekanizmalarını anlamak, böbrek hastalıkları için terapötik stratejiler geliştirmek için çok önemlidir.
Murin mezanjiyal hücreleri, araştırmacıların IgA nefropatisi6, diyabetik nefropati7 ve fokal segmental glomerüloskleroz (FSGS)8,9 gibi durumlarda yer alan moleküler ve hücresel süreçleri modellemelerini ve keşfetmelerini sağlar. Renal fibroz ve inflamasyondaki rolleri göz önüne alındığında, murin glomerüler MC'ler, terapötik bileşiklerin etkinliğini değerlendirmek için klinik çalışmalarda sıklıkla kullanılmaktadır 9,10. Ek olarak, murin mezanjiyal hücreleri, RhoA/ROCK yolu11 ve Dönüştürücü Büyüme Faktörü-beta (TGF-β) yolu12 dahil olmak üzere çeşitli sinyal yollarının böbrek fonksiyonu üzerindeki etkilerini incelemek için önemli bir araçtır. Bu çalışmalar, bu sinyal moleküllerinin böbrek hastalığının ilerlemesine nasıl katkıda bulunduğunu aydınlatmaya yardımcı olur. Hastalık modellemesi, terapötik geliştirme veya sinyal iletim araştırması için kullanılsa da, murin MC'leri böbrek sağlığı ve hastalığı anlayışımızı ilerletmek için çok önemli bir kaynak olarak hizmet etmeye devam ediyor.
Mackay ve ark. 1988'de transgenik farelerden glomerüler epitelyal, mezanjiyal ve endotel hücrelerinin ex vivo hücre dizilerini elde etmek için bir yöntem geliştirdi13. Wilson ve Stewart, primer MC'leri hasta böbrek dokusundan izole etmek ve saflaştırmak için üç tur eleme ve ortam14 ile kapsamlı yıkama içeren bir yöntem geliştirdi. Menè ve Stoppacciaro ayrıca primer MC'leri hasta veya sıçan böbrek dokusundan izole etmek için bir yöntem önerdi. Bu teknik, iki tur eleme, iki iğne itme ve kollajenaz sindirimini içerir. 4-8 sıçan böbreğinden elde edilen hücreler, verim nispeten düşük olmasına rağmen, altı oyuklu bir plaka üzerine kaplanır15. Bu yöntemler, işlenmeden önce böbreklerin küçük parçalara ayrılmasını gerektirir. Ek olarak, bu yaklaşımların saflaştırılmış MC'ler vermesi yaklaşık 3-4 hafta sürer.
Fareler, böbrek hastalıkları ile ilgili araştırmalarda en sık kullanılan deney hayvanı modelleridir. Bununla birlikte, murin MC'lerini izole etmek için sistematik bir yöntem hala eksiktir. Bu çalışmada, murin MC'lerin izolasyonu ve ex vivo hücre kültürü için optimize edilmiş bir protokol geliştirdik. Bu yöntem, deneysel araştırmalar için primer murin böbrek MC'leri kullanılırken kullanılabilir. Önceki yöntemlerle karşılaştırıldığında, bu yaklaşım sindirimden önce doku kesme ve eleme ihtiyacını ortadan kaldırır. Bunun yerine, tüm fare böbreği bir hücre öğütücü kullanılarak öğütülür ve doğrudan kollajenaz ile sindirilir. Sindirim çözeltisi daha sonra iki kez elenir, tüm hücreler ikinci elek üzerinde toplanır ve yeniden süspanse edilir. Bu yöntem, iki fare böbreğinin 10 gün içinde iki ila üç adet 100 mm'lik kültür kabını tohumlamak için yeterli hücre üretmesine izin verir. Saflaştırılmış MC'ler daha sonra D-valin içeren özel bir ortam kullanılarak kültür ve saflaştırma yoluyla elde edilir. Bu hücreler, hücre büyümesinden veya protein ekspresyonundan ödün vermeden birden çok kez pasajlanabilir, dondurulabilir, canlandırılabilir ve kültürlenebilir. Bu işlemler için gerekli ekipmanlar temel biyomedikal laboratuvarlar için kolaylıkla temin edilebilir ve hedef hücrelerin elde edilmesi için tüm süreç sadece 2-3 hafta sürer. Bu yöntem, verimli ve zaman kazandırıcı olduğu için böbrekle ilgili hastalıkları veya mekanizmaları araştırmak için murin MC'lerini içeren çalışmalar için uygundur.
Protokol
Hayvan deneyleri ARRIVE yönergelerine uygun olarak gerçekleştirilmiştir ve tüm hayvan prosedürleri ulusal mevzuata ve Avrupa Komisyonu Direktifine (2010/63/EU) uygun olarak gerçekleştirilmiştir. Fareler, Sichuan Üniversitesi Batı Çin Hastanesi Hayvan Bakım ve Kullanım Komitelerinin gerekliliklerine uygun olarak patojen içermeyen koşullarda barındırıldı ve tutuldu. Tüm deneysel hayvan çalışmaları, Sichuan Üniversitesi Batı Çin Hastanesi Hayvan Bakım ve Kullanım Komiteleri tarafından onaylanmıştır. Bu testte mezanjiyal hücre izolasyonu için sekiz haftalık C57BL / 6JGpt erkek fareler kullanıldı. Bu çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir. Şekil 1 , murin glomerüler mezanjiyal hücrelerinin izole edilmesi ve saflaştırılması için prosedürleri göstermektedir.
1. Murin MC'lerin izolasyonu için reaktiflerin hazırlanması
NOT: Tüm reaktiflerin ve ekipmanın steril olduğundan emin olun.
- Tip I kollajenaz (750 U/mL): RPMI 1640'ta kullanmadan önce tozu tartın ve çözün.
- Mezanjiyal hücre kültürü ortamı 1: RPMI 1640'ı 2 mM glutamin,% 17 FBS, antibiyotikler (100 ünite / mL Penisilin artı 10.000 μg / mL Streptomisin) ve 0.1 U / mL insülin ile karıştırın.
- Mezanjiyal hücre kültürü ortamı 2: RPMI 1640'ı (D-valin) 2 mM glutamin,% 10 FBS, antibiyotikler (100 birim / mL Penisilin artı 10.000 μg / mL Streptomisin), ITS-G (İnsülin, Transferrin, Selenyum çözeltisi 100x) ve 0.1 U / mL insülin ile birleştirin. Mezanjiyal hücre kültürü ortamını 4 ° C'de saklayın ve hazırlandıktan sonra 1 ay içinde kullanın.
- Hücre kriyoprezervasyon ortamı: 7:2:1 oranında RPMI 1640 ortamı, serum ve DMSO karışımı hazırlayın.
2. Fare MC'lerinin izolasyonu
- CO2 boğulması ve ardından servikal çıkık (kurumsal olarak onaylanmış protokoller izleyerek) yoluyla fareleri insanca kurban edin. Karkasları sterilizasyon için% 75 alkol içeren bir behere daldırın, ardından hayvanı aseptik bir çalışma yüzeyine aktarın.
- Farenin böbreklerini makas ve cımbız kullanarak aseptik olarak çıkarın, bir Petri kabına koyun, EBSS (Earle'ün Dengeli Tuz Çözeltisi) ile durulayın, ardından cımbız kullanarak bağ dokusunu ve böbrek kapsülünü dikkatlice çıkarın.
- Böbreği dikey olarak ikiye bölün, 3-4 mL kollajenaz I çözeltisi ekleyin ve plastik bir hücre tokmağı ile öğütün.
- Petri kabındaki tüm dokuları ve çözeltiyi 15 mL'lik bir santrifüj tüpüne pipetleyin. Tüm dokunun transfer edildiğinden emin olmak için Petri kabını 1-2 mL kollajenaz I solüsyonu ile durulayın. Çözeltiyi 37 °C'de çalkalayıcıya yerleştirin ve 120 rpm'de 30 dakika çalkalayın. Ardından, eşit hacimde bir durdurma çözeltisi (kültür ortamı 1) ekleyin.
- Çözeltiyi 15 mL'lik santrifüj tüpünden pipetleyin, 100 μm'lik bir hücre süzgecinden geçirin ve süzüntüyü 50 mL'lik bir santrifüj tüpünde toplayın.
- Sıvıyı adım 2.5'ten 40 μm'lik bir hücre süzgecinden geçirin, sadece 40 μm'lik hücre süzgecindeki hücreleri koruyun. Süzgeç üzerinde mümkün olduğunca çok hücre toplanmasını sağlamak için süzgeci kültür ortamı 1 ile tekrar tekrar durulayın. Toplanan hücreleri süzgeçten 50 mL'lik yeni bir santrifüj tüpüne aktarın.
- Süspansiyonu 600 x g'da 5 dakika (oda sıcaklığında) santrifüjleyin, ardından hücreleri hücre yoğunluğuna göre bir hücre kültürü kabında yeniden süspanse edin. Genel olarak, hücreleri iki veya üç 100 mm'lik kültür kabında (10 mL kültür ortamı 1/100 mm tabak) iki böbrekten yeniden süspanse edin. Bulaşıkları %95 hava/%5 CO2 içeren 37 °C'lik bir hücre inkübatöre yerleştirin.
- Ertesi gün hücre morfolojisini ve adezyonunu mikroskop altında (40×) inceleyin. Kültür ortamında yüzen ölü hücreler varsa, bağlı hücreleri rahatsız etmemeye dikkat ederek, ortamı kültür kabının altından çıkarmak için bir pipet kullanın.
- Hücreleri durulamak için kültür kabının iç kenarı boyunca 1-2 mL PBS ekleyin. Kültür kabının altındaki tüm PBS'yi çıkarmak için bir pipet kullanın ve son olarak kültür kabının iç kenarı boyunca 10 mL kültür ortamı 1 ekleyin.
3. Fare MC'lerinin saflaştırılması
- Ayırma işleminden bir gün sonra, kültür ortamını nazikçe yıkayarak ve adım 2.8'de açıklandığı gibi taze kültür ortamı 1 ile değiştirerek yapışmayan hücreleri çıkarın. Glomerulus hücrelerini faz kontrast mikroskobu altında gözlemleyin (40×).
NOT: Parlak küresel şekiller glomerulusu temsil ederken, çevredeki hücreler epitel hücrelerinin karakteristiği olan parke taşı benzeri özellikler sergiler (Şekil 2A). - 1-3 gün sonra hücre morfolojisini gözlemleyin (Şekil 2B-C). Yıldız şeklindeki ve iğ şeklindeki hücreler, Şekil 2D'de gösterildiği gibi parke taşı hücrelerinin etrafında görünecektir.
- Hücreler% 80 birleşmeye ulaştığında (genellikle 7-10 gün içinde), hücreleri steril PBS ile iki kez yıkayın, ardından hücreleri% 0.25 tripsin çözeltisi (100 mm'lik tabak başına 2 mL% 0.25 tripsin çözeltisi) ile tripsinize edin.
- İlk hücre tripsinizasyon süreci yaklaşık 20 dakika sürebilir. Tripsin ekledikten sonra, tabağı 37 °C'lik bir inkübatöre koyun. Hücrelerin tripsinizasyonunu değerlendirmek için işlemi bir faz kontrast mikroskobu (40×) altında gerçek zamanlı olarak gözlemleyin.
- Çoğu hücre yuvarlak bir morfoloji sergilediğinde ve çanak yüzeyinden ayrıldığında eşit hacimde ortam 2 ekleyerek tripsinizasyon işlemini sonlandırın.
- Hücreleri 600 × g'da 5 dakika (oda sıcaklığında) santrifüjleyin, ardından ortam 2'de yeniden süspanse edin. Genel olarak, hücreleri 100 mm'lik bir tabaktan iki adet 100 mm'lik kültür kabında (10 mL kültür ortamı 2/100 mm tabak) yeniden süspanse edin.
- Ertesi gün kültür ortamını 2 değiştirin. Mikroskop altında çok sayıda asılı hücre ve hücre fragmanını gözlemleyin (40×), çünkü sadece MC'ler D-valin ortamında hayatta kalabilir ve çoğalabilir16. Ölü hücreleri çıkarmak için ortamı her 1-2 günde bir değiştirin. Kültürdeki yapışık hücreler MC'lerdir (Şekil 3A-D). İzole MC'lerin büyüme oranını belirleyin (Şekil 3E).
- Hücreler %80 birleşmeye ulaştığında, tripsinize edin ve onları geçirin. MC'ler tipik olarak tripsinizasyon için yaklaşık 5-10 dakika sürer.
4. Murin MC'lerinin uzun süreli korunması
NOT: Birincil hücreler zamanla ve çoklu geçişlerle farklılaşıp mutasyona uğrayabileceğinden, uzun süreli koruma için hücre saflaştırmasından sonra MC'leri dondurun ve saklayın.
- Bir pipet kullanarak tabağın alt kenarı boyunca süpernatanı dikkatlice çıkarın, hücreleri steril PBS ile iki kez yıkayın, ardından% 0.25 tripsin çözeltisi (100 mm tabak başına 2 mL% 0.25 tripsin çözeltisi) ile tripsinize edin. Adım 3.3-3.8'de açıklandığı gibi tripsinizasyon adımlarını izleyin.
- Triplizasyondan sonra, işlemi sonlandırmak için eşit hacimde ortam 2 ekleyin ve tüm sıvıyı 15 mL'lik bir santrifüj tüpüne aktarın. Hücreleri 5 dakika boyunca (oda sıcaklığında) 600 × g'da santrifüjleyin, süpernatanı atın ve hücreleri saymak için hücreleri 1 mL PBS'de yeniden süspanse edin.
- Hücreleri saymak için otomatik hücre sayacı kullanın. 1 mL yeniden süspanse hücre çözeltisinden 20 μL alın ve toplam hücre sayısını belirlemek için özel bir hücre sayma plakasına ekleyin. Hücre sayımına bağlı olarak, bunları hücre kriyoprezervasyon ortamında (106 hücre başına 1 mL hücre kriyoprezervasyon ortamı) yeniden süspanse edin.
- Hücre çözeltisini kriyoprezervasyon tüplerine (2 mL kriyoprezervasyon tüpü başına 1 mL hücre kriyoprezervasyon ortamı) aktarın ve koruma için sıvı nitrojene aktarmadan önce -80 °C'ye kadar yavaş dondurma gerçekleştirin.
NOT: Gerektiğinde amplifikasyon için hücre kültürü kaplarındaki hücreleri yeniden askıya alın ve tohumlayın. Hücreler tam olarak karakterize edildikten sonra 3. ve 8. pasajlar arasında kullanılmalıdır17.
5. Fare MC'lerinin tanımlanması
NOT: Hücreler iki kez geçildikten sonra, aşağıdaki teknikleri kullanarak murin MC'lerini tanımlayın.
- Fare MC'lerinin batı lekesi
NOT: Prosedür için gerekli reaktifler Ek Tablo 1'de verilmiştir.- 3.3-3.8 ve adım 4.1'deki adımların aynısını izleyerek hücreleri tripsinize edin.
- Hücreleri topladıktan sonra, proteinleri çıkarmak ve protein konsantrasyonunu ölçmek için hücreleri parçalayın.
- Uygun miktarda numune alın (genellikle 20 ng), yükleme tamponu ekleyin ve 100 ° C'de 5 dakika denatüre edin.
- Proteini (20 ng) %10'luk bir SDS-PAGE jeli veya %7.5'lik bir SDS-PAGE jeli ile çözün, ardından sabit bir voltajda bir selüloz membrana aktarın.
- Membranı %5 yağsız sütle bloke edin, ardından birincil antikor ile gece boyunca bir çalkalayıcı üzerinde 4 °C'de inkübe edin.
- TBST (Tween 20 ile Tris Tamponlu Salin) ile üç kez yıkadıktan sonra ikincil antikor ile oda sıcaklığında 1 saat inkübe edin.
- Görüntüleme sistemi ile sinyalleri tespit edin.
NOT: Bu çalışmada kullanılan birincil antikorlar arasında fare anti-αSMA (1:500), tavşan anti-vimentin (1:2000), tavşan anti-fibronektin (1:2000) ve fare anti-GAPDH (1:50000) bulunmaktadır. Bu çalışmada kullanılan ikincil antikorlar arasında Peroksidaz konjuge Keçi Anti-Tavşan IgG (H + L) (1:5000) ve Peroksidaz konjuge Keçi Anti-Fare IgG (H + L) (1:5000) vardı.
- Murin MC'lerin immünofloresan boyası
NOT: Prosedür için gerekli reaktifler Ek Tablo 2'de verilmiştir.- Adım 3.3-3.8 ve adım 4.1'deki adımların aynısını izleyerek hücreleri tripsnize edin.
- Hücreleri yeniden askıya alın ve sayın. 1 x 105 hücre alın ve bunları 15 mm cam tabanlı hücre kültür kabına ekleyin (15 mm cam taban için 2 adet 1 mL kültür ortamı).
- MC'leri %4 paraformaldehit ile 15 dakika sabitleyin (15 mm cam taban başına 1 mL %4 paraformaldehit), ardından PBS ile üç kez yıkayın.
- Hücre zarlarına nüfuz etmek için MC'lere 10 dakika boyunca% 0.1 Triton X-100 uygulayın.
- PBS ile üç yıkamadan sonra, hücreleri oda sıcaklığında% 3 BSA PBS çözeltisi ile 30 dakika boyunca bloke edin.
- Hücreleri yıkayın ve gece boyunca 4 ° C'de birincil anti-fare αSMA ve anti-tavşan Vimentin antikorları ile inkübe edin.
- Oda sıcaklığında kırmızı Alexa 594'e konjuge edilmiş ikincil eşek anti-fare IgG ve yeşil FITC'ye konjuge eşek anti-tavşan IgG ile 1 saat inkübe edin.
- Oda sıcaklığında 1 dakika boyunca nükleer karşı boyama için DAPI kullanın.
- Floromount ortamı ekleyin ve bir cam slaytla örtün. Konfokal bir mikroskop kullanarak hücreleri analiz edin.
NOT: Bu çalışmada kullanılan birincil antikorlar fare anti-αSMA (1:200) ve tavşan anti-vimentini (1:200) içeriyordu. Bu çalışmada kullanılan ikincil antikorlar, kırmızı Alexa 594'e (1:400) konjuge eşek anti-fare IgG, yeşil FITC'ye (1:400) konjuge eşek anti-tavşan IgG ve DAPI'yi (1:1000) içeriyordu.
- Murin MC'lerin akış sitometrisi
- Adım 3.3-3.8 ve adım 4.1'deki adımların aynısını izleyerek hücreleri tripsnize edin.
- Hücreleri yeniden askıya alın ve sayın. 5 x 105 hücre alın ve bunları 3 mL PBS ile bir kez yıkayın.
- Hücreleri bir akış tüpünde 100 μL PBS ile yeniden süspanse edin, ardından 1-2 μL anti-fare PDGFRB (CD140b) antikoru ekleyin.
- Hücreleri karanlıkta 30 dakika boyunca buz üzerinde inkübe edin, ardından akış sitometrisi ile analiz edin.
Sonuçlar
Bu çalışma, murin MC'lerin izolasyonu ve ex vivo hücre kültürü için optimize edilmiş bir protokol geliştirmiştir. Bildiğimiz kadarıyla, birincil MC'leri ex vivo olarak doğrulamak için standart bir yöntem mevcut değildir. Önceki yayınlara göre, MC'ler αSMA, Vimentin ve Fibronektin 3,14,15 ekspresyonu ile karakterize edilir. MK'lerin ekspresyon düzeylerini tespit etmek için Western blot analizi kullanıldı. Bu çalışmada izole edilen MC'ler önemli ölçüde yüksek αSMA, Fibronektin ve Vimentin ekspresyonu sergiledi (Şekil 4A). Western blot görüntüsünün tamamı Ek Şekil 1'de verilmiştir.
scRNA-seq veritabanı CellMarker'a dayanarak, PDGFRB (CD140b) geni, MC'lerin18'inin bir belirteç geni olarak hizmet eder. Ortam 2'de 5 gün boyunca hücre seçimi ve kültürden sonra, PDGFRB (CD140b) ekspresyonu akış sitometrisi ile doğrulandı (Şekil 4F).
Saflığı daha da doğrulamak için, Medya 2'de yaklaşık 7-10 gün boyunca hücre seçimi ve kültüründen sonra, MC'ler immünofloresan boyama ile doğrulandı. Şekil 4B-E'de gösterildiği gibi, Ortam 2'de 10 günlük kültürden sonra, hücrelerin %95'inden fazlası hem αSMA hem de Vimentin eksprese etti. Pozitif immünofloresan boyama sonuçları (Şekil 4B-E), D-valin spesifik ortam16'daki hücrelerin canlılığı ile birlikte, yukarıda açıklanan protokollerin fare glomerüler MC'lerini başarıyla izole ettiğini göstermektedir. Bu veriler, diferansiyel yapışma yöntemi kullanılarak elde edilen MC'lerin yüksek saflığını daha da doğrulamaktadır.
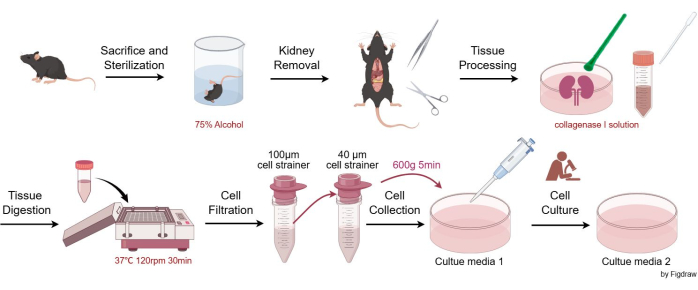
Şekil 1: Murin glomerüler mezanjiyal hücrelerinin izole edilmesi ve saflaştırılması için prosedür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: İzole edilmiş hücrelerin ilk kültürü. (A) İzolasyondan sonraki 1. günde, glomerülleri temsil eden parlak küresel yapılara sahip hücreler. (B) İzolasyondan sonraki 2. günde, epitel hücrelerinin karakteristik poligonal hücrelerini gösteren hücreler. (C) İzolasyondan sonraki 3. gündeki hücreler, glomerulusu çevreleyen epitel benzeri hücrelerin sayısı artmıştır. (D) İzolasyondan sonraki 6. günde hücreler. Kırmızı oklar glomerulusu gösterir. Her görüntünün sağ alt köşesindeki kırmızı ölçek çubukları 100 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Tripsinizasyondan sonra izole edilen hücrelerin morfolojisi ve ilk geçiş sırasında kültür ortamı 2'nin değiştirilmesi. (A) Tripsinizasyondan sonraki 1. gündeki hücreler, yüzeye yapışan yıldız şeklindeki hücreleri gösterir. (B) Tripsinizasyondan sonraki 4. günde hücreler. (C) Tripsinizasyondan sonraki 6. günde hücreler. (D) Tripsinizasyondan sonraki 10. günde, mezanjiyal hücrelerin karakteristik özelliği olan iğ şeklinde, çok katmanlı bir büyüme paterni sergileyen hücreler. (E) CCK-8 reaktifinin eklenmesinden 2 saat sonra ölçülen 450 nm'de absorbans ile 96 oyuklu plakalarda farklı yoğunluklarda ekilen hücreler. Her görüntünün sağ alt köşesindeki kırmızı ölçek çubukları 200 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: İzole edilmiş mezanjiyal hücrelerin tanımlanması. (A) Yükleme kontrolü olarak GAPDH ile mezanjiyal hücrelerde α-SMA, Vimentin ve Fibronektin ekspresyonunun Western blot analizi. (B-E) Vimentin (yeşil), α-SMA (kırmızı) ve DAPI (mavi) için izole edilmiş mezanjiyal hücrelerin immünofloresan boyama. (F) 5 gün boyunca ortam 2'de kültürlenen mezanjiyal hücrelerde PDGFRB (CD140b) ekspresyonunun akış sitometrisi analizi. Mavi tepe spesifik boyamayı temsil ederken, izotip kontrolü karşılaştırma için gösterilir. Her görüntünün sol üst köşesindeki kırmızı ölçek çubukları 100 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Tam Western blot görüntüsü. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo 1: Western blot analizi için kullanılan reaktifler. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo 2: İmmünofloresan boyama için kullanılan reaktifler. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Böbrekle ilgili hastalıklar oldukça yaygındır ve fareler, insanlara genetik benzerlikleri ve iyi bilinen hastalık modellerinin mevcudiyeti nedeniyle bu koşulları incelemek için birincil hayvan modeli olarak yaygın olarak kullanılmaktadır. Mezanjiyal hücreler, yapısal destek sağlayarak, glomerüler filtrasyonu düzenleyerek ve bağışıklık tepkilerine katılarak glomerulusun normal yapısını ve işlevini korumada çok önemli bir rol oynar. İnsanlardan, sıçanlardan ve tavuklardan mezanjiyal hücreleri izole etmek için çeşitli deneysel teknikler mevcut olsada 14,15,19, bu hücreleri fare böbreklerinden izole etmek için standartlaştırılmış, verimli ve tekrarlanabilir bir yöntem henüz oluşturulmamıştır. Böyle bir yöntemin olmaması, araştırma ilerlemesini sınırlar ve böbrek hastalığının fare modellerinde mezanjiyal hücre fonksiyonunu araştırma yeteneğini engeller.
Bu çalışmada, murin mezanjiyal hücrelerinin izolasyonu, saflaştırılması ve ex vivo kültürü için zaman açısından verimli ve etkili bir yöntem geliştirilmiştir. Optimize edilmiş protokol, yüksek miktarda canlı hücre verimi sağlar ve bu da onu böbrek araştırmaları için değerli bir araç haline getirir. Başarılı hücre izolasyonu elde etmek ve yüksek hücre canlılığını korumak için deneysel süreç sırasında birkaç kritik faktör dikkatlice dikkate alınmalıdır: (1) Sterilite bakımı: Hücre canlılığını tehlikeye atabilecek ve deney sonuçlarını etkileyebilecek mikrobiyal kontaminasyonu önlemek için tüm hücre toplama aşamaları temiz bir tezgah altında gerçekleştirilmelidir. (2) Doku bozulması: Öğütme çubuğu, böbrek dokusunu iyice öğütmek, tam mekanik ayrışmayı sağlamak ve enzimatik sindirimi kolaylaştırmak için kullanılmalıdır. Yetersiz öğütme, verimsiz hücre salınımına ve daha düşük hücre verimine neden olabilir. (3) Doku sindirim optimizasyonu: Enzimatik sindirim işlemi sırasında, doku parçalanmasının derecesini değerlendirmek için periyodik gözlem gereklidir. Çözeltinin birden çok kez nazikçe ters çevrilmesi, hücrelere verilen zararı en aza indirirken enzimatik etkiyi artırmaya ve daha iyi hücre ayrışmasını desteklemeye yardımcı olur. (4) Hücre eleme ve toplama: Eleme aşamasında, toplanan hücre sayısını en üst düzeye çıkarmak için hücre süzgecini birden çok kez durulamak çok önemlidir. Eksik durulama, hücre kaybına ve verimin düşmesine neden olarak izolasyon işleminin genel başarısını etkileyebilir.
Bu yöntem şu anda yalnızca birincil mezanjiyal hücrelerin fare böbreklerinden izolasyonu için optimize edilmiştir ve diğer hayvan modellerine uygulanabilirliği henüz değerlendirilmemiştir. Bu protokol kullanılarak başarılı bir izolasyon elde edilmiş olsa da, farklı türlerde kullanılmak üzere uyarlanması için daha fazla değişiklik yapılması gerekebilir. Kültürlenmiş birincil mezanjiyal hücreler yedinci nesle kadar canlı kaldı; Bununla birlikte, daha sonraki pasajlarda büyüme hızında bir düşüş gözlendi. Proliferasyon kapasitesindeki bu azalma, hücresel yaşlanmaya veya kültür ortamındaki değişikliklere bağlanabilir. Bu nedenle, optimum işlevsellik ve deneysel tekrarlanabilirliği sağlamak için hücrelerin birincil kültürün erken aşamalarında ilgili deneyler için kullanılması önerilir.
Genel olarak, bu yöntem, yaygın olarak bulunan laboratuvar ekipmanı ve reaktifleri kullanarak birincil mezanjiyal hücrelerin hızlı izolasyonu için güvenilir, verimli ve tekrarlanabilir bir yaklaşım sağlar. Bu teknik, basit ve erişilebilir bir protokol sunarak böbrek araştırmalarını kolaylaştırır ve hastalık modellerinde mezanjiyal hücre fonksiyonunu araştıran çalışmaları destekler. Farelerden birincil mezanjiyal hücrelere ihtiyaç duyan araştırmacılar için bu yöntem, çeşitli deneysel uygulamalar için yüksek kaliteli hücre kültürlerinin oluşturulmasını sağlayan değerli bir referans görevi görür.
Açıklamalar
Yazarlar, finansal veya başka türlü herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı'ndan (No. 82470196, No. 82070219 ve No. 81870157) ve Sichuan Üniversitesi Fakülte Başlangıç Fonu'ndan NZ'ye verilen hibelerle desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 µm Cell Strainer | Biosharp | BS-100-CS | |
| 100 mm Petri Dish | Sorfa | 230301 | |
| 15 mL Centrifuge Tube | Sorfa | 411000 | |
| 15 mm glass bottom cell culture dish | Sorfa | 201200 | |
| 180 kDa Plus Prestained Protein Marker | Vazyme | MP201-01 | |
| 2 mM L-glutamine | BasalMedia | S210JV | |
| 4% Paraformaldehyde | Biosharp | BL539A | |
| 40 µm Cell Strainer | Biosharp | BS-40-XBS | |
| 50 mL Centrifuge Tube | Sorfa | 41000 | |
| 60 mm Petri Dish | Sorfa | 230201 | |
| 75% Alcohol | Knowles | 64-17-5 | |
| 96 Well Cell Culture Plates, TC-treated | Servicebio | CCP-96H | |
| Antibiotics (10 μg/mL ceftriaxone plus 100 μg/mL gentamicin) | NCM | C100C5 | |
| BCA (Bicinchoninic acid) Protein Assay kit | CWBIO | CW0014S | |
| Cell Counting Kit-8 | Oriscience | CB101 | |
| Confocal Microscope | FV-3000 | Olympus | |
| DMSO | Sigma | D2650 | |
| DMSO | Sigma | D2650 | |
| Earle's Balanced Salt Solution (1x EBSS) | Beyotime | C0213 | |
| Fetal Bovine Serum (FBS) | Excell | FSP500 | |
| Fluorescence Cell Analyzer | Mira FL | Countstar | |
| Fluoromount media | Southern Biotech | 0100-01 | |
| Insulin, Transferrin, Selenium Solution 100x (ITS -G) | Gibco | 41400045 | |
| Inverted Fluorescence Microscope | Olympus | IX83 | |
| Lysis Buffer | Adilab | PP1101 | |
| One-Step PAGE Preparation Kit (10%) | Oriscience | PB102 | |
| One-Step PAGE Preparation Kit (7.5%) | Oriscience | PB101 | |
| PE anti-mouse CD140b Antibody | Biolegend | 323605 | |
| Phosphate Buffered Saline (PBS) | Servicebio | G4202 | |
| Plastic Cell Pestle | Biofil | CC-4090 | |
| Proteinase Inhibitor Cocktail | Roche | 4693159001 | |
| PVDF Membrane | Vazyme | E802-01 | |
| Recombinant Human Insulin | Solarbio | 11061-68-0 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Corning | 10-040-CV | |
| SDS-PAGE Sample Loading Buffer (5x) | Servicebio | G2013 | |
| Specially customized Roswell Park Memorial Institute (RPMI) 1640 Medium (D-valine instead of L-valine) | Procell | WH3923U222 | |
| TBS (Tris Buffered Saline) | Servicebio | G0001-2L | |
| Triton X-100 | Biosharp | BS084 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Tween 20 | Biosharp | BS100 | |
| Type I collagenase | Solarbio | CB140 |
Referanslar
- Pollak, M. R., Quaggin, S. E., Hoenig, M. P., Dworkin, L. D. The glomerulus: The sphere of influence. Clin J Am Soc Nephrol. 9 (8), 1461-1469 (2014).
- Mené, P., Simonson, M. S., Dunn, M. J. Physiology of the mesangial cell. Physiol Rev. 69 (4), 1347-1424 (1989).
- Avraham, S., Korin, B., Chung, J. J., Oxburgh, L., Shaw, A. S. The mesangial cell - the glomerular stromal cell. Nat Rev Nephrol. 17 (12), 855-864 (2021).
- Chadban, S. J., Atkins, R. C. Glomerulonephritis. Lancet. 365 (9473), 1797-1806 (2005).
- Qian, Y., Feldman, E., Pennathur, S., Kretzler, M., Brosius, F. C. From fibrosis to sclerosis: Mechanisms of glomerulosclerosis in diabetic nephropathy. Diabetes. 57 (6), 1439-1445 (2008).
- Zhu, Y., et al. Iga Gut microbiome regulates the production of hypoglycosilated iga1 via the tlr4 signaling pathway. Nephrol Dial Transplant. 39 (10), 1624-1641 (2024).
- Kong, L. -. L., et al. Advances in murine models of diabetic nephropathy. J Diabetes Res. 2013, 797548 (2013).
- Schiffer, M., et al. Inhibitory smads and tgf-beta signaling in glomerular cells. J Am Soc Nephrol. 13 (11), 2657-2666 (2002).
- Gyarmati, G., et al. Sparsentan improves glomerular hemodynamics, cell functions, and tissue repair in a mouse model of FSGS. JCI Insight. 9 (19), e177775 (2024).
- Chafin, C. B., Regna, N. L., Hammond, S. E., Reilly, C. M. Cellular and urinary microRNA alterations in NZB/W mice with hydroxychloroquine or prednisone treatment. Int Immunopharmacol. 17 (3), 894-906 (2013).
- Lucero, C. M., et al. Tnf-α plus il-1β induces opposite regulation of cx43 hemichannels and gap junctions in mesangial cells through a rhoa/rock-dependent pathway. Int J Mol Sci. 23 (17), (2022).
- Schnaper, H. W., Hayashida, T., Hubchak, S. C., Poncelet, A. C. Tgf-beta signal transduction and mesangial cell fibrogenesis. Am J Physiol Renal Physiol. 284 (2), F243-F252 (2003).
- Mackay, K., et al. Glomerular epithelial, mesangial, and endothelial cell lines from transgenic mice. Kidney Int. 33 (3), 677-684 (1988).
- Wilson, H. M., Stewart, K. N. Glomerular epithelial and mesangial cell culture and characterization. Methods Mol Med. 107, 269-282 (2005).
- Menè, P., Stoppacciaro, A. Isolation and propagation of glomerular mesangial cells. Methods Mol Biol. 466, 3-17 (2009).
- Gilbert, S. F., Migeon, B. R. D-valine as a selective agent for normal human and rodent epithelial cells in culture. Cell. 5 (1), 11-17 (1975).
- Kreisberg, J. I., Venkatachalam, M., Troyer, D. Contractile properties of cultured glomerular mesangial cells. Am J Physiol. 249 (4 Pt 2), F457-F463 (1985).
- Adam, M., Potter, A. S., Potter, S. S. Psychrophilic proteases dramatically reduce single-cell rna-seq artifacts: A molecular atlas of kidney development. Development. 144 (19), 3625-3632 (2017).
- Sadovnic, M. J., Brand-Elnaggar, J., Bolton, W. K. Isolation and characterization of chicken mesangial cells. Nephron. 58 (1), 75-84 (1991).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır