Method Article
マウス糸球体メサンギウム細胞の単離と精製の最適化
要約
この研究では、マウスメサンギウム細胞(MC)とその ex vivo 細胞培養の単離に最適化されたプロトコルを開発しました。これらの細胞は、細胞増殖やタンパク質発現を損なうことなく、複数回継代し、凍結、蘇生、培養することができます。
要約
メサンギアル細胞(MC)は、糸球体の中央空間に位置する間質細胞であり、糸球体の恒常性において極めて重要な機能を持っています。糸球体MCの単離、精製、培養の方法は、1980年代以降、生物医学研究、特に腎臓学の分野で使用するために開発され、最適化されてきました。マウスは、腎疾患の研究において最も頻繁に使用される実験動物モデルです。本研究では、マウスMCの単離と ex vivo 細胞培養に最適化されたプロトコールを開発しました。これらの細胞は、細胞増殖やタンパク質発現を損なうことなく、複数回継代し、凍結、蘇生、培養することができます。この最適化されたアプローチにより、研究者の研究期間が大幅に短縮され、細胞の長期保存が可能になります。手順に必要な機器は、基本的な生物医学研究所で簡単にアクセスでき、手順も簡単です。標的細胞の獲得には2〜3週間しかかからず、既存の方法と比較して少なくとも1週間短縮できます。
概要
糸球体は、血液をろ過して尿1を形成するという重要な役割を果たす毛細血管のネットワークです。メサンギウム細胞(MC)は、糸球体毛細血管の間に位置するメサンギウムマトリックス内に埋め込まれており、その多様な機能を通じて糸球体ダイナミクスに影響を与える独自の位置にあります2。MCは、糸球体の発達、糸球体毛細血管の構造的支持、食作用、糸球体基底膜マトリックスの産生など、糸球体において重要な役割を果たします3。メサンギウム細胞の研究は、腎臓の生理学と病理学の理解を深めるために極めて重要です。
病理学的状態におけるメサンギウム細胞の関与も注目に値する。糖尿病性腎症や糸球体腎炎などの糸球体損傷や疾患に反応して、メサンギウム細胞は増殖して過剰な細胞外マトリックス成分を分泌し、糸球体硬化症や腎機能障害を引き起こす可能性があります4,5。したがって、メサンギウム細胞の機能と制御メカニズムを理解することは、腎臓病の治療戦略を開発するために不可欠です。
マウスメサンギウム細胞は、研究者がIgA腎症6、糖尿病性腎症7、限局性分節性糸球体硬化症(FSGS)8,9などの疾患に関与する分子および細胞プロセスをモデル化し、探索することを可能にします。腎線維症および炎症におけるそれらの役割を考えると、マウス糸球体MCは、治療化合物の有効性を評価するための臨床研究で頻繁に使用されます9,10。さらに、マウスメサンギウム細胞は、RhoA/ROCK経路11やTransforming Growth Factor-β(TGF-β)経路12など、さまざまなシグナル伝達経路が腎機能に及ぼす影響を研究するための重要なツールです。これらの研究は、これらのシグナル伝達分子が腎臓病の進行にどのように寄与しているかを解明するのに役立ちます。疾患モデリング、治療法開発、シグナル伝達研究のいずれに使用される場合でも、マウスMCは、腎臓の健康と疾患についての理解を深めるための重要なリソースとして機能し続けています。
Mackayらは、1988年にトランスジェニックマウスから糸球体上皮細胞、メサンギアル細胞、および内皮細胞の ex vivo 細胞株を取得する方法を確立しました13。WilsonとStewartは、患者の腎臓組織から一次MCを単離し精製する方法を開発したが、これには3回のふるい分けと培地14による広範な洗浄が含まれる。MenèとStoppacciaroは、患者またはラットの腎臓組織から一次MCを分離する方法も提案しました。この手法には、2回のふるい分け、2回の針の押し込み、およびコラゲナーゼ消化が含まれます。4〜8個のラット腎臓から得られた細胞を6ウェルプレートに播種するが、収率は比較的低い15。これらの方法では、処理する前に腎臓を細かく解剖する必要があります。さらに、これらのアプローチでは、精製されたMCが得られるまでに約3〜4週間かかります。
マウスは、腎疾患の研究において最も頻繁に使用される実験動物モデルです。しかし、マウスMCを分離するための体系的な方法はまだ不足しています。本研究では、マウスMCの単離と ex vivo 細胞培養に最適化されたプロトコールを開発しました。この方法は、実験研究に一次マウス腎臓MCを使用する場合に使用できます。従来の方法と比較して、このアプローチでは、消化前に組織を切断してふるい分ける必要がなくなります。代わりに、マウスの腎臓全体をセルグラインダーを使用して粉砕し、コラゲナーゼで直接消化します。次に、消化溶液を2回ふるいにかけ、すべての細胞を2番目のふるいに集めて再懸濁します。この方法により、2つのマウス腎臓が10日以内に2〜3個の100mm培養皿を播種するのに十分な細胞を産生することができます。精製されたMCは、その後、D-バリンを含む特殊な培地を使用して培養および精製することにより得られます。これらの細胞は、細胞増殖やタンパク質発現を損なうことなく、複数回継代し、凍結、蘇生、培養することができます。これらの手順に必要な機器は、基本的な生物医学研究所で簡単に入手でき、全体のプロセスで標的細胞を取得するのにわずか2〜3週間かかります。この方法は、効率的で時間を節約することができるため、腎臓関連の疾患やメカニズムを調査するためのマウスMCを含む研究に適しています。
プロトコル
動物実験はARRIVEガイドラインに準拠し、すべての動物手順は国内法および欧州委員会指令(2010/63/EU)に従って実施されました。マウスは、四川大学西中国病院の動物管理および使用委員会の要件に準拠して、病原体のない状態で飼育および維持されました。すべての実験動物実験は、四川大学西中国病院の動物管理および使用委員会によって承認されました。このアッセイでは、8週齢のC57BL/6JGpt雄マウスをメサンギウム細胞の単離に使用しました。本試験で使用した試薬および装置の詳細は、 材料表に記載されています。 図1 は、マウスの糸球体メサンギウム細胞を単離および精製する手順を示しています。
1. マウスMC単離用試薬の調製
注:すべての試薬と機器が無菌であることを確認してください。
- I型コラゲナーゼ(750 U/mL):粉末を秤量し、RPMI 1640で使用する直前に溶解します。
- メサンギアル細胞培養培地1:RPMI 1640を2 mMのグルタミン、17%FBS、抗生物質(100ユニット/mLのペニシリンと10,000 μg/mLのストレプトマイシン)、および0.1 U/mLのインスリンと混合します。
- メサンギアル細胞培養培地2:RPMI 1640(D-バリン)を2 mMのグルタミン、10%FBS、抗生物質(100ユニット/mLのペニシリンと10,000 μg/mLのストレプトマイシン)、ITS-G(インスリン、トランスフェリン、セレン溶液100倍)、および0.1 U/mLインスリンと組み合わせます。メサンギウム細胞培養培地は4°Cで保存し、調製後1ヶ月以内にご使用ください。
- 細胞凍結保存培地:RPMI 1640培地、血清、およびDMSOの混合物を7:2:1の比率で調製します。
2. マウスMCの単離
- CO2 窒息とそれに続く子宮頸部脱臼 (施設で承認されたプロトコルに従う) を介してマウスを人道的に犠牲にします。死体を75%アルコールを含むビーカーに浸して滅菌し、動物を無菌作業台に移します。
- ハサミとピンセットを使用してマウスの腎臓を無菌的に取り出し、ペトリ皿に入れ、EBSS(Earle's Balanced Salt Solution)ですすぎ、ピンセットを使用して結合組織と腎臓嚢を慎重に除去します。
- 腎臓を縦に半分にし、コラゲナーゼI溶液を3〜4mL加え、プラスチック細胞乳棒で挽きます。
- ペトリ皿からすべての組織と溶液を15mLの遠心分離チューブにピペットで移します。ペトリ皿を1〜2 mLのコラゲナーゼI溶液ですすいで、すべての組織が転写されていることを確認します。溶液を37°Cのシェーカーに入れ、120rpmで30分間振とうします。次に、同量の停止溶液(培地1)を添加します。
- 15 mLの遠心分離チューブから溶液をピペットで取り出し、100 μmのセルストレーナーに通し、濾液を50 mLの遠心チューブに回収します。
- ステップ 2.5 の液体を 40 μm セルストレーナに通し、40 μm セルストレーナ上のセルのみを保持します。ストレーナーを培地1で繰り返しすすぎ、ストレーナーにできるだけ多くの細胞が集まるようにします。採取した細胞をストレーナーから新しい50 mL遠心チューブに移します。
- 懸濁液を600 x g で5分間(室温)遠心分離し、細胞密度に応じて細胞培養皿に細胞を再懸濁します。一般的には、2つの腎臓から採取した細胞を2つまたは3つの100 mm培養皿(10 mL Culture Media 1/100 mm皿)に再懸濁します。皿を95%空気/ 5%CO2の37°Cセルインキュベーターに入れます。
- 翌日、顕微鏡(40×)で細胞の形態と接着を調べます。培養培地に浮遊死細胞が存在する場合は、付着した細胞を乱さないように注意しながら、ピペットを使用して培養皿の底から培地を取り出します。
- 培養皿の内側の端に沿って1〜2mLのPBSを加えて、細胞をすすぎます。ピペットを使用して培養皿の底からすべてのPBSを取り出し、最後に培養皿の内側の端に沿って10mLの培養培地1を追加します。
3. マウスMCの精製
- 分離の1日後、ステップ2.8で説明したように、培地を静かに洗浄し、新鮮な培地1と交換することにより、非接着性細胞を除去します。糸球体細胞を位相差顕微鏡(40×)で観察します。
注:明るい球形は糸球体を表し、周囲の細胞は上皮細胞の特徴である丸石のような特徴を示します(図2A)。 - 1〜3日後に細胞の形態を観察します(図2B-C)。図2Dに示すように、星形と紡錘形のセルが丸石のセルの周りに現れます。
- 細胞が80%のコンフルエンスに達したら(通常は7〜10日以内)、滅菌PBSで細胞を2回洗浄し、次に0.25%トリプシン溶液(100mm皿あたり2mLの0.25%トリプシン溶液)で細胞をトリプシンします。
- 最初の細胞トリプシン化プロセスには約20分かかる場合があります。トリプシンを加えたら、ディッシュを37°Cのインキュベーターに入れます。位相差顕微鏡(40×)でプロセスをリアルタイムで観察し、細胞のトリプシン化を評価します。
- ほとんどの細胞が丸みを帯びた形態を示し、皿の表面から剥離するときに、等量の培地2を添加することにより、トリプシン化プロセスを終了します。
- 細胞を600 × g で5分間(室温)遠心分離し、培地2に再懸濁します。一般的には、100 mmディッシュ1枚の細胞を100 mm培養ディッシュ2枚(10 mL Culture Media 2/100 mmディッシュ)に再懸濁します。
- 翌日、培地2を交換します。D-バリンの培地16ではMCのみが生存および増殖できるため、顕微鏡下(40×)で多数の懸濁細胞および細胞断片を観察します。1〜2日ごとにメディアを交換して、死んだ細胞を取り除きます。培養中の接着細胞はMCです(図3A-D)。単離されたMCの成長率を決定します(図3E)。
- 細胞が80%のコンフルエントに達したら、トリプシンして継代します。MCは通常、トリプシン化に約5〜10分かかります。
4. マウスMCの長期保存
注:初代細胞は時間や複数の継代によって分化および変異する可能性があるため、細胞精製後にMCを凍結して保存し、長期保存してください。
- ピペットを使用して皿の下端に沿って上清を慎重に取り除き、滅菌PBSで細胞を2回洗浄し、次に0.25%トリプシン溶液(100 mm皿あたり2 mLの0.25%トリプシン溶液)でトリプシン化します。.手順 3.3 から 3.8 で説明されているトリプシン処理の手順に従います。
- トリプシン処理後、等量の培地2を添加してプロセスを終了し、液体全体を15 mLの遠心チューブに移します。細胞を600 × g で5分間(室温)遠心分離し、上清を廃棄し、細胞を1 mL PBSに再懸濁して細胞をカウントします。
- 自動セルカウンターを使用して、セルをカウントします。再懸濁した細胞溶液1mLから20μLを取り出し、専用の細胞計数プレートに加えると、細胞の総数が測定されます。細胞数に基づいて、それらを細胞凍結保存培地(106細胞あたり 1 mLの細胞凍結保存培地)に再懸濁します。
- 細胞溶液を凍結保存チューブ(凍結保存チューブ2 mLあたり1 mLの細胞凍結保存培地)に移し、-80°Cまでゆっくりと凍結してから、液体窒素に移して保存します。
注:必要に応じて増幅するために、細胞培養皿に細胞を再懸濁して播種します。細胞は、完全に特性化された後、継代3と8の間で使用されるべきである17。
5. マウスMCの同定
注:細胞を2回継代した後、以下の手法を用いてマウスMCを同定する。
- マウスMCのウェスタンブロット
注:この手順に必要な試薬は 、補足表1に記載されています。- 3.3-3.8およびステップ4.1と同じ手順に従って細胞をトリプシン化します。
- 細胞を採取した後、細胞を溶解してタンパク質を抽出し、タンパク質濃度を測定します。
- 適量のサンプル(通常は20 ng)を採取し、ローディングバッファーを添加し、100°Cで5分間変性させます。
- タンパク質(20 ng)を10% SDS-PAGEゲルまたは7.5% SDS-PAGEゲルで分離し、一定電圧でセルロースメンブレンに移します。
- メンブレンを5%無脂肪乳でブロックし、一次抗体と4°Cのシェーカーで一晩インキュベートします。
- TBST(Tris Buffered Saline with Tween 20)で3回洗浄した後、二次抗体と室温で1時間インキュベートします。
- イメージングシステムで信号を検出します。
注:この研究で使用された主要な抗体には、マウス抗αSMA(1:500)、ウサギ抗ビメンチン(1:2000)、ウサギ抗フィブロネクチン(1:2000)、およびマウス抗GAPDH(1:50000)が含まれていました。本試験で用いた二次抗体には、ペルオキシダーゼ標識ヤギ抗ウサギIgG(H + L)(1:5000)およびペルオキシダーゼ結合ヤギ抗マウスIgG(H + L)(1:5000)が含まれていました。
- マウスMCの免疫蛍光染色
注:この手順に必要な試薬は 、補足表2に記載されています。- ステップ3.3-3.8およびステップ4.1と同じ手順に従って細胞をトリプシン化します。
- セルを再懸濁してカウントします。1 x 105 細胞を取り出し、15 mmガラス底細胞培養皿(15 mmガラス底部あたり1 mL培養培地2)に加えます。
- MCを4%パラホルムアルデヒドで15分間固定し(ガラス底15mmあたり4%パラホルムアルデヒド1mL)、PBSで3回洗浄します。
- MCを0.1% Triton X-100で10分間処理し、細胞膜を透過化します。
- PBSでさらに3回洗浄した後、細胞を室温で3%BSA PBS溶液で30分間ブロックします。
- 細胞を洗浄し、一次抗マウスαSMA抗体および抗ウサギビメンチン抗体と4°Cで一晩インキュベートします。
- 赤色のAlexa 594に結合した二次ロバ抗マウスIgGおよび緑色FITCに結合したロバ抗ウサギIgGを室温で1時間インキュベートします。
- 核対比染色にはDAPIを室温で1分間使用します。
- 蛍光合成用培地を追加し、スライドガラスで覆います。共焦点顕微鏡を使用して細胞を分析します。
注:この研究で使用された主要な抗体には、マウス抗αSMA(1:200)とウサギ抗ビメンチン(1:200)が含まれていました。この研究で使用された二次抗体には、赤色のAlexa 594に結合したロバ抗マウスIgG(1:400)、緑色のFITCに結合したロバ抗ウサギIgG(1:400)、およびDAPI(1:1000)が含まれていました。
- マウスMCのフローサイトメトリー
- ステップ3.3-3.8およびステップ4.1と同じ手順に従って細胞をトリプシン化します。
- セルを再懸濁してカウントします。5 x 105 細胞を取って、3 mLのPBSで1回洗浄します。
- フローチューブに100 μLのPBSを入れて細胞を再懸濁し、1〜2 μLの抗マウスPDGFRB(CD140b)抗体を添加します。
- 細胞を氷上で暗所で30分間インキュベートし、フローサイトメトリーで解析します。
結果
この研究では、マウスMCの単離とex vivo細胞培養に最適化されたプロトコルを開発しました。私たちの知る限り、一次MCをex vivoで検証するための標準的な方法は存在しません。以前の出版物によると、MCはαSMA、ビメンチン、およびフィブロネクチンの発現によって特徴付けられます3,14,15。ウェスタンブロット分析を使用して、MCの発現レベルを検出しました。この研究で単離されたMCは、αSMA、フィブロネクチン、およびビメンチンの有意な高発現を示しました(図4A)。完全なウェスタンブロット画像は、補足図1に記載されています。
scRNA-seqデータベースCellMarkerに基づくと、PDGFRB(CD140b)遺伝子はMCのマーカー遺伝子として機能します18。細胞を選択し、培地2で5日間培養した後、PDGFRB(CD140b)の発現をフローサイトメトリーで確認しました(図4F)。
純度をさらに検証するために、細胞を選択し、Media 2で約7〜10日間培養した後、MCを免疫蛍光染色によって検証しました。図4B-Eに示すように、培地2での10日間の培養後、95%を超える細胞がαSMAとVimentinの両方を発現しました。陽性の免疫蛍光染色結果(図4B−E)は、D−バリン特異的培地16中の細胞の生存率とともに、上述のプロトコルがマウス糸球体MCを首尾よく単離したことを示している。これらのデータは、示差接着法を用いて得られたMCの高純度をさらに確認するものです。
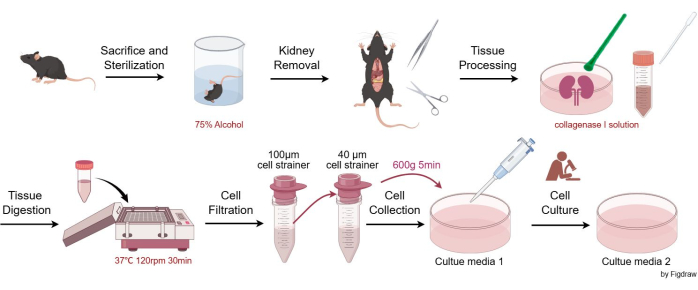
図1:マウス糸球体メサンギウム細胞を単離および精製する手順。 この図の拡大版を表示するには、ここをクリックしてください。

図2:単離細胞の初期培養 (A)単離後1日目の細胞、糸球体を表す明るい球状構造を持つ細胞。(B)単離後2日目の細胞で、上皮細胞に特徴的な多角形細胞を示している。(C)単離後3日目の細胞で、糸球体を取り巻く上皮様細胞の数が増加している。(D)単離後6日目の細胞。赤い矢印は糸球体を指しています。各画像の右下隅にある赤いスケールバーは100μmを表しています。 この図の拡大版を表示するには、ここをクリックしてください。

図3:トリプシン処理後の単離細胞の形態と、最初の継代中の培地2の置換 (A)トリプシン処理後の1日目の細胞、表面に付着した星状の細胞を示す。(B)トリプシン処理後4日目の細胞。(C)トリプシン処理後6日目の細胞。(D)トリプシン処理後10日目の細胞で、メサンギウム細胞に特徴的な紡錘形の多層成長パターンを示す。(E)CCK-8試薬の添加後2時間後に450 nmでの吸光度を測定した96ウェルプレートに異なる密度で播種した細胞。各画像の右下隅にある赤いスケールバーは200μmを表しています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:単離されたメサンギウム細胞の同定 (A)メサンギウム細胞におけるα-SMA、ビメンチン、およびフィブロネクチン発現のウェスタンブロット解析、GAPDHをローディングコントロールとして使用。(B-E)Vimentin(緑)、α-SMA(赤)、DAPI(青)の単離されたメサンギウム細胞の免疫蛍光染色。(F)培地2で5日間培養したメサンギウム細胞におけるPDGFRB(CD140b)発現のフローサイトメトリー解析。青色のピークは特異的な染色を表し、アイソタイプコントロールは比較のために示されています。各画像の左上隅にある赤いスケールバーは100μmを表しています。この図の拡大版を表示するには、ここをクリックしてください。
補足図1:ウェスタンブロットの完全画像。このファイルをダウンロードするには、ここをクリックしてください。
補足表1:ウェスタンブロット分析に使用した試薬。 このファイルをダウンロードするには、ここをクリックしてください。
補足表2:免疫蛍光染色に使用した試薬。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
腎臓関連疾患は非常に一般的であり、マウスはヒトとの遺伝的類似性や確立された疾患モデルの利用可能性から、これらの疾患を研究するための主要な動物モデルとして広く使用されています。メサンギウム細胞は、構造的なサポートを提供し、糸球体濾過を調節し、免疫応答に関与することにより、糸球体の正常な構造と機能を維持する上で重要な役割を果たします。ヒト、ラット、およびニワトリ14,15,19からメサンギウム細胞を単離するための種々の実験的技術が存在する一方で、マウス腎臓からこれらの細胞を単離するための標準化された、効率的で、再現性のある方法はまだ確立されていない。このような方法がないと、研究の進歩が制限され、腎臓病のマウスモデルにおけるメサンギウム細胞の機能を調べる能力が妨げられます。
この研究では、マウスメサンギウム細胞の単離、精製、 およびex vivo 培養のための時間効率が高く効果的な方法を開発しました。最適化されたプロトコールにより、生細胞の高収率が保証され、腎臓研究のための貴重なツールとなっています。成功した細胞分離を達成し、高い細胞生存率を維持するために、実験プロセス中にいくつかの重要な要素を慎重に考慮する必要があります: (1)無菌性の維持:すべての細胞採取ステップは、微生物汚染を防ぐためにクリーンベンチの下で実行する必要があります。これは細胞の生存能力を損ない、実験結果に影響を与える可能性があります。(2)組織の破壊:粉砕ロッドを使用して腎臓組織を徹底的に粉砕し、完全な機械的解離を確保し、酵素消化を促進する必要があります。粉砕が不十分な場合、細胞の放出が非効率的になり、細胞収量が低下する可能性があります。(3)組織消化の最適化:酵素消化プロセスでは、組織分解の程度を評価するために定期的な観察が必要です。溶液を複数回穏やかに反転させることで、酵素作用を強化し、細胞への損傷を最小限に抑えながら細胞の解離を促進することができます。(4)細胞のふるい分けと収集:ふるい分けの段階では、細胞ストレーナーを複数回すすぐことが、収集された細胞の数を最大化するために不可欠です。すすぎが不完全であると、細胞が失われ、収量が低下する可能性があり、単離プロセスの全体的な成功に影響を与える可能性があります。
この方法は現在、マウス腎臓からの初代メサンギウム細胞の単離に専ら最適化されており、他の動物モデルへの適用性はまだ評価されていません。このプロトコルを使用して単離に成功していますが、さまざまな種での使用に適合させるためには、さらなる変更が必要になる場合があります。培養された初代メサンギウム細胞は、第7世代まで生存し続けました。しかし、その後のパッセージでは成長率の低下が観察されました。この増殖能力の低下は、細胞の老化または培養環境の変化に起因する可能性があります。したがって、細胞を初代培養の初期段階で関連する実験に利用し、最適な機能と実験の再現性を確保することをお勧めします。
全体として、この方法は、一般的に入手可能な実験装置および試薬を利用して、初代メサンギウム細胞を迅速に単離するための信頼性、効率性、再現性のあるアプローチを提供します。この技術は、簡単でアクセスしやすいプロトコルを提供することで、腎臓研究を促進し、疾患モデルにおけるメサンギウム細胞機能の研究をサポートします。マウス由来の初代メサンギウム細胞を必要とする研究者にとって、この方法は貴重な参考資料となり、さまざまな実験用途で高品質な細胞培養を確立することができます。
開示事項
著者は、金銭的またはその他の利益相反を宣言しません。
謝辞
この研究は、中国国家自然科学基金会(No.82470196、No.82070219、No.81870157)からのY.Z.への助成金と、四川大学教員開始基金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 100 µm Cell Strainer | Biosharp | BS-100-CS | |
| 100 mm Petri Dish | Sorfa | 230301 | |
| 15 mL Centrifuge Tube | Sorfa | 411000 | |
| 15 mm glass bottom cell culture dish | Sorfa | 201200 | |
| 180 kDa Plus Prestained Protein Marker | Vazyme | MP201-01 | |
| 2 mM L-glutamine | BasalMedia | S210JV | |
| 4% Paraformaldehyde | Biosharp | BL539A | |
| 40 µm Cell Strainer | Biosharp | BS-40-XBS | |
| 50 mL Centrifuge Tube | Sorfa | 41000 | |
| 60 mm Petri Dish | Sorfa | 230201 | |
| 75% Alcohol | Knowles | 64-17-5 | |
| 96 Well Cell Culture Plates, TC-treated | Servicebio | CCP-96H | |
| Antibiotics (10 μg/mL ceftriaxone plus 100 μg/mL gentamicin) | NCM | C100C5 | |
| BCA (Bicinchoninic acid) Protein Assay kit | CWBIO | CW0014S | |
| Cell Counting Kit-8 | Oriscience | CB101 | |
| Confocal Microscope | FV-3000 | Olympus | |
| DMSO | Sigma | D2650 | |
| DMSO | Sigma | D2650 | |
| Earle's Balanced Salt Solution (1x EBSS) | Beyotime | C0213 | |
| Fetal Bovine Serum (FBS) | Excell | FSP500 | |
| Fluorescence Cell Analyzer | Mira FL | Countstar | |
| Fluoromount media | Southern Biotech | 0100-01 | |
| Insulin, Transferrin, Selenium Solution 100x (ITS -G) | Gibco | 41400045 | |
| Inverted Fluorescence Microscope | Olympus | IX83 | |
| Lysis Buffer | Adilab | PP1101 | |
| One-Step PAGE Preparation Kit (10%) | Oriscience | PB102 | |
| One-Step PAGE Preparation Kit (7.5%) | Oriscience | PB101 | |
| PE anti-mouse CD140b Antibody | Biolegend | 323605 | |
| Phosphate Buffered Saline (PBS) | Servicebio | G4202 | |
| Plastic Cell Pestle | Biofil | CC-4090 | |
| Proteinase Inhibitor Cocktail | Roche | 4693159001 | |
| PVDF Membrane | Vazyme | E802-01 | |
| Recombinant Human Insulin | Solarbio | 11061-68-0 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Corning | 10-040-CV | |
| SDS-PAGE Sample Loading Buffer (5x) | Servicebio | G2013 | |
| Specially customized Roswell Park Memorial Institute (RPMI) 1640 Medium (D-valine instead of L-valine) | Procell | WH3923U222 | |
| TBS (Tris Buffered Saline) | Servicebio | G0001-2L | |
| Triton X-100 | Biosharp | BS084 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Tween 20 | Biosharp | BS100 | |
| Type I collagenase | Solarbio | CB140 |
参考文献
- Pollak, M. R., Quaggin, S. E., Hoenig, M. P., Dworkin, L. D. The glomerulus: The sphere of influence. Clin J Am Soc Nephrol. 9 (8), 1461-1469 (2014).
- Mené, P., Simonson, M. S., Dunn, M. J. Physiology of the mesangial cell. Physiol Rev. 69 (4), 1347-1424 (1989).
- Avraham, S., Korin, B., Chung, J. J., Oxburgh, L., Shaw, A. S. The mesangial cell - the glomerular stromal cell. Nat Rev Nephrol. 17 (12), 855-864 (2021).
- Chadban, S. J., Atkins, R. C. Glomerulonephritis. Lancet. 365 (9473), 1797-1806 (2005).
- Qian, Y., Feldman, E., Pennathur, S., Kretzler, M., Brosius, F. C. From fibrosis to sclerosis: Mechanisms of glomerulosclerosis in diabetic nephropathy. Diabetes. 57 (6), 1439-1445 (2008).
- Zhu, Y., et al. Iga Gut microbiome regulates the production of hypoglycosilated iga1 via the tlr4 signaling pathway. Nephrol Dial Transplant. 39 (10), 1624-1641 (2024).
- Kong, L. -. L., et al. Advances in murine models of diabetic nephropathy. J Diabetes Res. 2013, 797548 (2013).
- Schiffer, M., et al. Inhibitory smads and tgf-beta signaling in glomerular cells. J Am Soc Nephrol. 13 (11), 2657-2666 (2002).
- Gyarmati, G., et al. Sparsentan improves glomerular hemodynamics, cell functions, and tissue repair in a mouse model of FSGS. JCI Insight. 9 (19), e177775 (2024).
- Chafin, C. B., Regna, N. L., Hammond, S. E., Reilly, C. M. Cellular and urinary microRNA alterations in NZB/W mice with hydroxychloroquine or prednisone treatment. Int Immunopharmacol. 17 (3), 894-906 (2013).
- Lucero, C. M., et al. Tnf-α plus il-1β induces opposite regulation of cx43 hemichannels and gap junctions in mesangial cells through a rhoa/rock-dependent pathway. Int J Mol Sci. 23 (17), (2022).
- Schnaper, H. W., Hayashida, T., Hubchak, S. C., Poncelet, A. C. Tgf-beta signal transduction and mesangial cell fibrogenesis. Am J Physiol Renal Physiol. 284 (2), F243-F252 (2003).
- Mackay, K., et al. Glomerular epithelial, mesangial, and endothelial cell lines from transgenic mice. Kidney Int. 33 (3), 677-684 (1988).
- Wilson, H. M., Stewart, K. N. Glomerular epithelial and mesangial cell culture and characterization. Methods Mol Med. 107, 269-282 (2005).
- Menè, P., Stoppacciaro, A. Isolation and propagation of glomerular mesangial cells. Methods Mol Biol. 466, 3-17 (2009).
- Gilbert, S. F., Migeon, B. R. D-valine as a selective agent for normal human and rodent epithelial cells in culture. Cell. 5 (1), 11-17 (1975).
- Kreisberg, J. I., Venkatachalam, M., Troyer, D. Contractile properties of cultured glomerular mesangial cells. Am J Physiol. 249 (4 Pt 2), F457-F463 (1985).
- Adam, M., Potter, A. S., Potter, S. S. Psychrophilic proteases dramatically reduce single-cell rna-seq artifacts: A molecular atlas of kidney development. Development. 144 (19), 3625-3632 (2017).
- Sadovnic, M. J., Brand-Elnaggar, J., Bolton, W. K. Isolation and characterization of chicken mesangial cells. Nephron. 58 (1), 75-84 (1991).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved