Method Article
Optimisation de l’isolement et de la purification des cellules mésangiales glomérulaires murines
Dans cet article
Résumé
Cette étude a développé un protocole optimisé pour l’isolement des cellules mésangiales (MC) murines et leur culture cellulaire ex vivo . Ces cellules peuvent être traversées plusieurs fois, congelées, ravivées et cultivées sans compromettre la croissance cellulaire ou l’expression des protéines.
Résumé
Les cellules mésangiales (MC) sont des cellules stromales situées dans l’espace moyen du glomérule, avec des fonctions pivots dans l’homéostasie glomérulaire. Des méthodes d’isolement, de purification et de culture des MC glomérulaires ont été développées et optimisées depuis les années 1980 pour être utilisées dans la recherche biomédicale, en particulier dans le domaine de la néphrologie. Les souris sont les modèles animaux expérimentaux les plus fréquemment utilisés dans la recherche sur les maladies rénales. Dans cette étude, nous avons développé un protocole optimisé pour l’isolement des MC murins et la culture cellulaire ex vivo . Ces cellules peuvent être traversées plusieurs fois, congelées, ravivées et cultivées sans compromettre la croissance cellulaire ou l’expression des protéines. Cette approche optimisée réduit considérablement la durée de l’étude pour les chercheurs et permet la préservation des cellules à long terme. L’équipement nécessaire aux procédures est facilement accessible dans un laboratoire biomédical de base, et les étapes de la procédure sont simples. L’acquisition des cellules cibles ne nécessite que 2 à 3 semaines, soit une réduction d’au moins 1 semaine par rapport aux méthodes existantes.
Introduction
Le glomérule est un réseau de capillaires qui effectue la tâche essentielle de filtrer le sang pour former l’urine1. Les cellules mésangiales (MC) sont intégrées dans la matrice mésangiale, situées entre les capillaires glomérulaires, et sont particulièrement bien placées pour influencer la dynamique glomérulaire grâce à leurs diverses fonctions2. Les MC jouent des rôles cruciaux dans le glomérule, notamment le développement glomérulaire, le soutien structurel des capillaires glomérulaires, la phagocytose et la production de la matrice de la membrane basale glomérulaire3. L’étude des cellules mésangiales est essentielle pour faire progresser notre compréhension de la physiologie et de la pathologie rénales.
L’implication des cellules mésangiales dans des conditions pathologiques est également à noter. En réponse à une lésion ou à une maladie glomérulaire, telle que la néphropathie diabétique ou la glomérulonéphrite, les cellules mésangiales peuvent proliférer et sécréter un excès de composants de la matrice extracellulaire, entraînant une glomérulosclérose et une altération de la fonction rénale 4,5. Comprendre les fonctions et les mécanismes régulateurs des cellules mésangiales est donc essentiel pour développer des stratégies thérapeutiques pour les maladies rénales.
Les cellules mésangiales murines permettent aux chercheurs de modéliser et d’explorer les processus moléculaires et cellulaires impliqués dans des affections telles que la néphropathie à IgA6, la néphropathie diabétique7 et la glomérulosclérose segmentaire focale (FSGS)8,9. Compte tenu de leur rôle dans la fibrose rénale et l’inflammation, les MC glomérulaires murins sont fréquemment utilisés dans les études cliniques pour évaluer l’efficacité des composés thérapeutiques 9,10. De plus, les cellules mésangiales murines sont un outil important pour étudier les effets de diverses voies de signalisation sur la fonction rénale, y compris la voie RhoA/ROCK11 et la voie12 du facteur de croissance transformant bêta (TGF-β). Ces études aident à élucider comment ces molécules de signalisation contribuent à la progression de la maladie rénale. Qu’ils soient utilisés pour la modélisation de maladies, le développement thérapeutique ou la recherche sur la transduction du signal, les MC murins continuent de servir de ressource cruciale pour faire progresser notre compréhension de la santé et des maladies rénales.
Mackay et al. ont mis au point une méthode pour acquérir des lignées cellulaires ex vivo de cellules épithéliales, mésangiales et endothéliales glomérulaires à partir de souris transgéniques en 198813. Wilson et Stewart ont mis au point une méthode pour isoler et purifier les MC primaires du tissu rénal du patient, qui implique trois cycles de tamisage et un lavage approfondi avec un média14. Menè et Stoppacciaro ont également proposé une méthode pour isoler les MC primaires du tissu rénal du patient ou du rat. Cette technique implique deux cycles de tamisage, deux poussées d’aiguille et une digestion par la collagénase. Les cellules obtenues à partir de 4 à 8 reins de rat sont plaquées sur une plaque à six puits, bien que le rendement soit relativement faible15. Ces méthodes nécessitent la dissection des reins en petits morceaux avant le traitement. De plus, ces approches prennent environ 3 à 4 semaines pour produire des MC purifiés.
Les souris sont les modèles animaux expérimentaux les plus fréquemment utilisés dans la recherche sur les maladies rénales. Cependant, il n’existe toujours pas de méthode systématique pour isoler les MC murins. Dans cette étude, nous avons développé un protocole optimisé pour l’isolement des MC murins et la culture cellulaire ex vivo . Cette méthode peut être utilisée lors de l’utilisation de MC primaires de rein murin pour la recherche expérimentale. Par rapport aux méthodes précédentes, cette approche élimine le besoin de couper les tissus et de les tamiser avant la digestion. Au lieu de cela, l’ensemble du rein de souris est broyé à l’aide d’un broyeur de cellules et directement digéré avec de la collagénase. La solution de digestion est ensuite tamisée deux fois, toutes les cellules étant collectées sur le deuxième tamis et remises en suspension. Cette méthode permet à deux reins de souris de produire suffisamment de cellules pour ensemencer deux à trois boîtes de culture de 100 mm en 10 jours. Les MC purifiés sont ensuite obtenus par culture et purification à l’aide d’un milieu spécialisé contenant de la D-valine. Ces cellules peuvent être traversées plusieurs fois, congelées, ravivées et cultivées sans compromettre la croissance cellulaire ou l’expression des protéines. L’équipement nécessaire à ces procédures est facilement disponible pour les laboratoires biomédicaux de base, et l’ensemble du processus ne prend que 2 à 3 semaines pour obtenir les cellules cibles. Cette méthode est adaptée aux études impliquant des MC murins pour étudier des maladies ou des mécanismes liés aux reins, car elle est efficace et permet de gagner du temps.
Protocole
Les expériences sur les animaux ont été conformes aux directives ARRIVE, et toutes les procédures sur les animaux ont été menées conformément à la législation nationale et à la directive de la Commission européenne (2010/63/UE). Les souris ont été logées et maintenues dans des conditions exemptes d’agents pathogènes, conformément aux exigences des comités de soin et d’utilisation des animaux de l’hôpital de Chine occidentale de l’Université du Sichuan. Toutes les études expérimentales sur des animaux ont été approuvées par les comités de protection et d’utilisation des animaux de l’hôpital de l’Ouest de la Chine de l’Université du Sichuan. Des souris mâles C57BL/6JGpt âgées de huit semaines ont été utilisées pour l’isolement des cellules mésangiales dans cet essai. Les détails des réactifs et de l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux. La figure 1 illustre les procédures d’isolement et de purification des cellules mésangiaires glomérulaires murines.
1. Préparation des réactifs pour l’isolement des MC murins
REMARQUE : Assurez-vous que tous les réactifs et équipements sont stériles.
- Collagénase de type I (750 U/mL) : Peser la poudre et la dissoudre peu de temps avant l’utilisation dans RPMI 1640.
- Milieu de culture cellulaire mésangial 1 : Mélanger RPMI 1640 avec 2 mM de glutamine, 17 % de FBS, des antibiotiques (100 unités/mL de pénicilline plus 10 000 μg/mL de streptomycine) et 0,1 U/mL d’insuline.
- Milieu de culture cellulaire mésangial 2 : Combinez RPMI 1640 (D-valine) avec 2 mM de glutamine, 10 % de FBS, des antibiotiques (100 unités/mL de pénicilline plus 10 000 μg/mL de streptomycine), ITS-G (insuline, transferrine, solution de sélénium 100x) et 0,1 U/mL d’insuline. Conserver le milieu de culture de cellules mésangiales à 4 °C et l’utiliser dans le mois suivant la préparation.
- Milieu de cryoconservation cellulaire : Préparez un mélange de milieu RPMI 1640, de sérum et de DMSO dans un rapport de 7:2:1.
2. Isolement des MC murins
- Sacrifiez sans cruauté les souris par asphyxie au CO2 suivie d’une luxation cervicale (selon les protocoles approuvés par l’institution). Immerger les carcasses dans un bécher contenant 75 % d’alcool pour la stérilisation, puis transférer l’animal sur une surface de travail aseptique.
- Retirez aseptiquement les reins de la souris à l’aide de ciseaux et d’une pince à épiler, placez-les dans une boîte de Pétri, rincez avec EBSS (Earle’s Balanced Salt Solution), puis retirez soigneusement le tissu conjonctif et la capsule rénale à l’aide d’une pince à épiler.
- Coupez le rein en deux verticalement, ajoutez 3 à 4 ml de solution de collagénase I et broyez avec un pilon en plastique.
- Pipeter tous les tissus et la solution de la boîte de Pétri dans un tube à centrifuger de 15 ml. Rincez la boîte de Pétri avec 1 à 2 ml de solution de collagénase I pour vous assurer que tous les tissus sont transférés. Placez la solution dans l’agitateur à 37 °C, en agitant à 120 tr/min pendant 30 min. Ensuite, ajoutez un volume égal de solution stop (milieu de culture 1).
- Pipeter la solution à partir du tube à centrifuger de 15 mL, la faire passer dans une crépine de 100 μm et recueillir le filtrat dans un tube à centrifuger de 50 mL.
- Faites passer le fluide de l’étape 2.5 à travers une crépine de 40 μm, en ne conservant que les cellules de la crépine de 40 μm. Rincez la passoire à plusieurs reprises avec le milieu de culture 1 pour assurer la collecte d’autant de cellules que possible sur la passoire. Transférez les cellules collectées de la crépine dans un nouveau tube à centrifuger de 50 ml.
- Centrifuger la suspension à 600 x g pendant 5 min (à température ambiante), puis remettre les cellules en suspension dans une boîte de culture cellulaire en fonction de la densité cellulaire. En général, remettre en suspension les cellules de deux reins dans deux ou trois boîtes de culture de 100 mm (milieu de culture de 10 mL boîte de 1/100 mm). Placez les plats dans un incubateur à cellules à 37 °C avec 95 % d’air / 5 % de CO2.
- Examiner la morphologie et l’adhésion des cellules au microscope (40×) le lendemain. Si des cellules mortes flottantes sont présentes dans le milieu de culture, utilisez une pipette pour retirer le milieu du fond de la boîte de culture, en prenant soin de ne pas déranger les cellules attachées.
- Ajouter 1 à 2 ml de PBS le long du bord intérieur de la boîte de culture pour rincer les cellules. À l’aide d’une pipette, retirez tout le PBS du fond de la boîte de culture, et ajoutez enfin 10 ml de milieu de culture 1 le long du bord intérieur de la boîte de culture.
3. Purification des MC murins
- Un jour après la séparation, retirez les cellules non adhérentes en lavant délicatement et en remplaçant le milieu de culture par du milieu de culture frais 1, comme décrit à l’étape 2.8. Observez les cellules du glomérule au microscope à contraste de phase (40×).
REMARQUE : Les formes sphériques brillantes représentent le glomérule, tandis que les cellules environnantes présentent des caractéristiques semblables à des pavés, caractéristiques des cellules épithéliales (Figure 2A). - Observez la morphologie cellulaire après 1 à 3 jours (Figure 2B-C). Des cellules en forme d’étoile et de fuseau apparaîtront autour des cellules de galets, comme le montre la figure 2D.
- Lorsque les cellules atteignent une confluence de 80 % (généralement dans un délai de 7 à 10 jours), lavez-les deux fois avec du PBS stérile, puis trypsinisez les cellules avec une solution de trypsine à 0,25 % (2 ml de solution de trypsine à 0,25 % par boîte de 100 mm).
- Le processus initial de trypsinisation cellulaire peut prendre environ 20 min. Après avoir ajouté la trypsine, placez la parabole dans un incubateur à 37 °C. Observez le processus en temps réel à l’aide d’un microscope à contraste de phase (40×) pour évaluer la trypsinisation des cellules.
- Terminez le processus de trypsinisation en ajoutant un volume égal de milieu 2 lorsque la plupart des cellules présentent une morphologie arrondie et se détachent de la surface de la boîte.
- Centrifuger les cellules à 600 × g pendant 5 min (à température ambiante), puis les remettre en suspension dans le milieu 2. En général, remettre en suspension les cellules d’une boîte de 100 mm dans deux boîtes de culture de 100 mm (milieu de culture de 10 mL boîte de 2/100 mm).
- Changez le milieu de culture 2 le lendemain. Observez de nombreuses cellules en suspension et fragments de cellules au microscope (40×), car seuls les MC peuvent survivre et proliférer dans le milieu de la D-valine16. Changez le milieu tous les 1 à 2 jours pour éliminer les cellules mortes. Les cellules adhérentes de la culture sont des MC (Figure 3A-D). Déterminer le taux de croissance des MC isolés (figure 3E).
- Une fois que les cellules atteignent 80 % de confluence, trypsinisez et passez-les. Les MC prennent généralement environ 5 à 10 minutes pour la trypsinisation.
4. Conservation à long terme des MC murins
REMARQUE : Comme les cellules primaires peuvent se différencier et muter avec le temps et de multiples passages, congelez et stockez les MC après la purification cellulaire pour une conservation à long terme.
- Retirer délicatement le surnageant le long du bord inférieur de la boîte à l’aide d’une pipette, laver les cellules deux fois avec du PBS stérile, puis essayer avec une solution de trypsine à 0,25 % (2 ml de solution de trypsine à 0,25 % par boîte de 100 mm). Suivez les étapes de trypsinisation décrites aux étapes 3.3 à 3.8.
- Après l’essayensination, ajoutez un volume égal de milieu 2 pour terminer le processus et transférez tout le liquide dans un tube à centrifuger de 15 ml. Centrifuger les cellules à 600 × g pendant 5 minutes (à température ambiante), jeter le surnageant et remettre les cellules en suspension dans 1 mL de PBS pour compter les cellules.
- Utilisez un compteur automatique de cellules pour compter les cellules. Prélever 20 μL de 1 mL de solution de cellules remises en suspension et les ajouter à une plaque de comptage de cellules dédiée pour déterminer le nombre total de cellules. En fonction du nombre de cellules, les remettre en suspension dans un milieu de cryoconservation cellulaire (1 mL de milieu de cryoconservation cellulaire pour 106 cellules).
- Transférez la solution cellulaire dans des tubes de cryoconservation (1 mL de milieu de cryoconservation cellulaire pour tube de cryoconservation de 2 mL) et effectuez une congélation lente jusqu’à -80 °C avant de passer à l’azote liquide pour la conservation.
REMARQUE : Remettez en suspension et ensemencez les cellules dans des boîtes de culture cellulaire pour amplification si nécessaire. Les cellules doivent être utilisées entre les passages 3 et 8 après avoir été entièrement caractérisées17.
5. Identification des MC murins
REMARQUE : Après que les cellules ont été traversées deux fois, identifiez les MC murins à l’aide des techniques suivantes.
- Western blot de MC murins
REMARQUE : Les réactifs nécessaires à la procédure sont indiqués dans le tableau supplémentaire 1.- Essayez de diviser les cellules en suivant les mêmes étapes qu’aux sections 3.3-3.8 et 4.1.
- Après avoir collecté les cellules, lysez-les pour en extraire des protéines et mesurer la concentration en protéines.
- Prélever une quantité appropriée d’échantillon (généralement 20 ng), ajouter un tampon de chargement et dénaturer à 100 °C pendant 5 min.
- Résoudre la protéine (20 ng) avec un gel SDS-PAGE à 10 % ou un gel SDS-PAGE à 7,5 %, puis la transférer sur une membrane cellulosique à une tension constante.
- Bloquez la membrane avec du lait écrémé à 5 %, puis incubez avec l’anticorps primaire à 4 °C sur un agitateur pendant la nuit.
- Incuber avec l’anticorps secondaire à température ambiante pendant 1 h après le lavage avec TBST (Tris Buffered Saline with Tween 20) trois fois.
- Détectez les signaux avec le système d’imagerie.
REMARQUE : Les principaux anticorps utilisés dans cette étude comprenaient l’anti-αSMA de souris (1:500), l’anti-vimentine de lapin (1:2000), l’anti-fibronectine de lapin (1:2000) et l’anti-GAPDH de souris (1:50000). Les anticorps secondaires utilisés dans cette étude comprenaient des IgG anti-lapin de chèvre conjuguées à la peroxydase (H + L) (1:5000) et des IgG anti-souris de chèvre conjuguées à la peroxydase (H + L) (1:5000).
- Coloration par immunofluorescence de MC murins
REMARQUE : Les réactifs nécessaires à la procédure sont fournis dans le tableau supplémentaire 2.- Essayez de pixelliser les cellules en suivant les mêmes étapes qu’aux étapes 3.3-3.8 et 4.1.
- Remettez les cellules en suspension et comptez-les. Prenez 1 x 105 cellules et ajoutez-les dans la boîte de culture cellulaire à fond en verre de 15 mm (1 ml de milieu de culture 2 par fond en verre de 15 mm).
- Fixez les MC avec 4 % de paraformaldéhyde pendant 15 minutes (1 ml de paraformaldéhyde à 4 % par fond de verre de 15 mm), puis lavez-les trois fois avec du PBS.
- Traitez les MC avec 0,1 % de Triton X-100 pendant 10 min pour perméabiliser les membranes cellulaires.
- Après trois autres lavages avec du PBS, bloquez les cellules à température ambiante avec une solution de BSA PBS à 3 % pendant 30 min.
- Lavez les cellules et incuberez-les avec des anticorps primaires anti-SMA αSMA de souris et anti-Vimentin de lapin à 4 °C pendant la nuit.
- Incuber pendant 1 h avec des IgG anti-souris d’âne secondaires conjuguées à Alexa 594 rouge et des IgG anti-lapin d’âne conjuguées à FITC vertes à température ambiante.
- Utilisez le DAPI pour la contre-coloration nucléaire pendant 1 min à température ambiante.
- Ajoutez un support fluoromount et couvrez avec une lame de verre. Analysez les cellules à l’aide d’un microscope confocal.
REMARQUE : Les anticorps primaires utilisés dans cette étude comprenaient l’anti-αSMA de souris (1:200) et l’anti-vimentine de lapin (1:200). Les anticorps secondaires utilisés dans cette étude comprenaient des IgG anti-souris d’âne conjuguées à Alexa 594 rouge (1:400), des IgG anti-lapin d’âne conjuguées à FITC vertes (1:400) et DAPI (1:1000).
- Cytométrie en flux des MC murins
- Essayez de pixelliser les cellules en suivant les mêmes étapes qu’aux étapes 3.3-3.8 et 4.1.
- Remettez les cellules en suspension et comptez-les. Prenez 5 x 105 cellules et lavez-les une fois avec 3 ml de PBS.
- Réintroduisez les cellules avec 100 μL de PBS dans un tube d’écoulement, puis ajoutez 1 à 2 μL d’anticorps anti-souris PDGFRB (CD140b).
- Incuber les cellules sur glace pendant 30 min dans l’obscurité, puis analyser par cytométrie en flux.
Résultats
Cette étude a développé un protocole optimisé pour l’isolement des MC murins et la culture cellulaire ex vivo. A notre connaissance, il n’existe pas de méthode standard pour valider les MC primaires ex vivo. Selon les publications précédentes, les MC sont caractérisés par l’expression de l’αSMA, de la vimentine et de la fibronectine 3,14,15. L’analyse par transfert Western a été utilisée pour détecter les niveaux d’expression des MC. Les MC isolés dans cette étude ont montré une expression significativement élevée de l’αSMA, de la fibronectine et de la vimentine (Figure 4A). L’image complète du transfert Western est fournie à la figure supplémentaire 1.
Basé sur la base de données scRNA-seq CellMarker, le gène PDGFRB (CD140b) sert de gène marqueur des MCs18. Après sélection cellulaire et culture dans le milieu 2 pendant 5 jours, l’expression de PDGFRB (CD140b) a été vérifiée par cytométrie en flux (Figure 4F).
Pour valider davantage la pureté, après la sélection cellulaire et la culture dans le milieu 2 pendant environ 7 à 10 jours, les MC ont été vérifiés par coloration par immunofluorescence. Comme le montre la figure 4B-E, après 10 jours de culture dans le milieu 2, plus de 95 % des cellules exprimaient à la fois l’αSMA et la vimentine. Les résultats positifs de la coloration par immunofluorescence (Figure 4B-E), ainsi que la viabilité des cellules dans les milieux spécifiques de la D-valine16, indiquent que les protocoles décrits ci-dessus ont réussi à isoler les MC glomérulaires de souris. Ces données confirment en outre la grande pureté des MC obtenus par la méthode d’adhésion différentielle.
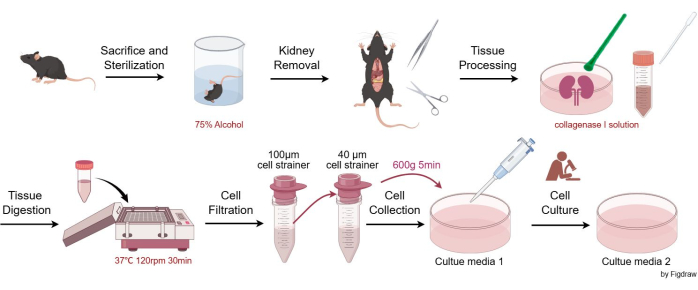
Figure 1 : Procédure d’isolement et de purification des cellules mésangiaires glomérulaires murines. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Culture initiale de cellules isolées. (A) Cellules au jour 1 après l’isolement, avec des structures sphériques brillantes représentant des glomérules. (B) Cellules au jour 2 après l’isolement, montrant des cellules polygonales caractéristiques des cellules épithéliales. (C) Cellules au jour 3 après l’isolement, avec un nombre accru de cellules de type épithélial entourant le glomérule. (D) Cellules au jour 6 après l’isolement. Les flèches rouges pointent vers le glomérule. Les barres d’échelle rouges dans le coin inférieur droit de chaque image représentent 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 3 : Morphologie des cellules isolées après trypsinisation et remplacement du milieu de culture 2 lors du premier passage. (A) Cellules au jour 1 après la trypsinisation, montrant des cellules de forme étoilée adhérant à la surface. (B) Cellules au jour 4 après la trypsinisation. (C) Cellules au jour 6 après la trypsinisation. (D) Cellules au 10e jour après la trypsinisation, présentant un schéma de croissance multicouche en forme de fuseau caractéristique des cellules mésangiales. (E) Cellules ensemencées à différentes densités dans des plaques à 96 puits, avec une absorbance à 450 nm mesurée 2 h après l’ajout du réactif CCK-8. Les barres d’échelle rouges dans le coin inférieur droit de chaque image représentent 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Identification de cellules mésangiales isolées. (A) Analyse par transfert Western de l’expression de la α-SMA, de la vimentine et de la fibronectine dans les cellules mésangiales, avec GAPDH comme contrôle de charge. (B-E) Coloration par immunofluorescence de cellules mésangiales isolées pour la vimentine (vert), la α-SMA (rouge) et le DAPI (bleu). (F) Analyse par cytométrie en flux de l’expression de PDGFRB (CD140b) dans des cellules mésangiales cultivées dans le milieu 2 pendant 5 jours. Le pic bleu représente une coloration spécifique, tandis que le contrôle de l’isotype est montré à des fins de comparaison. Des barres d’échelle rouges dans le coin supérieur gauche de chaque image représentent 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Image complète du transfert de Western. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 1 : Réactifs utilisés pour l’analyse par transfert Western. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 2 : Réactifs utilisés pour la coloration par immunofluorescence. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Les maladies rénales sont très répandues et les souris sont largement utilisées comme principal modèle animal pour l’étude de ces conditions en raison de leur similitude génétique avec les humains et de la disponibilité de modèles de maladies bien établis. Les cellules mésangiales jouent un rôle crucial dans le maintien de la structure et de la fonction normales du glomérule en fournissant un soutien structurel, en régulant la filtration glomérulaire et en participant aux réponses immunitaires. Bien qu’il existe diverses techniques expérimentales pour isoler les cellules mésangiales des humains, des rats et des poulets 14,15,19, une méthode standardisée, efficace et reproductible pour isoler ces cellules des reins de souris n’a pas encore été établie. L’absence d’une telle méthode limite les progrès de la recherche et entrave la capacité d’étudier la fonction des cellules mésangiales dans des modèles murins de maladie rénale.
Dans cette étude, une méthode efficace et efficace a été mise au point pour l’isolement, la purification et la culture ex vivo de cellules mésangiales murines. Le protocole optimisé garantit un rendement élevé de cellules viables, ce qui en fait un outil précieux pour la recherche sur les reins. Plusieurs facteurs critiques doivent être soigneusement pris en compte au cours du processus expérimental pour réussir l’isolement cellulaire et maintenir une viabilité cellulaire élevée : (1) Maintien de la stérilité : Toutes les étapes de prélèvement des cellules doivent être effectuées sous un banc propre pour éviter la contamination microbienne, qui pourrait compromettre la viabilité des cellules et affecter les résultats expérimentaux. (2) Rupture tissulaire : La tige de broyage doit être utilisée pour broyer complètement le tissu rénal, assurant une dissociation mécanique complète et facilitant la digestion enzymatique. Un broyage inadéquat peut entraîner une libération inefficace des cellules et une baisse du rendement des cellules. (3) Optimisation de la digestion tissulaire : Au cours du processus de digestion enzymatique, une observation périodique est nécessaire pour évaluer l’étendue de la dégradation tissulaire. L’inversion douce de la solution plusieurs fois permet d’améliorer l’action enzymatique et de favoriser une meilleure dissociation cellulaire tout en minimisant les dommages aux cellules. (4) Tamis et collecte des cellules : Au stade du tamisage, il est essentiel de rincer la passoire cellulaire plusieurs fois pour maximiser le nombre de cellules collectées. Un rinçage incomplet peut entraîner une perte de cellules et une réduction du rendement, ce qui affecte le succès global du processus d’isolement.
Cette méthode est actuellement optimisée exclusivement pour l’isolement de cellules mésangiales primaires à partir de reins de souris, et son applicabilité à d’autres modèles animaux n’a pas encore été évaluée. Bien que l’isolement ait été réussi à l’aide de ce protocole, d’autres modifications pourraient être nécessaires pour l’adapter à différentes espèces. Les cellules mésangiales primaires cultivées sont restées viables jusqu’à la septième génération ; Cependant, une baisse du taux de croissance a été observée dans les passages ultérieurs. Cette réduction de la capacité de prolifération peut être attribuée à la sénescence cellulaire ou à des altérations de l’environnement de culture. Par conséquent, il est recommandé d’utiliser les cellules pour des expériences pertinentes aux premiers stades de la culture primaire afin d’assurer une fonctionnalité et une reproductibilité expérimentales optimales.
Dans l’ensemble, cette méthode fournit une approche fiable, efficace et reproductible pour l’isolement rapide des cellules mésangiales primaires, en utilisant des équipements de laboratoire et des réactifs couramment disponibles. En offrant un protocole simple et accessible, cette technique facilite la recherche sur les reins et soutient les études portant sur la fonction des cellules mésangiales dans des modèles de maladies. Pour les chercheurs nécessitant des cellules mésangiales primaires de souris, cette méthode constitue une référence précieuse, permettant d’établir des cultures cellulaires de haute qualité pour diverses applications expérimentales.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts, financier ou autre.
Remerciements
Ce travail a été soutenu par des subventions accordées à Y.Z. par la Fondation nationale des sciences naturelles de Chine (n° 82470196, n° 82070219 et n° 81870157) et par le Fonds de démarrage des professeurs de l’Université du Sichuan.
matériels
| Name | Company | Catalog Number | Comments |
| 100 µm Cell Strainer | Biosharp | BS-100-CS | |
| 100 mm Petri Dish | Sorfa | 230301 | |
| 15 mL Centrifuge Tube | Sorfa | 411000 | |
| 15 mm glass bottom cell culture dish | Sorfa | 201200 | |
| 180 kDa Plus Prestained Protein Marker | Vazyme | MP201-01 | |
| 2 mM L-glutamine | BasalMedia | S210JV | |
| 4% Paraformaldehyde | Biosharp | BL539A | |
| 40 µm Cell Strainer | Biosharp | BS-40-XBS | |
| 50 mL Centrifuge Tube | Sorfa | 41000 | |
| 60 mm Petri Dish | Sorfa | 230201 | |
| 75% Alcohol | Knowles | 64-17-5 | |
| 96 Well Cell Culture Plates, TC-treated | Servicebio | CCP-96H | |
| Antibiotics (10 μg/mL ceftriaxone plus 100 μg/mL gentamicin) | NCM | C100C5 | |
| BCA (Bicinchoninic acid) Protein Assay kit | CWBIO | CW0014S | |
| Cell Counting Kit-8 | Oriscience | CB101 | |
| Confocal Microscope | FV-3000 | Olympus | |
| DMSO | Sigma | D2650 | |
| DMSO | Sigma | D2650 | |
| Earle's Balanced Salt Solution (1x EBSS) | Beyotime | C0213 | |
| Fetal Bovine Serum (FBS) | Excell | FSP500 | |
| Fluorescence Cell Analyzer | Mira FL | Countstar | |
| Fluoromount media | Southern Biotech | 0100-01 | |
| Insulin, Transferrin, Selenium Solution 100x (ITS -G) | Gibco | 41400045 | |
| Inverted Fluorescence Microscope | Olympus | IX83 | |
| Lysis Buffer | Adilab | PP1101 | |
| One-Step PAGE Preparation Kit (10%) | Oriscience | PB102 | |
| One-Step PAGE Preparation Kit (7.5%) | Oriscience | PB101 | |
| PE anti-mouse CD140b Antibody | Biolegend | 323605 | |
| Phosphate Buffered Saline (PBS) | Servicebio | G4202 | |
| Plastic Cell Pestle | Biofil | CC-4090 | |
| Proteinase Inhibitor Cocktail | Roche | 4693159001 | |
| PVDF Membrane | Vazyme | E802-01 | |
| Recombinant Human Insulin | Solarbio | 11061-68-0 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Corning | 10-040-CV | |
| SDS-PAGE Sample Loading Buffer (5x) | Servicebio | G2013 | |
| Specially customized Roswell Park Memorial Institute (RPMI) 1640 Medium (D-valine instead of L-valine) | Procell | WH3923U222 | |
| TBS (Tris Buffered Saline) | Servicebio | G0001-2L | |
| Triton X-100 | Biosharp | BS084 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Tween 20 | Biosharp | BS100 | |
| Type I collagenase | Solarbio | CB140 |
Références
- Pollak, M. R., Quaggin, S. E., Hoenig, M. P., Dworkin, L. D. The glomerulus: The sphere of influence. Clin J Am Soc Nephrol. 9 (8), 1461-1469 (2014).
- Mené, P., Simonson, M. S., Dunn, M. J. Physiology of the mesangial cell. Physiol Rev. 69 (4), 1347-1424 (1989).
- Avraham, S., Korin, B., Chung, J. J., Oxburgh, L., Shaw, A. S. The mesangial cell - the glomerular stromal cell. Nat Rev Nephrol. 17 (12), 855-864 (2021).
- Chadban, S. J., Atkins, R. C. Glomerulonephritis. Lancet. 365 (9473), 1797-1806 (2005).
- Qian, Y., Feldman, E., Pennathur, S., Kretzler, M., Brosius, F. C. From fibrosis to sclerosis: Mechanisms of glomerulosclerosis in diabetic nephropathy. Diabetes. 57 (6), 1439-1445 (2008).
- Zhu, Y., et al. Iga Gut microbiome regulates the production of hypoglycosilated iga1 via the tlr4 signaling pathway. Nephrol Dial Transplant. 39 (10), 1624-1641 (2024).
- Kong, L. -. L., et al. Advances in murine models of diabetic nephropathy. J Diabetes Res. 2013, 797548 (2013).
- Schiffer, M., et al. Inhibitory smads and tgf-beta signaling in glomerular cells. J Am Soc Nephrol. 13 (11), 2657-2666 (2002).
- Gyarmati, G., et al. Sparsentan improves glomerular hemodynamics, cell functions, and tissue repair in a mouse model of FSGS. JCI Insight. 9 (19), e177775 (2024).
- Chafin, C. B., Regna, N. L., Hammond, S. E., Reilly, C. M. Cellular and urinary microRNA alterations in NZB/W mice with hydroxychloroquine or prednisone treatment. Int Immunopharmacol. 17 (3), 894-906 (2013).
- Lucero, C. M., et al. Tnf-α plus il-1β induces opposite regulation of cx43 hemichannels and gap junctions in mesangial cells through a rhoa/rock-dependent pathway. Int J Mol Sci. 23 (17), (2022).
- Schnaper, H. W., Hayashida, T., Hubchak, S. C., Poncelet, A. C. Tgf-beta signal transduction and mesangial cell fibrogenesis. Am J Physiol Renal Physiol. 284 (2), F243-F252 (2003).
- Mackay, K., et al. Glomerular epithelial, mesangial, and endothelial cell lines from transgenic mice. Kidney Int. 33 (3), 677-684 (1988).
- Wilson, H. M., Stewart, K. N. Glomerular epithelial and mesangial cell culture and characterization. Methods Mol Med. 107, 269-282 (2005).
- Menè, P., Stoppacciaro, A. Isolation and propagation of glomerular mesangial cells. Methods Mol Biol. 466, 3-17 (2009).
- Gilbert, S. F., Migeon, B. R. D-valine as a selective agent for normal human and rodent epithelial cells in culture. Cell. 5 (1), 11-17 (1975).
- Kreisberg, J. I., Venkatachalam, M., Troyer, D. Contractile properties of cultured glomerular mesangial cells. Am J Physiol. 249 (4 Pt 2), F457-F463 (1985).
- Adam, M., Potter, A. S., Potter, S. S. Psychrophilic proteases dramatically reduce single-cell rna-seq artifacts: A molecular atlas of kidney development. Development. 144 (19), 3625-3632 (2017).
- Sadovnic, M. J., Brand-Elnaggar, J., Bolton, W. K. Isolation and characterization of chicken mesangial cells. Nephron. 58 (1), 75-84 (1991).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon