Method Article
Optimierung der Isolierung und Reinigung von murinen glomerulären Mesangialzellen
In diesem Artikel
Zusammenfassung
In dieser Studie wurde ein optimiertes Protokoll für die Isolierung von murinen Mesangialzellen (MCs) und deren ex vivo Zellkultur entwickelt. Diese Zellen können mehrfach passageiert, eingefroren, wiederbelebt und kultiviert werden, ohne das Zellwachstum oder die Proteinexpression zu beeinträchtigen.
Zusammenfassung
Mesangialzellen (MCs) sind Stromazellen, die sich im mittleren Raum des Glomerulus befinden und eine zentrale Funktion in der glomerulären Homöostase haben. Seit den 1980er Jahren wurden Methoden zur Isolierung, Reinigung und Kultivierung glomerulärer MCs für den Einsatz in der biomedizinischen Forschung, insbesondere im Bereich der Nephrologie, entwickelt und optimiert. Mäuse sind die am häufigsten verwendeten Versuchstiermodelle in der Forschung zu Nierenerkrankungen. In dieser Studie haben wir ein optimiertes Protokoll für die Isolierung von murinen MCs und die ex vivo Zellkultur entwickelt. Diese Zellen können mehrfach passageiert, eingefroren, wiederbelebt und kultiviert werden, ohne das Zellwachstum oder die Proteinexpression zu beeinträchtigen. Dieser optimierte Ansatz verkürzt die Studiendauer für die Forscher erheblich und ermöglicht eine langfristige Zellkonservierung. Die für die Eingriffe notwendige Ausrüstung ist in einem einfachen biomedizinischen Labor leicht zugänglich, und die Verfahrensschritte sind einfach. Die Gewinnung von Zielzellen dauert nur 2-3 Wochen, eine Reduktion von mindestens 1 Woche im Vergleich zu bestehenden Methoden.
Einleitung
Der Glomerulus ist ein Netzwerk von Kapillaren, das die wesentliche Aufgabe erfüllt, das Blut zu filtern, um Urinzu bilden 1. Mesangialzellen (MCs) sind in die mesangiale Matrix eingebettet, befinden sich zwischen den glomerulären Kapillaren und sind durch ihre vielfältigen Funktionen einzigartig positioniert, um die glomeruläre Dynamik zu beeinflussen2. MCs spielen eine entscheidende Rolle im Glomerulus, einschließlich der glomerulären Entwicklung, der strukturellen Unterstützung der glomerulären Kapillaren, der Phagozytose und der Produktion der glomerulären Basalmembranmatrix3. Die Untersuchung von Mesangialzellen ist von entscheidender Bedeutung, um unser Verständnis der Nierenphysiologie und -pathologie zu verbessern.
Bemerkenswert ist auch die Beteiligung von Mesangialzellen an pathologischen Zuständen. Als Reaktion auf glomeruläre Verletzungen oder Erkrankungen, wie z. B. diabetische Nephropathie oder Glomerulonephritis, können sich Mesangialzellen vermehren und überschüssige extrazelluläre Matrixkomponenten sezernieren, was zu Glomerulosklerose und eingeschränkter Nierenfunktion führt 4,5. Das Verständnis der Funktionen und Regulationsmechanismen von Mesangialzellen ist daher essentiell für die Entwicklung von Therapiestrategien für Nierenerkrankungen.
Maus-Mesangialzellen ermöglichen es den Forschern, die molekularen und zellulären Prozesse zu modellieren und zu erforschen, die an Erkrankungen wie der IgA-Nephropathie6, der diabetischen Nephropathie7 und der fokalen segmentalen Glomerulosklerose (FSGS) beteiligt sind8,9. Aufgrund ihrer Rolle bei Nierenfibrose und -entzündung werden murine glomeruläre MCs häufig in klinischen Studien verwendet, um die Wirksamkeit therapeutischer Wirkstoffe zu beurteilen 9,10. Darüber hinaus sind murine Mesangialzellen ein wichtiges Instrument, um die Auswirkungen verschiedener Signalwege auf die Nierenfunktion zu untersuchen, einschließlich des RhoA/ROCK-Signalwegs11 und des Transforming Growth Factor-beta (TGF-β)-Signalwegs12. Diese Studien helfen aufzuklären, wie diese Signalmoleküle zum Fortschreiten von Nierenerkrankungen beitragen. Unabhängig davon, ob sie für die Modellierung von Krankheiten, die therapeutische Entwicklung oder die Signaltransduktionsforschung eingesetzt werden, dienen murine MCs weiterhin als entscheidende Ressource für unser besseres Verständnis der Gesundheit und Krankheit von Nieren.
Mackay et al. etablierten 1988 eine Methode zur Gewinnung von ex vivo-Zelllinien von glomerulären Epithel-, Mesangial- und Endothelzellen von transgenen Mäusen13. Wilson und Stewart entwickelten ein Verfahren zur Isolierung und Reinigung primärer MCs aus dem Nierengewebe des Patienten, das drei Siebrunden und ausgiebiges Waschen mit Medien14 umfasst. Menè und Stoppacciaro schlugen auch eine Methode zur Isolierung primärer MCs aus Nierengewebe von Patienten oder Ratten vor. Diese Technik umfasst zwei Siebrunden, zwei Nadelstöße und einen Kollagenaseaufschluss. Zellen, die aus 4-8 Rattennieren gewonnen werden, werden auf einer Sechs-Well-Platte plattiert, obwohl die Ausbeute mit15 relativ gering ist. Bei diesen Methoden müssen die Nieren vor der Verarbeitung in kleine Stücke zerlegt werden. Darüber hinaus dauert es bei diesen Ansätzen etwa 3-4 Wochen, bis gereinigte MCs erhalten werden.
Mäuse sind die am häufigsten eingesetzten Versuchstiermodelle in der Forschung zu Nierenerkrankungen. Eine systematische Methode zur Isolierung muriner MCs fehlt jedoch noch. In dieser Studie haben wir ein optimiertes Protokoll für die Isolierung von murinen MCs und die ex vivo Zellkultur entwickelt. Diese Methode kann bei der Verwendung primärer muriner Nieren-MCs für die experimentelle Forschung eingesetzt werden. Im Vergleich zu bisherigen Methoden entfällt bei diesem Ansatz das Schneiden und Sieben des Gewebes vor der Verdauung. Stattdessen wird die gesamte Mausniere mit einer Zellmühle zerkleinert und direkt mit Kollagenase verdaut. Die Aufschlusslösung wird dann zweimal gesiebt, wobei alle Zellen auf dem zweiten Sieb gesammelt und resuspendiert werden. Diese Methode ermöglicht es zwei Mausnieren, innerhalb von 10 Tagen genügend Zellen zu produzieren, um zwei bis drei 100-mm-Kulturschalen auszusäen. Gereinigte MCs werden anschließend durch Kultur und Reinigung mit einem speziellen Medium gewonnen, das D-Valin enthält. Diese Zellen können mehrfach passageiert, eingefroren, wiederbelebt und kultiviert werden, ohne das Zellwachstum oder die Proteinexpression zu beeinträchtigen. Die für diese Verfahren erforderliche Ausrüstung ist für grundlegende biomedizinische Laboratorien leicht verfügbar, und der gesamte Prozess dauert nur 2-3 Wochen, um die Zielzellen zu erhalten. Diese Methode eignet sich für Studien mit murinen MCs zur Untersuchung nierenbedingter Erkrankungen oder Mechanismen, da sie effizient und zeitsparend ist.
Protokoll
Die Tierversuche entsprachen den ANARRIVE-Richtlinien, und alle Tierversuche wurden in Übereinstimmung mit den nationalen Rechtsvorschriften und der Richtlinie der Europäischen Kommission (2010/63/EU) durchgeführt. Die Mäuse wurden unter pathogenfreien Bedingungen untergebracht und gehalten, in Übereinstimmung mit den Anforderungen der Animal Care and Use Committees des West China Hospital der Sichuan University. Alle experimentellen Tierversuche wurden von den Animal Care and Use Committees des West China Hospital der Sichuan University genehmigt. Acht Wochen alte männliche C57BL/6JGpt-Mäuse wurden in diesem Assay für die Isolierung von mesangialen Zellen verwendet. Die Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt. Abbildung 1 veranschaulicht die Verfahren zur Isolierung und Reinigung von glomerulären mesangialen Zellen der Maus.
1. Herstellung von Reagenzien für die Isolierung von MC aus Mäusen
HINWEIS: Stellen Sie sicher, dass alle Reagenzien und Geräte steril sind.
- Kollagenase Typ I (750 U/ml): Pulver wiegen und kurz vor der Verwendung in RPMI 1640 auflösen.
- Mesangiale Zellkulturmedien 1: Mischen Sie RPMI 1640 mit 2 mM Glutamin, 17 % FBS, Antibiotika (100 Einheiten/ml Penicillin plus 10.000 μg/ml Streptomycin) und 0,1 U/ml Insulin.
- Mesangiale Zellkulturmedien 2: Kombinieren Sie RPMI 1640 (D-Valin) mit 2 mM Glutamin, 10 % FBS, Antibiotika (100 Einheiten/ml Penicillin plus 10.000 μg/ml Streptomycin), ITS-G (Insulin, Transferrin, Selenlösung 100x) und 0,1 U/ml Insulin. Lagern Sie den mesangialen Zellkulturmedien bei 4 °C und verwenden Sie ihn innerhalb von 1 Monat nach der Zubereitung.
- Kryokonservierungsmedium für Zellen: Bereiten Sie eine Mischung aus RPMI 1640 Medium, Serum und DMSO im Verhältnis 7:2:1 vor.
2. Isolierung von murinen MCs
- Humane Tötung von Mäusen durch CO2 -Erstickung mit anschließender Gebärmutterhalsluxation (nach institutionell anerkannten Protokollen). Tauchen Sie die Schlachtkörper zur Sterilisation in ein Becherglas mit 75 % Alkohol und bringen Sie das Tier dann auf eine aseptische Arbeitsfläche.
- Entfernen Sie die Nieren der Maus aseptisch mit Schere und Pinzette, legen Sie sie in eine Petrischale, spülen Sie sie mit EBSS (Earle's Balanced Salt Solution) ab und entfernen Sie dann vorsichtig das Bindegewebe und die Nierenkapsel mit einer Pinzette.
- Halbieren Sie die Niere vertikal, fügen Sie 3-4 ml Kollagenase I-Lösung hinzu und mahlen Sie sie mit einem Kunststoffstößel.
- Pipettieren Sie alle Gewebe und die Lösung aus der Petrischale in ein 15-ml-Zentrifugenröhrchen. Spülen Sie die Petrischale mit 1-2 ml Kollagenase I-Lösung aus, um sicherzustellen, dass das gesamte Gewebe übertragen wird. Die Lösung bei 37 °C in den Schüttler geben und 30 Minuten lang bei 120 U/min schütteln. Fügen Sie dann ein gleiches Volumen Stopplösung (Nährmedium 1) hinzu.
- Pipettieren Sie die Lösung aus dem 15-ml-Zentrifugenröhrchen, leiten Sie sie durch ein 100-μm-Zellsieb und sammeln Sie das Filtrat in einem 50-ml-Zentrifugenröhrchen.
- Die Flüssigkeit aus Schritt 2.5 wird durch ein 40-μm-Zellsieb geleitet, wobei nur die Zellen auf dem 40-μm-Zellsieb verbleiben. Spülen Sie das Sieb wiederholt mit dem Nährmedium 1, um sicherzustellen, dass so viele Zellen wie möglich auf dem Sieb gesammelt werden. Übertragen Sie die gesammelten Zellen aus dem Sieb in ein neues 50-ml-Zentrifugenröhrchen.
- Zentrifugieren Sie die Suspension bei 600 x g für 5 min (bei Raumtemperatur) und resuspendieren Sie die Zellen dann in einer Zellkulturschale entsprechend der Zelldichte. Im Allgemeinen werden die Zellen von zwei Nieren in zwei oder drei 100-mm-Kulturschalen (10-ml-Kulturmedien 1/100-mm-Schale) resuspendiert. Stellen Sie die Schalen in einen 37 °C heißen Zelleninkubator mit 95 % Luft/5 % CO2.
- Untersuchen Sie die Zellmorphologie und Adhäsion am nächsten Tag unter einem Mikroskop (40×). Wenn sich schwimmende tote Zellen im Nährmedium befinden, entfernen Sie das Medium mit einer Pipette vom Boden der Kulturschale und achten Sie darauf, die anhaftenden Zellen nicht zu beschädigen.
- Geben Sie 1-2 ml PBS entlang des Innenrandes der Kulturschale, um die Zellen zu spülen. Entfernen Sie mit einer Pipette das gesamte PBS vom Boden der Kulturschale und fügen Sie schließlich 10 ml Nährmedium 1 entlang des inneren Randes der Kulturschale hinzu.
3. Aufreinigung von murinen MC
- Einen Tag nach der Trennung entfernen Sie die nicht adhärenten Zellen, indem Sie den Nährmedium vorsichtig waschen und durch frischen Nährmedium 1 ersetzen, wie in Schritt 2.8 beschrieben. Betrachten Sie die Glomeruluszellen unter einem Phasenkontrastmikroskop (40×).
HINWEIS: Die hellen kugelförmigen Formen stellen den Glomerulus dar, während die umgebenden Zellen kopfsteinpflasterartige Merkmale aufweisen, die für Epithelzellen charakteristisch sind (Abbildung 2A). - Beobachten Sie die Zellmorphologie nach 1-3 Tagen (Abbildung 2B-C). Sternförmige und spindelförmige Zellen erscheinen um die Kopfsteinpflasterzellen, wie in Abbildung 2D dargestellt.
- Wenn die Zellen eine Konfluenz von 80 % erreichen (normalerweise innerhalb von 7-10 Tagen), waschen Sie die Zellen zweimal mit sterilem PBS und trypsinisieren Sie die Zellen dann mit 0,25 % Trypsinlösung (2 ml 0,25 % Trypsinlösung pro 100 mm Schale).
- Der anfängliche Prozess der Zelltrypsinisierung kann ca. 20 Minuten dauern. Nach der Zugabe von Trypsin das Gericht in einen 37 °C heißen Inkubator stellen. Beobachten Sie den Prozess in Echtzeit unter einem Phasenkontrastmikroskop (40×), um die Trypsinisierung von Zellen zu bewerten.
- Beenden Sie den Trypsinisierungsprozess durch Zugabe eines gleichen Volumens an Medium 2, wenn die meisten Zellen eine abgerundete Morphologie aufweisen und sich von der Oberfläche der Schale lösen.
- Die Zellen werden 5 min lang bei 600 × g (bei Raumtemperatur) zentrifugiert und anschließend in Medium 2 resuspendiert. Im Allgemeinen werden die Zellen aus einer 100-mm-Schale in zwei 100-mm-Kulturschalen (10-ml-Nährmedien 2/100-mm-Schale) resuspendiert.
- Wechseln Sie den Nährmedium 2 am nächsten Tag. Betrachten Sie zahlreiche suspendierte Zellen und Zellfragmente unter dem Mikroskop (40×), da nur MCs in den Medien von D-Valin überleben und sich vermehren können16. Wechseln Sie das Medium alle 1–2 Tage, um abgestorbene Zellen zu entfernen. Die adhärenten Zellen in der Kultur sind MCs (Abbildung 3A-D). Bestimmen Sie die Wachstumsrate isolierter MCs (Abbildung 3E).
- Sobald die Zellen eine Konfluenz von 80 % erreicht haben, trypsinisieren sie und passieren sie. MCs benötigen in der Regel etwa 5-10 Minuten für die Trypsinisierung.
4. Langzeitkonservierung von murinen MCs
HINWEIS: Da sich Primärzellen mit der Zeit und mehreren Durchgängen differenzieren und mutieren können, frieren Sie MCs nach der Zellreinigung ein und lagern Sie sie zur Langzeitkonservierung.
- Entfernen Sie vorsichtig den Überstand entlang des unteren Randes der Schale mit einer Pipette, waschen Sie die Zellen zweimal mit sterilem PBS und trypsinisieren Sie dann mit 0,25%iger Trypsinlösung (2 ml 0,25%ige Trypsinlösung pro 100-mm-Schale). Befolgen Sie die Schritte zur Trypsinisierung, wie in den Schritten 3.3-3.8 beschrieben.
- Nach der Trypsinisierung wird ein gleiches Volumen des Mediums 2 hinzugefügt, um den Prozess zu beenden, und die gesamte Flüssigkeit in ein 15-ml-Zentrifugenröhrchen überführt. Zentrifugieren Sie die Zellen 5 Minuten lang bei 600 × g (bei Raumtemperatur), verwerfen Sie den Überstand und resuspendieren Sie die Zellen in 1 ml PBS, um die Zellen zu zählen.
- Verwenden Sie einen automatischen Zellzähler, um die Zellen zu zählen. Nehmen Sie 20 μl aus dem 1 ml der resuspendierten Zelllösung und geben Sie sie in eine spezielle Zellzählplatte, um die Gesamtzahl der Zellen zu bestimmen. Basierend auf der Zellzahl resuspendieren Sie sie in Zellkryokonservierungsmedien (1 ml Zellkryokonservierungsmedium pro 106 Zellen).
- Übertragen Sie die Zelllösung in Kryokonservierungsröhrchen (1 ml Kryokonservierungsmedium pro 2 ml-Kryokonservierungsröhrchen) und frieren Sie sie langsam auf -80 °C ein, bevor Sie sie zur Konservierung in flüssigen Stickstoff umfüllen.
HINWEIS: Resuspendieren und säen Sie die Zellen in Zellkulturschalen zur Amplifikation nach Bedarf. Die Zellen sollten zwischen den Passagen 3 und 8 verwendet werden, nachdem sie vollständig charakterisiert wurden17.
5. Identifizierung von murinen MC
HINWEIS: Nachdem die Zellen zweimal durchquert wurden, identifizieren Sie die murinen MCs mit den folgenden Techniken.
- Westlicher Blot von murinen MCs
HINWEIS: Die für das Verfahren benötigten Reagenzien sind in der ergänzenden Tabelle 1 aufgeführt.- Trypsinisieren Sie die Zellen mit den gleichen Schritten wie in 3.3-3.8 und Schritt 4.1.
- Nachdem Sie die Zellen gesammelt haben, lysieren Sie die Zellen, um Proteine zu extrahieren und die Proteinkonzentration zu messen.
- Entnehmen Sie eine angemessene Menge der Probe (in der Regel 20 ng), fügen Sie einen Ladepuffer hinzu und denaturieren Sie sie 5 Minuten lang bei 100 °C.
- Lösen Sie das Protein (20 ng) mit einem 10%igen SDS-PAGE-Gel oder einem 7,5%igen SDS-PAGE-Gel auf und übertragen Sie es dann bei konstanter Spannung auf eine Zellulosemembran.
- Blockieren Sie die Membran mit 5 % fettfreier Milch und inkubieren Sie dann mit dem Primärantikörper bei 4 °C auf einem Shaker über Nacht.
- Inkubieren Sie mit dem Sekundärantikörper 1 h bei Raumtemperatur, nachdem Sie dreimal mit TBST (Tris Buffered Saline with Tween 20) gewaschen haben.
- Erkennen Sie Signale mit dem Bildgebungssystem.
HINWEIS: Zu den primären Antikörpern, die in dieser Studie verwendet wurden, gehörten Maus-Anti-αSMA (1:500), Kaninchen-Anti-Vimentin (1:2000), Kaninchen-Anti-Fibronektin (1:2000) und Maus-Anti-GAPDH (1:50000). Zu den in dieser Studie verwendeten Sekundärantikörpern gehörten Peroxidase-konjugiertes Ziegen-Anti-Kaninchen-IgG (H + L) (1:5000) und Peroxidase-konjugiertes Ziegen-Anti-Maus-IgG (H + L) (1:5000).
- Immunfluoreszenzfärbung von murinen MCs
HINWEIS: Die für das Verfahren benötigten Reagenzien sind in der ergänzenden Tabelle 2 aufgeführt.- Trypsinisieren Sie die Zellen mit den gleichen Schritten wie in den Schritten 3.3-3.8 und Schritt 4.1.
- Resuspendieren Sie die Zellen und zählen Sie sie. Nehmen Sie 1 x 105 Zellen und geben Sie sie in die 15-mm-Zellkulturschale mit Glasboden (1 mL Nährmedium, 2 pro 15 mm Glasboden).
- Fixieren Sie die MCs 15 Minuten lang mit 4 % Paraformaldehyd (1 ml 4 % Paraformaldehyd pro 15 mm Glasboden) und waschen Sie sie dann dreimal mit PBS.
- Behandeln Sie die MCs 10 Minuten lang mit 0,1 % Triton X-100, um die Zellmembranen zu permeabilisieren.
- Nach drei weiteren Wäschen mit PBS die Zellen bei Raumtemperatur mit 3%iger BSA-PBS-Lösung für 30 min blockieren.
- Waschen Sie die Zellen und inkubieren Sie sie mit primären Anti-Maus-αSMA- und Anti-Kaninchen-Vimentin-Antikörpern bei 4 °C über Nacht.
- 1 Stunde lang mit sekundärem Esel-Anti-Maus-IgG, konjugiert mit rotem Alexa 594, und Esel-Anti-Kaninchen-IgG, konjugiert mit grünem FITC, bei Raumtemperatur.
- Verwenden Sie DAPI für die nukleare Gegenfärbung für 1 Minute bei Raumtemperatur.
- Fluoromount-Medien hinzufügen und mit einem Objektträger abdecken. Analysieren Sie die Zellen mit einem konfokalen Mikroskop.
HINWEIS: Zu den primären Antikörpern, die in dieser Studie verwendet wurden, gehörten Maus-Anti-αSMA (1:200) und Kaninchen-Antivimentin (1:200). Zu den in dieser Studie verwendeten Sekundärantikörpern gehörten Esel-Anti-Maus-IgG, konjugiert an rotes Alexa 594 (1:400), Esel-Anti-Kaninchen-IgG, konjugiert an grünes FITC (1:400) und DAPI (1:1000).
- Durchflusszytometrie von murinen MCs
- Trypsinisieren Sie die Zellen mit den gleichen Schritten wie in den Schritten 3.3-3.8 und Schritt 4.1.
- Resuspendieren Sie die Zellen und zählen Sie sie. Nehmen Sie 5 x 105 Zellen und waschen Sie sie einmal mit 3 mL PBS.
- Resuspendieren Sie die Zellen mit 100 μl PBS in einem Durchflussröhrchen und fügen Sie dann 1-2 μl Anti-Maus-PDGFRB-Antikörper (CD140b) hinzu.
- Inkubieren Sie die Zellen 30 Minuten lang im Dunkeln auf Eis und analysieren Sie sie dann mittels Durchflusszytometrie.
Ergebnisse
In dieser Studie wurde ein optimiertes Protokoll für die Isolierung von murinen MCs und die ex vivo Zellkultur entwickelt. Unseres Wissens gibt es keine Standardmethode zur Validierung primärer MCs ex vivo. Früheren Veröffentlichungen zufolge sind MCs durch die Expression von αSMA, Vimentin und Fibronektingekennzeichnet 3,14,15. Die Western-Blot-Analyse wurde verwendet, um die Expressionsniveaus von MCs zu bestimmen. Die in dieser Studie isolierten MCs zeigten eine signifikant hohe Expression von αSMA, Fibronektin und Vimentin (Abbildung 4A). Das vollständige Western-Blot-Bild ist in der ergänzenden Abbildung 1 zu sehen.
Basierend auf der scRNA-seq-Datenbank CellMarker dient das PDGFRB (CD140b)-Gen als Markergen für MCs18. Nach Zellselektion und Kultivierung in Medium 2 für 5 Tage wurde die Expression von PDGFRB (CD140b) durchflusszytometrisch verifiziert (Abbildung 4F).
Um die Reinheit weiter zu validieren, wurden die MCs nach Zellselektion und Kultivierung in Medium 2 für ca. 7-10 Tage durch Immunfluoreszenzfärbung verifiziert. Wie in Abbildung 4B-E gezeigt, exprimierten nach 10-tägiger Kultur in Medium 2 mehr als 95 % der Zellen sowohl αSMA als auch Vimentin. Die positiven Ergebnisse der Immunfluoreszenzfärbung (Abbildung 4B-E) sowie die Lebensfähigkeit der Zellen in D-Valin-spezifischen Medien16 deuten darauf hin, dass die oben beschriebenen Protokolle glomeruläre MCs von Mäusen erfolgreich isoliert haben. Diese Daten bestätigen die hohe Reinheit der MCs, die mit der Methode der differentiellen Adhäsion gewonnen wurden.
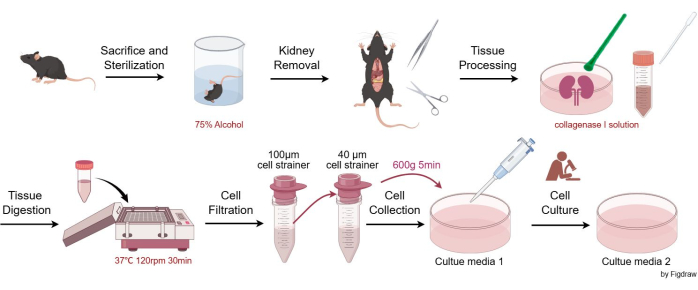
Abbildung 1: Verfahren zur Isolierung und Reinigung von murinen glomerulären Mesangialzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Erstkultur isolierter Zellen. (A) Zellen am Tag 1 nach der Isolierung, mit hellen kugelförmigen Strukturen, die Glomeruli darstellen. (B) Zellen am Tag 2 nach der Isolierung, die polygonale Zellen zeigen, die für Epithelzellen charakteristisch sind. (C) Zellen am Tag 3 nach der Isolierung, mit einer erhöhten Anzahl epithelähnlicher Zellen, die den Glomerulus umgeben. (D) Zellen am Tag 6 nach der Isolierung. Die roten Pfeile zeigen auf den Glomerulus. Rote Maßstabsbalken in der unteren rechten Ecke jedes Bildes stehen für 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Morphologie der isolierten Zellen nach der Trypsinisierung und dem Austausch des Kulturmediums 2 während der ersten Passage. (A) Zellen am Tag 1 nach der Trypsinisierung, mit sternförmigen Zellen, die an der Oberfläche haften. (B) Zellen am Tag 4 nach der Trypsinisierung. (C) Zellen am Tag 6 nach der Trypsinisierung. (D) Zellen am Tag 10 nach der Trypsinisierung, die ein spindelförmiges, mehrschichtiges Wachstumsmuster aufweisen, das für Mesangialzellen charakteristisch ist. (E) Zellen, die in unterschiedlichen Dichten in 96-Well-Platten ausgesät wurden, wobei die Absorption bei 450 nm 2 h nach der Zugabe des CCK-8-Reagenzes gemessen wurde. Rote Maßstabsbalken in der unteren rechten Ecke jedes Bildes stehen für 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Identifizierung isolierter Mesangialzellen. (A) Western-Blot-Analyse der Expression von α-SMA, Vimentin und Fibronektin in Mesangialzellen, mit GAPDH als Belastungskontrolle. (B-E) Immunfluoreszenzfärbung von isolierten Mesangialzellen für Vimentin (grün), α-SMA (rot) und DAPI (blau). (F) Durchflusszytometrische Analyse der PDGFRB (CD140b)-Expression in Mesangialzellen, die 5 Tage lang in Medium 2 kultiviert wurden. Der blaue Peak stellt die spezifische Färbung dar, während die Isotypkontrolle zum Vergleich dargestellt ist. Rote Maßstabsbalken in der oberen linken Ecke jedes Bildes stehen für 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Vollständiges Western-Blot-Bild. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 1: Reagenzien für die Western-Blot-Analyse. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 2: Reagenzien für die Immunfluoreszenzfärbung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Nierenerkrankungen sind weit verbreitet, und Mäuse werden aufgrund ihrer genetischen Ähnlichkeit mit dem Menschen und der Verfügbarkeit gut etablierter Krankheitsmodelle häufig als primäres Tiermodell für die Untersuchung dieser Erkrankungen verwendet. Mesangialzellen spielen eine entscheidende Rolle bei der Aufrechterhaltung der normalen Struktur und Funktion des Glomerulus, indem sie strukturelle Unterstützung bieten, die glomeruläre Filtration regulieren und an Immunreaktionen teilnehmen. Während verschiedene experimentelle Techniken zur Isolierung von Mesangialzellen von Menschen, Ratten und Hühnern existieren 14,15,19, wurde eine standardisierte, effiziente und reproduzierbare Methode zur Isolierung dieser Zellen aus Mausnieren noch nicht etabliert. Das Fehlen einer solchen Methode schränkt den Forschungsfortschritt ein und behindert die Fähigkeit, die Funktion der Mesangialzellen in Mausmodellen für Nierenerkrankungen zu untersuchen.
In dieser Studie wurde eine zeiteffiziente und effektive Methode für die Isolierung, Reinigung und ex vivo-Kultivierung von murinen Mesangialzellen entwickelt. Das optimierte Protokoll gewährleistet eine hohe Ausbeute an lebensfähigen Zellen und ist damit ein wertvolles Werkzeug für die Nierenforschung. Mehrere kritische Faktoren müssen während des experimentellen Prozesses sorgfältig berücksichtigt werden, um eine erfolgreiche Zellisolierung zu erreichen und eine hohe Zellviabilität aufrechtzuerhalten: (1) Aufrechterhaltung der Sterilität: Alle Zellernteschritte müssen unter einer sauberen Bank durchgeführt werden, um eine mikrobielle Kontamination zu verhindern, die die Lebensfähigkeit der Zellen beeinträchtigen und die experimentellen Ergebnisse beeinträchtigen könnte. (2) Aufschluss des Gewebes: Der Mahlstab sollte verwendet werden, um das Nierengewebe gründlich zu zerkleinern, um eine vollständige mechanische Dissoziation zu gewährleisten und die enzymatische Verdauung zu erleichtern. Eine unzureichende Vermahlung kann zu einer ineffizienten Zellfreisetzung und einer geringeren Zellausbeute führen. (3) Optimierung der Gewebeverdauung: Während des enzymatischen Verdauungsprozesses ist eine periodische Beobachtung erforderlich, um das Ausmaß des Gewebeabbaus zu beurteilen. Die mehrfache sanfte Inversion der Lösung trägt dazu bei, die enzymatische Wirkung zu verstärken und eine bessere Zelldissoziation zu fördern, während die Schädigung der Zellen minimiert wird. (4) Zellsiebung und -sammlung: In der Siebphase ist es wichtig, das Zellsieb mehrmals zu spülen, um die Anzahl der gesammelten Zellen zu maximieren. Eine unvollständige Spülung kann zu Zellverlust und verringerter Ausbeute führen, was sich auf den Gesamterfolg des Isolierungsprozesses auswirkt.
Diese Methode ist derzeit ausschließlich für die Isolierung primärer Mesangialzellen aus der Nieren von Mäusen optimiert und ihre Anwendbarkeit auf andere Tiermodelle wurde noch nicht bewertet. Obwohl mit diesem Protokoll eine erfolgreiche Isolierung erreicht wurde, können weitere Modifikationen erforderlich sein, um es für die Verwendung bei verschiedenen Spezies anzupassen. Die kultivierten primären Mesangialzellen blieben bis zur siebten Generation lebensfähig; In späteren Passagen war jedoch ein Rückgang der Wachstumsrate zu beobachten. Diese Verringerung der Proliferationskapazität kann auf die zelluläre Seneszenz oder Veränderungen in der Kulturumgebung zurückgeführt werden. Daher wird empfohlen, die Zellen in den frühen Stadien der Primärkultur für relevante Experimente zu verwenden, um eine optimale Funktionalität und experimentelle Reproduzierbarkeit zu gewährleisten.
Insgesamt bietet diese Methode einen zuverlässigen, effizienten und reproduzierbaren Ansatz für die schnelle Isolierung primärer Mesangialzellen unter Verwendung allgemein verfügbarer Laborgeräte und Reagenzien. Durch das Angebot eines unkomplizierten und zugänglichen Protokolls erleichtert diese Technik die Nierenforschung und unterstützt Studien, die die Funktion von Mesangialzellen in Krankheitsmodellen untersuchen. Für Forscher, die primäre Mesangialzellen von Mäusen benötigen, dient diese Methode als wertvolle Referenz, um hochwertige Zellkulturen für verschiedene experimentelle Anwendungen zu etablieren.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte, weder finanziell noch anderweitig.
Danksagungen
Diese Arbeit wurde durch Zuschüsse an Y.Z. von der National Natural Science Foundation of China (Nr. 82470196, Nr. 82070219 und Nr. 81870157) und dem Sichuan University Faculty Start Fund unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 µm Cell Strainer | Biosharp | BS-100-CS | |
| 100 mm Petri Dish | Sorfa | 230301 | |
| 15 mL Centrifuge Tube | Sorfa | 411000 | |
| 15 mm glass bottom cell culture dish | Sorfa | 201200 | |
| 180 kDa Plus Prestained Protein Marker | Vazyme | MP201-01 | |
| 2 mM L-glutamine | BasalMedia | S210JV | |
| 4% Paraformaldehyde | Biosharp | BL539A | |
| 40 µm Cell Strainer | Biosharp | BS-40-XBS | |
| 50 mL Centrifuge Tube | Sorfa | 41000 | |
| 60 mm Petri Dish | Sorfa | 230201 | |
| 75% Alcohol | Knowles | 64-17-5 | |
| 96 Well Cell Culture Plates, TC-treated | Servicebio | CCP-96H | |
| Antibiotics (10 μg/mL ceftriaxone plus 100 μg/mL gentamicin) | NCM | C100C5 | |
| BCA (Bicinchoninic acid) Protein Assay kit | CWBIO | CW0014S | |
| Cell Counting Kit-8 | Oriscience | CB101 | |
| Confocal Microscope | FV-3000 | Olympus | |
| DMSO | Sigma | D2650 | |
| DMSO | Sigma | D2650 | |
| Earle's Balanced Salt Solution (1x EBSS) | Beyotime | C0213 | |
| Fetal Bovine Serum (FBS) | Excell | FSP500 | |
| Fluorescence Cell Analyzer | Mira FL | Countstar | |
| Fluoromount media | Southern Biotech | 0100-01 | |
| Insulin, Transferrin, Selenium Solution 100x (ITS -G) | Gibco | 41400045 | |
| Inverted Fluorescence Microscope | Olympus | IX83 | |
| Lysis Buffer | Adilab | PP1101 | |
| One-Step PAGE Preparation Kit (10%) | Oriscience | PB102 | |
| One-Step PAGE Preparation Kit (7.5%) | Oriscience | PB101 | |
| PE anti-mouse CD140b Antibody | Biolegend | 323605 | |
| Phosphate Buffered Saline (PBS) | Servicebio | G4202 | |
| Plastic Cell Pestle | Biofil | CC-4090 | |
| Proteinase Inhibitor Cocktail | Roche | 4693159001 | |
| PVDF Membrane | Vazyme | E802-01 | |
| Recombinant Human Insulin | Solarbio | 11061-68-0 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Corning | 10-040-CV | |
| SDS-PAGE Sample Loading Buffer (5x) | Servicebio | G2013 | |
| Specially customized Roswell Park Memorial Institute (RPMI) 1640 Medium (D-valine instead of L-valine) | Procell | WH3923U222 | |
| TBS (Tris Buffered Saline) | Servicebio | G0001-2L | |
| Triton X-100 | Biosharp | BS084 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Tween 20 | Biosharp | BS100 | |
| Type I collagenase | Solarbio | CB140 |
Referenzen
- Pollak, M. R., Quaggin, S. E., Hoenig, M. P., Dworkin, L. D. The glomerulus: The sphere of influence. Clin J Am Soc Nephrol. 9 (8), 1461-1469 (2014).
- Mené, P., Simonson, M. S., Dunn, M. J. Physiology of the mesangial cell. Physiol Rev. 69 (4), 1347-1424 (1989).
- Avraham, S., Korin, B., Chung, J. J., Oxburgh, L., Shaw, A. S. The mesangial cell - the glomerular stromal cell. Nat Rev Nephrol. 17 (12), 855-864 (2021).
- Chadban, S. J., Atkins, R. C. Glomerulonephritis. Lancet. 365 (9473), 1797-1806 (2005).
- Qian, Y., Feldman, E., Pennathur, S., Kretzler, M., Brosius, F. C. From fibrosis to sclerosis: Mechanisms of glomerulosclerosis in diabetic nephropathy. Diabetes. 57 (6), 1439-1445 (2008).
- Zhu, Y., et al. Iga Gut microbiome regulates the production of hypoglycosilated iga1 via the tlr4 signaling pathway. Nephrol Dial Transplant. 39 (10), 1624-1641 (2024).
- Kong, L. -. L., et al. Advances in murine models of diabetic nephropathy. J Diabetes Res. 2013, 797548 (2013).
- Schiffer, M., et al. Inhibitory smads and tgf-beta signaling in glomerular cells. J Am Soc Nephrol. 13 (11), 2657-2666 (2002).
- Gyarmati, G., et al. Sparsentan improves glomerular hemodynamics, cell functions, and tissue repair in a mouse model of FSGS. JCI Insight. 9 (19), e177775 (2024).
- Chafin, C. B., Regna, N. L., Hammond, S. E., Reilly, C. M. Cellular and urinary microRNA alterations in NZB/W mice with hydroxychloroquine or prednisone treatment. Int Immunopharmacol. 17 (3), 894-906 (2013).
- Lucero, C. M., et al. Tnf-α plus il-1β induces opposite regulation of cx43 hemichannels and gap junctions in mesangial cells through a rhoa/rock-dependent pathway. Int J Mol Sci. 23 (17), (2022).
- Schnaper, H. W., Hayashida, T., Hubchak, S. C., Poncelet, A. C. Tgf-beta signal transduction and mesangial cell fibrogenesis. Am J Physiol Renal Physiol. 284 (2), F243-F252 (2003).
- Mackay, K., et al. Glomerular epithelial, mesangial, and endothelial cell lines from transgenic mice. Kidney Int. 33 (3), 677-684 (1988).
- Wilson, H. M., Stewart, K. N. Glomerular epithelial and mesangial cell culture and characterization. Methods Mol Med. 107, 269-282 (2005).
- Menè, P., Stoppacciaro, A. Isolation and propagation of glomerular mesangial cells. Methods Mol Biol. 466, 3-17 (2009).
- Gilbert, S. F., Migeon, B. R. D-valine as a selective agent for normal human and rodent epithelial cells in culture. Cell. 5 (1), 11-17 (1975).
- Kreisberg, J. I., Venkatachalam, M., Troyer, D. Contractile properties of cultured glomerular mesangial cells. Am J Physiol. 249 (4 Pt 2), F457-F463 (1985).
- Adam, M., Potter, A. S., Potter, S. S. Psychrophilic proteases dramatically reduce single-cell rna-seq artifacts: A molecular atlas of kidney development. Development. 144 (19), 3625-3632 (2017).
- Sadovnic, M. J., Brand-Elnaggar, J., Bolton, W. K. Isolation and characterization of chicken mesangial cells. Nephron. 58 (1), 75-84 (1991).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten