Method Article
Domuzlarda anestezi sırasında tekrarlanan kortikal kayıtlar için kronik kraniyal pencere tekniği
Bu Makalede
Özet
Bu çalışma, bir domuz modelinde tekrarlanan kronik kortikal kayıtlar için ölçeklenebilir, güvenilir ve tekrarlanabilir bir yöntem sunmaktadır. Yöntemin, ağrı araştırmaları ve nörolojik hastalık teşhisi dahil olmak üzere sinirbilimin çeşitli alanlarında uygulamaları vardır.
Özet
Kortikal kayıtlar, beyin-bilgisayar arayüzleri ve hastalık teşhisi dahil olmak üzere çeşitli uygulamaları bilgilendirmek için nöronal sinyalleri çıkarmak için gereklidir. Her uygulama, kayıt tekniğine özel gereksinimler getirir ve uzun süreli kayıtlar için genellikle invaziv çözümler seçilir. Bununla birlikte, invaziv kayıt yöntemleri, uzun vadeli sinyal kalitesini tehlikeye atan cihaz arızası ve olumsuz doku tepkileri nedeniyle zorlanmaktadır.
Cihaz arızası ve doku reaksiyonları ile ilgili riskleri en aza indirirken kronik kortikal kayıtların güvenilirliğini ve kalitesini artırmak için bir kraniyal pencere tekniği geliştirdik. Bu protokolde, juvenil landrace domuzlarında bir kraniyal pencereye implante etme ve erişme yöntemlerini rapor ediyoruz, bu da dura mater üzerinde geçici elektrokortikografi (ECoG) dizisi yerleştirmeyi kolaylaştırır. Kraniyal pencere tekniği kullanılarak kortikal sinyallerin nasıl kaydedilebileceğini daha ayrıntılı olarak açıklıyoruz. Kranial pencere erişimi birkaç kez tekrarlanabilir, ancak iyileşmeyi ve doku iyileşmesini kolaylaştırmak için implant ve giriş ameliyatları arasında en az 2 hafta tavsiye edilir.
Kraniyal pencere yaklaşımı, yaygın elektrot arıza modlarını ve doku yanıtlarını başarılı bir şekilde en aza indirerek zaman içinde stabil ve güvenilir kortikal kayıtlarla sonuçlandı. Örnek olarak primer somatosensoriyel korteksten olayla ilgili potansiyelleri (ERP'ler) kaydettik. Yöntem, bir müdahalenin (yüksek frekanslı stimülasyon) ERP'ler üzerindeki etkisinin değerlendirilmesine de izin veren son derece güvenilir kayıtlar sağladı. Önemli cihaz arızalarının olmaması ve kullanılan elektrot sayısının azalması (iki elektrot, 43 kayıt seansı, 16 hayvan) gelişmiş bir araştırma ekonomisine işaret etmektedir. Elektrot yerleştirilmesi için küçük cerrahi erişim gerekli olsa da, yöntem enfeksiyon riskinin azalması ve hayvan refahının iyileştirilmesi gibi avantajlar sunar.
Bu çalışma, ağrı araştırmaları ve nörolojik hastalık teşhisi de dahil olmak üzere sinirbilimin çeşitli alanlarında potansiyel uygulamaları olan kronik kortikal kayıtlar için ölçeklenebilir, güvenilir ve tekrarlanabilir bir yöntem sunmaktadır. Gelecekteki adaptasyonlar, kullanımını diğer türlere ve intrakortikal kayıtlar ve görüntüleme teknikleri gibi kayıt modalitelerine genişletebilir.
Giriş
Genel olarak, kortikal kayıtların amacı, beyindeki nöronal sinyallerden bilgi çıkarmaktır. Bu bilgiler, harici bir cihazı kontrol etme, iletişim, hastalık teşhisi veya rehabilitasyon gibi çeşitli şekillerde kullanılabilir 1,2,3,4. Her uygulama, gereken bilgi içeriği ve uzamsal çözünürlük ve kabul edilebilir olarak kabul edilen istilacılık miktarı konusunda benzersiz gereksinimler getirir. Bu nedenle, 1929'da elektroensefalogramın keşfinden bu yana bir dizi invazivlik ve uzamsal çözünürlüğe sahip kayıt çözümleri geliştirilmiştir5.
Genel olarak, bunlar elektroensefalografi (EEG), elektrokortikografi (ECoG) ve intrakortikal kayıtlara ayrılabilir. EEG, tüm beyinden nöral salınımları ve olayla ilgili potansiyelleri (ERP'ler) yakalayan, invaziv olmayan bir kayıt yöntemidir. Bununla birlikte, bu aktivitenin kaynaklarını tanımlama yeteneği, düşük uzamsal çözünürlüğü nedeniyle sınırlıdır. ECoG, elektrotların epi veya subdural olarak yerleştirildiği ve tipik olarak korteksin daha küçük bir bölümünü kaplayan daha invaziv bir yöntemdir. Daha yüksek bir uzamsal çözünürlüğe sahiptir ve ERP ve yüzey yerel alan potansiyellerini (LFP) kaydedebilir. Bu nedenle, beyin aktivitesinin kaynağını daha kesin bir şekilde lokalize edebilir, bu da örneğin fokal epilepsinin kökenini belirlemede yardımcı olur. İntrakortikal kayıt, en invaziv kayıt yöntemidir ve beynin yüzeysel veya derinliklerinde bulunan bireysel nöronlardan ve elektrotların etrafındaki nöronların hacminden LFP'den ani yükselme aktivitesini kaydedebilir. Bu sinyaller çok yüksek bir uzamsal çözünürlüğe ve bilgi içeriğine sahiptir, ancak sınırlı bir nöron alt kümesi tarafından üretilir (kanal başına 1-10 nöron)6.
Beyinden uzun süreler (aylar-yıllar) boyunca bilgi elde etmek için, elde edilen sinyallerin tüm süre boyunca aynı bilgiyi temsil etmeye devam etmesi için arayüzün kararlı ve güvenilir olması gerekir. EEG kayıtları sık elektrot değişiklikleri gerektirir ve güvenilirliklerini çok düşükten çok yükseğedeğiştirir 7,8,9,10. Bu nedenle, ECoG ve intrakortikal yöntemler genellikle uzun süreli kayıtlar için seçilir. Bununla birlikte, bu yöntemlerin her ikisi de kayıt elektrodunun durumunun yanı sıra dokunun da zaman içinde stabil kalmasını gerektirir. Elektrot genellikle aynı yerde kalırken, elektrot-doku arayüzü, doku reaksiyonları veya elektrot arıza modları 11,12,13,14 nedeniyle değişebilir. Doku reaksiyonları arasında nöronal ölüm, kanama, biyolojik kirlenme, yabancı cisim reaksiyonu, gliosis, kapsülleme, enfeksiyon, menenjit ve meningeal ekstrüzyon bulunur15. Bu reaksiyonlar, elektrotların12,13 kayıt yeteneklerini tehlikeye atar. Yaygın elektrot arıza modları, yalıtılmış parçalarda delaminasyon veya sızıntı, elektrot yüzey kaplamasında delaminasyon veya çatlama, tel hasarı ve elektrot çıkığıdır 11,12.
Elektrot arıza modlarının üstesinden gelmek için, nöronal ölüm, yabancı cisim reaksiyonu, glioz, kapsülleme ve meningeal ekstrüzyon gibi doku tepkileriyle ilgili birçok zorluğu da ele alan geçici bir elektrot yerleştirme çözümünün uygulanabilirliğini düşündük. Ayrıca, güvenilir ve tekrarlanabilir nöronal kayıtlar elde etmek için tutarlı elektrot yerleşimi bir gereklilikti. Elektrot epidural olarak sinir dokusuna birkaç milimetre uzaklıkta yerleştirildiği için elektrotun hareketi 1 mm'yi geçmemelidir. Kraniyal pencere, elektrot yerleşimleri arasında aşırı hareketi önleyecek boyutlarda tasarlanmıştır. Kraniyal pencere tekniğinin geliştirilmesi ile uzun vadeli sinyal güvenilirliğini ve kalitesini iyileştirmeyi ve elektrot arızası riskini ortadan kaldırmayı hedefliyoruz.
Protokol
Bu protokol, Danimarka Gıda, Tarım ve Balıkçılık Bakanlığı'na bağlı Danimarka Veterinerlik ve Gıda İdaresi tarafından onaylanmıştır (protokol numarası 2020-15-0201-00514). Toplam 16 dişi kara domuzu prosedürlere tabi tutulmuştur. Hayvanlar tesise vardıklarında yaklaşık 20 kg ağırlığındaydı, yani yaklaşık 2 aylıktılar. İmplantasyon sırasında yaklaşık 30 kg ve çalışmanın sonunda 40-60 kg ağırlığındaydılar. Prosedürler implantasyon cerrahisi, giriş cerrahisi ve terminal cerrahiden oluşur (Şekil 1).

Şekil 1: Deneysel prosedürlerin zaman çizelgesi. Giriş ameliyatı (Faz II) birkaç kez tekrarlanabilir. İyileşme için ameliyatlar arasında en az 2 hafta ve ameliyatlar arasında yara iyileşmesi için en az 2 haftalık bir mesafe önerilir. Kısaltma: ERP = olayla ilgili potansiyel. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. İmplantasyon cerrahisi (Faz I)
NOT: Domuzun birincil somatosensoriyel korteksinden tekrarlanan kayıtları kolaylaştırmak için 3D baskılı bir polilaktik asit (PLA) kraniyal penceresi (Şekil 2) implante edilmiştir. Ulnar sinirin elektriksel stimülasyonuna bağlı ERP'ler kaydedilir. Ameliyat ve yara kapatma, kafatası penceresine erişilebilecek ve daha sonra kapatılabilecek şekilde yapılır.
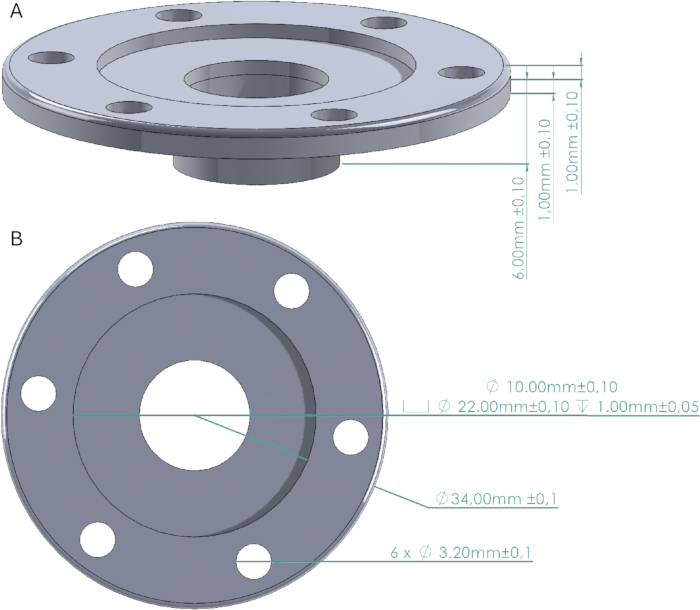
Şekil 2: Kafatası pencere tasarımı. (A) Duvarların yüksekliğini ve kafatasına tutturulmuş tabanı gösteren kafatası penceresinin yandan görünümü. (B) Kraniyal dulun çapını, vida deliklerini, kapak boşluğunu ve pencereyi gösteren üstten görünüm. Kraniyal pencere kapağı, kapak boşluğuna tam olarak uyan 1 mm yüksekliğe sahip 22 mm çapında bir silindirdir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Kraniyal pencere implantasyonu
- Ameliyat için hazırlık
NOT: Ameliyat başlamadan önce veri işlemcisi (RZ2), iş istasyonu (WS8) ve PC açılır. Ameliyat notları, hayati belirtileri (kalp atış hızı, spO2, gelgit sonu CO2, çekirdek sıcaklığı), anestezi seviyelerini (propofol infüzyon hızı, fentanil infüzyon hızı, sevofluran yüzdesi), ameliyatın aşamasını ve herhangi bir düzensizliği belgelemek için steril olmayan bir araştırmacı tarafından en az 15 dakikada bir elektronik tabloya alınır.- 5-7 mL Zoletil karışımının kas içi enjeksiyonunu kullanarak hayvanı sakinleştirin (1 mL, 8.3 mg Tiletamin, 8.3 mg Zolazepam, 8.3 mg Xylasin ve 1.7 mg Butofanol içerir).
NOT: Bu özel çalışma için, NMDA reseptörlerini bloke etmekten kaçınmak için Zoletil karışımından ketamin çıkarılmıştır. - Hayvanı ameliyathaneye nakledin. Hayvanı entübe edin ve mekanik bir vantilatöre bağlayın.
- Propofol, fentanil ve salin uygulamak için bir kulak damarı kateteri yerleştirin.
- Cerrahi anestezi uygulayın: Sevofluran% 1-2, propofol (8 mg - kg-1 - 1 h-1'de infüze edilmiş 10 mg / mL), fentanil (20 μg - kg-1 - 1 'de infüze edilmiş 50 μg / mL).
- Steril örtülemeden önce steril bir işaretleyici kullanarak insizyon bölgesini işaretleyin. Her kulak ile karşı göz arasında düz çizgiler çizerek bregma noktasını tanımlayın; bregma noktası bu çizgilerin kesiştiği noktadadır (Şekil 3A). Kesinin, uyarılan ön ayağa karşı tarafta, orta hatta hafifçe lateral olduğundan emin olun.
- Metal plakayı perdelerin altına yerleştirin ve ameliyata başlamadan önce uygun yerleştirme ve stabiliteyi sağlayın.
- 5-7 mL Zoletil karışımının kas içi enjeksiyonunu kullanarak hayvanı sakinleştirin (1 mL, 8.3 mg Tiletamin, 8.3 mg Zolazepam, 8.3 mg Xylasin ve 1.7 mg Butofanol içerir).
- Kafatasına erişim
NOT: Protokolün bu ve bundan sonraki bölümlerinde, aksi belirtilmedikçe tüm işlemler steril bir cerrah tarafından gerçekleştirilir.- Dermisteki ilk kesiyi, adım 1.1.1.5'te belirtildiği gibi, orta hattın hafifçe yanında bir neşter ile yapın. Bir koterizatör ile deriden insizyona devam edin.
NOT: Domuzun büyük frontal sinüslerinden kaçınmak için kesiği çok öne uzatmayın. Daha fazla alana ihtiyaç duyulursa, kesiyi arka tarafa uzatın. - Ekartörü yerleştirin ve forseps kullanarak cildi tutun ve cilde daha fazla esneklik sağlamak ve adım 1.4'te dikiş atmayı kolaylaştırmak için periost ile subkutis arasındaki avasküler bağ dokusunu kesin (Şekil 3B). Ekartörü kazanılan esnekliğe göre ayarlayın.
- Periosteumu kesin ve bir periost asansörü kullanarak kafatasından gevşetin. Ekartörü kullanarak periosteuumu bir kenara tutun.
- Dermisteki ilk kesiyi, adım 1.1.1.5'te belirtildiği gibi, orta hattın hafifçe yanında bir neşter ile yapın. Bir koterizatör ile deriden insizyona devam edin.
- Dura'ya erişim
- Sagital sütür çizgisinin önünde ve orta hat sütürünün yanında 10 mm çapında bir delik açın (Şekil 3C). Dura seviyesinde 10 mm çapında bir delik elde etmek için 15 mm çapında bir çaptan başlayın, çünkü yuvarlatılmış matkap ucu hafifçe konik bir deliğe neden olacaktır.
- İyi bir uyum sağlamak için kafatası penceresini deliğe erkenden yerleştirin.
- Dura seviyesinde deliğin maksimum genişliğini elde etmek için dura görünür hale geldiğinde daha küçük bir matkap ucuna geçin. Rongeurs kullanarak kenarları kırpın.
- Kraniyal pencere implantasyonu
- Kraniyal pencerenin deliğin içine ve dibine kadar oturduğunu onaylayın ve derinliğine karar verin. Bu hayvana bağlı olmasına rağmen, kafatası penceresinin duvarlarının iyi bir uyum için duraya ulaştığından emin olun, ancak beyne herhangi bir yerde baskı uygulamayın.
- Kraniyal pencereyi yerinde tutarken el matkabını kullanarak vida deliklerini işaretleyin.
- Kraniyal pencereyi çıkarın ve delikleri en az 4 mm derinliğinde delin. Kortikal kayıtlar için toprak/referans olarak kullanmak üzere vidalardan biri için kafatasına nüfuz edin.
- Kraniyal pencereyi yerleştirin (Şekil 3) ve iğneyi kelebek infüzyon setinden çıkarın. Künt kelebeği kullanarak kafatası penceresinden geçen vida deliklerinin derinliğini ölçün. Deliğe uygun uzunlukta bir vida yerleştirin ve sabitleyin.
NOT: Çok uzun bir vida, kraniyal pencere kapağını etkili bir şekilde sabitleyemez. - Kafatasını delen ve duraya dokunan bir vidanın altına bir U-konektörü yerleştirin.
NOT: Bu vidanın uzunluğunun kafatasının kalınlığından daha büyük olması önemlidir, böylece yeniden büyüyen kemik dura ile teması engellemez.
- Ameliyat için hazırlık
- Periferik tel implantasyonu
NOT: Bu prosedür kraniyal pencere implantasyonu ile eş zamanlı olarak yapılabilir. Bu steril bir işlemdir. Cerrahi bölgenin veya kraniyal bölgenin kontaminasyonunu önlemek için steril kıyafetler giyilmelidir.- Ulnar sinirin yakınına tel implantasyonu
- Ön ayağın arka distal kısmındaki cilde iki iğne (nüfuz etmeyen) veya 2 cm ile ayrılmış başka bir steril metal parçası ile dokunarak cilde 5 mA'da elektrik stimülasyonu uygulayın. Sinirin bu iki nokta arasında ilerlediğini gösteren net bir toynak fleksiyonu arayın.
NOT: Arka kısma erişimin daha kolay olması için uzvun geriye doğru döndürülmesi gerekebilir. - İki iğneyi sinirin seyrine dik olarak yaklaşık 2 cm aralıklarla yerleştirin. Cildi yerleştirme noktasından yaklaşık 3 cm uzakta tekrar delin (Şekil 4A).
- İğnelere 2 mA'da uygulanan bir test uyaranı kullanarak konumu doğrulayın; Tırnağın net bir hareketinin görünür olduğundan emin olun.
- Cooner tellerini iğnelerin içinden geçirin ve iğneleri çıkarın, Cooner tellerini kısmen derinin altında bırakın. Telin ortasındaki yalıtımsız parçanın her iki tel için de deri altında olduğundan emin olun (Şekil 4B).
NOT: Uzuv geriye doğru döndürüldüyse, dikkatlice ileri doğru döndürün. - Her bir timsah konektörünü iki Cooner kablosunun izole edilmemiş bir ucuna takın.
- Ön ayağın arka distal kısmındaki cilde iki iğne (nüfuz etmeyen) veya 2 cm ile ayrılmış başka bir steril metal parçası ile dokunarak cilde 5 mA'da elektrik stimülasyonu uygulayın. Sinirin bu iki nokta arasında ilerlediğini gösteren net bir toynak fleksiyonu arayın.
- Motor eşiğinin oluşturulması
- Yukarı-aşağı yöntemini kullanarak motor eşiğini bulun16,17; 100 μA'dan başlayın, 50 μA'lık adımlarla artarken, tırnak bölgesinde bir motor tepkiyi izlerken ve hissedin. 1 mA'nın altında bir eşik tipik olarak mümkündür.
- STG'yi, motor eşiğin 2 katında 200 μs darbe genişliğine sahip 100 dikdörtgen bifazik simetrik uyaran ve ardından motor eşiğin 10 katında 100 uyaran sağlayacak şekilde programlayın.
- Ulnar sinirin yakınına tel implantasyonu
- Kortikal sinyallerin kaydedilmesi
- Steril olmayan bir araştırmacının önamplifikatörü yerine getirmesini ve fiber optik kablolar kullanarak veri işlemcisine (RZ2) bağlamasını sağlayın.
- Sevofluranı% 0.5-1'e (cerrahi seviyesinin yarısı) düşürün ve yeterli ve stabil anestezi derinliğini sağlamak için kalp atış hızını, süresi dolmuş CO2'yi ve kan basıncını (varsa) izleyin. Gerektiği gibi hem propofol hem de fentanili artırın.
- Steril olmayan bir araştırmacının headstage'i ön'e takmasını sağlayınampkaldırıcı (SI8) ve (ZIF-klips) headstage'i manyetik stand mikromanipülatörüne monte edilmiş olan headstage tutucusuna yerleştirin.
- Steril örtüyü mikromanipülatörün etrafına yerleştirin ve yapışkan parçayı başlığa takın.tage ve headstage tutucusu (Şekil 5A).
- Steril olmayan bir araştırmacının manyetik standı kullanarak mikromanipülatörü sabitlemesini, μECoG elektrodunu alkole batırmasını ve (ZIF-klipsi) başlığına yerleştirmesini sağlayın.tage.
NOT: Elektrodu dura üzerine yerleştirmeden önce kurumasını bekleyin. μECoG elektrodu steril olmadığı için yalnızca başlığı kaplayan steril örtüye dokunduğunuzdan emin olun. - Mikromanipülatörü kullanarak μECoG'yi yerine getirin ve bir pamuklu çubukla yönlendirin. μECoG'nin topraklama kablolarını bir timsah konektörü ile topraklama vidasına bağlayın.
- Yeterli ve stabil anestezi derinliğini sağlamak için sevofluranı% 0'a düşürün, kalp atış hızını, süresi dolmuş CO2'yi ve kan basıncını (varsa) izleyin, gerektiğinde hem propofol hem de fentanili artırın.
- Synapse'deki sinyalleri önizleyin; tipik sinyal aralığı ±100 μV'a kadardır.
- Sinyal kalın bir çizgi gibi görünüyorsa (hat gürültüsünün göstergesi), steril bir kişinin aşağıdaki işlemleri gerçekleştirmesini sağlayın: topraklama devresini inceleyin ve topraklama vidasını ve bağlantılarını kuru ve yakındaki dokulardan izole edin. Diğer kabloların domuz gövdesinden ve cerrahi aletlerden izole edilip edilmediğini araştırın. Değilse, kabloları vücuttan veya cerrahi aletlerden izole etmek için steril gazlı bez kullanın.
- Sinyalin genliği ±100 μV'den büyükse (hareket artefaktlarının göstergesi), elektrotun askıya alındığından ve beyne dayandığından ve ulnar sinirin ventilasyonu veya elektriksel stimülasyonu nedeniyle domuz hareket ettiğinde kabloların hareket etmediğinden emin olun.
- Sinyal genliği ± 20 mV'den küçükse (zayıf temas veya derin anestezinin göstergesi), μECoG'nin beyne dayandığından ve dura ile elektrotun hidratlandığından emin olun; Gerekirse, elektrotun üzerine biraz tuzlu su damlatın. Sevofluranın kapatıldığından emin olun ve propofol (ve muhtemelen fentanil) infüzyon hızını azaltın. Bir test stimülasyonu gerçekleştirin ve uyarılmış yanıtların görünür olup olmadığını kontrol edin. Çevresel telin yalıtılmamış kısmının tamamen derinin altında olduğundan emin olun.
NOT: Uyarılmış tepkiler tipik olarak çevrimiçi tek taramalarda ayırt edilebilir, ancak bunu ortalama 5-10 uyaran alarak çevrimdışı olarak değerlendirmek de mümkündür. Tetikleme anında bir tepe noktası görünüyorsa, bu bir stimülasyon artefaktıdır. Stimülasyon artefaktı veri analizine müdahale edecektir.
- İyi doku temasını sağlamak için elektrot üzerine steril gazlı bez yerleştirin. Dokunun kurumasını önlemek için gazlı bez üzerine vücut sıcaklığında tuzlu su damlatın.
NOT: Bu kayıtlar epidural olduğundan, kesin sıcaklık önemli değildir. Subdural kayıtlarda bu daha kritiktir. - Elektrotun oturmasına izin verin (30 dakika) ve benzer sonraki kayıtları sağlamak için elektrot yerleşimini ve topraklama konektörü kurulumunu belgeleyin (Şekil 5B-D). Kayda başlayın ve her 10 dakikada bir stimülasyon programına başlamadan önce 30 saniye bekleyin.
NOT: Kayıtlar arasında elektrot üzerindeki gazlı bezin nemli kaldığını düzenli olarak kontrol edin ve gerekirse vücut sıcaklığında tuzlu su damlatın. - Üç tur stimülasyondan sonra bir müdahale gerçekleştirin (müdahale öncesi temel olarak hizmet etmek için). Dokuz tur daha stimülasyonu tekrarlayın.
NOT: Elektrot üzerindeki gazlı bezin sulu kaldığını ve gerekirse tuzlu su damlattığını kayıtlar arasında düzenli olarak kontrol etmeye devam edin.
- İmplant bölgesinin kapatılması
- Gazlı bezi elektrottan çıkarın ve bir pamuklu çubukla nazikçe yönlendirirken mikromanipülatörü kullanarak elektrodu çıkarın.
- Steril olmayan bir araştırmacının mikromanipülatörü, elektrodu, başlığı ve önampyükselticiyi çıkarıp saklamasını sağlayın ve doku kalıntısını gidermek için deiyonize su ile hızlı bir durulama kullanarak elektrodu üreticinin talimatlarına göre temizleyin. Elektrot yüzeyindeki doku ve proteinleri çıkarmak için elektrodu lens temizleyicide 4 saate kadar bekletin, ardından lens temizleyiciyi elektrot yüzeyinden çıkarmak için deiyonize su ile ikinci bir durulama uygulayın. Saklamadan önce elektrodu izopropil alkole batırın.
- Kraniyal pencereyi kapatmak için kraniyal pencere kapağını yerleştirin ve kafatası penceresine tam olarak oturduğundan emin olun. Ek sabitleme gerektirmez; Deriden implant üzerine yapılan basınç, onu yerinde tutacaktır.
- Antibiyotik poşunu kraniyal pencere kapağının üstüne yerleştirin ve gömülü dikey yatak sütür tekniğini kullanarak cildi tek emilebilir sütürlerle cilt altından kapatın (Şekil 6A). Dikişleri 5-10 mm aralıklarla yerleştirin, bu da kutanöz dikişlerin yerleştirilmesi için alan sağlar. Son üç dikişi yerleştirdikten sonra bağlamayınız. Bunun yerine, tüm dikişler yerleştirildiğinde bu üç dikişi bağlayın.
NOT: Üçünü de yerleştirdikten sonra son üç dikişi bağlamak, son dikişleri yerleştirmek için yeterli alan olmasını sağlar. - Sürekli intradermal dikişleri cilde sürekli bir şekilde yerleştirin. İntradermal sütürü insizyon bölgesinden 1-2 cm lateralde başlatın ve sütürlerin aşırı çizilmesini ve gevşemesini önlemek için cilt altından cildin dermal tabakasına ancak yüzeyinin altına tünel açın (Şekil 6B). Dikişin yan ucuna bir düğüm atın.
NOT: Propofol ve fentanil, birkaç dakikalık uyanma süresine sahip oldukları için bu prosedür sırasında kapatılabilir. - Sürekli sütürü, insizyonun diğer tarafına ulaşılana kadar deri altı dikişler arasına yerleştirin.
NOT: Sütürün dermisten çıkması ancak cildi delmemesi önemlidir, böylece hayvan dikişleri daha az kaşıyabilir. - Sütürü insizyona 1-2 cm lateral bir şekilde lateral bir çıkış bölgesine tünelleyin ve bir düğüm atın (Şekil 6B). Kesi bölgesine doku yapıştırıcısı sürün.
- Hayvan eve dönüş kalemi
- Steril örtüleri hayvandan çıkarın ve hareket gözlemlenir gözlemlenmez hayvanı ventilatörden ayırın.
- Hayvanı evdeki ağıla aktarın ve bir gece boyunca kalem arkadaşından ayrı tutun.
NOT: Domuzlar ameliyattan sonra ayrılır, çünkü kalem arkadaşını şiddetli bir şekilde uyandırmaya çalışmaları normaldir ve bu da ısırık yaralarına neden olur. Domuzlar burun teması kurabilmelidir.

Şekil 3: Kraniyal pencerenin implantasyonu. (A) Bregma noktasının beklenen konumu, steril örtülemeden önce domuz üzerinde tanımlanır ve işaretlenir, çünkü bunun daha sonra ayırt edilmesi zor olabilir. (B) Cilt kesisinden sonra avasküler subkutis makas kullanılarak gevşetilir. (C) Kafatasında 15 mm çapında bir delik açılır ve kenarlar rongeurlar kullanılarak çıkarılır. Koronal ve sagital sütür çizgileri belirgindir. (D) Kraniyal pencere vidalar kullanılarak implante edilir ve sabitlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Periferik tellerin implantasyonu. (A) Deriye iki adet 23 G iğne yerleştirilir ve bunların içinden Cooner telleri sokulur. (B) İğneler çıkarılır ve teller timsülatör klipsleri kullanılarak stimülatöre bağlı deride bırakılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Kortikal kayıt kurulumu. (A) Elektrot dizisi dura üzerine yerleştirilir ve baş aşaması tutucusu ve mikromanipülatör, insizyonun daha uzun ve daha lateral olduğu bir implantasyon ameliyatı sırasında steril bir manşon içindedir. (B) İnsizyonun daha medial olduğu bir erişim ameliyatı sırasında kayıt kurulumunda μECoG'nin yakın çekimi. (C) ECoG üzerindeki tüm topraklama ve referans kablolarının kısa devre yaptığı ve U-konektörü aracılığıyla peri-kraniyal vidaya bağlandığı topraklama kurulumu. (D) Bir erişim ameliyatı sırasında baş sahnesinin ve baş sahne tutucusunun yakın çekimi. μECoG, dura üzerine yerleştirilir. Kısaltmalar: ECoG = elektrokortikografi; μECoG = mikroECoG. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Dikiş tekniği. (A) Deri altı gömülü dikey yatak tekniğinin şeması. (B) Sürekli intradermal sütür tekniğinin şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Giriş cerrahisi (Faz II)
NOT: 2-4 hafta sonra, S1'den gelen kortikal sinyallerin takip kayıtlarını yapmak için kraniyal pencere açılır. Ameliyat ve yaranın kapatılması yine kafatası penceresine ulaşılabilecek ve tekrar kapatılabilecek şekilde yapılır.
- Ameliyat için hazırlık
NOT: 2.1.1-2.1.6 adımları, 1.1.1.1-1.1.1.6 adımlarına benzer.- Hayvanı bir zoletil karışımı (5 mL zoletil [tiletamin 25 mg / mL ve zolazepam 25 mg / mL], 6.25 mL ksilazin (20 mg / mL) ve 2.5 mL butorphanol (10 mg / mL)) kullanarak sakinleştirin.
NOT: Bu özel çalışma için, NMDA reseptörlerinin bloke edilmesini önlemek için zoletil karışımından ketamin çıkarılmıştır. - Hayvanı ameliyathaneye taşıyın ve entübe edin ve havalandırın.
- Bir kulak damarı kateteri yerleştirin. Kateter yoluyla propofol, fentanil ve salin uygulayın.
- Cerrahi anestezi uygulayın: Sevofluran% 1-2, propofol (8 mg - kg-1 - 1 h-1'de infüze edilmiş 10 mg / mL), fentanil (20 μg - kg-1 - 1 'de infüze edilmiş 50 μg / mL).
- Gerekirse, steril örtülemeden önce steril bir işaretleyici kullanarak insizyon bölgesini işaretleyin. Her kulak ile karşı göz arasında düz çizgiler çizerek bregma noktasını tanımlayın; bregma bu çizgilerin kesişim noktasındadır (Şekil 3A).
NOT: İlk kesi tipik olarak hala görülebilir. Yeni kesi, skar dokusunun çoğundan kaçınmak ve yaranın kapanmasını kolaylaştırmak için ilk kesiden en az 30 mm uzağa yerleştirilmelidir. - Metal plakayı perdelerin altına yerleştirin ve ameliyata başlamadan önce uygun yerleştirme ve stabiliteyi sağlayın.
- Hayvanı bir zoletil karışımı (5 mL zoletil [tiletamin 25 mg / mL ve zolazepam 25 mg / mL], 6.25 mL ksilazin (20 mg / mL) ve 2.5 mL butorphanol (10 mg / mL)) kullanarak sakinleştirin.
- Kraniyal pencereye erişim
NOT: 2.2.1-2.2.3 adımları, 1.1.2.1-1.1.2.3 adımlarına benzer.- Dermisteki ilk kesiyi, adım 2.1.5'te belirtildiği gibi orta hatta hafifçe lateral bir neşter ile yapın. Bir koterizatör ile deriden insizyona devam edin.
NOT: Bir terminal deneyi durumunda, kesi orijinal kesi ile aynı yerde yapılabilir. - Ekartörü yerleştirin ve forseps kullanarak cildi tutun ve cilde daha fazla esneklik sağlamak ve adım 1.4'te dikiş atmayı kolaylaştırmak için periost ile subkutis arasındaki avasküler bağ dokusunu kesin (Şekil 3B). Ekartörü kazanılan esnekliğe göre ayarlayın.
NOT: Bu bir terminal deneyiyse, bu adım atlanabilir. - Periosteumu kesin ve periosteum asansörünü kullanarak kafatasından gevşetin. Ekartörü kullanarak periosteuumu bir kenara tutun.
- Kraniyal pencere kapağını çıkarın ve duraya ulaşılana kadar bir pamuklu çubukla hafif dairesel hareketler kullanarak açıklıktaki tüm bağları çıkarın.
- Dermisteki ilk kesiyi, adım 2.1.5'te belirtildiği gibi orta hatta hafifçe lateral bir neşter ile yapın. Bir koterizatör ile deriden insizyona devam edin.
- Periferik tel implantasyonu
- Adım 1.2'yi tekrarlayın.
- Kortikal sinyallerin kaydedilmesi
- Adım 1.3'ü tekrarlayın.
- İmplant bölgesinin kapatılması
- Adım 1.4'ü tekrarlayın.
NOT: Bu bir terminal deneyiyse, bu adım atlanabilir.
- Adım 1.4'ü tekrarlayın.
3. Terminal cerrahi (Faz III)
NOT: 2-4 hafta sonra, S1'den gelen kortikal sinyallerin takip kayıtlarını yapmak için kraniyal pencere açılır. Adım 2.2-2.5, yukarıda açıklandığı gibi tekrarlanır ve ardından adım 3.1 gelir.
- Ötanazi
NOT: Barbitüratın oksidasyonunu önlemek için kulak damarı kateterinin hortumunun salin ile yıkanması gerekir.- Kulak damarı kateterini tuzlu su ile yıkayın.
- Aşırı dozda pentobarbital (10 mL, 400 mg / mL) içeren bir şırınga takın ve pentobarbitali kulak damarı kateteri yoluyla enjekte edin.
Sonuçlar
Kraniyal pencere tekniği kullanılarak, 16 hayvanda 43 seansta kortikal sinyaller kaydedildi. Hayvanlar ameliyattan sonra uygun şekilde iyileşti ve çalışma boyunca çift olarak barındırıldı ve Ek Tablo S1'deki refah şeması kullanılarak günlük olarak izlendi. Tüm hayvanlar her zaman 0 puan aldı ve bu da mükemmel bir refah olduğunu gösteriyor. Şekil 7 , pencerelerin gerçekten de domuz korteksinin S1 alanı üzerine yerleştirildiğini göstermektedir. Durada genellikle in vivo ve post-mortem üzerinde bir miktar yara izi gözlenmiştir (Şekil 7A), ancak ölüm sonrası inceleme, tüm hayvanlarda sağlıklı görünen ve kontralateral S1 alanıyla karşılaştırılabilir olan altta yatan kortikal dokuyu (Şekil 7B) hiç etkilemediğini ortaya koymuştur.

Şekil 7: Kortikal pencerenin beyin anatomisine göre yerleşimi. (A) Kortikal dokunun sağlığını ve kortikal pencerenin S1'e göre yerleşimini araştırmak için, çalışmanın sonunda kraniyal pencere çıkarıldı. Bu olguda 2 haftalık ameliyat aralıkları kullanıldı ve dura üzerinde bir miktar skar dokusu gözlendi. (B) Altta yatan beyin dokusu sağlıklı ve implanttan etkilenmemiş görünür. (C) İki fotoğrafın üst üste bindirilmesi, implantın gerçekten de domuz korteksinin S1 bölgesini kapladığını göstermektedir. Ok, ön-arka ekseni gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kısaca, kortikal sinyalleri analiz etmek için, hat gürültüsünü ve diğer artefaktları gidermek için filtrelenmeleri gerekir (bkz. Şekil 8 ve Tablo 1). Avrupa'da 50 Hz olan hat gürültü frekansı ve harmonikleri etrafında bir çentik filtresi kullanılmaktadır. Sinyaller daha sonra ofset ve düşük frekanslı hareket artefaktlarını gidermek için yüksek geçişli filtrelenir; maksimum kesme frekansı kayıtların amacına bağlıdır, ancak hem ERP hem de spontan EEG özelliklerini zayıflatacağı için 5 Hz'den yüksek olması tavsiye edilmez. Ayrıca, herhangi bir yüksek frekanslı gürültüyü gidermek için alçak geçiren bir filtre kullanılır. Elektrot duranın üzerine yerleştirildiğinden, yüksek frekanslar beyin ile elektrot arasındaki doku tarafından hafifçe zayıflatılır18. Bu nedenle, kesme frekansı, elektrotun doğrudan beyin dokusuna yerleştirildiği zamandan daha düşük olabilir.
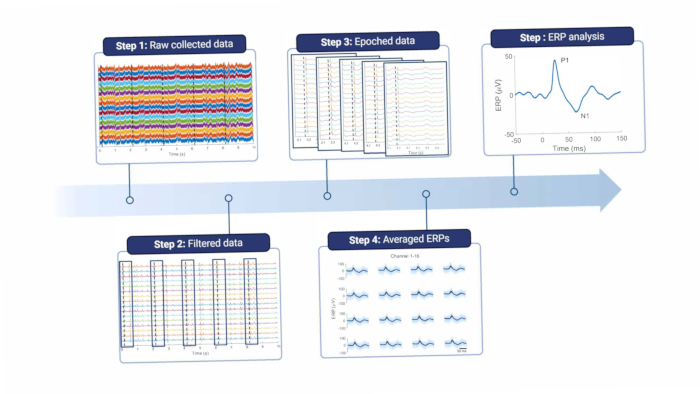
Şekil 8: Veri işleme hattı. Toplanan ham veriler (1. adım) filtrelenerek işlenir (2. adım). Daha sonra, ortalaması alınan (adım 4) uyaran tetikleyicilerine (adım 3) dayalı olarak dönemlere ayrılırlar. Veri analizi için ortalama ERP'ler kullanılır (5. adım). Kısaltma: ERP'ler = olayla ilgili potansiyeller. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Filtre türü | Tipik kesme | Tipik sipariş | Kullanılan kesme | Kullanılan sipariş |
| Çentik | 50±3 Hz veya 60±3 Hz | Yüksek sipariş | 50±3 Hz ve | 10. sıra |
| ve harmonikler | harmonikler ±1 Hz | |||
| Yüksek geçiş | 0,1-5 Hz | Düşük sipariş | 1-5 Hz | 2. sipariş |
| Düşük geçiş | 100-1000 Hz | Düşük sipariş | 300 Hz | 2. sipariş |
Tablo 1: Elektrokortikografi veya elektroensefalografi elektrotları ile kaydedilen yüzey beyin sinyallerinin analizi için tipik filtre özellikleri.
Filtrelenen veriler, uyarandan önce 50-100 ms ve uyarandan sonra 500-1.000 ms dönemlerine bölünür. Gürültülü kanallar verilerden çıkarılır (Şekil 9A) ve artefaktlarla kontamine olmuş dönemler kaldırılır (Şekil 9B). Kalan artefaktsız dönemlerin her kanal için ortalaması alınır. Uyarılmış tepkiler genellikle tek taramalarda ayırt edilebilir. Bunlar, en az 10 yanıtın ortalaması alındığında daha net ve daha tutarlı hale gelir ve 25'ten fazla yanıtın ortalaması alındığında değişmez. Güvenilir bir ortalama elde etmek için en az 20 artefaktsız dönem olmalıdır. Bu tipik olarak böyledir ve veri kümelerinin yarısından fazlasında herhangi bir dönemi kaldırmak gerekli değildi. Farklı aşamalarda (implantasyon, erişim, ötenazi ameliyatları) kaydedilen ERP'ler arasında karşılaştırmayı kolaylaştırmak için, veriler tipik olarak anestezik derinlik ve arka plan aktivitesindeki farklılıkları hesaba katmak için z-skoru ile normalleştirilir.

Şekil 9: Kötü kanal ve dönem örnekleri. (A) Beynin nispeten küçük bir bölgesindeki epidural kayıtlardan gelen sinyaller benzer özelliklere ancak farklı genliklere sahiptir. Arızalı kanallar, ERP dalga formunun olmaması nedeniyle kolayca ayırt edilir. Ek olarak, kanallar artefaktlar, daha gürültülü bir görünüm ve daha büyük sinyal genliği sergileyebilir (kanal 9, 10 ve 13). Kanal 7, arızalı bir kanalın başka bir örneğidir ve herhangi bir sinyal veya gürültü almaz. (B) Beklenen ERP genliği yaklaşık 100 μV'a kadardır. Gürültülü dönemler tipik olarak daha büyük bir genliğe sahiptir, bu da ortalama ERP dalga biçimini etkileyebilir ve bu nedenle kaldırılmalıdır. Tipik ERP dalga biçimi bunlardan eksiktir, ancak bu dalga biçimi tek dönemlerde her zaman ayırt edilemez. Kısaltma: ERP = olayla ilgili potansiyel. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kraniyal pencere tekniği kullanılarak kaydedilen ERP'lerin güvenilirliği pik amplitüdler ve latans açısından yüksekti19. Tekrarlanan ölçülen varyans analizinde (RM-ANOVA) tepe genliği (kayıt 1: 17.9 ± 7.26 μV; kayıt 2: 17.6 ± 10.1 μV; kayıt 3: 14.0 ± 6.95 μV) ve kanallar arasındaki varyans (kayıt 1: 6.47 ± 8.36 μV; kayıt 2: 3.93 ± 6.13 μV; kayıt 3: 3.84 ± 3.71 μV) için anlamlı bir fark bulunmadı. İlk ve takip kayıtları arasında en yüksek gecikme süresinde önemli bir fark bulundu. Bu çalışmada ergen kara ırkı domuzları kullanıldığı için sinir sisteminin gelişimi ile ilişkili olabilecek takip kayıtlarına(kayıt 1: 25.2 ± 2.0 ms; kayıt 2: 24.0 ± 2.4 ms; kayıt 3: 24.1 ± 2.0 ms) kıyasla ilk kayıtta tepe noktası 1 ms daha sonraydı.
Kraniyal pencere tekniği, yüksek frekanslı stimülasyonun (HFS) ERP'ler üzerindeki etkisini araştırmak için daha fazla kullanıldı. HFS, kemirgenlerdeyüzeysel dorsal boynuz nöronlarının uzun süreli güçlenmesine 22,23, insanlarda ağrı duyarlılığının artmasına ve uyarılmış beyin tepkilerinin artmasınaneden olur 24,25. Olayla ilgili potansiyellerin N1 zirvesinin genliğinde önemli bir artış gözlenmiştir (müdahale öncesi taban çizgisine kıyasla %259 ± %107 artış) ve HFS ile aynı hayvanda HFS'nin uygulanmadığı deneyler arasında açık bir fark ayırt edilebilir (Şekil 10)17.
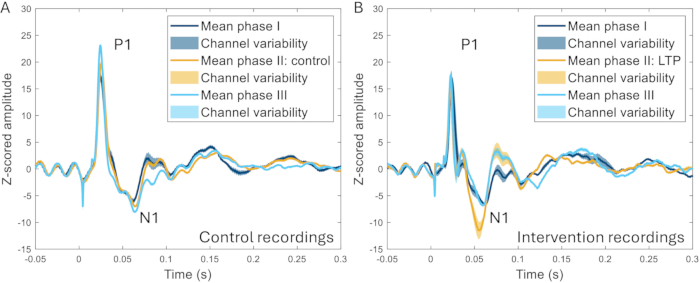
Şekil 10: Bir ağrı modelinin indüksiyonundan 2-3 hafta önce, sırasında ve 2-3 hafta sonra kaydedilen tüm kanallarda ortalaması alınan ERP örnekleri. (A) Aynı hayvandan 2 hafta arayla üç farklı kayıt sırasında toplanan ERP'ler çok benzer özellikler göstermektedir. (B) ERP'ler kayıtlar arasında benzer özelliklere sahiptir, ancak N1, faz II'de uzun vadeli potansiyasyonun indüksiyonundan sonra, faz II'den 3-4 hafta önce ve sonra olan diğer fazlara kıyasla daha büyük bir genliğe sahiptir. Gölgeli alanlar, kanallar arasındaki standart sapmayı gösterir. Kısaltmalar: ERP'ler = olayla ilgili potansiyeller; LTP = uzun vadeli güçlendirme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Tablo S1: Domuzların yalnız ve sosyal davranışlarını puanlamak için refah planı. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu tekniğin geliştirilmesinin önemi, elektrot yetmezlik modlarının ortadan kaldırılması, doku yanıtlarının azaltılması ve böylece invaziv kortikal kayıt tekniklerinin güvenilirliğinin arttırılmasında yatmaktadır. Çalışma sırasında herhangi bir elektrot arızası modu meydana gelmedi ve çalışma boyunca 16 hayvan ve 43 kayıt oturumu dahil olmak üzere toplam iki ECoG dizisi kullanıldı. Bunun araştırma ekonomisi üzerinde ek bir olumlu etkisi vardır. Geleneksel tamamen implante edilmiş yöntemler 12,26,27 kullanılarak, hiçbir cihaz arızasının meydana gelmediği varsayımı altında en az 16 ECoG dizisi gerekli olacaktır. Bununla birlikte, başarısızlık modları ve doku yanıtları, intrakraniyal beyin kaydının yaygın olarak uygulanmasında önemli zorluklar oluşturmaya devam etmektedir 11,12,13,28,29. Bu çalışma, elektrot sayısını önemli ölçüde azaltmış, böylece kronik sinirbilim çalışmalarının hem maliyetini hem de riskini aynı anda azaltmıştır.
Kraniyal pencere implantlarında meydana gelen tek olumsuz olay, erken ameliyatlarda ara sıra ortaya çıkan enfeksiyonlardır. Bu enfeksiyonlar her zaman yüzeyseldi (dura seviyesine ulaşmıyordu) ve bir Genta-coll emilebilir antibiyotik süngeri implante edilerek çözüldü. Bu tedavinin etkinliği nedeniyle, önleyici bir önlem olarak kraniyal pencere implantasyonunun bir parçası olarak antibiyotik süngerin implantasyonu benimsenmiştir. Domuzlar köklenme davranışı sergileyen güçlü hayvanlar olmasına rağmen, standart PLA'dan yapılan implantların hiçbiri kırılmadı.
İmplante edilen tüm elektrotlar yabancı cisim tepkisine ve glial veya fibröz kapsüllemeyetabidir 14,15,28,29,30. Bu, elektrot-doku arayüzünün yanı sıra elektrotun kayıt kabiliyetinin implantasyondan sonra zamanla değiştiği anlamına gelir 13,18,28. Mevcut yöntem kullanılarak, doku tepkileri, geçici elektrot yerleştirme stratejisi nedeniyle elektrotların bütünlüğünü ve kayıt doğruluğunu etkilememiştir. Elektrot her seansta dura üzerine yerleştirildi ve bu nedenle elektrot-doku arayüzü her seansta karşılaştırılabilirdi. Seans başına biraz farklılık gösterebilecek tek faktör elektrot pozisyonudur. Bu nedenle, pencere boyutunu elektrot boyutuyla eşleştirmek ve her kayıt oturumu sırasında elektrot yerleşiminin fotoğraflarını çekmek çok önemlidir. Bu çabalarla, son derece güvenilir ve tekrarlanabilir ERP'ler kaydedilmiştir19.
Kraniyal pencere implantına doku yanıtı meydana geldi ve kafatasının dış yüzeyinden duraya uzanan duvarları olmayan bir transkraniyal pencere kullanan en eski pilotlarda kemik büyümesi gözlendi. İlk seanstan 2 hafta sonra sürekli bir yumuşak kemik dokusu tabakası bulundu ve bu da kemiğin yeniden büyüdüğünü gösteriyor. Bu dokuyu çıkarmak ve duraya erişmek imkansızdı; Bu nedenle, kafatasının yüzeyinden Dura31'e kadar uzanan dikey duvarlar kafatası penceresine eklendi. Korteks üzerindeki baskıyı önlemek için implantı kafatası kalınlığına uyacak şekilde farklı duvar uzunluklarına sahip pencereler basıldı. Tüm hayvanlarda sağlıklı görünen beyin dokusunu ortaya çıkaran ötenazi sonrası hayvanlar araştırıldı. Pencere alanı içinde hala yumuşak doku oluşur; Bununla birlikte, duvara yapışmaz ve kafatası ile sürekli değildir, bu da bir pamuklu çubuk kullanılarak çıkarılmasını kolaylaştırır. Bu yumuşak dokunun pencereden çıkarılması ve böylece elektrodun her seferinde dura üzerine yerleştirilmesi kayıtların güvenilirliği açısından kritiktir.
Ameliyatlar arasında en az 3 hafta olması ile optimal sonuçlar elde edilir. 2 haftada, kraniyal pencereye erişilebilir, ancak pencere alanındaki yumuşak doku duraya bağlanır. Ayrıca, yaranın açılması ve kapanması, kanama ve dokudaki esneklik eksikliği nedeniyle karmaşıktır. 3 ve 4. haftalarda, insizyon yarası, normal doku sınırlarının (örneğin, periosteum, deri, dura) belirgin olduğu kadar iyileşmiştir, bu da yumuşak dokuyu pencereden çıkarmayı ve cildi implant üzerinden yeniden kapatmayı kolaylaştırır. 4 hafta aralıklarla kemik benzeri doku gözlenmediği için ameliyatlar arasında 4 haftadan fazla ve çoklu erişim ameliyatları mümkün olabilir. Ameliyatlar arasındaki sürenin birkaç aya kadar uzatılıp uzatılamayacağını araştırmadık.
İmplant ve giriş ameliyatlarının başarısı için ilk kesi ve yara kapatma işlemi kritik öneme sahiptir. Domuzun alın derisinin esnekliği çok sınırlıdır, bu nedenle cildin avasküler deri altı tabakasını gevşetmek çok önemlidir. Bu, implant üzerindeki cildi kapatmak için ekstra esneklik sağlar ve dikişler üzerindeki stresi azaltır. Bu stres, iki kat sütür ve ek cilt yapıştırıcısı kullanılarak daha da azaltılır. Hayvanların yaraları kaşımasını ve dikişlerin erken çıkarılmasını önlemek için sürekli bir intradermal dikiş tekniği kullanılarak deri dikilir. Yara açma ve kapama stratejileri, ister implant ister erişim ameliyatı olsun, her iki sağkalım cerrahisinde de kritik öneme sahiptir.
Mevcut yaklaşımın bir sınırlaması, pencereye erişimin uyanık hayvanlarda kayıtları engelleyen küçük bir ameliyat gerektirmesidir. Bu, araştırma sorusuna bağlı olarak, her çalışma için uygun bir yaklaşım olmayacağı anlamına gelir. Uyanık kayıtlarda kullanılacak tamamen implante edilmiş cihazlar için, arayüzdeki biyolojik değişikliklerin üstesinden gelmek için başka yöntemler de mevcuttur32. Kraniyal pencereye erişim küçük bir işlem olduğundan, genel anestezi yerine lokal anestezik ve sakinleştirici kullanmak mümkün olabilir. Kraniyal pencerenin tamamen deri altında olmasının avantajları, hayvanlar çift veya grup halinde barındırılabildiğinden, enfeksiyon olasılığının azalması ve hayvan refahının artmasıdır. Ayrıca, sadece uyarılan tepkilerin güvenilirliğini araştırdık19. Bununla birlikte, spontan beyin aktivitesi kaydedilmiştir ve genellikle ERP8'den daha güvenilir ve tekrarlanabilirdir, bu da yöntemin ERP kaydı ile sınırlı olmadığını gösterir.
Yöntemimiz, kronik kortikal kayıtlar için yeni, ölçeklenebilir, güvenilir ve tekrarlanabilir bir yöntem sunmaktadır. Bu yöntem, çalışmaların sonucu için güvenilirlik ve tekrarlanabilirliğin gerekli olduğu sinirbilim araştırma çalışmaları için oldukça değerlidir33,34. Yöntemi, farklı ağrı modellerinin ve kontrollerinin indüksiyonundan önce ve sonra S1'den kortikal uyarılmış yanıtları araştırmak için kullandık ve sağlam sonuçlar gösterdik17. Genel olarak, yöntem, örneğin hareket, işitme veya görmeyi araştırmak için diğer kortikal alanlara erişmek için kolayca uyarlanabilir. Yöntemi epilepsitanısı için kullanmak da mümkün olabilir 4,35 veya beyin hasarı sonrası tedavi ve rehabilitasyonuizlemek 36,37.
Yöntem aynı zamanda insan olmayan primatlar veya diğer memeliler, kediler, köpekler veya koyunlar gibi diğer türler için de ölçeklenebilir 35,38,39. Bu uyarlamaların her biri, cerrahi tekniğin ayarlanmasını, kraniyal pencere yerleşimi için güvenilir yer işaretlerinin belirlenmesini ve tasarımının ayarlanmasını gerektirecektir. Yazarlar, pilot teste geçmeden önce kafatası penceresi tekniğini optimize etmek için kadavraların kullanılmasını önermektedir. Bazı beyin bölgeleri için ameliyat daha invaziv olabilir ve bu da önerdiğimizden farklı bir optimal iyileşme süresi ile sonuçlanabilir. Teknik ayrıca, subdural ECoG kayıtlarını ve intrakortikal kayıtları mümkün kılacak şekilde uyarlanabilir, böylece uygulamalarını genişletir ve çeşitli beyin bölgelerine erişimi artırır. Domuz kafatasının kalınlığı nedeniyle, subdural kayıtlar için durotomi yapmak için kortikal pencerenin boyutunu artırmak gerekebilir26,27.
İntrakortikal kayıtlar için, elektrodu bir kanül veya bir mekik40 aracılığıyla yerleştirmek mümkündür, bu da kortikal pencerenin boyutunun daha da azaltılmasına izin verir. Hem subdural hem de intrakraniyal teknikler kanama riskini artıracaktır, bu nedenle ameliyat sırasında kan damarlarından kaçınmak için dikkatli olunmalıdır. Kraniyal pencere tekniği, beyinden gelen elektrik sinyallerini kaydetmekten başka amaçlar için de kullanılabilir, örneğin, migren41'in domuz modellerinde oldukça önemli olan vaskülatürün görüntülenmesi. Ayrıca, kraniyal pencere yöntemi, 2-foton görüntüleme gibi yeni görüntüleme teknikleriyle31 birlikte kullanılmak üzere uyarlanabilir ve gelişmiş optik çözünürlük42 için Costine-Bartell ve ark. tarafından geliştirilen dural ikame ile birleştirilebilir.
Sonuç olarak, sunulan metodolojik yaklaşım, cihaz arızası riskini ortadan kaldırarak, elektrot bölgesindeki biyolojik tepkileri en aza indirerek ve böylece kayıt doğruluğunu artırarak ve son derece güvenilir kortikal kayıtlarla sonuçlanarak kalıcı bir implant12,13 ile ilgili riskleri azaltmaktadır. Metodoloji, diğer türlere ve kayıt türlerine göre ölçeklenebilir olduğu için diğer uygulamalar için de büyük umut vaat ediyor.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, Aalborg Üniversite Hastanesi'ndeki laboratuvar hayvanları tesisindeki hayvan bakıcılarına ve teknisyenlerine teşekkür eder. Nöroplastisite ve Ağrı Merkezi (CNAP), Danimarka Ulusal Araştırma Vakfı (DNRF121) tarafından desteklenmektedir. Şekil 6 ve Şekil 8 BioRender'da oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
Referanslar
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır