Method Article
تقنية نافذة الجمجمة المزمنة للتسجيلات القشرية المتكررة أثناء التخدير في الخنازير
In This Article
Summary
تقدم هذه الدراسة طريقة قابلة للتطوير وموثوقة وقابلة للتكرار للتسجيلات القشرية المزمنة المتكررة في نموذج الخنزير. هذه الطريقة لها تطبيقات في مختلف مجالات علم الأعصاب ، بما في ذلك أبحاث الألم وتشخيص الأمراض العصبية.
Abstract
تعد التسجيلات القشرية ضرورية لاستخراج الإشارات العصبية لإبلاغ التطبيقات المختلفة ، بما في ذلك واجهات الدماغ والحاسوب وتشخيص الأمراض. يضع كل تطبيق متطلبات محددة على تقنية التسجيل ، وغالبا ما يتم اختيار الحلول الغازية للتسجيلات طويلة المدى. ومع ذلك ، فإن طرق التسجيل الغازية تواجه تحديا بسبب فشل الجهاز واستجابات الأنسجة الضارة ، مما يضر بجودة الإشارة على المدى الطويل.
لتحسين موثوقية وجودة التسجيلات القشرية المزمنة مع تقليل المخاطر المتعلقة بفشل الجهاز وتفاعلات الأنسجة ، قمنا بتطوير تقنية نافذة الجمجمة. في هذا البروتوكول ، نبلغ عن طرق زرع نافذة الجمجمة والوصول إليها في خنازير السلالات المحلية اليافعة ، مما يسهل وضع مصفوفة القشرة الكهربائية المؤقتة (ECoG) على الأم الجافية. نصف أيضا كيف يمكن تسجيل الإشارات القشرية باستخدام تقنية نافذة الجمجمة. يمكن تكرار الوصول إلى نافذة الجمجمة عدة مرات ، ولكن ينصح بأسبوعين على الأقل بين جراحات الزرع والوصول لتسهيل الشفاء والتئام الأنسجة.
نجح نهج نافذة الجمجمة في تقليل أوضاع فشل القطب الكهربائي الشائعة واستجابات الأنسجة ، مما أدى إلى تسجيلات قشرية مستقرة وموثوقة بمرور الوقت. سجلنا الإمكانات المتعلقة بالحدث (ERPs) من القشرة الحسية الجسدية الأولية كمثال. وفرت الطريقة تسجيلات موثوقة للغاية ، مما سمح أيضا بتقييم تأثير التدخل (التحفيز عالي التردد) على تخطيط موارد المؤسسات. يشير عدم وجود أعطال كبيرة في الجهاز وانخفاض عدد الأقطاب الكهربائية المستخدمة (قطبان كهربائيان ، 43 جلسة تسجيل ، 16) إلى تحسن اقتصاد البحث. في حين أن الوصول الجراحي البسيط مطلوب لوضع القطب الكهربائي ، فإن الطريقة توفر مزايا مثل تقليل مخاطر العدوى وتحسين رفاهية.
تقدم هذه الدراسة طريقة قابلة للتطوير وموثوقة وقابلة للتكرار للتسجيلات القشرية المزمنة ، مع تطبيقات محتملة في مختلف مجالات علم الأعصاب ، بما في ذلك أبحاث الألم وتشخيص الأمراض العصبية. قد تمتد التعديلات المستقبلية من استخدامه ليشمل الأنواع الأخرى وطرائق التسجيل ، مثل التسجيلات داخل القشرة وتقنيات التصوير.
Introduction
بشكل عام ، الغرض من التسجيلات القشرية هو استخراج المعلومات من الإشارات العصبية في الدماغ. يمكن استخدام هذه المعلومات بطرق مختلفة - التحكم في جهاز خارجي أو الاتصال أو تشخيص المرض أو إعادة التأهيل1،2،3،4. يضع كل تطبيق متطلبات فريدة على محتوى المعلومات والدقة المكانية المطلوبة ومقدار الغزو الذي يعتبر مقبولا. لذلك ، تم تطوير حلول التسجيل ذات النطاق الجراحي والدقة المكانية منذ اكتشاف مخطط كهربية الدماغ في عام 19295.
بشكل عام ، يمكن تقسيمها إلى تخطيط كهربية الدماغ (EEG) ، وتخطيط كهربية القشرة (ECoG) ، وتسجيلات داخل القشرة. مخطط كهربية الدماغ هي طريقة تسجيل غير جراحية تلتقط التذبذبات العصبية والإمكانات المرتبطة بالأحداث (ERPs) من الدماغ بأكمله. ومع ذلك ، فإن قدرته على تحديد مصادر هذا النشاط محدودة بسبب انخفاض استبانته المكانية. ECoG هي طريقة أكثر توغلا حيث يتم وضع الأقطاب الكهربائية epi- أو تحت الدوام ، وعادة ما تغطي جزءا أصغر من القشرة. لديها دقة مكانية أعلى ويمكنها تسجيل تخطيط موارد المؤسسات وإمكانيات المجال المحلي السطحي (LFP). لذلك ، يمكنه تحديد مصدر نشاط الدماغ بشكل أكثر دقة ، مما يجعله مفيدا ، على سبيل المثال ، في تحديد أصل الصرع البؤري. التسجيل داخل القشرة هو طريقة التسجيل الأكثر توغلا ويمكنه تسجيل نشاط الارتفاع من الخلايا العصبية الفردية الموجودة بشكل سطحي أو عميق داخل الدماغ و LFP من حجم الخلايا العصبية حول الأقطاب الكهربائية. تتميز هذه الإشارات بدقة مكانية عالية جدا ومحتوى معلومات ولكنها يتم إنتاجها بواسطة مجموعة فرعية مقيدة من الخلايا العصبية (1-10 خلايا عصبية لكل قناة)6.
لاستخراج المعلومات من الدماغ لفترات طويلة (شهور - سنوات) ، يجب أن تكون الواجهة مستقرة وموثوقة حتى تستمر الإشارات المكتسبة في تمثيل نفس المعلومات خلال الفترة بأكملها. تتطلب تسجيلات EEG تغييرات متكررة في القطب الكهربائي ، مما يجعل موثوقيتها متغيرة من منخفضة جدا إلى عاليةجدا 7،8،9،10. لذلك ، غالبا ما يتم اختيار طرق ECoG وداخل القشرة للتسجيلات المطولة. ومع ذلك ، تتطلب هاتان الطريقتان أن تظل حالة قطب التسجيل ، وكذلك الأنسجة ، مستقرة بمرور الوقت. بينما يظل القطب الكهربائي عادة في نفس الموقع ، فقد تتغير واجهة القطب الكهربائي بسبب تفاعلات الأنسجة أو أوضاع فشل القطبالكهربائي 11،12،13،14. تشمل تفاعلات الأنسجة موت الخلايا العصبية ، والنزيف ، والقاشف الحيوي ، ورد فعل الأجسام الغريبة ، والدبقي ، والتغليف ، والعدوى ، والتهاب السحايا ، وبثق السحايا15. هذه التفاعلات تضر بقدرات تسجيل الأقطابالكهربائية 12،13. أوضاع فشل القطب الكهربائي الشائعة هي التفريغ أو التسرب في الأجزاء المعزولة ، وتفريغ أو تكسير طلاء سطح القطب الكهربائي ، وتلف الأسلاك ، وخلع القطبالكهربائي 11،12.
للتغلب على أوضاع فشل القطب الكهربائي ، نظرنا في جدوى حل وضع القطب الكهربائي المؤقت الذي يعالج أيضا العديد من التحديات المتعلقة باستجابات الأنسجة ، وهي موت الخلايا العصبية ، ورد فعل الأجسام الغريبة ، والانبساط ، والتغليف ، والبثق السحائي علاوة على ذلك ، كان وضع القطب الكهربائي المتسق شرطا لتحقيق تسجيلات عصبية موثوقة وقابلة للتكرار. نظرا لأن القطب تم وضعه بشكل جانبي على مسافة بضعة ملليمترات من الأنسجة العصبية ، يجب ألا تتجاوز حركة القطب 1 مم. تم تصميم نافذة الجمجمة بأبعاد لمنع الحركة المفرطة بين مواضع الأقطاب الكهربائية. مع تطوير تقنية نافذة الجمجمة ، نهدف إلى تحسين موثوقية الإشارة وجودتها على المدى الطويل وإزالة مخاطر فشل القطب.
Protocol
تمت الموافقة على هذا البروتوكول من قبل الإدارة البيطرية والأغذية الدنماركية التابعة لوزارة الأغذية والزراعة ومصايد الأسماك في الدنمارك (البروتوكول رقم 2020-15-0201-00514). خضعت ما مجموعه 16 من أنثى خنزير السلالات المحلية لهذه الإجراءات. كان وزن حوالي 20 كجم عند وصولها إلى المنشأة ، مما يعني أنها كانت تبلغ من العمر شهرين تقريبا. كان وزنهم حوالي 30 كجم عند الزرع و 40-60 كجم في نهاية الدراسة. تتكون الإجراءات من جراحة الزرع وجراحة الوصول والجراحة النهائية (الشكل 1).

الشكل 1: الجدول الزمني للإجراءات التجريبية. يمكن تكرار جراحة الوصول (المرحلة الثانية) عدة مرات. ينصح بالفصل لمدة أسبوعين على الأقل بين العمليات الجراحية للتعافي والتئام الجروح بين العمليات الجراحية. الاختصار: ERP = الإمكانات المتعلقة بالحدث. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. جراحة الزرع (المرحلة الأولى)
ملاحظة: يتم زرع نافذة قحفية من حمض البولي لاكتيك (PLA) مطبوعة ثلاثية الأبعاد (الشكل 2) لتسهيل التسجيلات المتكررة من القشرة الحسية الجسدية الأولية للخنزير. يتم تسجيل تخطيط موارد المؤسسات بسبب التحفيز الكهربائي للعصب الزندي. يتم إجراء الجراحة وإغلاق الجرح بحيث يمكن الوصول إلى نافذة الجمجمة وإغلاقها لاحقا.
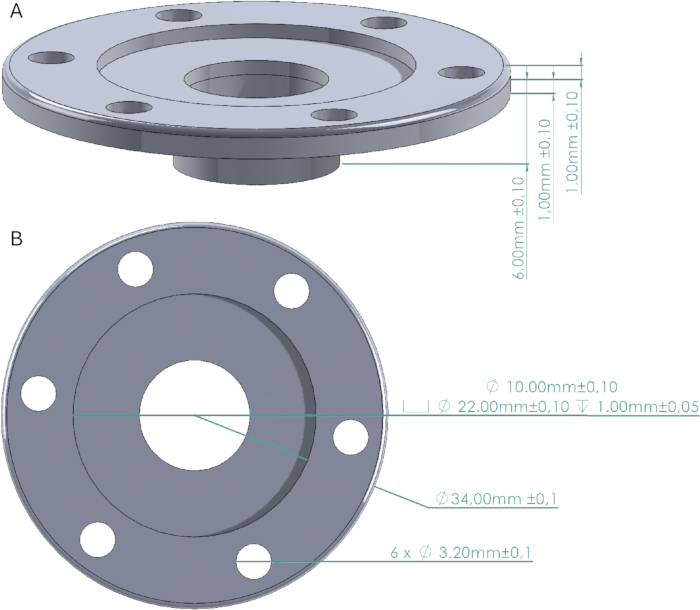
الشكل 2: تصميم نافذة الجمجمة. (أ) منظر جانبي لنافذة الجمجمة يشير إلى ارتفاع الجدران والقاعدة المثبتة بالجمجمة. (ب) منظر علوي يشير إلى قطر أرملة الجمجمة وفتحات المسامير ومساحة الغطاء والنافذة. غطاء نافذة الجمجمة عبارة عن أسطوانة قطرها 22 مم بارتفاع 1 مم تتناسب بدقة مع مساحة الغطاء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- زرع النافذة القحفية
- التحضير للجراحة
ملاحظة: يتم تشغيل معالج البيانات (RZ2) ومحطة العمل (WS8) والكمبيوتر الشخصي قبل بدء الجراحة. يتم تدوين ملاحظات الجراحة في جدول بيانات كل 15 دقيقة على الأقل من قبل باحث غير معقم لتوثيق العلامات الحيوية (معدل ضربات القلب ، SPO2 ، ثاني أكسيد الكربون2 في نهاية المد والجزر ، درجة الحرارة الأساسية) ، مستويات التخدير (معدل ضخ البروبوفول ، معدل ضخ الفنتانيل ، نسبة سيفوفلوران) ، مرحلة الجراحة وأي مخالفات.- تهدئة باستخدام حقن عضلي من 5-7 مل من خليط زولتيل (1 مل يحتوي على 8.3 مجم من التيليتامين ، و 8.3 مجم من زولازيبام ، و 8.3 مجم من زيلاسين ، و 1.7 مجم من البوتوفانول).
ملاحظة: في هذه الدراسة بالذات ، تم حذف الكيتامين من خليط Zoletil لتجنب منع مستقبلات NMDA. - انقل إلى غرفة الجراحة. تنبيب وتوصيله بجهاز التنفس الصناعي.
- ضع قسطرة وريد الأذن لإعطاء البروبوفول والفنتانيل والمحلول الملحي.
- إدارة التخدير الجراحي: سيفوفلوران 1-2٪ ، بروبوفول (10 مجم / مل منقوع عند 8 مجم كجم -1 ساعة -1) ، الفنتانيل (50 ميكروغرام / مل منقوع عند 20 ميكروغرام كغ -1 ساعة -1).
- ضع علامة على موقع الشق باستخدام قلم معقم قبل اللف المعقم. تحديد نقطة بريجما عن طريق رسم خطوط مستقيمة بين كل أذن والعين المقابلة ؛ تقع نقطة بريجما عند تقاطع تلك الخطوط (الشكل 3 أ). تأكد من أن الشق جانبي قليلا إلى خط الوسط على الجانب المقابل للطرف الأمامي المحفز.
- ضع اللوح المعدني تحت الستائر وتأكد من وضعه وثباته بشكل صحيح قبل بدء الجراحة.
- تهدئة باستخدام حقن عضلي من 5-7 مل من خليط زولتيل (1 مل يحتوي على 8.3 مجم من التيليتامين ، و 8.3 مجم من زولازيبام ، و 8.3 مجم من زيلاسين ، و 1.7 مجم من البوتوفانول).
- الوصول إلى الجمجمة
ملاحظة: في هذا القسم والأجزاء التالية من البروتوكول ، يتم تنفيذ جميع الإجراءات من قبل جراح معقم ما لم يذكر خلاف ذلك.- قم بعمل شق أولي في الأدمة بمشرط جانبي قليلا إلى خط الوسط ، كما هو موضح في الخطوة 1.1.1.5. استمر في الشق عبر الجلد باستخدام الكي.
ملاحظة: لا تقم بتمديد الشق بعيدا جدا إلى الأمام لتجنب الجيوب الأمامية الكبيرة للخنزير. إذا كانت هناك حاجة إلى مساحة أكبر ، فقم بتمديد الشق على الجانب الخلفي. - ضع الضام وامسك الجلد باستخدام ملقط وقم بقطع النسيج الضام اللاوعائي بين السمحاق وتحت الجلد (الشكل 3 ب) لتوفير مزيد من المرونة للجلد وتسهيل الخياطة في الخطوة 1.4. اضبط الضام على المرونة التي تم اكتسابها.
- شق السمحاق وفكه من الجمجمة باستخدام مصعد السمحاق. أمسك السمحاق جانبا باستخدام الضام.
- قم بعمل شق أولي في الأدمة بمشرط جانبي قليلا إلى خط الوسط ، كما هو موضح في الخطوة 1.1.1.5. استمر في الشق عبر الجلد باستخدام الكي.
- الوصول إلى الجافية
- قم بحفر ثقب قطره 10 مم أمامي لخط الخياطة السهمية وجانبيا إلى خياطة خط الوسط (الشكل 3C). ابدأ بقطر 15 مم لتحقيق ثقب قطره 10 مم على مستوى الجافية لأن لقمة الثقب المستديرة ستؤدي إلى ثقب مدبب قليلا.
- قم بتركيب نافذة الجمجمة في الفتحة في وقت مبكر لضمان ملاءمة جيدة.
- قم بالتبديل إلى مثقاب أصغر عندما تصبح الجافية مرئية لتحقيق أقصى عرض للثقب على مستوى الجافة. قص الحواف باستخدام Rongeurs.
- زرع النافذة القحفية
- تأكد من أن نافذة الجمجمة تتناسب مع قاع الحفرة وحتى قاع الحفرة وحدد عمقها. على الرغم من أن هذا يعتمد على ، تأكد من أن جدران نافذة الجمجمة تصل إلى الجافية لملاءمة جيدة ولكن لا تمارس ضغطا على الدماغ في أي مكان.
- ضع علامة على فتحات المسامير باستخدام المثقاب اليدوي أثناء تثبيت نافذة الجمجمة في مكانها.
- قم بإزالة نافذة الجمجمة وحفر الثقوب بعمق 4 مم على الأقل. اخترق الجمجمة لأحد البراغي لاستخدامها كأرضية / مرجع للتسجيلات القشرية.
- ضع نافذة الجمجمة (الشكل 3) ، وقم بإزالة الإبرة من مجموعة ضخ الفراشة. قم بقياس عمق فتحات المسامير من خلال نافذة الجمجمة باستخدام الفراشة الحادة. أدخل وربط المسمار بطول مطابق في الفتحة.
ملاحظة: سيفشل المسمار الطويل جدا في ربط غطاء نافذة الجمجمة بشكل فعال. - ضع موصل U أسفل برغي واحد يثقب الجمجمة ويلامس الجافة.
ملاحظة: من المهم أن يكون طول هذا المسمار أكبر من سمك الجمجمة حتى لا يمنع نمو العظام ملامسة الجافية.
- التحضير للجراحة
- زرع الأسلاك الطرفية
ملاحظة: يمكن إجراء هذا الإجراء بالتزامن مع زرع نافذة الجمجمة. هذا إجراء معقم. لمنع تلوث موقع الجراحة أو موقع الجمجمة ، يجب ارتداء ملابس معقمة.- زرع الأسلاك بالقرب من العصب الزندي
- ضع التحفيز الكهربائي عند 5 مللي أمبير على الجلد عن طريق لمس الجلد في الجزء الخلفي البعيد من الطرف الأمامي بإبرتين (لا تخترق) أو قطعة معدنية معقمة أخرى مفصولة بمقدار 2 سم. ابحث عن ثني الحافر الواضح ، مما يشير إلى أن العصب يمتد بين هاتين النقطتين.
ملاحظة: قد يحتاج الطرف إلى الدوران للخلف حتى يسهل الوصول إلى الجزء الخلفي. - أدخل الإبرتين بشكل عمودي على مسار العصب على بعد حوالي 2 سم. ثقب الجلد مرة أخرى على بعد حوالي 3 سم من نقطة الإدخال (الشكل 4 أ).
- تحقق من الموقع باستخدام محفز اختبار مطبق على الإبر عند 2 مللي أمبير ؛ تأكد من رؤية حركة واضحة للحافر.
- مرر أسلاك Cooner عبر الإبر وقم بإزالة الإبر ، تاركا أسلاك Cooner جزئيا تحت الجلد. تأكد من أن الجزء غير المعزول في منتصف السلك تحت الجلد لكلا السلكين (الشكل 4 ب).
ملاحظة: إذا تم تدوير الطرف للخلف ، فقم بتدويره بعناية للأمام. - قم بتوصيل كل موصل تمساح بنهاية غير معزولة لسلكي Cooner.
- ضع التحفيز الكهربائي عند 5 مللي أمبير على الجلد عن طريق لمس الجلد في الجزء الخلفي البعيد من الطرف الأمامي بإبرتين (لا تخترق) أو قطعة معدنية معقمة أخرى مفصولة بمقدار 2 سم. ابحث عن ثني الحافر الواضح ، مما يشير إلى أن العصب يمتد بين هاتين النقطتين.
- تحديد عتبة المحرك
- أوجد عتبة المحرك باستخدام طريقة من أعلى إلى أسفل16،17 ؛ ابدأ من 100 ميكرو أمبير ، وتزداد بخطوات 50 ميكرو أمبير ، أثناء المراقبة والشعور بالاستجابة الحركية في منطقة الحافر. عادة ما يكون من الممكن تحقيق عتبة أقل من 1 مللي أمبير.
- قم ببرمجة STG لتوفير 100 محفز متماثل ثنائي الطور مستطيل بعرض نبضة 200 ميكرو ثانية عند 2x عتبة المحرك متبوعا ب 100 محفز عند 10 أضعاف عتبة المحرك.
- زرع الأسلاك بالقرب من العصب الزندي
- تسجيل الإشارات القشرية
- اطلب من باحث غير معقم إحضار مكبر الصوت المسبق في موضعه وتوصيله بمعالج البيانات (RZ2) باستخدام كبلات الألياف البصرية.
- خفض سيفوفلوران إلى 0.5-1٪ (نصف مستواه الجراحي) ومراقبة معدل ضربات القلب وثاني أكسيد الكربون منتهي الصلاحية2 وضغط الدم (إن وجد) لضمان عمق التخدير الكافي والمستقر قم بزيادة كل من البروبوفول والفنتانيل حسب الحاجة.
- اطلب من باحث غير معقم إرفاق الواجهة بمكبر الصوت (SI8) ووضع منصة الرأس (مشبك ZIF) في حامل المسرح ، والذي يتم تثبيته على جهاز المعالجة الدقيقة للحامل المغناطيسي.
- ضع اللف المعقم حول المعالج الدقيق وقم بتوصيل الجزء اللاصق بحامل الرأس والمسرح (الشكل 5 أ).
- اطلب من باحث غير معقم تأمين المعالج الدقيق باستخدام الحامل المغناطيسي ، وغمس قطب μECoG في الكحول ، ووضعه في مسرح الرأس (مشبك ZIF).
ملاحظة: اترك القطب يجف قبل وضعه على الجافة. تأكد من لمس الغلاف المعقم الذي يغطي الرأس فقط ، لأن القطب الكهربائي μECoG ليس معقما. - ضع μECoG في مكانه باستخدام المعالج الدقيق والتوجيه باستخدام برعم قطني. قم بتوصيل الأسلاك الأرضية μECoG بالمسمار الأرضي بموصل تمساح.
- خفض السيفوفلوران إلى 0٪ ، ومراقبة معدل ضربات القلب ، وثاني أكسيد الكربون منتهيالصلاحية 2 ، وضغط الدم (إن وجد) لضمان عمق التخدير الكافي والمستقر ، وزيادة كل من البروبوفول والفنتانيل حسب الحاجة.
- معاينة الإشارات في المشبك ؛ نطاق الإشارة النموذجي يصل إلى ±100 ميكرو فولت.
- إذا ظهرت الإشارة كخط غامق (يدل على ضوضاء الخط) ، فاطلب من شخص معقم تنفيذ الإجراءات التالية: تحقق من دائرة التأريض وحافظ على برغي التأريض والوصلات جافة ومعزولة عن الأنسجة القريبة. تحقق مما إذا كانت الكابلات الأخرى معزولة عن جسم الخنزير والأدوات الجراحية. إذا لم يكن الأمر كذلك ، فاستخدم شاشا معقما لعزل الكابلات عن الجسم أو الأدوات الجراحية.
- إذا كانت سعة الإشارة أكبر من ±100 ميكرو فولت (تدل على القطع الأثرية للحركة) ، فتأكد من تعليق القطب الكهربائي وتثبيته على الدماغ وأن الكابلات لا تتحرك عندما يتحرك الخنزير بسبب التهوية أو التحفيز الكهربائي للعصب الزندي.
- إذا كانت سعة الإشارة أصغر من ± 20 مللي فولت (مما يدل على ضعف الاتصال أو التخدير العميق) ، فتأكد من أن μECoG يقع على الدماغ وأن الجافية والقطب الكهربائي رطبان ؛ إذا لزم الأمر ، قم بتقطير بعض المحلول الملحي على القطب. تأكد من إيقاف تشغيل السيفوفلوران وتقليل معدل تسريب البروبوفول (وربما الفنتانيل). قم بإجراء تحفيز اختبار وتحقق مما إذا كانت الاستجابات المستحثة مرئية أم لا. تأكد من أن الجزء غير المعزول من السلك المحيطي يقع بالكامل تحت الجلد.
ملاحظة: يمكن عادة تمييز الاستجابات المستحثة في عمليات مسح فردية عبر الإنترنت ، ولكن من الممكن أيضا تقييم هذا في وضع عدم الاتصال ، مع أخذ ما معدله من 5 إلى 10 محفزات. إذا كانت الذروة مرئية في وقت الزناد ، فهي قطعة أثرية تحفيزية. سوف تتداخل قطعة التحفيز مع تحليل البيانات.
- ضع شاشا معقما على القطب الكهربائي للحفاظ على ملامسة الأنسجة. قم بتنقيط محلول ملحي بدرجة حرارة الجسم على الشاش لمنع جفاف الأنسجة.
ملاحظة: نظرا لأن هذه التسجيلات فوق الجافية ، فإن درجة الحرارة الدقيقة ليست ضرورية. مع التسجيلات تحت الجافية ، يكون هذا أكثر أهمية. - اسمح للقطب الكهربائي بالاستقرار (30 دقيقة) وقم بتوثيق وضع القطب الكهربائي وإعداد الموصل الأرضي لضمان تسجيلات لاحقة مماثلة (الشكل 5B-D). ابدأ التسجيل وانتظر 30 ثانية قبل بدء برنامج التحفيز كل 10 دقائق.
ملاحظة: تحقق بانتظام بين التسجيلات من أن الشاش الموجود على القطب يظل رطبا ويقطر محلول ملحي لدرجة حرارة الجسم إذا لزم الأمر. - قم بإجراء تدخل بعد ثلاث جولات من التحفيز (لتكون بمثابة خط أساس ما قبل التدخل). كرر التحفيز لتسع جولات أخرى.
ملاحظة: استمر في التحقق بانتظام بين التسجيلات من أن الشاش الموجود على القطب يظل رطبا ومحلول ملحي بالتنقيط إذا لزم الأمر.
- إغلاق موقع الزرع
- قم بإزالة الشاش من القطب الكهربائي وإزالة القطب الكهربائي باستخدام أداة المعالجة الدقيقة أثناء توجيهه برفق باستخدام برعم قطني.
- اطلب من باحث غير معقم إزالة وتخزين المعالج الدقيق والقطب الكهربائي ومرحلة الرأس ومكبر الصوت وتنظيف القطب الكهربائي وفقا لتوجيهات الشركة المصنعة باستخدام شطف سريع بالماء منزوع الأيونات لإزالة بقايا الأنسجة. انقع القطب لمدة تصل إلى 4 ساعات في منظف العدسة لإزالة الأنسجة والبروتينات من سطح القطب ، متبوعا بشطف ثان بالماء منزوع الأيونات لإزالة منظف العدسة من سطح القطب. قبل تخزينه ، اغمس القطب في كحول الأيزوبروبيل.
- ضع غطاء نافذة الجمجمة لإغلاق نافذة الجمجمة ، مع التأكد من ملاءمته بدقة لنافذة الجمجمة. لا يتطلب أي تثبيت إضافي ؛ الضغط من الجلد على الغرسة سيبقيها في مكانها.
- ضع كيس المضادات الحيوية أعلى غطاء نافذة الجمجمة وأغلق الجلد تحت الجلد باستخدام خيوط مفردة قابلة للامتصاص باستخدام تقنية خياطة المرتبة العمودية المدفونة (الشكل 6 أ). ضع الغرز على مسافة 5-10 مم ، مما يتيح مساحة لوضع الغرز الجلدية. لا تربط الغرز الثلاث الأخيرة بعد وضعها. بدلا من ذلك ، اربط هذه الغرز الثلاث عند وضع جميع الغرز.
ملاحظة: يضمن ربط الغرز الثلاث الأخيرة بعد وضع الثلاثة وجود مساحة كافية لوضع الغرز الأخيرة. - ضع خيوط جراحية مستمرة داخل الأدمة بطريقة مستمرة في الجلد. ابدأ الخيط داخل الأدمة 1-2 سم بشكل جانبي إلى موقع الشق ونفق تحت الجلد إلى الطبقة الجلدية من الجلد ولكن تحت سطحه (الشكل 6 ب) لتجنب الخدش المفرط وتخفيف الغرز. اربط عقدة على الطرف الجانبي للخياطة.
ملاحظة: يمكن إيقاف تشغيل البروبوفول والفنتانيل أثناء هذا الإجراء ، حيث أن لهما عدة دقائق من وقت الاستيقاظ. - ضع الخيط المستمر بين الغرز تحت الجلد حتى يتم الوصول إلى الجانب الآخر من الشق.
ملاحظة: من المهم أن تخرج الخيط من الأدمة ولكنها لا تخترق الجلد حتى يكون أقل قدرة على خدش الغرز. - نفق الخيط 1-2 سم جانبيا إلى الشق إلى موقع الخروج الجانبي واربط عقدة (الشكل 6 ب). ضع غراء الأنسجة على موقع الشق.
- عودة إلى حظيرة المنزل
- قم بإزالة الستائر المعقمة من ، وفطم عن جهاز التنفس الصناعي بمجرد ملاحظة الحركة.
- انقل إلى حظيرة المنزل واحتفظ به منفصلا عن رفيق القلم لليلة واحدة.
ملاحظة: يتم فصل الخنازير بعد الجراحة ، حيث من الطبيعي أن تحاول بعنف إيقاظ رفيقها في القلم ، مما يؤدي إلى جروح العض. يجب أن تكون الخنازير قادرة على ملامسة الخطم.

الشكل 3: زرع نافذة الجمجمة. (أ) يتم تحديد الموقع المتوقع لنقطة بريجما وتمييزه على الخنزير قبل اللف المعقم ، حيث قد يكون من الصعب تمييز ذلك بعد ذلك. (ب) بعد شق الجلد ، يتم فك الجلد تحت الجلد باستخدام المقص. (ج) يتم حفر ثقب قطره 15 مم في الجمجمة ، وإزالة الحواف باستخدام rongeurs. يتم تمييز خطوط الخياطة الإكليلية والسهمية. (د) يتم زرع نافذة الجمجمة وتثبيتها باستخدام البراغي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: زرع الأسلاك الطرفية. (أ) يتم وضع إبرتين 23 جم في الجلد ويتم إدخال أسلاك Cooner من خلالها. (ب) تتم إزالة الإبر ، وتترك الأسلاك في الجلد المتصلة بالمحفز باستخدام مشابك التمساح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: إعداد التسجيل القشري. (أ) يتم وضع مصفوفة الأقطاب الكهربائية على الجافية ، ويكون حامل المسرح والمعالج الدقيق في غلاف معقم أثناء جراحة الزرع ، حيث يكون الشق أطول وأكثر جانبيا. (ب) لقطة مقربة ل μECoG في إعداد التسجيل أثناء جراحة الوصول ، حيث يكون الشق أكثر وسطية. (ج) إعداد التأريض ، حيث يتم تقصير جميع أسلاك التأريض والمرجعية على ECoG وتوصيلها عبر موصل U بالمسمار المحيط بالجمجمة. (د) لقطة مقربة لمنصة الرأس وحامل المسرح أثناء جراحة الوصول. يتم وضع μECoG على الجافة. الاختصارات: ECoG = القشرة الكهربائية. μECoG = microECoG. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: تقنية الخياطة. (أ) تخطيطي لتقنية المرتبة العمودية المدفونة تحت الجلد. (ب) تخطيطي لتقنية الخياطة المستمرة داخل الأدمة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. جراحة الوصول (المرحلة الثانية)
ملاحظة: بعد 2-4 أسابيع ، يتم فتح نافذة الجمجمة لإجراء تسجيلات متابعة للإشارات القشرية من S1. يتم إجراء الجراحة وإغلاق الجرح مرة أخرى بطريقة يمكن الوصول إلى نافذة الجمجمة وإغلاقها مرة أخرى.
- التحضير للجراحة
ملاحظة: تتشابه الخطوات 2.1.1-2.1.6 مع الخطوات 1.1.1.1-1.1.6.- تهدئة باستخدام خليط الزوليتيل (5 مل من الزوليتيل [تيليتامين 25 مجم / مل وزولازيبام 25 مجم / مل] ، 6.25 مل من الزيلازين (20 مجم / مل) ، و 2.5 مل من البوتورفانول (10 مجم / مل)).
ملاحظة: في هذه الدراسة بالذات ، تم حذف الكيتامين من خليط الزوليتيل لتجنب حجب مستقبلات NMDA. - انقل إلى غرفة الجراحة وقم بتنبيبه وتهويته.
- ضع قسطرة وريد الأذن. قم بإعطاء البروبوفول والفنتانيل والمحلول الملحي عبر القسطرة.
- إدارة التخدير الجراحي: سيفوفلوران 1-2٪ ، بروبوفول (10 مجم / مل منقوع عند 8 مجم كجم -1 ساعة -1) ، الفنتانيل (50 ميكروغرام / مل منقوع عند 20 ميكروغرام كغ -1 ساعة -1).
- إذا لزم الأمر ، ضع علامة على موقع الشق باستخدام قلم معقم قبل اللف المعقم. تحديد نقطة بريجما عن طريق رسم خطوط مستقيمة بين كل أذن والعين المقابلة ؛ بريجما عند تقاطع تلك الخطوط (الشكل 3 أ).
ملاحظة: عادة ما يكون الشق الأولي مرئيا. يجب وضع الشق الجديد على بعد 30 مم على الأقل من الشق الأولي لتجنب معظم الأنسجة الندبية وتسهيل إغلاق الجرح. - ضع اللوح المعدني تحت الستائر وتأكد من وضعه وثباته بشكل صحيح قبل بدء الجراحة.
- تهدئة باستخدام خليط الزوليتيل (5 مل من الزوليتيل [تيليتامين 25 مجم / مل وزولازيبام 25 مجم / مل] ، 6.25 مل من الزيلازين (20 مجم / مل) ، و 2.5 مل من البوتورفانول (10 مجم / مل)).
- الوصول إلى نافذة الجمجمة
ملاحظة: تتشابه الخطوات 2.2.1-2.2.3 مع الخطوات 1.1.2.1-1.1.2.3.- قم بعمل شق أولي في الأدمة بمشرط جانبي قليلا إلى خط الوسط كما هو موضح في الخطوة 2.1.5. استمر في الشق عبر الجلد باستخدام الكي.
ملاحظة: في حالة إجراء تجربة نهائية ، يمكن إجراء الشق في نفس موقع الشق الأصلي. - ضع الضام وامسك الجلد باستخدام ملقط وقم بقطع النسيج الضام اللاوعائي بين السمحاق وتحت الجلد (الشكل 3 ب) لتوفير مزيد من المرونة للجلد وتسهيل الخياطة في الخطوة 1.4. اضبط الضام على المرونة التي تم اكتسابها.
ملاحظة: إذا كانت هذه تجربة نهائية، فيمكن حذف هذه الخطوة. - قم بشق السمحاق وفكه من الجمجمة باستخدام مصعد السمحاق. أمسك السمحاق جانبا باستخدام الضام.
- قم بإزالة غطاء نافذة الجمجمة وإزالة أي ضام من الفتحة باستخدام حركات دائرية لطيفة باستخدام برعم قطني حتى الوصول إلى الجافة.
- قم بعمل شق أولي في الأدمة بمشرط جانبي قليلا إلى خط الوسط كما هو موضح في الخطوة 2.1.5. استمر في الشق عبر الجلد باستخدام الكي.
- زرع الأسلاك الطرفية
- كرر الخطوة 1.2.
- تسجيل الإشارات القشرية
- كرر الخطوة 1.3.
- إغلاق موقع الزرع
- كرر الخطوة 1.4.
ملاحظة: إذا كانت هذه تجربة نهائية، فيمكن حذف هذه الخطوة.
- كرر الخطوة 1.4.
3. الجراحة النهائية (المرحلة الثالثة)
ملاحظة: بعد 2-4 أسابيع ، يتم فتح نافذة الجمجمة لإجراء تسجيلات متابعة للإشارات القشرية من S1. تتكرر الخطوات 2.2-2.5 ، كما هو موضح أعلاه ، متبوعة بالخطوة 3.1.
- القتل الرحيم
ملاحظة: يجب شطف أنبوب قسطرة وريد الأذن بالمحلول الملحي لمنع أكسدة الباربيتورات.- اغسل قسطرة وريد الأذن بالمحلول الملحي.
- إرفاق حقنة بجرعة زائدة من البنتوباربيتال (10 مل ، 400 مجم / مل) وحقن البنتوباربيتال عبر قسطرة وريد الأذن.
النتائج
باستخدام تقنية نافذة الجمجمة ، تم تسجيل الإشارات القشرية في 43 جلسة في 16. شفيت بشكل مناسب بعد الجراحة وتم إيواؤها طوال الدراسة ومراقبتها يوميا باستخدام مخطط الرعاية الاجتماعية في الجدول التكميلي S1. حصلت جميع على درجة 0 في جميع الأوقات ، مما يشير إلى رفاهية ممتازة. يوضح الشكل 7 أن النوافذ تم وضعها بالفعل فوق منطقة S1 من قشرة الخنازير. عادة ما لوحظ بعض الندوب على الجافية في الجسم الحي وما بعد الوفاة (الشكل 7 أ) ، لكن فحص ما بعد الوفاة كشف أنه لم يؤثر أبدا على الأنسجة القشرية الأساسية (الشكل 7 ب) ، والتي بدت صحية في جميع ويمكن مقارنتها بمنطقة S1 المقابلة.

الشكل 7: وضع النافذة القشرية فيما يتعلق بتشريح الدماغ. (أ) للتحقيق في صحة الأنسجة القشرية ووضع النافذة القشرية بالنسبة إلى S1 ، تمت إزالة نافذة الجمجمة في نهاية الدراسة. تم استخدام فترات الجراحة لمدة أسبوعين في هذه الحالة ، ويمكن ملاحظة بعض الأنسجة الندبية على الجافية. (ب) يبدو أن أنسجة المخ الأساسية سليمة وغير متأثرة بالزرع. (ج) يظهر تراكب الصورتين أن الغرسة غطت بالفعل منطقة S1 من قشرة الخنزير. يشير السهم إلى المحور الأمامي الخلفي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
باختصار ، لتحليل الإشارات القشرية ، يجب تصفيتها لإزالة ضوضاء الخط وغيرها من القطع الأثرية (انظر الشكل 8 والجدول 1). يتم استخدام مرشح الشق حول تردد ضوضاء الخط ، وهو 50 هرتز في أوروبا والتوافقيات الخاصة به. ثم يتم ترشيح الإشارات بتمرير عال لإزالة القطع الأثرية للحركة ذات الإزاحة والتردد المنخفض. يعتمد الحد الأقصى لتردد القطع على الغرض من التسجيلات ، ولكن لا ينصح بأعلى من 5 هرتز ، لأن هذا سيخفف من ميزات تخطيط موارد المؤسسات ومخطط كهربية الدماغ التلقائي. علاوة على ذلك ، يتم استخدام مرشح التمرير المنخفض لإزالة أي ضوضاء عالية التردد. نظرا لوضع القطب الكهربائي فوق الجافية ، فإن الترددات العالية تضعف قليلا بواسطة الأنسجة بين الدماغ والقطب18. لذلك ، يمكن أن يكون تردد القطع أقل مما كان عليه عندما يكون القطب الكهربائي موجودا مباشرة على أنسجة المخ.
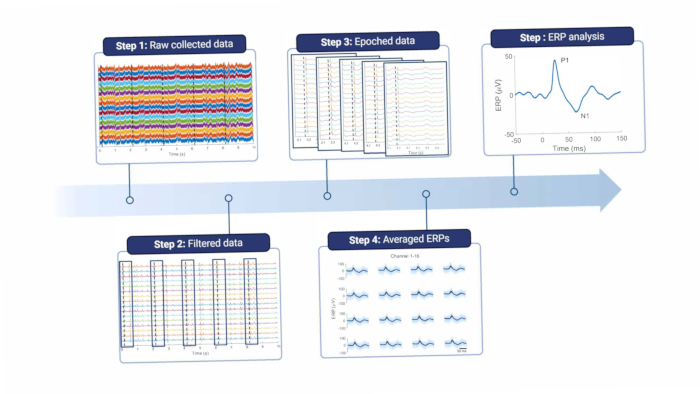
الشكل 8: خط أنابيب معالجة البيانات. تتم معالجة البيانات الأولية التي تم جمعها (الخطوة 1) عن طريق التصفية (الخطوة 2). ثم يتم تقسيمها إلى حقب بناء على محفزات التحفيز (الخطوة 3) ، والتي يتم حسابها في المتوسط (الخطوة 4). ويستعمل متوسط تخطيط موارد المؤسسات لتحليل البيانات (الخطوة 5). الاختصار: ERPs = الإمكانات المتعلقة بالحدث. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| نوع الفلتر | قطع نموذجي | ترتيب نموذجي | قطع مستعملة | طلب مستعمل |
| فرض | 50±3 هرتز أو 60±3 هرتز | ترتيب عالي | 50±3 هرتز و | 10الدرجة |
| والتوافقيات | التوافقيات ±1 هرتز | |||
| تمريرة عالية | 0.1-5 هرتز | ترتيب منخفض | 1-5 هرتز | 2الترتيب |
| تمرير منخفض | 100-1000 هرتز | ترتيب منخفض | 300 هرتز | 2الترتيب |
الجدول 1: خصائص المرشح النموذجية لتحليل إشارات الدماغ السطحية المسجلة باستخدام القشرة الكهربائية أو أقطاب كهربية الدماغ.
تنقسم البيانات التي تمت تصفيتها إلى فترات تتراوح من 50 إلى 100 مللي ثانية قبل التحفيز و500-1,000 مللي ثانية بعد التحفيز. تتم إزالة القنوات الصاخبة من البيانات (الشكل 9 أ) ، وتتم إزالة العصور الملوثة بالقطع الأثرية (الشكل 9 ب). يتم حساب متوسط الحقب المتبقية الخالية من القطع الأثرية لكل قناة. غالبا ما يمكن تمييز الاستجابات المستحثة في عمليات مسح فردية. تصبح هذه أكثر وضوحا واتساقا عندما يتم حساب متوسط 10 ردود على الأقل ولا تتغير عند حساب متوسط أكثر من 25. يجب أن يكون هناك ما لا يقل عن 20 حقبة خالية من القطع الأثرية للحصول على متوسط موثوق. هذا هو الحال عادة ، وفي أكثر من نصف مجموعات البيانات ، لم يكن من الضروري إزالة أي حقب. لتسهيل المقارنة بين تخطيط موارد المؤسسات المسجلة خلال المراحل المختلفة (عمليات الزرع ، الوصول ، جراحات القتل الرحيم) ، عادة ما يتم تطبيع البيانات z-score لحساب الاختلافات في عمق التخدير ونشاط الخلفية.

الشكل 9: أمثلة على القنوات والعصور السيئة. (أ) الإشارات من التسجيلات فوق الجافية على مساحة صغيرة نسبيا من الدماغ لها خصائص متشابهة ولكن اتساعات مختلفة. يمكن تمييز القنوات المعطلة بسهولة من خلال افتقارها إلى شكل موجة تخطيط موارد المؤسسات. بالإضافة إلى ذلك ، قد تعرض القنوات قطع أثرية ومظهرا أكثر ضوضاء وسعة إشارة أكبر (القنوات 9 و 10 و 13). القناة 7 هي مثال آخر على القناة المعطلة ولا تلتقط أي إشارة أو ضوضاء. (ب) يصل اتساع تخطيط موارد المؤسسات المتوقع إلى حوالي 100 ميكرو فولت. عادة ما يكون للعصور الصاخبة سعة أكبر ، مما قد يؤثر على متوسط شكل موجة تخطيط موارد المؤسسات وبالتالي يجب إزالته. يفتقر شكل موجة ERP النموذجي إلى هذه ، لكن هذا الشكل الموجي لا يمكن تمييزه دائما في حقب فردية. الاختصار: ERP = الإمكانات المتعلقة بالحدث. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
كانت موثوقية ERPs المسجلة باستخدام تقنية نافذة الجمجمة عالية من حيث سعة الذروة وزمن الوصول19. لم يتم العثور على فروق يعتد بها في سعة الذروة (التسجيل 1: 17.9 ± 7.26 ميكروفولت ؛ التسجيل 2: 17.6 ± 10.1 ميكروفولت ؛ التسجيل 3: 14.0 ± 6.95 ميكروفولت) والتباين بين القنوات (التسجيل 1: 6.47 ± 8.36 ميكروفولت ؛ التسجيل 2: 3.93 ± 6.13 ميكروفولت ؛ التسجيل 3: 3.84 ± 3.71 ميكروفولت) في تحليل التباين المقاس المتكرر (RM-ANOVA). تم العثور على اختلاف كبير في ذروة زمن الوصول بين التسجيلات الأولى وتسجيلات المتابعة. كانت الذروة بعد 1 مللي ثانية في التسجيل الأول مقارنة بتسجيلات المتابعة (التسجيل 1: 25.2 ± 2.0 مللي ثانية ؛ التسجيل 2: 24.0 ± 2.4 مللي ثانية ؛ التسجيل 3: 24.1 ± 2.0 مللي ثانية) ، والتي قد تكون مرتبطة بتطور الجهاز العصبي20،21 ، حيث تم استخدام خنازير السلالات المحلية المراهقة في هذه الدراسة.
تم استخدام تقنية نافذة الجمجمة أيضا للتحقيق في تأثير التحفيز عالي التردد (HFS) على ERPs. يتسبب HFS في تقوية طويلة الأمد للخلايا العصبية للقرن الظهري السطحي في القوارض22،23 ، وزيادة حساسية الألم ، وزيادة استجابات الدماغ المستحثة لدىالبشر 24،25. لوحظت زيادة كبيرة في اتساع ذروة N1 للإمكانات المرتبطة بالحدث (زيادة 259 ± 107٪ مقارنة بخط الأساس قبل التدخل) ، ويمكن تمييز فرق واضح بين HFS والتجارب التي لم يتم فيها تطبيق HFS في نفس (الشكل 10) 17.
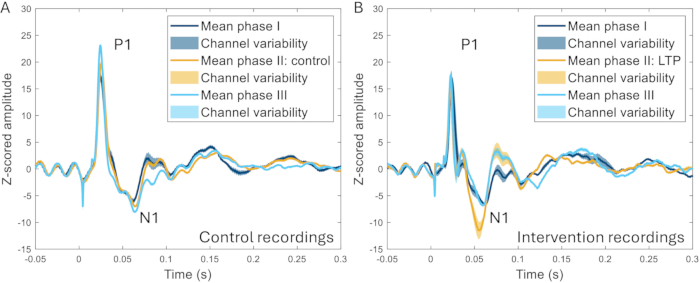
الشكل 10: أمثلة على تخطيط موارد المؤسسات في المتوسط عبر جميع القنوات المسجلة قبل 2-3 أسابيع من وأثناء وبعد 2-3 أسابيع من تحريض نموذج الألم. (أ) يظهر تخطيط موارد المؤسسات الذي تم جمعه من نفس خلال ثلاثة تسجيلات مختلفة بفارق أسبوعين خصائص متشابهة جدا. (ب) تتميز أنظمة تخطيط موارد المؤسسات بخصائص متشابهة بين التسجيلات ، لكن N1 له سعة أكبر بعد تحريض التقوية طويلة الأجل في المرحلة الثانية مقارنة بالمراحل الأخرى التي تتراوح بين 3-4 أسابيع قبل المرحلة الثانية وبعدها. تشير المناطق المظللة إلى الانحراف المعياري عبر القنوات. الاختصارات: ERPs = الإمكانات المتعلقة بالحدث. LTP = التقوية طويلة الأجل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي S1: مخطط الرفاهية لتسجيل السلوك الانفرادي والاجتماعي للخنازير. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تكمن أهمية تطوير هذه التقنية في إزالة أوضاع فشل القطب الكهربائي ، وتقليل استجابات الأنسجة ، وبالتالي تحسين موثوقية تقنيات التسجيل القشرية الغازية. لم تحدث أي أوضاع لفشل القطب الكهربائي أثناء الدراسة ، وتم استخدام ما مجموعه مصفوفتان من ECoG طوال الدراسة ، بما في ذلك 16 و 43 جلسة تسجيل. هذا له تأثير إيجابي إضافي على اقتصاد البحوث. باستخدام الطرق التقليدية المزروعةبالكامل 12،26،27 ، ستكون هناك حاجة إلى ما لا يقل عن 16 مصفوفة ECoG على افتراض عدم حدوث أعطال في الجهاز. ومع ذلك ، لا تزال أنماط الفشل واستجابات الأنسجة تشكل تحديات كبيرة للتنفيذ الواسع النطاق لتسجيل الدماغداخل الجمجمة 11،12،13،28،29. خفضت هذه الدراسة بشكل كبير عدد الأقطاب الكهربائية ، وبالتالي تقليل تكلفة ومخاطر دراسات علم الأعصاب المزمنة في نفس الوقت.
الحدث السلبي الوحيد الذي حدث مع زراعة نافذة الجمجمة هو الالتهابات العرضية في العمليات الجراحية المبكرة. كانت هذه الالتهابات دائما سطحية (لا تصل إلى مستوى الجافية) وتم حلها عن طريق زرع إسفنجة مضاد حيوي قابل للامتصاص Genta-coll. نظرا لفعالية هذا العلاج ، تم اعتماد زرع إسفنجة المضاد الحيوي كجزء من زرع نافذة الجمجمة كإجراء وقائي. على الرغم من كون الخنازير قوية تؤدي سلوك التجذير ، إلا أنه لم يتم كسر أي من الغرسات المصنوعة من جيش التحرير الشعبى الصينى القياسي.
تخضع جميع الأقطاب الكهربائية المزروعة لاستجابة جسم غريب ، وتغليف الدبقي أو الليفي14،15،28،29،30. هذا يعني أن واجهة القطب والأنسجة ، بالإضافة إلى قدرة تسجيل القطب ، تتغير بمرور الوقت بعد الزرع13،18،28. باستخدام الطريقة الحالية ، لم تؤثر استجابات الأنسجة على سلامة ودقة تسجيل الأقطاب الكهربائية بسبب استراتيجية وضع القطب الكهربائي المؤقت. تم وضع القطب الكهربائي على الجافية خلال كل جلسة ، وبالتالي كانت واجهة القطب الكهربائي والأنسجة قابلة للمقارنة خلال كل جلسة. العامل الوحيد الذي يمكن أن يختلف قليلا في كل جلسة هو موضع القطب. لذلك ، من الأهمية بمكان مطابقة حجم النافذة مع حجم القطب الكهربائي والتقاط صور لموضع القطب الكهربائي خلال كل جلسة تسجيل. وبهذه الجهود، تم تسجيل19 تخطيط موارد للموارد (ERP) الموثوق به والقابل للتكرار.
حدثت استجابة الأنسجة لزرع نافذة الجمجمة ، ولوحظت إعادة نمو العظام في الطيارين الأوائل باستخدام نافذة عبر الجمجمة بدون جدران تمتد من السطح الخارجي للجمجمة إلى الجافية. تم العثور على طبقة مستمرة من الأنسجة العظمية الرخوة بعد أسبوعين من الجلسة الأولى ، مما يشير إلى إعادة نمو العظام. كان من المستحيل إزالة هذا النسيج والوصول إلى الجافية. لذلك ، تمت إضافة الجدران الرأسية الممتدة من سطح الجمجمة إلى الجافية31 إلى نافذة الجمجمة. تمت طباعة النوافذ بأطوال الجدران المختلفة لتتناسب مع الغرسة مع سمك الجمجمة لتجنب الضغط على القشرة. تم التحقيق في بعد القتل الرحيم ، والذي كشف عن ظهور أنسجة المخ الصحية في جميع. لا تزال الأنسجة الرخوة تتشكل داخل منطقة النافذة. ومع ذلك ، فإنه لا يعلق على الحائط وليس مستمرا مع الجمجمة ، مما يجعل من السهل إزالته باستخدام برعم قطني. من الأهمية بمكان لموثوقية التسجيلات إزالة هذه الأنسجة الرخوة من النافذة بحيث يتم وضع القطب الكهربائي على الجافية في كل مرة.
يتم الحصول على النتائج المثلى في غضون 3 أسابيع على الأقل بين العمليات الجراحية. في أسبوعين ، يمكن الوصول إلى نافذة الجمجمة ، ولكن يتم توصيل الأنسجة الرخوة في منطقة النافذة بالجافية. علاوة على ذلك ، فإن فتح الجرح وإغلاقه معقد بسبب النزيف ونقص المرونة في الأنسجة. في 3 و 4 أسابيع ، يلتئم الجرح الشق بشكل كاف بحيث تكون حدود الأنسجة الطبيعية (مثل السمحاق والجلد والجافة) مميزة ، مما يجعل من السهل إزالة الأنسجة الرخوة من النافذة وإعادة إغلاق الجلد فوق الغرسة. نظرا لعدم ملاحظة أي نسيج شبيه بالعظام على فترات 4 أسابيع ، فقد يكون من الممكن أكثر من 4 أسابيع بين العمليات الجراحية وجراحات الوصول المتعددة. لم نحقق فيما إذا كان يمكن تمديد الفترة الفاصلة بين العمليات الجراحية إلى عدة أشهر.
لنجاح جراحات الزرع والوصول ، يعد الشق الأولي وإغلاق الجرح أمرا بالغ الأهمية. مرونة جلد جبهة الخنزير محدودة للغاية ، وهذا هو السبب في أن تخفيف الطبقة اللاوعائية تحت الجلد أمر ضروري. يوفر ذلك مرونة إضافية لإغلاق الجلد فوق الغرسة ويقلل من الضغط على الغرز. يتم تقليل هذا الضغط بشكل أكبر باستخدام طبقتين من الغرز وغراء الجلد الإضافي. يتم خياطة الجلد باستخدام تقنية خياطة داخل الأدمة المستمرة لتجنب خدش للجروح وإزالة الغرز قبل الأوان. تعتبر استراتيجيات فتح الجرح وإغلاقه أمرا بالغ الأهمية في كلا النوعين من جراحة البقاء على قيد الحياة ، سواء كانت عملية زرع أو جراحة وصول.
أحد قيود النهج الحالي هو أن الوصول إلى النافذة يتطلب جراحة بسيطة ، مما يمنع التسجيلات في المستيقظة. هذا يعني أنه ، اعتمادا على سؤال البحث ، لن يكون نهجا مناسبا لكل دراسة. لاستخدام الأجهزة المزروعة بالكامل في التسجيلات المستيقظة ، توجد طرق أخرى للتغلب على التغيرات البيولوجية في الواجهة32. نظرا لأن الوصول إلى نافذة الجمجمة هو إجراء صغير ، فقد يكون من الممكن استخدام مخدر موضعي ومهدئ بدلا من التخدير العام. تتمثل مزايا وجود نافذة الجمجمة بالكامل تحت الجلد في تقليل فرص الإصابة بالعدوى وتحسين رفاهية ، حيث يمكن أن تكون في زوج أو جماعة. علاوة على ذلك ، قمنا فقط بالتحقيق في موثوقية الاستجابات المستحثة19. ومع ذلك ، فقد تم تسجيل نشاط الدماغ التلقائي وهو بشكل عام أكثر موثوقية وقابلية للتكرار من ERP8 ، مما يشير إلى أن الطريقة لا تقتصر على تسجيل تخطيط موارد المؤسسات.
تقدم طريقتنا طريقة جديدة وقابلة للتطوير وموثوقة وقابلة للتكرار للتسجيلات القشرية المزمنة. هذه الطريقة ذات قيمة عالية لدراسات أبحاث علم الأعصاب ، حيث تكون الموثوقية والاستنساخ ضروريين لنتائج الدراسات33،34. لقد استخدمنا الطريقة للتحقيق في الاستجابات القشرية المستحثة من S1 قبل وبعد تحريض نماذج الألم المختلفة والضوابط ، مما أظهر نتائج قوية17. بشكل عام ، يمكن تكييف الطريقة بسهولة للوصول إلى المناطق القشرية الأخرى ، على سبيل المثال ، للتحقق من الحركة أو السمع أو الرؤية. قد يكون من الممكن أيضا استخدام الطريقة لتشخيص الصرع4،35 أو مراقبة العلاج وإعادة التأهيل بعد إصابة الدماغ36،37.
هذه الطريقة قابلة للتطوير أيضا لتشمل الأنواع الأخرى ، مثل الرئيسيات غير البشرية أو الثدييات الأخرى أو القطط أو أو الأغنام35،38،39. سيتطلب كل من هذه التعديلات تعديل التقنية الجراحية ، وتحديد المعالم الموثوقة لوضع نافذة الجمجمة ، وتعديل تصميمها. يوصي المؤلفون باستخدام الجثث لتحسين تقنية نافذة الجمجمة قبل الشروع في الاختبار التجريبي. بالنسبة لمناطق معينة من الدماغ، قد تكون الجراحة أكثر توغلا، مما قد يؤدي إلى وقت تعافي مثالي مختلف عما نوصي به. علاوة على ذلك ، يمكن تكييف هذه التقنية لتمكين تسجيلات ECoG تحت الجافية والتسجيلات داخل القشرة ، وبالتالي توسيع تطبيقاتها وزيادة الوصول إلى مناطق الدماغ المختلفة. نظرا لسمك جمجمة الخنازير ، قد يكون من الضروري زيادة حجم النافذة القشرية لإجراء بضع التحمل للتسجيلات تحت الجافية26،27.
بالنسبة للتسجيلات داخل القشرة ، من الممكن وضع القطب الكهربائي عبر قنية أو مكوك40 ، مما يسمح بمزيد من التقليل من حجم النافذة القشرية. ستزيد كل من التقنيات تحت الجافية وداخل الجمجمة من خطر النزيف ، لذلك يجب توخي الحذر أثناء الجراحة لتجنب الأوعية الدموية. يمكن أيضا استخدام تقنية نافذة الجمجمة لأغراض أخرى غير تسجيل الإشارات الكهربائية من الدماغ ، على سبيل المثال ، تصوير الأوعية الدموية ، وهو أمر وثيق الصلة بنماذج الخنازير للصداع النصفي41. علاوة على ذلك ، يمكن تكييف طريقة نافذة الجمجمة للاستخدام مع تقنيات التصوير الجديدة31 ، مثل التصوير ثنائي الفوتون ، ويمكن دمجها مع البديل الجاففي الذي طوره Costine-Bartell et al. لتحسين الدقة البصرية42.
في الختام ، يقلل النهج المنهجي المقدم من المخاطر المتعلقة بالغرسة الدائمة12،13 من خلال القضاء على مخاطر فشل الجهاز ، وتقليل الاستجابات البيولوجية في موقع القطب الكهربائي ، وبالتالي زيادة دقة التسجيل ويؤدي إلى تسجيلات قشرية موثوقة للغاية. تحمل المنهجية أيضا وعدا كبيرا للتطبيقات الأخرى ، حيث إنها قابلة للتطوير لتشمل الأنواع الأخرى وأنواع التسجيل.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
يود المؤلفون أن يشكروا القائمين على رعاية والفنيين في منشأة المختبر في مستشفى جامعة ألبورغ. يتم دعم مركز المرونة العصبية والألم (CNAP) من قبل مؤسسة البحوث الوطنية الدنماركية (DNRF121). تم إنشاء الشكل 6 والشكل 8 في BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
References
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved