Method Article
慢性颅窗技术用于猪麻醉期间重复皮质记录
摘要
本研究提出了一种可扩展、可靠且可重复的方法,用于猪模型中重复的慢性皮质记录。该方法在神经科学的各个领域都有应用,包括疼痛研究和神经系统疾病诊断。
摘要
皮层记录对于提取神经元信号以通知各种应用至关重要,包括脑机接口和疾病诊断。每个应用都对记录技术提出了特定的要求,并且通常会选择侵入性解决方案进行长期记录。然而,侵入性记录方法受到设备故障和不良组织反应的挑战,这会影响长期信号质量。
为了提高慢性皮层记录的可靠性和质量,同时最大限度地降低与设备故障和组织反应相关的风险,我们开发了一种颅窗技术。在该协议中,我们报告了在幼年长白猪中植入和进入颅窗的方法,这有助于在硬脑膜上放置临时皮层电图 (ECoG) 阵列。我们进一步描述了如何使用颅窗技术记录皮层信号。颅窗入路可以重复多次,但建议在植入和入路手术之间至少间隔 2 周,以促进恢复和组织愈合。
颅窗方法成功地最大限度地减少了常见的电极失效模式和组织反应,从而随着时间的推移获得稳定可靠的皮质记录。我们以初级体感皮层的事件相关电位 (ERP) 为例。该方法提供了高度可靠的记录,这也允许评估干预(高频刺激)对 ERP 的影响。没有明显的设备故障和使用的电极数量减少(两个电极,43 个记录会话,16 只动物)表明研究经济性有所提高。虽然电极放置需要较小的手术通道,但该方法具有降低感染风险和改善动物福利等优点。
本研究提出了一种可扩展、可靠且可重复的慢性皮质记录方法,在神经科学的各个领域具有潜在应用,包括疼痛研究和神经系统疾病诊断。未来的适应可能会将其用途扩展到其他物种和记录方式,例如皮层内记录和成像技术。
引言
一般来说,皮层记录的目的是从大脑中的神经元信号中提取信息。这些信息可以以多种方式使用——控制外部设备、通信、疾病诊断或康复 1,2,3,4。每个应用程序对所需的信息内容和空间分辨率以及可接受的侵入量都有独特的要求。因此,自 1929 年发现脑电图以来,已经开发了具有一系列侵入性和空间分辨率的记录解决方案5。
通常,这些可分为脑电图 (EEG)、皮层电图 (ECoG) 和皮层内记录。EEG 是一种非侵入性记录方法,可从整个大脑捕获神经振荡和事件相关电位 (ERP)。但是,由于空间分辨率较低,其定义此活动源的能力受到限制。ECoG 是一种更具侵入性的方法,其中电极放置在硬膜外或硬膜下,通常覆盖皮层的较小部分。它具有更高的空间分辨率,可以记录 ERP 和表面局部场电位 (LFP)。因此,它可以更精确地定位大脑活动的来源,这使得它有助于识别局灶性癫痫的来源。皮层内记录是最具侵入性的记录方法,可以记录位于大脑浅表或深处的单个神经元的尖峰活动,以及电极周围神经元体积的 LFP。这些信号具有非常高的空间分辨率和信息内容,但由有限的神经元子集(每个通道 1-10 个神经元)产生6。
为了长时间(数月至数年)从大脑中提取信息,界面必须稳定可靠,以便获取的信号在整个期间继续代表相同的信息。脑电图记录需要频繁更换电极,使其可靠性从非常低到非常高不等 7,8,9,10。因此,通常选择 ECoG 和皮质内方法进行长时间记录。然而,这些方法都要求记录电极和组织的状况必须随着时间的推移保持稳定。虽然电极通常保持在同一位置,但电极-组织界面可能会因组织反应或电极失效模式11、12、13、14 而发生变化。组织反应包括神经元死亡、出血、生物污染、异物反应、神经胶质增生、包膜、感染、脑膜炎和脑膜挤压15。这些反应损害了电极的记录能力12,13。常见的电极失效模式是绝缘部件分层或泄漏、电极表面涂层分层或开裂、导线损坏和电极位错11,12。
为了克服电极故障模式,我们考虑了临时电极放置解决方案的可行性,该解决方案还解决了与组织反应相关的许多挑战,即神经元死亡、异物反应、神经胶质增生、包膜和脑膜挤压。此外,一致的电极放置是实现可靠和可重复的神经元记录的要求。由于电极被硬膜外放置在距离神经组织几毫米的位置,因此电极的运动不应超过 1 毫米。颅窗的尺寸设计可防止电极放置之间过度移动。随着颅窗技术的发展,我们的目标是提高长期信号的可靠性和质量,并消除电极故障的风险。
研究方案
该协议已获得丹麦食品、农业和渔业部下属的丹麦兽医和食品管理局的批准(协议编号 2020-15-0201-00514)。共有 16 头雌性地方品种猪接受了这些手术。动物到达设施时重约 20 公斤,这意味着它们大约有 2 个月大。它们在植入时重约 30 公斤,在研究结束时重 40-60 公斤。这些手术包括植入手术、通路手术和终末手术(图 1)。

图 1:实验程序的时间表。 通路手术(第二阶段)可以重复几次。建议在手术之间至少间隔 2 周进行恢复和手术之间的伤口愈合。缩写: ERP = event-related potential。 请单击此处查看此图的较大版本。
1. 植入手术(第一阶段)
注意:植入 3D 打印的聚乳酸 (PLA) 颅窗(图 2)以促进猪初级体感皮层的重复记录。记录由于尺神经电刺激引起的 ERP。进行手术和伤口闭合,以便随后可以进入和关闭颅窗。
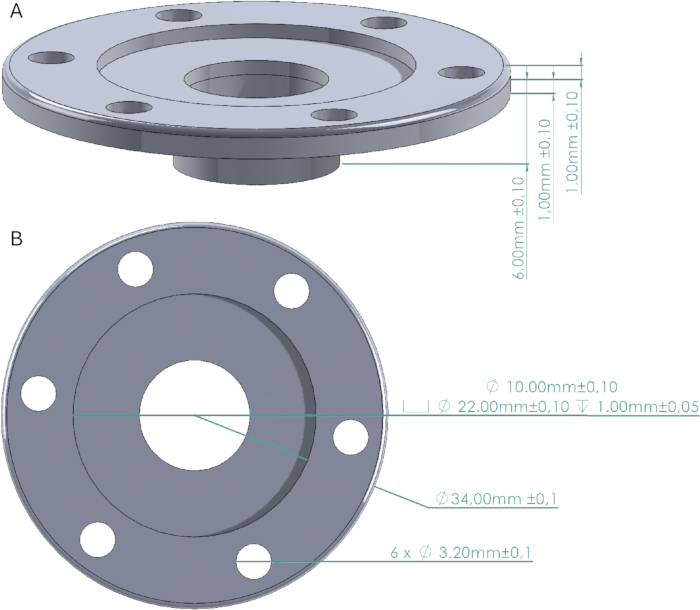
图 2:颅窗设计。 (A) 颅窗的侧视图,显示了壁的高度和固定在颅骨上的底座。(B) 俯视图,显示颅寡妇的直径、螺丝孔、帽空间和窗口。颅窗盖是一个直径为 22 mm 的圆柱体,高度为 1 mm,可精确安装在颅窗盖空间内。 请单击此处查看此图的较大版本。
- 颅窗植入术
- 手术准备
注意: 数据处理器 (RZ2)、工作站 (WS8) 和 PC 在手术开始前已打开。非无菌研究人员至少每 15 分钟在电子表格上记录一次手术记录,以记录生命体征(心率、spO2、呼气末 CO2、核心温度)、麻醉水平(异丙酚输注速率、芬太尼输注速率、七氟烷百分比)、手术阶段和任何不规则情况。- 肌肉注射 5-7 mL Zoletil 混合物(1 mL 含有 8.3 mg Tiletamine、8.3 mg Zolazepam、8.3 mg Xylacin 和 1.7 mg Butophanol)使动物镇静。
注意:对于这项特定研究,Zoletil 混合物中省略了氯胺酮,以避免阻断 NMDA 受体。 - 将动物运送到手术室。给动物插管并将其连接到机械呼吸机。
- 放置耳静脉导管以施用异丙酚、芬太尼和生理盐水。
- 手术麻醉:七氟烷 1-2%、异丙酚(10 mg/mL 以 8 mg∙kg-1∙h-1 输注)、芬太尼(50 μg/mL 以 20 μg∙kg-1∙h-1 输注)。
- 在无菌悬垂之前,使用无菌标记标记切口部位。通过在每只耳朵和对侧眼之间画直线来确定前囟点;前囟点位于这些线的交点(图 3A)。确保切口在受刺激前肢对侧的中线略微外侧。
- 在开始手术之前,将金属板放在窗帘下,并确保正确放置和稳定性。
- 肌肉注射 5-7 mL Zoletil 混合物(1 mL 含有 8.3 mg Tiletamine、8.3 mg Zolazepam、8.3 mg Xylacin 和 1.7 mg Butophanol)使动物镇静。
- 进入颅骨
注意:在协议的这一部分和以下部分中,除非另有说明,否则所有程序均由无菌外科医生执行。- 用手术刀在真皮上做初始切口,略偏向中线,如步骤 1.1.1.5 所示。用烧灼器继续穿过皮肤切开。
注意:不要将切口向前延伸太远,以避免猪的大额窦。如果需要更多空间,请延长后侧的切口。 - 放置牵开器并使用镊子托住皮肤,并切开骨膜和皮下之间的无血管结缔组织(图 3B),为皮肤提供更大的灵活性,并在步骤 1.4 中简化缝合。调整牵开器以获得的灵活性。
- 切开骨膜并使用骨膜升降机将其从颅骨中松开。使用牵开器将骨膜放在一边。
- 用手术刀在真皮上做初始切口,略偏向中线,如步骤 1.1.1.5 所示。用烧灼器继续穿过皮肤切开。
- 进入硬脑膜
- 在矢状缝合线正面和中线缝合线外侧钻一个直径为 10 毫米的孔(图 3C)。从 15 毫米的直径开始,在硬脑膜水平处形成直径为 10 毫米的孔,因为圆形钻头会产生略微锥形的孔。
- 尽早将颅窗安装到孔中,以确保良好贴合。
- 当硬脑膜可见时,切换到较小的钻头,以在硬脑膜水平达到孔的最大宽度。使用 Rongeurs 剪辑边缘。
- 颅窗植入术
- 确认颅窗适合孔的底部并直到孔的底部,并确定其深度。虽然这取决于动物,但请确保颅窗壁到达硬脑膜以良好贴合,但不要在任何位置对大脑施加压力。
- 在将颅窗固定到位的同时,用手钻标记螺丝孔。
- 取下颅窗并钻孔至少 4 毫米深。插入颅骨中的一个螺钉,将其用作皮质记录的接地/参考。
- 放置颅窗(图 3),然后从蝶形输液器中取出针头。使用钝蝶测量穿过颅窗的螺丝孔深度。将长度匹配的螺钉插入并固定到孔中。
注意: 太长的螺钉将无法有效拧紧颅窗盖。 - 将 U 型连接器放在一个螺钉下,该螺钉会穿孔颅骨并接触硬脑膜。
注意:重要的是,该螺钉的长度大于颅骨的厚度,这样再生的骨骼就不会阻止与硬脑膜的接触。
- 手术准备
- 外围线植入术
注意:该程序可以与颅窗植入同时进行。这是一个无菌程序。为防止手术部位或颅骨部位污染,应穿着无菌服装。- 在尺神经附近植入导线
- 用两根针(不穿透)或另一块相隔 2 cm 的无菌金属接触前肢后部远端的皮肤,以 5 mA 的电流对皮肤施加电刺激。寻找清晰的蹄屈,这表明神经在这两个点之间运行。
注意:肢体可能需要向后旋转,以便更容易接近后部。 - 将两根针垂直于神经走行插入,相距约 2 厘米。在距离插入点约 3 cm 处再次刺穿皮肤(图 4A)。
- 使用施加在针头上的 2 mA 测试刺激验证位置;确保可以看到蹄子的清晰运动。
- 将 Cooner 线穿过针头并取下针头,将 Cooner 线部分留在皮肤下。确保电线中间的未绝缘部分位于两根电线的皮肤下(图 4B)。
注意:如果肢体向后旋转,请小心地向前旋转。 - 将每个鳄鱼连接器连接到两根 Cooner 线的去隔离端。
- 用两根针(不穿透)或另一块相隔 2 cm 的无菌金属接触前肢后部远端的皮肤,以 5 mA 的电流对皮肤施加电刺激。寻找清晰的蹄屈,这表明神经在这两个点之间运行。
- 建立运动阈值
- 使用上下方法16,17 求运动阈值;从 100 μA 开始,以 50 μA 的步长增加,同时观察和感受蹄部区域的电机响应。低于 1 mA 的阈值通常是可行的。
- 对 STG 进行编程,以提供 100 个矩形双相对称刺激,脉冲宽度为 200 μs,速度为运动阈值的 2 倍,然后是 100 个脉冲,速度为运动阈值的 10 倍。
- 在尺神经附近植入导线
- 记录皮层信号
- 让非无菌研究人员将前置放大器安装到位,并使用光纤电缆将其连接到数据处理器 (RZ2)。
- 将七氟烷减少至 0.5-1%(手术水平的一半)并监测心率、呼出的 CO2 和血压(如果有),以确保足够和稳定的麻醉深度。根据需要增加异丙酚和芬太尼。
- 让非无菌研究人员将头台连接到前置放大器 (SI8) 上,并将(ZIF 夹)头台放在安装在磁力架显微纵器上的头台支架中。
- 将无菌悬垂物放在显微作器周围,并将粘合部分连接到头台和头台支架上(图 5A)。
- 让非无菌研究人员使用磁力架固定显微作器,将 μECoG 电极浸入酒精中,然后将其放入(ZIF 夹)头部。
注意:在将电极放在硬脑膜上之前,让电极干燥。确保只触摸覆盖在头部的无菌铺巾,因为 μECoG 电极不是无菌的。 - 使用显微作器和棉签引导将 μECoG 固定到位。使用鳄鱼皮连接器将 μECoG 的接地线连接到接地螺钉。
- 将七氟烷降至 0%,监测心率、呼出的 CO2 和血压(如果有)以确保麻醉深度足够和稳定,根据需要增加异丙酚和芬太尼。
- 在 synapse 中预览信号;典型信号范围高达 ±100 μV。
- 如果信号显示为 粗线 (表示线路噪声),请让无菌人员执行以下作:调查接地电路并保持接地螺钉和连接干燥并与附近的组织隔离。调查是否从猪体和手术器械中隔离出其他电缆。如果没有,请使用无菌纱布将电缆与身体或手术器械隔离开来。
- 如果信号幅度大于 ±100 μV(表明运动伪影),请确保电极悬浮并放在大脑上,并且当猪由于尺神经的通气或电刺激而移动时,电缆不会移动。
- 如果信号幅度小于 ± 20 mV(表明接触不良或深度麻醉),请确保 μECoG 位于大脑上,并且硬脑膜和电极是水合的;如果需要,在电极上滴一些盐水。确保已关闭七氟烷并降低异丙酚(可能还有芬太尼)的输注速度。执行测试刺激并检查是否可见诱发的反应。确保外围线的未绝缘部分完全位于皮肤下方。
注意:诱发的反应通常可以在在线单次扫描中区分,但也可以离线评估,平均采用 5-10 次刺激。如果在触发时可以看到峰值,则它是刺激伪影。刺激伪影会干扰数据分析。
- 将无菌纱布放在电极上,以保持良好的组织接触。在纱布上滴下体温盐水,以防止组织干燥。
注意:由于这些记录是硬膜外的,因此准确的温度不是必需的。对于硬膜下录音,这一点更为关键。 - 让电极稳定(30 分钟)并记录电极放置和接地连接器设置,以确保类似的后续记录(图 5B-D)。开始记录并等待 30 秒,然后每 10 分钟启动一次刺激程序。
注意:在两次记录之间定期检查电极上的纱布是否保持水分,并在必要时滴入体温盐水。 - 在三轮刺激后进行干预(作为干预前基线)。重复刺激再进行九轮。
注意:在两次记录之间继续定期检查电极上的纱布是否保持水分,并在必要时滴下盐水。
- 种植体部位闭合
- 从电极上取下纱布,使用显微作器取下电极,同时用棉签轻轻引导它。
- 让未消毒的研究人员取出并存放显微作器、电极、头部和前置放大器,并根据制造商的说明使用去离子水快速冲洗以去除组织残留物。将电极浸泡在镜头清洁剂中长达 4 小时,以去除电极表面的组织和蛋白质,然后用去离子水第二次冲洗,以从电极表面去除镜头清洁剂。存放前,将电极浸入异丙醇中。
- 放置颅窗帽以关闭颅窗,确保其与颅窗精确贴合。它不需要额外的紧固;从皮肤到植入物上的压力会将其保持在原位。
- 将抗生素袋放在颅窗帽的顶部,并使用埋地垂直床垫缝合技术用单根可吸收缝合线皮下闭合皮肤(图 6A)。将缝合线放置在 5-10 毫米的距离处,以便有空间放置皮肤缝合线。放置后不要系好最后三条缝合线。相反,在放置所有缝合线时系好这三条缝合线。
注意:在放置所有三根缝合线后系好最后三条缝合线可确保有足够的空间放置最后一条缝合线。 - 在皮肤中以连续的方式放置连续的皮内缝合线。在切口部位外侧 1-2 cm 处开始皮内缝合,并在皮肤下隧道到皮肤的真皮层,但低于其表面(图 6B),以避免缝合线过度划伤和松动。在缝合线的外侧打一个结。
注意:在此过程中可以关闭异丙酚和芬太尼,因为它们有几分钟的唤醒时间。 - 将连续缝合线放在皮下缝合线之间,直到到达切口的另一侧。
注意:缝合线从真皮中引出但不刺穿皮肤很重要,这样动物就不会刮伤缝合线。 - 将缝合线在切口外侧 1-2 cm 处挖到外侧出口部位并打结(图 6B)。将组织胶涂抹在切口部位。
- 动物归巢围栏
- 取下动物身上的无菌窗帘,一旦观察到运动,就立即让动物脱离呼吸机。
- 将动物转移到家庭围栏中,并将其与围栏伴侣分开一晚。
注意:猪在手术后被分开,因为它们猛烈地试图唤醒猪圈伙伴,导致咬伤是正常的。猪应该能够接触到鼻子。

图 3:颅窗植入。 (A) 在无菌悬垂之前,在猪身上确定并标记前囟点的预期位置,因为之后可能很难区分。(B) 皮肤切开后,用剪刀松弛缺血皮下组织。(C) 在颅骨上钻一个直径为 15 毫米的孔,并使用 rongeurs 去除边缘。冠状面和矢状面缝合线突出显示。(D) 颅窗植入并使用螺钉固定。 请单击此处查看此图的较大版本。

图 4:外围线的植入。 (A) 将两根 23 G 针放入皮肤中,并通过这些针插入 Cooner 线。(B) 取下针头,使用鳄鱼夹将电线留在连接到刺激器的皮肤中。 请单击此处查看此图的较大版本。

图 5:皮层记录设置。 (A) 电极阵列放置在硬脑膜上,在植入手术过程中,头部支架和显微作器位于无菌套筒中,切口更长、更侧向。(B) 在通路手术期间记录装置中 μECoG 的特写,其中切口更内侧。(C) 接地设置,其中 ECoG 上的所有接地线和参考线都短路并通过 U 型连接器连接到颅周螺钉。(D) 通路手术期间头部和头部支架的特写。将 μECoG 放置在硬脑膜上。缩写:ECoG = 皮层电图;μECoG = 微 ECoG。 请单击此处查看此图的较大版本。

图 6:缝合技术。 (A) 皮下埋入垂直床垫技术的示意图。(B) 连续皮内缝合技术的示意图。 请单击此处查看此图的较大版本。
2. 通路手术(第二阶段)
注意:2-4 周后,打开颅窗以对来自 S1 的皮质信号进行后续记录。手术和伤口闭合再次以可以进入和关闭颅窗的方式进行。
- 手术准备
注意:步骤 2.1.1-2.1.6 与步骤 1.1.1.1-1.1.1.6 类似。- 使用唑勒醇混合物(5 mL 唑勒醇 [平达胺 25 mg/mL 和唑拉西泮 25 mg/mL]、6.25 mL 甲苯噻嗪 (20 mg/mL) 和 2.5 mL 布托啡诺 (10 mg/mL))使动物镇静。
注意:对于这项特定研究,zoletil 混合物中省略了氯胺酮,以避免阻断 NMDA 受体。 - 将动物运送到手术室并插管和通气。
- 放置耳静脉导管。通过导管施用异丙酚、芬太尼和生理盐水。
- 手术麻醉:七氟烷 1-2%、异丙酚(10 mg/mL 以 8 mg∙kg-1∙h-1 输注)、芬太尼(50 μg/mL 以 20 μg∙kg-1∙h-1 输注)。
- 如果需要,在无菌悬垂之前使用无菌标记标记切口部位。通过在每只耳朵和对侧眼之间画直线来确定前囟点;前囟位于这些线的交汇处(图 3A)。
注意:初始切口通常仍然可见。新切口应放置在距离初始切口至少 30 毫米的位置,以避免大部分疤痕组织并简化伤口的闭合。 - 在开始手术之前,将金属板放在窗帘下,并确保正确放置和稳定性。
- 使用唑勒醇混合物(5 mL 唑勒醇 [平达胺 25 mg/mL 和唑拉西泮 25 mg/mL]、6.25 mL 甲苯噻嗪 (20 mg/mL) 和 2.5 mL 布托啡诺 (10 mg/mL))使动物镇静。
- 进入颅窗
注意:步骤 2.2.1-2.2.3 与步骤 1.1.2.1-1.1.2.3 类似。- 按照步骤 2.1.5 中标记的,用手术刀在中线略微外侧在真皮上做初始切口。用烧灼器继续穿过皮肤切开。
注意:在终端实验的情况下,可以在与原始切口相同的位置进行切口。 - 放置牵开器并使用镊子托住皮肤,并切开骨膜和皮下之间的无血管结缔组织(图 3B),为皮肤提供更大的灵活性,并在步骤 1.4 中简化缝合。调整牵开器以获得的灵活性。
注意:如果这是一个终端实验,则可以省略此步骤。 - 切开骨膜并使用骨膜升降机将其从颅骨中松开。使用牵开器将骨膜放在一边。
- 取下颅窗盖,用棉签轻轻打圈从开口处取下任何结缔剂,直到到达硬脑膜。
- 按照步骤 2.1.5 中标记的,用手术刀在中线略微外侧在真皮上做初始切口。用烧灼器继续穿过皮肤切开。
- 外围线植入术
- 重复步骤 1.2。
- 记录皮层信号
- 重复步骤 1.3。
- 种植体部位闭合
- 重复步骤 1.4。
注意:如果这是一个终端实验,则可以省略此步骤。
- 重复步骤 1.4。
3. 终末手术(III 期)
注意:2-4 周后,打开颅窗以对来自 S1 的皮质信号进行后续记录。如上所述,重复步骤 2.2-2.5,然后是步骤 3.1。
- 安乐死
注意:耳静脉导管的管道需要用生理盐水冲洗,以防止巴比妥酸盐氧化。- 用生理盐水冲洗耳静脉导管。
- 连接过量戊巴比妥(10 mL、400 mg/mL)的注射器,并通过耳静脉导管注射戊巴比妥。
结果
使用颅窗技术,在 43 只动物中记录了 16 个会话的皮质信号。动物在手术后适当愈合,并在整个研究过程中成对饲养,并使用 补充表 S1 中的福利计划每天进行监测。所有动物在任何时候都得到 0 分,表明福利非常好。 图 7 显示,窗户确实放置在猪皮层的 S1 区域上方。通常在 体内 和死后硬脑膜上观察到一些疤痕(图 7A),但尸检显示它从未影响到下面的皮质组织(图 7B),该组织在所有动物中都看起来很健康,并且与对侧 S1 区域相当。

图 7:皮质窗的位置与大脑解剖结构的关系。 (A) 为了研究皮质组织的健康状况和皮质窗相对于 S1 的位置,颅窗在研究结束时被移除。在这种情况下,手术间隔为 2 周,可以在硬脑膜上观察到一些疤痕组织。(B) 下面的脑组织看起来健康且不受植入物的影响。(C) 两张照片的叠加显示,植入物确实覆盖了猪皮层的 S1 区域。箭头表示前后轴。 请单击此处查看此图的较大版本。
简而言之,要分析皮质信号,必须对其进行过滤以消除线路噪声和其他伪影(参见 图 8 和 表 1)。在线路噪声频率周围使用陷波滤波器,在欧洲及其谐波中为 50 Hz。然后对信号进行高通滤波,以消除偏移和低频运动伪影;最大截止频率取决于记录的目的,但不建议高于 5 Hz,因为这会减弱 ERP 和自发性脑电图特征。此外,低通滤波器用于消除任何高频噪声。由于电极放置在硬脑膜的顶部,因此高频被大脑和电极18 之间的组织略微衰减。因此,截止频率可能低于电极直接位于脑组织上时。
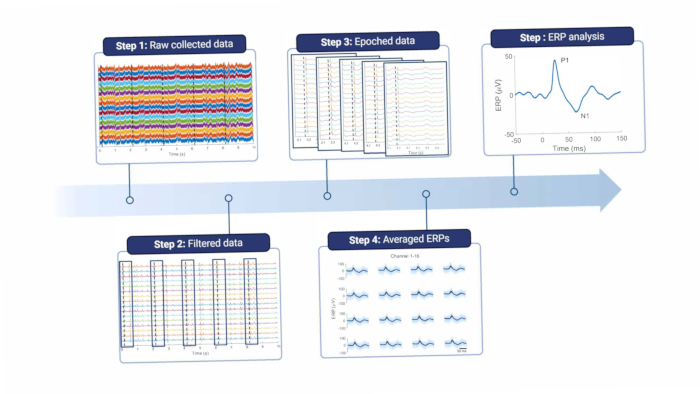
图 8:数据处理管道。 原始收集的数据(步骤 1)通过筛选(步骤 2)进行处理。然后,根据刺激触发因素(第 3 步)将它们划分为纪元,这些纪元被平均(第 4 步)。平均 ERP 用于数据分析(步骤 5)。缩写:ERPs = 事件相关电位。 请单击此处查看此图的较大版本。
| 过滤器类型 | 典型截止值 | 典型顺序 | 已使用的截止值 | 二手订单 |
| 缺口 | 50±3 Hz 或 60±3 Hz | 高阶 | 50±3 Hz 和 | 第 10 阶 |
| 和谐波 | 谐波 ±1 Hz | |||
| 高通 | 0.1-5 赫兹 | 低阶 | 1-5 赫兹 | 2阶 |
| 低通 | 100-1000 赫兹 | 低阶 | 300 赫兹 | 2阶 |
表 1:用于分析用皮层电图或脑电图电极记录的表面脑信号的典型滤波器特性。
过滤后的数据分为刺激前 50-100 毫秒和刺激后 500-1,000 毫秒的纪元。从数据中删除了有噪声的通道(图 9A),并删除了被伪影污染的 epoch(图 9B)。剩余的无伪影 epoch 是每个通道的平均值。诱发的反应通常可以在单次扫描中区分。当至少平均 10 个响应时,这些变化会变得更清晰、更一致,而当平均超过 25 个响应时,这些变化不会改变。至少应有 20 个无伪影的 epoch 才能获得可靠的平均值。通常情况是这样,在超过一半的数据集中,没有必要删除任何 epoch。为了便于比较在不同阶段(植入、通路、安乐死手术)记录的 ERP,数据通常进行 z 分数归一化,以解释麻醉深度和背景活动的差异。

图 9:不良通道和 epoch 的示例。 (A) 来自大脑相对较小区域的硬膜外记录的信号具有相似的特征,但振幅不同。故障信道很容易通过缺少 ERP 波形来区分。此外,通道可能会出现伪影、更嘈杂的外观和更大的信号幅度(通道 9、10 和 13)。通道 7 是通道故障的另一个示例,它不会拾取任何信号或噪声。(B) 预期的 ERP 幅度高达约 100 μV。有噪声的 epoch 通常具有较大的幅度,这可能会影响平均 ERP 波形,因此应将其删除。这些波形中缺乏典型的 ERP 波形,但这种波形在单个 epoch 中并不总是可以区分的。缩写: ERP = event-related potential。 请单击此处查看此图的较大版本。
使用颅窗技术记录的 ERP 在峰值振幅和延迟方面的可靠性很高19。在重复测量的方差分析 (RM-ANOVA) 中,峰值振幅(记录 1:17.9 ± 7.26 μV;记录 2:17.6 ± 10.1 μV;记录 3:14.0 ± 6.95 μV)和通道间方差(记录 1:6.47 ± 8.36 μV;记录 2:3.93 ± 6.13 μV;记录 3:3.84 ± 3.71 μV)没有显著差异。发现第一次和后续记录之间的峰值延迟存在显着差异。与后续记录相比,第一次记录中的峰值晚了 1 ms(记录 1:25.2 ± 2.0 ms;记录 2:24.0 ± 2.4 ms;记录 3:24.1 ± 2.0 ms),这可能与神经系统的发育有关20,21,因为本研究中使用了青春期长白猪。
颅窗技术进一步用于研究高频刺激 (HFS) 对 ERP 的影响。HFS 导致啮齿动物背角浅表神经元的长期增强22,23,增加疼痛敏感性,并增加人类的诱发脑反应24,25。观察到事件相关电位的 N1 峰振幅显着增加(与干预前基线相比增加 259 ± 107%),并且可以区分 HFS 与未在同一动物中应用 HFS 的实验之间存在明显差异(图 10)17。
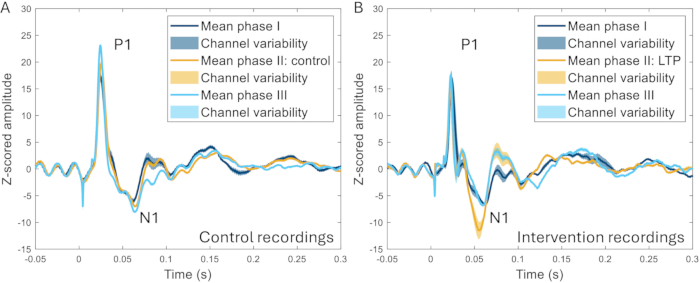
图 10:在疼痛模型诱导之前、期间和之后 2-3 周记录的所有渠道平均 ERP 示例。 (A) 在相隔 2 周的三个不同记录中从同一只动物收集的 ERP 显示出非常相似的特征。(B) ERP 在记录之间具有相似的特性,但与 II 期前后 3-4 周的其他阶段相比,N1 在 II 期诱导长期增强后具有更大的振幅。阴影区域表示跨通道的标准偏差。缩写: ERPs = 事件相关电位;LTP = 长时程增效。 请单击此处查看此图的较大版本。
补充表 S1:对猪的独居和社交行为进行评分的福利计划。请点击此处下载此文件。
讨论
该技术发展的意义在于消除电极失效模式,减少组织反应,从而提高侵入性皮层记录技术的可靠性。研究期间未发生电极故障模式,整个研究过程中共使用了两个 ECoG 阵列,包括 16 只动物和 43 次记录。这对研究经济产生了额外的积极影响。使用传统的全植入方法 12,26,27,在没有发生器件故障的情况下,至少需要 16 个 ECoG 阵列。然而,失败模式和组织反应继续对颅内脑记录的广泛实施构成重大挑战 11,12,13,28,29。这项研究大大减少了电极的数量,从而同时降低了慢性神经科学研究的成本和风险。
颅窗植入物发生的唯一不良事件是早期手术中的偶尔感染。这些感染总是浅表的(未达到硬脑膜的水平),并通过植入 Genta-coll 可吸收抗生素海绵来解决。由于这种治疗的有效性,作为预防措施,采用抗生素海绵植入作为颅窗植入的一部分。尽管猪是执行生根行为的强壮动物,但由标准 PLA 制成的植入物都没有损坏。
所有植入的电极都受到异物反应以及神经胶质或纤维包膜 14,15,28,29,30 的影响。这意味着电极-组织界面以及电极的记录能力在植入后会随着时间的推移而变化 13,18,28。使用当前方法,由于临时电极放置策略,组织反应不会影响电极的完整性和记录保真度。在每次治疗期间将电极放置在硬脑膜上,因此在每次治疗期间电极-组织界面是可比的。每个会话唯一可能略有不同的因素是电极位置。因此,将窗口大小与电极大小相匹配并在每次记录期间拍摄电极放置的照片至关重要。通过这些努力,已经记录了高度可靠和可重复的 ERP19。
组织对颅窗植入物的反应发生,并且在最早的飞行员中使用经颅窗观察到骨再生,没有从颅骨外表面延伸到硬脑膜的壁。第一次治疗后 2 周发现一层连续的软骨组织,表明骨骼再生。去除这些组织并进入硬脑膜是不可能的;因此,从颅骨表面延伸到硬脑膜31 的垂直壁被添加到颅窗上。打印不同壁长的窗户以匹配植入物和颅骨厚度,以避免对皮层的压力。安乐死后对动物进行了调查,结果显示所有动物的脑组织看起来都很健康。软组织仍在窗口区域内形成;但是,它不会附着在墙上,也不与头骨连续,因此很容易使用棉签去除。对于记录的可靠性至关重要,必须从窗口中取出这些软组织,以便每次都将电极放在硬脑膜上。
手术间隔至少 3 周可获得最佳结果。在 2 周时,颅窗可以触及,但窗区域的软组织附着在硬脑膜上。此外,伤口的打开和闭合因出血和组织缺乏柔韧性而复杂。在 3 周和 4 周时,切口伤口已充分愈合,正常组织边界(例如,骨膜、皮肤、硬脑膜)清晰可见,因此很容易从窗户上去除软组织并重新闭合植入物上的皮肤。由于每隔 4 周未观察到骨样组织,因此手术和多通路手术之间超过 4 周可能是可行的。我们尚未调查手术之间的间隔是否可以延长至几个月。
为了种植体和通路手术的成功,初始切口和伤口闭合至关重要。猪额头皮肤的柔韧性非常有限,这就是为什么松弛皮肤的无血管皮下层是必不可少的。这为闭合种植体上的皮肤提供了额外的灵活性,并减少了缝合线的压力。通过使用两层缝合线和额外的皮肤胶水,可以进一步减轻这种压力。使用连续皮内缝合技术缝合皮肤,以避免动物抓伤伤口并过早移除缝合线。伤口打开和闭合策略在两种类型的生存手术中都至关重要,无论是植入物还是通路手术。
当前方法的一个局限性是进入窗口需要小手术,这排除了对清醒动物的记录。这意味着,根据研究问题,它不会是适合每项研究的方法。对于用于清醒记录的完全植入的设备,存在其他方法可以克服界面32 处的生物变化。由于进入颅窗是一个小手术,因此可以使用局部麻醉剂和镇静剂而不是全身麻醉。颅窗完全在皮肤下的优点是减少了感染的机会并改善了动物福利,因为动物可以成对或成群饲。此外,我们只调查了诱发反应的可靠性19。然而,自发的大脑活动已经被记录下来,并且通常比 ERP8 更可靠和可重复,这表明该方法不仅限于 ERP 的记录。
我们的方法为慢性皮质记录提供了一种新颖、可扩展、可靠且可重复的方法。这种方法对于神经科学研究非常有价值,其中可靠性和可重复性对研究结果至关重要33,34。我们使用该方法研究了不同疼痛模型和对照诱导前后 S1 的皮质诱发电调,显示出稳健的结果17。通常,该方法可以很容易地适应进入其他皮质区域,例如,研究运动、听力或视觉。也可以使用该方法诊断癫痫 4,35 或监测脑损伤后的治疗和康复36,37。
该方法也适用于其他物种,如非人类灵长类动物或其他哺乳动物、猫、狗或羊 35,38,39。这些调整中的每一项都需要调整手术技术,确定颅窗放置的可靠标志,并调整其设计。作者建议在进行试点测试之前使用尸体来优化颅窗技术。对于某些大脑区域,手术可能更具侵入性,这可能会导致最佳恢复时间与我们推荐的不同。此外,该技术可以适应硬膜下 ECoG 记录和皮层内记录,从而扩大其应用并增加对各个大脑区域的访问。由于猪颅骨的厚度,可能需要增加皮质窗口的大小以进行硬膜下记录的硬膜切开术26,27。
对于皮层内记录,可以通过套管或梭子40 放置电极,这样可以进一步减小皮质窗的大小。硬膜下和颅内技术都会增加出血的风险,因此手术过程中必须小心避免血管。颅窗技术还可用于记录来自大脑的电信号以外的目的,例如,脉管系统的成像,这与偏头痛的猪模型高度相关41。此外,颅窗方法可以适应与新的成像技术31 结合使用,如 2 光子成像,并且可以与 Costine-Bartell 等人开发的硬脑膜替代品结合使用,以提高光学分辨率42。
总之,所提出的方法通过消除设备故障的风险,最大限度地减少电极部位的生物反应,从而降低了与永久植入物相关的风险12,13,从而提高了记录保真度并导致高度可靠的皮质记录。该方法对其他应用也有很大的希望,因为它可以扩展到其他物种和记录类型。
披露声明
作者没有需要披露的利益冲突。
致谢
作者要感谢奥尔堡大学医院实验动物设施的动物看护人和技术人员。神经可塑性与疼痛中心 (CNAP) 得到了丹麦国家研究基金会 (DNRF121) 的支持。 图 6 和 图 8 是在 BioRender 中创建的。
材料
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
参考文献
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。