Method Article
Técnica de janela craniana crônica para registros corticais repetidos durante anestesia em suínos
Neste Artigo
Resumo
Este estudo apresenta um método escalável, confiável e reprodutível para registros corticais crônicos repetidos em um modelo suíno. O método tem aplicações em vários campos da neurociência, incluindo pesquisa da dor e diagnóstico de doenças neurológicas.
Resumo
As gravações corticais são essenciais para extrair sinais neuronais para informar várias aplicações, incluindo interfaces cérebro-computador e diagnóstico de doenças. Cada aplicação impõe requisitos específicos à técnica de gravação, e soluções invasivas são frequentemente selecionadas para gravações de longo prazo. No entanto, os métodos de registro invasivos são desafiados pela falha do dispositivo e respostas adversas do tecido, que comprometem a qualidade do sinal a longo prazo.
Para melhorar a confiabilidade e a qualidade dos registros corticais crônicos, minimizando os riscos relacionados à falha do dispositivo e às reações teciduais, desenvolvemos uma técnica de janela craniana. Neste protocolo, relatamos métodos para implantar e acessar uma janela craniana em suínos juvenis de raça local, o que facilita a colocação temporária de matriz de eletrocorticografia (ECoG) na dura-máter. Descrevemos ainda como os sinais corticais podem ser registrados usando a técnica da janela craniana. O acesso à janela craniana pode ser repetido várias vezes, mas recomenda-se um mínimo de 2 semanas entre as cirurgias de implante e acesso para facilitar a recuperação e a cicatrização do tecido.
A abordagem da janela craniana minimizou com sucesso os modos comuns de falha do eletrodo e as respostas do tecido, resultando em registros corticais estáveis e confiáveis ao longo do tempo. Registramos potenciais relacionados a eventos (ERPs) do córtex somatossensorial primário como exemplo. O método forneceu registros altamente confiáveis, o que também permitiu avaliar o efeito de uma intervenção (estimulação de alta frequência) nos ERPs. A ausência de falhas significativas do dispositivo e o número reduzido de eletrodos utilizados (dois eletrodos, 43 sessões de gravação, 16 animais) sugerem uma melhor economia de pesquisa. Embora seja necessário um pequeno acesso cirúrgico para a colocação do eletrodo, o método oferece vantagens como redução do risco de infecção e melhoria do bem-estar animal.
Este estudo apresenta um método escalável, confiável e reprodutível para registros corticais crônicos, com aplicações potenciais em vários campos da neurociência, incluindo pesquisa da dor e diagnóstico de doenças neurológicas. Adaptações futuras podem estender seu uso a outras espécies e modalidades de registro, como registros intracorticais e técnicas de imagem.
Introdução
Em geral, o objetivo das gravações corticais é extrair informações da sinalização neuronal no cérebro. Essas informações podem ser usadas de várias maneiras - controlando um dispositivo externo, comunicação, diagnóstico de doenças ou reabilitação 1,2,3,4. Cada aplicativo coloca requisitos exclusivos sobre o conteúdo da informação e a resolução espacial necessária e a quantidade de invasividade considerada aceitável. Portanto, soluções de registro com uma gama de invasividade e resolução espacial foram desenvolvidas desde a descoberta do eletroencefalograma em 19295.
Geralmente, eles podem ser divididos em eletroencefalografia (EEG), eletrocorticografia (ECoG) e registros intracorticais. O EEG é um método de registro não invasivo que captura oscilações neurais e potenciais relacionados a eventos (ERPs) de todo o cérebro. No entanto, sua capacidade de definir as fontes dessa atividade é limitada devido à sua baixa resolução espacial. O ECoG é um método mais invasivo em que os eletrodos são colocados epi ou subduramente, normalmente cobrindo uma porção menor do córtex. Tem uma resolução espacial mais alta e pode registrar ERP e potenciais de campo local de superfície (LFP). Portanto, ele pode localizar a fonte da atividade cerebral com mais precisão, o que o torna útil, por exemplo, na identificação da origem da epilepsia focal. O registro intracortical é o método de registro mais invasivo e pode registrar a atividade de pico de neurônios individuais localizados superficialmente ou profundamente dentro do cérebro e LFP do volume de neurônios ao redor dos eletrodos. Esses sinais têm uma resolução espacial e conteúdo de informação muito altos, mas são produzidos por um subconjunto restrito de neurônios (1-10 neurônios por canal)6.
Para extrair informações do cérebro por períodos prolongados (meses-anos), a interface deve ser estável e confiável para que os sinais adquiridos continuem a representar as mesmas informações durante todo o período. Os registros de EEG requerem trocas frequentes de eletrodos, tornando sua confiabilidade variável de muito baixa a muito alta 7,8,9,10. ECoG e métodos intracorticais são, portanto, frequentemente selecionados para registros prolongados. No entanto, esses métodos exigem que a condição do eletrodo de registro, bem como do tecido, permaneça estável ao longo do tempo. Enquanto o eletrodo geralmente permanece no mesmo local, a interface eletrodo-tecido pode mudar devido a reações teciduais ou modos de falha do eletrodo 11,12,13,14. As reações teciduais incluem morte neuronal, hemorragia, bioincrustação, reação de corpo estranho, gliose, encapsulamento, infecção, meningite e extrusão meníngea15. Essas reações comprometem a capacidade de registro dos eletrodos12,13. Os modos comuns de falha do eletrodo são delaminação ou vazamento nas partes isoladas, delaminação ou rachadura do revestimento da superfície do eletrodo, danos ao fio e deslocamento do eletrodo11,12.
Para superar os modos de falha do eletrodo, consideramos a viabilidade de uma solução temporária de colocação de eletrodos que também aborda muitos dos desafios relacionados às respostas teciduais, ou seja, morte neuronal, reação de corpo estranho, gliose, encapsulamento e extrusão meníngea. Além disso, a colocação consistente do eletrodo era um requisito para obter registros neuronais confiáveis e reprodutíveis. Como o eletrodo foi colocado por via peridural a alguns milímetros de distância do tecido nervoso, o movimento do eletrodo não deve exceder 1 mm. A janela craniana foi projetada com dimensões para evitar movimento excessivo entre as colocações dos eletrodos. Com o desenvolvimento da técnica da janela craniana, pretendemos melhorar a confiabilidade e a qualidade do sinal a longo prazo e remover o risco de falha do eletrodo.
Protocolo
Este protocolo foi aprovado pela Administração Veterinária e Alimentar Dinamarquesa sob o Ministério da Alimentação, Agricultura e Pesca da Dinamarca (número de protocolo 2020-15-0201-00514). Um total de 16 porcas fêmeas foram submetidas aos procedimentos. Os animais pesavam aproximadamente 20 kg na chegada à instalação, o que significa que tinham aproximadamente 2 meses de idade. Eles pesavam cerca de 30 kg no momento da implantação e 40-60 kg no final do estudo. Os procedimentos consistem em cirurgia de implante, cirurgia de acesso e cirurgia terminal (Figura 1).

Figura 1: Linha do tempo dos procedimentos experimentais. A cirurgia de acesso (Fase II) pode ser repetida várias vezes. Aconselha-se uma separação de pelo menos 2 semanas entre as cirurgias para recuperação e cicatrização de feridas entre as cirurgias. Abreviatura: ERP = potencial relacionado a eventos. Clique aqui para ver uma versão maior desta figura.
1. Cirurgia de implantação (Fase I)
NOTA: Uma janela craniana de ácido polilático (PLA) impressa em 3D (Figura 2) é implantada para facilitar gravações repetidas do córtex somatossensorial primário do porco. Os ERPs devido à estimulação elétrica do nervo ulnar são registrados. A cirurgia e o fechamento da ferida são realizados para que a janela craniana possa ser acessada e fechada posteriormente.
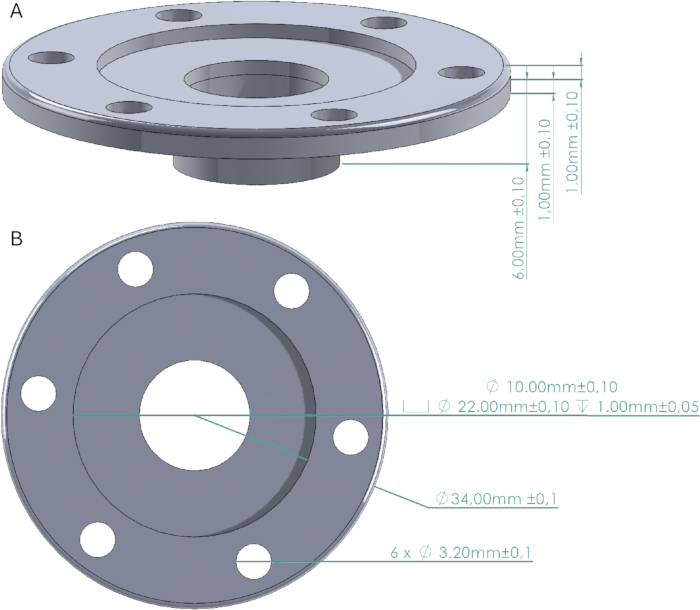
Figura 2: Projeto da janela craniana. (A) Vista lateral da janela craniana indicando a altura das paredes e a base que está presa ao crânio. (B) Vista superior indicando o diâmetro da viúva craniana, os orifícios dos parafusos, o espaço da tampa e a janela. A tampa da janela craniana é um cilindro de 22 mm de diâmetro com uma altura de 1 mm que se encaixa precisamente no espaço da tampa. Clique aqui para ver uma versão maior desta figura.
- Implante de janela craniana
- Preparação para cirurgia
NOTA: O processador de dados (RZ2), a estação de trabalho (WS8) e o PC são ligados antes do início da cirurgia. As anotações da cirurgia são feitas em uma planilha pelo menos a cada 15 minutos por um pesquisador não estéril para documentar os sinais vitais (frequência cardíaca, spO2, CO expirado2, temperatura central), níveis de anestesia (taxa de infusão de propofol, taxa de infusão de fentanil, porcentagem de sevoflurano), estágio da cirurgia e quaisquer irregularidades.- Tranquilize o animal usando uma injeção intramuscular de 5-7 mL da mistura de Zoletil (1 mL continha 8,3 mg de Tiletamina, 8,3 mg de Zolazepam, 8,3 mg de Xilacina e 1,7 mg de Butofanol).
NOTA: Para este estudo em particular, a cetamina foi omitida da mistura Zoletil para evitar o bloqueio dos receptores NMDA. - Transporte o animal para a sala de cirurgia. Intubar o animal e conectá-lo a um ventilador mecânico.
- Coloque um cateter de veia da orelha para administrar propofol, fentanil e solução salina.
- Administrar anestesia cirúrgica: Sevoflurano 1-2%, propofol (10 mg/mL infundido a 8 mg∙kg-1∙h-1), fentanil (50 μg/mL infundido a 20 μg∙kg-1∙h-1).
- Marque o local da incisão usando um marcador estéril antes de cobrir o campo estéril. Identifique o ponto de bregma desenhando linhas retas entre cada orelha e o olho contralateral; o ponto bregma está na interseção dessas linhas (Figura 3A). Certifique-se de que a incisão esteja ligeiramente lateral à linha média no lado contralateral ao membro anterior estimulado.
- Coloque a placa de metal sob as cortinas e garanta a colocação e estabilidade adequadas antes de iniciar a cirurgia.
- Tranquilize o animal usando uma injeção intramuscular de 5-7 mL da mistura de Zoletil (1 mL continha 8,3 mg de Tiletamina, 8,3 mg de Zolazepam, 8,3 mg de Xilacina e 1,7 mg de Butofanol).
- Acessando o crânio
NOTA: Nesta e nas seguintes partes do protocolo, todos os procedimentos são realizados por um cirurgião estéril, salvo indicação em contrário.- Fazer a incisão inicial na derme com um bisturi ligeiramente lateral à linha média, conforme indicado no passo 1.1.1.5. Continue a incisão através da pele com um cauterizador.
NOTA: Não estenda a incisão muito para trás para evitar os grandes seios frontais do porco. Se for necessário mais espaço, estenda a incisão no lado posterior. - Coloque o afastador e segure a pele com uma pinça e corte o tecido conjuntivo avascular entre o periósteo e o subcutâneo (Figura 3B) para dar mais flexibilidade à pele e facilitar a sutura na etapa 1.4. Ajustar o retractor à flexibilidade obtida.
- Incise o periósteo e solte-o do crânio usando um elevador de periósteo. Afastar o periósteo com o retractor.
- Fazer a incisão inicial na derme com um bisturi ligeiramente lateral à linha média, conforme indicado no passo 1.1.1.5. Continue a incisão através da pele com um cauterizador.
- Acessando a dura-máter
- Faça um orifício de 10 mm de diâmetro frontal à linha de sutura sagital e lateral à sutura da linha média (Figura 3C). Comece com um diâmetro de 15 mm para obter um furo de 10 mm de diâmetro no nível da dura-máter, pois a broca arredondada resultará em um furo ligeiramente cônico.
- Encaixe a janela craniana no orifício desde o início para garantir um bom ajuste.
- Mude para uma broca menor quando a dura-máter se tornar visível para atingir a largura máxima do furo no nível da dura-máter. Corte as bordas usando Rongeurs.
- Implante de janela craniana
- Confirme se a janela craniana se encaixa dentro e até o fundo do orifício e decida sua profundidade. Embora isso dependa do animal, certifique-se de que as paredes da janela craniana alcancem a dura-máter para um bom ajuste, mas não exerça pressão sobre o cérebro em nenhum local.
- Marque os orifícios dos parafusos usando a furadeira manual enquanto segura a janela craniana no lugar.
- Remova a janela craniana e faça os furos com pelo menos 4 mm de profundidade. Penetre no crânio para um dos parafusos para usá-lo como aterramento/referência para as gravações corticais.
- Coloque a janela craniana (Figura 3) e remova a agulha do conjunto de infusão de borboletas. Meça a profundidade dos orifícios dos parafusos através da janela craniana usando a borboleta romba. Insira e aperte um parafuso com um comprimento correspondente no orifício.
NOTA: Um parafuso muito longo não conseguirá apertar a tampa da janela craniana de forma eficaz. - Coloque um conector em U sob um parafuso que perfura o crânio e toca a dura-máter.
NOTA: É importante que o comprimento deste parafuso seja maior que a espessura do crânio para que o osso em crescimento não impeça o contato com a dura-máter.
- Preparação para cirurgia
- Implante de fio periférico
NOTA: Este procedimento pode ser feito simultaneamente com o implante da janela craniana. Este é um procedimento estéril. Para evitar a contaminação do local cirúrgico ou do local craniano, deve-se usar trajes estéreis.- Implante de fios perto do nervo ulnar
- Aplique estimulação elétrica a 5 mA na pele tocando a pele na parte distal posterior do membro anterior com duas agulhas (não penetrantes) ou outro pedaço de metal estéril separado por 2 cm. Procure uma flexão clara do casco, o que indica que o nervo corre entre esses dois pontos.
NOTA: O membro pode precisar ser girado para trás para que a parte posterior seja mais fácil de acessar. - Insira as duas agulhas perpendiculares ao curso do nervo a aproximadamente 2 cm de distância. Perfure a pele novamente a cerca de 3 cm do ponto de inserção (Figura 4A).
- Verifique a localização usando um estímulo de teste aplicado às agulhas a 2 mA; Certifique-se de que um movimento claro do casco seja visível.
- Passe os fios Cooner pelas agulhas e remova as agulhas, deixando os fios Cooner parcialmente sob a pele. Certifique-se de que a parte não isolada no meio do fio esteja sob a pele de ambos os fios (Figura 4B).
NOTA: Se o membro foi girado para trás, gire-o cuidadosamente para frente. - Conecte cada conector de crocodilo a uma extremidade isolada dos dois fios Cooner.
- Aplique estimulação elétrica a 5 mA na pele tocando a pele na parte distal posterior do membro anterior com duas agulhas (não penetrantes) ou outro pedaço de metal estéril separado por 2 cm. Procure uma flexão clara do casco, o que indica que o nervo corre entre esses dois pontos.
- Estabelecendo limiar motor
- Encontre o limiar motor usando o método up-down 16,17; comece em 100 μA, aumentando com passos de 50 μA, enquanto observa e sente uma resposta motora na área do casco. Um limite abaixo de 1 mA é normalmente viável.
- Programe o STG para fornecer 100 estímulos simétricos bifásicos retangulares com uma largura de pulso de 200 μs a 2x o limiar motor seguido por 100 estímulos a 10x o limiar motor.
- Implante de fios perto do nervo ulnar
- Registro de sinais corticais
- Peça a um pesquisador não estéril que coloque o pré-amplificador em posição e conecte-o ao processador de dados (RZ2) usando cabos de fibra óptica.
- Diminua o sevoflurano para 0,5-1% (metade do seu nível cirúrgico) e monitore a frequência cardíaca, o COexpirado 2 e a pressão arterial (se disponível) para garantir a profundidade adequada e estável da anestesia. Aumente o propofol e o fentanil conforme necessário.
- Peça a um pesquisador não estéril que conecte o headstage ao préamplifier (SI8) e coloque o headstage (clipe ZIF) no suporte do headstage, que é montado no micromanipulador de suporte magnético.
- Coloque o campo estéril ao redor do micromanipulador e prenda a parte adesiva no headstage e no suporte do headstage (Figura 5A).
- Peça a um pesquisador não estéril que prenda o micromanipulador usando o suporte magnético, mergulhe o eletrodo μECoG em álcool e coloque-o no headstage (clipe ZIF).
NOTA: Deixe o eletrodo secar antes de colocá-lo na dura-máter. Certifique-se de tocar apenas no campo estéril que cobre o headstage, pois o eletrodo μECoG não é estéril. - Coloque o μECoG no lugar usando o micromanipulador e guie com um cotonete. Conecte os fios de aterramento do μECoG ao parafuso de aterramento com um conector de crocodilo.
- Diminua o sevoflurano para 0%, monitore a frequência cardíaca, o COexpirado 2 e a pressão arterial (se disponível) para garantir a profundidade adequada e estável da anestesia, aumente o propofol e o fentanil conforme necessário.
- Visualize os sinais na sinapse; a faixa de sinal típica é de até ±100 μV.
- Se o sinal aparecer como uma linha em negrito (indicativo de ruído de linha), peça a uma pessoa estéril que execute as seguintes ações: investigue o circuito de aterramento e mantenha o parafuso de aterramento e as conexões secas e isoladas dos tecidos próximos. Investigue se outro cabeamento está isolado do corpo do porco e dos instrumentos cirúrgicos. Caso contrário, use gaze estéril para isolar o cabeamento do corpo ou dos instrumentos cirúrgicos.
- Se a amplitude do sinal for maior que ±100 μV (indicativo de artefatos de movimento), certifique-se de que o eletrodo esteja suspenso e apoiado no cérebro e que o cabeamento não se mova quando o porco se mover devido à ventilação ou estimulação elétrica do nervo ulnar.
- Se a amplitude do sinal for menor que ± 20 mV (indicativo de mau contato ou anestesia profunda), certifique-se de que o μECoG esteja apoiado no cérebro e que a dura-máter e o eletrodo estejam hidratados; Se necessário, pingue um pouco de solução salina no eletrodo. Certifique-se de que o sevoflurano foi desligado e diminua a taxa de infusão de propofol (e possivelmente fentanil). Realize um teste de estimulação e verifique se as respostas evocadas são visíveis. Certifique-se de que a parte não isolada do fio periférico esteja totalmente sob a pele.
NOTA: As respostas evocadas normalmente podem ser distinguidas em varreduras únicas online, mas também é possível avaliar isso offline, tomando uma média de 5 a 10 estímulos. Se um pico for visível no momento do gatilho, é um artefato de estimulação. O artefato de estimulação interferirá na análise dos dados.
- Coloque gaze estéril no eletrodo para manter um bom contato com o tecido. Goteje soro fisiológico à temperatura corporal na gaze para evitar o ressecamento do tecido.
NOTA: Como esses registros são epidurais, a temperatura exata não é essencial. Com registros subdurais, isso é mais crítico. - Deixe o eletrodo assentar (30 min) e documente a colocação do eletrodo e a configuração do conector de aterramento para garantir gravações subsequentes semelhantes (Figura 5B-D). Comece a gravar e aguarde 30 s antes de iniciar o programa de estimulação a cada 10 minutos.
NOTA: Verifique regularmente entre as gravações se a gaze do eletrodo permanece hidratada e goteje solução salina à temperatura corporal, se necessário. - Realize uma intervenção após três rodadas de estimulação (para servir como linha de base pré-intervenção). Repita a estimulação por mais nove rodadas.
NOTA: Continue a verificar regularmente entre as gravações se a gaze no eletrodo permanece hidratada e goteje solução salina, se necessário.
- Fechamento do local do implante
- Remova a gaze do eletrodo e remova o eletrodo usando o micromanipulador, guiando-o suavemente com um cotonete.
- Peça a um pesquisador não estéril que remova e armazene o micromanipulador, o eletrodo, o headstage e o pré-amplificador e limpe o eletrodo de acordo com as instruções do fabricante usando um enxágue rápido com água deionizada para remover os resíduos do tecido. Mergulhe o eletrodo por até 4 h em limpador de lentes para remover tecidos e proteínas da superfície do eletrodo, seguido de um segundo enxágue com água deionizada para remover o limpador de lentes da superfície do eletrodo. Antes de armazená-lo, mergulhe o eletrodo em álcool isopropílico.
- Coloque a tampa da janela craniana para fechar a janela craniana, certificando-se de que ela se encaixe precisamente na janela craniana. Não requer fixação adicional; A pressão da pele sobre o implante irá mantê-lo no lugar.
- Coloque a bolsa antibiótica em cima da tampa da janela craniana e feche a pele por via subcutânea com suturas reabsorvíveis únicas usando a técnica de sutura vertical enterrada em colchão (Figura 6A). Coloque as suturas a uma distância de 5 a 10 mm, o que permite espaço para colocar as suturas cutâneas. Não amarre as três últimas suturas depois de colocá-las. Em vez disso, amarre essas três suturas quando todas as suturas forem colocadas.
NOTA: Amarrar as três últimas suturas depois de colocar as três garante que haja espaço suficiente para colocar as últimas suturas. - Coloque suturas intradérmicas contínuas de forma contínua na pele. Inicie a sutura intradérmica 1-2 cm lateral ao local da incisão e faça um túnel sob a pele até a camada dérmica da pele, mas abaixo de sua superfície (Figura 6B) para evitar arranhões e afrouxamento excessivos das suturas. Dê um nó na extremidade lateral da sutura.
NOTA: O propofol e o fentanil podem ser desligados durante este procedimento, pois têm vários minutos de tempo de despertar. - Coloque a sutura contínua entre as suturas subcutâneas até que o outro lado da incisão seja alcançado.
NOTA: É importante que a sutura saia na derme, mas não perfure a pele para que o animal tenha menos capacidade de arranhar as suturas. - Tunelamente a sutura 1-2 cm lateral à incisão em um local de saída lateral e dê um nó (Figura 6B). Aplique cola de tecido no local da incisão.
- Animal de volta ao cercado de casa
- Remova as cortinas estéreis do animal e desmame-o do ventilador assim que o movimento for observado.
- Transfira o animal para o curral doméstico e mantenha-o separado do companheiro de curral por uma noite.
NOTA: Os porcos são separados após a cirurgia, pois é normal que eles tentem acordar violentamente o companheiro de curral, resultando em mordidas. Os porcos devem poder ter contato com o focinho.

Figura 3: Implantação da janela craniana. (A) A localização esperada do ponto bregma é identificada e marcada no porco antes do drapeado estéril, pois isso pode ser difícil de distinguir posteriormente. (B) Após a incisão na pele, a subcutânea avascular é afrouxada com tesoura. (C) Um orifício de 15 mm de diâmetro é perfurado no crânio e as bordas são removidas usando rongeurs. Destacam-se as linhas de sutura coronal e sagital. (D) A janela craniana é implantada e fixada com parafusos. Clique aqui para ver uma versão maior desta figura.

Figura 4: Implante de fios periféricos. (A) Duas agulhas de 23 G são colocadas na pele e os fios de Cooner são inseridos através delas. (B) As agulhas são removidas e os fios são deixados na pele conectados ao estimulador usando clipes de crocodilo. Clique aqui para ver uma versão maior desta figura.

Figura 5: Configuração de gravação cortical. (A) O feixe de eletrodos é colocado na dura-máter, e o suporte do estágio principal e o micromanipulador ficam em uma manga estéril durante uma cirurgia de implantação, onde a incisão é mais longa e lateral. (B) Close-up do μECoG na configuração de gravação durante uma cirurgia de acesso, onde a incisão é mais medial. (C) A configuração de aterramento, onde todos os fios de aterramento e referência no ECoG são curto-circuitados e conectados através do conector em U ao parafuso pericraniano. (D) Close-up do headstage e do suporte do headstage durante uma cirurgia de acesso. O μECoG é colocado na dura-máter. Abreviaturas: ECoG = eletrocorticografia; μECoG = microECoG. Clique aqui para ver uma versão maior desta figura.

Figura 6: Técnica de sutura. (A) Esquema da técnica do colchão vertical enterrado subcutâneo. (B) Esquema da técnica de sutura intradérmica contínua. Clique aqui para ver uma versão maior desta figura.
2. Cirurgia de acesso (Fase II)
NOTA: Após 2-4 semanas, a janela craniana é aberta para realizar registros de acompanhamento dos sinais corticais do S1. A cirurgia e o fechamento da ferida são novamente realizados de forma que a janela craniana possa ser acessada e fechada novamente.
- Preparação para cirurgia
NOTA: As etapas 2.1.1-2.1.6 são semelhantes às etapas 1.1.1.1-1.1.1.6.- Tranquilize o animal usando uma mistura de zoletil (5 mL de zoletil [tiletamina 25 mg / mL e zolazepam 25 mg / mL], 6,25 mL de xilazina (20 mg / mL) e 2,5 mL de butorfanol (10 mg / mL)).
NOTA: Para este estudo em particular, a cetamina foi omitida da mistura de zoletil para evitar o bloqueio dos receptores NMDA. - Transporte o animal para a sala de cirurgia e intube-o e ventile-o.
- Coloque um cateter de veia da orelha. Administre propofol, fentanil e solução salina através do cateter.
- Administrar anestesia cirúrgica: Sevoflurano 1-2%, propofol (10 mg/mL infundido a 8 mg∙kg-1∙h-1), fentanil (50 μg/mL infundido a 20 μg∙kg-1∙h-1).
- Se necessário, marque o local da incisão usando um marcador estéril antes de cobrir o campo estéril. Identifique o ponto de bregma desenhando linhas retas entre cada orelha e o olho contralateral; bregma está na interseção dessas linhas (Figura 3A).
NOTA: A incisão inicial normalmente ainda é visível. A nova incisão deve ser colocada a pelo menos 30 mm da incisão inicial para evitar a maior parte do tecido cicatricial e facilitar o fechamento da ferida. - Coloque a placa de metal sob as cortinas e garanta a colocação e estabilidade adequadas antes de iniciar a cirurgia.
- Tranquilize o animal usando uma mistura de zoletil (5 mL de zoletil [tiletamina 25 mg / mL e zolazepam 25 mg / mL], 6,25 mL de xilazina (20 mg / mL) e 2,5 mL de butorfanol (10 mg / mL)).
- Acessando a janela craniana
NOTA: As etapas 2.2.1-2.2.3 são semelhantes às etapas 1.1.2.1-1.1.2.3.- Faça a incisão inicial na derme com um bisturi ligeiramente lateral à linha média, conforme marcado na etapa 2.1.5. Continue a incisão através da pele com um cauterizador.
NOTA: No caso de um experimento terminal, a incisão pode ser feita no mesmo local da incisão original. - Coloque o afastador e segure a pele com uma pinça e corte o tecido conjuntivo avascular entre o periósteo e o subcutâneo (Figura 3B) para dar mais flexibilidade à pele e facilitar a sutura na etapa 1.4. Ajustar o retractor à flexibilidade obtida.
NOTA: Se este for um experimento terminal, esta etapa poderá ser omitida. - Incise o periósteo e solte-o do crânio usando o elevador do periósteo. Afastar o periósteo com o retractor.
- Remova a tampa da janela craniana e remova qualquer conectivo da abertura usando movimentos circulares suaves com um cotonete até que a dura-máter seja alcançada.
- Faça a incisão inicial na derme com um bisturi ligeiramente lateral à linha média, conforme marcado na etapa 2.1.5. Continue a incisão através da pele com um cauterizador.
- Implante de fio periférico
- Repita a etapa 1.2.
- Registro de sinais corticais
- Repita a etapa 1.3.
- Fechamento do local do implante
- Repita a etapa 1.4.
NOTA: Se este for um experimento terminal, esta etapa poderá ser omitida.
- Repita a etapa 1.4.
3. Cirurgia terminal (Fase III)
NOTA: Após 2-4 semanas, a janela craniana é aberta para realizar registros de acompanhamento dos sinais corticais do S1. As etapas 2.2 a 2.5 são repetidas, conforme descrito acima, seguidas pela etapa 3.1.
- Eutanásia
NOTA: O tubo do cateter da veia da orelha precisa ser lavado com solução salina para evitar a oxidação do barbitúrico.- Lave o cateter da veia da orelha com solução salina.
- Conecte uma seringa com a overdose de pentobarbital (10 mL, 400 mg / mL) e injete o pentobarbital através do cateter da veia da orelha.
Resultados
Utilizando a técnica de janela craniana, os sinais corticais foram registrados em 43 sessões em 16 animais. Os animais cicatrizaram adequadamente após a cirurgia e foram alojados em pares durante todo o estudo e monitorados diariamente usando o esquema de bem-estar na Tabela Suplementar S1. Todos os animais receberam pontuação 0 em todos os momentos, indicando excelente bem-estar. A Figura 7 mostra que as janelas foram de fato colocadas sobre a área S1 do córtex suíno. Algumas cicatrizes foram geralmente observadas na dura-máter in vivo e post-mortem (Figura 7A), mas o exame post-mortem revelou que nunca afetou o tecido cortical subjacente (Figura 7B), que parecia saudável em todos os animais e comparável à área S1 contralateral.

Figura 7: Posicionamento da janela cortical em relação à anatomia cerebral. (A) Para investigar a saúde do tecido cortical e a colocação da janela cortical em relação a S1, a janela craniana foi removida ao final do estudo. Intervalos cirúrgicos de 2 semanas foram utilizados neste caso, e algum tecido cicatricial pode ser observado na dura-máter. (B) O tecido cerebral subjacente parece saudável e não afetado pelo implante. (C) Uma sobreposição das duas fotos mostra que o implante realmente cobriu a área S1 do córtex de porco. A seta indica o eixo ântero-posterior. Clique aqui para ver uma versão maior desta figura.
Resumidamente, para analisar os sinais corticais, eles devem ser filtrados para remover o ruído da linha e outros artefatos (ver Figura 8 e Tabela 1). Um filtro de entalhe é usado em torno da frequência de ruído da linha, que é de 50 Hz na Europa e seus harmônicos. Os sinais são então filtrados passa-alta para remover artefatos de deslocamento e movimento de baixa frequência; a frequência de corte máxima depende da finalidade das gravações, mas não é aconselhável mais de 5 Hz, pois isso atenuará os recursos do ERP e do EEG espontâneo. Além disso, um filtro passa-baixa é usado para remover qualquer ruído de alta frequência. Como o eletrodo é colocado no topo da dura-máter, as altas frequências são ligeiramente atenuadas pelo tecido entre o cérebro e o eletrodo18. Portanto, a frequência de corte pode ser menor do que quando o eletrodo está situado diretamente no tecido cerebral.
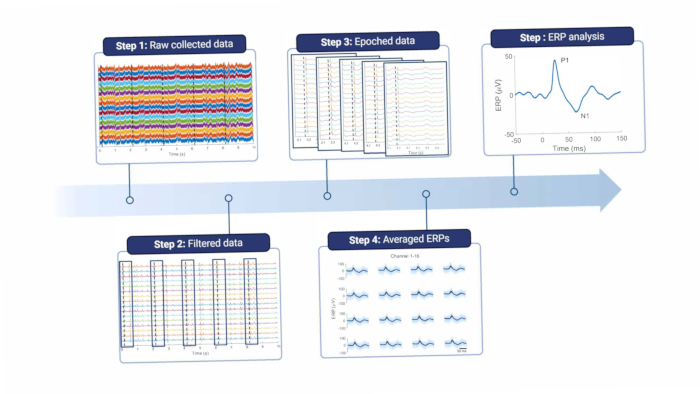
Figura 8: Pipeline de processamento de dados. Os dados brutos coletados (etapa 1) são processados por filtragem (etapa 2). Eles são então divididos em épocas com base nos gatilhos de estímulo (etapa 3), que são calculados em média (etapa 4). Os ERPs médios são usados para análise de dados (etapa 5). Abreviatura: ERPs = potenciais relacionados a eventos. Clique aqui para ver uma versão maior desta figura.
| Tipo de filtro | Corte típico | Ordem típica | Corte usado | Pedido usado |
| Entalhe | 50±3 Hz ou 60±3 Hz | Ordem alta | 50±3 Hz e | 10ª ordem |
| e harmônicos | harmônicos ±1 Hz | |||
| Passa-alta | 0,1-5 Hz | Ordem baixa | 1-5 Hz | 2ª ordem |
| Passa-baixo | 100-1000 Hz | Ordem baixa | 300 Hz | 2ª ordem |
Tabela 1: Propriedades típicas do filtro para análise de sinais cerebrais de superfície registrados com eletrodos de eletrocorticografia ou eletroencefalografia.
Os dados filtrados são divididos em épocas de 50-100 ms antes e 500-1.000 ms após o estímulo. Canais ruidosos são removidos dos dados (Figura 9A) e as épocas contaminadas com artefatos são removidas (Figura 9B). As épocas livres de artefatos restantes são calculadas para cada canal. As respostas evocadas geralmente podem ser distinguidas em varreduras únicas. Eles se tornam mais claros e consistentes quando pelo menos 10 respostas são calculadas e não mudam quando mais de 25 são calculadas. Deve haver pelo menos 20 épocas livres de artefatos para obter uma média confiável. Normalmente, esse é o caso e, em mais da metade dos conjuntos de dados, não foi necessário remover nenhuma época. Para facilitar a comparação entre os ERPs registrados durante as diferentes fases (implantação, acesso, cirurgias de eutanásia), os dados são normalmente normalizados pelo escore z para levar em conta as diferenças na profundidade do anestésico e na atividade de fundo.

Figura 9: Exemplos de canais e épocas ruins. (A) Os sinais de registros epidurais em uma área relativamente pequena do cérebro têm características semelhantes, mas amplitudes diferentes. Canais com defeito são facilmente distinguidos pela falta da forma de onda do ERP. Além disso, os canais podem exibir artefatos, uma aparência mais ruidosa e maior amplitude de sinal (canais 9, 10 e 13). O canal 7 é outro exemplo de canal com defeito e não capta nenhum sinal ou ruído. (B) A amplitude esperada do ERP é de até aproximadamente 100 μV. Épocas ruidosas normalmente têm uma amplitude maior, o que pode afetar a forma de onda média do ERP e, portanto, devem ser removidas. A forma de onda típica do ERP está faltando dessas, mas essa forma de onda nem sempre é distinguível em épocas únicas. Abreviatura: ERP = potencial relacionado a eventos. Clique aqui para ver uma versão maior desta figura.
A confiabilidade dos ERPs registrados pela técnica de janela craniana foi alta em termos de amplitudes de pico e latência19. Não foram encontradas diferenças significativas para a amplitude de pico (registro 1: 17,9 ± 7,26 μV; registro 2: 17,6 ± 10,1 μV; registro 3: 14,0 ± 6,95 μV) e variância entre os canais (registro 1: 6,47 ± 8,36 μV; registro 2: 3,93 ± 6,13 μV; registro 3: 3,84 ± 3,71 μV) em uma análise de variância medida repetida (RM-ANOVA). Foi encontrada diferença significativa no pico de latência entre o primeiro e o acompanhamento dos registros. O pico foi 1 ms mais tarde no primeiro registro em comparação com os registros de acompanhamento (registro 1: 25,2 ± 2,0 ms; registro 2: 24,0 ± 2,4 ms; registro 3: 24,1 ± 2,0 ms), o que pode estar relacionado ao desenvolvimento do sistema nervoso20,21, uma vez que foram utilizados porcos adolescentes de raça local neste estudo.
A técnica da janela craniana foi ainda usada para investigar o efeito da estimulação de alta frequência (HFS) em ERPs. O HFS causa potenciação a longo prazo dos neurônios superficiais do corno dorsal em roedores22,23, aumento da sensibilidade à dor e aumento das respostas cerebrais evocadas em humanos24,25. Observou-se um aumento significativo na amplitude do pico N1 dos potenciais relacionados ao evento (259 ± aumento de 107% em relação à linha de base pré-intervenção), e uma clara diferença pôde ser distinguida entre HFS e experimentos em que nenhum HFS foi aplicado no mesmo animal (Figura 10)17.
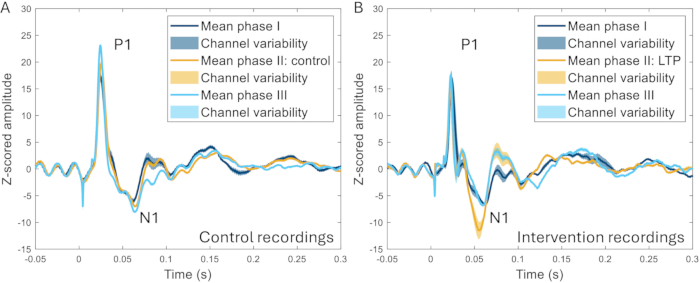
Figura 10: Exemplos de ERPs em média em todos os canais registrados 2-3 semanas antes, durante e 2-3 semanas após a indução de um modelo de dor. (A) O ERP coletado do mesmo animal durante três gravações diferentes com 2 semanas de intervalo mostra características muito semelhantes. (B) Os ERPs têm características semelhantes entre os registros, mas o N1 tem uma amplitude maior após a indução da potenciação de longo prazo na fase II em comparação com as outras fases que são 3-4 semanas antes e depois da fase II. As áreas sombreadas indicam o desvio padrão entre os canais. Abreviaturas: ERPs = potenciais relacionados a eventos; LTP = potenciação de longo prazo. Clique aqui para ver uma versão maior desta figura.
Tabela Suplementar S1: Esquema de bem-estar para pontuar o comportamento solitário e social dos porcos. Clique aqui para baixar este arquivo.
Discussão
A importância do desenvolvimento dessa técnica está na remoção dos modos de falha do eletrodo, reduzindo as respostas teciduais e, assim, melhorando a confiabilidade das técnicas invasivas de registro cortical. Nenhum modo de falha de eletrodo ocorreu durante o estudo, e um total de duas matrizes ECoG foram usadas ao longo do estudo, incluindo 16 animais e 43 sessões de gravação. Isso tem um impacto positivo adicional na economia da pesquisa. Usando métodos tradicionais totalmente implantados 12,26,27, pelo menos 16 matrizes ECoG seriam necessárias sob a suposição de que não ocorrem falhas no dispositivo. No entanto, os modos de falha e as respostas teciduais continuam a representar desafios significativos para a implementação generalizada do registro cerebral intracraniano 11,12,13,28,29. Este estudo reduziu substancialmente o número de eletrodos, reduzindo assim o custo e o risco de estudos crônicos de neurociência ao mesmo tempo.
O único evento adverso que ocorreu com os implantes de janela craniana foram infecções ocasionais nas cirurgias iniciais. Essas infecções eram sempre superficiais (não atingindo o nível da dura-máter) e eram resolvidas com o implante de uma esponja antibiótica reabsorvível Genta-coll. Devido à eficácia desse tratamento, o implante da esponja antibiótica foi adotado como parte do implante da janela craniana como medida preventiva. Apesar de os porcos serem animais fortes que realizam o comportamento de enraizamento, nenhum dos implantes feitos de PLA padrão foi quebrado.
Todos os eletrodos implantados estão sujeitos a uma resposta de corpo estranho e encapsulamento glial ou fibroso 14,15,28,29,30. Isso significa que a interface eletrodo-tecido, bem como a capacidade de registro do eletrodo, muda com o tempo após o implante 13,18,28. Usando o método atual, as respostas teciduais não afetaram a integridade e a fidelidade de registro dos eletrodos devido à estratégia temporária de colocação de eletrodos. O eletrodo foi colocado na dura-máter durante cada sessão e, portanto, a interface eletrodo-tecido foi comparável durante cada sessão. O único fator que poderia ter diferido ligeiramente por sessão é a posição do eletrodo. É, portanto, crucial combinar o tamanho da janela com o tamanho do eletrodo e tirar fotos do posicionamento do eletrodo durante cada sessão de gravação. Com esses esforços, ERPs altamente confiáveis e reprodutíveis foram registrados19.
A resposta do tecido ao implante da janela craniana ocorreu, e o crescimento ósseo foi observado nos primeiros pilotos usando uma janela transcraniana sem paredes que se estendem da superfície externa do crânio até a dura-máter. Uma camada contínua de tecido ósseo mole foi encontrada 2 semanas após a primeira sessão, indicando crescimento ósseo. Era impossível remover esse tecido e acessar a dura-máter; portanto, paredes verticais que se estendiam da superfície do crânio até adura-máter 31 foram adicionadas à janela craniana. Janelas com diferentes comprimentos de parede foram impressas para combinar o implante com a espessura do crânio para evitar pressão no córtex. Os animais foram investigados após a eutanásia, que revelou tecido cerebral de aparência saudável em todos os animais. O tecido mole ainda se forma dentro da área da janela; No entanto, ele não se prende à parede e não é contínuo com o crânio, facilitando a remoção com um cotonete. É fundamental para a confiabilidade dos registros que esse tecido mole seja removido da janela para que o eletrodo seja colocado na dura-máter a cada vez.
Os melhores resultados são obtidos com pelo menos 3 semanas entre as cirurgias. Com 2 semanas, a janela craniana está acessível, mas o tecido mole na área da janela está preso à dura-máter. Além disso, a abertura e o fechamento da ferida são complicados pelo sangramento e pela falta de flexibilidade do tecido. Com 3 e 4 semanas, a ferida da incisão cicatrizou o suficiente para que os limites normais do tecido (por exemplo, periósteo, pele, dura-máter) sejam distintos, facilitando a remoção do tecido mole da janela e o fechamento da pele sobre o implante. Como nenhum tecido semelhante a osso foi observado em intervalos de 4 semanas, mais de 4 semanas entre cirurgias e cirurgias de acesso múltiplo podem ser viáveis. Não investigamos se o período entre as cirurgias pode ser estendido para vários meses.
Para o sucesso das cirurgias de implante e acesso, a incisão inicial e o fechamento da ferida são fundamentais. A flexibilidade da pele da testa do porco é muito limitada, razão pela qual é essencial afrouxar a camada subcutânea avascular da pele. Isso fornece flexibilidade extra para fechar a pele sobre o implante e reduz o estresse nas suturas. Esse estresse é ainda mais reduzido usando duas camadas de suturas e cola adicional para a pele. A pele é suturada usando uma técnica de sutura intradérmica contínua para evitar que os animais cocem as feridas e removam as suturas prematuramente. As estratégias de abertura e fechamento da ferida são críticas em ambos os tipos de cirurgia de sobrevivência, seja um implante ou uma cirurgia de acesso.
Uma limitação da abordagem atual é que o acesso à janela requer uma pequena cirurgia, o que impede gravações em animais acordados. Isso significa que, dependendo da questão de pesquisa, não será uma abordagem adequada para todos os estudos. Para que dispositivos totalmente implantados sejam usados em gravações acordadas, existem outros métodos para superar as alterações biológicas na interface32. Como o acesso à janela craniana é um procedimento pequeno, pode ser possível usar um anestésico local e um sedativo em vez de anestesia geral. As vantagens de a janela craniana estar inteiramente sob a pele são a redução das chances de infecção e a melhoria do bem-estar animal, pois os animais podem ser alojados em pares ou em grupo. Além disso, investigamos apenas a confiabilidade das respostas evocadas19. No entanto, a atividade cerebral espontânea foi registrada e geralmente é mais confiável e reprodutível do que o ERP8, indicando que o método não se limita ao registro do ERP.
Nosso método apresenta um método novo, escalável, confiável e reprodutível para registros corticais crônicos. Esse método é altamente valioso para estudos de pesquisa em neurociência, onde a confiabilidade e a reprodutibilidade são essenciais para o resultado dos estudos33,34. Utilizamos o método para investigar as respostas evocadas corticais de S1 antes e após a indução de diferentes modelos de dor e controles, mostrando resultados robustos17. Geralmente, o método pode ser facilmente adaptado para acessar outras áreas corticais, por exemplo, para investigar movimento, audição ou visão. Também pode ser possível utilizar o método para o diagnóstico de epilepsia 4,35 ou monitorar o tratamento e a reabilitação após lesão cerebral36,37.
O método também é escalável para outras espécies, como primatas não humanos ou outros mamíferos, gatos, cães ou ovelhas 35,38,39. Cada uma dessas adaptações exigirá o ajuste da técnica cirúrgica, a identificação de pontos de referência confiáveis para a colocação da janela craniana e o ajuste de seu design. Os autores recomendam o uso de cadáveres para otimizar a técnica da janela craniana antes de prosseguir com o teste piloto. Para certas áreas do cérebro, a cirurgia pode ser mais invasiva, o que pode resultar em um tempo de recuperação ideal diferente do recomendado. A técnica pode, além disso, ser adaptada para permitir registros ECoG subdurais e registros intracorticais, ampliando assim suas aplicações e aumentando o acesso a várias regiões do cérebro. Devido à espessura do crânio suíno, pode ser necessário aumentar o tamanho da janela cortical para realizar a durotomia para registros subdurais26,27.
Para registros intracorticais, é possível colocar o eletrodo por meio de uma cânula ou um shuttle40, o que permite uma redução adicional do tamanho da janela cortical. As técnicas subdurais e intracranianas aumentam o risco de sangramento, portanto, deve-se tomar cuidado durante a cirurgia para evitar vasos sanguíneos. A técnica da janela craniana também pode ser usada para outros fins além do registro de sinais elétricos do cérebro, por exemplo, imagens da vasculatura, que é altamente relevante em modelos suínos de enxaqueca41. Além disso, o método da janela craniana pode ser adaptado para uso em combinação com novas técnicas de imagem31, como a imagem de 2 fótons, e pode ser combinado com o substituto dural desenvolvido por Costine-Bartell et al. para melhorar a resolução óptica42.
Em conclusão, a abordagem metodológica apresentada reduz os riscos relacionados a um implante permanente12,13 ao eliminar o risco de falha do dispositivo, minimizando as respostas biológicas no local do eletrodo e, assim, aumentando a fidelidade do registro e resultando em registros corticais altamente confiáveis. A metodologia também é muito promissora para outras aplicações, pois é escalável para outras espécies e tipos de registro.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Os autores gostariam de agradecer aos cuidadores e técnicos de animais da instalação de animais de laboratório do Hospital Universitário de Aalborg. O Centro de Neuroplasticidade e Dor (CNAP) é apoiado pela Fundação Nacional de Pesquisa Dinamarquesa (DNRF121). A Figura 6 e a Figura 8 foram criadas no BioRender.
Materiais
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
Referências
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados