Method Article
Mısır (Zea mays) Abiyotik Stres Fenottiplerinin Miktarının Belirlenmesi için Görüntüleme ve Analiz
Bu Makalede
Özet
Fenotipleri ölçmek için bitkilerin düşük maliyetli görüntülenmesi için bir yöntemin yanı sıra, görüntü yakalama için en iyi uygulamalar ve bitki özelliklerini ölçmek için bir görüntü analiz hattı sunulmaktadır. Bu yöntemler sıcaklık, kuraklık ve kombine abiyotik stres koşulları altında mısır (Zea mays) fenotiplerini ölçmek için uygulanmıştır.
Özet
Kantitatif bitki fenotiplerinin veya özelliklerinin ölçülmesi, bitkilerin biyotik ve abiyotik stresler dahil olmak üzere çevresel faktörlere verdiği tepkileri anlamak için çok önemlidir. Bununla birlikte, bitkileri ölçmenin geleneksel yöntemleri, özellikle biyokütle ve yükseklik gibi özellikleri bireysel olarak değerlendirirken zaman alıcı, yanlış ve yıkıcı olabilir. Görüntü tabanlı analiz, iş gücünü azaltma, doğruluğu ve hassasiyeti artırma ve aynı tesisin birden fazla zaman noktasında tekrarlanan ölçümlerini sağlama fırsatı sunar. Yüksek verimli fenotipleme tesisleri bir çözüm sunarken, genellikle dünya çapında aşırı derecede pahalıdır ve kullanılabilirlikleri sınırlıdır. Ücretsiz ve açık kaynaklı paket PlantCV'ye dayalı bir görüntü analiz hattı ile birlikte bir fotoğraf stüdyosu kurulumunda düşük maliyetli tek kartlı bilgisayarlar ve dijital kameralar kullanarak bitki görüntülerini yakalamak için bir yöntem açıklanmaktadır. Bu yöntem, yüksek kaliteli görüntü alımını sağlamak için en iyi uygulamaların yanı sıra görüntü yakalama, etiketleme ve aktarma için hızlı ve doğru bir protokol sunar. Görüntü analizi yoluyla, bitki boyutu, yüksekliği ve rengi gibi özellikler de dahil olmak üzere deneydeki tüm görüntüler için aynı anda 10'dan fazla fenotip ölçüldü. Bu yöntemler, Zea mays (mısır) ile yetiştirilmiş B73 çeşidinin ısı, kuraklık ve birleşik ısı ve kuraklık abiyotik stres koşullarına tepkisini karakterize etmek için kullanılmıştır.
Giriş
Bitki özelliklerinin veya fenotiplerin ölçülmesi, bitki bilimindeki temel ve uygulamalı soruları yanıtlamak için kritik öneme sahiptir. Örneğin, bir genetik mutasyonun bitki büyüklüğü üzerindeki etkisini anlamak isteyen bir araştırmacının, bitki boyunu ve yaprak alanınınicel olarak ölçmesi gerekecektir 1. Biyotik stres (bakteriyel, viral veya mantar enfeksiyonu gibi) veya abiyotik stres (kuraklık, sıcak, soğuk veya besin tükenmesi gibi) uygulayan bir araştırmacının, klorozu ölçmek için stresin bitki rengi veya "yeşillik" üzerindeki etkisini araştırması gerekecektir 2,3.
Bu özelliklerin ölçülmesi, temel bitki biyolojisi ve uygulamalı bitki ıslahı için gerekli olsa da, bu özelliklerin elle ölçülmesi zaman alıcı, kesin olmayan ve yanlış olabilir 4,5,6,7. Örneğin, bitkilerin yüksekliğinin ölçülmesi, çoğu zaman sıcak veya nemli çevre koşullarında, her bitki için manuel olarak bir cetvel kullanmayı içerir ve ölçen kişinin bakış açısından ve hangi noktanın bitkinin "tepesi" olarak kabul edildiğinde hataya tabidir. Ayrıca, biyokütle ve pigment içeriği gibi ölçümler tahrip edicidir ve aynı bitkinin zaman içindeki değişimi ölçülemez veya bu ölçümlerin yapılması sürecinde yok edilmesi gerektiğinden birden fazla örnekleme için kullanılamaz 4,5,6,7. Bu ölçümlerin zaman alıcı, hataya açık doğası, bitkilerin fenotipik ve fizyolojik stres tepkileri açısından değerlendirilmesindeki ilerlemeyi engellemektedir.
Bitkilerin görüntülerinin yakalanması ve görüntüden kantitatif özelliklerin ölçülmesi bu problemlere çözüm getirir 4,5,6,7. Görüntü analizi, bir araştırmacının ölçüm yapması gereken süreyi azaltırken doğruluğu ve hassasiyeti artırır ve tahribatsız özellik ölçümü 4,5,6,7 nedeniyle aynı bitki birden çok kez görüntülenebilir veya diğer örneklemeler için kullanılabilir. Ayrıca, bir deney tamamlandıktan ve bitkiler bertaraf edildikten çok sonra görüntüler saklanabilir ve yeniden analiz edilebilir 4,5,6,7. Görüntü analizi, ImageJ (Fiji)8 gibi düşük verimli görüntü düzenleme araçlarıyla tek tek veya PlantCV9 gibi platformlarla bilgisayar görüşü ve makine öğrenimi kullanılarak daha yüksek aktarım hızında tamamlanabilir. PlantCV, araştırmacıların önce bir bitkiyi veya başka bir nesneyi bir görüntünün arka planından maskelemelerini (veya ayırmalarını) ve bu bitki veya nesnenin boyut, morfoloji, renk ve daha fazlasını ölçmelerini sağlayan ücretsiz, açık kaynaklı bir görüntü analiz platformudur9. Modüler bir iş akışı kullanarak, bir araştırmacı önce örnek bir görüntü ile farklı modüllerden oluşan esnek bir iş akışı (veya boru hattı) oluşturur, ardından kalan görüntüleri her bir görüntüyle etkileşime girmeden yüksek verimli iş akışına tabi tutar9. Nicel özellikler çıktı alınır ve gruplar arasındaki istatistiksel olarak anlamlı farklılıklar için analiz edilir. Derin Öğrenme işlem hatları, yeterli sayıda görüntü yakalandıktan ve uygun özellik ölçümleri veya meta verilerle etiketlendikten sonra verimli, otomatik görüntü analizi için geliştirilebilir10.
"Yüksek verimli" fenotipleme, veri toplama ve/veya veri analizi sırasında hızı artırabilir ve insan emeğini azaltabilir 4,5,6,7. Yüksek verimli fenotipleme tesisleri, bitkilerin konveyör bantları üzerinde veya robotlar aracılığıyla bir görüntüleme istasyonuna taşındığı ve otomatik olarak bitki 6,11,12,13,14 ile ilişkili adla (yani meta veri içeren etiket) etiketlendiği kontrollü ortamlarda görüntü toplamanın otomasyonunu sağlamıştır . Bu konveyör bantları veya robot özellikli tesisler, insan müdahalesi olmadan büyük miktarda görüntünün yakalanmasını ve etiketlenmesini sağlarken, dünyada çok az sayıda var ve inşa etmek milyonlarca dolara mal olabilir, bu da onları birçok araştırmacı için erişilemez hale getiriyor. Bu otomatik görüntüleme kavramlarını daha düşük bir maliyetle uygulamak için, Raspberry Pi (burada tek kartlı bilgisayarlar, SBC olarak anılacaktır), kontrollü ortamlarda yetiştirilen bitkilerin görüntülerini yakalamak, adlandırmak, depolamak ve aktarmak için kullanılan düşük maliyetli bilgisayarlardır (her biri 35 dolardan az). Bu kurulumlar, 72 Raspberry Pi 12,15,16'ya kadar bir dizi kullanarak görüntüleri otomatik, zamanlanmış aralıklarla yakalar. Milyonlarca dolara mal olabilen konveyör bant sistemlerinden daha uygun maliyetli olsa da, daha önce açıklanan SBC büyüme odaları, büyüyen küçük bitkilerin yukarıdan aşağıya görünümü için en uygun olanıdır ve yine de çok sayıda SBC15 gerektirir. Tarla ortamlarında, köprüler, insansız hava araçları gibi UAS (mürettebatsız hava sistemleri) ve uyduların tümü, bitki özelliklerinin analizi için görüntüler yakalar17,18. Hem saha sistemleri hem de yüksek verimli kontrollü ortam tesisleri, sistemleri oluşturmak ve bakımını yapmak ve ayrıca görüntüleri analiz etmek için gerekli olan ön maliyetleri, bakımları ve uzman bilgileri açısından engelleyici olabilir17,18. Bitki fotoğrafçılığı için tek başına kullanılan cep telefonları ve dijital kameralar, aşağı akış görüntü analizi için gerekli olan meta verilerle görüntü aktarımı ve adlandırma gibi zaman alıcı zorluklar sunar.
Burada açıklanan yöntemler, diğer sistemler tarafından ele alınmayan zorluklar için tesis görüntülemeye düşük maliyetli bir çözüm sunar. Bitkilerin tek tek stüdyoya taşındığı bir fotoğraf kurulumu, saksılardaki her büyüklükteki bitkinin verimli bir şekilde ölçülmesine olanak tanır. Bir dijital kameraya bağlı bir SBC kullanarak, bu yöntem önce görüntülerin standartlaştırılmış olarak yakalanmasını, etiketlenmesini ve aktarılmasını sağlar. Görüntüleri yakalandıkları gibi adlandırmak için bir klavye veya QR/barkod tarayıcı kullanmak, görüntüleri yakalandıktan ve depolandıktan sonra meta verilerle yeniden adlandırmanın zaman alıcı ve hataya açık etkinliğini ortadan kaldırır. Görüntünün bileşimi ve önerilen kamera ayarları, aşağı akış görüntü analizini mümkün kılmak için önemlidir ve yönergeler burada ayrıntılı olarak açıklanmıştır. Son olarak, yakalanan görüntülerden yaprak alanı, bitki yüksekliği, genişliği ve rengi gibi nicel özellikleri çıkarmak için PlantCV'de bir görüntü analizi boru hattı sağlanır.
Konveyör bant sistemlerine göre, bu yöntem düşük maliyetlidir ve tek bir SBC gerektirir. Burada açıklanan fenotipleme kurulumu, bir konveyör bandının veya robotik sistemlerin kısıtlamalarını ve maliyetlerini ortadan kaldırmak için inşa edilmiştir - kurulum büyüme alanından ayrılabildiği için herhangi bir boyuttaki tesis ölçülebilir, yalnızca tek bir SBC'ye ihtiyaç vardır ve maksimum esneklik ve satın alınabilirlik için çok sayıda kamera türüyle çalışır. Burada sunulana benzer yaklaşımlar arasında PhenoBox veya PhenoRig12,19 bulunur. Manuel ölçümlerle karşılaştırıldığında, bu yöntem zamandan tasarruf sağlar, hataları azaltır ve bitkileri tahrip etmez 4,12,15,19.
Protokol
Bu protokolde kullanılan reaktifler ve ekipmanla ilgili ayrıntılar Malzeme Tablosunda listelenmiştir.
1. Fotoğraf stüdyosunun hazırlanması
- Yandan görünüm görüntüleme için siyah fotoğrafçılık sınıfı kumaşı duvara veya tavana asın. Kumaşı zemine en az 0.5 m örtün, böylece bitki kumaşın üzerine yerleştirilir (Şekil 1).
NOT: Kumaş, görüntülenecek bitkiden en az 100 cm daha uzun ve daha geniş olmalıdır. - Arka plana, çerçevede görülebilecek şekilde kutu gibi bir nesneye dayanacak şekilde bir renk kartı yerleştirin (Şekil 1). 30 cm'den uzun veya geniş bitkiler için en az 20 cm genişliğinde bir renk kartı kullanın. Boyu 30 cm'den küçük veya genişliğindeki bitkiler için 4-8 cm genişliğinde bir renk kartı kullanın.
- Bir dizüstü veya masaüstü bilgisayara bir SD kart takın. Raspberry Pi Imager'ı web sitesindeki (https://www.raspberrypi.com/software/) yazılım bölümünden indirin ve sağlanan raspberrypi-image-capture.img.gz dosyasını (https://github.com/danforthcenter/photo-maize-paper) dizüstü veya masaüstü bilgisayara indirin.
- İndirilen görüntüleyici (.exe) dosyasını açarak Görüntüleyiciyi başlatın. İşletim Sistemi Seç düğmesine tıklayın ve alttaki Özel Kullan düğmesini seçin. image-capture.img.gz dosyasını seçin.
- Ardından, Depolama Alanı Seç düğmesine tıklayın ve bilgisayara takılı SD kartı seçin. Yaz düğmesine tıklayın.
NOT: Doğru SD kartın seçildiğinden emin olun, çünkü bu işlem kartta depolanan tüm verileri silecektir.
- Ardından, Depolama Alanı Seç düğmesine tıklayın ve bilgisayara takılı SD kartı seçin. Yaz düğmesine tıklayın.
- SBC'nin en son sürümünü bir USB kablosu kullanarak bir klavyeye, bir HDMI kablosu kullanarak harici bir monitöre ve anahtarlı bir güç kablosu kullanarak bir anahtarlı uzatma kablosuna bağlayın. Monitörle birlikte verilen güç kablosunu kullanarak monitörü anahtarlı uzatma kablosuna bağlayın. SD kartı SBC'ye yerleştirin. Kurulumun etiketli şeması için Şekil 1'e bakın.
- Şerit üzerindeki düğmeye basarak anahtarlı uzatma kablosunu açın, monitördeki düğmeyi kullanarak monitörü açın, ardından güç kablosundaki anahtarı "açık" konuma getirerek SBC'yi açın.
- SBC'yi WIFI veya bir ethernet kablosu kullanarak yerel internete bağlayın.
- Fotoğraflar doğrudan bir sunucuya veya bulut depolama alanına aktarılacaksa:
- SBC'deki "CAPTURE-PHOTO.py" dosyasını, aktarımı tamamlamak için dosya yolunu içerecek şekilde düzenleyin.
- Terminalde aşağıdaki komutu kullanarak win-credentials dosyasını sunucu veya bulut depolamanın yolu ve parolasıyla düzenleyin: sudo nano /etc/win-credentials.
NOT: Klasörün dosya aktarma iznine sahip olduğundan emin olmak için internet sistem yöneticisine başvurun.
- USB veya Bluetooth kullanarak, barkod tarayıcıyla birlikte verilen üretici talimatlarını kullanarak SBC'ye kablosuz bir barkod tarayıcı bağlayın.
- Ekranın sol üst köşesindeki Raspberry Pi düğmesine tıklayarak, Oturumu Kapat'a tıklayarak ve ardından SBC'yi güvenli bir şekilde kapatmak için Kapat'a tıklayarak SBC'yi kapatın. Kapattıktan sonra, SBC güç anahtarını "açık", güç kablosunu "kapalı" ve anahtarlı uzatma kablosunu "kapalı" konuma getirin.
2. Bitki büyümesi ve stres tedavisi
NOT: Herhangi bir bitki bu fenotipleme yöntemi için uygundur; Bu bitki yetiştirme yöntemleri, burada sunulan temsili sonuçlara uygulanabilir.
- Bir stok merkezinden B73 veya başka bir mısır çeşidinin tohumlarını alın.
- Toprak ortamını ve büyüme koşullarını hazırlayın:
- 3,5 inçlik saksıları (0,7 L) hacimce 1:1 Turface MVP ve Berger BM7-35 karışımıyla 3 lb/metreküp yavaş salınan gübre 14-14-14 (N-P-K) ile doldurun. Tencereleri delikli bir tepsiye koyun ve ters ozmoz (RO) suyuyla iyice sulayın.
- Bir büyüme odasını aşağıdaki çevresel koşullara ayarlayın: 30 °C gündüz/20 °C gece, 16 saat gündüz uzunluk, %60 nem ve gün boyunca saksı seviyesinde 500 mmol.m-2 s-1 ışık. Isı stresi için 38 °C gündüz/28 °C gece dışında aynı koşullara sahip ayrı bir büyüme odası ayarlayın.
- Her biri 3,5 inçlik bir tencereye 20 mısır tohumu, toprağın ~2 cm derinliğine yerleştirerek ve yer değiştiren toprakla kaplayarak ekin. RO suyu ile iyice sulayın ve kontrol büyüme odasına yerleştirin. Her gün sıvı gübre ile sulayın (üreticinin talimatlarına göre karıştırılır; Malzeme Tablosuna bakınız).
NOT: Deney için gerekli olan ekstra bitkilerin ekilmesi, bir stres uygulamasının başlamasından önce zayıf çimlenme ve tekdüzelik eksikliğine neden olacaktır. Çimlenme oranı çeşide göre değişecektir. - 21 günlük büyümeden sonra, en homojen bitkilerden 16'sını (tedavi başına n = 4 bitki), RO suyu ile önceden ıslatılmış, aynı saksı toprağı karışımıyla doldurulmuş 3.79 L saksıya nakledin. Bitkileri kontrol büyüme odasına geri koyun.
- 25. günde (dikimden 4 gün sonra), bitkilerin yarısını (n = 8) odadaki ışıklar yandığında ısı stresi odasına taşıyın. Kuraklık stresi altındaki bitkileri her iki odacıkta da sulamayı bırakın (oda başına n = 4).
NOT: Kuraklık stresi olan bitkilerin, bitkilerin deneyin sonuna kadar hayatta kalabilmesi için sulanması gerekebilir; Burada kuraklık bitkileri 31. ve 37. günlerde gübre suyu ile sulandı. - 38. günde (stresin başlamasından 13 gün sonra), bitkileri görüntüleme için büyüme odalarından çıkarın.
3. Bitki görüntüleme
- SBC'yi başlatın (bkz. Şekil 2):
- Çoklu priz üzerindeki anahtarı kullanarak anahtarlı uzatma kablosunu açın.
- Monitördeki düğmeyi kullanarak monitörü açın.
NOT: Monitör açılmadan önce SBC açılırsa, düzgün şekilde başlamaz. - SBC güç kablosundaki anahtarı "açık" konuma getirin.
NOT: Bu, SBC'yi açacak ve monitörde açılacaktır; SBC'nin kendisinde "açma" düğmesi yoktur, yalnızca güç kablosunda bulunur.
- Fotoğraf makinesini bir tripod veya sabit bir masaya yerleştirin.
NOT: Bitki ve renk kartının tamamı kamera ekranında görünmelidir. Kamera yere dik olmalı ve bitkinin merkezinin doğrudan bir görüntüsüne (açı yok) sahip olmalıdır. Kameranın gphoto2 paketiyle uyumlu olması gerekir ve burada bir liste bulunabilir: http://www.gphoto.org/proj/libgphoto2/support.php. - Kamera veya pillerle birlikte bir güç kablosu aracılığıyla kameraya güç sağlayın. Fotoğraf makinesi üzerindeki düğmeyi kullanarak fotoğraf makinesini açın.
- Kamerayla birlikte verilen veri aktarım kablosunu kullanarak kamerayı SBC'deki USB bağlantı noktasına bağlayın.
- Fotoğraf kurulumunda bitkiyi düzenleyin:
- Yerleştirmenin her bitki için aynı olduğundan emin olmak için saksının yerleştirileceği fotoğraf sınıfı kumaşın üzerine bir parça koyu renkli bant yerleştirin. Renk kartının bant parçasıyla aynı hizada olduğundan emin olun.
NOT: Renk kartını bitkinin kenarından en az 10 cm uzağa yerleştirin. PlantCV iş akışındaki (aşağıda) kalite kontrolü sırasında, renk çiplerinin nihai özellik çıkarımına dahil edilmediğinden emin olmak için görüntü yalnızca bitkiyi ve saksıyı içerecek şekilde kırpılabilmeli, ancak renk kartını içermeyecek şekilde kırpılabilmelidir. Yüksek ve düşük kaliteli görüntü örnekleri için Şekil 2'ye bakın. - Tencereyi bant parçasının üzerine yerleştirin. Mısır (Zea mays) ve sorgum (Sorghum bicolor) gibi bir düzlemde büyüyen bitkiler için, bitkinin kameraya doğru en geniş açısına bakın. Bir düzlemde büyümeyen bitkiler için, bitkinin 0 ve 90 derecelik açılarını yakalayın ve görüntü analizi tamamlandıktan sonra elde edilen nicel ölçümlerin ortalamasını alın.
- Yerleştirmenin her bitki için aynı olduğundan emin olmak için saksının yerleştirileceği fotoğraf sınıfı kumaşın üzerine bir parça koyu renkli bant yerleştirin. Renk kartının bant parçasıyla aynı hizada olduğundan emin olun.
- Monitörde gösterilen SBC masaüstü ekranında, sol üst menü çubuğundaki terminal düğmesine tıklayarak terminali açın.
- Doğrudan bir sunucuya veya bulut depolama alanına kaydediyorsanız, gerekli bulut depolama yolunu (aşağıdaki örnekte cloud-storage-path) ve parolayı düzenleyerek, açık terminal penceresine kod satırını yazarak ve klavyede enter tuşuna basarak aşağıdaki komutu kullanarak depolamayı bağlayın. Fabrika ayarlarından değiştirilmezse, kullanıcı kimliği (UID) "pi" olacaktır.
NOT:
sudo mount -t cifs -o kimlik bilgileri=/etc/win-credentials,uid=pi //cloud-storage-path /mnt/cloud-storage - Aşağıdaki kodu terminale yazın ve klavyede enter tuşuna basın. Yeni bir pencere açılacaktır.
./RUN-PHOTOSTUDIO-SHELL.sh
NOT: RUN-PHOTOSTUDIO-SHELL.sh dosyası, yukarıdaki yöntem kullanılarak yüklenmişse pi'ye önceden yüklenmiş olan CAPTURE-PHOTO.py dosyasını çağırır. Alternatif olarak, bu komut dosyaları mevcut bir Raspberry Pi SD kartına takmak için GitHub'da sağlanmıştır. - Bir grafik kullanıcı arayüzü penceresi açılacaktır. Görüntünün adını yazın veya bir barkod tarayıcı kullanarak tesisin barkodunu veya QR kodunu tarayın.
- Görüntüyü yerel olarak veya bağlı bir sunucuya/bulut depolama alanına kaydetmek için bir seçenek belirleyin.
- Tıkla Fotoğraf çekmek için buraya tıklayın! düğme.
- Yerel depolama seçildiyse, görüntüyü incelemek için masaüstündeki FOTOĞRAFLAR klasörünü açın. Bir sunucu veya bulut depolama seçildiyse, görüntüyü o konumda açın.
- Gerekirse, kamerayı SBC'den çıkararak, üreticinin talimatlarını kullanarak ayarlayarak ve tekrar SBC'ye takarak kameradaki ayarları yapın.
NOT: Pozlama, parlaklık, kontrast vb. ayarların odadaki aydınlatmaya ve görüntülenen nesneye bağlı olarak ayarlanması gerekebilir. Yaygın bir hata, görüntüleri aşırı pozlamaktır. Bir test görüntüsünün pozlamasını kontrol etmek için, pozlama için bir kalite kontrol kontrolü içeren PlantCV görüntü analizi iş akışı aracılığıyla test görüntüsüyle devam edin. Histogramlar uygun şekilde dağıtılana kadar pozlamayı azaltmak veya artırmak için kamera ayarlarını gerektiği gibi ayarlayın. - Tüm görüntüler yakalandıktan sonra, USB depolama, internet tarayıcısı veya SSH aktarımı gibi tercih edilen yöntemi kullanarak görüntüleri SBC'den yerel bir bilgisayara veya bulut depolama alanına aktarın.
4. Görüntülerden özellik çıkarma
- Aşağıdaki dosyaları yerel bir bilgisayara veya sunucuya indirin: "photo-studio-SV-notebook.ipynb", "workflow.py" ve "photo-studio-SV-config.json". Tüm dosyalar GitHub'da (https://github.com/danforthcenter/photo-maize-paper) mevcuttur.
- Açıklanan adımları (https://plantcv.readthedocs.io/en/latest/installation/) kullanarak PlantCV'yi yerel bilgisayara veya sunucuya yükleyin.
- JupyterLab veya Visual Studio Code gibi tercih edilen kod düzenleyicisini kullanarak photo-studio-SV-notebook.ipynb dosyasını açın.
- Yalnızca görüntüdeki bitkinin temiz bir maskesini elde etmek için kod bloğunda belirtilen parametreler göz önüne alındığında gerektiği gibi düzenleyerek her bir kod bloğunu çalıştırın.
- Örnek görüntünün analizinden memnun kaldığınızda, dosyayı tercih edilen kod düzenleyicisinde workflow.py açın. Bu dosyayı "photo-studio-SV-notebook.ipynb" içinde değiştirilen parametrelerle düzenleyin ve kaydedin.
- Dosyayı photo-studio-SV-config.json açın ve dosyada belirtildiği gibi bir giriş görüntüleri klasörüne, istenen bir çıktı klasörüne vb. yönlendirmek için dosya yollarını düzenleyin.
- Bir terminal açın ve PlantCV'yi etkinleştirmek için aşağıdaki kodu çalıştırın. Bunu yapmak için kodu yazın conda activate plantcv terminale girin ve klavyede enter tuşuna basın.
- Aşağıdaki kod satırını "photo-studio-SV-config.json" dosyasının dosya yoluna değiştirin (aşağıdaki kodda yapılacak tek değişiklik budur).
- Terminalde, düzenlenen kodu yazın ve klavyede enter tuşuna basın. Bu, iş akışını denemede yakalanan tüm görüntüler üzerinde çalıştırır.
NOT:
plantcv-run-workflow --config /Users/KULLANICI ADICI/photo-studio-SV-config.json
- Terminalde, düzenlenen kodu yazın ve klavyede enter tuşuna basın. Bu, iş akışını denemede yakalanan tüm görüntüler üzerinde çalıştırır.
- Kodun tüm görüntüler için uygun olup olmadığını belirlemek için çıktı görüntülerini inceleyin.
NOT: Bitkinin mavi ve pembe dış hatları bitkinin kenarlarında olmalı ve görüntüde başka hiçbir nesne olmamalıdır. Gerekirse, "photo-studio-SV-analysis.ipynb" adresine geri dönün ve sorunlu görüntüleri test edin ve istenen sonuçları elde etmek için kodu, özellikle maskeleme adımlarını ve gürültü azaltmayı düzenleyin. Yüksek, kabul edilebilir ve düşük kaliteli görüntü segmentasyonu örnekleri için Şekil 3'e bakın. - Çıktı dosyası bir .json dosyası biçiminde olacaktır. Terminale geri dönün ( conda activate plantcv'nin zaten çalıştırıldığından emin olun), aşağıdaki kodu yazın ve dosyayı aşağı akış istatistiksel analizi için .csv dönüştürmek için klavyede enter tuşuna basın ve dosya yolunu "results-photo-studio.json" dosyasınınkiyle değiştirin.
plantcv-utils json2csv -j /kullanıcılar/KULLANICI ADI/results-photo-studio.json -c /Kullanıcılar/KULLANICI ADI/results-photo-studio.csv
NOT: Ölçümleri piksellerden cm gibi standart bir ölçü birimine dönüştürmek için PlantCV iş akışındaki find_color_card işlevinden sağlanan dönüştürmeyi kullanın. - Farklı bitki türleri, çeşitleri, tedavileri ve zaman noktaları nedeniyle bitki fenotiplerindeki farklılıkları belirlemek için çıktı kantitatif özelliklerinin istatistiksel analizini yapın.
NOT: R Studio'daki pcvr paketi, PlantCV'den elde edilen çıktıları istatistiksel anlamlılık ve sonuçların çizimi için analiz etmek üzere formüle edilmiştir20. Şekil 4'te toplanan özelliklerin bir özetine ve görsel temsiline bakın.
Sonuçlar
Bu yöntemi geliştirmek için, B73 mısır bitkileri, kontrol sıcaklıkları, ısı sıcaklıkları, iyi sulanma ve kuraklık koşulları altında kantitatif fenotipler ve bunların kombinasyonları için toplam dört muamele için değerlendirildi. B73, zengin genetik verilere sahip, iyi bilinen bir akraba mısır çeşididir21.
PlantCV'deki görüntü analizi, Şekil 3'te gösterildiği gibi, görüntülerin rengini başarıyla düzeltti, nicel sonuçları bitki meta verileriyle etiketledi ve bitkiyi arka plandan bölümlere ayırdı (başka bir deyişle ayırdı). Başarısız bir analiz, bitkinin dış tarafındaki mavi anahattı veya pembe şekli göstermeyen, bunun yerine ek gürültü veya bitkinin eksik parçalarını içeren çıktı görüntüleri sağlayacaktır (Şekil 3, düşük kaliteli örnek). Maskeye mümkün olduğunca çok bitkinin dahil edilmesi için çift kanallı bir eşik gerekliydi ("photo-studio-SV-notebook.ipynb" bölümündeki alternatif tek kanallı stratejilere bakın). Bununla birlikte, bazı bitkiler, özellikle mor renkli gövdeli olanlar, mükemmel bir segmentasyona sahip değildi, ancak aşağı akış analizi için yeterliydi (Şekil 3).
PlantCV analizi, Şekil 4'te özetlenen 16 nicel, tek değerli özellik sağlamıştır. Tek bir değer özelliği, bitki başına bir değer sağlar - örneğin, yaprak alanı, yükseklik, genişlik ve renk tonu dairesel ortalaması. Yaprak alanı "analyze.shape" fonksiyonu (Şekil 4) kullanılarak dikkate alındı ve tüm bitki olarak kabul edildi. Bununla birlikte, yükseklik ve genişlik, bitki toprağı çizgisine çizilen bir sınır ile "analyze.bound_horizontal fonksiyonu" kullanılarak dikkate alındı. Bunun nedeni, saksının kenarından sarkan bitkilerin, bitkiyi bir bütün olarak ele alındığında daha büyük bir yüksekliğe sahip olması ve bunun yerine yalnızca toprakla buluştuğu bitki tabanından ölçülmesi gerektiğidir. Tek değerli özelliklere ek olarak, PlantCV, bitkinin her bir pikselini temsil eden, özellikle renk değerlerinin histogramları olan çok değerli özellikler çıkarır. Dairesel renk tonu ortalaması, tüm bitki için ortalama renk tonu değeri olan tek değerli bir özelliktir.
Hangi özelliklerin en ilginç olduğunu belirlemek için, her bir özellik için tedavi tarafından açıklanan varyans ve pcvr R Studio paket20'deki "frem" fonksiyonu kullanılarak farklı özellikler arasındaki korelasyon hesaplandı (Şekil 5A). Yaprak alanı, yükseklik, genişlik ve renk tonu dairesel ortalaması, işleme bağlı varyansın %50'sinden fazlasını açıkladıkları ve bitki büyümesi (alan, yükseklik ve genişlik) ve sağlığın (renk tonu) ilgili ölçümleri oldukları için aşağı akış analizi için seçilmiştir. En büyük ve en küçük yaprak alanına sahip bitkinin temsili görüntüleri, bu deneyde toplanan fenotiplerdeki varyasyonu göstermektedir (sırasıyla Şekil 5B,C). En büyük yaprak alanına sahip bitki aynı zamanda en yüksek ortalama renk tonuna sahipti ve B73, iyi sulanan, ısı stresli bir bitkiydi (Şekil 5B). En küçük yaprak alanı en küçük ortalama renk tonuna sahipti (Şekil 5C) ve B73, kuraklık stresli, ısı stresli bir bitkiydi.
Su arıtmanın yaprak alanı (F(1,13) = 226.5, p = 1.32 x 10-9), yükseklik (F(1,13) = 21.1, p = 0.0005), genişlik (F(1,13) = 75.5, p = 8.92 x 10-7) ve renk tonu dairesel ortalamasının (F(1,13) = 27.8, p = 0.0002) belirlenmesinde anlamlı bir etkisi olmuştur, tedavi etkisi için doğrusal regresyon modeli ve R Studio'da iki yönlü bir ANOVA kullanılarak belirlenmiştir ( Tablo 1'deki tam sonuçlar). Sıcaklık işleminin yükseklik üzerinde anlamlı bir etkisi vardı (F (1,13) = 5.94, p = 0.03), ancak yaprak alanı, genişlik veya renk tonu dairesel ortalaması üzerinde anlamlı bir etkiye sahip değildi (p > 0.05, Tablo 1). Sıcaklık ve su durumu arasındaki etkileşim, ölçülen özelliklerin hiçbirinde önemli bir faktör değildi (p > 0.05, Tablo 1).
Daha sonra, bireysel tedaviler, çoklu karşılaştırmalar için bir Sidak düzeltmesi ile doğrusal regresyon ve post-hoc test (tahmini marjinal ortalamalar) kullanılarak kontrol ve birbirleriyle karşılaştırıldı (Şekil 6). Yaprak alanı, bitki boyu, bitki genişliği ve renk tonu dairesel ortalaması, kuraklık stresi altındaki bitkilerde her iki sıcaklık koşulunda da iyi sulananlara kıyasla önemli ölçüde azalmıştır (p < 0.05, Şekil 6). İyi sulanırken ısı stresi sadece bitki boyunu azalttı (p < 0.05, Şekil 6), ancak yaprak alanını, bitki genişliğini veya dairesel renk tonunu önemli ölçüde azaltmadı. Renk tonundaki bu fark, yalnızca bir ortalamadan ziyade Şekil 7'de bir histogram olarak çizilen çok değerli renk özelliği tonunun değerlendirilmesiyle daha fazla araştırılabilir. Kuraklık nedeniyle ortalama renk tonundaki azalma, kloroz olarak bilinen yeşil piksellerden sarı piksellere geçişten kaynaklanıyordu (Şekil 7). Isı, ortalama renk tonunda önemli bir fark göstermezken, yeşil rengin hem sararması (kloroz) hem de koyulaşması nedeniyle bir azalma ve artış göstermiştir (Şekil 7).
Görüntüleme sonrası bitkiler kök-sürgün birleşim yerinden kesilerek toprak üstü dokunun ağırlığı kaydedildi. Kökler nazikçe yıkandı ve bir havluyla kurutuldu, daha sonra açıklanan görüntü tabanlı fenotipleme yöntemiyle karşılaştırmak için toplam bitki biyokütlesini (ağırlık olarak da bilinir) hesaplamak için tartıldı. Görüntü analizi ile ölçülen yaprak alanı, bitki biyokütlesi ile güçlü bir şekilde ilişkilidir (R2 = 0.84, Şekil 8).

Şekil 1: Bitki görüntülerini toplamak için etiketlenmiş bileşenlerle fotoğraf stüdyosu kurulumunun görüntüsü. (A) Fotoğraf kalitesinde kumaş, (B) renk kartı, (C) saksıları düzgün bir şekilde yerleştirmek için bant çizgisi, (D) dijital kamera, (E) tek kartlı bilgisayar, (F) görüntü yakalama işlemini gösteren monitör. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Görüntüleme iş akışına genel bakış. Temsili bir "yüksek kalite" ve "düşük kalite" görüntüsü sağlanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
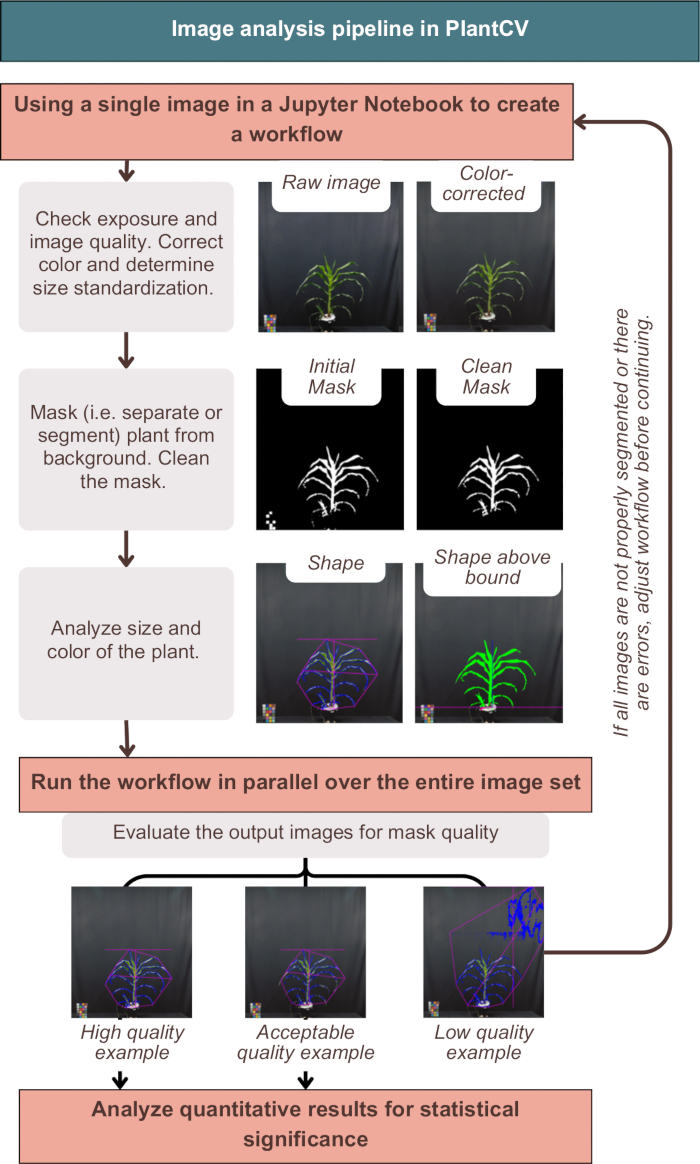
Şekil 3: PlantCV'deki görüntü analizi iş akışına genel bakış. "Yüksek", "kabul edilebilir" ve "düşük" kalite segmentasyonunun temsili görüntüleri sunulmaktadır; PlantCV özellikleri, tüm bitki şeklinin pembe bir taslağı ve bitki alanının mavi bir taslağı kullanılarak temsil edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Analizden elde edilen şekil özelliklerinin özeti ve görsel temsili. PlantCV'de şekil işlevi. Mor kutular, hesaplamalarında başka bir özellik kullanmayan özellikleri temsil eder. Turuncu kutular, hesaplamalarında diğer özellikleri kullanan özellikleri temsil eder; Oklar, bu hesaplamalarda hangi özelliklerin kullanıldığını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
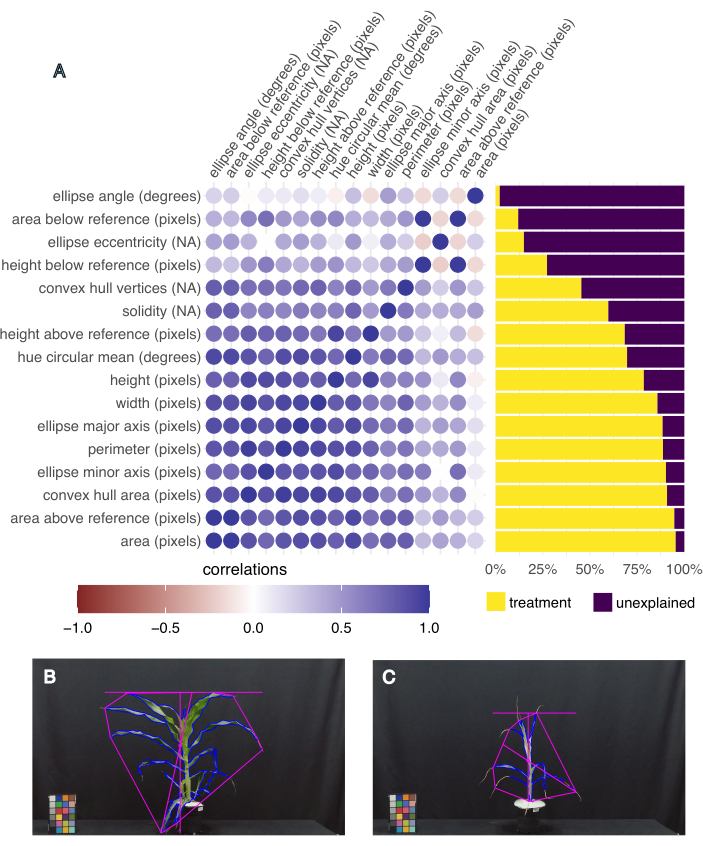
Şekil 5: Görüntü tabanlı fenotipleme, fenotipik varyansı ve ilişkili özellikleri yakalar. (A) Tedavi ile açıklanan özelliklerin varyansı (sağda) ve özelliklerin birbiriyle korelasyonu (solda). Her özellik etiketlenir, ardından ölçü birimi gelir; "NA", birimsiz bir ölçüm olduğu anlamına gelir. (B) En yüksek yaprak alanına ve en yüksek renk dairesel ortalamasına (derece) sahip bitkinin görüntüsü. (C) En küçük yaprak alanına ve en düşük renk tonu dairesel ortalamasına (derece) sahip bitkinin görüntüsü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
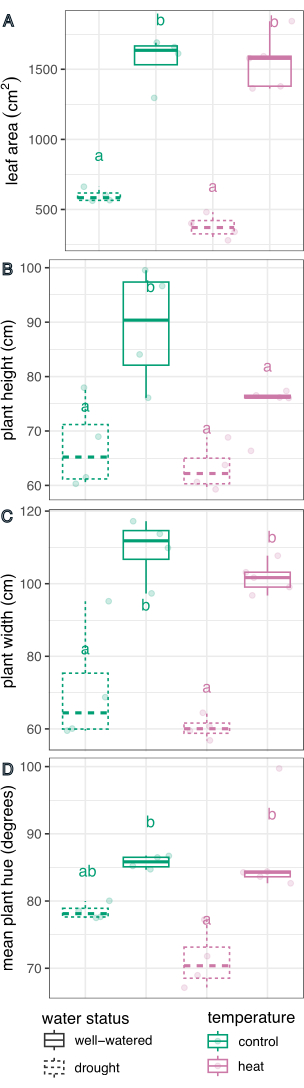
Şekil 6: Bitki fenotipleri üzerindeki tedavi etkilerinin kutu grafiği karşılaştırması. Yaprak alanı (A), yükseklik (B), genişlik (C) ve renk tonu dairesel ortalaması (D), kuraklık, ısı ve birleşik gerilmelerin etkisi için karşılaştırılır. n = 4 olur. Harfler, tedaviler arasında istatistiksel olarak anlamlı farklılıkları temsil eder (p < 0.05); tedaviler doğrusal regresyon ve post-hoc test (tahmini marjinal ortalamalar) kullanılarak karşılaştırıldı ve çoklu karşılaştırmalar için Sidak düzeltmesi yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
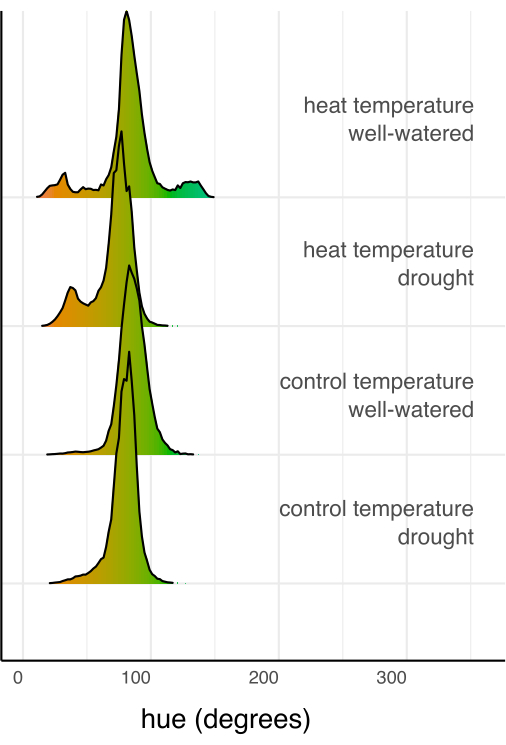
Şekil 7: Her tedavi kombinasyonunun tüm piksellerinin toplamı ve tedavi kombinasyonundaki toplam piksel sayısı ile normalize edilmiş renk (ton) histogramları. Histogramlar, ton derecesi için renk değerine göre renklendirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
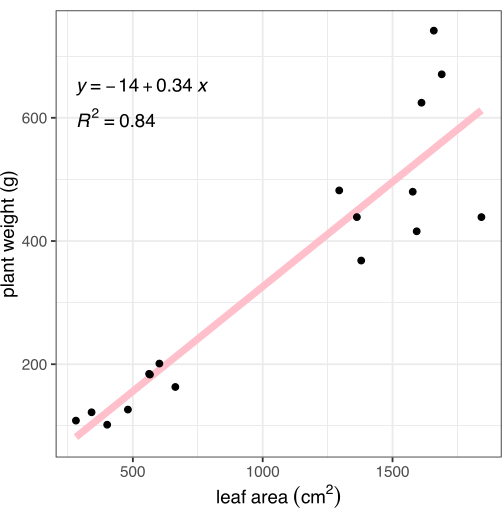
Şekil 8: Görüntülerden ölçülen yaprak alanının tüm bitki biyokütlesi ile korelasyonu. Her siyah nokta bir bitkiyi temsil eder. Pembe çizgi, yaprak alanı (X) ile biyokütle (Y) arasındaki doğrusal korelasyonu temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Özellik | Etken | Serbestlik dereceleri | F değeri | p-değeri |
| Yaprak Alanı (cm^2) | Sıcaklık | 1 | 0.5372 | 0.4766 |
| Yaprak Alanı (cm^2) | Su | 1 | 226.5318 | 1.32E-09 |
| Yaprak Alanı (cm^2) | Sıcaklık: Su | 1 | 2.1526 | 0.1661 |
| Yaprak Alanı (cm^2) | Kalıntılar | 13 | ||
| Yükseklik (cm) | Sıcaklık | 1 | 5.9426 | 0.0298935 |
| Yükseklik (cm) | Su | 1 | 21.107 | 0.0005029 |
| Yükseklik (cm) | Sıcaklık: Su | 1 | 2.1752 | 0.1640545 |
| Yükseklik (cm) | Kalıntılar | 13 | ||
| Genişlik (cm) | Sıcaklık | 1 | 2.2495 | 0.1575 |
| Genişlik (cm) | Su | 1 | 75.5474 | 8.92E-07 |
| Genişlik (cm) | Sıcaklık: Su | 1 | 0.0839 | 0.7766 |
| Genişlik (cm) | Kalıntılar | 13 | ||
| renk tonu dairesel ortalama (derece) | Sıcaklık | 1 | 0.9154 | 0.3561432 |
| renk tonu dairesel ortalama (derece) | Su | 1 | 27.7988 | 0.0001509 |
| renk tonu dairesel ortalama (derece) | Sıcaklık: Su | 1 | 3.4792 | 0.0848724 |
| renk tonu dairesel ortalama (derece) | Kalıntılar | 13 |
Tablo 1: Su arıtma, sıcaklık arıtımı ve bunların bitki özellikleri üzerindeki etkileşimlerini inceleyen doğrusal regresyon modeli ve iki yönlü ANOVA analizlerinin sonuçları.
Tartışmalar
Görüntü tabanlı fenotipleme, bitki fenotiplerinin 4,5,6,7 doğru, hızlı ve nicel ölçümlerini sağlar. Bu yöntem önemli ölçüde daha hızlı, daha kesin, daha doğrudur ve bitki boyunu kaydetmek için manuel olarak bir cetvel kullanmaktan veya sağlıkla ilgili olabilecek bitki renk özelliklerinin kalitatif ölçümlerinden daha fazla sayıda ölçüm sağlar 4,5,6,7. Yaprak alanı burada ve önceki araştırmalarda10, bitki biyokütlesi ile güçlü bir şekilde ilişkili olarak görülmüştür (Şekil 8), bu önlemin, tüm bitki biyokütlesini manuel olarak tartmanın zaman alıcı, yıkıcı ve hataya açık sürecinin güvenilir bir şekilde yerini alabileceğini düşündürmektedir. Görüntüleri yakalamak için tek başına bir kamera kullanılabilirken, düşük maliyetli SBC'nin eklenmesi, görüntü toplama ve gerekli meta verilerle görüntü etiketleme otomasyonu yoluyla verimi artırdı15. Bu yöntem, günde bir kez (veya daha az sıklıkta) görüntülenen bir ila ~ 300 bitki için uygundur. Bir deneydeki daha fazla sayıda bitki için, görüntüleme için bitkileri tek tek hareket ettirme süresi bir iş gününden daha uzun olabileceğinden, konveyör tabanlı, baş üstü portal veya robot özellikli bir görüntüleme sistemi daha uygundur11,13. Daha sık zaman noktaları için (örneğin, günde bir kez veya daha az sıklıkta değil, saatte bir görüntü), bir büyüme odasının içindeki kamera kurulumları daha uygundur çünkü görüntüleri otomatik olarak yakalarlar, ancak bitkilerin boyutuyla sınırlıdırlar ve ek SBC15'e ihtiyaç duyarlar.
PlantCV burada görüntü analizi seçeneği olarak sunulurken, başka yazılımlar da mevcuttur. ImageJ (Fiji), bir grafik kullanıcı arayüzü (GUI) aracılığıyla bitkilerin görüntüleri için de kullanılabilen, görüntü analizi için ücretsiz bir yazılım paketidir8; bununla birlikte, tüm tesis görüntü analizi için özel olarak geliştirilmemiştir, yüksek verimli bilgi işleme daha az uyarlanabilir ve yeni görüntülere kolayca uygulanabilen PlantCV'dekiler gibi halihazırda çalışan boru hatlarından daha az kolay tekrarlanabilir9. Derin Öğrenme (BioDock gibi, Malzeme Tablosuna bakınız) ve Her Şeyi Segmente Et22) yöntemleri, bitkileri arka plandan kolayca segmentlere ayırma yetenekleri nedeniyle çekicidir ve burada açıklanan segmentasyon görevleri için kullanılabilir. Bununla birlikte, bu Derin Öğrenme modelleri, burada açıklanan bitki fenotip ölçümlerini sağlamaz10 ve kantitatif fenotiplerin bu daha karmaşık ölçümlerini yapmak için büyük miktarda eğitim görüntüsü (genellikle 10.000'den fazla) ve temel bir dizüstü veya masaüstü bilgisayarın ötesinde bilgi işlem gücü gerekebilir10. Bu modeller aynı zamanda birçok araştırmacı için mevcut olmayan önemli miktarda bilgisayar belleği ve işlem gücü gerektirir10.
Protokolün en kritik adımı, bitki görüntüleme kurulumunu düzenlemek ve ilgilenilen bitkiye yakın hiçbir nesnenin (diğer bitkiler, renk kartı veya bitki kalıntıları gibi) bulunmamasını sağlamaktır14. Görüntüler uygun şekilde ayarlanmazsa veya bir renk kartı kullanılmazsa, standardizasyon mekanizması olmadığı için daha sonra analiz etmek imkansız olacaktır. Bu protokolde herhangi bir kalibrasyon adımı gerekli olmamakla birlikte, işleme sırasında renk düzeltmesi ve boyut standardizasyonu esastır. Her zaman tüm renk kartının çerçeve içinde olduğundan, ancak bitki ile örtüşmediğinden emin olun (Şekil 2). Diğer bir yaygın tuzak, gölgelere veya parlak çekimlere neden olabilen düzensiz aydınlatmadır; Eşit olmayan aydınlatmayı önlemek için parlak, dağınık tepe ışığı kullanmanızı ve odadaki pencereleri örtmenizi öneririz (Şekil 2). Tepe lambaları gölgelere neden oluyorsa, tesise tam olarak bakan bir açıyla ek lambalar eklenebilir. Görüntüdeki rengin bir renk kartı kullanılarak düzeltileceği göz önüne alındığında, ampulün türü bir sorun değildir. Bulanık görüntüler analiz için kabul edilemez - görüntülerin net olduğundan emin olmak için kameradaki otomatik odaklamayı veya üreticinin manuel odaklama talimatlarını kullanın.
Benzer şekilde, görüntülerin aşırı pozlanmamasını sağlamak (yaygın bir hata) uygun analize izin verir (Şekil 2); Aşırı pozlanmış görüntüler, görüntü analizi sırasında bir renk düzeltmesinde düzeltilemez, çünkü piksel değerleri mevcut ayarlarla kameranın algılama aralığının dışındadır14. Aşırı pozlamayı önlemek için, burada açıklanan PlantCV iş akışını kullanarak bir test görüntüsü için renk histogramlarını veya RGB değerlerini değerlendirin (Şekil 3) ve pozlama testi görüntünün aşırı pozlandığını belirlerse kameradaki parlaklık ayarını azaltın. RGB değerleri (ve dolayısıyla histogramlar) 0 veya 255'te değerlere sahip olmamalıdır, bu değer aralığıdır, çünkü bu değerlerin algılama aralığının üstünde veya altında olması mümkündür ve gerçek değer yerine yalnızca minimum veya maksimum değeri kaydedebilir. Bir test görüntüsü, aşırı pozlama için her zaman bu yöntemler kullanılarak değerlendirilmelidir (Şekil 2 ve Şekil 3); Bu yayında sağlanan PlantCV maruz kalma kalite kontrolünü, kaliteli bir görüntünün her renk için 0 veya 255'te piksellerin yüzde 5'inden daha azına sahip olduğunu belirleyen bir kontrol olarak kullanmanızı öneririz. Genel bir kural olarak, kameralar ve analiz yazılımları, eşit ve eksiksiz histogram kuyruklarına sahip olması gereken histogramlar sağlar; 0'ın altında (az pozlanmış) veya 255'in üzerinde (aşırı pozlanmış) kesilen değerler, ayarlanan kamera ayarlarıyla yeniden çekilmelidir. Pencereler çok parlak, düzensiz olabileceğinden ve alana sık sık ışık maruziyetini değiştirebileceğinden, aydınlatma için penceresi olmayan, parlak, eşit, yapay aydınlatmalı bir yer seçmenizi öneririz. Görüntüler eşit şekilde aydınlatılmış görünmeli ve bir renk kartının gri kareleri beyaz görünmemelidir, bu da aşırı pozlamayı gösterir.
Kullanıcının kurumunun IP ve güvenlik ayarlarına bağlı olarak görüntü yakalama kodu için sorun giderme gerekebilir. Sorun gidermek için internet bağlantısı ve dosya aktarımı sorunları için BT departmanıyla iletişime geçin. Yaygın bir hata, SBC için yanlış boyutta SD kart kullanmak veya bağlı monitör açılmadan önce SBC'yi açmaktır. Sorun gidermek için yukarıdaki protokolü tam olarak izleyin ve SBC yazılımını yeniden yükleyin. Çevrimiçi forumlar, gphoto2 kullanırken tercih edilen belirli kamera için sorun giderme ve çözüm bulma konusunda mükemmel bir kaynaktır. PlantCV görüntü analizinde sorun gidermek ve en güncel sürüm oluşturmayı kullanmak için dokümantasyon sayfasını (https://plantcv.readthedocs.io/en/latest/) kullanın veya GitHub'da (https://github.com/danforthcenter/plantcv/issues) bir sorun yayınlayın. Özellikle, bu protokoldeki eşikleme yöntemi bitkiyi arka plandan yeterince ayırmıyorsa, "photo-studio-SV-notebook.ipynb" veya dokümantasyon sayfasında sağlanan alternatif eşikleme yöntemlerini kullanın.
Bu yöntem, açıklanan birleştirilmiş fototografi kurulumuna taşınabilen herhangi bir bitki türüne ve tedaviye uygulanabilir. Örneğin, bir tarlada yetişen bitkiler için geçerli değildir, çünkü bitki kazılmadan fotoğraf kurulumuna taşınamazlar. Bu durumda, bitkiler kesilebilir ve daha sonra protokol kullanılarak görüntülenebilir, ancak ölçüm yıkıcı olacaktır. Tek bir görüntüde birden fazla bitki yakalanabilir ve analiz edilebilir, ancak bir kullanıcı bitkilerin birbirine temas etmesini önlemeye dikkat etmelidir (Şekil 2) ve iş akışının tüm görüntü seti üzerinde otomatik olarak çalıştırılabilmesini sağlamak için bitkiler her seferinde arka planda aynı yere yerleştirilir. Arabidopsis thaliana gibi bitkiler için yukarıdan aşağıya bir görünüm gerekiyorsa, kamerayı fotoğraf sınıfı kumaşın üzerine yerleştirilen bitkilerin tepesine taşımak için bir tripod kullanın; Görüntü yakalama ve analiz için kalan yöntemler aynı kalır.
Burada mısırda gösterildiği gibi, bu yöntem hem bitki ıslahı hem de bitkilerin sıcaklık ve kuraklık gibi abiyotik stresleri nasıl tolere ettiğine dair temel bilgiler için önemlidir. Sıcaklık ve kuraklık stresi bir araya geldiğinde mısırda dünya çapında yıllık %15-20 verim kaybına neden olmaktadır23. Sıcaklıkların 2100 yılına kadar 1,4-4,4°C artması beklendiğinden, verim kayıplarının yalnızca küresel iklim değişikliğiyle birlikte artması beklenmektedir24. Stres toleransı için mısır çeşitliliğinin değerlendirilmesinin yanı sıra abiyotik stres toleransının fenotipik, fizyolojik ve moleküler mekanizmalarının belirlenmesi, küresel gıda güvenliği için kritik araştırma hedefleridir25. Bu soruları ele almak için, tüm bitişik alanlardaki araştırmacılar - fizyologlar, genetikçiler, yetiştiriciler, moleküler biyologlar, vb. - abiyotik stres altındaki mısır bitkilerinin fenotiplerini hızlı, etkili ve genellikle tahribatsız bir şekilde değerlendirebilmelidir25. Burada gösterilen yöntem ve örnek sonuçlar bu ihtiyacı ele almaktadır ve araştırmacıların gerçek dünyadaki tarımsal zorlukları ele almaları için önemli bir araçtır.
Burada gözlemlenen fenotipler, daha önce yapılan çok sayıda araştırma göz önüne alındığında varsayılmıştır - kuraklık stresi bitki boyutunu ve yeşilliğini azaltır (renk tonu dairesel ortalaması ile ölçülür)26 (Şekil 6, Şekil 7 ve Tablo 1). Kuyu sulama ile ısı stresi fenotipi beklenmedik bir şekilde yaprak alanını önemli ölçüde azaltmadı, ancak daha fazla kopya ile bu ilişki istatistiksel olarak daha iyi değerlendirilebildi ve yükseklik beklendiği gibi kısaldı (Şekil 6). Dairesel renk tonu ortalaması ısı nedeniyle değiştirilmemiş olsa da, renk profili aslında hem daha sarı hem de daha koyu yeşil pikselleri içerecek şekilde değiştirildi, bu da sadece ortalama renk tonunun değerlendirilmesinin yetersiz olduğunu ve rengin çok değerli özellik histogramının dikkate alınması gerektiğini gösterdi (Şekil 7). Bu fenotipik değişiklikler, bir bitkinin çevreye verdiği tepkiyi tanımlar ve strese yanıt olarak meydana gelen fizyolojik değişiklikleri değerlendirmek için gaz değişimi ölçümleri, mikroskopi görüntüleme ve daha fazlası gibi ek teknikler kullanılabilir. Bu sonuç, aksi takdirde bitki sağlığının manuel veya kalitatif ölçümleri kullanılarak kaçırılacak olan kesin, nicel ölçümlerin gücünü göstermektedir. Bu bilgiler, küresel mahsul verimini önemli ölçüde azaltan ve gelecek yıllarda daha da kötüleşeceği tahmin edilen iklim değişikliğine dirençli mahsullerin yetiştirilmesi ve mühendislik mahsulleri için kritik öneme sahiptir.
Açıklamalar
Hiç kimse.
Teşekkürler
Bu çalışma, K.M.M. ve J.G.D.'ye finansman desteği sağlayan Fenotipleme Çekirdek Tesisi, Donald Danforth Bitki Bilim Merkezi'nde (RRID: SCR_019049) gerçekleştirilmiştir. Bu çalışma, Donald Danforth Bitki Bilimi Merkezi Kurumsal Araç Kiralama Araştırma Enstitüsü Hibesi tarafından desteklenmiştir. DS, Taylor Geospatial Institute Block Grant ve ABD Ekonomik Kalkınma İdaresi AgTech ve Uygulamalı Konum Bilimi ve Teknolojisi Merkezi (CATALST) hibesi (ED21HDQ0240072) tarafından finanse edildi. Kevin Reilly ve Kris Haines'e (Entegre Bitki Yetiştirme Tesisi, Donald Danforth Bitki Bilimi Merkezi, RRID: SCR_024902) bitki büyümesi konusundaki uzmanlıkları ve yardımları için teşekkür ederiz. Noah Fahlgren, Malia Gehan ve Haley Schuhl'a PlantCV hakkındaki tavsiyeleri için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15W USB-C Power Supply | CanaKit | DCAR-RSP-3A5-C | |
| 25604 UC-E6 USB Cable | Nikon | 18208256044 | |
| 3.5 inch pots | Hummert International | 13006000 | |
| Berger BM7 35% Bark HP | Hummert International | 10121500 | |
| Biodock 2024 | AI Software Platform | www.biodock.ai. | |
| Code editing software | Jupyter | https://jupyter.org/install | |
| Code editing software | Visual Studio Code | https://code.visualstudio.com/download | |
| Color Card ColorChecker Classic | Calibrite | CCC | |
| Color Card ColorChecker Passport | Calibrite | CCPP2 | |
| Conviron Growth Chamber | Conviron | BDW80 model | |
| Dell 22 Monitor | Dell | SE2222H | |
| EH-67 AC Adapter | Nikon | AZ185 | |
| Image analysis software | PlantCV | https://plantcv.readthedocs.io/en/latest/installation/ | |
| Jack's Water Soluble Fertilizer 15-5-15 | Hummert International | 7590200 | liquid fertilizer |
| Keyboard and Mouse | Logitech | 1440638 | MK270 wireless keyboard and mouse |
| Maize seed | USDA-ARS Germplasm Resources Information Network (GRIN) | B73 | https://www.ars-grin.gov/ |
| Micro HDMI to HDMI cable | Amazon | B07KSDB25X | |
| Nikon Coolpix B500 camera | Nikon | ||
| Nikon D7200 camera | Nikon | ||
| Osmocote 14-14-14 | Hummert International | 7630000 | |
| Photography-grade fabric | Yayoya | Polyester Fabric Black Photo Backdrop for Photo Video Studio Televison | |
| Raspberry Pi 4 Case with heatsink | iUniker | B07ZVKN262 | |
| Raspberry Pi 4 Model B Rev 1.1 | Raspberry Pi Foundation | RP4B4GB_BP | |
| Raspberry Pi 4 PiSwitch (USB-C) | CanaKit | RSP-PISWITCH-USBC | |
| Raspberry Pi software | Raspberry Pi Imager | https://www.raspberrypi.com/software/ | |
| Statistical analysis software | Rstudio | https://posit.co/downloads/ | |
| Tripod | K&F Concept | T255A3+BH-28L | |
| Turface MVP | Hummert International | 10240000 | |
| Wireless Barcode Scanner | Netumscan | B08X4NMX2M | 1D and 2D barcode scanner |
Referanslar
- Xiao, Q., Bai, X., Zhang, C., He, Y. Advanced high-throughput plant phenotyping techniques for genome-wide association studies: A review. J Adv Res. 35, 215-230 (2022).
- Mutka, A. M., et al. image-based phenotyping methods provide insight into spatial and temporal dimensions of plant disease. Plant Physiol. 172 (2), 650-660 (2016).
- Mutka, A. M., Bart, R. S. Image-based phenotyping of plant disease symptoms. Front Plant Sci. 5, 734 (2014).
- Fahlgren, N., Gehan, M. A., Baxter, I. Lights, camera, action: High-throughput plant phenotyping is ready for a close-up. Curr Opin Plant Biol. 24 (2), 93-99 (2015).
- Das Choudhury, S., Samal, A., Awada, T. Leveraging image analysis for high-throughput plant phenotyping. Front Plant Sci. 10, 508 (2019).
- Yang, W., et al. Crop phenomics and high-throughput phenotyping: Past decades, current challenges, and future perspectives. Mol Plant. 13 (2), 187-214 (2020).
- Omari, M. K., et al. Digital image-based plant phenotyping: A review. Korean J Agric Sci. 47 (1), 119-130 (2020).
- Schindelin, J., et al. Fiji: An open-source platform for biolFiogical-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Gehan, M. A., et al. PlantCV v2: Image analysis software for high-throughput plant phenotyping. PeerJ. 5, e4088 (2017).
- Murphy, K. M., Ludwig, E., Gutierrez, J., Gehan, M. A. Deep learning in image-based plant phenotyping. Annu Rev Plant Biol. 75 (1), 771-795 (2024).
- Fahlgren, N., et al. A versatile phenotyping system and analytics platform reveals diverse temporal responses to water availability in Setaria. Mol Plant. 8 (3), 1520-1535 (2015).
- Yu, L., et al. Development of a mobile, high-throughput, and low-cost image-based plant growth phenotyping system. bioRxiv. , (2023).
- Atefi, A., Ge, Y., Pitla, S., Schnable, J. Robotic technologies for high-throughput plant phenotyping: Contemporary reviews and future perspectives. Front Plant Sci. 12, 611940 (2021).
- Berry, J. C., Fahlgren, N., Pokorny, A. A., Bart, R. S., Veley, K. M. An automated, high-throughput method for standardizing image color profiles to improve image-based plant phenotyping. PeerJ. 6, e5727 (2018).
- Tovar, J. C., et al. Raspberry Pi-powered imaging for plant phenotyping. Appl Plant Sci. 6, e1031 (2018).
- Jolles, J. W. Broad-scale applications of the Raspberry Pi: A review and guide for biologists. Methods Ecol Evol. 12 (5), 1562-1579 (2021).
- Watt, M., et al. Phenotyping: New windows into the plant for breeders. Annu Rev Plant Biol. 71 (1), 689-712 (2020).
- Xie, C., Yang, C. A review on plant high-throughput phenotyping traits using UAV-based sensors. Comput Electron Agric. 178, 105731 (2020).
- Czedik-Eysenberg, A., et al. The "PhenoBox", a flexible, automated, open-source plant phenotyping solution. New Phytol. 219 (4), 808-823 (2018).
- Sumner, J., Fahlgren, N., Murphy, K. M. PCVR: An R package and tutorials for guided statistical analysis of plant phenotyping data. Authorea Preprints. , (2023).
- Schnable, P. S., et al. The B73 maize genome: complexity, diversity, and dynamics. Science. 326 (5956), 1112-1115 (2009).
- Kirillov, A., et al. Segment Anything. , 3992-4003 (2023).
- Gabaldón-Leal, C., et al. Modelling the impact of heat stress on maize yield formation. Field Crops Res. 198 (3), 226-237 (2016).
- Intergovernmental Panel on Climate Change. . SYNTHESIS REPORT OF THE IPCC SIXTH ASSESSMENT REPORT (AR6). , (2023).
- Quiñones, A., et al. Optimized methods for applying and assessing heat, drought, and nutrient stress of maize seedlings in controlled environment experiments. Cold Spring Harb Protoc. , (2024).
- Murphy, K. M., et al. Maize abiotic stress treatments in controlled environments. Cold Spring Harb Protoc. , (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır