Method Article
Визуализация и анализ для количественного определения фенотипов абиотического стресса кукурузы (Zea mays)
В этой статье
Резюме
Представлен метод недорогой визуализации растений для измерения фенотипов, а также передовые методы получения изображений и конвейер анализа изображений для количественной оценки признаков растений. Эти методы были применены для измерения фенотипов кукурузы (Zea mays) в условиях жары, засухи и комбинированного абиотического стресса.
Аннотация
Количественное измерение фенотипов или признаков растений имеет важное значение для понимания реакции растений на факторы окружающей среды, включая биотические и абиотические стрессы. Тем не менее, традиционные методы измерения растений могут отнимать много времени, быть неточными и разрушительными, особенно при оценке таких признаков, как биомасса и высота на индивидуальной основе. Анализ на основе изображений дает возможность сократить трудозатраты, повысить точность и прецизионность, а также обеспечить повторные измерения одного и того же растения в нескольких временных точках. Несмотря на то, что высокопроизводительные фенотипические установки являются решением, они часто непомерно дороги и ограничены в доступности во всем мире. Описан метод получения изображений растений с помощью недорогих одноплатных компьютеров и цифровых камер в фотостудии, сопровождаемый конвейером анализа изображений на основе бесплатного пакета PlantCV с открытым исходным кодом. Этот метод предлагает быстрый и точный протокол для захвата, маркировки и передачи изображений, а также передовые методы обеспечения высококачественного получения изображений. С помощью анализа изображений было количественно определено более 10 фенотипов для всех изображений в эксперименте одновременно, включая такие признаки, как размер растения, высота и цвет. Эти методы были использованы для характеристики реакции инбредного сорта В73 Zea mays (кукуруза) на жару, засуху и комбинированные условия абиотического стресса от жары и засухи.
Введение
Измерение признаков растений, или фенотипов, имеет решающее значение для ответа на фундаментальные и прикладные вопросы в науке о растениях. Например, исследователь, стремящийся понять влияние генетической мутации на размер растения, должен будет количественно измерить высоту растенияи площадь листьев. Исследователь, применяющий биотический стресс (например, бактериальную, вирусную или грибковую инфекцию) или абиотический стресс (например, засуху, жару, холод или истощение питательных веществ), должен будет исследовать влияние стресса на цвет растений, или «зеленость», чтобы измерить хлороз 2,3.
В то время как измерение этих признаков имеет важное значение для фундаментальной биологии растений, а также для прикладной селекции растений, ручное измерение этих признаков может быть трудоемким, неточным, неточным. Например, измерение высоты растений включает в себя ручное использование линейки для каждого растения, часто в жарких или влажных условиях окружающей среды, и подвержено ошибкам с точки зрения человека, который измеряет, а также с точки зрения того, какая точка считается «верхушкой» растения. Кроме того, такие измерения, как биомасса и содержание пигмента, являются разрушительными, и одно и то же растение не может быть измерено на предмет изменений с течением времени или использовано для многократного отбора проб, потому что оно должно быть уничтожено в процессе проведенияэтих измерений. Трудоемкий и подверженный ошибкам характер этих измерений препятствует прогрессу в оценке фенотипических и физиологических реакций растений на стресс.
Получение изображений растений и измерение количественных признаков по изображению обеспечивает решение этих задач 4,5,6,7. Анализ изображений повышает точность и аккуратность, сокращая при этом время, которое требуется исследователю для проведения измерений, и одно и то же растение может быть визуализировано несколько раз или использовано для других проб благодаря количественной оценке неразрушающих признаков 4,5,6,7. Кроме того, изображения могут быть сохранены и повторно проанализированы в течение длительного времени после завершения эксперимента и утилизации растений 4,5,6,7. Анализ изображений может быть выполнен индивидуально с помощью инструментов редактирования изображений с низкой пропускной способностью, таких как ImageJ (Fiji)8, или с более высокой пропускной способностью с помощью компьютерного зрения и машинного обучения с помощью таких платформ, как PlantCV9. PlantCV — это бесплатная платформа для анализа изображений с открытым исходным кодом, которая позволяет исследователям сначала замаскировать (или отделить) растение или другой объект от фона изображения, а также измерить размер, морфологию, цвет и многое другое этого растенияили объекта. Используя модульный рабочий процесс, исследователь сначала создает гибкий рабочий процесс (или конвейер) из различных модулей с образцом изображения, а затем подвергает остальные изображения высокопроизводительному рабочему процессу, не взаимодействуя с каждым отдельным изображением9. Количественные признаки выводятся и анализируются на предмет статистически значимых различий между группами. Конвейеры глубокого обучения могут быть разработаны для эффективного автоматизированного анализа изображений после того, как будет получено достаточное количество изображений и помечено соответствующими измерениями признаков или метаданными10.
«Высокопроизводительное» фенотипирование может увеличить скорость и сократить человеческий труд во время сбора данных и/или во время их анализа 4,5,6,7. Высокопроизводительные установки фенотипирования позволили автоматизировать сбор изображений в контролируемых средах, где установки перемещаются по конвейерным лентам или с помощью роботов к станции обработки изображений и автоматически маркируются именем (т.е. меткой с метаданными), связанным с установкой 6,11,12,13,14. В то время как эти конвейерные ленты или роботизированные установки позволяют захватывать и маркировать большие объемы изображений без вмешательства человека, их мало в мире, и их создание может стоить миллионы долларов, что делает их недоступными для многих исследователей. Чтобы применить эти концепции автоматизированной визуализации с меньшими затратами, Raspberry Pi (здесь называемые одноплатными компьютерами, SBC) — это недорогие компьютеры (менее 35 долларов каждый), которые используются для захвата, именования, хранения и передачи изображений растений, выращенных в контролируемых условиях. Эти конфигурации захватывают изображения с автоматическими временными интервалами с использованием массива до 72 Raspberry Pi 12,15,16. Несмотря на то, что они более экономичны, чем конвейерные системы, которые могут стоить миллионы долларов, ранее описанные камеры для выращивания SBC наиболее применимы для нисходящего взгляда на выращивание небольших растений и по-прежнему требуют большого количества SBC15. В полевых условиях порталы, беспилотные летательные аппараты, такие как беспилотные летательные аппараты, и спутники делают снимки для анализа характеристик растений 17,18. Как полевые системы, так и объекты с контролируемой средой с высокой пропускной способностью могут быть непомерно высокими с точки зрения их первоначальных затрат, обслуживания и экспертных знаний, необходимых для создания и обслуживания систем, а также для анализа изображений17,18. Сотовые телефоны и цифровые камеры, используемые отдельно для фотосъемки растений, сопряжены с трудоемкими проблемами передачи изображений и присвоения имен метаданным, что имеет важное значение для последующего анализа изображений.
Описанные здесь методы представляют собой недорогое решение для визуализации установок для задач, которые не решаются другими системами. Фотоустановка, при которой растения перевозятся в студию по отдельности, позволяет эффективно измерять растения всех размеров в горшках. Используя SBC, подключенный к цифровой камере, этот метод сначала обеспечивает стандартизированную съемку, маркировку и передачу изображений. Использование клавиатуры или сканера QR-кодов и штрихкодов для присвоения имен изображениям во время их сканирования позволяет избежать трудоемкой и подверженной ошибкам операции по переименованию изображений с метаданными после их захвата и сохранения. Композиция изображения и рекомендуемые настройки камеры важны для обеспечения возможности последующего анализа изображения, а рекомендации подробно описаны здесь. Наконец, в PlantCV предусмотрен конвейер анализа изображений для извлечения количественных характеристик из полученных изображений, таких как площадь листьев, высота, ширина и цвет растения.
По сравнению с конвейерными ленточными системами, этот метод является недорогим и требует одного SBC. Описанная здесь установка для фенотипирования была создана для устранения ограничений и затрат на конвейерную ленту или роботизированные системы - растение любого размера может быть измерено, потому что установка может быть отделена от пространства для выращивания, требуется только один SBC, и она работает с многочисленными типами камер для максимальной гибкости и доступности. Подходы, аналогичные представленному здесь, включают в себя PhenoBox или PhenoRig12,19. По сравнению с ручными измерениями, этот метод экономит время, уменьшает количество ошибок, а также не разрушает растения 4,12,15,19.
протокол
Подробная информация о реагентах и оборудовании, используемых в этом протоколе, приведена в Таблице материалов.
1. Подготовка фотостудии
- Повесьте черную ткань фотографического качества на стену или потолок для создания изображений сбоку. Драпируйте ткань не менее чем на 0,5 м на пол так, чтобы растение было размещено поверх ткани (рисунок 1).
ПРИМЕЧАНИЕ: Ткань должна быть как минимум на 100 см выше и шире изображения. - Поместите цветную карточку на задний план, прислонив ее к объекту, например коробке, так, чтобы она была видна в кадре (рис. 1). Для растений размером более 30 см в высоту или ширину используйте цветовую карту шириной не менее 20 см. Для растений размером менее 30 см в высоту или ширину используйте цветовую карту шириной от 4 до 8 см.
- Подключите SD-карту к ноутбуку или настольному компьютеру. Загрузите Raspberry Pi Imager из раздела программного обеспечения на веб-сайте (https://www.raspberrypi.com/software/) и загрузите предоставленный файл raspberrypi-image-capture.img.gz (https://github.com/danforthcenter/photo-maize-paper) на ноутбук или настольный компьютер.
- Запустите имидж-сканер, открыв загруженный файл имидж-сканера (.exe). Нажмите на кнопку «Выбрать ОС» и выберите кнопку «Использовать пользовательский » внизу. Выберите файл image-capture.img.gz.
- Затем нажмите на кнопку «Выбрать хранилище » и выберите SD-карту, подключенную к компьютеру. Нажмите на кнопку «Записать ».
ПРИМЕЧАНИЕ: Убедитесь, что выбрана правильная SD-карта, так как в этом процессе будут удалены все данные, хранящиеся на карте.
- Затем нажмите на кнопку «Выбрать хранилище » и выберите SD-карту, подключенную к компьютеру. Нажмите на кнопку «Записать ».
- Подключите последнюю версию SBC к клавиатуре с помощью USB-кабеля, к внешнему монитору — с помощью кабеля HDMI, а к удлинителю — с помощью кабеля питания с переключателем. Подключите монитор к удлинителю с помощью кабеля питания, входящего в комплект поставки монитора. Вставьте SD-карту в SBC. На рисунке 1 приведена схема установки с метками.
- Включите удлинитель, нажав на переключатель на полосе, включите монитор с помощью кнопки на мониторе, затем включите SBC, переведя переключатель на шнуре питания в положение «вкл.».
- Подключите SBC к местному Интернету с помощью Wi-Fi или кабеля Ethernet.
- Если фотографии должны быть переданы непосредственно на сервер или в облачное хранилище:
- Отредактируйте файл "CAPTURE-PHOTO.py" в SBC, чтобы он содержал путь к файлу для завершения передачи.
- Отредактируйте файл win-credentials с указанием пути и пароля для сервера или облачного хранилища с помощью следующей команды в терминале: sudo nano /etc/win-credentials.
ПРИМЕЧАНИЕ: Обратитесь к системному администратору Интернета, чтобы убедиться, что у папки есть разрешение на передачу файлов.
- Подключите беспроводной сканер штрихкодов к SBC, следуя инструкциям производителя, прилагаемым к сканеру штрихкодов, с помощью USB или Bluetooth.
- Выключите SBC, нажав кнопку Raspberry Pi в верхнем левом углу экрана, нажав «Выйти», а затем нажав « Выключить », чтобы безопасно выключить SBC. После выключения переключите выключатель питания SBC «вкл.», шнур питания в положение «выкл.» и удлинитель в положение «выкл.».
2. Рост растений и лечение стресса
ПРИМЕЧАНИЕ: Для этого метода фенотипирования подходит любое растение; Эти методы выращивания растений применимы к репрезентативным результатам, представленным здесь.
- Приобретите семена B73 или другого сорта кукурузы в складском центре.
- Подготовьте почвенные среды и условия произрастания:
- Наполните 3,5-дюймовые горшки (0,7 л) смесью Turface MVP и Berger BM7-35 в соотношении 1:1 по объему с удобрением с медленным высвобождением 14-14-14 (N-P-K). Поместите горшки в поддон с отверстиями и тщательно полейте водой обратного осмоса (RO).
- Установите камеру для выращивания на следующие условия окружающей среды: 30 °C днем/20 °C ночью, продолжительность дня 16 часов, влажность 60% и 500 ммоль.м-2 с-1 света на уровне горшка в течение дня. Установите отдельную камеру роста с теми же условиями, за исключением 38 °C днем и 28 °C ночью для теплового стресса.
- Посадите 20 семян кукурузы, каждое в горшок диаметром 3,5 дюйма, погрузив в почву на ~2 см вглубь и засыпав ее вытесненной почвой. Тщательно полейте водой обратного осмоса и поместите в контрольную камеру роста. Ежедневно поливать жидким удобрением (смешанным согласно инструкции производителя; см. Таблицу материалов).
ПРИМЕЧАНИЕ: Посадка дополнительных растений, необходимых для эксперимента, приведет к плохой всхожести и отсутствию однородности до начала применения стресса. Всхожесть будет варьироваться в зависимости от сорта. - Через 21 день роста пересадите 16 наиболее однородных растений (n = 4 растения за одну обработку) в горшки объемом 3,79 л, заполненные такой же почвенной смесью, предварительно смоченной водой обратного осмоса. Верните растения в контрольную камеру роста.
- На 25-й день (через 4 дня после пересадки) переместите половину растений (n = 8) в камеру теплового стресса на момент включения света в камере. Прекратите полив растений, страдающих от засухи, в обеих камерах (n = 4 на камеру).
ПРИМЕЧАНИЕ: Растения, испытывающие стресс от засухи, могут нуждаться в поливе, чтобы растения дожили до конца эксперимента; Здесь засушливые растения поливали на 31-й и 37-й день удобряющей водой. - На 38 день (через 13 дней после начала стресса) извлеките растения из камер роста для визуализации.
3. Визуализация растений
- Запустите SBC (см. рисунок 2):
- Включите удлинитель с помощью переключателя на удлинителе.
- Включите монитор с помощью кнопки на мониторе.
ПРИМЕЧАНИЕ: Если SBC включен до включения монитора, он не запустится правильно. - Поверните переключатель на шнуре питания SBC в положение «ВКЛ».
ПРИМЕЧАНИЕ: Это включит SBC, и он загрузится на мониторе; на самом SBC нет переключателя «вкл.», только на шнуре питания.
- Поместите камеру на штатив или устойчивый стол.
ПРИМЕЧАНИЕ: Все растение и цветовая карта должны быть в поле зрения на экране камеры. Камера должна быть перпендикулярна земле и иметь прямой обзор (без угла) центра растения. Камера должна быть совместима с пакетом gphoto2, а список можно найти здесь: http://www.gphoto.org/proj/libgphoto2/support.php. - Подайте питание на камеру через кабель питания вместе с камерой или батареями. Включите камеру с помощью кнопки на камере.
- Подключите камеру к USB-порту на SBC с помощью кабеля для передачи данных, входящего в комплект камеры.
- Расстановка растения в фотосъемке:
- Поместите кусок темной ленты на ткань фотографического качества в том месте, где будет размещен горшок, чтобы убедиться, что расположение одинаково для каждого растения. Убедитесь, что цветовая карта находится на одной линии с куском ленты.
ПРИМЕЧАНИЕ: Разместите цветовую карту на расстоянии не менее 10 см от края растения. Во время контроля качества в рабочем процессе PlantCV (ниже) изображение должно быть обрезано так, чтобы включить только растение и горшок, но не цветовую карту, чтобы гарантировать, что цветовые чипы не будут включены в экстракцию конечного признака. На рисунке 2 приведены примеры изображений высокого и низкого качества. - Поместите горшок на кусок скотча. Для растений, которые растут в плоскости, таких как кукуруза (Zea mays) и сорго (Sorghum bicolor), смотрите на самый широкий угол растения в сторону камеры. Для растений, которые растут не в плоскости, захватите углы 0 и 90 градусов растения и усредните полученные количественные измерения после завершения анализа изображений.
- Поместите кусок темной ленты на ткань фотографического качества в том месте, где будет размещен горшок, чтобы убедиться, что расположение одинаково для каждого растения. Убедитесь, что цветовая карта находится на одной линии с куском ленты.
- На экране рабочего стола SBC, отображаемом на мониторе, откройте терминал, нажав на кнопку терминала в верхней левой строке меню.
- Если вы сохраняете данные непосредственно на сервере или в облачном хранилище, смонтируйте хранилище с помощью следующей команды, указав необходимый путь к облачному хранилищу (cloud-storage-path в приведенном ниже примере) и пароль, введя строку кода в открытое окно терминала и нажав клавишу Enter на клавиатуре. Если настройки не изменились по сравнению с заводскими настройками, идентификатор пользователя (UID) будет "pi".
ЗАМЕТКА:
sudo mount -t cifs -o credentials=/etc/win-credentials,uid=pi //cloud-storage-path /mnt/cloud-storage - Введите следующий код в терминал и нажмите клавишу Enter на клавиатуре. Появится новое окно.
./RUN-PHOTOSTUDIO-SHELL.sh
ПРИМЕЧАНИЕ: Файл RUN-PHOTOSTUDIO-SHELL.sh вызывает файл CAPTURE-PHOTO.py, которые предварительно загружаются в pi, если он был загружен с использованием вышеуказанного метода. Кроме того, эти скрипты были предоставлены на GitHub для размещения на существующей SD-карте Raspberry Pi. - Откроется окно графического пользовательского интерфейса. Введите название изображения, либо отсканируйте штрих-код или QR-код растения с помощью сканера штрих-кодов.
- Выберите вариант сохранения образа локально или на подключенном сервере/в облачном хранилище.
- Нажмите Нажмите здесь, чтобы сделать снимок! пуговица.
- Если было выбрано локальное хранилище, откройте папку «Фотографии » на рабочем столе, чтобы изучить изображение. Если был выбран сервер или облачное хранилище, откройте образ в этом месте.
- При необходимости отрегулируйте настройки камеры, отключив ее от SBC, отрегулировав в соответствии с инструкциями производителя и снова вставив в SBC.
ПРИМЕЧАНИЕ: Такие настройки, как экспозиция, яркость, контрастность и т. д., могут потребоваться в зависимости от освещения в комнате и объекта изображения. Распространенной ошибкой является передержка изображений. Чтобы проверить экспозицию тестового изображения, выполните процесс анализа изображений PlantCV, который включает в себя проверку качества экспозиции. При необходимости отрегулируйте параметры камеры, чтобы уменьшить или увеличить экспозицию, пока гистограммы не будут распределены соответствующим образом. - После того, как все изображения будут сделаны, перенесите изображения из SBC на локальный компьютер или в облачное хранилище с помощью предпочтительного метода, например USB-накопителя, интернет-браузера или передачи по SSH.
4. Извлечение черт из изображений
- Загрузите на локальный компьютер или сервер следующие файлы: "photo-studio-SV-notebook.ipynb", "workflow.py" и "photo-studio-SV-config.json". Все файлы доступны на GitHub (https://github.com/danforthcenter/photo-maize-paper).
- Установите PlantCV на локальный компьютер или сервер, выполнив описанные действия (https://plantcv.readthedocs.io/en/latest/installation/).
- Откройте файл photo-studio-SV-notebook.ipynb с помощью предпочитаемого редактора кода, такого как JupyterLab или Visual Studio Code.
- Запустите каждый блок кода, редактируя его по мере необходимости с учетом параметров, изложенных в блоке кода, чтобы получить чистую маску только растения на изображении.
- Когда вы будете удовлетворены анализом образца изображения, откройте файл workflow.py в предпочитаемом редакторе кода. Отредактируйте этот файл с любыми измененными параметрами в "photo-studio-SV-notebook.ipynb" и сохраните его.
- Откройте файл photo-studio-SV-config.json и отредактируйте пути к файлам, чтобы они направляли в папку с входными изображениями, нужную папку вывода и т. д., как указано в файле.
- Откройте терминал и выполните следующий код для активации PlantCV. Для этого введите в терминал код conda activate plantcv и нажмите клавишу Enter на клавиатуре.
- Измените следующую строку кода на путь к файлу "photo-studio-SV-config.json" (это единственное изменение, которое необходимо внести в приведенный ниже код).
- В терминале введите отредактированный код и нажмите клавишу Enter на клавиатуре. При этом рабочий процесс будет запущен для всех изображений, полученных в ходе эксперимента.
ЗАМЕТКА:
plantcv-run-workflow --config /Пользователи/ИМЯ_ПОЛЬЗОВАТЕЛЯ/photo-studio-SV-config.json
- В терминале введите отредактированный код и нажмите клавишу Enter на клавиатуре. При этом рабочий процесс будет запущен для всех изображений, полученных в ходе эксперимента.
- Проверьте выходные изображения, чтобы определить, подходит ли код для всех изображений.
ПРИМЕЧАНИЕ: Сине-розовый контур растения должен быть по краям растения, и на изображении не должно быть других объектов. При необходимости вернитесь на страницу "photo-studio-SV-analysis.ipynb" и протестируйте проблемные изображения и отредактируйте код, в частности шаги маскирования и шумоподавления, чтобы получить желаемые результаты. На рисунке 3 приведены примеры сегментации изображений высокого, приемлемого и низкого качества. - Выходной файл будет в виде файла .json. Вернитесь в терминал (убедитесь, что conda activate plantcv уже запущена), введите следующий код и нажмите клавишу Enter на клавиатуре, чтобы преобразовать файл в .csv для последующего статистического анализа, изменив путь к файлу на путь к файлу "results-photo-studio.json".
plantcv-utils json2csv -j /Users/USERNAME/results-photo-studio.json -c /Users/USERNAME/results-photo-studio.csv
ПРИМЕЧАНИЕ: Чтобы преобразовать измерения из пикселей в стандартные единицы измерения, такие как см, используйте преобразование, предоставляемое функцией find_color_card в рабочем процессе PlantCV. - Выполнение статистического анализа выходных количественных признаков для определения различий в фенотипах растений из-за разных видов растений, сортов, обработок и временных точек.
ПРИМЕЧАНИЕ: Пакет pcvr в R Studio был разработан для анализа результатов работы PlantCV на предмет статистической значимости и построения графиков результатов20. Сводка и визуальное представление собранных признаков представлены на рисунке 4.
Результаты
Для разработки этого метода растения кукурузы B73 были оценены по количественным фенотипам при контрольных температурах, тепловых температурах, хорошем орошении и засушливых условиях, а также их комбинаций, в общей сложности в четырех обработках. В73 – известный инбредный сорт кукурузы с богатыми генетическими данными21.
Анализ изображений в PlantCV позволил успешно провести цветокоррекцию изображений, пометить количественные результаты метаданными растения и сегментировать (другими словами, отделить) растение от фона, как показано на рисунке 3. Неудачный анализ дал бы выходные изображения, которые не показывают синий контур или розовую форму вокруг растения, а скорее включают дополнительный шум или отсутствующие части растения (рисунок 3, пример низкого качества). Двухканальный порог был необходим, чтобы включить в маску как можно большую часть растения (см. альтернативные одноканальные стратегии в разделе "photo-studio-SV-notebook.ipynb"). Тем не менее, некоторые растения, особенно с фиолетовыми стеблями, не имели идеальной сегментации, но были достаточны для последующего анализа (рис. 3).
Анализ PlantCV выявил 16 количественных однозначных признаков, обобщенных на рисунке 4. Однозначный признак предоставляет одно значение для каждого растения - например, площадь листьев, высоту, ширину и среднее значение оттенка по кругу. Площадь листьев рассматривали с помощью функции "analyze.shape" (рис. 4) и рассматривали все растение. Высота и ширина, однако, рассматривались с использованием «функции analyze.bound_horizontal», с границей, проведенной на линии почвы растения. Это связано с тем, что растения, которые свисают над стенкой горшка, будут иметь большую высоту, рассматривая растение как целостный объект, и вместо этого должны измерять только от основания растения, где оно встречается с почвой. В дополнение к однозначным типажам, PlantCV выводит многозначные признаки, которые представляют собой гистограммы, в частности цветовых значений, представляющих каждый пиксель растения. Круговое среднее по оттенку — это однозначный признак, который является средним значением оттенка для всего растения.
Чтобы определить, какие черты являются наиболее интересными, была рассчитана дисперсия, объясняемая обработкой для каждой черты, а также корреляция между различными чертами с помощью функции "frem" в пакете pcvr R Studio20 (рисунок 5A). Площадь листьев, высота, ширина и среднее круговое значение оттенка были выбраны для анализа ниже по течению, потому что они объясняют более 50% отклонений, вызванных обработкой, и являются соответствующими показателями роста растений (площадь, высота и ширина) и здоровья (оттенок). Репрезентативные изображения растения с самой большой и наименьшей площадью листьев демонстрируют вариацию фенотипов, собранных в этом эксперименте (рис. 5B, C соответственно). Растение с самой большой площадью листьев также имело самый высокий средний оттенок и относилось к категории B73, хорошо поливаемому, испытывающему тепловой стресс (рисунок 5B). Самая маленькая площадь листьев имела наименьший средний оттенок (рис. 5C) и была растением B73, подверженным засухе и жаре.
Обработка воды оказала значительное влияние на определение площади листьев (F(1,13) = 226,5, p = 1,32 x 10-9), высоты (F(1,13) = 21,1, p = 0,0005), ширины (F(1,13) = 75,5, p = 8,92 x 10-7) и среднего круга оттенка (F(1,13) = 27,8, p = 0,0002), определенных с использованием модели линейной регрессии для эффекта обработки и двустороннего ANOVA в R Studio (полные результаты приведены в таблице 1). Температурная обработка оказала существенное влияние на высоту (F(1,13) = 5,94, p = 0,03), но не на площадь листа, ширину или среднее круговое значение оттенка (p > 0,05, табл. 1). Взаимодействие между температурой и состоянием воды не было значимым фактором ни в одном из измеряемых признаков (p > 0,05, таблица 1).
Затем отдельные методы лечения сравнивались с контрольной группой и друг с другом с использованием линейной регрессии и апостериорного теста (оценка маргинальных средних) с поправкой Сидака для множественных сравнений (рис. 6). Площадь листьев, высота растений, ширина растений и среднее круговое значение оттенка были значительно снижены у растений, испытывающих стресс от засухи, по сравнению с хорошо поливаемыми в обоих температурных условиях (p < 0,05, рис. 6). Тепловой стресс при хорошем поливе только снижал высоту растений (p < 0,05, рис. 6), но не приводил к значительному уменьшению площади листьев, ширины растений или среднего круга оттенка. Эту разницу в оттенке можно дополнительно исследовать, оценив многозначный оттенок цветового признака, который на рисунке 7 представлен в виде гистограммы, а не просто среднего значения. Уменьшение среднего оттенка из-за засухи произошло из-за сдвига от зеленых к желтым пикселям, известного как хлороз (Рисунок 7). В то время как тепло не показало существенной разницы в среднем оттенке, оно продемонстрировало уменьшение и увеличение из-за пожелтения (хлороза) и потемнения зеленого цвета (Рисунок 7).
После визуализации растения срезали в месте соединения корня и побега, и регистрировали вес надземной ткани. Корни были аккуратно промыты и высушены полотенцем, а затем взвешены, чтобы рассчитать общую биомассу растений (также известную как вес) для сравнения с описанным методом фенотипирования на основе изображений. Площадь листьев, измеренная с помощью анализа изображений, сильно коррелировала с биомассой растений (R2 = 0,84, рис. 8).

Рисунок 1: Изображение фотостудии с маркированными компонентами для сбора изображений растений. (A) ткань фотографического качества, (B) цветная карта, (C) линия ленты для равномерного размещения горшков, (D) цифровая камера, (E) одноплатный компьютер, (F) монитор с отображением процесса съемки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Обзор рабочего процесса обработки изображений. Предоставляется репрезентативное изображение «высокого качества» и «низкого качества». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
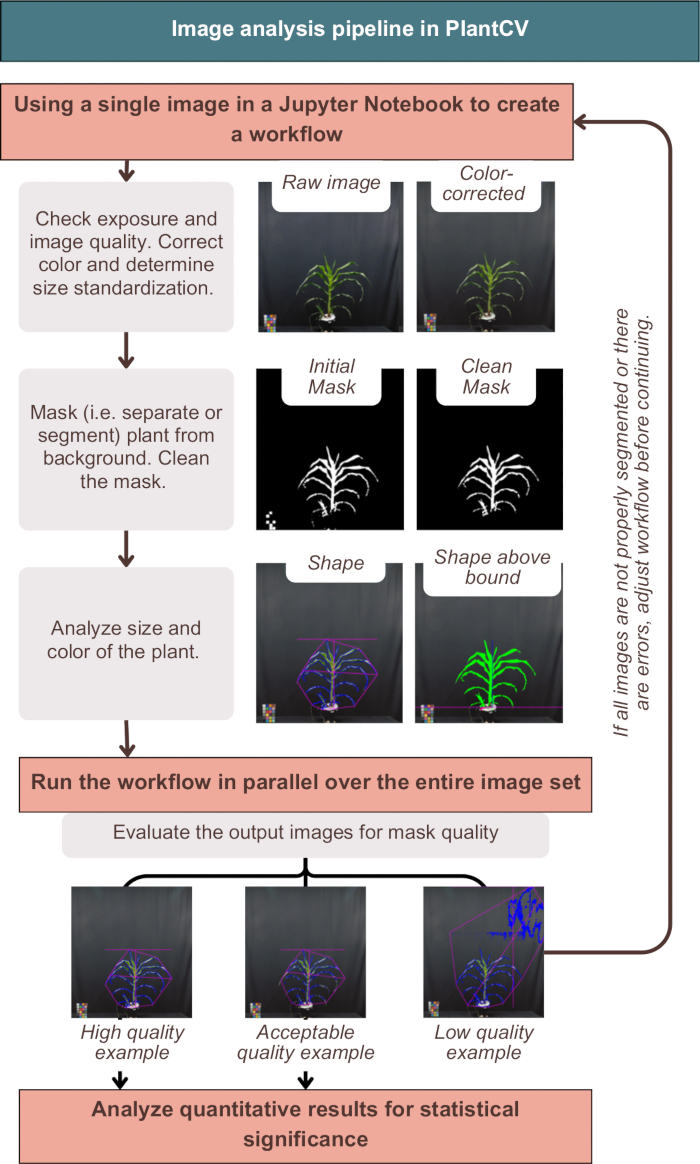
Рисунок 3: Обзор рабочего процесса анализа изображений в PlantCV. Представлены репрезентативные образы сегментации «высокое», «приемлемое» и «низкое» качество; Признаки PlantCV представлены с помощью розового контура формы всего растения и синего контура области растения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Резюме и визуальное представление черт формы, полученных в результате анализа. Функция Shape в PlantCV. Фиолетовые прямоугольники обозначают черты, которые не используют другой признак в своих вычислениях. Оранжевые прямоугольники представляют черты, которые используют другие черты в своих вычислениях; Стрелки указывают, какие признаки используются в этих вычислениях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
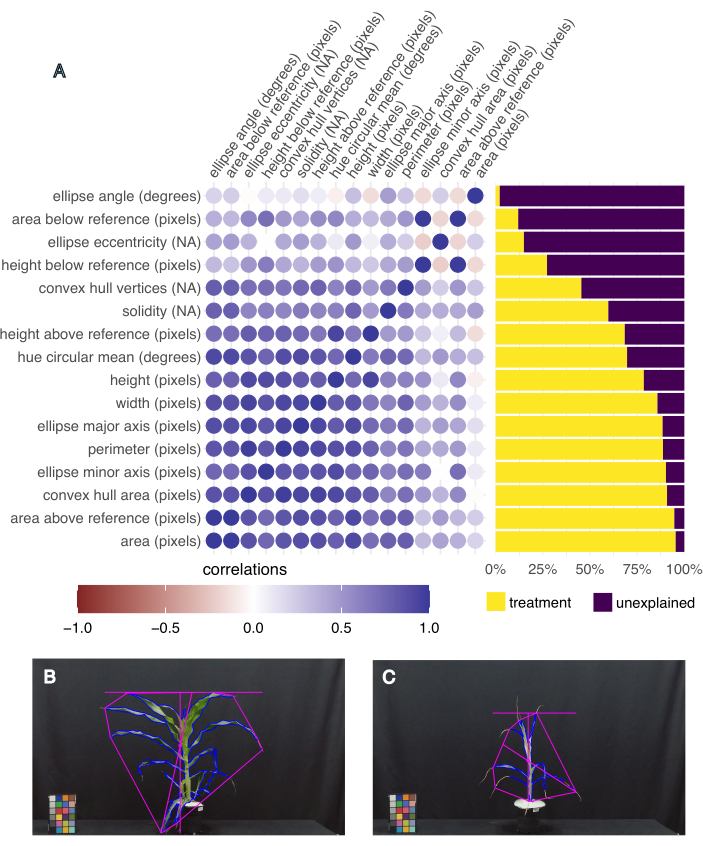
Рисунок 5: Фенотипирование на основе изображений фиксирует фенотипическую вариативность и коррелированные признаки. (А) Вариативность признаков, объясняемых лечением (справа), и корреляция черт друг с другом (слева). Каждый признак помечен, за ним следует его единица измерения; «NA» означает, что это безразмерное измерение. (B) Изображение растения, которое имело наибольшую площадь листьев и наибольшее среднее круговое значение (градусы). (В) Изображение растения, которое имело наименьшую площадь листьев и наименьшее среднее круговое значение оттенка (градусы). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
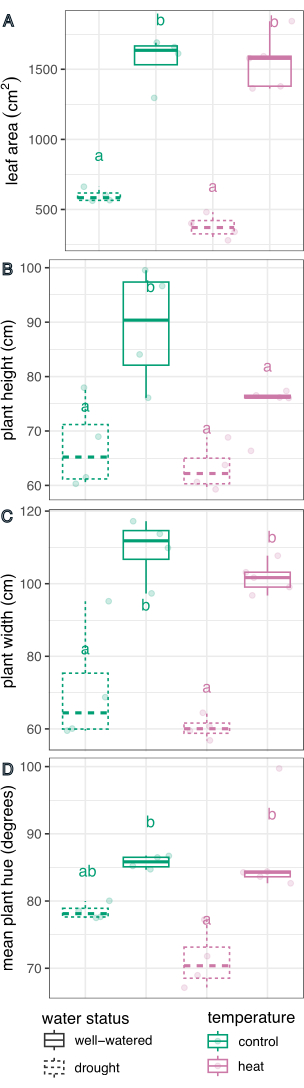
Рисунок 6: Сравнение эффектов обработки на фенотипы растений. Площадь листьев (A), высота (B), ширина (C) и среднее круговое значение оттенка (D) сравниваются для влияния засухи, жары и комбинированных напряжений. n = 4. Буквы представляют статистически значимые различия между методами лечения (p < 0,05); Методы лечения сравнивали с использованием линейной регрессии и апостериорного теста (оценка маргинальных средних) с поправкой Сидака для множественных сравнений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
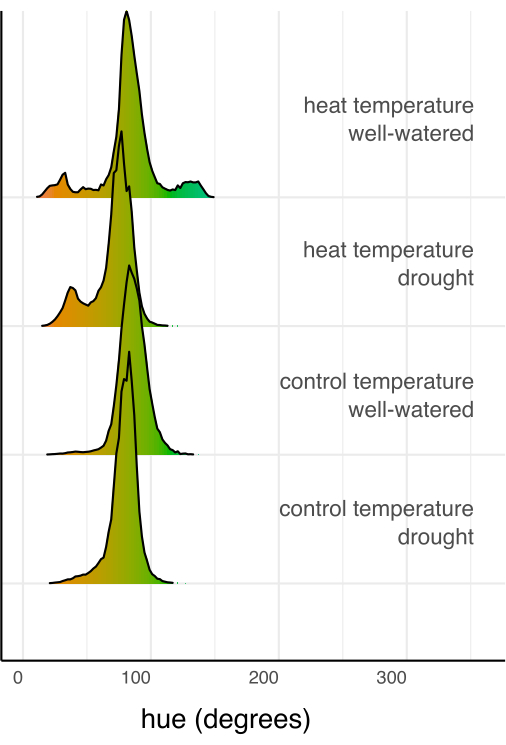
Рисунок 7: Гистограммы цвета (оттенка), суммированные из всех пикселей каждой комбинации лечения, нормализованные на общее количество пикселей в комбинации лечения. Гистограммы раскрашиваются в соответствии со значением цвета для степени оттенка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
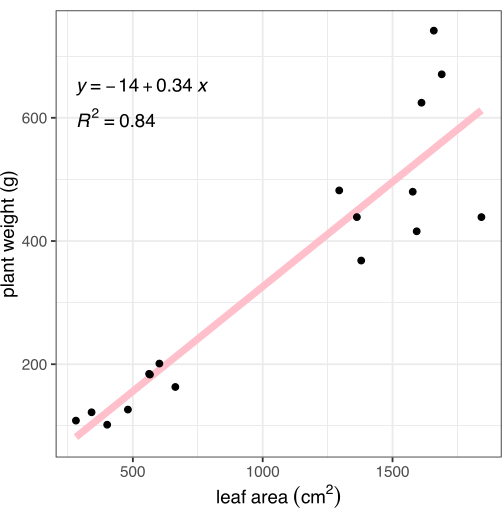
Рисунок 8: Корреляция площади листьев, измеренной по изображениям, с биомассой всего растения. Каждая черная точка представляет одно растение. Розовая линия представляет собой линейную корреляцию между площадью листьев (X) и биомассой (Y). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Черта | Фактор | Степени свободы | Значение F | p-значение |
| площадь листа (см^2) | Температура | 1 | 0.5372 | 0.4766 |
| площадь листа (см^2) | Вода | 1 | 226.5318 | 1.32Э-09 |
| площадь листа (см^2) | Температура:Вода | 1 | 2.1526 | 0.1661 |
| площадь листа (см^2) | Остатки | 13 | ||
| Высота (см) | Температура | 1 | 5.9426 | 0.0298935 |
| Высота (см) | Вода | 1 | 21.107 | 0.0005029 |
| Высота (см) | Температура:Вода | 1 | 2.1752 | 0.1640545 |
| Высота (см) | Остатки | 13 | ||
| ширина (см) | Температура | 1 | 2.2495 | 0.1575 |
| ширина (см) | Вода | 1 | 75.5474 | 8.92Э-07 |
| ширина (см) | Температура:Вода | 1 | 0.0839 | 0.7766 |
| ширина (см) | Остатки | 13 | ||
| Среднее по кругу оттенка (градусы) | Температура | 1 | 0.9154 | 0.3561432 |
| Среднее по кругу оттенка (градусы) | Вода | 1 | 27.7988 | 0.0001509 |
| Среднее по кругу оттенка (градусы) | Температура:Вода | 1 | 3.4792 | 0.0848724 |
| Среднее по кругу оттенка (градусы) | Остатки | 13 |
Таблица 1: Результаты линейной регрессионной модели и двустороннего анализа ANOVA, изучающие влияние очистки воды, температурной обработки и их взаимодействие на характеристики растений.
Обсуждение
Фенотипирование на основе изображений обеспечивает точные, быстрые, количественные измерения фенотипов растений 4,5,6,7. Этот метод значительно быстрее, точнее, точнее и обеспечивает большее количество измерений, чем ручное использование линейки для записи высоты растения, или качественные измерения цветовых особенностей растения, которые могут относиться к здоровью 4,5,6,7. Площадь листьев была замечена здесь и в предыдущих исследованиях10 как сильно коррелировавшая с биомассой растений (рис. 8), что позволяет предположить, что эта мера может надежно заменить трудоемкий, разрушительный и подверженный ошибкам процесс ручного взвешивания биомассы всего растения. В то время как для захвата изображений можно было использовать только камеру, добавление недорогого SBC увеличило пропускную способность за счет автоматизации сбора изображений и маркировки изображений необходимыми метаданными. Этот метод подходит для от одного до ~300 растений, которые фотографируются один раз в день (или реже). Для большого числа растений в эксперименте более подходит конвейерная, подвесная портальная или роботизированная система визуализации, поскольку время перемещения растений по отдельности для визуализации может быть больше, чем рабочий день11,13. Для более частых временных точек (например, изображение каждый час, а не один раз в день или реже) более подходящими являются камеры внутри камеры выращивания, поскольку они захватывают изображения автоматически, но ограничены размером растений и требуют дополнительного SBC15.
В то время как PlantCV представлен здесь как вариант анализа изображений, существует и другое программное обеспечение. ImageJ (Фиджи) - это бесплатный программный пакет для анализа изображений, который также может быть использован для изображений растений через графический пользовательский интерфейс (GUI)8; однако он не специально разработан для анализа изображений всего предприятия, менее адаптируем к высокопроизводительным вычислениям и менее легко воспроизводим, чем уже работающие конвейеры, подобные тем, что есть в PlantCV, которые могут быть легко применены к новым изображениям9. Методы глубокого обучения (такие как BioDock, см. Таблицу материалов) и Segment Anything22) привлекательны своей способностью легко сегментировать растения от фона и могут быть использованы для задач сегментации, описанных здесь. Однако эти модели глубокого обучения не обеспечивают описанных здесь измерений фенотиповрастений10, и для проведения этих более сложных измерений количественных фенотипов может потребоваться большое количество обучающих изображений (часто более 10 000) и вычислительная мощность, превышающая обычный ноутбук или настольный компьютер10. Эти модели также требуют значительной компьютерной памяти и вычислительной мощности, которые недоступнымногим исследователям.
Наиболее важным этапом протокола является организация установки для визуализации растения и обеспечение отсутствия объектов (таких как другие растения, цветовая карта или растительные остатки) рядомс интересующим растением. Если изображения не настроены должным образом или не используется цветовая карта, их будет невозможно проанализировать в дальнейшем, потому что нет механизма стандартизации. Несмотря на то, что в этом протоколе не требуется никаких этапов калибровки, цветокоррекция и стандартизация размера во время обработки имеют важное значение. Всегда следите за тем, чтобы вся цветовая карта находилась в рамке, но не перекрывалась с растением (Рисунок 2). Еще один распространенный подводный камень — неравномерное освещение, которое может вызвать тени или яркие кадры; мы рекомендуем использовать яркий, рассеянный верхний свет и закрывать окна в комнате для предотвращения неравномерного освещения (Рисунок 2). Дополнительные лампы могут быть добавлены под углом лицевой стороны к растению, если верхний свет создает тени. Тип лампочки не имеет значения, учитывая, что цвет на изображении будет корректироваться с помощью цветовой карты. Размытые изображения неприемлемы для анализа — используйте автофокусировку на камере или инструкции производителя по ручной фокусировке, чтобы обеспечить четкость изображений.
Аналогичным образом, обеспечение того, чтобы изображения не были переэкспонированы (распространенная ошибка), позволяет провести надлежащий анализ (рис. 2); Переэкспонированные изображения не могут быть исправлены при цветокоррекции во время анализа изображения, так как значения пикселей выходят за пределы диапазона обнаружения камеры при текущих настройках14. Чтобы предотвратить передержку, оцените цветовые гистограммы или значения RGB для тестового изображения с помощью рабочего процесса PlantCV, описанного здесь (рис. 3), и уменьшите настройку яркости на камере, если тест экспозиции определит, что изображение переэкспонировано. Значения RGB (и, следовательно, гистограммы) не должны иметь значения на 0 или на 255, что является диапазоном значений, поскольку возможно, что эти значения находятся выше или ниже диапазона обнаружения и могут записывать только минимальное или максимальное, а не истинное значение. Тестовое изображение всегда следует оценивать с использованием этих методов на предмет передержки (Рисунок 2 и Рисунок 3); мы предлагаем использовать контроль качества экспозиции PlantCV, представленный в этой публикации, в качестве проверки, которая определяет, что качественное изображение имеет менее 5 процентов пикселей при 0 или 255 для каждого цвета. Как правило, камеры и аналитическое программное обеспечение предоставляют гистограммы, которые должны иметь равные и полные хвосты гистограммы; Значения, отсеченные ниже 0 (недоэкспонированный) или выше 255 (переэкспонированный), следует переснять с отрегулированными настройками камеры. Мы рекомендуем выбирать место с ярким, равномерным, искусственным освещением без окон для освещения, так как окна могут быть слишком яркими, неравномерными и часто менять освещенность пространства. Изображения должны выглядеть равномерно освещенными, а серые квадраты цветной карты не должны казаться белыми, что предполагает передержку.
Устранение неполадок с кодом захвата изображения может потребоваться в зависимости от IP-адреса и настроек безопасности учреждения пользователя. Чтобы устранить неполадки, обратитесь в ИТ-отдел по вопросам подключения к Интернету и передачи файлов. Распространенной ошибкой является использование SD-карты неправильного размера для SBC или включение SBC до включения подключенного монитора. Для устранения неполадок точно следуйте указанному выше протоколу и повторно загрузите программное обеспечение SBC. Онлайн-форумы являются отличным ресурсом для устранения неполадок и поиска решений для конкретной камеры, выбранной при использовании gphoto2. Чтобы устранить неполадки при анализе изображений PlantCV и использовать самые последние версии, используйте страницу документации (https://plantcv.readthedocs.io/en/latest/) или опубликуйте сообщение о проблеме на GitHub (https://github.com/danforthcenter/plantcv/issues). В частности, если метод порогирования в этом протоколе недостаточно отделяет растение от фона, используйте альтернативные методы порогирования, представленные в "photo-studio-SV-notebook.ipynb" или на странице документации.
Этот метод может быть применен к любым видам растений и обработке, которая может быть перенесена на собранную фотоографическую установку, описанную выше. Например, это неприменимо к растениям, растущим в поле, так как их нельзя транспортировать к фотосъемочной площадке без выкапывания растения. В этой ситуации растения могут быть вырублены и впоследствии визуализированы с использованием протокола, хотя измерение будет разрушительным. Несколько растений могут быть запечатлены на одном изображении и проанализированы, но пользователь должен остерегаться соприкосновения растений друг с другом (рис. 2), и растения каждый раз размещаются в одном и том же месте на заднем плане, чтобы обеспечить возможность автоматического запуска рабочего процесса для всего набора изображений. Если для таких растений, как Arabidopsis thaliana, необходим вид сверху вниз, используйте штатив, чтобы переместить камеру на верхнюю часть растений, размещенных на ткани фотографического качества; Остальные методы захвата и анализа изображений остаются прежними.
Как показано на примере кукурузы, этот метод важен как для селекции растений, так и для фундаментального понимания того, как растения переносят абиотические стрессы, такие как жара и засуха. Жара и засуха в совокупности приводят к потере урожая кукурузы на 15-20% в год во всем мире23. Ожидается, что потери урожая будут только увеличиваться в связи с глобальным изменением климата, поскольку ожидается, что к 2100 году температура повысится на 1,4-4,4°C24. Оценка разнообразия кукурузы на предмет стрессоустойчивости, а также определение фенотипических, физиологических и молекулярных механизмов абиотической стрессоустойчивости являются важнейшими целями исследований для глобальной продовольственной безопасности25. Чтобы ответить на эти вопросы, исследователи во всех смежных областях - физиологи, генетики, селекционеры, молекулярные биологи и т.д. - должны быть в состоянии быстро, эффективно и часто неразрушающе оценить фенотипы растений кукурузы в условиях абиотического стресса. Показанные здесь методы и примеры результатов удовлетворяют эту потребность и являются важным инструментом для исследователей для решения реальных сельскохозяйственных проблем.
Наблюдаемые здесь фенотипы были гипотетическими, учитывая множество предыдущих исследований - стресс от засухи уменьшает размер и зелень растений (измеряется по среднему кругу оттенка)26 (Рисунок 6, Рисунок 7 и Таблица 1). Фенотип теплового стресса при неожиданном поливе из скважины не привел к значительному уменьшению площади листьев, хотя при большем количестве повторений эту взаимосвязь можно было бы лучше оценить статистически, и высота была уменьшена, как и ожидалось (Рисунок 6). В то время как среднее значение круга оттенка не изменилось из-за нагрева, цветовой профиль действительно был изменен, чтобы включить больше желтых и более темно-зеленых пикселей, показывая, что оценка только среднего оттенка недостаточна, и следует учитывать гистограмму цвета с несколькими признаками (рис. 7). Эти фенотипические изменения описывают реакцию растения на окружающую среду, и дополнительные методы, такие как измерения газообмена, микроскопия и другие, могут быть использованы для оценки физиологических изменений, происходящих в ответ на стресс. Этот результат демонстрирует силу точных, количественных измерений, которые в противном случае были бы упущены при ручных или качественных измерениях здоровья растений. Эти выводы имеют решающее значение для селекции и создания культур, устойчивых к изменению климата, что значительно снижает глобальную урожайность сельскохозяйственных культур и, по прогнозам, ухудшится в ближайшие годы.
Раскрытие информации
Никакой.
Благодарности
Эта работа проводилась в Центре фенотипирования Научного центра растений Дональда Дэнфорта (RRID: SCR_019049), который оказывал финансовую поддержку K.M.M. и J.G.D. Эта работа была поддержана грантом Научно-исследовательского института Rent-A-Car Научного центра растений Дональда Дэнфорта. D.S. был профинансирован грантом Геопространственного института Тейлора и грантом Центра Управления экономического развития США по сельскохозяйственным технологиям и прикладным наукам и технологиям (CATALST) (ED21HDQ0240072). Мы благодарим Кевина Рейли и Криса Хейнса (Интегрированный центр выращивания растений, Научный центр растений Дональда Дэнфорта, RRID: SCR_024902) за их опыт и помощь в выращивании растений. Мы благодарим Ноа Фальгрена, Малию Гехан и Хейли Шуль за их советы по PlantCV.
Материалы
| Name | Company | Catalog Number | Comments |
| 15W USB-C Power Supply | CanaKit | DCAR-RSP-3A5-C | |
| 25604 UC-E6 USB Cable | Nikon | 18208256044 | |
| 3.5 inch pots | Hummert International | 13006000 | |
| Berger BM7 35% Bark HP | Hummert International | 10121500 | |
| Biodock 2024 | AI Software Platform | www.biodock.ai. | |
| Code editing software | Jupyter | https://jupyter.org/install | |
| Code editing software | Visual Studio Code | https://code.visualstudio.com/download | |
| Color Card ColorChecker Classic | Calibrite | CCC | |
| Color Card ColorChecker Passport | Calibrite | CCPP2 | |
| Conviron Growth Chamber | Conviron | BDW80 model | |
| Dell 22 Monitor | Dell | SE2222H | |
| EH-67 AC Adapter | Nikon | AZ185 | |
| Image analysis software | PlantCV | https://plantcv.readthedocs.io/en/latest/installation/ | |
| Jack's Water Soluble Fertilizer 15-5-15 | Hummert International | 7590200 | liquid fertilizer |
| Keyboard and Mouse | Logitech | 1440638 | MK270 wireless keyboard and mouse |
| Maize seed | USDA-ARS Germplasm Resources Information Network (GRIN) | B73 | https://www.ars-grin.gov/ |
| Micro HDMI to HDMI cable | Amazon | B07KSDB25X | |
| Nikon Coolpix B500 camera | Nikon | ||
| Nikon D7200 camera | Nikon | ||
| Osmocote 14-14-14 | Hummert International | 7630000 | |
| Photography-grade fabric | Yayoya | Polyester Fabric Black Photo Backdrop for Photo Video Studio Televison | |
| Raspberry Pi 4 Case with heatsink | iUniker | B07ZVKN262 | |
| Raspberry Pi 4 Model B Rev 1.1 | Raspberry Pi Foundation | RP4B4GB_BP | |
| Raspberry Pi 4 PiSwitch (USB-C) | CanaKit | RSP-PISWITCH-USBC | |
| Raspberry Pi software | Raspberry Pi Imager | https://www.raspberrypi.com/software/ | |
| Statistical analysis software | Rstudio | https://posit.co/downloads/ | |
| Tripod | K&F Concept | T255A3+BH-28L | |
| Turface MVP | Hummert International | 10240000 | |
| Wireless Barcode Scanner | Netumscan | B08X4NMX2M | 1D and 2D barcode scanner |
Ссылки
- Xiao, Q., Bai, X., Zhang, C., He, Y. Advanced high-throughput plant phenotyping techniques for genome-wide association studies: A review. J Adv Res. 35, 215-230 (2022).
- Mutka, A. M., et al. image-based phenotyping methods provide insight into spatial and temporal dimensions of plant disease. Plant Physiol. 172 (2), 650-660 (2016).
- Mutka, A. M., Bart, R. S. Image-based phenotyping of plant disease symptoms. Front Plant Sci. 5, 734 (2014).
- Fahlgren, N., Gehan, M. A., Baxter, I. Lights, camera, action: High-throughput plant phenotyping is ready for a close-up. Curr Opin Plant Biol. 24 (2), 93-99 (2015).
- Das Choudhury, S., Samal, A., Awada, T. Leveraging image analysis for high-throughput plant phenotyping. Front Plant Sci. 10, 508 (2019).
- Yang, W., et al. Crop phenomics and high-throughput phenotyping: Past decades, current challenges, and future perspectives. Mol Plant. 13 (2), 187-214 (2020).
- Omari, M. K., et al. Digital image-based plant phenotyping: A review. Korean J Agric Sci. 47 (1), 119-130 (2020).
- Schindelin, J., et al. Fiji: An open-source platform for biolFiogical-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Gehan, M. A., et al. PlantCV v2: Image analysis software for high-throughput plant phenotyping. PeerJ. 5, e4088 (2017).
- Murphy, K. M., Ludwig, E., Gutierrez, J., Gehan, M. A. Deep learning in image-based plant phenotyping. Annu Rev Plant Biol. 75 (1), 771-795 (2024).
- Fahlgren, N., et al. A versatile phenotyping system and analytics platform reveals diverse temporal responses to water availability in Setaria. Mol Plant. 8 (3), 1520-1535 (2015).
- Yu, L., et al. Development of a mobile, high-throughput, and low-cost image-based plant growth phenotyping system. bioRxiv. , (2023).
- Atefi, A., Ge, Y., Pitla, S., Schnable, J. Robotic technologies for high-throughput plant phenotyping: Contemporary reviews and future perspectives. Front Plant Sci. 12, 611940 (2021).
- Berry, J. C., Fahlgren, N., Pokorny, A. A., Bart, R. S., Veley, K. M. An automated, high-throughput method for standardizing image color profiles to improve image-based plant phenotyping. PeerJ. 6, e5727 (2018).
- Tovar, J. C., et al. Raspberry Pi-powered imaging for plant phenotyping. Appl Plant Sci. 6, e1031 (2018).
- Jolles, J. W. Broad-scale applications of the Raspberry Pi: A review and guide for biologists. Methods Ecol Evol. 12 (5), 1562-1579 (2021).
- Watt, M., et al. Phenotyping: New windows into the plant for breeders. Annu Rev Plant Biol. 71 (1), 689-712 (2020).
- Xie, C., Yang, C. A review on plant high-throughput phenotyping traits using UAV-based sensors. Comput Electron Agric. 178, 105731 (2020).
- Czedik-Eysenberg, A., et al. The "PhenoBox", a flexible, automated, open-source plant phenotyping solution. New Phytol. 219 (4), 808-823 (2018).
- Sumner, J., Fahlgren, N., Murphy, K. M. PCVR: An R package and tutorials for guided statistical analysis of plant phenotyping data. Authorea Preprints. , (2023).
- Schnable, P. S., et al. The B73 maize genome: complexity, diversity, and dynamics. Science. 326 (5956), 1112-1115 (2009).
- Kirillov, A., et al. Segment Anything. , 3992-4003 (2023).
- Gabaldón-Leal, C., et al. Modelling the impact of heat stress on maize yield formation. Field Crops Res. 198 (3), 226-237 (2016).
- Intergovernmental Panel on Climate Change. . SYNTHESIS REPORT OF THE IPCC SIXTH ASSESSMENT REPORT (AR6). , (2023).
- Quiñones, A., et al. Optimized methods for applying and assessing heat, drought, and nutrient stress of maize seedlings in controlled environment experiments. Cold Spring Harb Protoc. , (2024).
- Murphy, K. M., et al. Maize abiotic stress treatments in controlled environments. Cold Spring Harb Protoc. , (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены