Method Article
التصوير والتحليل لقياس الأنماط الظاهرية للإجهاد اللاأحيائي للذرة (Zea mays)
In This Article
Summary
يتم تقديم طريقة للتصوير منخفض التكلفة للنباتات لقياس الأنماط الظاهرية ، جنبا إلى جنب مع أفضل الممارسات لالتقاط الصور وخط أنابيب تحليل الصور لقياس سمات النبات. تم تطبيق هذه الطرق لقياس الأنماط الظاهرية للذرة (Zea mays) تحت الحرارة والجفاف وظروف الإجهاد اللاأحيائي المشتركة.
Abstract
يعد قياس الأنماط الظاهرية الكمية للنباتات ، أو السمات ، أمرا ضروريا لفهم استجابات النبات للعوامل البيئية ، بما في ذلك الضغوط الحيوية وغير الحيوية. ومع ذلك ، يمكن أن تستغرق الطرق التقليدية لقياس النباتات وقتا طويلا وغير دقيقة ومدمرة ، خاصة عند تقييم سمات مثل الكتلة الحيوية والطول على أساس فردي. يوفر التحليل المستند إلى الصور فرصة لتقليل العمالة وتحسين الدقة والدقة وتمكين القياسات المتكررة لنفس النبات على مدى نقاط زمنية متعددة. في حين أن مرافق التنميط الظاهري عالية الإنتاجية توفر حلا ، إلا أنها غالبا ما تكون باهظة الثمن ومحدودة التوافر في جميع أنحاء العالم. يتم وصف طريقة لالتقاط صور النبات باستخدام أجهزة كمبيوتر أحادية اللوحة منخفضة التكلفة وكاميرات رقمية داخل إعداد استوديو الصور ، مصحوبة بخط أنابيب لتحليل الصور بناء على حزمة PlantCV المجانية والمفتوحة المصدر. توفر هذه الطريقة بروتوكولا سريعا ودقيقا لالتقاط الصور ووضع العلامات عليها ونقلها ، جنبا إلى جنب مع أفضل الممارسات لضمان الحصول على صور عالية الجودة. من خلال تحليل الصور ، تم تحديد أكثر من 10 أنماط ظاهرية لجميع الصور في التجربة في وقت واحد ، بما في ذلك سمات مثل حجم النبات وارتفاعه ولونه. تم استخدام هذه الطرق لتوصيف استجابة الصنف الفطري من Zea mays (الذرة) B73 للحرارة والجفاف وظروف الإجهاد اللاأحيائي للحرارة والجفاف.
Introduction
يعد قياس السمات النباتية ، أو الأنماط الظاهرية ، أمرا بالغ الأهمية للإجابة على الأسئلة الأساسية والتطبيقية في علوم النبات. على سبيل المثال ، سيحتاج الباحث الذي يسعى إلى فهم تأثير الطفرة الجينية على حجم النبات إلى قياس ارتفاع النبات ومساحةالورقة كميا 1. سيحتاج الباحث الذي يطبق الإجهاد الحيوي (مثل العدوى البكتيرية أو الفيروسية أو الفطرية) أو الإجهاد اللاأحيائي (مثل الجفاف أو الحرارة أو البرودة أو استنفاد المغذيات) إلى التحقيق في تأثير الإجهاد على لون النبات ، أو "الخضرة" ، لقياس الإصابة بالكلور2،3.
في حين أن قياس هذه السمات ضروري لبيولوجيا النبات الأساسية بالإضافة إلى تربية النباتات التطبيقية ، فإن قياسات هذه السمات يدويا يمكن أن تستغرق وقتا طويلا وغير دقيقةوغير دقيقة 4،5،6،7. على سبيل المثال ، يتضمن قياس النباتات للارتفاع استخدام مسطرة يدويا لكل نبات ، في كثير من الأحيان في الظروف البيئية الحارة أو الرطبة ، ويخضع للخطأ من وجهة نظر الشخص الذي يقيس ، وكذلك النقطة التي تعتبر "أعلى" النبات. علاوة على ذلك ، فإن القياسات مثل الكتلة الحيوية ومحتوى الصبغة مدمرة ، ولا يمكن قياس نفس النبات للتغيير بمرور الوقت أو استخدامه لأخذ عينات متعددة لأنه يجب تدميره في عملية إجراء هذه القياسات4،5،6،7. تعيق طبيعة هذه القياسات التي تستغرق وقتا طويلا والمعرضة للخطأ التقدم في تقييم النباتات من حيث استجاباتها للإجهاد الظاهري والفسيولوجي.
يوفر التقاط صور للنباتات وقياس السمات الكمية من الصورة حلولا لهذه المشكلات4،5،6،7. يعمل تحليل الصور على تحسين الدقة والدقة ، مع تقليل الوقت الذي يتعين على الباحث إجراء القياسات ، ويمكن تصوير نفس النبات عدة مرات أو استخدامه لأخذ عينات أخرى بسبب القياس الكمي للسمة غير المدمرة4،5،6،7. علاوة على ذلك ، يمكن تخزين الصور وإعادة تحليلها لفترة طويلة بعد اكتمال التجربة والتخلص من النباتات4،5،6،7. يمكن إكمال تحليل الصور بشكل فردي باستخدام أدوات تحرير الصور منخفضة الإنتاجية ، مثل ImageJ (Fiji) 8 ، أو بإنتاجية أعلى باستخدام رؤية الكمبيوتر والتعلم الآلي مع منصات مثل PlantCV9. PlantCV عبارة عن منصة مجانية ومفتوحة المصدر لتحليل الصور تمكن الباحثين من إخفاء (أو فصل) نبات أو كائن آخر أولا عن خلفية الصورة ، وإجراء قياسات للحجم والتشكل واللون والمزيد من هذا النبات أوالكائن 9. باستخدام سير عمل معياري ، يقوم الباحث أولا ببناء سير عمل مرن (أو خط أنابيب) من وحدات نمطية مختلفة مع صورة نموذجية ، ثم يخضع الصور المتبقية لسير العمل عالي الإنتاجية دون التفاعل مع كل صورةفردية 9. يتم إخراج السمات الكمية وتحليلها بحثا عن اختلافات ذات دلالة إحصائية بين المجموعات. يمكن تطوير مسارات التعلم العميق لتحليل الصور الآلي الفعال بعد التقاط صور كافية وتصنيفها بقياسات السمات المناسبة أو البيانات الوصفية10.
يمكن أن يؤدي التنميط الظاهري "عالي الإنتاجية" إلى زيادة السرعة وتقليل العمل البشري أثناء جمع البيانات ، و / أو أثناء تحليل البيانات4،5،6،7. مكنت مرافق التنميط الظاهري عالية الإنتاجية من أتمتة جمع الصور في البيئات الخاضعة للرقابة ، حيث تتحرك المصانع على أحزمة النقل أو عبر الروبوتات إلى محطة التصوير ، ويتم تصنيفها تلقائيا بالاسم (أي الملصق مع البيانات الوصفية) المرتبطة بالمصنع6،11،12،13،14. في حين أن هذه السيور الناقلة أو المرافق التي تدعم الروبوت تتيح التقاط كميات كبيرة من الصور ووضع العلامات عليها دون تدخل بشري ، إلا أن هناك القليل منها في العالم ، ويمكن أن يكلف بنائها ملايين الدولارات ، مما يجعلها غير متاحة للعديد من الباحثين. لتطبيق مفاهيم التصوير الآلي هذه بتكلفة أقل ، فإن Raspberry Pi (يشار إليها هنا باسم أجهزة الكمبيوتر أحادية اللوحة ، SBC) هي أجهزة كمبيوتر منخفضة التكلفة (أقل من 35 دولارا لكل منها) تم استخدامها لالتقاط وتسمية وتخزين ونقل الصور للنباتات المزروعة في بيئات خاضعة للرقابة. تلتقط هذه الإعدادات الصور في فواصل زمنية تلقائية وموقوتة باستخدام مصفوفة تصل إلى 72 Raspberry Pi12،15،16. في حين أنها أكثر فعالية من حيث التكلفة من أنظمة الحزام الناقل التي يمكن أن تكلف ملايين الدولارات ، إلا أن غرف نمو SBC الموصوفة سابقا هي الأكثر قابلية للتطبيق على العرض من أعلى إلى أسفل لزراعة النباتات الصغيرة ولا تزال تتطلب العديد من SBC15. في البيئات الميدانية ، تلتقط الجسور ، الطائرات بدون طيار (الأنظمة الجوية غير المأهولة) مثل الطائرات بدون طيار والأقمار الصناعية صورا لتحليل السمات النباتية17،18. يمكن أن تكون كل من الأنظمة الميدانية ومرافق البيئة الخاضعة للرقابة عالية الإنتاجية باهظة في التكلفة الأولية والصيانة والمعرفة المتخصصة اللازمة لبناء الأنظمة وصيانتها ، بالإضافة إلى تحليل الصور17،18. تمثل الهواتف المحمولة والكاميرات الرقمية المستخدمة بمفردها للتصوير الفوتوغرافي للنباتات تحديات تستغرق وقتا طويلا في نقل الصور والتسمية باستخدام البيانات الوصفية ، وهو أمر ضروري لتحليل الصور النهائية.
تقدم الطرق الموضحة هنا حلا منخفض التكلفة لتصوير المصنع للتحديات التي لم تعالجها الأنظمة الأخرى. يسمح إعداد التصوير الفوتوغرافي ، حيث يتم نقل النباتات بشكل فردي إلى الاستوديو ، بالقياس الفعال للنباتات من جميع الأحجام في الأواني. باستخدام SBC متصل بكاميرا رقمية ، توفر هذه الطريقة أولا التقاط الصور ووضع العلامات عليها ونقلها بشكل موحد. يؤدي استخدام لوحة مفاتيح أو ماسح ضوئي QR / barcode لتسمية الصور أثناء التقاطها إلى التحايل على النشاط الذي يستغرق وقتا طويلا وعرضة للخطأ لإعادة تسمية الصور بالبيانات الوصفية بعد التقاطها وتخزينها. يعد تكوين الصورة وإعدادات الكاميرا الموصى بها أمرا مهما لجعل تحليل الصور النهائية ممكنا ، ويتم تفصيل الإرشادات هنا. أخيرا ، يتم توفير خط أنابيب تحليل الصور في PlantCV لاستخراج السمات الكمية من الصور الملتقطة ، مثل مساحة الورقة وارتفاع النبات وعرضه واللون.
بالنسبة لأنظمة الحزام الناقل ، فإن هذه الطريقة منخفضة التكلفة وتتطلب SBC واحدا. تم إنشاء إعداد التنميط الظاهري الموضح هنا لإزالة قيود وتكاليف الحزام الناقل أو الأنظمة الروبوتية - يمكن قياس أي حجم للمصنع لأنه يمكن فصل الإعداد عن مساحة النمو ، ولا يلزم سوى SBC واحد ، ويعمل مع العديد من أنواع الكاميرات لتحقيق أقصى قدر من المرونة والقدرة على تحمل التكاليف. تشمل الأساليب المماثلة للطريقة المعروضة هنا PhenoBox أو PhenoRig12،19. بالمقارنة مع القياسات اليدوية ، فإن هذه الطريقة توفر الوقت وتقلل من الأخطاء ولا تدمر النباتات4،12،15،19.
Protocol
وترد تفاصيل الكواشف والمعدات المستخدمة في هذا البروتوكول في جدول المواد.
1. إعداد استوديو الصور
- قم بتعليق قماش أسود من فئة التصوير الفوتوغرافي من الحائط أو السقف للتصوير الجانبي. ثنى القماش على الأقل 0.5 متر على الأرض بحيث يتم وضع النبات فوق القماش (الشكل 1).
ملاحظة: يجب أن يكون القماش أطول بمقدار 100 سم على الأقل وأوسع من النبات المراد تصويره. - ضع بطاقة ملونة على الخلفية ، مدعومة على كائن مثل الصندوق بحيث يكون مرئيا في الإطار (الشكل 1). بالنسبة للنباتات التي يزيد طولها عن 30 سم أو عرضها ، استخدم بطاقة ملونة لا يقل عرضها عن 20 سم. بالنسبة للنباتات التي يقل طولها عن 30 سم أو عرضها ، استخدم بطاقة ملونة يتراوح عرضها بين 4-8 سم.
- قم بتوصيل بطاقة SD بجهاز كمبيوتر محمول أو كمبيوتر مكتبي. قم بتنزيل Raspberry Pi Imager من قسم البرامج على موقع الويب (https://www.raspberrypi.com/software/) ، وقم بتنزيل ملف raspberrypi-image-capture.img.gz المقدم (https://github.com/danforthcenter/photo-maize-paper) على الكمبيوتر المحمول أو الكمبيوتر المكتبي.
- قم بتشغيل Imager عن طريق فتح ملف المصور (.exe) الذي تم تنزيله. انقر فوق الزر "اختيار نظام التشغيل" وحدد الزر "استخدام مخصص" في الأسفل. حدد ملف image-capture.img.gz.
- بعد ذلك ، انقر فوق الزر "اختيار التخزين" وحدد بطاقة SD المتصلة بالكمبيوتر. انقر فوق الزر "كتابة ".
ملاحظة: تأكد من تحديد بطاقة SD الصحيحة ، حيث ستؤدي هذه العملية إلى حذف جميع البيانات المخزنة على البطاقة.
- بعد ذلك ، انقر فوق الزر "اختيار التخزين" وحدد بطاقة SD المتصلة بالكمبيوتر. انقر فوق الزر "كتابة ".
- قم بتوصيل أحدث إصدار من SBC بلوحة مفاتيح باستخدام سلك USB ، وشاشة خارجية باستخدام سلك HDMI ، وبشريط طاقة باستخدام سلك طاقة مع مفتاح. قم بتوصيل الشاشة بمشترك الطاقة باستخدام سلك الطاقة المرفق مع الشاشة. ضع بطاقة SD في SBC. انظر الشكل 1 للحصول على مخطط مسمى للإعداد.
- قم بتشغيل شريط الطاقة عن طريق الضغط على المفتاح الموجود على الشريط ، وقم بتشغيل الشاشة باستخدام الزر الموجود على الشاشة ، ثم قم بتشغيل SBC عن طريق قلب المفتاح الموجود على سلك الطاقة إلى "تشغيل".
- قم بتوصيل SBC بالإنترنت المحلي باستخدام WIFI أو كابل إيثرنت.
- إذا كان سيتم نقل الصور مباشرة إلى خادم أو وحدة تخزين سحابية:
- قم بتحرير الملف "CAPTURE-PHOTO.py" على SBC لاحتواء مسار الملف لإكمال النقل.
- قم بتحرير ملف win-credentials باستخدام المسار وكلمة المرور للخادم أو التخزين السحابي باستخدام الأمر التالي في المحطة الطرفية: sudo nano /etc/win-credentials.
ملاحظة: اتصل بمسؤول نظام الإنترنت للتأكد من أن المجلد لديه إذن لنقل الملفات.
- قم بتوصيل ماسح ضوئي لاسلكي للباركود بوحدة التحكم في اللوحة باستخدام تعليمات الشركة المصنعة المرفقة مع ماسح الباركود، إما باستخدام USB أو Bluetooth.
- قم بإيقاف تشغيل SBC بالنقر فوق الزر Raspberry Pi في الجزء العلوي الأيسر من الشاشة ، والنقر فوق تسجيل الخروج ، ثم النقر فوق إيقاف التشغيل لإيقاف تشغيل SBC بأمان. بعد إيقاف التشغيل ، قم بتشغيل مفتاح الطاقة SBC "تشغيل" سلك الطاقة إلى "إيقاف التشغيل" وشريط الطاقة إلى "إيقاف التشغيل".
2. نمو النبات ومعالجة الإجهاد
ملاحظة: أي نبات مناسب لهذه الطريقة من التنميط الظاهري. تنطبق طرق نمو النبات هذه على النتائج التمثيلية المعروضة هنا.
- احصل على بذور B73 أو أي نوع آخر من الذرة من مركز المخزون.
- تحضير وسط التربة وظروف النمو:
- املأ الأواني مقاس 3.5 بوصة (0.7 لتر) بمزيج 1: 1 من حيث الحجم من Turface MVP و Berger BM7-35 ب 3 أرطال / ياردة مكعبة من السماد بطيء الإطلاق 14-14-14 (N-P-K). ضع الأواني في صينية بها ثقوب والماء جيدا بماء التناضح العكسي (RO).
- اضبط غرفة النمو على الظروف البيئية التالية: 30 درجة مئوية في النهار / 20 درجة مئوية في الليل ، وطول النهار 16 ساعة ، ورطوبة 60٪ ، و 500 مليمول -2ثانية -1 من الضوء على مستوى الإناء أثناء النهار. قم بتعيين غرفة نمو منفصلة بنفس الظروف ، باستثناء 38 درجة مئوية في النهار / 28 درجة مئوية في الليل للإجهاد الحراري.
- ازرع 20 بذرة ذرة ، كل منها في إناء 3.5 بوصة ، عن طريق وضع عمق ~ 2 سم في التربة وتغطيتها بالتربة النازحة. اسق جيدا بماء التناضح العكسي وضعه في غرفة نمو التحكم. اسق يوميا بالأسمدة السائلة (يخلط وفقا لتعليمات الشركة المصنعة ؛ انظر جدول المواد).
ملاحظة: إن زراعة نباتات إضافية مطلوبة للتجربة ستأخذ في الحسبان ضعف الإنبات وعدم التوحيد قبل بدء تطبيق الإجهاد. يختلف معدل الإنبات حسب الصنف. - بعد 21 يوما من النمو ، قم بزرع 16 من أكثر النباتات اتساقا (ن = 4 نباتات لكل معالجة) إلى 3.79 لتر أواني مملوءة بنفس مزيج التربة المزروعة ، مبللة مسبقا بماء التناضح العكسي. أعد النباتات إلى غرفة نمو التحكم.
- في اليوم 25 (4 أيام بعد الزرع) ، انقل نصف النباتات (ن = 8) إلى غرفة الإجهاد الحراري في الوقت الذي تضيء فيه الأضواء في الغرفة. توقف عن سقي النباتات المجهدة للجفاف في كلتا الغرفتين (ن = 4 لكل غرفة).
ملاحظة: قد تحتاج نباتات الإجهاد الجفاف إلى الري حتى تبقى النباتات على قيد الحياة حتى نهاية التجربة. هنا ، تم سقي نباتات الجفاف في اليوم 31 واليوم 37 بمياه الأسمدة. - في اليوم 38 (بعد 13 يوما من بدء الإجهاد) ، قم بإزالة النباتات من غرف النمو للتصوير.
3. تصوير النبات
- بدء تشغيل SBC (انظر الشكل 2):
- قم بتشغيل شريط الطاقة باستخدام المفتاح الموجود على شريط الطاقة.
- قم بتشغيل الشاشة باستخدام الزر الموجود على الشاشة.
ملاحظة: إذا تم تشغيل SBC قبل تشغيل الشاشة، فلن يبدأ تشغيله بشكل صحيح. - قم بتشغيل المفتاح الموجود على سلك طاقة SBC إلى "تشغيل".
ملاحظة: سيؤدي هذا إلى تشغيل SBC ، وسيتم تشغيله على الشاشة ؛ لا يوجد مفتاح "تشغيل" على SBC نفسه ، فقط على سلك الطاقة.
- ضع الكاميرا على حامل ثلاثي القوائم أو طاولة ثابتة.
ملاحظة: يجب أن يكون النبات بالكامل وبطاقة الألوان معروضة على شاشة الكاميرا. يجب أن تكون الكاميرا عمودية على الأرض ولها رؤية مباشرة (بدون زاوية) لمركز النبات. يجب أن تكون الكاميرا متوافقة مع حزمة gphoto2 ، ويمكن العثور على قائمة هنا: http://www.gphoto.org/proj/libgphoto2/support.php. - توفير الطاقة للكاميرا عبر سلك طاقة مع الكاميرا أو البطاريات. قم بتشغيل الكاميرا باستخدام الزر الموجود على الكاميرا.
- قم بتوصيل الكاميرا بمنفذ USB على SBC باستخدام كابل نقل البيانات المرفق مع الكاميرا.
- ترتيب النبات في إعداد التصوير الفوتوغرافي:
- ضع قطعة من الشريط اللاصق الداكن اللون على القماش المخصص للتصوير الفوتوغرافي حيث سيتم وضع الوعاء للتأكد من أن الموضع هو نفسه لكل نبات. تأكد من أن بطاقة الألوان تتماشى مع قطعة الشريط.
ملاحظة: ضع بطاقة الألوان على بعد 10 سم على الأقل من حافة النبات. أثناء مراقبة الجودة في سير عمل PlantCV (أدناه) ، يجب أن تكون الصورة قابلة للاقتصاص لتشمل النبات والوعاء فقط ولكن ليس بطاقة الألوان لضمان عدم تضمين رقائق الألوان في استخراج السمات النهائية. انظر الشكل 2 للحصول على أمثلة للصور عالية الجودة ومنخفضة الجودة. - ضع القدر على قطعة الشريط اللاصق. بالنسبة للنباتات التي تنمو في طائرة ، مثل الذرة (Zea mays) والذرة الرفيعة (الذرة الرفيعة ثنائية اللون) ، تواجه أوسع زاوية للنبات باتجاه الكاميرا. بالنسبة للنباتات التي لا تنمو في مستوى ، التقط زوايا 0 و 90 درجة للنبات ، وقم بمتوسط القياسات الكمية الناتجة بعد اكتمال تحليل الصورة.
- ضع قطعة من الشريط اللاصق الداكن اللون على القماش المخصص للتصوير الفوتوغرافي حيث سيتم وضع الوعاء للتأكد من أن الموضع هو نفسه لكل نبات. تأكد من أن بطاقة الألوان تتماشى مع قطعة الشريط.
- على شاشة سطح مكتب SBC المعروضة على الشاشة ، افتح الجهاز بالنقر فوق زر المحطة الطرفية في شريط القائمة العلوي الأيسر.
- في حالة الحفظ مباشرة على خادم أو تخزين سحابي، قم بتحميل التخزين باستخدام الأمر التالي عن طريق التحرير إلى مسار التخزين السحابي الضروري (cloud-storage-path في المثال أدناه) وكلمة المرور، وكتابة سطر التعليمات البرمجية في نافذة المحطة الطرفية المفتوحة، والضغط على Enter على لوحة المفاتيح. إذا لم يتم تغييره من إعدادات المصنع، فسيكون معرف المستخدم (UID) هو "pi".
ملاحظه:
sudo mount -t cifs -o credentials =/ etc / win-credentials,uid = pi //cloud-storage-path /mnt/cloud-storage - اكتب الرمز التالي في الجهاز واضغط على Enter على لوحة المفاتيح. ستظهر نافذة جديدة.
./RUN-PHOTOSTUDIO-SHELL.sh
ملاحظة: يستدعي الملف RUN-PHOTOSTUDIO-SHELL.sh الملف CAPTURE-PHOTO.py ، والذي يتم تحميله مسبقا على pi إذا تم تحميله باستخدام الطريقة المذكورة أعلاه. بدلا من ذلك ، تم توفير هذه البرامج النصية على GitHub لوضعها على بطاقة Raspberry Pi SD موجودة. - سيتم فتح نافذة واجهة مستخدم رسومية. اكتب اسم الصورة ، أو امسح الرمز الشريطي أو رمز الاستجابة السريعة للمصنع باستخدام ماسح الباركود.
- حدد خيارا لحفظ الصورة محليا أو على خادم / تخزين سحابي محمل.
- انقر هنا لالتقاط صورة! زر.
- إذا تم اختيار التخزين المحلي، فافتح مجلد الصور على سطح المكتب لفحص الصورة. إذا تم اختيار خادم أو تخزين سحابي، فافتح الصورة في هذا الموقع.
- إذا لزم الأمر، اضبط الإعدادات على الكاميرا عن طريق فصلها عن SBC، وضبطها باستخدام تعليمات الشركة المصنعة، وتوصيلها مرة أخرى بوحدة التحكم في الجسم.
ملاحظة: قد يلزم ضبط الإعدادات مثل التعريض الضوئي وتباين السطوع وما إلى ذلك وفقا للإضاءة في الغرفة والكائن الذي يتم تصويره. من الأخطاء الشائعة الإفراط في تعريض الصور. للتحقق من تعرض صورة الاختبار ، تابع صورة الاختبار من خلال سير عمل تحليل الصور PlantCV ، والذي يتضمن فحص مراقبة الجودة للتعرض. اضبط إعدادات الكاميرا حسب الحاجة لتقليل التعريض الضوئي أو زيادته حتى يتم توزيع الرسوم البيانية بشكل مناسب. - بعد التقاط جميع الصور، انقل الصور من SBC إلى كمبيوتر محلي أو تخزين سحابي باستخدام الطريقة المفضلة، مثل تخزين USB أو متصفح الإنترنت أو نقل SSH.
4. استخراج السمات من الصور
- قم بتنزيل الملفات التالية على جهاز كمبيوتر أو خادم محلي: "photo-studio-SV-notebook.ipynb" و "workflow.py" و "photo-studio-SV-config.json". جميع الملفات متوفرة على GitHub (https://github.com/danforthcenter/photo-maize-paper).
- قم بتثبيت PlantCV على الكمبيوتر أو الخادم المحلي باستخدام الخطوات الموضحة (https://plantcv.readthedocs.io/en/latest/installation/).
- افتح ملف photo-studio-SV-notebook.ipynb باستخدام محرر التعليمات البرمجية المفضل ، مثل JupyterLab أو Visual Studio Code.
- قم بتشغيل كل كتلة من التعليمات البرمجية ، وقم بالتحرير حسب الضرورة بالنظر إلى المعلمات الموضحة في كتلة التعليمات البرمجية للحصول على قناع نظيف للنبات فقط في الصورة.
- عندما تكون راضيا عن تحليل عينة الصورة ، افتح workflow.py الملف في محرر التعليمات البرمجية المفضل. قم بتحرير هذا الملف مع أي معلمات تم تغييرها في "photo-studio-SV-notebook.ipynb" واحفظه.
- افتح photo-studio-SV-config.json الملف وقم بتحرير مسارات الملفات للتوجيه إلى مجلد من صور الإدخال ، ومجلد الإخراج المطلوب ، وما إلى ذلك ، كما هو موضح في الملف.
- افتح محطة طرفية وقم بتشغيل الكود التالي لتنشيط PlantCV. للقيام بذلك ، اكتب الرمز conda activate plantcv في الجهاز واضغط على Enter على لوحة المفاتيح.
- قم بتغيير سطر التعليمات البرمجية التالي إلى مسار الملف الخاص بالملف "photo-studio-SV-config.json" (هذا هو التغيير الوحيد الذي يجب إجراؤه في الكود أدناه).
- في الجهاز ، اكتب الكود المحرر واضغط على Enter على لوحة المفاتيح. سيؤدي هذا إلى تشغيل سير العمل على جميع الصور الملتقطة في التجربة.
ملاحظه:
plantcv-run-workflow --config /Users/USERNAME/photo-studio-SV-config.json
- في الجهاز ، اكتب الكود المحرر واضغط على Enter على لوحة المفاتيح. سيؤدي هذا إلى تشغيل سير العمل على جميع الصور الملتقطة في التجربة.
- افحص صور الإخراج لتحديد ما إذا كانت التعليمات البرمجية مناسبة لجميع الصور.
ملاحظة: يجب أن يكون المخطط الأزرق والوردي للنبات حول حواف النبات ، ويجب ألا يكون هناك أشياء أخرى في الصورة. إذا لزم الأمر ، ارجع إلى "photo-studio-SV-analysis.ipynb" واختبر الصور التي بها مشكلات وقم بتحرير الكود ، وتحديدا خطوات الإخفاء وتقليل الضوضاء ، للحصول على النتائج المرجوة. انظر الشكل 3 للحصول على أمثلة على تجزئة الصور عالية الجودة والمقبولة والمنخفضة. - سيكون ملف الإخراج في شكل ملف .json. ارجع إلى المحطة الطرفية (تأكد من تشغيل conda activate plantcv بالفعل) ، واكتب الكود التالي ، واضغط على Enter على لوحة المفاتيح لتحويل الملف إلى .csv للتحليل الإحصائي المتداول ، وتغيير مسار الملف إلى مسار الملف "results-photo-studio.json".
plantcv-utils json2csv -j /المستخدمون / اسم المستخدم / results-photo-studio.json -c / المستخدمون / اسم المستخدم / results-photo-studio.csv
ملاحظة: لتحويل القياسات من وحدات البكسل إلى وحدة قياس قياسية، مثل cm، استخدم التحويل المقدم من الدالة find_color_card في سير عمل PlantCV. - إجراء تحليل إحصائي للسمات الكمية الناتجة لتحديد الاختلافات في الأنماط الظاهرية للنبات بسبب الأنواع النباتية المختلفة والأصناف والمعالجات والنقاط الزمنية.
ملاحظة: تمت صياغة حزمة pcvr في R Studio لتحليل المخرجات من PlantCV من أجل الدلالة الإحصائية ورسم النتائج20. انظر ملخصا وتمثيلا مرئيا للسمات التي تم جمعها في الشكل 4.
النتائج
لتطوير هذه الطريقة ، تم تقييم نباتات الذرة B73 من حيث الأنماط الظاهرية الكمية تحت درجات حرارة التحكم ، ودرجات الحرارة ، وظروف الري الجيد ، والجفاف ، بالإضافة إلى مجموعاتها ، ليصبح المجموع أربع معالجات. B73 هو نوع معروف من الذرة الفطرية مع ثروة من البيانات الجينية21.
نجح تحليل الصور في PlantCV في تصحيح الصور بالألوان ، وتصنيف النتائج الكمية بالبيانات الوصفية للمصنع ، وتقسيم (بمعنى آخر ، فصل) النبات عن الخلفية ، كما هو موضح في الشكل 3. سيوفر التحليل غير الناجح صورا ناتجة لا تظهر المخطط الأزرق أو الشكل الوردي حول الجزء الخارجي من النبات ، ولكنها تتضمن ضوضاء إضافية أو قطعا مفقودة من النبات (الشكل 3 ، مثال منخفض الجودة). كانت عتبة القناة المزدوجة ضرورية لتضمين أكبر قدر ممكن من النبات في القناع (انظر الاستراتيجيات البديلة أحادية القناة في "photo-studio-SV-notebook.ipynb"). ومع ذلك ، فإن بعض النباتات ، خاصة تلك ذات السيقان ذات اللون الأرجواني ، لم يكن لديها تجزئة مثالية ، ولكنها كانت كافية لتحليل المصب (الشكل 3).
قدم تحليل PlantCV 16 سمة كمية أحادية القيمة ، ملخصة في الشكل 4. توفر السمة أحادية القيمة قيمة واحدة لكل نبات - على سبيل المثال ، مساحة الورقة والارتفاع والعرض والمتوسط الدائري لتدرج اللون. تم النظر في مساحة الورقة باستخدام وظيفة "تحليل.الشكل" (الشكل 4) واعتبرت النبات بأكمله. ومع ذلك ، تم النظر في الارتفاع والعرض باستخدام "الوظيفة analyze.bound_horizontal" ، مع رسم حد عند خط تربة النبات. وذلك لأن النباتات التي تتدلى على جانب الإناء سيكون لها ارتفاع أكبر مع الأخذ في الاعتبار النبات ككائن كامل ، وبدلا من ذلك يجب أن يتم قياسها فقط من قاعدة النبات حيث يلتقي بالتربة. بالإضافة إلى السمات أحادية القيمة ، ينتج PlantCV سمات متعددة القيم ، وهي رسوم بيانية ، خاصة لقيم اللون ، تمثل كل بكسل من النبات. المتوسط الدائري لتدرج اللون هو سمة أحادية القيمة وهي متوسط قيمة تدرج اللون للنبات بأكمله.
لتحديد السمات الأكثر إثارة للاهتمام ، تم حساب التباين الذي تم تفسيره من خلال العلاج لكل سمة ، بالإضافة إلى الارتباط بين السمات المختلفة باستخدام وظيفة "frem" في حزمة pcvr RStudio 20 (الشكل 5 أ). تم اختيار مساحة الورقة وارتفاعها وعرضها ومتوسط دائري اللون لتحليل المصب لأنها أوضحت أكثر من 50٪ من التباين الناتج عن المعالجة ، وهي مقاييس ذات صلة لنمو النبات (المساحة والارتفاع والعرض) والصحة (اللون). توضح الصور التمثيلية للنبات الذي يحتوي على أكبر وأصغر مساحة للأوراق التباين في الأنماط الظاهرية التي تم جمعها في هذه التجربة (الشكل 5 ب ، ج ، على التوالي). كان للنبات الذي يحتوي على أكبر مساحة أوراق أيضا أعلى متوسط لون وكان نباتا B73 ، مرقى جيدا ، ويعاني من الإجهاد الحراري (الشكل 5 ب). كان لأصغر مساحة للأوراق أصغر متوسط لون (الشكل 5 ج) ، وكانت نباتا B73 ، مصابا بالجفاف ، والإجهاد الحراري.
كان لمعالجة المياه تأثير كبير في تحديد مساحة الأوراق (F (1،13) = 226.5 ، ص = 1.32 × 10-9) ، الارتفاع (F (1،13) = 21.1 ، p = 0.0005) ، العرض (F (1،13) = 75.5 ، p = 8.92 × 10-7) ، والمتوسط الدائري لدرجة اللون (F (1،13) = 27.8 ، ص = 0.0002) ، تم تحديده باستخدام نموذج الانحدار الخطي لتأثير العلاج و ANOVA ثنائي الاتجاه في R Studio (النتائج الكاملة في الجدول 1). كان لمعالجة درجة الحرارة تأثير كبير على الارتفاع (F (1،13) = 5.94 ، p = 0.03) ، ولكن ليس مساحة الورقة أو عرضها أو متوسط دائري اللون (ص > 0.05 ، الجدول 1). لم يكن التفاعل بين درجة الحرارة وحالة الماء عاملا مهما في أي من السمات المقاسة (ص > 0.05 ، الجدول 1).
بعد ذلك ، تمت مقارنة العلاجات الفردية مع الضابط وبعضها البعض باستخدام الانحدار الخطي والاختبار اللاحق (الوسائل الهامشية المقدرة) مع تصحيح Sidak للمقارنات المتعددة (الشكل 6). انخفضت مساحة الأوراق وارتفاع النبات وعرض النبات والمتوسط الدائري لدرجة اللون بشكل كبير في النباتات المجهدة بالجفاف مقارنة بالري الجيد في كل من ظروف درجة الحرارة (ص < 0.05 ، الشكل 6). الإجهاد الحراري أثناء الري الجيد يقلل فقط من ارتفاع النبات (ص < 0.05 ، الشكل 6) ، لكنه لم يقلل بشكل كبير من مساحة الورقة أو عرض النبات أو المتوسط الدائري لتدرج اللون. يمكن التحقيق في هذا الاختلاف في تدرج اللون بشكل أكبر من خلال تقييم تدرج سمة اللون متعدد القيم ، المرسوم كرسم بياني في الشكل 7 ، بدلا من مجرد متوسط. كان الانخفاض في متوسط تدرج اللون بسبب الجفاف بسبب التحول من البكسل الأخضر إلى الأصفر ، المعروف باسم داء الاخضرار (الشكل 7). في حين أن الحرارة لم تظهر اختلافا كبيرا في متوسط درجة اللون ، إلا أنها أظهرت انخفاضا وزيادة بسبب كل من الاصفرار (داء الاخضرار) وتغميق اللون الأخضر (الشكل 7).
بعد التصوير ، تم قطع النباتات عند تقاطع جذر الجذر ، وتم تسجيل وزن الأنسجة الموجودة فوق سطح الأرض. تم غسل الجذور وتجفيفها برفق بمنشفة ، ثم وزنها ، لحساب إجمالي الكتلة الحيوية للنبات (المعروف أيضا باسم الوزن) للمقارنة مع طريقة التنميط الظاهري القائمة على الصور الموصوفة. ترتبط مساحة الورقة المقاسة عن طريق تحليل الصور ارتباطا وثيقا بالكتلة الحيوية للنبات (R2 = 0.84 ، الشكل 8).

الشكل 1: صورة لإعداد استوديو الصور مع مكونات مصنفة لجمع صور النباتات. (أ) قماش من فئة التصوير الفوتوغرافي ، (ب) بطاقة ملونة ، (ج) خط شريط لوضع الأواني بشكل موحد ، (د) كاميرا رقمية ، (ه) كمبيوتر أحادي اللوحة ، (و) شاشة تعرض عملية التقاط الصور. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: نظرة عامة على سير عمل التصوير. يتم توفير صورة تمثيلية "عالية الجودة" و "منخفضة الجودة". الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
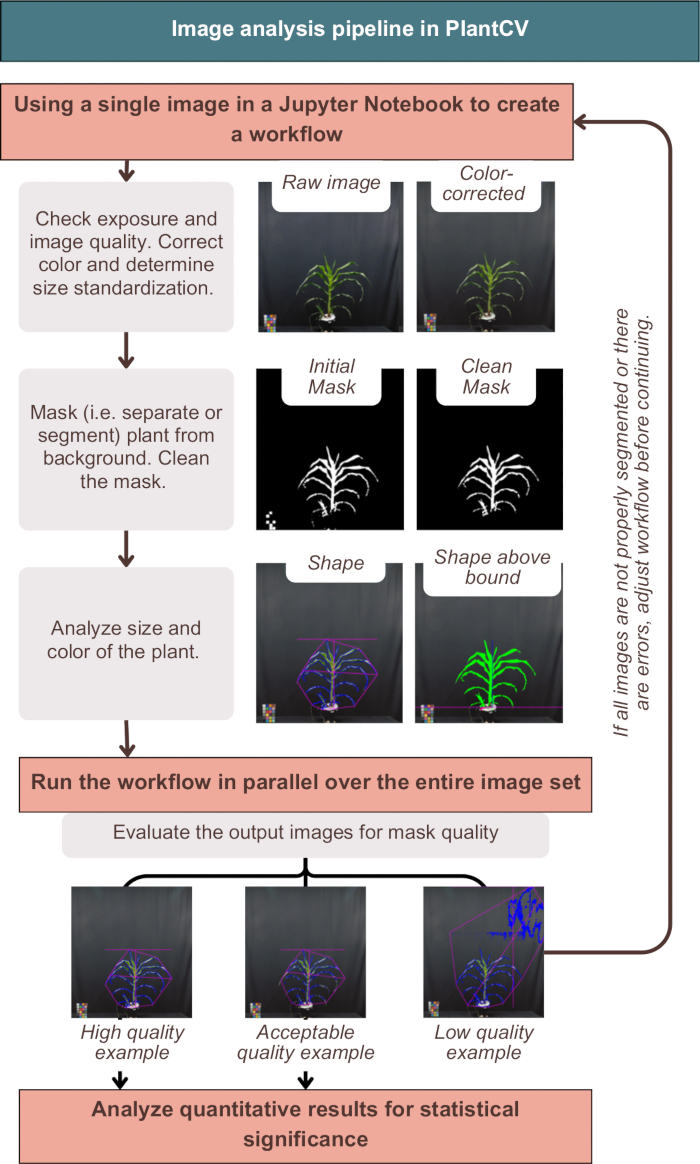
الشكل 3: نظرة عامة على سير عمل تحليل الصور في PlantCV. يتم تقديم صور تمثيلية للتجزئة ذات الجودة "العالية" و "المقبولة" و "المنخفضة" ؛ يتم تمثيل سمات PlantCV باستخدام مخطط وردي لشكل النبات بالكامل ، ومخطط أزرق لمنطقة النبات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: ملخص وتمثيل مرئي لسمات الشكل التي تم التقاطها من التحليل. وظيفة الشكل في PlantCV. تمثل الصناديق الأرجوانية سمات لا تستخدم سمة أخرى في حسابها. تمثل الصناديق البرتقالية السمات التي تستخدم سمات أخرى في حسابها. تشير الأسهم إلى السمات المستخدمة في هذه العمليات الحسابية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
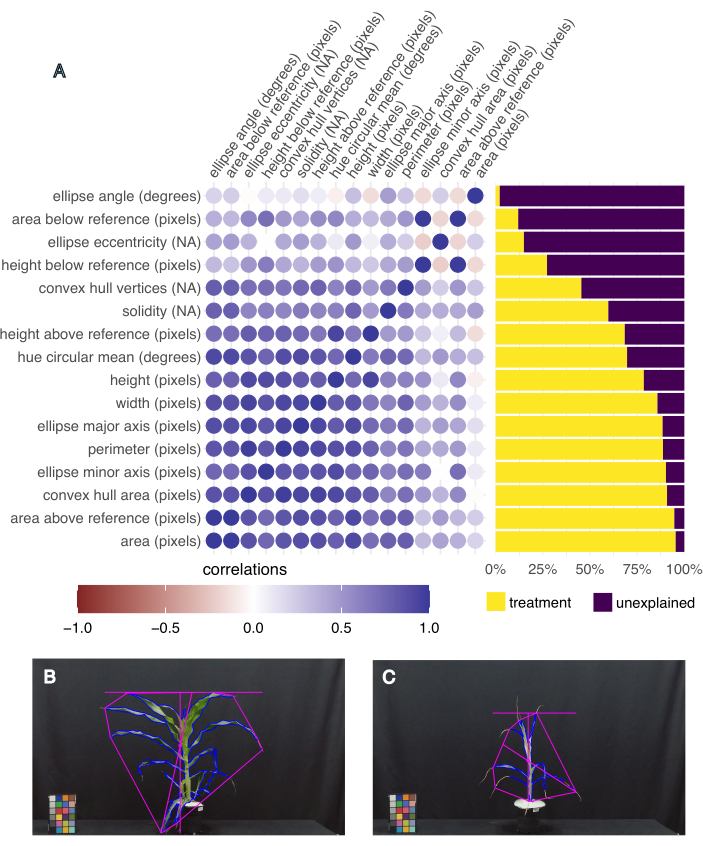
الشكل 5: التنميط الظاهري المستند إلى الصور يلتقط تباين النمط الظاهري والسمات المترابطة. (أ) تباين السمات المفسرة بالعلاج (يمين) ، وارتباط السمات ببعضها البعض (يسار). يتم تسمية كل سمة ، متبوعة بوحدة القياس الخاصة بها. "NA" تعني أنه قياس بدون وحدات. (ب) صورة للنبات الذي يحتوي على أعلى مساحة للأوراق وأعلى متوسط دائري للصبغة (درجات). (ج) صورة للنبات الذي يحتوي على أصغر مساحة للأوراق وأدنى متوسط دائري للصبغة (درجات). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
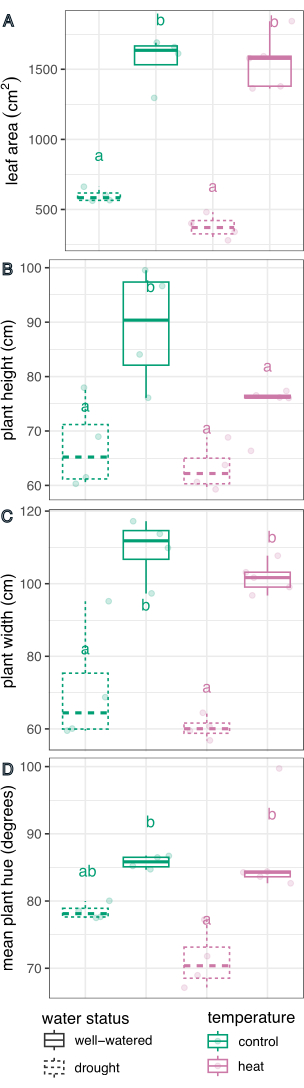
الشكل 6: مقارنة Boxplot لتأثيرات العلاج على الأنماط الظاهرية للنبات. تتم مقارنة مساحة الورقة (A) والارتفاع (B) والعرض (C) والمتوسط الدائري لتدرج اللون (D) لتأثير الجفاف والحرارة والضغوط المجمعة. ن = 4. تمثل الحروف اختلافات ذات دلالة إحصائية بين العلاجات (ص < 0.05). تمت مقارنة المعالجات باستخدام الانحدار الخطي والاختبار اللاحق (الوسائل الهامشية المقدرة) مع تصحيح Sidak للمقارنات المتعددة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
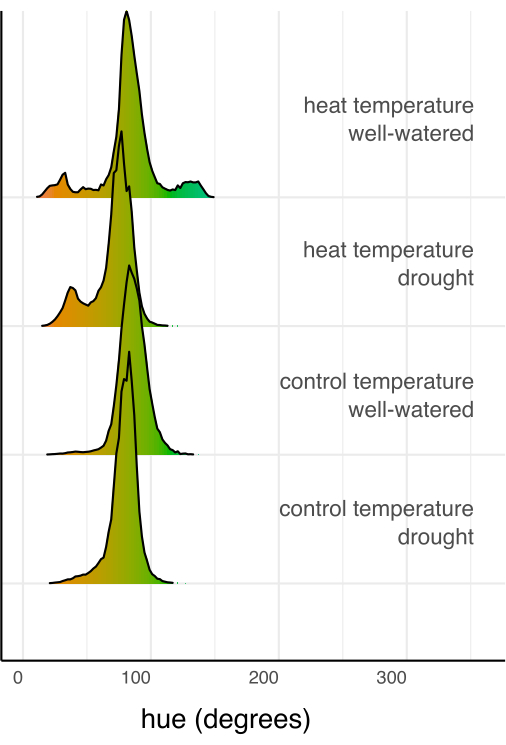
الشكل 7: الرسوم البيانية للون (تدرج اللون) المجمعة لجميع وحدات البكسل لكل مجموعة علاجية ، مع تطبيعها من خلال العدد الإجمالي للبكسل في مجموعة العلاج. يتم تلوين الرسوم البيانية بقيمة اللون لدرجة اللون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
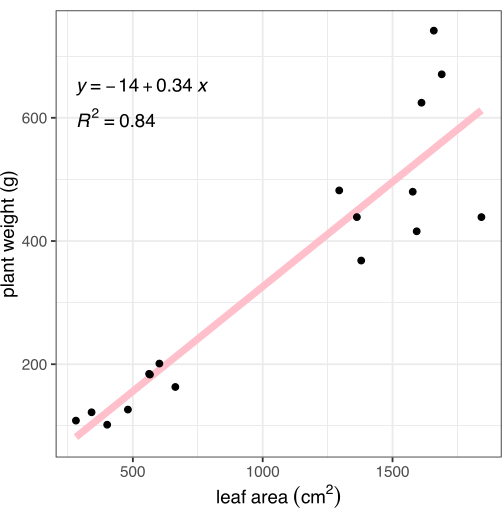
الشكل 8: ارتباط مساحة الورقة المقاسة من الصور بالكتلة الحيوية للنبات بالكامل. تمثل كل نقطة سوداء نباتا واحدا. يمثل الخط الوردي الارتباط الخطي بين مساحة الورقة (X) والكتلة الحيوية (Y). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| سمه | عامل | درجات الحرية | قيمة F | قيمة p |
| مساحة الورقة (سم ^ 2) | درجة الحرارة | 1 | 0.5372 | 0.4766 |
| مساحة الورقة (سم ^ 2) | الماء | 1 | 226.5318 | 1.32E-09 |
| مساحة الورقة (سم ^ 2) | درجة الحرارة: ماء | 1 | 2.1526 | 0.1661 |
| مساحة الورقة (سم ^ 2) | مخلفات | 13 | ||
| الارتفاع (سم) | درجة الحرارة | 1 | 5.9426 | 0.0298935 |
| الارتفاع (سم) | الماء | 1 | 21.107 | 0.0005029 |
| الارتفاع (سم) | درجة الحرارة: ماء | 1 | 2.1752 | 0.1640545 |
| الارتفاع (سم) | مخلفات | 13 | ||
| العرض (سم) | درجة الحرارة | 1 | 2.2495 | 0.1575 |
| العرض (سم) | الماء | 1 | 75.5474 | 8.92E-07 |
| العرض (سم) | درجة الحرارة: ماء | 1 | 0.0839 | 0.7766 |
| العرض (سم) | مخلفات | 13 | ||
| متوسط دائري اللون (درجات) | درجة الحرارة | 1 | 0.9154 | 0.3561432 |
| متوسط دائري اللون (درجات) | الماء | 1 | 27.7988 | 0.0001509 |
| متوسط دائري اللون (درجات) | درجة الحرارة: ماء | 1 | 3.4792 | 0.0848724 |
| متوسط دائري اللون (درجات) | مخلفات | 13 |
الجدول 1: نتائج نموذج الانحدار الخطي وتحليلات ANOVA ثنائية الاتجاه التي تدرس آثار معالجة المياه ومعالجة درجة الحرارة وتفاعلها على الصفات النباتية.
Discussion
يوفر التنميط الظاهري المستند إلى الصور قياسات دقيقة وسريعة وكمية للأنماط الظاهريةالنباتية 4،5،6،7. هذه الطريقة أسرع بكثير وأكثر دقة ودقة وتوفر عددا أكبر من القياسات من استخدام المسطرة يدويا لتسجيل ارتفاع النبات ، أو المقاييس النوعية لميزات لون النبات التي قد تتعلق بالصحة4،5،6،7. شوهدت مساحة الأوراق هنا ، وفي البحثالسابق 10 ، ترتبط ارتباطا وثيقا بالكتلة الحيوية للنبات (الشكل 8) ، مما يشير إلى أن هذا الإجراء يمكن أن يحل محل العملية التي تستغرق وقتا طويلا ومدمرة ومعرضة للخطأ لوزن الكتلة الحيوية للنبات بالكامل يدويا. بينما يمكن استخدام الكاميرا وحدها لالتقاط الصور ، فإن إضافة SBC منخفض التكلفة زاد من الإنتاجية من خلال أتمتة جمع الصور ووضع العلامات على الصور باستخدام البيانات الوصفية الضرورية15. هذه الطريقة مناسبة لواحد إلى ~ 300 نبات يتم تصويرها مرة واحدة يوميا (أو بشكل أقل تكرارا). بالنسبة لأعداد أكبر من النباتات في التجربة ، يكون نظام التصوير القائم على الناقل أو القنطرة العلوية أو الروبوت أكثر ملاءمة لأن وقت نقل النباتات بشكل فردي للتصوير قد يكون أطول من يوم عمل11،13. بالنسبة للنقاط الزمنية الأكثر تكرارا (على سبيل المثال ، صورة كل ساعة بدلا من مرة واحدة في اليوم أو أقل تكرارا) ، تكون إعدادات الكاميرا داخل غرفة النمو أكثر ملاءمة لأنها تلتقط الصور تلقائيا ، ولكنها محدودة بحجم النباتات ، وتحتاج إلى SBC15 إضافي.
بينما يتم تقديم PlantCV كخيار تحليل الصور هنا ، توجد برامج أخرى. ImageJ (فيجي) هي حزمة برمجيات مجانية لتحليل الصور يمكن استخدامها أيضا لصور النباتات من خلال واجهة مستخدم رسومية (GUI)8; ومع ذلك ، لم يتم تطويره بشكل خاص لتحليل صور المصنع بالكامل ، وهو أقل قابلية للتكيف مع الحوسبة عالية الإنتاجية ، وهو أقل قابلية للتكرار بسهولة من خطوط الأنابيب التي تعمل بالفعل مثل تلك الموجودة في PlantCV والتي يمكن تطبيقها بسهولة على الصور الجديدة9. تعد طرق التعلم العميق (مثل BioDock ، انظر جدول المواد) وتقسيم أي شيء22) جذابة لقدرتها على تقسيم النباتات بسهولة من الخلفية ، ويمكن استخدامها لمهام التجزئة الموضحة هنا. ومع ذلك ، فإن نماذج التعلم العميق هذه لا توفر قياسات النمط الظاهري للنبات الموضحة هنا10 ، ولإجراء هذه القياسات الأكثر تعقيدا للأنماط الظاهرية الكمية قد تتطلب قدرا كبيرا من صور التدريب (في كثير من الأحيان أكبر من 10,000) وقوة حوسبة تتجاوز الكمبيوتر المحمول الأساسي أو الكمبيوترالمكتبي 10. تتطلب هذه النماذج أيضا ذاكرة كمبيوتر كبيرة وقوة معالجة ، وهي غير متوفرة للعديد منالباحثين 10.
تتمثل الخطوة الأكثر أهمية في البروتوكول في ترتيب إعداد تصوير النبات والتأكد من عدم وجود كائنات (مثل النباتات الأخرى أو بطاقة الألوان أو بقايا النبات) بالقرب من النبات محل الاهتمام14. إذا لم يتم تعيين الصور بشكل مناسب ، أو لم يتم استخدام بطاقة ألوان ، فسيكون من المستحيل تحليلها لاحقا لأنه لا توجد آلية للتوحيد القياسي. على الرغم من عدم وجود خطوات معايرة ضرورية في هذا البروتوكول ، إلا أن تصحيح الألوان وتوحيد الحجم أثناء المعالجة ضروريان. تأكد دائما من أن بطاقة الألوان بأكملها في الإطار ، ولكن لا تتداخل مع النبات (الشكل 2). مأزق شائع آخر هو الإضاءة غير المتساوية ، والتي يمكن أن تسبب ظلالا أو لقطات ساطعة. نوصي باستخدام ضوء علوي ساطع ومنتشر ونوافذ تغطي في الغرفة لمنع الإضاءة غير المتساوية (الشكل 2). يمكن إضافة مصابيح إضافية بزاوية وجها لوجه إلى النبات إذا كانت الأضواء العلوية تسبب الظلال. نوع المصباح الكهربائي ليس مصدر قلق ، نظرا لأنه سيتم تصحيح اللون في الصورة باستخدام بطاقة ملونة. الصور غير الواضحة غير مقبولة للتحليل - استخدم التركيز التلقائي على الكاميرا ، أو تعليمات الشركة المصنعة للتركيز اليدوي لضمان وضوح الصور.
وبالمثل ، فإن ضمان عدم تعريض الصور بشكل مفرط (خطأ شائع) يسمح بالتحليل المناسب (الشكل 2) ؛ لا يمكن إصلاح الصور ذات التعريض المفرط في تصحيح الألوان أثناء تحليل الصورة لأن قيم البكسل تتجاوز نطاق اكتشاف الكاميرا مع الإعداداتالحالية 14. لمنع التعريض الضوئي الزائد، قم بتقييم الرسوم البيانية الملونة أو قيم RGB لصورة اختبار باستخدام سير عمل PlantCV الموضح هنا (الشكل 3)، وقم بتقليل إعداد السطوع على الكاميرا إذا حدد اختبار التعريض الضوئي أن الصورة معرضة للتعريض الضوئي الزائد. يجب ألا تحتوي قيم RGB (وبالتالي الرسوم البيانية) على قيم عند 0 أو عند 255 ، وهو نطاق القيمة لأنه من الممكن أن تكون هذه القيم أعلى أو أقل من نطاق الكشف ويمكنها فقط تسجيل الحد الأدنى أو الحد الأقصى بدلا من القيمة الحقيقية. يجب دائما تقييم صورة الاختبار باستخدام هذه الطرق للتعريض المفرط (الشكل 2 والشكل 3) ؛ نقترح استخدام مراقبة جودة التعرض PlantCV المتوفرة في هذا المنشور كفحص ، والذي يحدد جودة الصورة لتحتوي على أقل من 5 بالمائة من وحدات البكسل عند 0 أو 255 لكل لون. كقاعدة عامة ، توفر الكاميرات وبرامج التحليل الرسوم البيانية ، والتي يجب أن يكون لها ذيول رسم بياني متساوية وكاملة. يجب إعادة التقاط القيم المقطوعة أقل من 0 (التعريض الضوئي المنخفض) أو أعلى من 255 (التعريض المفرط) باستخدام إعدادات الكاميرا المعدلة. نقترح اختيار موقع به إضاءة صناعية ساطعة ومتساوية بدون نوافذ للإضاءة ، حيث يمكن أن تكون النوافذ ساطعة للغاية وغير متساوية وتغير التعرض للضوء في كثير من الأحيان للمساحة. يجب أن تظهر الصور مضاءة بشكل متساو ، ويجب ألا تظهر المربعات الرمادية لبطاقة الألوان باللون الأبيض ، مما يشير إلى التعريض المفرط.
قد يكون استكشاف الأخطاء وإصلاحها ضروريا لرمز التقاط الصورة اعتمادا على إعدادات IP والأمان لمؤسسة المستخدم. لاستكشاف الأخطاء وإصلاحها، اتصل بقسم تكنولوجيا المعلومات لمعرفة مشكلات الاتصال بالإنترنت ونقل الملفات. من الأخطاء الشائعة استخدام بطاقة SD ذات الحجم الخاطئ ل SBC ، أو تشغيل SBC قبل تشغيل الشاشة المتصلة. لاستكشاف الأخطاء وإصلاحها، اتبع البروتوكول أعلاه بدقة، وأعد تحميل برنامج SBC. تعد المنتديات عبر الإنترنت مصدرا ممتازا لاستكشاف الأخطاء وإصلاحها وإيجاد حلول للكاميرا المحددة التي تختارها عند استخدام gphoto2. لاستكشاف أخطاء تحليل صور PlantCV وإصلاحها واستخدام أحدث إصدار، استخدم صفحة الوثائق (https://plantcv.readthedocs.io/en/latest/)، أو انشر مشكلة على GitHub (https://github.com/danforthcenter/plantcv/issues). على وجه الخصوص ، إذا كانت طريقة العتبة في هذا البروتوكول لا تفصل النبات بشكل كاف عن الخلفية ، فاستخدم طرق العتبة البديلة المتوفرة في "photo-studio-SV-notebook.ipynb" أو في صفحة الوثائق.
يمكن تطبيق هذه الطريقة على أي نوع نباتي ومعالجة يمكن نقلها إلى إعداد التصوير الفوتوغرافي المجمع الموصوف. على سبيل المثال ، لا ينطبق على النباتات التي تنمو في الحقل ، حيث لا يمكن نقلها إلى إعداد التصوير الفوتوغرافي دون حفر النبات. في هذه الحالة ، يمكن قطع النباتات وتصويرها لاحقا باستخدام البروتوكول ، على الرغم من أن القياس سيكون مدمرا. يمكن التقاط نباتات متعددة في صورة واحدة وتحليلها ، ولكن يجب على المستخدم الحذر من منع النباتات من ملامسة بعضها البعض (الشكل 2) ، ويتم وضع النباتات في نفس الموقع على الخلفية في كل مرة لضمان إمكانية تشغيل سير العمل تلقائيا على مجموعة الصور بأكملها. إذا كان العرض من أعلى إلى أسفل ضروريا لنباتات مثل نبات الأرابيدوبسيس ثاليانا ، فاستخدم حامل ثلاثي القوائم لتحريك الكاميرا إلى أعلى النباتات الموضوعة على قماش التصوير الفوتوغرافي. تظل الطرق المتبقية لالتقاط الصور وتحليلها كما هي.
كما هو موضح هنا مع الذرة ، فإن هذه الطريقة مهمة لكل من تربية النباتات والرؤى الأساسية حول كيفية تحمل النباتات للضغوط اللاأحيائية ، مثل الحرارة والجفاف. يساهم الإجهاد الحراري والجفاف معا في فقدان محصول الذرة بنسبة 15٪ -20٪ سنويا في جميع أنحاءالعالم 23. من المتوقع أن تزداد خسائر الغلة فقط مع تغير المناخ العالمي ، حيث من المتوقع أن ترتفع درجات الحرارة بمقدار 1.4-4.4 درجة مئوية بحلول عام 210024. يعد تقييم تنوع الذرة من أجل تحمل الإجهاد ، وكذلك تحديد الآليات الظاهرية والفسيولوجية والجزيئية لتحمل الإجهاد اللاأحيائي ، أهدافا بحثية حاسمة للأمن الغذائيالعالمي 25. لمعالجة هذه الأسئلة ، يجب أن يكون الباحثون في جميع المجالات المجاورة - علماء وظائف الأعضاء ، وعلماء الوراثة ، والمربين ، وعلماء الأحياء الجزيئية ، وما إلى ذلك - قادرين على تقييم الأنماط الظاهرية لنباتات الذرة بسرعة وفعالية وغالبا بشكل غير مدمر تحت الإجهاد اللاأحيائي25. تلبي الطريقة والنتائج النموذجية المعروضة هنا هذه الحاجة ، وهي أداة مهمة للباحثين لمواجهة التحديات الزراعية في العالم الحقيقي.
تم افتراض الأنماط الظاهرية التي لوحظت هنا ، بالنظر إلى ثروة من الأبحاث السابقة - يقلل إجهاد الجفاف من حجم النبات والخضرة (يقاس بالمتوسط الدائري لدرجة اللون) 26 (الشكل 6 والشكل 7 والجدول 1). لم يقلل النمط الظاهري للإجهاد الحراري مع سقي الآبار بشكل غير متوقع من مساحة الأوراق بشكل كبير ، على الرغم من أنه مع المزيد من التكرارات ، يمكن تقييم هذه العلاقة بشكل أفضل إحصائيا ، وتم تقليل الارتفاع كما هو متوقع (الشكل 6). في حين أن المتوسط الدائري لتدرج اللون لم يتغير بسبب الحرارة ، فقد تم بالفعل تغيير ملف تعريف اللون ليشمل المزيد من وحدات البكسل الصفراء والخضراء الداكنة ، مما يدل على أن تقييم متوسط درجة اللون فقط غير كاف ، ويجب مراعاة الرسم البياني متعدد السمات للون (الشكل 7). تصف هذه التغييرات المظهرية استجابة النبات للبيئة ، ويمكن استخدام تقنيات إضافية مثل قياسات تبادل الغازات ، والتصوير المجهري ، والمزيد لتقييم التغيرات الفسيولوجية التي تحدث استجابة للإجهاد. توضح هذه النتيجة قوة القياسات الدقيقة والكمية التي كان من الممكن تفويتها باستخدام المقاييس اليدوية أو النوعية لصحة النبات. هذه الأفكار ضرورية لتربية وهندسة المحاصيل المقاومة لتغير المناخ ، مما يقلل بشكل كبير من غلة المحاصيل العالمية ومن المتوقع أن يزداد سوءا في السنوات المقبلة.
Disclosures
اي.
Acknowledgements
تم إجراء هذا العمل في مرفق التنميط الظاهري الأساسي ، مركز علوم النبات دونالد دانفورث (RRID: SCR_019049) ، والذي قدم الدعم التمويلي ل K.M.M. و JGD. تم دعم هذا العمل من قبل منحة معهد أبحاث تأجير السيارات التابع لمركز دونالد دانفورث لعلوم النبات. تم تمويل DS من قبل منحة كتلة معهد تايلور الجيومكاني ومنحة مركز إدارة التنمية الاقتصادية الأمريكية للتكنولوجيا الزراعية وعلوم وتكنولوجيا الموقع التطبيقي (CATALST) (ED21HDQ0240072). نشكر كيفن رايلي وكريس هينز (مرفق نمو النبات المتكامل ، مركز علوم النبات دونالد دانفورث ، RRID: SCR_024902) على خبرتهم ومساعدتهم في نمو النبات. نشكر نوح فالغرين وماليا جيهان وهالي شوهل على نصائحهم بشأن PlantCV.
Materials
| Name | Company | Catalog Number | Comments |
| 15W USB-C Power Supply | CanaKit | DCAR-RSP-3A5-C | |
| 25604 UC-E6 USB Cable | Nikon | 18208256044 | |
| 3.5 inch pots | Hummert International | 13006000 | |
| Berger BM7 35% Bark HP | Hummert International | 10121500 | |
| Biodock 2024 | AI Software Platform | www.biodock.ai. | |
| Code editing software | Jupyter | https://jupyter.org/install | |
| Code editing software | Visual Studio Code | https://code.visualstudio.com/download | |
| Color Card ColorChecker Classic | Calibrite | CCC | |
| Color Card ColorChecker Passport | Calibrite | CCPP2 | |
| Conviron Growth Chamber | Conviron | BDW80 model | |
| Dell 22 Monitor | Dell | SE2222H | |
| EH-67 AC Adapter | Nikon | AZ185 | |
| Image analysis software | PlantCV | https://plantcv.readthedocs.io/en/latest/installation/ | |
| Jack's Water Soluble Fertilizer 15-5-15 | Hummert International | 7590200 | liquid fertilizer |
| Keyboard and Mouse | Logitech | 1440638 | MK270 wireless keyboard and mouse |
| Maize seed | USDA-ARS Germplasm Resources Information Network (GRIN) | B73 | https://www.ars-grin.gov/ |
| Micro HDMI to HDMI cable | Amazon | B07KSDB25X | |
| Nikon Coolpix B500 camera | Nikon | ||
| Nikon D7200 camera | Nikon | ||
| Osmocote 14-14-14 | Hummert International | 7630000 | |
| Photography-grade fabric | Yayoya | Polyester Fabric Black Photo Backdrop for Photo Video Studio Televison | |
| Raspberry Pi 4 Case with heatsink | iUniker | B07ZVKN262 | |
| Raspberry Pi 4 Model B Rev 1.1 | Raspberry Pi Foundation | RP4B4GB_BP | |
| Raspberry Pi 4 PiSwitch (USB-C) | CanaKit | RSP-PISWITCH-USBC | |
| Raspberry Pi software | Raspberry Pi Imager | https://www.raspberrypi.com/software/ | |
| Statistical analysis software | Rstudio | https://posit.co/downloads/ | |
| Tripod | K&F Concept | T255A3+BH-28L | |
| Turface MVP | Hummert International | 10240000 | |
| Wireless Barcode Scanner | Netumscan | B08X4NMX2M | 1D and 2D barcode scanner |
References
- Xiao, Q., Bai, X., Zhang, C., He, Y. Advanced high-throughput plant phenotyping techniques for genome-wide association studies: A review. J Adv Res. 35, 215-230 (2022).
- Mutka, A. M., et al. image-based phenotyping methods provide insight into spatial and temporal dimensions of plant disease. Plant Physiol. 172 (2), 650-660 (2016).
- Mutka, A. M., Bart, R. S. Image-based phenotyping of plant disease symptoms. Front Plant Sci. 5, 734 (2014).
- Fahlgren, N., Gehan, M. A., Baxter, I. Lights, camera, action: High-throughput plant phenotyping is ready for a close-up. Curr Opin Plant Biol. 24 (2), 93-99 (2015).
- Das Choudhury, S., Samal, A., Awada, T. Leveraging image analysis for high-throughput plant phenotyping. Front Plant Sci. 10, 508 (2019).
- Yang, W., et al. Crop phenomics and high-throughput phenotyping: Past decades, current challenges, and future perspectives. Mol Plant. 13 (2), 187-214 (2020).
- Omari, M. K., et al. Digital image-based plant phenotyping: A review. Korean J Agric Sci. 47 (1), 119-130 (2020).
- Schindelin, J., et al. Fiji: An open-source platform for biolFiogical-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Gehan, M. A., et al. PlantCV v2: Image analysis software for high-throughput plant phenotyping. PeerJ. 5, e4088 (2017).
- Murphy, K. M., Ludwig, E., Gutierrez, J., Gehan, M. A. Deep learning in image-based plant phenotyping. Annu Rev Plant Biol. 75 (1), 771-795 (2024).
- Fahlgren, N., et al. A versatile phenotyping system and analytics platform reveals diverse temporal responses to water availability in Setaria. Mol Plant. 8 (3), 1520-1535 (2015).
- Yu, L., et al. Development of a mobile, high-throughput, and low-cost image-based plant growth phenotyping system. bioRxiv. , (2023).
- Atefi, A., Ge, Y., Pitla, S., Schnable, J. Robotic technologies for high-throughput plant phenotyping: Contemporary reviews and future perspectives. Front Plant Sci. 12, 611940 (2021).
- Berry, J. C., Fahlgren, N., Pokorny, A. A., Bart, R. S., Veley, K. M. An automated, high-throughput method for standardizing image color profiles to improve image-based plant phenotyping. PeerJ. 6, e5727 (2018).
- Tovar, J. C., et al. Raspberry Pi-powered imaging for plant phenotyping. Appl Plant Sci. 6, e1031 (2018).
- Jolles, J. W. Broad-scale applications of the Raspberry Pi: A review and guide for biologists. Methods Ecol Evol. 12 (5), 1562-1579 (2021).
- Watt, M., et al. Phenotyping: New windows into the plant for breeders. Annu Rev Plant Biol. 71 (1), 689-712 (2020).
- Xie, C., Yang, C. A review on plant high-throughput phenotyping traits using UAV-based sensors. Comput Electron Agric. 178, 105731 (2020).
- Czedik-Eysenberg, A., et al. The "PhenoBox", a flexible, automated, open-source plant phenotyping solution. New Phytol. 219 (4), 808-823 (2018).
- Sumner, J., Fahlgren, N., Murphy, K. M. PCVR: An R package and tutorials for guided statistical analysis of plant phenotyping data. Authorea Preprints. , (2023).
- Schnable, P. S., et al. The B73 maize genome: complexity, diversity, and dynamics. Science. 326 (5956), 1112-1115 (2009).
- Kirillov, A., et al. Segment Anything. , 3992-4003 (2023).
- Gabaldón-Leal, C., et al. Modelling the impact of heat stress on maize yield formation. Field Crops Res. 198 (3), 226-237 (2016).
- Intergovernmental Panel on Climate Change. . SYNTHESIS REPORT OF THE IPCC SIXTH ASSESSMENT REPORT (AR6). , (2023).
- Quiñones, A., et al. Optimized methods for applying and assessing heat, drought, and nutrient stress of maize seedlings in controlled environment experiments. Cold Spring Harb Protoc. , (2024).
- Murphy, K. M., et al. Maize abiotic stress treatments in controlled environments. Cold Spring Harb Protoc. , (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved