Method Article
トウモロコシ(Zea mays)非生物的ストレス表現型を定量化するためのイメージングと解析
要約
表現型を測定するための植物の低コストイメージングの方法、画像キャプチャのベストプラクティス、および植物形質を定量化するための画像分析パイプラインが紹介されています。これらの方法は、暑さ、干ばつ、および複合的な非生物的ストレス条件下でのトウモロコシ(Zea mays)の表現型を測定するために適用されました。
要約
定量的な植物の表現型(形質)を測定することは、生物的および非生物的ストレスなどの環境要因に対する植物の応答を理解するために不可欠です。しかし、従来の植物測定方法は、特にバイオマスや高さなどの特性を個別に評価する場合、時間がかかり、不正確で、破壊的になる可能性があります。画像ベースの解析は、労力を削減し、精度と精度を向上させ、同じプラントを複数の時点にわたって繰り返し測定できるようにする機会を提供します。ハイスループットの表現型解析施設は解決策を提供しますが、多くの場合、法外に高価で、世界中での利用可能性が限られています。フォトスタジオのセットアップ内で低コストのシングルボードコンピュータとデジタルカメラを使用してプラント画像をキャプチャする方法と、無料のオープンソースパッケージであるPlantCVに基づく画像分析パイプラインについて説明します。この方法は、画像のキャプチャ、ラベリング、および転送のための高速で正確なプロトコルと、高品質の画像取得を確保するためのベストプラクティスを提供します。画像解析により、植物の大きさ、高さ、色などの形質を含む、実験のすべての画像について10を超える表現型が同時に定量化されました。これらの方法は、熱、干ばつ、および複合熱と干ばつの非生物的ストレス条件に対する Zea mays (トウモロコシ)近交系品種B73の応答を特徴付けるために使用されました。
概要
植物の形質、または表現型を測定することは、植物科学における基本的な問題と応用的な質問に答えるために重要です。例えば、遺伝子変異が植物の大きさに与える影響を理解しようとする研究者は、植物の高さと葉の面積を定量的に測定する必要があります1。生物的ストレス(細菌、ウイルス、真菌感染など)または非生物的ストレス(干ばつ、暑さ、寒さ、栄養の枯渇など)を適用する研究者は、クロロシスを測定するために、ストレスが植物の色、つまり「緑」に及ぼす影響を調査する必要があります2,3。
これらの形質を測定することは、基本的な植物生物学だけでなく、応用植物育種にも不可欠ですが、これらの形質を手作業で測定するには時間がかかり、不正確で、不正確になる可能性があります4,5,6,7。たとえば、植物の高さを測定するには、多くの場合、高温多湿の環境条件で、各植物に定規を手動で使用することが含まれ、測定する人の観点から、また植物の「上部」と見なされるポイントからエラーが発生する可能性があります。さらに、バイオマスや顔料含有量などの測定は破壊的であり、これらの測定を行う過程で破壊されなければならないため、同じ植物を経時変化を測定したり、複数のサンプリングに使用したりすることはできません4,5,6,7。これらの測定には時間がかかり、エラーが発生しやすい性質があるため、植物の表現型および生理学的ストレス応答の評価が進んでいません。
植物の画像をキャプチャし、画像から量的形質を測定することで、これらの問題に対する解決策が得られます4,5,6,7。画像解析は、研究者が測定を行う時間を短縮しながら、精度と精度を向上させ、非破壊形質定量化4,5,6,7により、同じ植物を複数回画像化したり、他のサンプリングに使用したりできます。さらに、実験が完了し、植物が廃棄された後も、画像を保存して再解析することができます4,5,6,7。画像解析は、ImageJ(Fiji)8などの低スループットの画像編集ツールを使用して個別に行うことも、PlantCV9などのプラットフォームでコンピュータビジョンや機械学習を使用して高スループットで完了することもできます。PlantCVは、研究者が最初に植物やその他のオブジェクトを画像の背景からマスク(または分離)し、その植物やオブジェクトのサイズ、形態、色などを測定できるようにする無料のオープンソース画像分析プラットフォームです9。モジュール式ワークフローを使用して、研究者はまず、サンプル画像を用いて異なるモジュールの柔軟なワークフロー(またはパイプライン)を構築し、次に、個々の画像と対話することなく、残りの画像をハイスループットワークフローにさらす9。量的形質が出力され、グループ間の統計的に有意な差について分析されます。ディープラーニングパイプラインは、十分な画像がキャプチャされ、適切な特性測定値またはメタデータ10でラベル付けされた後、効率的で自動化された画像分析のために開発できます。
「ハイスループット」表現型は、データ収集中、および/またはデータ分析中、速度を上げ、人的労力を削減することができる4,5,6,7。ハイスループットの表現型解析機能により、制御された環境での画像収集の自動化が可能になり、植物はコンベヤーベルト上またはロボットを介してイメージングステーションに移動し、プラントに関連付けられた名前(つまり、メタデータ付きのラベル)で自動的にラベル付けされます6,11,12,13,14 .これらのコンベヤーベルトやロボット対応の施設は、人間の介入なしに大量の画像をキャプチャしてラベル付けすることを可能にしますが、世界にはほとんどなく、構築に数百万ドルの費用がかかるため、多くの研究者がアクセスできません。これらの自動イメージングの概念を低コストで適用するために、Raspberry Pi(ここではシングルボードコンピューター、SBC)は、制御された環境で栽培された植物の画像をキャプチャ、命名、保存、および転送するために使用されてきた低コストのコンピューター(各35ドル未満)です。これらのセットアップは、最大72台のRaspberry Pi 12,15,16の配列を使用して、自動化された時間間隔で画像をキャプチャします。数百万ドルの費用がかかるコンベヤベルトシステムよりも費用対効果が高い一方で、前述のSBC成長チャンバーは、成長する小さな植物を上から見下ろすビューに最も適しており、それでも多数のSBC15が必要です。野外環境では、ガントリー、ドローンなどのUAS(無人航空機システム)、衛星など、いずれも植物特性の解析のための画像を取得する17,18。フィールドシステムとハイスループット制御環境施設はどちらも、システムの構築と保守に必要な初期費用、メンテナンス、および画像17,18の分析に必要な専門知識において法外な場合があります。携帯電話やデジタルカメラを単独で工場撮影に使用すると、画像の転送やメタデータによるネーミングなど、下流の画像解析に不可欠な課題が生じます。
ここで説明する方法は、他のシステムでは対処できない課題に対するプラントイメージングの低コストのソリューションを提供します。植物を個別にスタジオに運ぶ撮影セットアップにより、鉢植えのあらゆるサイズの植物を効率的に測定できます。この方法では、デジタルカメラに接続されたSBCを使用して、最初に画像の標準化されたキャプチャ、ラベル付け、および転送を行います。キーボードやQR/バーコードスキャナーを使用して、キャプチャされた画像に名前を付けることで、キャプチャして保存した後にメタデータを使用して画像の名前を変更するという、時間がかかりエラーが発生しやすい作業を回避できます。画像の構図と推奨されるカメラ設定は、ダウンストリームの画像解析を可能にするために重要であり、ガイドラインについてはこちらで詳しく説明しています。最後に、PlantCVの画像分析パイプラインが提供され、キャプチャされた画像から葉の面積、植物の高さ、幅、色などの定量的な特性が抽出されます。
コンベヤベルトシステムと比較して、この方法は低コストであり、単一のSBCが必要です。ここで説明する表現型解析のセットアップは、コンベアベルトやロボットシステムの制約やコストを取り除くために構築されました - セットアップは成長スペースから分離でき、必要なSBCは1つだけで、多数のカメラタイプで動作するため、あらゆるサイズのプラントを測定でき、最大限の柔軟性と手頃な価格を実現します。ここで紹介するアプローチと同様のアプローチには、PhenoBoxまたはPhenoRig12,19が含まれます。手動測定と比較して、この方法は時間を節約し、エラーを減らし、植物を破壊しません4,12,15,19。
プロトコル
このプロトコールで使用される試薬と機器の詳細については、 資料表に記載されています。
1. フォトスタジオの準備
- 黒の写真撮影グレードの生地を壁や天井から吊るして、側面から見て撮影します。植物が布の上に配置されるように、布を床に少なくとも0.5mドレープします(図1)。
注:生地は、画像化する植物よりも少なくとも100 cm高く、幅が広い必要があります。 - 背景にカラーカードを置き、ボックスなどのオブジェクトに立てかけてフレーム内に表示されるようにします(図1)。高さまたは幅が30cmを超える植物の場合は、幅が20cm以上のカラーカードを使用してください。高さまたは幅が30 cm未満の植物の場合は、幅が4〜8 cmのカラーカードを使用してください。
- SDカードをラップトップまたはデスクトップコンピューターに接続します。Raspberry Pi ImagerをWebサイト(https://www.raspberrypi.com/software/)のソフトウェアセクションからダウンロードし、提供されたraspberrypi-image-capture.img.gzファイル(https://github.com/danforthcenter/photo-maize-paper)をラップトップまたはデスクトップコンピューターにダウンロードします。
- ダウンロードしたイメージャー(.exe)ファイルを開いて、イメージャーを起動します。 [Choose OS ] ボタンをクリックし、下部にある [Use Custom ] ボタンを選択します。image-capture.img.gzファイルを選択します。
- 次に、[ ストレージの選択 ]ボタンをクリックして、コンピューターに接続されているSDカードを選択します。 「書き込み 」ボタンをクリックします。
注意: このプロセスではカードに保存されているすべてのデータが削除されるため、正しいSDカードが選択されていることを確認してください。
- 次に、[ ストレージの選択 ]ボタンをクリックして、コンピューターに接続されているSDカードを選択します。 「書き込み 」ボタンをクリックします。
- 最新バージョンの SBC は、USB コードを使用してキーボードに接続し、HDMI コードを使用して外部モニターに接続し、スイッチ付きの電源コードを使用して電源タップに接続します。モニターに付属の電源コードを使用して、モニターを電源タップに接続します。SDカードをSBCに挿入します。図 1 に、セットアップのラベル付き回路図を示します。
- ストリップのスイッチを押して電源タップをオンにし、モニターのボタンを使用してモニターの電源を入れてから、電源コードのスイッチを「オン」に切り替えてSBCをオンにします。
- WIFIまたはイーサネットケーブルを使用してSBCをローカルインターネットに接続します。
- 写真をサーバーまたはクラウドストレージに直接転送する場合:
- SBC のファイル "CAPTURE-PHOTO.py" を編集して、転送を完了するためのファイル パスを含めます。
- ターミナルで次のコマンドを使用して、サーバーまたはクラウドストレージのパスとパスワードを使用してwin-credentialsファイルを編集します: sudo nano / etc / win-credentials。
注:インターネットシステム管理者に連絡して、フォルダにファイルを転送する権限があることを確認してください。
- バーコードスキャナーに付属の製造元の指示に従って、USBまたはBluetoothを使用して、ワイヤレスバーコードスキャナーをSBCに接続します。
- 画面の左上にある Raspberry Pi ボタンをクリックし、[ログアウト]をクリックしてから、[ シャットダウン ]をクリックしてSBCを安全にシャットダウンして、SBCの電源を切ります。シャットダウン後、SBC電源スイッチを「オン」にし、電源コードを「オフ」に、電源タップを「オフ」に切り替えます。
2.植物の成長とストレス治療
注:どの植物もこの表現型分析の方法に適しています。これらの植物成長法は、ここで提示した代表的な結果に適用できます。
- ストックセンターからB73または他のトウモロコシ品種の種子を入手します。
- 土壌培地と成長条件を準備します。
- 3.5インチのポット(0.7 L)に、Turface MVPとBerger BM7-35の1:1体積ミックスと3 lb /立方ヤードの徐放性肥料14-14-14(NPK)を入れます。穴の開いたトレイにポットを置き、逆浸透(RO)水で十分に水をまきます。
- 成長チャンバーを次の環境条件に設定します:30°Cの日/ 20°Cの夜、16時間の日長、60%の湿度、および日中のポットのレベルでの500mmol.m-2s-1の光。熱ストレスのために38°Cの日/28°Cの夜を除いて、同じ条件で別の成長チャンバーを設定します。
- トウモロコシの種を20個、それぞれ3.5インチの鉢に植えます。土壌の深さ~2 cmを置き、移動した土壌で覆います。RO水で十分に水をまき、制御成長チャンバーに入れます。液体肥料(製造元の指示に従って混合)で毎日水をまきます( 材料の表を参照)。
注:実験に必要な追加の植物を植えると、ストレス適用の開始前に発芽が不十分で均一性が欠如します。発芽率は品種によって異なります。 - 成長の21日後、最も均一な植物16個(処理ごとにn = 4植物)を、RO水で事前に湿らせた同じ培養土混合物で満たされた3.79 Lの鉢に移植します。植物を制御成長チャンバーに戻します。
- 25日目(移植後4日)に、植物の半分(n = 8)をチャンバー内のライトが点灯する時間に熱ストレスチャンバーに移動します。両方のチャンバーで干ばつストレスを受けた植物への水やりをやめます(チャンバーあたりn = 4)。
注:干ばつストレス植物は、実験が終了するまで植物が生き残るために、水をやる必要があるかもしれません。ここでは、31日目と37日目に干ばつ植物に肥料水で水をやりました。 - 38日目(ストレス開始から13日後)に、イメージングのために成長チャンバーから植物を取り出します。
3. 植物イメージング
- SBC を起動します ( 図 2 を参照)。
- 電源タップのスイッチを使用して電源タップをオンにします。
- モニターのボタンを使用してモニターの電源を入れます。
メモ: モニターの電源が入る前にSBCがオンになっていると、SBCは正しく起動しません。 - SBC電源コードのスイッチを「オン」にします。
注:これによりSBCがオンになり、モニターで起動します。SBC自体には「オン」スイッチはなく、電源コードにのみ「オン」スイッチがあります。
- カメラを三脚または安定したテーブルに置きます。
注意: 植物全体とカラーカードが view カメラ画面に表示されます。カメラは地面に対して垂直で、植物の中心を直接見る(角度なし)必要があります。カメラは gphoto2 パッケージと互換性がある必要があり、リストは http://www.gphoto.org/proj/libgphoto2/support.php にあります。 - カメラまたはバッテリーに付属の電源コード を介して カメラに電力を供給します。カメラのボタンを使用してカメラの電源を入れます。
- カメラに付属のデータ転送ケーブルを使用して、カメラをSBCのUSBポートに接続します。
- 写真撮影のセットアップで植物を配置します。
- ポットが配置される写真グレードの生地に暗い色のテープを貼って、各植物で配置が同じになるようにします。カラーカードがテープと一直線に並んでいることを確認します。
注意: カラーカードを植物の端から少なくとも10cm離して置きます。PlantCVワークフロー(下記)での品質管理では、カラーチップが最終的な形質抽出に含まれないように、植物と鉢のみを含むように画像をトリミングし、カラーカードは含めないようにする必要があります。高画質と低画質の画像の例については、 図 2 を参照してください。 - ポットをテープの上に置きます。トウモロコシ (Zea mays) やソルガム (Sorghum bicolor) など、平面内で育つ植物の場合、カメラに向けて植物の最も広い角度を向きます。平面内で成長しない植物の場合は、植物の 0 度と 90 度の角度をキャプチャし、画像解析の完了後に結果の定量的測定値を平均化します。
- ポットが配置される写真グレードの生地に暗い色のテープを貼って、各植物で配置が同じになるようにします。カラーカードがテープと一直線に並んでいることを確認します。
- モニターに表示されているSBCデスクトップ画面で、左上のメニューバーにある ターミナル ボタンをクリックしてターミナルを開きます。
- サーバーまたはクラウドストレージに直接保存する場合は、次のコマンドを使用して、必要なクラウドストレージパス(以下の例ではcloud-storage-path)とパスワードに編集し、開いているターミナルウィンドウにコード行を入力して、キーボードの Enter キーを押してストレージをマウントします。工場出荷時の設定から変更されていない場合、ユーザーID(UID)は「pi」になります。
手記:
sudo mount -t cifs -o credentials=/etc/win-credentials,uid=pi //cloud-storage-path /mnt/cloud-storage - ターミナルに次のコードを入力し、キーボードの Enter キーを押します。新しいウィンドウが表示されます。
./RUN-PHOTOSTUDIO-SHELL.sh
注:RUN-PHOTOSTUDIO-SHELL.sh ファイルは CAPTURE-PHOTO.py ファイルを呼び出し、上記の方法を使用してロードされた場合はpiに事前にロードされます。または、これらのスクリプトは、既存のRaspberry Pi SDカードに配置するためにGitHubで提供されています。 - グラフィカルユーザーインターフェースウィンドウが開きます。画像の名前を入力するか、バーコードスキャナーを使用して植物のバーコードまたはQRコードをスキャンします。
- イメージをローカルに保存するか、マウントされたサーバー/クラウドストレージに保存するかを選択します。
- 写真を撮る にはここをクリックしてください! ボタン。
- ローカルストレージを選択した場合は、デスクトップの PHOTOS フォルダを開いて画像を調べます。サーバーまたはクラウドストレージを選択した場合は、その場所でイメージを開きます。
- 必要に応じて、カメラをSBCから取り外し、製造元の指示に従って調整し、SBCに接続し直して、カメラの設定を調整します。
注意: 露出、明るさ、コントラストなどの設定は、部屋の照明や画像化されるオブジェクトによっては調整する必要がある場合があります。よくある間違いは、画像を露出オーバーにすることです。テスト画像の露出を確認するには、露出の品質管理チェックを含むPlantCV画像解析ワークフローを通じてテスト画像を進めます。必要に応じてカメラの設定を調整し、ヒストグラムが適切に分布するまで露出を増減します。 - すべての画像がキャプチャされたら、USB ストレージ、インターネット ブラウザー、SSH 転送などの推奨される方法を使用して、SBC からローカル コンピューターまたはクラウド ストレージに画像を転送します。
4. 画像からの特性抽出
- 次のファイルをローカルコンピューターまたはサーバーにダウンロードします:「photo-studio-SV-notebook.ipynb」、「workflow.py」、「photo-studio-SV-config.json」。すべてのファイルはGitHub(https://github.com/danforthcenter/photo-maize-paper)で入手できます。
- 説明されている手順(https://plantcv.readthedocs.io/en/latest/installation/)を使用して、ローカルコンピュータまたはサーバーに PlantCV をインストールします。
- JupyterLab や Visual Studio Code などの優先コード エディターを使用して、 photo-studio-SV-notebook.ipynb ファイルを開きます。
- 各コード ブロックを実行し、コード ブロックで概説されているパラメーターを前提として必要に応じて編集して、イメージ内の植物のみのクリーンなマスクを取得します。
- サンプル イメージの分析に問題がなければ、優先するコード エディターでファイル workflow.py を開きます。このファイルを「photo-studio-SV-notebook.ipynb」で変更したパラメータで編集し、保存してください。
- ファイル photo-studio-SV-config.json を開き、ファイルパスを編集して、ファイルに示されているように、入力画像のフォルダー、目的の出力フォルダーなどに移動します。
- ターミナルを開き、次のコードを実行してPlantCVをアクティブにします。これを行うには、コード conda activate plantcvをターミナルに入力し、キーボードの Enter キーを押します。
- 次のコード行を "photo-studio-SV-config.json" ファイルのファイル パスに変更します (これは、次のコードで行う唯一の変更です)。
- ターミナルで、編集したコードを入力し、キーボードの Enter キーを押します。これにより、実験でキャプチャされたすべての画像に対してワークフローが実行されます。
手記:
plantcv-run-workflow --config /Users/USERNAME/photo-studio-SV-config.json
- ターミナルで、編集したコードを入力し、キーボードの Enter キーを押します。これにより、実験でキャプチャされたすべての画像に対してワークフローが実行されます。
- 出力イメージを調べて、コードがすべてのイメージに適しているかどうかを判断します。
注:植物の青とピンクの輪郭は植物の端の周りにあり、画像に他のオブジェクトがあってはなりません。必要に応じて、「photo-studio-SV-analysis.ipynb」に戻り、問題のある画像をテストし、コード(特にマスキング手順とノイズリダクション)を編集して、目的の結果を取得します。 図 3 では、高画質、許容範囲、低品質の画像セグメンテーションの例を示します。 - 出力ファイルは.jsonファイルの形式になります。ターミナルに戻り( conda activate plantcv がすでに実行されていることを確認してください)、次のコードを入力し、キーボードのEnterキーを押して、ファイルをダウンストリーム統計分析用の.csvに変換し、ファイルパスを「results-photo-studio.json」ファイルのパスに変更します。
plantcv-utils json2csv -j /Users/USERNAME/results-photo-studio.json -c /Users/USERNAME/results-photo-studio.csv
注:測定値をピクセルからcmなどの標準測定単位に変換するには、PlantCVワークフローのfind_color_card機能から提供される変換を利用します。 - 出力された量的形質の統計分析を実行して、異なる植物種、品種、処理、および時点による植物の表現型の違いを判断します。
注:R Studioのpcvrパッケージは、PlantCVからの出力を分析して統計的有意性と結果のプロットを分析するために策定されています20。 図 4 に収集した特性の概要と視覚的表現を参照してください。
結果
この方法を開発するために、B73トウモロコシ植物は、制御温度、熱温度、水やり、干ばつ条件、およびそれらの組み合わせ、合計4つの処理で定量的表現型について評価されました。B73は、豊富な遺伝データを持つよく知られた近交系トウモロコシ品種です21。
PlantCVでの画像解析では、 図3に示すように、画像の色補正、植物メタデータによる定量結果へのラベル付け、植物を背景からセグメント化(つまり、分離)することに成功しました。解析に失敗すると、プラントの外側の青い輪郭やピンク色の形状を示さず、追加のノイズやプラントの欠落した部分を含む出力画像が得られます(図3、低品質の例)。マスクにできるだけ多くの植物を含めるには、デュアルチャネルのしきい値が必要でした(「photo-studio-SV-notebook.ipynb」の代替シングルチャネル戦略を参照)。しかし、一部の植物、特に紫色の茎を持つ植物は、完全なセグメンテーションを持っていませんでしたが、下流の分析には十分でした(図3)。
PlantCV分析では、 図4に要約されている16の定量的な単一値特性が提供されました。単一値特性は、植物ごとに 1 つの値 (葉の面積、高さ、幅、色相の円形平均など) を提供します。葉の面積は「analyze.shape」関数(図4)を用いて検討し、植物全体を考慮しました。ただし、高さと幅は「analyze.bound_horizontal関数」を使用して考慮され、植物の土壌線に境界が描画されました。これは、鉢の側面に垂れ下がっている植物は、植物を全体としての物体と見なすと高さが大きくなるため、代わりに、土壌と出会う植物の根元からのみ測定する必要があるためです。単一値特性に加えて、PlantCV は、植物の各ピクセルを表すヒストグラム、特に色値のヒストグラムである複数値特性を出力します。色相の循環平均は、植物全体の平均色相値である単一の値特性です。
どの形質が最も興味深いかを決定するために、各形質の治療によって説明される分散を計算し、また、pcvr R Studioパッケージ20 の「frem」関数を使用して異なる形質間の相関を計算した(図5A)。葉の面積、高さ、幅、および色相の円形平均は、処理による分散の 50% を超えることを説明し、植物の成長 (面積、高さ、幅) と健康 (色相) の関連する尺度であるため、下流の分析に選択されました。葉の面積が最大と最小の植物の代表的な画像は、この実験で収集された表現型のばらつきを示しています(それぞれ図5B、C)。葉の面積が最も大きい植物は、平均色相も最も高く、B73で、水やりがよく、熱ストレスを受けた植物でした(図5B)。最小の葉面積は平均色相が最も小さく(図5C)、B73、干ばつストレス、熱ストレスを受けた植物でした。
水処理は、葉の面積(F(1,13)= 226.5、p = 1.32 x 10-9)、高さ(F(1,13)= 21.1、 p = 0.0005)、幅(F(1,13)= 75.5、p = 8.92 x 10-7)、および色相の円形平均(F(1,13)= 27.8、 p = 0.0002)を決定するのに有意な効果をもたらし ました。温度処理は高さに有意な影響を及ぼしましたが(F(1,13)= 5.94、 p = 0.03)、葉の面積、幅、または色相の円形平均には影響しませんでした(p > 0.05、 表1)。温度と水の状態との間の相互作用は、測定されたどの形質においても有意な要因ではありませんでした(p > 0.05、 表1)。
次に、線形回帰と事後検定(推定周辺平均)を使用して、個々の処理を対照と比較し、多重比較のためのSidak補正を使用して相互に比較しました(図6)。葉の面積、植物の高さ、植物の幅、および色相の円形平均は、両方の温度条件下で十分に水をやった植物と比較して、干ばつストレスを受けた植物で有意に減少しました(p < 0.05、 図6)。十分に水をやっている間の熱ストレスは、植物の高さを減少させただけで(p < 0.05、 図6)、葉の面積、植物の幅、または色相の円形平均を大幅に減少させることはありませんでした。この色相の違いは、単なる平均値ではなく、 図7のヒストグラムとしてプロットされた複数値の色形質の色相を評価することで、さらに調査できます。干ばつによる平均色相の減少は、クロロシスとして知られる緑から黄色のピクセルへのシフトによるものでした(図7)。熱は平均色相に有意差を示さなかったが、緑色が黄変(クロロシス)と暗くなることの両方により、減少と増加を示した(図7)。
イメージング後、植物を根とシュートの接合部で切断し、地上組織の重量を記録しました。根をタオルで優しく洗い、乾燥させた後、秤量して、記載した画像ベースの表現型法と比較するための総植物バイオマス(重量とも呼ばれる)を計算した。画像解析 で 測定した葉面積は、植物バイオマスと強く相関していました(R2 =0.84、 図8)。

図1:植物の画像を収集するためのラベル付きコンポーネントを備えたフォトスタジオのセットアップの画像: (A)写真用の生地、(B)カラーカード、(C)ポットを均一に配置するためのテープのライン、(D)デジタルカメラ、(E)シングルボードコンピューター、(F)画像キャプチャプロセスを表示するモニター。 この図の拡大版を表示するには、ここをクリックしてください。

図2:イメージングワークフローの概要。 代表的な「高品質」と「低品質」の画像を提供します。 この図の拡大版を表示するには、ここをクリックしてください。
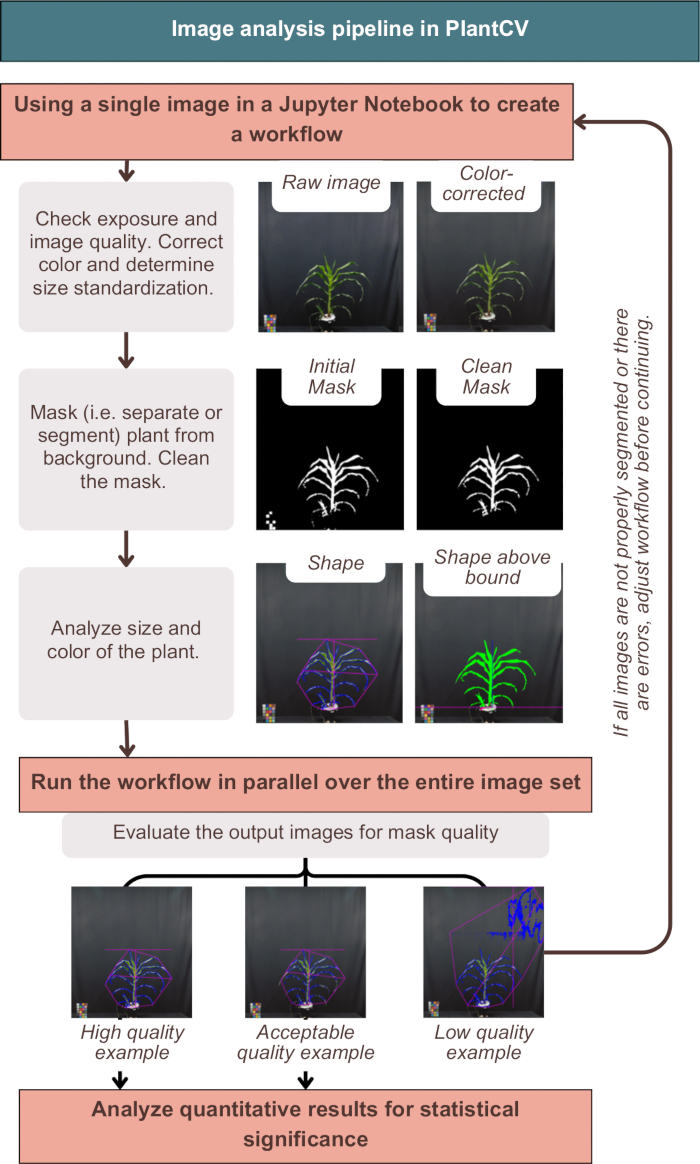
図3:PlantCVの画像解析ワークフローの概要。 「高」、「許容可能」、「低」品質のセグメンテーションの代表的な画像が表示されます。PlantCV 形質は、植物全体の形状のピンクの輪郭と、植物領域の青い輪郭を使用して表されます。 この図の拡大版を表示するには、ここをクリックしてください。

図4:解析から取得した形状特性の概要と視覚的表現。 PlantCVのシェイプ機能。紫色のボックスは、計算に別の特性を利用しない特性を表します。オレンジ色のボックスは、計算に他の特性を利用する特性を表します。矢印は、これらの計算で使用される特性を示します。 この図の拡大版を表示するには、ここをクリックしてください。
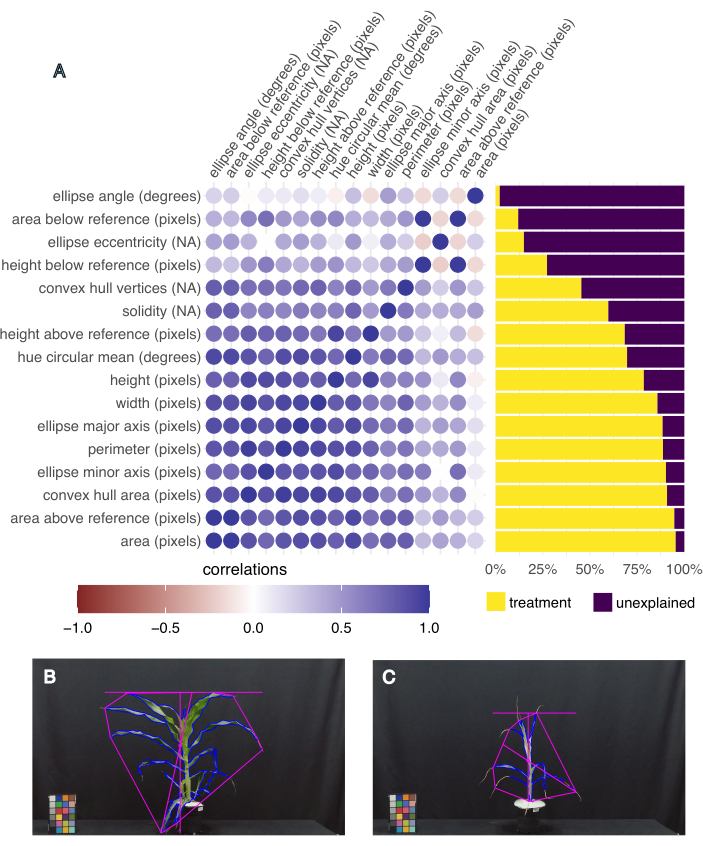
図5:画像ベースの表現型は、表現型の分散と相関する形質を捕捉します。 (A)治療によって説明される形質の分散(右)、および特性の相互の相関(左)。各特性にはラベルが付けられ、その後にその測定単位が続きます。「NA」は、単位のない測定値であることを意味します。(B)葉の面積が最も多く、色相の円形平均(度)が最も高い植物の画像。(C)葉の面積が最も小さく、色相の円形平均(度)が最も低かった植物の画像。 この図の拡大版を表示するには、ここをクリックしてください。
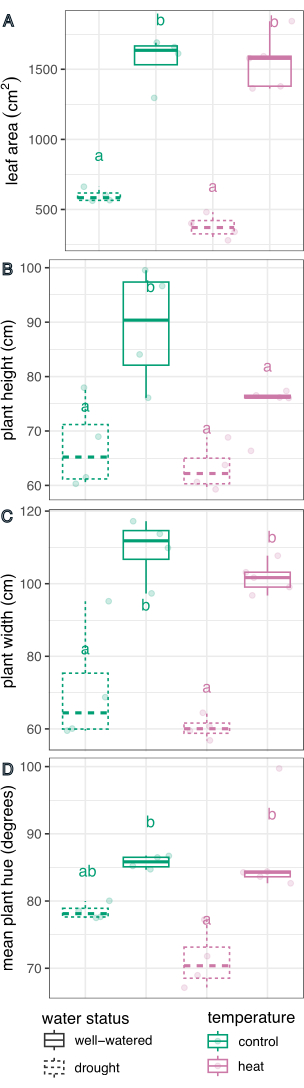
図6:植物の表現型に対する処理効果の箱ひげ図比較。 葉の面積(A)、高さ(B)、幅(C)、および色相の円形平均(D)は、干ばつ、暑さ、および複合ストレスの影響について比較されます。n = 4 です。文字は、治療間の統計的に有意な差を表します(p < 0.05)。治療は、線形回帰と事後検定(推定周辺平均)を使用して比較され、多重比較のためのSidak補正が行われた。 この図の拡大版を表示するには、ここをクリックしてください。
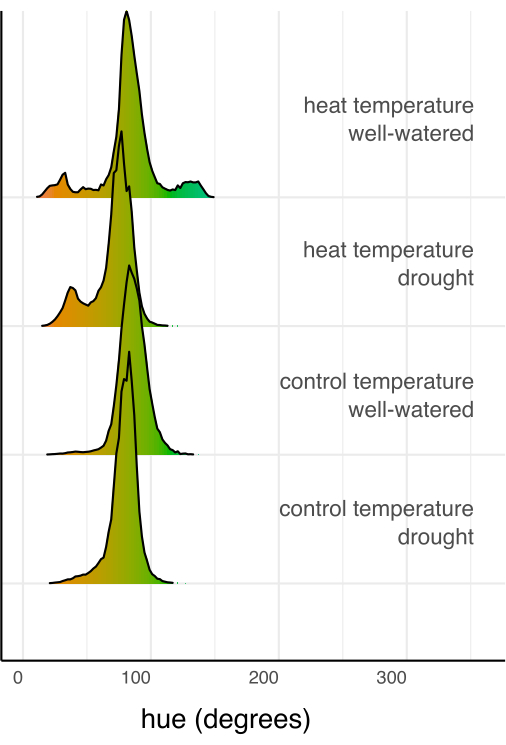
図7:各処理の組み合わせのすべてのピクセルを合計した色(色相)のヒストグラムを、処理の組み合わせのピクセルの総数で正規化したものです。 ヒストグラムは、色相の度数の色値によって色分けされます。 この図の拡大版を表示するには、ここをクリックしてください。
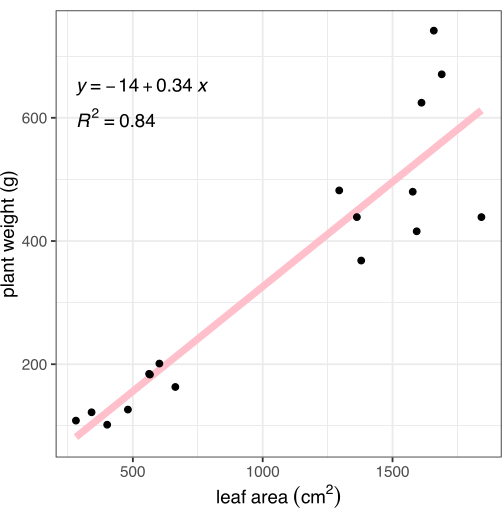
図8:画像から測定した葉面積と全植物バイオマスの相関関係。 各黒い点は 1 つの植物を表します。ピンクの線は、葉の面積(X)とバイオマス(Y)の間の線形相関を表しています。 この図の拡大版を表示するには、ここをクリックしてください。
| 習性 | 因子 | 自由度 | F値 | p値 |
| 葉の面積 (cm^2) | 温度 | 1 | 0.5372 | 0.4766 |
| 葉の面積 (cm^2) | 水 | 1 | 226.5318 | 1.32E-09 |
| 葉の面積 (cm^2) | 温度:水 | 1 | 2.1526 | 0.1661 |
| 葉の面積 (cm^2) | 残 差 | 13 | ||
| 高さ(cm) | 温度 | 1 | 5.9426 | 0.0298935 |
| 高さ(cm) | 水 | 1 | 21.107 | 0.0005029 |
| 高さ(cm) | 温度:水 | 1 | 2.1752 | 0.1640545 |
| 高さ(cm) | 残 差 | 13 | ||
| 幅(cm) | 温度 | 1 | 2.2495 | 0.1575 |
| 幅(cm) | 水 | 1 | 75.5474 | 8.92E-07 |
| 幅(cm) | 温度:水 | 1 | 0.0839 | 0.7766 |
| 幅(cm) | 残 差 | 13 | ||
| 色相の円形平均 (度) | 温度 | 1 | 0.9154 | 0.3561432 |
| 色相の円形平均 (度) | 水 | 1 | 27.7988 | 0.0001509 |
| 色相の円形平均 (度) | 温度:水 | 1 | 3.4792 | 0.0848724 |
| 色相の円形平均 (度) | 残 差 | 13 |
表1:水処理、温度処理、およびそれらの相互作用が植物形質に及ぼす影響を調べる線形回帰モデルと二元配置ANOVA分析の結果。
ディスカッション
画像ベースの表現型は、植物の表現型4,5,6,7の正確、迅速、定量的な測定を提供します。この方法は、定規を手動で使用して植物の高さを記録したり、健康に関連する可能性のある植物の色の特徴を定性的に測定したりするよりも、大幅に速く、より正確で、より正確で、より多くの測定を提供します4,5,6,7。葉の面積は、ここで見られ、以前の研究10では、植物バイオマスと強く相関しており(図8)、この測定値は、植物全体のバイオマスを手動で計量するという、時間がかかり、破壊的で、エラーが発生しやすいプロセスを確実に置き換えることができることを示唆しています。カメラだけで画像をキャプチャすることもできましたが、低コストのSBCを追加することで、必要なメタデータ15による画像収集と画像ラベリングの自動化によりスループットが向上しました。この方法は、1日1回(またはそれ以下の頻度で)画像化される1〜~300の植物に適しています。実験における植物の数が多い場合、イメージングのために植物を個別に移動する時間が就業日11,13よりも長くなる可能性があるため、コンベアベース、オーバーヘッドガントリー、またはロボット対応イメージングシステムがより適しています。より頻繁な時点(たとえば、1日に1回ではなく1時間ごとに画像を取得するなど)の場合、成長チャンバー内のカメラセットアップは、画像を自動的にキャプチャしますが、植物のサイズによって制限され、追加のSBC15が必要になるため、より適しています。
ここでは画像解析オプションとしてPlantCVが提示されていますが、他のソフトウェアも存在します。ImageJ(フィジー)は、グラフィカルユーザーインターフェース(GUI)8を介して植物の画像にも使用できる画像分析用のフリーソフトウェアパッケージです。ただし、プラント全体の画像分析用に特別に開発されたわけではなく、ハイスループットコンピューティングへの適応性が低く、新しい画像に容易に適用できるPlantCVのようなすでに動作しているパイプラインよりも再現性が低くなります9。ディープラーニング(BioDockなど、 Table of Materialsを参照)やSegment Anything22)の手法は、背景から植物を簡単にセグメント化できる点で魅力的であり、ここで説明するセグメンテーションタスクに使用できます。しかし、これらの深層学習モデルは、ここで述べた植物表現型の測定10を提供しておらず、定量的表現型のこれらのより複雑な測定を行うためには、大量の学習画像(しばしば10,000を超える)と基本的なラップトップまたはデスクトップコンピュータ10を超える計算能力が必要になるかもしれない。これらのモデルはまた、多くの研究者が利用できない大量のコンピューターメモリと処理能力を必要とします10。
プロトコルの最も重要なステップは、植物イメージングセットアップを配置し、関心のある植物14の近くに物体(他の植物、カラーカード、または植物の破片など)がないことを確認することです。画像が適切に設定されていなかったり、カラーカードが使われていなかったりすると、標準化の仕組みがないため、後から解析ができなくなります。このプロトコルではキャリブレーション手順は必要ありませんが、処理中の色補正とサイズの標準化は不可欠です。カラーカード全体がフレーム内にあり、植物と重ならないように常に確認してください(図2)。もう1つの一般的な落とし穴は、照明が不均一で、影や明るいショットを引き起こす可能性があります。明るく拡散した頭上光を使用し、部屋の窓を覆って、照明の不均一を防ぐことをお勧めします(図2)。頭上のライトが影を引き起こしている場合は、プラントに対して正面から角度を付けてランプを追加できます。電球の種類は、カラーカードを使用して画像内の色が修正されるため、問題はありません。ぼやけた画像は分析に適していません - カメラのオートフォーカスを使用するか、メーカーのマニュアルフォーカスの指示を使用して、画像が鮮明であることを確認してください。
同様に、画像が露出オーバーにならないようにすることで(よくある間違い)、適切な分析が可能になります(図2)。露出オーバーの画像は、ピクセル値が現在の設定14でカメラの検出範囲を超えているため、画像分析中の色補正で修正することはできません。露出オーバーを防ぐには、ここで説明するPlantCVワークフロー(図3)を使用してテスト画像のカラーヒストグラムまたはRGB値を評価し、露出テストで画像が露出オーバーであると判断された場合は、カメラの明るさ設定を下げます。RGB値(したがってヒストグラム)は、0または255(値の範囲)に値を持つべきではありません。これは、これらの値が検出範囲より上または下にある可能性があり、真の値ではなく最小値または最大値しか記録できないためです。テスト画像は、露出オーバーについて常にこれらの方法を使用して評価する必要があります(図2 および 図3)。この出版物で提供されているPlantCV露出品質管理をチェックとして利用し、各色のピクセルが0または255で5%未満の品質画像を決定することをお勧めします。原則として、カメラと分析ソフトウェアはヒストグラムを提供し、ヒストグラムのテールは等しく完全なものである必要があります。0(露出アンダー)または255(露出オーバー)未満でカットオフされた値は、カメラ設定を調整して再撮影する必要があります。窓は明るすぎたり、不均一であったり、空間への光の露出が頻繁に変化する可能性があるため、照明用の窓がない、明るく均一な人工照明のある場所を選択することをお勧めします。画像は均一に照らされ、カラーカードの灰色の四角形は白く見えないようにする必要があります。これは露出オーバーを示唆しています。
イメージキャプチャコードのトラブルシューティングは、ユーザのインスティテューションのIPおよびセキュリティ設定によっては必要になる場合があります。トラブルシューティングを行うには、インターネット接続とファイル転送の問題についてIT部門にお問い合わせください。よくある間違いは、SBCに間違ったサイズのSDカードを使用したり、接続されたモニターの電源を入れる前にSBCをオンにしたりすることです。トラブルシューティングを行うには、上記のプロトコルに正確に従い、SBCソフトウェアをリロードします。オンラインフォーラムは、gphoto2を使用する際に選択した特定のカメラのトラブルシューティングと解決策を見つけるための優れたリソースです。PlantCV画像解析のトラブルシューティングを行い、最新のバージョン管理を使用するには、ドキュメントページ(https://plantcv.readthedocs.io/en/latest/)を利用するか、GitHub(https://github.com/danforthcenter/plantcv/issues)に問題を投稿してください。特に、このプロトコルの閾値処理方法で植物を背景から十分に分離できない場合は、「photo-studio-SV-notebook.ipynb」またはドキュメンテーションページに記載されている別の閾値処理方法を使用してください。
この方法は、記載されている組み立てられたフォトフォトグラフィーセットアップに輸送できる任意の植物種および処理に適用することができます。たとえば、植物を掘り起こさずに撮影現場に運ぶことができないため、畑で育つ植物には適用できません。この状況では、植物を切り倒し、その後プロトコルを使用して画像化することができますが、測定は破壊的です。複数の植物を1つの画像にキャプチャして分析することができますが、植物が互いに接触しないように注意し(図2)、植物は毎回背景の同じ場所に配置されて、ワークフローが画像セット全体に対して自動的に実行されるようにする必要があります。 シロイヌナズナなどの植物に上から見下ろすビューが必要な場合は、三脚を使用して、写真撮影用の生地に配置された植物の上部にカメラを移動します。画像のキャプチャと分析の残りの方法は同じままです。
ここでトウモロコシで実証されているように、この方法は、植物の育種と、植物が熱や干ばつなどの非生物的ストレスにどのように耐えるかについての基本的な洞察の両方にとって重要です。暑さと干ばつのストレスが組み合わさって、世界中でトウモロコシの収量が年間15%〜20%減少しています23。収量の損失は、2100年までに気温が1.4〜4.4°C上昇すると予想されているため、地球規模の気候変動によってのみ増加すると予想されています24。トウモロコシの多様性をストレス耐性として評価し、非生物的ストレス耐性の表現型、生理学的、分子的メカニズムを決定することは、世界の食料安全保障にとって重要な研究目標である25。これらの疑問に取り組むために、生理学者、遺伝学者、育種家、分子生物学者など、隣接するすべての分野の研究者は、非生物的ストレス下でのトウモロコシ植物の表現型を迅速、効果的、そしてしばしば非破壊的に評価できなければならない25。ここに示されている方法と結果例は、このニーズに対応しており、研究者が実際の農業の課題に取り組むための重要なツールです。
ここで観察された表現型は、豊富な先行研究、すなわち干ばつストレスが植物のサイズと緑を減少させる(色相の円形平均で測定)26 (図6、 図7、 表1)ことから仮定されたものである。十分な水やりによる熱ストレスの表現型は、予想外に葉の面積を有意に減少させませんでしたが、反復回数が多いほど、この関係は統計的により適切に評価でき、高さは予想どおりに減少しました(図6)。色相の円形平均は熱によって変化しませんでしたが、実際にはカラープロファイルがより多くの黄色と濃い緑のピクセルの両方を含むように変更されており、平均色相の評価だけでは不十分であり、色の多値特性ヒストグラムを考慮する必要があります(図7)。これらの表現型の変化は、環境に対する植物の反応を表しており、ガス交換の測定、顕微鏡イメージングなどの追加の技術を使用して、ストレスに応答して発生する生理学的変化を評価することができます。この結果は、植物の健康状態を手動または定性的に測定すると見逃される可能性のある、正確で定量的な測定の力を示しています。これらの知見は、世界の作物収量を大幅に減少させ、将来的に悪化すると予測される気候変動に耐性のある作物の育種や工学にとって重要です。
開示事項
何一つ。
謝辞
この研究は、K.M.M.とJ.G.D.に資金援助を提供したドナルド・ダンフォース植物科学センター(RRID:SCR_019049)の表現型コア施設で行われました。この研究は、ドナルド・ダンフォース植物科学センター・エンタープライズレンタカー研究所助成金の支援を受けました。D.S.は、Taylor Geospatial Institute Block Grantと、US Economic Development Administration Center for AgTech and Applied Location Science and Technology(CATALST)助成金(ED21HDQ0240072)から資金提供を受けました。ケビン・ライリー氏とクリス・ヘインズ氏(統合植物成長施設、ドナルド・ダンフォース植物科学センター、RRID:SCR_024902)の植物成長に関する専門知識と支援に感謝します。PlantCVに関するアドバイスを提供してくださったNoah Fahlgren氏、Malia Gehan氏、Haley Schuhl氏に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 15W USB-C Power Supply | CanaKit | DCAR-RSP-3A5-C | |
| 25604 UC-E6 USB Cable | Nikon | 18208256044 | |
| 3.5 inch pots | Hummert International | 13006000 | |
| Berger BM7 35% Bark HP | Hummert International | 10121500 | |
| Biodock 2024 | AI Software Platform | www.biodock.ai. | |
| Code editing software | Jupyter | https://jupyter.org/install | |
| Code editing software | Visual Studio Code | https://code.visualstudio.com/download | |
| Color Card ColorChecker Classic | Calibrite | CCC | |
| Color Card ColorChecker Passport | Calibrite | CCPP2 | |
| Conviron Growth Chamber | Conviron | BDW80 model | |
| Dell 22 Monitor | Dell | SE2222H | |
| EH-67 AC Adapter | Nikon | AZ185 | |
| Image analysis software | PlantCV | https://plantcv.readthedocs.io/en/latest/installation/ | |
| Jack's Water Soluble Fertilizer 15-5-15 | Hummert International | 7590200 | liquid fertilizer |
| Keyboard and Mouse | Logitech | 1440638 | MK270 wireless keyboard and mouse |
| Maize seed | USDA-ARS Germplasm Resources Information Network (GRIN) | B73 | https://www.ars-grin.gov/ |
| Micro HDMI to HDMI cable | Amazon | B07KSDB25X | |
| Nikon Coolpix B500 camera | Nikon | ||
| Nikon D7200 camera | Nikon | ||
| Osmocote 14-14-14 | Hummert International | 7630000 | |
| Photography-grade fabric | Yayoya | Polyester Fabric Black Photo Backdrop for Photo Video Studio Televison | |
| Raspberry Pi 4 Case with heatsink | iUniker | B07ZVKN262 | |
| Raspberry Pi 4 Model B Rev 1.1 | Raspberry Pi Foundation | RP4B4GB_BP | |
| Raspberry Pi 4 PiSwitch (USB-C) | CanaKit | RSP-PISWITCH-USBC | |
| Raspberry Pi software | Raspberry Pi Imager | https://www.raspberrypi.com/software/ | |
| Statistical analysis software | Rstudio | https://posit.co/downloads/ | |
| Tripod | K&F Concept | T255A3+BH-28L | |
| Turface MVP | Hummert International | 10240000 | |
| Wireless Barcode Scanner | Netumscan | B08X4NMX2M | 1D and 2D barcode scanner |
参考文献
- Xiao, Q., Bai, X., Zhang, C., He, Y. Advanced high-throughput plant phenotyping techniques for genome-wide association studies: A review. J Adv Res. 35, 215-230 (2022).
- Mutka, A. M., et al. image-based phenotyping methods provide insight into spatial and temporal dimensions of plant disease. Plant Physiol. 172 (2), 650-660 (2016).
- Mutka, A. M., Bart, R. S. Image-based phenotyping of plant disease symptoms. Front Plant Sci. 5, 734 (2014).
- Fahlgren, N., Gehan, M. A., Baxter, I. Lights, camera, action: High-throughput plant phenotyping is ready for a close-up. Curr Opin Plant Biol. 24 (2), 93-99 (2015).
- Das Choudhury, S., Samal, A., Awada, T. Leveraging image analysis for high-throughput plant phenotyping. Front Plant Sci. 10, 508 (2019).
- Yang, W., et al. Crop phenomics and high-throughput phenotyping: Past decades, current challenges, and future perspectives. Mol Plant. 13 (2), 187-214 (2020).
- Omari, M. K., et al. Digital image-based plant phenotyping: A review. Korean J Agric Sci. 47 (1), 119-130 (2020).
- Schindelin, J., et al. Fiji: An open-source platform for biolFiogical-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Gehan, M. A., et al. PlantCV v2: Image analysis software for high-throughput plant phenotyping. PeerJ. 5, e4088 (2017).
- Murphy, K. M., Ludwig, E., Gutierrez, J., Gehan, M. A. Deep learning in image-based plant phenotyping. Annu Rev Plant Biol. 75 (1), 771-795 (2024).
- Fahlgren, N., et al. A versatile phenotyping system and analytics platform reveals diverse temporal responses to water availability in Setaria. Mol Plant. 8 (3), 1520-1535 (2015).
- Yu, L., et al. Development of a mobile, high-throughput, and low-cost image-based plant growth phenotyping system. bioRxiv. , (2023).
- Atefi, A., Ge, Y., Pitla, S., Schnable, J. Robotic technologies for high-throughput plant phenotyping: Contemporary reviews and future perspectives. Front Plant Sci. 12, 611940 (2021).
- Berry, J. C., Fahlgren, N., Pokorny, A. A., Bart, R. S., Veley, K. M. An automated, high-throughput method for standardizing image color profiles to improve image-based plant phenotyping. PeerJ. 6, e5727 (2018).
- Tovar, J. C., et al. Raspberry Pi-powered imaging for plant phenotyping. Appl Plant Sci. 6, e1031 (2018).
- Jolles, J. W. Broad-scale applications of the Raspberry Pi: A review and guide for biologists. Methods Ecol Evol. 12 (5), 1562-1579 (2021).
- Watt, M., et al. Phenotyping: New windows into the plant for breeders. Annu Rev Plant Biol. 71 (1), 689-712 (2020).
- Xie, C., Yang, C. A review on plant high-throughput phenotyping traits using UAV-based sensors. Comput Electron Agric. 178, 105731 (2020).
- Czedik-Eysenberg, A., et al. The "PhenoBox", a flexible, automated, open-source plant phenotyping solution. New Phytol. 219 (4), 808-823 (2018).
- Sumner, J., Fahlgren, N., Murphy, K. M. PCVR: An R package and tutorials for guided statistical analysis of plant phenotyping data. Authorea Preprints. , (2023).
- Schnable, P. S., et al. The B73 maize genome: complexity, diversity, and dynamics. Science. 326 (5956), 1112-1115 (2009).
- Kirillov, A., et al. Segment Anything. , 3992-4003 (2023).
- Gabaldón-Leal, C., et al. Modelling the impact of heat stress on maize yield formation. Field Crops Res. 198 (3), 226-237 (2016).
- Intergovernmental Panel on Climate Change. . SYNTHESIS REPORT OF THE IPCC SIXTH ASSESSMENT REPORT (AR6). , (2023).
- Quiñones, A., et al. Optimized methods for applying and assessing heat, drought, and nutrient stress of maize seedlings in controlled environment experiments. Cold Spring Harb Protoc. , (2024).
- Murphy, K. M., et al. Maize abiotic stress treatments in controlled environments. Cold Spring Harb Protoc. , (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved