Method Article
Programlanmış Ölüm Ligandı 1 Ekspresyonunun Görüntülenmesi için 68Galyum Etiketli D-Peptid PET İzleyicinin Geliştirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu çalışma, [68Ga] D-dodekapeptid antagonistinin pozitron emisyon tomografik görüntülemesine dayanarak, programlanmış ölüm ligandı 1'in tüm vücuttaki dağılımını değerlendirmek için invaziv olmayan ve gerçek zamanlı bir yöntem geliştirmiştir. Bu tekniğin konvansiyonel immünohistokimyaya göre avantajları vardır ve immün kontrol noktası blokaj tedavisinden fayda görecek uygun hastaları belirleme etkinliğini artırır.
Özet
Programlanmış hücre ölüm proteini 1 (PD-1)/programlanmış ölüm ligandı 1'e (PD-L1) dayalı immün kontrol noktası blokaj tedavisinin geliştirilmesi, son yıllarda kanser tedavilerinde devrim yaratmıştır. Bununla birlikte, tümör hücrelerinde PD-L1'in heterojen ekspresyonu nedeniyle hastaların sadece bir kısmı PD-1 / PD-L1 inhibitörlerine yanıt verir. Bu heterojenlik, yaygın olarak kullanılan immünohistokimya (IHC) yaklaşımı ile tümör hücrelerinin kesin olarak saptanmasında bir zorluk teşkil etmektedir. Bu durum, tedavi etkinliğini artırmak için immün kontrol noktası blokaj tedavisinden fayda görecek hastaları sınıflandırmak için daha iyi yöntemler gerektirmektedir. Pozitron emisyon tomografisi (PET), tüm vücut PD-L1 ekspresyonunun noninvaziv bir şekilde gerçek zamanlı olarak görüntülenmesini sağlar. Bu nedenle, PET görüntüleme yoluyla tümörlerde PD-L1 dağılımını tespit etmek için radyoaktif işaretli izleyicilerin geliştirilmesine ihtiyaç vardır.
L-muadilleriyle karşılaştırıldığında, dekstrorotary (D)-peptitler, proteolitik direnç ve oldukça uzun metabolik yarılanma ömürleri gibi özelliklere sahiptir. Bu çalışma, tümör taşıyan farelerde bir D-dodekapeptid antagonisti (DPA) olan 68Ga etiketli PD-L1 hedefli D-peptidin PET görüntülemesine dayalı PD-L1 ekspresyonunu tespit etmek için yeni bir yöntem tasarladı. Sonuçlar, [68Ga] DPA'nın in vivo olarak PD-L1 aşırı eksprese eden tümörlere spesifik olarak bağlanabildiğini ve mükemmel görüntüleme yeteneğinin yanı sıra uygun stabilite gösterdiğini gösterdi, bu da [68Ga] DPA-PET'in tümörlerde PD-L1 durumunun değerlendirilmesi için umut verici bir yaklaşım olduğunu düşündürdü.
Giriş
İmmün kontrol noktası proteinlerinin keşfi, tümör tedavisinde bir atılımdı ve immün kontrol noktası blokaj tedavisiningeliştirilmesinde büyük ilerlemelere yol açtı 1. Programlanmış hücre ölüm proteini 1 (PD-1) ve programlanmış ölüm ligandı 1 (PD-L1), Gıda ve İlaç Dairesi (FDA) tarafından onaylanan çeşitli antikorlara sahip potansiyel ilaç hedefleridir. PD-1, CD4+, CD8+ T hücreleri ve düzenleyici T hücreleri gibi tümöre sızan bağışıklık hücreleri tarafından eksprese edilir. PD-L1, çeşitli tümör hücrelerinde aşırı eksprese edilen PD-1 ligandlarından biridir 2,3. PD-1 ve PD-L1 arasındaki etkileşim, PD-1'i inaktive eder, böylece antitümör bağışıklık tepkisinibaskılar 4. Bu bulgular, PD-L1'in inhibisyonunun bağışıklık hücrelerinin öldürme etkisini artırabileceğini ve tümör hücrelerini ortadan kaldırabileceğini düşündürmektedir5. Şu anda, kromojenik immünohistokimya (IHC), immün kontrol noktası tedavisineyanıt verme olasılığı en yüksek olan hastaları belirlemek için en yaygın kullanılan yaklaşımdır 6,7. Bununla birlikte, tümör hücrelerinde PD-L1'in heterojen ekspresyonu nedeniyle, biyopsilerden elde edilen IHC sonuçları, hastalarda PD-L1 ekspresyonu hakkında doğru bilgi verememektedir8. Önceki çalışmalar, hastaların sadece %20-40'ının immün kontrol noktası blokaj tedavisindenuzun vadeli faydalar sağladığını bildirmiştir 1,9,10. Bu nedenle, bu bağışıklık kontrol noktası proteinlerinin heterojen ekspresyonunun neden olduğu yanlış negatif sonuçları atlatmak için yeni bir yöntem geliştirmeye acil bir ihtiyaç vardır.
Pozitron emisyon tomografisi (PET) gibi moleküler görüntüleme teknolojisi, tüm vücudun invaziv olmayan bir şekilde gerçek zamanlı olarak görselleştirilmesini sağlar ve böylece geleneksel IHC yönteminden daha iyi performans gösterebilir 11,12,13. Radyoaktif işaretli antikorlar, peptitler ve küçük moleküller, kanser hastalarında PD-L1 ekspresyonunu izlemek için umut verici izleyicilerdir 14,15,16,17,18,19,20,21,22,23,24,25. FDA, üç PD-L1 terapötik monoklonal antikoru onayladı: avelumab, atezolizumab ve durvalumab26. Bu antikorlara dayanan immüno-PET izleyicileri iyi belgelenmiştir 27,28,29,30,31,32. Erken faz klinik çalışmalar, elverişsiz farmakokinetik nedeniyle klinik uygulama için sınırlı değer ortaya koymuştur30. Antikorlarla karşılaştırıldığında, peptitler sağlıklı organlardan daha hızlı kan ve organ temizliği sergiler ve kimyasal olarak kolayca değiştirilebilir33. PD-1 / PD-L1 için yüksek afiniteye sahip çoklu peptitler bildirilmiştir2; WL12, PD-L134'e spesifik bağlanma gösteren rapor edilmiş bir peptittir. Radyoaktif işaretli izleyicilerin, [64Cu] WL12, [68Ga] WL12 ve [18F] FPyWL12'nin, tümörlerde PD-L1 ekspresyonunun yüksek kaliteli görüntülerinin toplanmasına izin veren yüksek in vivo spesifik tümör hedefleme yeteneği gösterdiği bildirilmiştir 26,35,36,37. Ayrıca, radyoaktif işaretli WL12'nin ilk insan içi değerlendirmesi, [68Ga] WL12'nin (NOTA ile şelatlanmış) klinik tümör görüntüleme için güvenli ve verimli bir potansiyele sahip olduğunu göstermiştir38. Yüksek hidrofobikliği ve sağlıklı karaciğerde yüksek alımı nedeniyle, WL12'nin klinik kullanımı sınırlıdır. PD-L1'e spesifik olarak bağlanan TPP1 ve SETSKSF gibi diğer radyoaktif işaretleme peptitleri de tüm vücut PD-L1 ekspresyonunugörselleştirmek için potansiyel stabilite ve özgüllük göstermiştir 39,40. Bununla birlikte, modifiye edilmemiş peptitler proteazlar tarafından kolayca parçalanır ve böbrek tarafından hızla metabolize edilir. Dekstrorotary(D)-peptitler, solak (L)-peptitlerin 41,42,43 zayıf stabilitesi nedeniyle etkili aracılar olarak yaygın olarak kullanılmaktadır. D-peptitler, proteolitik bozunmaya karşı aşırı dirençlidir ve oldukça uzun metabolik yarılanma ömürlerine sahiptir. L-muadilleriyle karşılaştırıldığında, D-peptitler çoğunlukla spesifik bağlanma yetenekleri gösterir 44,45,46.
Bu çalışma, tümör taşıyan bir fare modelinde 68Ga etiketli PD-L1 hedefli D-peptid, D-dodekapeptid antagonistinin (DPA) PET görüntülemesine dayanan PD-L1 ekspresyonunu tespit etmek için yeni bir yöntem tasarladı47. [68Ga] DPA'nın stabilitesi ilk olarak fosfat tamponlu salin (PBS) ve fare serumunda incelendi, daha sonra PD-L1 aşırı eksprese eden tümörlerde [68Ga] DPA'nın bağlanma afinitesi test edildi. Daha sonra, [68Ga] DPA'nın tümörlerde PD-L1 ekspresyonunu izlemek için ideal bir PET izleyici olup olmadığını doğrulamak için glioblastoma ksenogreft modellerinde PET görüntüleme yapıldı. PET görüntüleme ve DPA'nın kombinasyonu, PD-L1'in heterojen ekspresyonu ile ilişkili zorlukların üstesinden gelmek için yeni bir yaklaşım sağlamakla kalmaz, aynı zamanda D-peptit bazlı radyoizleyicilerin geliştirilmesinin temelini oluşturur.
Protokol
Hayvan deney prosedürleri, Nanjing Tıp Üniversitesi Hayvan Etik Komitesi veya Ulusal Kuantum Bilimi ve Teknolojisi Enstitüleri tarafından onaylandı. Fare deneyleri, Laboratuvar Hayvanlarının Bakımı ve Kullanımı Komitesi'nin kurumsal yönergelerine sıkı sıkıya bağlı olarak gerçekleştirildi.
1. Peptit sentezi
- HafifN2 köpürme altında 30 dakika boyunca 1 mL N-metil-2-pirolidon (NMP) içinde 100 mg 4-metilbenzhidrilamin (MBHA) reçinesini (0.37 mmol / g yükleme kapasitesi) şişirin.
- 1 mL NMP'de Fmoc korumalı amino asitler (5.0 eşdeğer), HCTU (4.9 eşdeğer) ve DIPEA'dan (10.0 eşdeğer) oluşan taze bir stok tamponu hazırlayın ve reçineye (100 mg) ekleyin. Bağlanma reaksiyonunun 1.5-2 saat devam etmesine izin verin.
- NMP'de %50 (hacim/hacim) morfolinden oluşan koruma giderme tamponu hazırlayın. Amin grubundaki Fmoc grubunu çıkarmak için reçineyi (100 mg) 2 x 30 dakika her yıkamada 1 mL koruma giderici tampon ile yıkayın. Reçineyi diklorometan (DCM; 1 mL) ile 1 dakika yıkayın, DCM'yi çıkarın ve reçineyi NMP (1 mL) ile 1 dakika daha tekrar yıkayın. Ardından, NMP'yi çıkarın ve reçineyi 1 dakika boyunca DCM ile tekrar yıkayın.
NOT: Tüm yıkama prosedürleri hafifN2 köpürme altında gerçekleştirilir. Yukarıdaki prosedürler son amino aside kadar tekrarlanır. - Peptitin üzerine 1,4,7,10-tetraazasiklododekan-1,4,7,10-tetraasetik asit (DOTA) eklemek için, DOTA'yı N- (3-dimetilaminopropil) -N-etilkarbodiimid hidroklorür (EDC · HCl) ve N-hidroksisüksinimid (NHS). DOTA/EDC'nin stok tamponunu inkübe edin· 3 saat boyunca dimetil sülfoksit (DMSO) içinde 1:1:1 molar oranda HCl/NHS, son DOTA konsantrasyonu 1 M'dir. Daha sonra, stok tamponunu (1 mL) reçineye (100 mg) ekleyin ve reaksiyonun hafifN2 köpürme ile 2 saat devam etmesine izin verin.
NOT: 1,4,7-triazasiklononan-1,4,7-triasetik asit (NOTA), 68Ga kompleksleşmesi için bir şelatör olarak da kullanılabilir. Aynı prosedürler NOTA bağlantısı için de kullanılabilir. - DCM kullanarak reçineyi üstten iyice durulayın ve aynı anda kalan reaksiyon çözeltisini çıkarmak için bir vakum uygulayın. Reçineyi DCM (1,5 mL) kullanarak 3x durulayın ve ardından reçineyi küçültmek için MeOH (1,5 mL) ile durulayın. Reçineyi gece boyunca nitrojen altında veya reçine kuruyana kadar en az 4 saat yüksek vakum altında koyun.
- Kurutulmuş DPA peptit içeren reçineyi vidalı kapaklı 2 mL'lik bir polipropilen kaba koyun. Uygun bölünme kokteylini (95/2.5/2.5 TFA/TIS/H2O hacim; 1 mL/100 mg reçine) ekleyin ve kabı bir vidalı kapak kullanarak sıkıca kapatın. Reaksiyonu, çeker ocaktaki bir orbital çalkalayıcıda 20-25 °C'de 2 saat boyunca hafifçe çalkalayın.
DİKKAT: Trifloroasetik asidi (TFA) son derece aşındırıcı yapısı nedeniyle koruyucu giysi giyerek çeker ocakta hazırlayın. - Çeker ocaktaki nitrojen altında buharlaştırarak TFA'nın çoğunu çıkarın. Dietil eter (~ 1.5 mL / 100 mg reçine) ekleyerek peptitleri çökeltin.
- Peptitleri ezmek için karışımı vorteksleyin ve oda sıcaklığında (10.000 × g, 5 dakika) santrifüjleyin. Çözücüyü dikkatlice kabın dışına dökün. 1.7-1.8 arasındaki adımları tekrarlayın.
- Kalıntıyı açık kapta 10 dakika havayla kurutun. Ürünleri çözmek için %50 (hacim/hacim) sulu asetonitril ekleyin ve 1-2 saniye vorteksleyin (1 mL/100 mg reçine).
- Karışımı filtreleyerek reçineyi çıkarın ve ardından reçineyi 0,2 mL %50 (hacim/hacim) sulu asetonitril kullanarak 2x yıkayın. Yüksek performanslı sıvı kromatografisi (HPLC) saflaştırması için filtratları karıştırın. Aşağıdaki HPLC koşullarını kullanın. Sütun: YMC-Triat-C18 (4,6 mm iç çap [id], 150 mm, 5 mm); çözücü gradyanı: çözücü A-deiyonize su; çözücü B-asetonitril (% 0.1 TFA); akış süresi: 20 dakika, asetonitril ile% 10 ila% 90; akış hızı: 1 mL/dak.
- Toplanan HPLC eluentlerini gece boyunca -80 °C'de dondurun ve liyofilize edin (-50 °C ve <1 pa). Radyo-etiketleme için, katı peptidi sodyum asetat tamponu (100 mM, pH 5.0) içinde stok tamponu olarak 1 mg/mL'lik bir nihai konsantrasyonda çözün.
2. 68Ga radyo etiketleme
NOT 68Ga, Nanjing First Hospital'da (Nanjing, Çin) 68Ge/68Ga jeneratör kullanılarak şirket içinde üretilmiştir.
- 5 μL stok tamponunu vidalı kapaklı 1,5 mL'lik bir polipropilen kaba pipetleyin. Kaba 200 MBq [68Ga]GaCl3 (400 μL) ekleyin.
- Karışımı 5 saniye boyunca vorteksleyin. pH test şeritlerini kullanarak pH'ı ölçün. NaOH (0,1 M) ile pH'ı 4-4,5'e ayarlayın.
NOT: 68Ga ve DOTA arasındaki kompleksleşme için uygun bir pH kritik öneme sahiptir. - Çözeltiyi oda sıcaklığında 5-10 dakika inkübe edin. Aşağıdaki koşullar altında radyo-işaretleme verim analizi için reaksiyon karışımını radyo-HPLC'ye tabi tutun: sütun: YMC-Triat-C18 (4.6 mm iç çap, 150 mm, 5 mm); çözücü gradyanı: çözücü A-deiyonize su; çözücü B-asetonitril (% 0.1 TFA); akış süresi: 20 dakika, asetonitril ile% 10 ila% 90; akış hızı: 1 mL/dak.
NOT: Radyo ince tabaka kromatografisi (TLC), radyoetiketleme verimini incelemek için alternatif bir yaklaşım olarak kullanılabilir. Önerilen TLC elüsyon tamponu 0.1 MNa3C6H5O7, pH 4'tür.
3. İzleyici stabilite testi
- PBS'de izleyici stabilite testi
- PBS'ye (990 μL) [68Ga] DPA (10 μL, 3.7 MBq, NaOAc cinsinden) ekleyin. Hafif çalkalama ile 37 °C'de 1, 2 ve 4 saat inkübe edin.
- Her zaman noktasında 200 μL çözelti toplayın. Analiz için radyo-HPLC'ye enjekte edin.
- Fare serumunda izleyici stabilitesi
- Fare serumuna (90 μL, taze hazırlanmış) [68Ga] DPA (10 μL, ~ 3.7 MBq, NaOAc'de) ekleyin. Hafif çalkalama ile 37 °C'de 1, 2 ve 4 saat inkübe edin.
- Her zaman noktasında 20 μL çözelti toplayın. MeCN ve su (100 μL, 1:1, v/v) ekleyin.
- Karışımı 10 dakika (5.000 × g, 25 °C) santrifüjleyin. Süpernatanı radyo-HPLC kullanarak analiz edin.
4. PD-L1 ekspresyonunun akış sitometrisi ile analizi
- RPMI-1640 ortamını %10 (hacim/hacim) fetal sığır serumu ve %1 penisilin-streptomisin (hacim/hacim) ile destekleyerek kültür ortamını hazırlayın. U87MG hücrelerini kültür ortamında yeniden süspanse edin ve 105 hücre / kuyucuk yoğunluğunda 12 oyuklu plakalarda tohumlayın. Hücreleri bir inkübatöre (% 5 CO2, 37 ° C) yerleştirin ve rahatsız etmeden en az 24 saat kültürleyin.
- Hücreleri 0.5 mL PBS ile yıkayın ve 250 μL tripsin-EDTA (% 0.25) ekleyin. Hücreleri 2 dakika boyunca inkübatöre (% 5 CO2, 37 ° C) geri yerleştirin.
- Hücre ayrışmasını durdurmak için 1 mL kültür ortamı ekleyin. Hücrelere orta madde ekleyerek bulaşıklardan ayırmak için yukarı ve aşağı pipetleyerek 1,5 mL'lik tüplerde toplayın. Hücreleri 5 dakika (100 × g) santrifüjleyin.
- Süpernatanı çıkarın ve hücreleri 1 mL PBS'de yeniden süspanse edin. Hücreleri 5 dakika (100 × g) santrifüjleyin. Bu adımı bir kez daha tekrarlayın.
- Floresein izotiyosiyanat (FITC) ile konjuge PD-L1 antikorunu% 3 sığır serum albümini (BSA) ile 20 nmol / L'ye seyreltin.
- Hücreleri 5 dakika (100 × g) santrifüjleyin, ardından iki kez soğuk PBS ile yıkayın. Bir akış sitometresi ve analiz yazılımı kullanarak PD-L1 pozitif hücreleri analiz edin.
5. İmmünositokimya
- U87MG hücrelerini, oyuk başına 2.5 × 105 hücre yoğunluğunda cam tabanlı hücre kültürü kaplarına (35 mm) tohumlayın. % 60 birleşmeye ulaşıldığında, kültür ortamını aspire edin ve 1 mL PBS ekleyin. Hafifçe birkaç kez sallayın ve aspire edin. Yıkama adımını 3x gerçekleştirin.
- Bulaşıklara 500 μL% 4 paraformaldehit ekleyin. Hücreleri oda sıcaklığına yerleştirin ve 30 dakika sabitleyin.
- Hücreleri PBS ile 3 kez yıkayın. 1 mL %3 BSA (PBS cinsinden ağırlık/hacim) ekleyin ve sabit hücreleri oda sıcaklığında 2 saat bloke edin.
- % 3 BSA'yı çıkarın ve hücreleri gece boyunca 4 ° C'de birincil anti-PD-L1 antikoru (mAb, 1: 100,% 3 BSA ile seyreltilmiş) ile doğrudan inkübe edin.
NOT: Hücreleri BSA ile bloke ettikten sonra PBS ile yıkamayın. - Hücreleri %3 BSA tamponu ile 3x yıkayın. Hücreleri 1 saat boyunca FITC konjuge anti-insan IgG Fc sekonder antikoru (1:500, PBS'de seyreltilmiş) ile inkübe edin.
- Hücreleri PBS ile 3 kez yıkayın. Hücrelere 0,5 mL DAPI (1 μg/mL) ekleyin ve oda sıcaklığında 1 saat inkübe edin. Lekeli hücreleri PBS ile 3x yıkayın ve konfokal floresan mikroskobu kullanarak gözlemleyin.
6. Hücresel alım ve inhibisyon deneyi
- Hücresel alım deneyi
- U87MG hücrelerini% 80 birleşmeye ulaşılana kadar 12 oyuklu plakalarda kültürleyin. Ortamı çıkarın ve hücreleri 0.5 mL PBS ile yıkayın.
- [68Ga] DPA'yı taze ortamda 74 KBq / mL'lik bir konsantrasyona seyreltin. Her oyuğa 0.5 mL seyreltilmiş [68Ga] DPA tamponu ekleyin.
- Hücreleri farklı sürelerde (10, 30, 40 ve 120 dakika) 37 ° C'de [68Ga] DPA ile inkübe edin. Bir pipet kullanarak ortamı aspire edin. Hücreleri PBS (0.5 mL) ile üç kez yıkayın.
- Hücreleri parçalamak için NaOH çözeltisi (0.5 M, oyuk başına 300 μL) ekleyin. 30 saniye sonra, viskoz hücre lizatlarını 1.5 mL'lik tüplerde toplayın.
- Plakayı iki kez 0.4 mL PBS ile yıkayın. Yıkama solüsyonunu yukarıdaki 1,5 mL'lik tüpte toplayın.
- Otomatik gama sayacının yerleşik bilgisayarını başlatın; Tüpleri yerleşik rafa koyun. Tüm numuneleri konveyöre yükledikten sonra BAŞLAT düğmesine basın. Sonuçlar dahili yazılımda hesaplanır. Okuma, her bir tüpün dakika başına bozunma ile ilişkili sayımlarını (CPM) kaydeder.
- Rekabetçi bağlayıcı test
- U87MG hücrelerini% 80 birleşmeye ulaşılana kadar 12 oyuklu plakalarda kültürleyin. Ortamı çıkarın ve hücreleri 0.5 mL PBS ile yıkayın.
- [68Ga] DPA'yı taze ortamda 74 KBq / mL konsantrasyona seyreltin. 10 mM konsantrasyon (400 μL) elde etmek için uygun miktarda BMS202 bileşiğini% 10 DMSO içinde çözün.
- 100 μM'lik bir konsantrasyon elde etmek için 4 μL 10 mM BMS202'yi 396 μL PBS içinde seyreltin. Çeşitli BMS202 konsantrasyonları (1 μM, 10 nM, 100 pM ve 1 pM) elde etmek için bu adımı tekrarlayın.
- Her oyuğa 0.5 mL seyreltilmiş [68Ga] DPA tamponu ekleyin (kuyucuk başına 0.37 MBq). Her kuyucuğa 5 μL BMS202 çözeltisi ekleyin (her konsantrasyon için üç kuyu). Hücreleri bir hücre inkübatöründe 37 ° C'de 120 dakika inkübe edin.
- Bir pipet kullanarak ortamı aspire edin. Hücreleri 3 x 0.5 mL PBS ile yıkayın.
- Hücreleri parçalamak için NaOH çözeltisini (0.5 M, oyuk başına 300 μL) ekleyin. 30 saniye sonra, viskoz hücre lizatlarını 1.5 mL'lik tüplere toplayın. Plakayı 2 x 0,4 mL PBS ile yıkayın.
- Yıkama solüsyonunu yukarıdaki 1,5 mL'lik tüpte toplayın. Tüpleri otomatik gama sayacının yerleşik rafına yerleştirin.
- Adım 6.1.6 ile aynı prosedürleri izleyin.
7. PET görüntüleme
NOT: 159 cm yatay görüş alanı ve 0.796 cm eksenel görüş alanı ile 10 mm aralıklı (merkezden merkeze) 12.7 enine eksenel kesit sağlayan bir mikro PET tarayıcı kullanarak küçük hayvan PET görüntülemesi gerçekleştirin. Liste modunda toplanan tüm veriler üç boyutlu sinogramlar halinde düzenlenir. Fourier daha sonra iki boyutlu sinogramlara yeniden birleştirilir (çerçeve × dk: 4 × 1, 8 × 2, 8 × 5).
- Bu çalışmada erkek, 5-8 haftalık BALB / C çıplak fareler kullanın. 4.1-4.4 adımlarını izleyerek U87MG hücrelerini toplayın ve hücreleri 0.5 mL'lik bir şırıngaya aspire edin. Hücreleri deri altından farelere enjekte edin (tümör başına 1 × 106 hücre, fare başına iki tümör). Enjeksiyondan sonra tümör hacmi 100-300 mm olana kadar tümör büyümesini izleyin3.
- Fareleri %1-2 (h/h) izofluran (1 mL/dak) kullanarak uyuşturun. Isıtma cihazını açın ve PET'in hayvan yatağını 37 °C'de tutun.
- Anestezi uygulanmış fareleri PET makinesinin hayvan yatağında doğru pozisyona getirin. Kuruluğu önlemek için her iki göze de oftalmik merhem sürün.
DİKKAT: Tarama sırasında ölümü önlemek için fareleri yüzüstü pozisyonda tutun. Tüm görüntüleme işlemi sırasında, önceden takılmış bir tüp kullanarak burun yoluyla izofluran akışını (1.0 mL / dak) uygulayın. - Hayvan yatağı konumunu kontrol panelinden ayarlayın. İzleyicileri (10-17 MBq / 100-200 μL) önceden takılmış bir kuyruk ven kateterinden intravenöz olarak enjekte edin.
- Başvurulan yazılımı kullanarak bir ana bilgisayarda bir tarama iş akışı oluşturun (bkz. Malzeme Tablosu) Bir çalışma klasörü oluşturun ve edinme protokolünü üreticinin protokolüne göre ayarlayın. 3D liste modunda tüm farelerde dinamik taramalar (her fare için 60 dakika) gerçekleştirin.
- Üreticinin protokolünü takip eden bir histogram protokolü ve bir yeniden yapılandırma protokolü tanımlayın. Filtrelenmiş geri projeksiyon yoluyla PET dinamik görüntülerini (25-30 dakika ve 55-60 dakika) yeniden oluşturmak için 0,5 döngü/piksel Nyquist kesimli Hanning'in filtresini kullanın. Tüm fareler için maksimum yoğunluk projeksiyonu (MIP) görüntüleri oluşturun.
- Protokolleri bir iş akışında birleştirin ve iş akışını çalıştırın. Üreticinin protokolünü izleyerek yazılımı kullanarak ortaya çıkan üç boyutlu görüntüleri analiz edin.
NOT: İlgilendiğiniz hacimleri seçmek için simülasyon yazılımını kullanın. Radyoaktivite, enjeksiyon zamanına göre çürümeye göre düzeltilir ve toplam enjeksiyon dozunun yüzdesi / gram doku başına (% ID / g) olarak sunulur.
8. Ex vivo biyodağıtım
- Kuyruk damarı enjeksiyonu yoluyla U87MG taşıyan BALB/C çıplak farelere [68Ga] DPA (1.85 MBq/100 μL) uygulayın. Fareleri% 1 -% 2 (v / h) izofluran (1 mL / dak) kullanarak uyuşturun, daha sonra enjeksiyondan sonra 5, 30, 60 ve 120 dakika boyunca servikal çıkık yoluyla üç fareyi feda edin.
NOT: Bu prosedürü gösteren bireyler, bilinç kaybının hızla indüklenmesini sağlamak için servikal çıkıkla ilgili teknik beceriler konusunda eğitilmelidir. Bu, bu deneydeki ötenazi prosedürlerinin hepsinin insanca yapılmasını sağlayacaktır. - Ölüm onaylandıktan sonra, farelerin göğüs duvarını açın. Sonra kalbi açın. Kan almak için 1 mL'lik bir şırınga kullanın; şırıngadaki kanı gama sayacı için bir radyoimmünoassay (RIA) tüpüne (13 mm çapında) sıkın.
- Ana organları ve tümörleri eksize edin ve gama sayacı için RIA tüplerine (13 mm çapında) yerleştirin. Başlıca organlar arasında toplam kan, kalp, timus, karaciğer, dalak, kemik, mide, böbrekler, kas, bağırsak lenf nodu, ince bağırsak, pankreas, testis, beyin ve akciğerler bulunur. Tüm organları tartın.
- Bir otogama sayacı kullanarak toplanan organlardaki radyoaktiviteyi ölçün ve değerleri bozunarak düzeltin. Bir gram ıslak doku başına enjekte edilen dozun yüzdesini hesaplayın (% ID/g).
9. İmmünohistokimya
- Glioma dokularını toplayın ve PBS ile 3 kez yıkayın. Taze dokuları %4 paraformaldehite koyun ve gece boyunca 4 °C'de sabitleyin.
- Sabit dokuları parafine gömün ve 10 μm kalınlığa kadar bölümlere ayırın. Bölümleri bir inkübatöre (60 °C) yerleştirin ve 2 saat inkübe edin. Bölümleri her biri 10 dakika inkübe ederek mumdan arındırın ve nemlendirin: ksilen (iki kez), mutlak alkol, %95 alkol, %90 alkol, %80 alkol, %75 alkol.
- Bölümleri 0,01 M sodyum sitrat içine koyun ve 92-95 °C'ye ısıtın. Antijen alımını sağlamak için sıcaklığı 40 dakika koruyun.
- Bölümlere 200 μLH2O2çözeltisi (% 3) ekleyin ve endoperoksidazları oda sıcaklığında 10 dakika boyunca inaktive edin. Oda sıcaklığında 2 saat boyunca% 3 BSA ile muamele ederek spesifik olmayan bölgeleri bloke edin.
- Bölümleri primer anti-PD-L1 antikorunda (mAb, 1:100,% 3 BSA ile seyreltilmiş) gece boyunca 4 °C'de inkübe edin.
NOT: BSA ile bloke ettikten sonra PBS ile yıkamayın. - Bölümleri 3x PBS ile yıkayın. Bölümleri HRP etiketli keçi anti-tavşan ikincil antikoru (1:500, PBS ile seyreltilmiş) ile oda sıcaklığında 1 saat inkübe edin.
- Hücreleri PBS ile 3 kez yıkayın. Bölümlere 200 μL 3,3-diaminobenzidin (DAB) çalışma solüsyonu (çözelti A: çözelti B: çözelti C = 1:1:18) ekleyin ve karanlıkta 5 dakika inkübe edin.
- Bölümleri 3x PBS ile yıkayın. 500 μL hematoksilen çözeltisi (% 100) ekleyin ve oda sıcaklığında 5 dakika inkübe edin. Bölümleri 30 saniye suyla yıkayın. Bölümleri 30 saniye boyunca farklılaşma çözeltisine (%75 alkol: HCL = 99:1) koyun. Bölümleri 1 dakika su kullanarak yıkayın.
- %75 alkol, %80 alkol, %90 alkol, %95 alkol, mutlak alkol ve ksilen (her biri 10 dakika) ile sırayla inkübe ederek numuneleri kurutun. Tüm bölümleri nötr reçine kullanarak monte edin ve optik mikroskop altında gözlemleyin.
Sonuçlar
[68Ga]DPA radyoetiketleme ve kararlılık
Model peptit, DPA, etkili bir PD-L1 antagonistidir. DOTA-DPA, %>95 saflık ve %68 verim ile elde edilmiştir. DOTA-DPA'nın kütlesi deneysel olarak 1,073.3'te ([M+2H]2+) gözlemlenmiştir. 68Galyum, PET görüntüleme için peptitleri etiketlemek için uygun bir radyonüklid olarak kabul edilir ve bu nedenle bu çalışma için seçilmiştir. DPA'yı 68Ga (yarı ömür: 68 dakika) ile radyoetiketlemek için DOTA-PEG3-DPA sentezlendi (Şekil 1A). DOTA, 68Ga radyoetiketleme için bir şelatör olarak kullanıldı. DOTA ve DPA'yı doldurmak için bağlayıcı olarak PEG3 kullanıldı. [68Ga]-DOTA-PEG3-DPA (aşağıdaki metinde [68Ga]DPA olarak anılacaktır) yüksek radyokimyasal verim (%>95) ve radyokimyasal saflık (%>95) göstermiştir (Tablo 1). HPLC kullanılarak bir izleyici stabilite testi de yapıldı ve sonuçlar [68Ga] DPA'nın hem PBS hem de fare serumunda büyük stabiliteye sahip olduğunu gösterdi. 68Ga ayrışması veya peptit hidrolizi, 37 ° C'de 4 saatlik bir inkübasyondan sonra tespit edilmedi (Şekil 1B).
U87MG hücrelerinde PD-L1 ekspresyonu
Daha önceki bir çalışma, PD-L1 ekspresyonunun artmasının glioblastoma tümörlerinde kötü hasta sağkalımı ile ilişkili olduğunu göstermiştir, bu da PD-L1'in glioblastoma48'de dikkate değer bir prognostik biyobelirteç ve terapötik hedef olabileceğini göstermektedir. Bu nedenle, PD-L1 tümör görüntülemesi için PET/BT'de [68Ga] DPA'nın etkinliğini belirlemek için bir tümör modeli oluşturmak üzere bir insan glioblastoma hücre hattı olan U87MG kullanıldı. Akış sitometrisi sonuçları, U87MG hücrelerinin yaklaşık% 60'ının PD-L1 pozitif olduğunu göstermiştir (Şekil 2A). Ayrıca, immünofloresan boyama, U87MG hücrelerinde PD-L1'in güçlü ekspresyonunu doğruladı (Şekil 2B). Birlikte, bu veriler U87MG hücre hattının bu çalışma için uygun olduğunu gösterdi.
[68Ga] DPA'nın hücresel alımı ve özgüllüğü
U87MGhücreleri tarafından [68 Ga] DPA alımı zamana bağlı bir model sundu. Bir PD-L1 inhibitörü olan BMS202, bloke edici ajan olarak kullanıldığında, bağlanma kısmı ve [68Ga] DPA'nın alımı önemli ölçüde azalmıştır (Şekil 3A). Rekabetçi bir bağlanma testi, BMS202'nin U87MG hücrelerine bağlanma afinitesini (Ki) daha fazla inceledi. Rakip olarak [68Ga]DPA kullanıldığında BMS202 için tahmini bağlanma afinitesi 43.8 ± 8.6 nmol/L idi (Şekil 3B).
[68Ga]Tümör modellerinin DPA PET görüntülemesi
U87MGtümör taşıyan BALB / C çıplak farelerde [68 Ga] DPA'nın PET görüntülemesi yapıldı. [68Ga] DPA, U87MG tümörü 100 mm'yebüyüyene kadar intravenöz enjeksiyon yoluyla uygulandı 3. Tüm vücut PET görüntüleri, enjeksiyondan 30 ve 60 dakika sonra tümörde yüksek [68Ga] DPA birikimi olduğunu ve böbrek ve mesanede en yüksek birikimi gösterdi (Şekil 4A). [68Ga] DPA'nın PD-L1 pozitif tümörlerde spesifik olarak birikip birikmediğini doğrulamak için, PanNET hücre hattı Bon-1'i taşıyan başka bir fare modeli negatif kontrol olarak kullanıldı. Paralel bir deney, enjeksiyondan 60 dakika sonra Bon-1 tümörlerinde çok az [68Ga] DPA birikimi gösterdi (Şekil 4B).
Bu farklılığı açıklığa kavuşturmak için, tümör dokularında PD-L1 ekspresyonunu analiz etmek için immünohistokimyasal boyama yapıldı. Sonuçlar, U87MG hücrelerinin önemli ölçüde PD-L1 ekspresyonu gösterdiğini (Şekil 5A, C), ancak Bon-1 tümörünün (Şekil 5B, C) olmadığını ortaya koydu. Bu veriler PET sonuçlarıyla tutarlıydı. Bu nedenle, farklı tümör hücresi büyüme durumlarının farklı PD-L1 ekspresyonu (örn., doku nekrozu). Bunu doğrulamak için hematoksilen ve eozin (H&E) boyaması yapıldı. Beklendiği gibi, iki tümör dokusu arasında benzer bir hücre morfolojisi gözlendi (Şekil 5D).
U87MG tümörlerinde [68 Ga] DPA'nın ex vivo biyodağılımı
Ex vivo biyodağılım çalışması da U87MG taşıyan fareler kullanılarak gerçekleştirilmiştir (Tablo 2). Sonuçlar, kanda ve kalp, karaciğer, akciğer ve kas dahil olmak üzere analiz edilen organların çoğunda hızlı bir temizlenme gösterdi. Böbrek en yüksek miktarda radyoaktivite biriktirdi ve 5 dakikadan 120 dakikaya kadar% 0.12 ID / (g∙min) bir klirens oranı gösterdi. Tümör, tüm zaman noktalarında ikinci en yüksek izleyici alımını sergiledi. Ek olarak, enjeksiyondan 5 dakika ila 60 dakika sonra, tümör% 0.027 ID / (g∙min) gibi daha düşük bir izleyici klirens oranı sundu. Kan için klerens oranı %0.069 ID/(g∙min) iken, kas için klerens oranı %0.037 ID/(g∙min) idi.
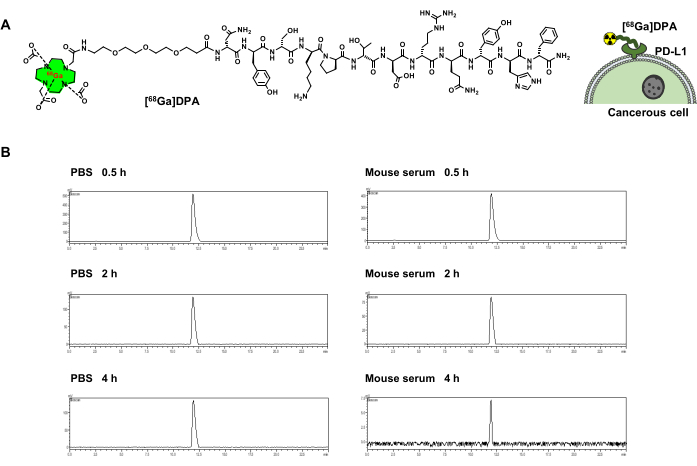
Şekil 1: [68Ga]DPA radyoetiketleme ve stabilite. (A) [68Ga] DPA'nın kimyasal yapısı ve PD-L1'i eksprese eden tümör hücrelerine bağlanmasının şematik gösterimi. (B) 0.5, 2 ve 4 saat boyunca PBS veya fare serumu ile inkübasyondan sonra [68Ga] DPA'nın radyoaktivitesini gösteren HPLC eğrileri. Bu rakam Hu ve ark.47'den değiştirilmiştir. Kısaltmalar: DPA = dodekapeptid antagonisti; PD-L1 = programlanmış ölüm ligandı 1; PBS = fosfat tamponlu salin; HPLC = yüksek performanslı sıvı kromatografisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
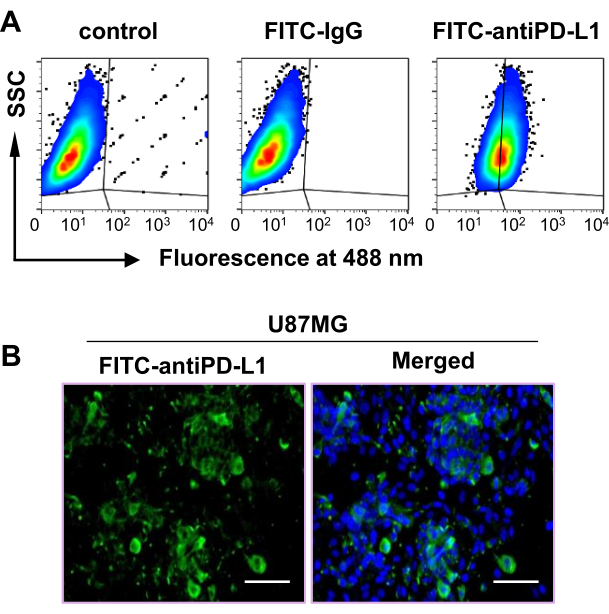
Şekil 2: U87MG hücre hattında PD-L1'in ekspresyonu. (A) U87MG hücre hattındaki PD-L1 ekspresyonu akış sitometrisi analizi ile ölçüldü. (B) U87MG hücrelerinde PD-L1 ekspresyonu, immünofloresan boyama testi ile ölçüldü. Ölçek çubuğu = 100 μm. Bu rakam Hu ve ark.47'den değiştirilmiştir. Kısaltmalar: PD-L1 = programlanmış ölüm ligandı 1; SSC = yan saçılma; FITC = floresein izotiyosiyanat. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
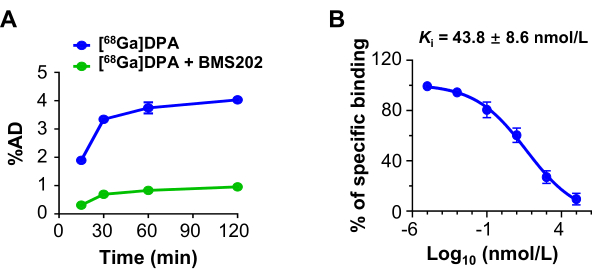
Şekil 3: [68Ga] DPA'nın hücresel alımı ve inhibisyonu. (A) Farklı süreler için [68Ga] DPA (0.74 MBq / mL) veya [68Ga] DPA (0.74 MBq / mL) + BMS202 (100 μmol / L) ile inkübe edildiğinde U87MG hücrelerinin alımı. (B) BMS202 ile inkübasyonu takiben [68Ga] DPA'nın (0.74 MBq / mL) U87MG hücrelerine rekabetçi bağlanması. Ki değeri panelde gösterilir. Bu rakam Hu ve ark.47'den değiştirilmiştir. Kısaltmalar: DPA = dodekapeptid antagonisti; % AD = uygulanan doz (bağlayıcı kısma göre). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: PD-L1 aşırı eksprese eden U87MG tümörlerinde [68Ga] DPA'nın PET görüntülemesi. (A, B) 30 dakika ve 60dakika boyunca intravenöz enjeksiyondan (~ 18.5 MBq) sonra U87MG taşıyan farelerde (A) ve Bon-1 taşıyan farelerde (negatif kontrol, B) [68 Ga] DPA'nın dağılımını gösteren PET-CT görüntüleri. Temsili maksimum yoğunluklu projeksiyon (MIP) (üst panel) ve enine PET-CT görüntüleri (alt panel) sunulmaktadır. Tümör pozisyonları beyaz kesikli dairelerle işaretlenmiştir. Bu rakam Hu ve ark.47. Kısaltmalar: DPA = dodekapeptid antagonisti; PD-L1 = programlanmış ölüm ligandı 1; PET-CT = pozitron emisyon tomografisi-bilgisayarlı tomografi; MIP = maksimum yoğunluk projeksiyonu; PI = enjeksiyon sonrası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: [68Ga] DPA ile tedavi edilen tümörlerin immünohistokimyasal analizi. (A,B) PD-L1'in (A) U87MG ve (B) Bon-1 tümörlerinde tüm kesit immünohistokimyasal görüntüleri. (C) A ve B'deki işaretli alanların büyütülmüş resimleri. (D) U87MG ve Bon-1 tümörünün H & E boyaması. Ölçek çubukları = 100 μm (C,D). Bu rakam Hu ve ark.47'den değiştirilmiştir. Kısaltmalar: DPA = dodekapeptid antagonisti; PD-L1 = programlanmış ölüm ligandı 1; H&E = hematoksilen ve eozin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| İzleyiciler | [68Ga] DPA |
| Radyokimyasal verim (%) | >95 |
| Molar aktivite (GBq μmol-1) | 37 ± 8 |
| Radyokimyasal saflıka (%) | >95 |
Tablo 1: [68Ga] DPA'nın radyo-etiketleme ve kalite kontrolü. Radyokimyasal verim, molar aktivite ve [68Ga] DPA'nın radyokimyasal saflığı. Veriler ortalama SD ± (n = 7) olarak temsil edilir. Bu tablo Hu ve ark.47'den değiştirilmiştir. Kısaltma: DPA = dodekapeptid antagonisti. bir[68Ga] DPA'nın radyokimyasal saflığı, optimize edilmiş bir koşul altında ters fazlı HPLC ile analiz edildi: 1) sütun: YMC-Triat-C18 (4.6 mm id, 150 mm, 5 mm); 2) çözücü gradyanı: çözücü A-deiyonize su; çözücü B-asetonitril (% 0.1 trifloroasetik asit); akış süresi: 20 dakika, asetonitril ile% 10 ila% 90; 1 mL/dk akış hızı.
| [68Ga] DPA | ||||||||
| 5 dk | 30 dk | 60 dk | 120 dk | |||||
| kan | 3.89 | ±0,43 | 1.55 | ±1.07 | 0.11 | ±0,02 | 0.05 | ±0,01 |
| kalp | 1.19 | ±0,39 | 0.52 | ±0,33 | 0.06 | ±0,02 | 0.05 | ±0,02 |
| karaciğer | 1.06 | ±0,26 | 0.59 | ±0,43 | 0.19 | ±0,02 | 0.16 | ±0,04 |
| dalak | 0.98 | ±0.14 | 0.68 | ±0,67 | 0.14 | ±0,06 | 0.09 | ±0,03 |
| akciğer | 1.64 | ±0,42 | 1.03 | ±0,9 | 0.13 | ±0,05 | 0.09 | ±0,02 |
| böbrek | 19.23 | ±1,95 | 16.13 | ±1.51 | 11.5 | ±0,44 | 5.2 | ±0,31 |
| mide | 1.54 | ±0.1 | 0.61 | ±0,35 | 0.08 | ±0,01 | 0.08 | ±0,03 |
| Bağırsak | 0.72 | ±0,27 | 0.47 | ±0,35 | 0.08 | ±0,02 | 0.06 | ±0,03 |
| pankreas | 1.88 | ±0,28 | 0.77 | ±0,75 | 0.16 | ±0,03 | 0.13 | ±0,03 |
| kas | 2.21 | ±0,27 | 0.71 | ±0,37 | 0.18 | ±0,02 | 0.14 | ±0,04 |
| kemik | 2.18 | ±0.11 | 0.85 | ±0,51 | 0.26 | ±0,09 | 0.14 | ±0,06 |
| beyin | 0.19 | ±0,04 | 0.11 | ±0,08 | 0.03 | ±0,01 | 0.02 | ±0,01 |
| tümör | 4.5 | ±0,32 | 3.77 | ±0,27 | 2.99 | ±0,03 | 0.89 | ±0.19 |
| yağ | 2.09 | ±0,49 | 0.81 | ±0.12 | 0.27 | ±0,07 | 0.1 | ±0,07 |
Tablo 2: Farklı sürelerde uygulamadan sonra U87MG tümör taşıyan farelerde [68Ga] DPA'nın biyolojik dağılımı (zaman noktası başına n = 3). Bu tablo Hu ve ark.47'den değiştirilmiştir. Kısaltma: DPA = dodekapeptid antagonisti.
Tartışmalar
Bu yöntemde açıklanan kritik adımlar, 68Ga'nın DPA'ya etkili bir şekilde etiketlenmesini ve tümördeki DPA'nın farmakodinamik paternine mükemmel şekilde uyması gereken PET görüntüleme için uygun bir zaman penceresinin seçilmesini içerir.
IHC'nin aksine, PET görüntüleme, tüm vücut PD-L1 ekspresyonunun noninvaziv bir şekilde gerçek zamanlı olarak saptanmasını sağlayarak heterojen bir tümördeki her pozitif alanın görselleştirilmesine olanak tanır 6,7. Peptitler, antikorların ve küçük moleküllerin dezavantajlarından kaçınmak için ligand olarak seçildi. Büyük moleküler ağırlığa sahip antikorlar genellikle uzun dolaşımdaki yarı ömre sahiptir, bu da sağlıklı organlar için daha yüksek toksisiteye neden olur. Küçük moleküllerin temizlenmesi genellikle gerekli tümör retansiyonunu elde etmek için çok hızlıdır. Peptitlerin moleküler ağırlığı, antikorlar ve küçük moleküller arasında değişir. Bu, peptit bazlı radyoizleyicilerin hem uzun süreli tümör retansiyonu hem de minimum toksisite ile iyi doku penetrasyonu elde etmesini sağlar 13,49,50,51,52,53. Daha da önemlisi, yaygın olarak bildirilen L-peptitlerden ziyade D-peptid DPA'nın faydası, [68Ga] DPA'ya oldukça uzun bir metabolik yarı ömür sağlar. Ayrıca, DPA in vivo pozitif yüklü ve hidrofiliktir ve bu nedenle yüksek çözünürlüğe sahiptir ve kanda spesifik olmayan hedeflemeyi önleyerek yüksek görüntüleme kalitesine sahip PET görüntülerinin oluşturulmasını kolaylaştırır.
Özellikle, başarılı 68Ga radyo-etiketleme, belirli bir pH gerektirir ve Cu (II) ve Fe (III) katyonları gibi geçiş metali iyonlarından parazit oluşturmaz. Bazı durumlarda, Cu2 + kontaminasyonu düşük radyokimyasal verime yol açar. Bu nedenle, tüm kapların ve pipet uçlarının kontamine olmadığından emin olmak çok önemlidir. Ayrıca bu yöntemde tümör aşılaması için U87MG kullanılmıştır. U87MG ksenogreftlerinde PD-L1 ekspresyonu önceki çalışmalarda doğrulanmış olsa da, ekspresyonu bireysel hayvanlar arasında farklılık gösterir. Bu nedenle, U87MG tümörlerinde izleyicinin mutlak alımı, bireysel fareler arasında değişmiştir. Tümörlerde etkin izleyici alımını sağlamak için, PET taraması için uygun tümör boyutuna (500 mm3 < hacmi < 100 mm3) sahip hayvanlar seçilmelidir.
[68Ga] DPA'nın sınırlamalarından biri, DPA'nın PD-L1'e bağlanma afinitesinin, WL12 gibi diğer birkaç PD-L1 hedefleme peptidine kıyasla nispeten düşük olmasıdır, bu da onu nispeten düşük PD-L1 ekspresyonu26,47 olan tümörler için uygun hale getirmez. D-peptidin daha fazla modifikasyonu, spesifik bağlanma kapasitesini artıracaktır. Ek olarak, [68Ga] DPA'nın görüntüleme etkisini arttırmak için, enjeksiyon stratejisinin formülasyonu, örneğin, spesifik olmayan bağlanma bölgelerini 54,55,56 bloke etmek için [68Ga] DPA'dan önce etiketlenmemiş DPA'nın eşzamanlı olarak enjekte edilmesiyle optimize edilebilir.
Sonuç olarak, bu çalışma, radyoizleyici olarak [68Ga] DPA kullanarak canlı hayvanların tüm vücudunda PD-L1 dağılımını izlemek için invaziv olmayan ve gerçek zamanlı bir yöntem geliştirmiştir. Sonuçlar, [68Ga] DPA'nın nispeten yüksek, in vivo spesifik bağlanma afinitesini, uygun stabilitesini ve mükemmel görüntüleme kapasitesini ortaya çıkardı, bu da [68Ga] DPA-PET'in PD-L1 aşırı eksprese eden tümörleri görselleştirmek için umut verici bir yaklaşım olduğunu düşündürdü. Ayrıca, bu teknik, DPA'yı 177Lu ve 225Ac gibi diğer radyonüklidlerle etiketleyerek PD-L1 pozitif tümörlerin tedavisine de uygulanabilir. Bu nedenle, DPA radyo-etiketleme tekniği sadece IHC'ye bağlı tanı sınırlamasının üstesinden gelmekle kalmaz, aynı zamanda tedavi için yeni bir seçenek sunar.
Açıklamalar
Çatışan çıkarlar beyan edilmez.
Teşekkürler
Bu çalışma, Çin Tıp Bilimleri Akademisi'nin kar amacı gütmeyen Merkezi Araştırma Enstitüsü Fonu (no. 2022-RC350-04) ve CAMS Tıp Bilimleri İnovasyon Fonu (no. 2021-I2M-1-026, 2022-I2M-1-026-1, 02120101, 02130101 ve 2022-I2M-2-002) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid (DOTA) | Merck | 60239-18-1 | 68Ga chelation |
| 3,3-diaminobenzidine (DAB) Kit | Sigma-Aldrich | D7304-1SET | Immunohistochemistry |
| anti-PD-L1 monoclonal antibody | Wuhan Proteintech | 17952-1-ap | Immunohistochemistry: primary antibody |
| BMS202 | Selleck | 1675203-84-5 | Competitive binding assay: inhibitor |
| BSA | Merck | V900933 | Immunofluorescent : blocking |
| DAPI | Merck | D9542 | Immunofluorescent: staining of nucleus |
| Dichloromethane (DCM) | Merck | 34856 | Solvent |
| DIPEA | Merck | 3439 | Peptide coupling |
| EDC·HCl | Merck | E6383 | Activation of DOTA |
| FBS | Gibco | 10099 | Cell culture: supplement |
| FITC-conjugated anti-human IgG Fc Antibody | Biolegend | 409310 | Immunofluorescent: secondary antibody |
| FITC-conjugated anti PD-L1 antibody | Biolegend | 393606 | Flow cytometry: direct antibody |
| HCTU | Energy Chemical | E070004-25g | Peptide coupling |
| HRP labeled goat anti-rabbit antibody | Servicebio | GB23303 | Immunohistochemistry: secondary antibody |
| Hydroxysuccinimide (NHS) | Merck | 130672 | Activation of DOTA |
| MeCN | Merck | PHR1551 | Solvent |
| Morpholine | Merck | 8.06127 | Fmoc- deprotection |
| NMP | Merck | 8.06072 | Solevent |
| Paraformaldehyde | Merck | 30525-89-4 | Fixation of tissues |
| PBS | Gibco | 10010023 | Cell culture: buffer |
| Penicillin-streptomycin | Gibco | 10378016 | Cell culture: supplement |
| RIA tube | PolyLab | P10301A | As tissue sample container |
| RPMI-1640 medium | Gibco | 11875093 | Cell culture: basic medium |
| Sodium acetate | Merck | 1.06264 | Salt for buffer |
| Trypsin-EDTA | Gibco | 25200056 | Cell culture: dissociation agent |
| U87MG cell line | Procell Life Science & Technology Co | CL-0238 | Cell model |
| Equipment | |||
| 68Ge/68Ga generator | Isotope Technologies Munich, ITM | Not applicable | Generation of [68Ga] |
| Autogamma counter | Perkin Elmer | Wizard2 | Detection of radioactivity |
| Confocal fluorescent microscopy | Keyence | Observation of immunofluorescent results | |
| Flow cytometer | Becton Dickinson, BD | LSRII | Monitoring the PD-L1 positive cells |
| High-performance liquid chromatography (HPLC) | SHIMAZU | LC-20AT | Purification of DPA peptide |
| PET scanner | Siemens Medical Solutions | Inveon MultiModality System | PET imaging |
| Optical microscopy | Nikon | Eclipse E100 | Observation of immunohistochemistry results |
| Solid phase peptide synthesizer | Promega Vac-Man Laboratory Vacuum Manifold | LOT#11101 | Synthesis of DPA-DOTA peptide |
| Software | |||
| ASIPro | Siemens Medical Solutions | Not applicable | Analysis of PET-CT results |
| FlowJo | Becton Dickinson, BD | FlowJo 7.6.1 | Analysis of the flow cytometer results |
| Inveon Acquisition Workplace (IAW) | Siemens Medical Solutions | Not applicable | Management of PET mechine |
| Prism | Graphpad | Prism 8.0 | Analysis of the data |
Referanslar
- Doroshow, D. B., et al. PD-L1 as a biomarker of response to immune-checkpoint inhibitors. Natire Reviews Clinical Oncology. 18 (6), 345-362 (2021).
- Krutzek, F., Kopka, K., Stadlbauer, S. Development of radiotracers for imaging of the PD-1/PD-L1 axis. Pharmaceuticals. 15 (6), 747(2022).
- Topalian, S. L., Drake, C. G., Pardoll, D. M. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell. 27 (4), 450-461 (2015).
- Pardoll, D. M. The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer. 12 (4), 252-264 (2012).
- Xiao, Z., et al. PEIGel: A biocompatible and injectable scaffold with innate immune adjuvanticity for synergized local immunotherapy. Materials Today Bio. 15, 100297(2022).
- Teng, M. W. L., Ngiow, S. F., Ribas, A., Smyth, M. J. Classifying cancers based on T-cell infiltration and PD-L1. Cancer Research. 75 (11), 2139-2145 (2015).
- Dolled-Filhart, M., et al. Development of a companion diagnostic for pembrolizumab in non-small cell lung cancer using immunohistochemistry for programmed death ligand-1. Archives of Pathology & Laboratory Medicine. 140 (11), 1243-1249 (2016).
- Meng, X. J., Huang, Z. Q., Teng, F. F., Xing, L. G., Yu, J. M. Predictive biomarkers in PD-1/PD-L1 checkpoint blockade immunotherapy. Cancer Treatment Reviews. 41 (10), 868-876 (2015).
- Hakozaki, T., Hosomi, Y., Kitadai, R., Kitagawa, S., Okuma, Y. Efficacy of immune checkpoint inhibitor monotherapy for patients with massive non-small-cell lung cancer. Journal of Cancer Research and Clinical Oncology. 146 (11), 2957-2966 (2020).
- Haslam, A., Prasad, V. Estimation of the percentage of US patients with cancer who are eligible for and respond to checkpoint inhibitor immunotherapy drugs. Jama Network Open. 2 (5), 192535(2019).
- Willmann, J. K., van Bruggen, N., Dinkelborg, L. M., Gambhir, S. S. Molecular imaging in drug development. Nature Reviews Drug Discovery. 7 (7), 591-607 (2008).
- Zhang, L., et al. Recent developments on PET radiotracers for TSPO and their applications in neuroimaging. Acta Pharmaceutica Sinica B. 11 (2), 373-393 (2021).
- Sun, J., et al. Imaging-guided targeted radionuclide tumor therapy: From concept to clinical translation. Advanced Drug Delivery Reviews. 190, 114538(2022).
- Xu, M., et al. Preclinical study of a fully human Anti-PD-L1 antibody as a theranostic agent for cancer immunotherapy. Molecular Pharmaceutics. 15 (10), 4426-4433 (2018).
- Niemeijer, A. N., et al. Whole body PD-1 and PD-L1 positron emission tomography in patients with non-small-cell lung cancer. Nature Communications. 9 (1), 4664(2018).
- Mayer, A. T., et al. Practical immuno-PET radiotracer design considerations for human immune checkpoint imaging. Journal of Nuclear Medicine. 58 (4), 538-546 (2017).
- Lv, G., et al. PET Imaging of tumor PD-L1 expression with a highly specific nonblocking single-domain antibody. Journal of Nuclear Medicine. 61 (1), 117-122 (2020).
- Li, D., et al. Immuno-PET imaging of 89Zr labeled anti-PD-L1 domain antibody. Molecular Pharmaceutics. 15 (4), 1674-1681 (2018).
- Lesniak, W. G., et al. PD-L1 detection in tumors using [(64)Cu]Atezolizumab with PET. Bioconjugate Chemistry. 27 (64), 2103-2110 (2016).
- Kristensen, L. K., et al. CD4(+) and CD8a(+) PET imaging predicts response to novel PD-1 checkpoint inhibitor: studies of Sym021 in syngeneic mouse cancer models. Theranostics. 9 (26), 8221-8238 (2019).
- Christensen, C., Kristensen, L. K., Alfsen, M. Z., Nielsen, C. H., Kjaer, A. Quantitative PET imaging of PD-L1 expression in xenograft and syngeneic tumour models using a site-specifically labelled PD-L1 antibody. European Journal of Nuclear Medicine and Molecular Imaging. 47 (5), 1302-1313 (2020).
- Bensch, F., et al. 89Zr-atezolizumab imaging as a non-invasive approach to assess clinical response to PD-L1 blockade in cancer. Nature Medicine. 24 (12), 1852-1858 (2018).
- Gonzalez Trotter, D. E., et al. In vivo imaging of the programmed death ligand 1 by 18F PET. Journal of Nuclear Medicine. 58 (11), 1852-1857 (2017).
- Lv, G., et al. Promising potential of a 18F-labelled small-molecular radiotracer to evaluate PD-L1 expression in tumors by PET imaging. Bioorganic Chemistry. 115, 105294(2021).
- Miao, Y., et al. One-step radiosynthesis and initial evaluation of a small molecule PET tracer for PD-L1 imaging. Bioorganic & Medicinal Chemical Letters. 30 (24), 127572(2020).
- Kumar, D., et al. Peptide-based PET quantifies target engagement of PD-L1 therapeutics. The Journal of Clinical Investigation. 129 (2), 616-630 (2019).
- Powles, T., et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature. 515 (7528), 558-562 (2014).
- Herbst, R. S., et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature. 515 (7528), 563-567 (2014).
- Marciscano, A. E., Gulley, J. L. Avelumab demonstrates promise in advanced NSCLC. Oncotarget. 8 (61), 102767-102768 (2017).
- Vaddepally, R. K., Kharel, P., Pandey, R., Garje, R., Chandra, A. B. Review of indications of FDA-approved immune checkpoint inhibitors per NCCN guidelines with the level of evidence. Cancers. 12 (3), 738(2020).
- Antonia, S. J., et al. Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. The New England Journal of Medicine. 377 (20), 1919-1929 (2017).
- Wang, D. Y., et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis. JAMA Oncology. 4 (12), 1721-1728 (2018).
- Sgouros, G., Bodei, L., McDevitt, M. R., Nedrow, J. R. Radiopharmaceutical therapy in cancer: clinical advances and challenges. Nature Reviews Drug Discovery. 19 (9), 589-608 (2020).
- (US) M. M. M, et al. Macrocyclic inhibitors of the pd-1/pd-l1 and cd80(b7-1)/pd-l1 protein/protein interactions. United States patent. , US-2017260237-A1 (2014).
- Chatterjee, S., et al. Rapid PD-L1 detection in tumors with PET using a highly specific peptide. Biochemical and Biophysical Research Communications. 483 (1), 258-263 (2017).
- De Silva, R. A., et al. Peptide-based 68Ga-PET radiotracer for imaging PD-L1 expression in cancer. Molecular Pharmaceutics. 15 (9), 3946-3952 (2018).
- Lesniak, W. G., et al. Development of [18F]FPy-WL12 as a PD-L1 specific PET imaging peptide. Molecular Imaging. 18, 1536012119852189(2019).
- Zhou, X., et al. First-in-humans evaluation of a PD-L1-binding peptide PET radiotracer in non-small cell lung cancer patients. Journal of Nuclear Medicine. 63 (4), 536-542 (2022).
- Hu, K., et al. Developing native peptide-based radiotracers for PD-L1 PET imaging and improving imaging contrast by pegylation. Chemical Communications. 55 (29), 4162-4165 (2019).
- Liu, H., et al. A novel small cyclic peptide-based 68Ga-Radiotracer for positron emission tomography imaging of PD-L1 expression in tumors. Molecular Pharmaceutics. 19 (1), 138-147 (2022).
- Rabideau, A. E., Pentelute, B. L. A D-amino acid at the N-terminus of a protein abrogates its degradation by the N-end rule pathway. ACS Central Science. 1 (8), 423-430 (2015).
- Uppalapati, M., et al. A potent D-protein antagonist of VEGF-A is nonimmunogenic, metabolically stable, and longer-circulating in vivo. ACS Chemical Biology. 11 (4), 1058-1065 (2016).
- Garton, M., et al. Method to generate highly stable D-amino acid analogs of bioactive helical peptides using a mirror image of the entire PDB. Proceedings of the National Academy of Sciences. 115 (7), 1505-1510 (2018).
- Jia, F. J., et al. D-amino acid substitution enhances the stability of antimicrobial peptide polybia-CP. Acta Biochimica et Biophysica Sinica. 49 (10), 916-925 (2017).
- Carmona, G., Rodriguez, A., Juarez, D., Corzo, G., Villegas, E. Improved protease stability of the antimicrobial peptide Pin2 substituted with D-amino acids. Protein Journal. 32 (6), 456-466 (2013).
- Feng, Z., Xu, B. Inspiration from the mirror: D-amino acid containing peptides in biomedical approaches. Biomolecular Concepts. 7 (3), 179-187 (2016).
- Hu, K., et al. Whole-body PET tracking of a d-dodecapeptide and its radiotheranostic potential for PD-L1 overexpressing tumors. Acta Pharmaceutica Sinica. B. 12 (3), 1363-1376 (2022).
- Qiu, X. Y., et al. PD-L1 confers glioblastoma multiforme malignancy via Ras binding and Ras/Erk/EMT activation. Biochimica Et Biophysica Acta. Molecular Basis of Disease. 1864, 1754-1769 (2018).
- Hu, K., et al. Development of a stable peptide-based PET tracer for detecting CD133-expressing cancer cells. ACS Omega. 7 (1), 334-341 (2021).
- Jin, Z. -H., et al. Radiotheranostic agent 64Cu-cyclam-RAFT-c(-RGDfK-)4 for management of peritoneal metastasis in ovarian cancer. Clinical Cancer Research. 26 (23), 6230-6241 (2020).
- Hu, K., et al. Harnessing the PD-L1 interface peptide for positron emission tomography imaging of the PD-1 immune checkpoint. RSC Chemical Biology. 1 (4), 214-224 (2020).
- Hu, K., et al. PET imaging of VEGFR with a novel 64Cu-labeled peptide. ACS Omega. 5 (15), 8508-8514 (2020).
- Hu, K., et al. An in-tether chiral center modulates the helicity, cell permeability, and target binding affinity of a peptide. Angewandte Chemie International Edition. 55 (28), 8013-8017 (2016).
- Zhao, J., et al. Concurrent injection of unlabeled antibodies allows positron emission tomography imaging of programmed cell death ligand 1 expression in an orthotopic pancreatic tumor model. ACS Omega. 5 (15), 8474-8482 (2020).
- Moroz, A., et al. A preclinical assessment of 89Zr-atezolizumab identifies a requirement for carrier added formulations not observed with 89Zr-C4. Bioconjugate Chemistry. 29 (10), 3476-3482 (2018).
- Nedrow, J. R., et al. Imaging of programmed cell death ligand 1: impact of protein concentration on distribution of anti-PD-L1 SPECT agents in an immunocompetent murine model of melanoma. Journal of Nuclear Medicine. 58 (10), 1560-1566 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır