Method Article
Sviluppo di un tracciante PET del peptide D marcato con 68gallio per l'imaging dell'espressione programmata del ligando di morte 1
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo studio ha sviluppato un metodo non invasivo e in tempo reale per valutare la distribuzione del ligando di morte programmato 1 in tutto il corpo, basato sull'imaging tomografico a emissione di positroni dell'antagonista D-dodecapeptide [68Ga]. Questa tecnica presenta vantaggi rispetto all'immunoistochimica convenzionale e migliora l'efficienza nell'identificazione dei pazienti appropriati che trarranno beneficio dalla terapia di blocco del checkpoint immunitario.
Abstract
Lo sviluppo di una terapia di blocco del checkpoint immunitario basata sulla proteina di morte cellulare programmata 1 (PD-1)/ligando di morte programmata 1 (PD-L1) ha rivoluzionato le terapie antitumorali negli ultimi anni. Tuttavia, solo una frazione dei pazienti risponde agli inibitori di PD-1/PD-L1, a causa dell'espressione eterogenea di PD-L1 nelle cellule tumorali. Questa eterogeneità rappresenta una sfida per la rilevazione precisa delle cellule tumorali mediante l'approccio immunoistochimico (IHC) comunemente usato. Questa situazione richiede metodi migliori per stratificare i pazienti che trarranno beneficio dalla terapia di blocco del checkpoint immunitario, per migliorare l'efficacia del trattamento. La tomografia a emissione di positroni (PET) consente la visualizzazione in tempo reale dell'espressione di PD-L1 in tutto il corpo in modo non invasivo. Pertanto, è necessario lo sviluppo di traccianti radiomarcati per rilevare la distribuzione di PD-L1 nei tumori attraverso l'imaging PET.
Rispetto alle loro controparti L, i peptidi destrorotatori (D) hanno proprietà come la resistenza proteolitica e un'emivita metabolica notevolmente prolungata. Questo studio ha progettato un nuovo metodo per rilevare l'espressione di PD-L1 basato sull'imaging PET di 68D-peptidi mirati a PD-L1 marcati con Ga, un antagonista del D-dodecapeptide (DPA), in topi portatori di tumore. I risultati hanno mostrato che il [68Ga]DPA può legarsi specificamente ai tumori che sovraesprimono PD-L1 in vivo e hanno mostrato una stabilità favorevole e un'eccellente capacità di imaging, suggerendo che [68Ga]DPA-PET è un approccio promettente per la valutazione dello stato di PD-L1 nei tumori.
Introduzione
La scoperta delle proteine del checkpoint immunitario è stata una svolta nella terapia dei tumori e ha portato a importanti progressi nello sviluppo della terapia di blocco del checkpoint immunitario1. La proteina di morte cellulare programmata 1 (PD-1) e il ligando di morte programmata 1 (PD-L1) sono potenziali bersagli farmacologici con diversi anticorpi approvati dalla Food and Drug Administration (FDA). PD-1 è espresso dalle cellule immunitarie infiltranti il tumore, come le cellule T CD4+, CD8+ e le cellule T regolatorie. PD-L1 è uno dei ligandi di PD-1, che è sovraespresso in una varietà di cellule tumorali 2,3. L'interazione tra PD-1 e PD-L1 inattiva PD-1, sopprimendo così la risposta immunitaria antitumorale4. Questi risultati suggeriscono che l'inibizione di PD-L1 può migliorare l'effetto di uccisione delle cellule immunitarie ed eliminare le cellule tumorali5. Attualmente, l'immunoistochimica cromogenica (IHC) è l'approccio più comunemente utilizzato per identificare i pazienti che hanno maggiori probabilità di rispondere alla terapia con checkpoint immunitario 6,7. Tuttavia, a causa dell'espressione eterogenea di PD-L1 nelle cellule tumorali, i risultati IHC delle biopsie non possono fornire informazioni accurate sull'espressione di PD-L1 nei pazienti8. Studi precedenti hanno riportato che solo il 20%-40% dei pazienti ottiene benefici a lungo termine dalla terapia di blocco del checkpoint immunitario 1,9,10. C'è, quindi, un urgente bisogno di sviluppare un nuovo metodo per aggirare i risultati falsi negativi causati dall'espressione eterogenea di queste proteine del checkpoint immunitario.
La tecnologia di imaging molecolare, come la tomografia a emissione di positroni (PET), consente la visualizzazione in tempo reale dell'intero corpo in modo non invasivo e quindi può superare il metodo IHC convenzionale 11,12,13. Gli anticorpi, i peptidi e le piccole molecole radiomarcati sono traccianti promettenti per il monitoraggio dell'espressione di PD-L1 nei pazienti oncologici 14,15,16,17,18,19,20,21,22,23,24,25. La FDA ha approvato tre anticorpi monoclonali terapeutici PD-L1: avelumab, atezolizumab e durvalumab26. I traccianti immuno-PET basati su questi anticorpi sono stati ben documentati 27,28,29,30,31,32. Gli studi clinici di fase iniziale hanno rivelato un valore limitato per l'applicazione clinica, a causa della farmacocinetica sfavorevole30. Rispetto agli anticorpi, i peptidi mostrano una più rapida clearance del sangue e degli organi dagli organi sani e possono essere facilmente modificati chimicamente33. Sono stati riportati peptidi multipli con elevate affinità per PD-1/PD-L12; WL12 è un peptide segnalato che mostra un legame specifico con PD-L134. È stato riportato che i traccianti radiomarcati, [64Cu]WL12, [68Ga]WL12 e [18F]FPyWL12, mostrano un'elevata capacità di targeting del tumore specifico in vivo, che consente la raccolta di immagini di alta qualità dell'espressione di PD-L1 nei tumori 26,35,36,37. Inoltre, la prima valutazione nell'uomo di WL12 radiomarcato ha dimostrato che [68Ga]WL12 (chelato da NOTA) ha un potenziale sicuro ed efficiente per l'imaging clinico del tumore38. A causa della sua elevata idrofobicità e dell'elevato assorbimento nel fegato sano, WL12 ha un uso clinico limitato. Altri peptidi radiomarcanti, come TPP1 e SETSKSF, che si legano specificamente a PD-L1, hanno anche mostrato potenziale stabilità e specificità per visualizzare l'espressione di PD-L1 in tutto il corpo39,40. Tuttavia, i peptidi non modificati sono facilmente degradati dalle proteasi e vengono rapidamente metabolizzati dal rene. I peptidi destrorotti (D) sono stati ampiamente utilizzati come mediatori efficaci, a causa della scarsa stabilità dei peptidi (L) mancini 41,42,43. I peptidi D sono iperresistenti alla degradazione proteolitica e hanno un'emivita metabolica notevolmente prolungata. Rispetto alle loro controparti L, i peptidi D mostrano per lo più capacità di legame specifiche 44,45,46.
Questo studio ha progettato un nuovo metodo per rilevare l'espressione di PD-L1, basato sull'imaging PET di un D-peptide mirato a PD-L1 marcato con 68Ga, antagonista del D-dodecapeptide (DPA), in un modello murino portatore di tumore47. La stabilità di [68Ga]DPA è stata studiata per la prima volta in soluzione salina tamponata con fosfato (PBS) e siero di topo, dopodiché è stata testata l'affinità di legame di [68Ga]DPA nei tumori che sovraesprimono PD-L1. Successivamente, l'imaging PET è stato eseguito in modelli di xenotrapianto di glioblastoma per confermare se [68Ga]DPA fosse un tracciante PET ideale per monitorare l'espressione di PD-L1 nei tumori. La combinazione di imaging PET e DPA non solo fornisce un nuovo approccio per superare le sfide associate all'espressione eterogenea di PD-L1, ma pone anche le basi per lo sviluppo di radiotraccianti a base di peptide D.
Protocollo
Le procedure sperimentali sugli animali sono state approvate dal Comitato Etico Animale dell'Università di Medicina di Nanchino o dal National Institutes of Quantum Science and Technology. Gli esperimenti sui topi sono stati eseguiti rigorosamente in conformità con le linee guida istituzionali del Comitato per la cura e l'uso degli animali da laboratorio.
1. Sintesi peptidica
- Gonfiare 100 mg di resina di 4-metilbenzidrilammina (MBHA) (capacità di carico di 0,37 mmol/g) in 1 mL di N-metil-2-pirrolidone (NMP) per 30 minuti sotto un leggero gorgogliamento di N2 .
- Preparare un tampone fresco costituito da amminoacidi protetti da Fmoc (5,0 equivalenti), HCTU (4,9 equivalenti) e DIPEA (10,0 equivalenti) in 1 mL di NMP e aggiungere alla resina (100 mg). Lasciare procedere la reazione di accoppiamento per 1,5-2 h.
- Preparare il tampone di protezione costituito dal 50% (vol/vol) di morfolina in NMP. Lavare la resina (100 mg) 2 x 30 min con 1 mL di tampone di deprotezione ad ogni lavaggio per rimuovere il gruppo Fmoc sul gruppo amminico. Lavare la resina con diclorometano (DCM; 1 mL) per 1 minuto, rimuovere il DCM e rilavare la resina con NMP (1 mL) per un altro 1 minuto. Successivamente, rimuovere l'NMP e lavare nuovamente la resina con DCM per 1 minuto.
NOTA: Tutte le procedure di lavaggio vengono eseguite in condizioni di lieve gorgogliamento di N2 . Le procedure di cui sopra vengono ripetute fino all'ultimo amminoacido. - Per aggiungere acido 1,4,7,10-tetraazciclododecano-1,4,7,10-tetraacetico (DOTA) al peptide, pre-attivare il DOTA con N-(3-dimetilamminopropil)-N-etilcarbodiimmide cloridrato (EDC· HCl) e N-idrossisuccinimide (NHS). Incubare il buffer di riserva di DOTA/EDC· HCl/NHS con un rapporto molare di 1:1:1 in dimetilsolfossido (DMSO) per 3 ore, con una concentrazione finale di DOTA di 1 M. Successivamente, aggiungere il tampone madre (1 mL) alla resina (100 mg) e lasciare che la reazione proceda per 2 ore con un leggero gorgogliamento di N2 .
NOTA: L'acido 1,4,7-triazciclononano-1,4,7-triacetico (NOTA) può essere utilizzato anche come chelante per la complessazione a 68Ga. Le stesse procedure possono essere utilizzate per l'accoppiamento NOTA. - Risciacquare accuratamente la resina dall'alto utilizzando DCM e applicare contemporaneamente un vuoto per rimuovere la soluzione di reazione residua. Risciacquare la resina 3 volte con DCM (1,5 mL), quindi risciacquare con MeOH (1,5 mL) per restringere la resina. Mettere la resina sotto azoto per una notte, o sotto vuoto alto per almeno 4 ore, fino a quando la resina non diventa asciutta.
- Mettere la resina essiccata contenente peptide DPA in un contenitore di polipropilene da 2 ml con tappo a vite. Aggiungere il cocktail di scissione appropriato (95/2,5/2,5 TFA/TIS/H2O in volume; 1 mL/100 mg di resina) e sigillare ermeticamente il contenitore con un tappo a vite. Agitare delicatamente la reazione su un agitatore orbitale in cappa aspirante a 20-25 °C per 2 ore.
ATTENZIONE: Preparare l'acido trifluoroacetico (TFA) in una cappa aspirante indossando indumenti protettivi, a causa della sua natura altamente corrosiva. - Rimuovere la maggior parte del TFA mediante evaporazione sotto azoto nella cappa aspirante. Precipitare i peptidi aggiungendo etere dietilico (~1,5 mL/100 mg di resina).
- Agitare la miscela per triturare i peptidi e centrifugare a temperatura ambiente (10.000 × g, 5 min). Versare con cautela il solvente fuori dal contenitore. Ripetere i passaggi 1.7-1.8.
- Asciugare all'aria il residuo nel contenitore aperto per 10 minuti. Aggiungere acetonitrile acquoso al 50% (vol/vol) e vorticare per 1-2 s per sciogliere i prodotti (1 mL/100 mg di resina).
- Rimuovere la resina filtrando la miscela, quindi lavare la resina 2 volte utilizzando 0,2 mL di acetonitrile acquoso al 50% (vol/vol). Miscelare i filtrati per la purificazione con cromatografia liquida ad alte prestazioni (HPLC). Utilizzare le seguenti condizioni HPLC. Colonna: YMC-Triat-C18 (diametro interno 4,6 mm, 150 mm, 5 mm); gradiente di solvente: acqua A-deionizzata solvente; solvente B-acetonitrile (0,1% TFA); tempo di flusso: 20 min, con acetonitrile dal 10% al 90%; portata: 1 mL/min.
- Congelare gli eluenti HPLC raccolti per una notte a -80 °C e liofilizzare (-50 °C e <1 pa). Per la radiomarcatura, sciogliere il peptide solido in tampone acetato di sodio (100 mM, pH 5,0) a una concentrazione finale di 1 mg/mL come tampone madre.
2. Radiomarcatura a 68Ga
NOTA 68Ga è stato generato internamente presso il Nanjing First Hospital (Nanchino, Cina) utilizzando un generatore da 68Ge/68Ga.
- Pipettare 5 μL di tampone di riserva in un contenitore di polipropilene da 1,5 mL con tappo a vite. Aggiungere 200 MBq [68Ga]GaCl3 (400 μL) al contenitore.
- Agitare il composto per 5 s. Misurare il pH utilizzando le strisce reattive per il pH. Regolare il pH a 4-4,5 con NaOH (0,1 M).
NOTA: Un pH appropriato è fondamentale per la complessazione tra 68Ga e DOTA. - Incubare la soluzione a temperatura ambiente per 5-10 min. Sottoporre la miscela di reazione a radio-HPLC per l'analisi della resa di radiomarcatura nelle seguenti condizioni: colonna: YMC-Triat-C18 (4,6 mm i.d., 150 mm, 5 mm); gradiente di solvente: acqua A-deionizzata solvente; solvente B-acetonitrile (0,1% TFA); tempo di flusso: 20 min, con acetonitrile dal 10% al 90%; portata: 1 mL/min.
NOTA: La cromatografia radio-su strato sottile (TLC) può essere utilizzata come approccio alternativo per esaminare la resa della radiomarcatura. Il tampone di eluizione TLC suggerito è 0,1 M Na3C6H5O7, pH 4.
3. Test di stabilità del tracciante
- Test di stabilità del tracciante in PBS
- Aggiungere [68Ga]DPA (10 μL, 3,7 MBq, in NaOAc) al PBS (990 μL). Incubare a 37 °C per 1, 2 e 4 ore con leggera agitazione.
- Raccogliere 200 μL di soluzione in ogni punto temporale. Iniettarlo nel radio-HPLC per l'analisi.
- Stabilità del tracciante nel siero di topo
- Aggiungere [68Ga]DPA (10 μL, ~3,7 MBq, in NaOAc) al siero di topo (90 μL, appena preparato). Incubare a 37 °C per 1, 2 e 4 ore con leggera agitazione.
- Raccogliere 20 μL di soluzione in ogni punto temporale. Aggiungere MeCN e acqua (100 μL, 1:1, v/v).
- Centrifugare la miscela per 10 minuti (5.000 × g, 25 °C). Analizzare il surnatante utilizzando la radio-HPLC.
4. Analisi dell'espressione di PD-L1 mediante citometria a flusso
- Preparare il terreno di coltura integrando il terreno RPMI-1640 con il 10% (vol/vol) di siero fetale bovino e l'1% di penicillina-streptomicina (vol/vol). Risospendere le cellule U87MG nel terreno di coltura e seminare in piastre da 12 pozzetti a una densità di 105 cellule/pozzetto. Mettere le cellule in un incubatore (5% CO2, 37 °C) e coltivare per almeno 24 ore senza disturbare.
- Lavare le cellule con 0,5 mL di PBS e aggiungere 250 μL di tripsina-EDTA (0,25%). Rimettere le cellule nell'incubatrice (5% CO2, 37 °C) per 2 minuti.
- Aggiungere 1 mL di terreno di coltura per arrestare la dissociazione cellulare. Aggiungere il terreno alle cellule per staccarle dalle piastre pipettando su e giù e raccoglierle in provette da 1,5 ml. Centrifugare le cellule per 5 minuti (100 × g).
- Rimuovere il surnatante e risospendere le cellule in 1 mL di PBS. Centrifugare le cellule per 5 minuti (100 × g). Ripeti questo passaggio ancora una volta.
- Diluire l'anticorpo PD-L1 coniugato con isotiocianato di fluoresceina (FITC) con albumina sierica bovina (BSA) al 3% a 20 nmol/L. Aggiungere alle cellule e incubare a 4 °C per 1 ora.
- Centrifugare le cellule per 5 minuti (100 × g), quindi lavarle due volte con PBS freddo. Analizza le cellule PD-L1-positive utilizzando un citometro a flusso e un software di analisi.
5. Immunocitochimica
- Seminare le cellule U87MG in piastre di coltura cellulare con fondo di vetro (35 mm) a una densità di 2,5 × 105 cellule per pozzetto. Quando viene raggiunto il 60% di confluenza, aspirare il terreno di coltura e aggiungere 1 mL di PBS. Agitare delicatamente più volte e aspirare. Eseguire la fase di lavaggio 3 volte.
- Aggiungere 500 μL di paraformaldeide al 4% nelle stoviglie. Porre le celle a temperatura ambiente e fissare per 30 min.
- Lavare le celle 3 volte con PBS. Aggiungere 1 mL di BSA al 3% (wt/vol, in PBS) e bloccare le celle fisse per 2 h a temperatura ambiente.
- Rimuovere il 3% di BSA e incubare direttamente le cellule con l'anticorpo primario anti-PD-L1 (mAb,1:100, diluito in BSA al 3%) per una notte a 4 °C.
NOTA: Dopo aver bloccato le celle con BSA, non lavare con PBS. - Lavare le celle 3 volte con tampone BSA al 3%. Incubare le cellule con l'anticorpo secondario anti-IgG Fc coniugato con FITC (1:500, diluito in PBS) per 1 ora.
- Lavare le celle 3 volte con PBS. Aggiungere 0,5 mL di DAPI (1 μg/mL) alle cellule e incubare a temperatura ambiente per 1 ora. Lavare le cellule colorate 3 volte con PBS e osservarle con il microscopio a fluorescenza confocale.
6. Esperimento di assorbimento e inibizione cellulare
- Esperimento di captazione cellulare
- Coltivare le cellule U87MG in piastre da 12 pozzetti fino a raggiungere l'80% di confluenza. Rimuovere il terreno e lavare le celle con 0,5 mL di PBS.
- Diluire il [68Ga]DPA in terreno fresco a una concentrazione di 74 KBq/mL. Aggiungere 0,5 mL del tampone [68Ga]DPA diluito a ciascun pozzetto.
- Incubare le cellule con [68Ga]DPA a 37 °C per durate diverse (10, 30, 40 e 120 min). Aspirare il terreno con una pipetta. Lavare le celle con PBS (0,5 ml) tre volte.
- Aggiungere una soluzione di NaOH (0,5 M, 300 μL per pozzetto) per lisare le cellule. Dopo 30 secondi, raccogliere i lisati di cellule viscose in provette da 1,5 mL.
- Lavare due volte la piastra con 0,4 ml di PBS. Raccogliere la soluzione di lavaggio nella provetta da 1,5 mL di cui sopra.
- Avviare il computer incorporato del contatore gamma automatico; Metti i tubi nel ripiano incorporato. Dopo aver caricato tutti i campioni sul trasportatore, premere il pulsante START. I risultati vengono calcolati nel software interno. La lettura registra i conteggi al minuto correlati al decadimento (CPM) di ciascuna provetta.
- Saggio di legame competitivo
- Coltivare le cellule U87MG in piastre da 12 pozzetti fino a raggiungere l'80% di confluenza. Rimuovere il terreno e lavare le celle con 0,5 mL di PBS.
- Diluire [68Ga]DPA in terreno fresco ad una concentrazione di 74 KBq/mL. Sciogliere una quantità appropriata di composti BMS202 in DMSO al 10% per ottenere una concentrazione di 10 mM (400 μL).
- Diluire 4 μL di 10 mM BMS202 in 396 μL di PBS per ottenere una concentrazione di 100 μM. Ripetere questo passaggio per ottenere varie concentrazioni di BMS202 (1 μM, 10 nM, 100 pM e 1 pM).
- Aggiungere 0,5 mL del tampone [68Ga]DPA diluito a ciascun pozzetto (0,37 MBq per pozzetto). Aggiungere 5 μL delle soluzioni BMS202 a ciascun pozzetto (tre pozzetti per ogni concentrazione). Incubare le cellule in un incubatore cellulare a 37 °C per 120 min.
- Aspirare il terreno con una pipetta. Lavare le celle con 3 x 0,5 mL di PBS.
- Aggiungere la soluzione di NaOH (0,5 M, 300 μL per pozzetto) per lisare le cellule. Dopo 30 secondi, raccogliere i lisati di cellule viscose in provette da 1,5 mL. Lavare la piastra con 2 x 0.4 mL di PBS.
- Raccogliere la soluzione di lavaggio nella provetta da 1,5 mL di cui sopra. Metti le provette nel ripiano integrato del contatore gamma automatico.
- Seguire le stesse procedure del passaggio 6.1.6.
7. Imaging PET
NOTA: Eseguire l'imaging PET di piccoli animali, utilizzando un micro scanner PET che fornisce 159 sezioni assiali trasversali distanziate di 0,796 mm (da centro a centro), con un campo visivo orizzontale di 10 cm e un campo visivo assiale di 12,7 cm. Tutti i dati raccolti in modalità elenco sono organizzati in sinogrammi tridimensionali. Il Fourier viene poi riassemblato in sinogrammi bidimensionali (frame × min: 4 × 1, 8 × 2, 8 × 5).
- In questo studio, utilizzare topi nudi maschi di 5-8 settimane di età pari a 5-8 settimane. Raccogliere le cellule U87MG seguendo i passaggi 4.1-4.4 e aspirare le cellule in una siringa da 0,5 mL. Iniettare per via sottocutanea le cellule nei topi (1 × 106 cellule per tumore, due tumori per topo). Monitorare la crescita del tumore dopo l'iniezione fino a quando il volume del tumore è di 100-300 mm3.
- Anestetizzare i topi utilizzando isoflurano all'1%-2% (v/v) (1 ml/min). Accendere il dispositivo di riscaldamento e mantenere la cuccia dell'animale in PET a 37 °C.
- Mettere i topi anestetizzati nella giusta posizione sul letto della macchina PET. Applicare un unguento oftalmico su entrambi gli occhi per prevenire la secchezza.
ATTENZIONE: Tenere i mouse in posizione prona per evitare la morte durante la scansione. Durante l'intero processo di imaging, somministrare il flusso di isoflurano (1,0 ml/min) attraverso il naso utilizzando una provetta preinstallata. - Regolare la posizione della cuccia dell'animale tramite il pannello di controllo. Iniettare i traccianti (10-17 MBq/100-200 μL) per via endovenosa attraverso un catetere della vena caudale preinstallato.
- Creare un flusso di lavoro di scansione in un computer host utilizzando il software di riferimento (vedere Tabella dei materiali) Creare una cartella di studio e impostare il protocollo di acquisizione in base al protocollo del produttore. Esegui scansioni dinamiche (60 minuti per ogni mouse) su tutti i mouse in modalità elenco 3D.
- Definire un protocollo dell'istogramma e un protocollo di ricostruzione seguendo il protocollo del produttore. Utilizza il filtro di Hanning con un cutoff di Nyquist di 0,5 cicli/pixel per ricostruire immagini dinamiche PET (25-30 min e 55-60 min) attraverso la retroproiezione filtrata. Genera immagini MIP (Maximum Intensity Projection) per tutti i mouse.
- Combinare i protocolli in un flusso di lavoro ed eseguire il flusso di lavoro. Analizza le immagini tridimensionali risultanti utilizzando il software, seguendo il protocollo del produttore.
NOTA: Utilizzare il software di simulazione per selezionare i volumi di interesse. La radioattività viene corretta per il decadimento in base al tempo di iniezione e presentata come percentuale della dose totale di iniezione/per grammo di tessuto (% ID/g).
8. Biodistribuzione ex vivo
- Somministrare [68Ga]DPA (1,85 MBq/100 μL) ai topi nudi BALB/C portatori di U87MG attraverso l'iniezione della vena caudale. Anestetizzare i topi utilizzando isoflurano all'1%-2% (v/v) (1 ml/min), quindi sacrificare tre topi tramite lussazione cervicale dopo l'iniezione per 5, 30, 60 e 120 min.
NOTA: Gli individui che dimostrano questa procedura devono essere addestrati nelle abilità tecniche della lussazione cervicale per garantire che la perdita di coscienza sia rapidamente indotta. Ciò garantirà che le procedure di eutanasia in questo esperimento siano tutte eseguite in modo umano. - Dopo che la morte è stata confermata, apri la parete toracica dei topi. Poi, aprite il cuore. Utilizzare una siringa da 1 ml per prelevare il sangue; spremere il sangue dalla siringa in una provetta per il dosaggio radioimmunologico (RIA) (13 mm di diametro) per il contatore gamma.
- Asportare gli organi principali e i tumori e posizionarli in provette RIA (13 mm di diametro) per il contatore gamma. Gli organi principali includono il sangue totale, il cuore, il timo, il fegato, la milza, le ossa, lo stomaco, i reni, i muscoli, i linfonodi intestinali, l'intestino tenue, il pancreas, i testicoli, il cervello e i polmoni. Pesare tutti gli organi.
- Misurare la radioattività all'interno degli organi raccolti utilizzando un contatore autogamma e correggere i valori in decadimento. Calcolare la percentuale di dose iniettata per grammo di tessuto umido (% ID/g).
9. Immunoistochimica
- Raccogliere i tessuti di glioma e lavarli 3 volte con PBS. Mettere i fazzoletti freschi in paraformaldeide al 4% e fissare per una notte a 4 °C.
- Incorporare i tessuti fissati in paraffina e sezionarli a uno spessore di 10 μm. Mettere le sezioni in un'incubatrice (60 °C) e incubare per 2 ore. Decerare e idratare le sezioni incubando per 10 minuti ciascuna nei seguenti mezzi: xilene (due volte), alcol assoluto, alcol 95%, alcol 90%, alcol 80%, alcol 75%.
- Immergere le sezioni in citrato di sodio 0,01 M e riscaldarle a 92-95 °C. Mantenere la temperatura per 40 minuti per ottenere il recupero dell'antigene.
- Aggiungere 200 μL di soluzione di H2O2 (3%) alle sezioni e inattivare le endoperossidasi per 10 minuti a temperatura ambiente. Bloccare i siti non specifici mediante trattamento con BSA al 3% per 2 ore a temperatura ambiente.
- Incubare le sezioni con anticorpo primario anti-PD-L1 (mAb, 1:100, diluito in BSA al 3%) per una notte a 4 °C.
NOTA: Dopo il blocco con BSA, non lavare con PBS. - Lavare le sezioni 3 volte con PBS. Incubare le sezioni con l'anticorpo secondario anticoniglio di capra marcato con HRP (1:500, diluito in PBS) a temperatura ambiente per 1 ora.
- Lavare le celle 3 volte con PBS. Aggiungere 200 μL di soluzione di lavoro di 3,3-diamminobenzidina (DAB) (soluzione A: soluzione B: soluzione C = 1:1:18) alle sezioni e incubare per 5 minuti al buio.
- Lavare le sezioni 3 volte con PBS. Aggiungere 500 μL di soluzione di ematossilina (100%) e incubare per 5 minuti a temperatura ambiente. Lavare le sezioni con acqua per 30 secondi. Mettere le sezioni in soluzione di differenziazione (alcol al 75%:HCL = 99:1) per 30 s. Lavare le sezioni con acqua per 1 min.
- Disidratare i campioni incubando in sequenza con alcol al 75%, alcol all'80%, alcol al 90%, alcol al 95%, alcol assoluto e xilene (due volte) (10 minuti ciascuno). Montare tutte le sezioni con resina neutra e osservarle al microscopio ottico.
Risultati
[68Ga]Radiomarcatura e stabilità DPA
Il peptide modello, DPA, è un efficace antagonista di PD-L1. DOTA-DPA è stato ottenuto con una purezza del >95% e una resa del 68%. La massa di DOTA-DPA è osservata sperimentalmente a 1.073,3 ([M+2H]2+). 68Il gallio è considerato un radionuclide adatto per marcare i peptidi per l'imaging PET, e quindi è stato scelto per questo studio. Per radiomarcare DPA con 68Ga (emivita: 68 min), è stato sintetizzato DOTA-PEG3-DPA (Figura 1A). DOTA è stato utilizzato come chelante per la radiomarcatura a 68Ga. Per spaziare DOTA e DPA, PEG3 è stato utilizzato come linker. Il [68Ga]-DOTA-PEG3-DPA (indicato come [68Ga]DPA nel testo seguente) ha mostrato un'elevata resa radiochimica (>95%) e purezza radiochimica (>95%) (Tabella 1). È stato eseguito anche un test di stabilità del tracciante utilizzando HPLC e i risultati hanno mostrato che [68Ga]DPA aveva una grande stabilità sia nel PBS che nel siero di topo. La decomposizione del 68Ga o l'idrolisi del peptide non è stata rilevata dopo un'incubazione di 4 ore a 37 °C (Figura 1B).
Espressione di PD-L1 nelle cellule U87MG
Uno studio precedente ha dimostrato che un aumento dell'espressione di PD-L1 è correlato a una scarsa sopravvivenza dei pazienti nei tumori del glioblastoma, indicando che PD-L1 può essere un notevole biomarcatore prognostico e un bersaglio terapeutico nel glioblastoma48. Pertanto, una linea cellulare di glioblastoma umano, U87MG, è stata utilizzata per stabilire un modello tumorale per determinare l'efficacia di [68Ga]DPA in PET/CT per l'imaging del tumore PD-L1. I risultati della citometria a flusso hanno suggerito che circa il 60% delle cellule U87MG erano PD-L1 positive (Figura 2A). Inoltre, la colorazione con immunofluorescenza ha confermato la forte espressione di PD-L1 nelle cellule U87MG (Figura 2B). Insieme, questi dati hanno dimostrato che la linea cellulare U87MG era adatta per questo studio.
Assorbimento cellulare e specificità di [68Ga]DPA
L'assorbimento di [68Ga]DPA da parte delle cellule U87MG ha presentato un modello dipendente dal tempo. Quando un inibitore di PD-L1, BMS202, è stato utilizzato come agente bloccante, la porzione di legame e l'assorbimento di [68Ga]DPA sono stati significativamente ridotti (Figura 3A). Un test di legame competitivo ha ulteriormente esaminato l'affinità di legame (Ki) di BMS202 con le cellule U87MG. L'affinità di legame stimata è stata di 43,8 ± 8,6 nmol/L per BMS202 quando [68Ga]DPA è stato utilizzato come concorrente (Figura 3B).
[68Ga]DPA Imaging PET di modelli tumorali
L'imaging PET di [68Ga]DPA è stato eseguito in topi nudi BALB/C portatori di tumore U87MG. [68Ga] La DPA è stata somministrata per via endovenosa fino a quando il tumore U87MG non è cresciuto fino a 100 mm3. Le immagini PET di tutto il corpo hanno rivelato un elevato accumulo di [68Ga]DPA nel tumore dopo 30 e 60 minuti di iniezione e hanno mostrato il massimo accumulo nel rene e nella vescica (Figura 4A). Per confermare se [68Ga]DPA si è accumulato specificamente nei tumori PD-L1-positivi, un altro modello murino con la linea cellulare PanNET Bon-1 è stato utilizzato come controllo negativo. Un esperimento parallelo ha dimostrato un basso accumulo di [68Ga]DPA nei tumori Bon-1 a 60 minuti dopo l'iniezione (Figura 4B).
Per chiarire questa differenza, è stata condotta una colorazione immunoistochimica per analizzare l'espressione di PD-L1 nei tessuti tumorali. I risultati hanno rivelato che le cellule U87MG presentavano una notevole espressione di PD-L1 (Figura 5A,C), ma non il tumore Bon-1 (Figura 5B,C). Questi dati erano coerenti con i risultati della PET. Pertanto, è possibile che i diversi stati di crescita delle cellule tumorali abbiano provocato una diversa espressione di PD-L1 (ad esempio, necrosi tissutale). Per verificarlo, è stata eseguita la colorazione con ematossilina ed eosina (H&E). Come previsto, è stata osservata una morfologia cellulare simile tra i due tessuti tumorali (Figura 5D).
Biodistribuzione ex vivo di [68Ga]DPA nei tumori U87MG
Lo studio di biodistribuzione ex vivo è stato condotto anche utilizzando topi portatori di U87MG (Tabella 2). I risultati hanno mostrato una rapida clearance nel sangue e nella maggior parte degli organi analizzati, tra cui cuore, fegato, polmone e muscoli. Il rene ha accumulato la più alta quantità di radioattività e ha mostrato un tasso di clearance dello 0,12% ID/(g∙min) da 5 minuti a 120 minuti. Il tumore ha mostrato l'assorbimento del secondo più alto assorbimento di traccianti in tutti i punti temporali. Inoltre, da 5 minuti a 60 minuti dopo l'iniezione, il tumore ha presentato un tasso di clearance del tracciante inferiore dello 0,027% ID/(g∙min). Per il sangue, il tasso di clearance è stato dello 0,069% ID/(g∙min), mentre per il muscolo, il tasso di clearance è stato dello 0,037% ID/(g∙min).
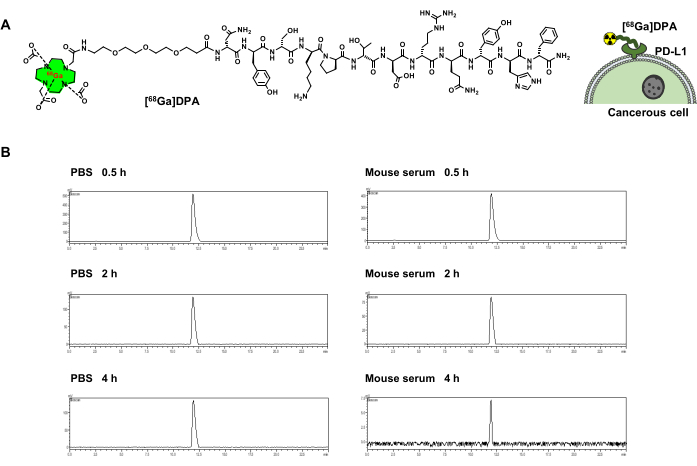
Figura 1: Radiomarcatura [68Ga]DPA e stabilità. (A) La struttura chimica di [68Ga]DPA e la rappresentazione schematica del suo legame con le cellule tumorali che esprimono PD-L1. (B) Curve HPLC che mostrano la radioattività di [68Ga]DPA dopo incubazione con PBS o siero di topo per 0,5, 2 e 4 ore. Questa cifra è stata modificata da Hu et al.47. Abbreviazioni: DPA = antagonista del dodecapeptide; PD-L1 = ligando di morte programmato 1; PBS = soluzione salina tamponata con fosfati; HPLC = cromatografia liquida ad alta prestazione. Fare clic qui per visualizzare una versione più grande di questa figura.
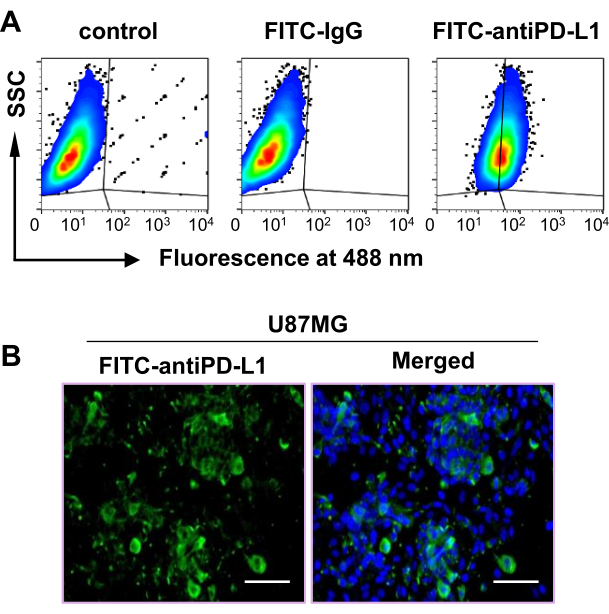
Figura 2: Espressione di PD-L1 nella linea cellulare U87MG. (A) L'espressione di PD-L1 nella linea cellulare U87MG è stata misurata attraverso l'analisi della citometria a flusso. (B) L'espressione di PD-L1 nelle cellule U87MG è stata misurata mediante test di colorazione in immunofluorescenza. Barra della scala = 100 μm. Questa cifra è stata modificata da Hu et al.47. Abbreviazioni: PD-L1 = ligando di morte programmato 1; SSC = dispersione laterale; FITC = isotiocianato di fluoresceina. Fare clic qui per visualizzare una versione più grande di questa figura.
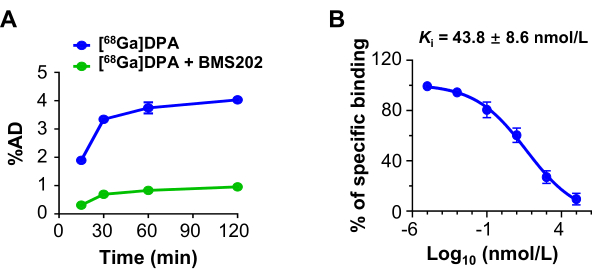
Figura 3: Assorbimento cellulare e inibizione di [68Ga]DPA. (A) L'assorbimento di cellule U87MG quando incubate con [68Ga]DPA (0,74 MBq/mL) o [68Ga]DPA (0,74 MBq/mL) + BMS202 (100 μmol/L) per durate diverse. (B) Legame competitivo di [68Ga]DPA (0,74 MBq /mL) alle cellule U87MG dopo incubazione con BMS202. Il valore Ki viene visualizzato nel pannello. Questa cifra è stata modificata da Hu et al.47. Abbreviazioni: DPA = antagonista del dodecapeptide; %AD = dose somministrata (rispetto alla porzione di legame). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Imaging PET di [68Ga]DPA nei tumori U87MG che sovraesprimono PD-L1. (A,B) Immagini PET-CT che mostrano la distribuzione di [68Ga]DPA nei topi portatori di U87MG (A) e nei topi portatori di Bon-1 (controllo negativo, B) dopo iniezione endovenosa (~18,5 MBq) per 30 minuti e 60 minuti. Vengono presentate immagini rappresentative di proiezione di massima intensità (MIP) (pannello superiore) e immagini PET-TC trasversali (pannello inferiore). Le posizioni del tumore sono contrassegnate da cerchi tratteggiati bianchi. Questa cifra è stata modificata da Hu et al.47. Abbreviazioni: DPA = antagonista del dodecapeptide; PD-L1 = ligando di morte programmato 1; PET-CT = tomografia computerizzata con tomografia a emissione di positroni; MIP = proiezione di intensità massima; P.I. = post-iniezione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Analisi immunoistochimica dei tumori trattati con [68Ga]DPA. (A,B) Immagini immunoistochimiche a sezione intera di PD-L1 nei tumori (A) U87MG e (B) Bon-1. (C) Immagini ingrandite delle aree contrassegnate in A e B. (D) Colorazione H&E del tumore U87MG e Bon-1. Barre di scala = 100 μm (C,D). Questa cifra è stata modificata da Hu et al.47. Abbreviazioni: DPA = antagonista del dodecapeptide; PD-L1 = ligando di morte programmato 1; H&E = ematossilina ed eosina. Fare clic qui per visualizzare una versione più grande di questa figura.
| Rivelatori | [68Ga] DPA |
| Resa radiochimica (%) | >95 |
| Attività molare (GBq μmol-1) | 37 ± 8 |
| Purezza radiochimicaa (%) | >95 |
Tabella 1: Radioetichettatura e controllo di qualità di [68Ga]DPA. Resa radiochimica, attività molare e purezza radiochimica di [68Ga]DPA. I dati sono rappresentati come media ± DS (n = 7). Questa tabella è stata modificata da Hu et al.47. Abbreviazione: DPA = antagonista del dodecapeptide. unLa purezza radiochimica di [68Ga]DPA è stata analizzata mediante HPLC in fase inversa in condizioni ottimizzate: 1) colonna: YMC-Triat-C18 (4,6 mm i.d., 150 mm, 5 mm); 2) gradiente solvente: solvente A-deionizzato acqua; solvente B-acetonitrile (0,1% acido trifluoroacetico); tempo di flusso: 20 min, con acetonitrile dal 10% al 90%; portata di 1 mL/min.
| [68Ga] DPA | ||||||||
| 5 minuti | 30 minuti | 60 minuti | 120 minuti | |||||
| sangue | 3.89 | ±0.43 | 1.55 | ±1.07 | 0.11 | ±0,02 | 0.05 | ±0.01 |
| cuore | 1.19 | ±0,39 | 0.52 | ±0.33 | 0.06 | ±0,02 | 0.05 | ±0,02 |
| fegato | 1.06 | ±0.26 | 0.59 | ±0.43 | 0.19 | ±0,02 | 0.16 | ±0.04 |
| milza | 0.98 | ±0.14 | 0.68 | ±0.67 | 0.14 | ±0,06 | 0.09 | ±0.03 |
| polmone | 1.64 | ±0.42 | 1.03 | ±0,9 | 0.13 | ±0,05 | 0.09 | ±0,02 |
| rene | 19.23 | ±1.95 | 16.13 | ±1.51 | 11.5 | ±0.44 | 5.2 | ±0.31 |
| stomaco | 1.54 | ±0.1 | 0.61 | ±0.35 | 0.08 | ±0.01 | 0.08 | ±0.03 |
| intestinale | 0.72 | ±0,27 | 0.47 | ±0.35 | 0.08 | ±0,02 | 0.06 | ±0.03 |
| pancreas | 1.88 | ±0.28 | 0.77 | ±0,75 | 0.16 | ±0.03 | 0.13 | ±0.03 |
| muscolo | 2.21 | ±0,27 | 0.71 | ±0.37 | 0.18 | ±0,02 | 0.14 | ±0.04 |
| osso | 2.18 | ±0.11 | 0.85 | ±0,51 | 0.26 | ±0.09 | 0.14 | ±0,06 |
| cervello | 0.19 | ±0.04 | 0.11 | ±0.08 | 0.03 | ±0.01 | 0.02 | ±0.01 |
| tumore | 4.5 | ±0.32 | 3.77 | ±0,27 | 2.99 | ±0.03 | 0.89 | ±0.19 |
| grasso | 2.09 | ±0.49 | 0.81 | ±0.12 | 0.27 | ±0.07 | 0.1 | ±0.07 |
Tabella 2: Biodistribuzione di [68Ga]DPA in topi portatori di tumore U87MG dopo somministrazione per diverse durate (n = 3 per punto temporale). Questa tabella è modificata da Hu et al.47. Abbreviazione: DPA = antagonista del dodecapeptide.
Discussione
I passaggi critici descritti in questo metodo includono l'etichettatura efficiente di 68Ga in DPA e la scelta di una finestra temporale adatta per l'imaging PET, che deve corrispondere perfettamente al modello farmacodinamico di DPA nel tumore.
A differenza dell'IHC, l'imaging PET consente di rilevare in tempo reale l'espressione di PD-L1 in tutto il corpo in modo non invasivo, consentendo la visualizzazione di ciascuna area positiva in un tumore eterogeneo 6,7. I peptidi sono stati scelti come ligandi per evitare gli svantaggi degli anticorpi e delle piccole molecole. Gli anticorpi con grandi pesi molecolari hanno generalmente una lunga emivita circolante, che provoca una maggiore tossicità per gli organi sani. La clearance delle piccole molecole è di solito troppo rapida per raggiungere la ritenzione tumorale richiesta. Il peso molecolare dei peptidi varia tra quello degli anticorpi e quello delle piccole molecole. Ciò consente ai radiotraccianti a base di peptidi di ottenere sia la ritenzione tumorale a lungo termine che una buona penetrazione nei tessuti con una tossicità minima 13,49,50,51,52,53. È importante sottolineare che l'utilità del D-peptide DPA, piuttosto che dei L-peptidi comunemente riportati, conferisce al [68Ga]DPA un'emivita metabolica notevolmente prolungata. Inoltre, il DPA è caricato positivamente e idrofilo in vivo, e quindi ha un'elevata solubilità e può evitare il targeting aspecifico nel sangue, facilitando la generazione di immagini PET con un'elevata qualità di imaging.
In particolare, il successo della radiomarcatura a 68Ga richiede un pH specifico e nessuna interferenza da parte di ioni di metalli di transizione, come i cationi Cu (II) e Fe (III). In alcuni casi, la contaminazione da Cu2+ porta a una bassa resa radiochimica. Pertanto, è fondamentale assicurarsi che tutti i contenitori e i puntali delle pipette non siano contaminati. Inoltre, in questo metodo, U87MG è stato utilizzato per l'inoculazione del tumore. Sebbene l'espressione di PD-L1 negli xenotrapianti U87MG sia stata verificata in studi precedenti, la sua espressione varia tra i singoli animali. Pertanto, l'assorbimento assoluto del tracciante nei tumori U87MG variava tra i singoli topi. Per garantire un'efficace captazione del tracciante nei tumori, è necessario selezionare animali con una dimensione del tumore appropriata (500 mm3 < volume < 100 mm3) per la scansione PET.
Uno dei limiti di [68Ga]DPA è che l'affinità di legame di DPA a PD-L1 è relativamente bassa rispetto a molti altri peptidi mirati a PD-L1, come WL12, il che lo rende inadatto per tumori con espressione relativamente bassa di PD-L126,47. Un'ulteriore modifica del peptide D migliorerà la sua capacità di legame specifica. Inoltre, per migliorare l'effetto di imaging di [68Ga]DPA, la formulazione della strategia di iniezione può essere ottimizzata, ad esempio, iniettando contemporaneamente DPA non marcato prima di [68Ga]DPA per bloccare i siti di legame non specifici 54,55,56.
In conclusione, questo studio ha sviluppato un metodo non invasivo e in tempo reale per tracciare la distribuzione di PD-L1 nell'intero corpo di animali viventi utilizzando [68Ga]DPA come radiotracciante. I risultati hanno rivelato un'affinità di legame specifica relativamente elevata e in vivo , una stabilità favorevole e un'eccellente capacità di imaging di [68Ga] DPA, suggerendo che [68Ga] DPA-PET è un approccio promettente per la visualizzazione di tumori che sovraesprimono PD-L1. Inoltre, questa tecnica può essere applicata anche al trattamento di tumori PD-L1 positivi quando si marca DPA con altri radionuclidi, come 177Lu e 225Ac. Pertanto, la tecnica di radiomarcatura DPA non solo supera i limiti della diagnosi dipendente dall'IHC, ma fornisce anche una nuova opzione per il trattamento.
Divulgazioni
Non vengono dichiarati interessi concorrenti.
Riconoscimenti
Questo studio è stato sostenuto dal Fondo dell'Istituto centrale di ricerca senza scopo di lucro dell'Accademia cinese delle scienze mediche (n. 2022-RC350-04) e dal Fondo per l'innovazione CAMS per le scienze mediche (n. 2021-I2M-1-026, 2022-I2M-1-026-1, 02120101, 02130101 e 2022-I2M-2-002).
Materiali
| Name | Company | Catalog Number | Comments |
| 1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid (DOTA) | Merck | 60239-18-1 | 68Ga chelation |
| 3,3-diaminobenzidine (DAB) Kit | Sigma-Aldrich | D7304-1SET | Immunohistochemistry |
| anti-PD-L1 monoclonal antibody | Wuhan Proteintech | 17952-1-ap | Immunohistochemistry: primary antibody |
| BMS202 | Selleck | 1675203-84-5 | Competitive binding assay: inhibitor |
| BSA | Merck | V900933 | Immunofluorescent : blocking |
| DAPI | Merck | D9542 | Immunofluorescent: staining of nucleus |
| Dichloromethane (DCM) | Merck | 34856 | Solvent |
| DIPEA | Merck | 3439 | Peptide coupling |
| EDC·HCl | Merck | E6383 | Activation of DOTA |
| FBS | Gibco | 10099 | Cell culture: supplement |
| FITC-conjugated anti-human IgG Fc Antibody | Biolegend | 409310 | Immunofluorescent: secondary antibody |
| FITC-conjugated anti PD-L1 antibody | Biolegend | 393606 | Flow cytometry: direct antibody |
| HCTU | Energy Chemical | E070004-25g | Peptide coupling |
| HRP labeled goat anti-rabbit antibody | Servicebio | GB23303 | Immunohistochemistry: secondary antibody |
| Hydroxysuccinimide (NHS) | Merck | 130672 | Activation of DOTA |
| MeCN | Merck | PHR1551 | Solvent |
| Morpholine | Merck | 8.06127 | Fmoc- deprotection |
| NMP | Merck | 8.06072 | Solevent |
| Paraformaldehyde | Merck | 30525-89-4 | Fixation of tissues |
| PBS | Gibco | 10010023 | Cell culture: buffer |
| Penicillin-streptomycin | Gibco | 10378016 | Cell culture: supplement |
| RIA tube | PolyLab | P10301A | As tissue sample container |
| RPMI-1640 medium | Gibco | 11875093 | Cell culture: basic medium |
| Sodium acetate | Merck | 1.06264 | Salt for buffer |
| Trypsin-EDTA | Gibco | 25200056 | Cell culture: dissociation agent |
| U87MG cell line | Procell Life Science & Technology Co | CL-0238 | Cell model |
| Equipment | |||
| 68Ge/68Ga generator | Isotope Technologies Munich, ITM | Not applicable | Generation of [68Ga] |
| Autogamma counter | Perkin Elmer | Wizard2 | Detection of radioactivity |
| Confocal fluorescent microscopy | Keyence | Observation of immunofluorescent results | |
| Flow cytometer | Becton Dickinson, BD | LSRII | Monitoring the PD-L1 positive cells |
| High-performance liquid chromatography (HPLC) | SHIMAZU | LC-20AT | Purification of DPA peptide |
| PET scanner | Siemens Medical Solutions | Inveon MultiModality System | PET imaging |
| Optical microscopy | Nikon | Eclipse E100 | Observation of immunohistochemistry results |
| Solid phase peptide synthesizer | Promega Vac-Man Laboratory Vacuum Manifold | LOT#11101 | Synthesis of DPA-DOTA peptide |
| Software | |||
| ASIPro | Siemens Medical Solutions | Not applicable | Analysis of PET-CT results |
| FlowJo | Becton Dickinson, BD | FlowJo 7.6.1 | Analysis of the flow cytometer results |
| Inveon Acquisition Workplace (IAW) | Siemens Medical Solutions | Not applicable | Management of PET mechine |
| Prism | Graphpad | Prism 8.0 | Analysis of the data |
Riferimenti
- Doroshow, D. B., et al. PD-L1 as a biomarker of response to immune-checkpoint inhibitors. Natire Reviews Clinical Oncology. 18 (6), 345-362 (2021).
- Krutzek, F., Kopka, K., Stadlbauer, S. Development of radiotracers for imaging of the PD-1/PD-L1 axis. Pharmaceuticals. 15 (6), 747 (2022).
- Topalian, S. L., Drake, C. G., Pardoll, D. M. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell. 27 (4), 450-461 (2015).
- Pardoll, D. M. The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer. 12 (4), 252-264 (2012).
- Xiao, Z., et al. PEIGel: A biocompatible and injectable scaffold with innate immune adjuvanticity for synergized local immunotherapy. Materials Today Bio. 15, 100297 (2022).
- Teng, M. W. L., Ngiow, S. F., Ribas, A., Smyth, M. J. Classifying cancers based on T-cell infiltration and PD-L1. Cancer Research. 75 (11), 2139-2145 (2015).
- Dolled-Filhart, M., et al. Development of a companion diagnostic for pembrolizumab in non-small cell lung cancer using immunohistochemistry for programmed death ligand-1. Archives of Pathology & Laboratory Medicine. 140 (11), 1243-1249 (2016).
- Meng, X. J., Huang, Z. Q., Teng, F. F., Xing, L. G., Yu, J. M. Predictive biomarkers in PD-1/PD-L1 checkpoint blockade immunotherapy. Cancer Treatment Reviews. 41 (10), 868-876 (2015).
- Hakozaki, T., Hosomi, Y., Kitadai, R., Kitagawa, S., Okuma, Y. Efficacy of immune checkpoint inhibitor monotherapy for patients with massive non-small-cell lung cancer. Journal of Cancer Research and Clinical Oncology. 146 (11), 2957-2966 (2020).
- Haslam, A., Prasad, V. Estimation of the percentage of US patients with cancer who are eligible for and respond to checkpoint inhibitor immunotherapy drugs. Jama Network Open. 2 (5), 192535 (2019).
- Willmann, J. K., van Bruggen, N., Dinkelborg, L. M., Gambhir, S. S. Molecular imaging in drug development. Nature Reviews Drug Discovery. 7 (7), 591-607 (2008).
- Zhang, L., et al. Recent developments on PET radiotracers for TSPO and their applications in neuroimaging. Acta Pharmaceutica Sinica B. 11 (2), 373-393 (2021).
- Sun, J., et al. Imaging-guided targeted radionuclide tumor therapy: From concept to clinical translation. Advanced Drug Delivery Reviews. 190, 114538 (2022).
- Xu, M., et al. Preclinical study of a fully human Anti-PD-L1 antibody as a theranostic agent for cancer immunotherapy. Molecular Pharmaceutics. 15 (10), 4426-4433 (2018).
- Niemeijer, A. N., et al. Whole body PD-1 and PD-L1 positron emission tomography in patients with non-small-cell lung cancer. Nature Communications. 9 (1), 4664 (2018).
- Mayer, A. T., et al. Practical immuno-PET radiotracer design considerations for human immune checkpoint imaging. Journal of Nuclear Medicine. 58 (4), 538-546 (2017).
- Lv, G., et al. PET Imaging of tumor PD-L1 expression with a highly specific nonblocking single-domain antibody. Journal of Nuclear Medicine. 61 (1), 117-122 (2020).
- Li, D., et al. Immuno-PET imaging of 89Zr labeled anti-PD-L1 domain antibody. Molecular Pharmaceutics. 15 (4), 1674-1681 (2018).
- Lesniak, W. G., et al. PD-L1 detection in tumors using [(64)Cu]Atezolizumab with PET. Bioconjugate Chemistry. 27 (64), 2103-2110 (2016).
- Kristensen, L. K., et al. CD4(+) and CD8a(+) PET imaging predicts response to novel PD-1 checkpoint inhibitor: studies of Sym021 in syngeneic mouse cancer models. Theranostics. 9 (26), 8221-8238 (2019).
- Christensen, C., Kristensen, L. K., Alfsen, M. Z., Nielsen, C. H., Kjaer, A. Quantitative PET imaging of PD-L1 expression in xenograft and syngeneic tumour models using a site-specifically labelled PD-L1 antibody. European Journal of Nuclear Medicine and Molecular Imaging. 47 (5), 1302-1313 (2020).
- Bensch, F., et al. 89Zr-atezolizumab imaging as a non-invasive approach to assess clinical response to PD-L1 blockade in cancer. Nature Medicine. 24 (12), 1852-1858 (2018).
- Gonzalez Trotter, D. E., et al. In vivo imaging of the programmed death ligand 1 by 18F PET. Journal of Nuclear Medicine. 58 (11), 1852-1857 (2017).
- Lv, G., et al. Promising potential of a 18F-labelled small-molecular radiotracer to evaluate PD-L1 expression in tumors by PET imaging. Bioorganic Chemistry. 115, 105294 (2021).
- Miao, Y., et al. One-step radiosynthesis and initial evaluation of a small molecule PET tracer for PD-L1 imaging. Bioorganic & Medicinal Chemical Letters. 30 (24), 127572 (2020).
- Kumar, D., et al. Peptide-based PET quantifies target engagement of PD-L1 therapeutics. The Journal of Clinical Investigation. 129 (2), 616-630 (2019).
- Powles, T., et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature. 515 (7528), 558-562 (2014).
- Herbst, R. S., et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature. 515 (7528), 563-567 (2014).
- Marciscano, A. E., Gulley, J. L. Avelumab demonstrates promise in advanced NSCLC. Oncotarget. 8 (61), 102767-102768 (2017).
- Vaddepally, R. K., Kharel, P., Pandey, R., Garje, R., Chandra, A. B. Review of indications of FDA-approved immune checkpoint inhibitors per NCCN guidelines with the level of evidence. Cancers. 12 (3), 738 (2020).
- Antonia, S. J., et al. Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. The New England Journal of Medicine. 377 (20), 1919-1929 (2017).
- Wang, D. Y., et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis. JAMA Oncology. 4 (12), 1721-1728 (2018).
- Sgouros, G., Bodei, L., McDevitt, M. R., Nedrow, J. R. Radiopharmaceutical therapy in cancer: clinical advances and challenges. Nature Reviews Drug Discovery. 19 (9), 589-608 (2020).
- (US) M. M. M, et al. Macrocyclic inhibitors of the pd-1/pd-l1 and cd80(b7-1)/pd-l1 protein/protein interactions. United States patent. , (2014).
- Chatterjee, S., et al. Rapid PD-L1 detection in tumors with PET using a highly specific peptide. Biochemical and Biophysical Research Communications. 483 (1), 258-263 (2017).
- De Silva, R. A., et al. Peptide-based 68Ga-PET radiotracer for imaging PD-L1 expression in cancer. Molecular Pharmaceutics. 15 (9), 3946-3952 (2018).
- Lesniak, W. G., et al. Development of [18F]FPy-WL12 as a PD-L1 specific PET imaging peptide. Molecular Imaging. 18, 1536012119852189 (2019).
- Zhou, X., et al. First-in-humans evaluation of a PD-L1-binding peptide PET radiotracer in non-small cell lung cancer patients. Journal of Nuclear Medicine. 63 (4), 536-542 (2022).
- Hu, K., et al. Developing native peptide-based radiotracers for PD-L1 PET imaging and improving imaging contrast by pegylation. Chemical Communications. 55 (29), 4162-4165 (2019).
- Liu, H., et al. A novel small cyclic peptide-based 68Ga-Radiotracer for positron emission tomography imaging of PD-L1 expression in tumors. Molecular Pharmaceutics. 19 (1), 138-147 (2022).
- Rabideau, A. E., Pentelute, B. L. A D-amino acid at the N-terminus of a protein abrogates its degradation by the N-end rule pathway. ACS Central Science. 1 (8), 423-430 (2015).
- Uppalapati, M., et al. A potent D-protein antagonist of VEGF-A is nonimmunogenic, metabolically stable, and longer-circulating in vivo. ACS Chemical Biology. 11 (4), 1058-1065 (2016).
- Garton, M., et al. Method to generate highly stable D-amino acid analogs of bioactive helical peptides using a mirror image of the entire PDB. Proceedings of the National Academy of Sciences. 115 (7), 1505-1510 (2018).
- Jia, F. J., et al. D-amino acid substitution enhances the stability of antimicrobial peptide polybia-CP. Acta Biochimica et Biophysica Sinica. 49 (10), 916-925 (2017).
- Carmona, G., Rodriguez, A., Juarez, D., Corzo, G., Villegas, E. Improved protease stability of the antimicrobial peptide Pin2 substituted with D-amino acids. Protein Journal. 32 (6), 456-466 (2013).
- Feng, Z., Xu, B. Inspiration from the mirror: D-amino acid containing peptides in biomedical approaches. Biomolecular Concepts. 7 (3), 179-187 (2016).
- Hu, K., et al. Whole-body PET tracking of a d-dodecapeptide and its radiotheranostic potential for PD-L1 overexpressing tumors. Acta Pharmaceutica Sinica. B. 12 (3), 1363-1376 (2022).
- Qiu, X. Y., et al. PD-L1 confers glioblastoma multiforme malignancy via Ras binding and Ras/Erk/EMT activation. Biochimica Et Biophysica Acta. Molecular Basis of Disease. 1864, 1754-1769 (2018).
- Hu, K., et al. Development of a stable peptide-based PET tracer for detecting CD133-expressing cancer cells. ACS Omega. 7 (1), 334-341 (2021).
- Jin, Z. -. H., et al. Radiotheranostic agent 64Cu-cyclam-RAFT-c(-RGDfK-)4 for management of peritoneal metastasis in ovarian cancer. Clinical Cancer Research. 26 (23), 6230-6241 (2020).
- Hu, K., et al. Harnessing the PD-L1 interface peptide for positron emission tomography imaging of the PD-1 immune checkpoint. RSC Chemical Biology. 1 (4), 214-224 (2020).
- Hu, K., et al. PET imaging of VEGFR with a novel 64Cu-labeled peptide. ACS Omega. 5 (15), 8508-8514 (2020).
- Hu, K., et al. An in-tether chiral center modulates the helicity, cell permeability, and target binding affinity of a peptide. Angewandte Chemie International Edition. 55 (28), 8013-8017 (2016).
- Zhao, J., et al. Concurrent injection of unlabeled antibodies allows positron emission tomography imaging of programmed cell death ligand 1 expression in an orthotopic pancreatic tumor model. ACS Omega. 5 (15), 8474-8482 (2020).
- Moroz, A., et al. A preclinical assessment of 89Zr-atezolizumab identifies a requirement for carrier added formulations not observed with 89Zr-C4. Bioconjugate Chemistry. 29 (10), 3476-3482 (2018).
- Nedrow, J. R., et al. Imaging of programmed cell death ligand 1: impact of protein concentration on distribution of anti-PD-L1 SPECT agents in an immunocompetent murine model of melanoma. Journal of Nuclear Medicine. 58 (10), 1560-1566 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon