Method Article
开发用于对程序性死亡配体 1 表达进行成像的 68镓标记的 D 肽 PET 示踪剂
* 这些作者具有相同的贡献
摘要
本研究开发了一种非侵入性和实时方法,基于[68Ga] D-十二肽拮抗剂的正电子发射断层成像,评估程序性死亡配体1在全身的分布。与传统的免疫组化相比,该技术具有优势,并提高了识别将从免疫检查点阻断疗法中受益的合适患者的效率。
摘要
近年来,基于程序性细胞死亡蛋白 1 (PD-1)/程序性死亡配体 1 (PD-L1) 的免疫检查点阻断疗法的发展彻底改变了癌症治疗。然而,由于 PD-L1 在肿瘤细胞中的异质表达,只有一小部分患者对 PD-1/PD-L1 抑制剂有反应。这种异质性给常用的免疫组化(IHC)方法精确检测肿瘤细胞带来了挑战。这种情况需要更好的方法来对将从免疫检查点阻断疗法中受益的患者进行分层,以提高治疗效果。正电子发射断层扫描 (PET) 能够以非侵入性方式实时可视化全身 PD-L1 表达。因此,需要开发放射性标记的示踪剂,通过PET成像检测PD-L1在肿瘤中的分布。
与L-肽相比,右旋(D)肽具有蛋白水解抗性和显著延长的代谢半衰期等特性。本研究设计了一种基于 68个Ga标记的PD-L1靶向D肽(一种D-十二肽拮抗剂(DPA))的PET成像检测PD-L1表达的新方法。结果表明,[68Ga]DPA 在体内可特异性结合PD-L1过表达的肿瘤,并显示出良好的稳定性和优异的成像能力,表明[68Ga]DPA-PET是评估肿瘤中PD-L1状态的一种有前途的方法。
引言
免疫检查点蛋白的发现是肿瘤治疗的突破,并导致了免疫检查点阻断疗法发展的重大进展1。程序性细胞死亡蛋白 1 (PD-1) 和程序性死亡配体 1 (PD-L1) 是美国食品和药物管理局 (FDA) 批准的多种抗体的潜在药物靶点。PD-1 由肿瘤浸润免疫细胞表达,例如 CD4+、CD8+ T 细胞和调节性 T 细胞。PD-L1 是 PD-1 配体之一,在多种肿瘤细胞中过表达 2,3。PD-1 和 PD-L1 之间的相互作用使 PD-1 失活,从而抑制抗肿瘤免疫反应4。这些发现表明,抑制PD-L1可以提高免疫细胞的杀伤效果并消除肿瘤细胞5。目前,显色免疫组化 (IHC) 是识别最有可能对免疫检查点治疗有反应的患者的最常用方法 6,7。然而,由于 PD-L1 在肿瘤细胞中的异质表达,活检的 IHC 结果无法提供有关患者 PD-L1 表达的准确信息8。先前的研究报告称,只有 20%-40% 的患者从免疫检查点阻断疗法中获得长期益处 1,9,10。因此,迫切需要开发一种新方法来规避这些免疫检查点蛋白的异质性表达引起的假阴性结果。
分子成像技术,如正电子发射断层扫描(PET),能够以非侵入性方式实时观察整个身体,因此可以优于传统的IHC方法11,12,13。放射性标记的抗体、肽和小分子是监测癌症患者 PD-L1 表达的有前途的示踪剂 14,15,16,17,18,19,20,21,22,23,24,25.FDA 已批准三种 PD-L1 治疗性单克隆抗体:avelumab、atezolizumab 和 durvalumab26。基于这些抗体的免疫PET示踪剂已被充分记录在案27,28,29,30,31,32。早期临床试验显示,由于不利的药代动力学30,临床应用的价值有限。与抗体相比,肽在血液和器官中清除健康器官的速度更快,并且可以很容易地进行化学修饰33。已报道了对 PD-1/PD-L1 具有高亲和力的多种肽2;WL12 是一种已报道的肽,显示出与 PD-L134 的特异性结合。据报道,放射性标记的示踪剂 [64Cu]WL12、[68Ga]WL12 和 [18F]FPyWL12 显示出高体内特异性肿瘤靶向能力,从而可以收获肿瘤中 PD-L1 表达的高质量图像 26,35,36,37。此外,对放射性标记的 WL12 的首次人体评估表明,[68Ga]WL12(由 NOTA 螯合)在临床肿瘤成像方面具有安全有效的潜力38。由于其高疏水性和在健康肝脏中的高摄取性,WL12的临床应用有限。其他与 PD-L1 特异性结合的放射性标记肽,如 TPP1 和 SETSKSF,也显示出潜在的稳定性和特异性,可可视化全身 PD-L1表达 39,40。然而,未修饰的肽很容易被蛋白酶降解,并被肾脏迅速代谢。由于左旋(L)肽的稳定性较差,右旋(D)肽已被广泛用作有效的介质41,42,43。D-肽对蛋白水解降解具有超强的抵抗力,并且具有显着延长的代谢半衰期。与L-对应物相比,D-肽大多表现出特异性结合能力44,45,46。
本研究设计了一种检测 PD-L1 表达的新方法,基于 68Ga 标记的 PD-L1 靶向 D 肽、D-十二肽拮抗剂 (DPA) 的 PET 成像,在荷瘤小鼠模型 47 中。首先在磷酸盐缓冲盐水(PBS)和小鼠血清中研究了[68Ga]DPA的稳定性,然后测试了[68Ga]DPA在PD-L1过表达肿瘤中的结合亲和力。此后,在胶质母细胞瘤异种移植模型中进行 PET 成像,以确认 [68Ga]DPA 是否是监测肿瘤中 PD-L1 表达的理想 PET 示踪剂。PET成像和DPA的结合不仅为克服PD-L1异质表达相关的挑战提供了一种新方法,而且还为开发基于D肽的放射性示踪剂奠定了基础。
研究方案
动物实验程序经南京医科大学动物伦理委员会或美国量子科学技术研究院批准。小鼠实验严格按照实验动物护理和使用委员会的机构准则进行。
1. 多肽合成
- 在温和的N2鼓泡下,将100mg 4-甲基苯甲胺(MBHA)树脂(负载量为0.37 mmol/g)在1 mL N-甲基-2-吡咯烷酮(NMP)中溶胀30分钟。
- 在 1 mL NMP 中制备由 Fmoc 保护氨基酸(5.0 当量)、HCTU(4.9 当量)和 DIPEA(10.0 当量)组成的新鲜储备缓冲液,然后加入树脂 (100 mg)。让偶联反应进行1.5-2小时。
- 在NMP中制备由50%(体积/体积)吗啉组成的脱保护缓冲液。在每次洗涤中用1mL脱保护缓冲液洗涤树脂(100mg)2×30分钟,以除去胺基上的Fmoc基团。用二氯甲烷(DCM;1 mL)洗涤树脂1分钟,去除DCM,再用NMP(1 mL)重新洗涤树脂1分钟。接下来,取出NMP并用DCM重新洗涤树脂1分钟。
注意: 所有洗涤程序均在温和的 N2 起泡下进行。重复上述过程,直到最后一个氨基酸。 - 为了向肽中加入1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA),用 N-(3-二甲氨基丙基)-N-乙基碳二亚胺盐酸盐(EDC·HCl)和 N-羟基琥珀酰亚胺(NHS)。孵育DOTA/EDC·HCl/NHS 在二甲基亚砜 (DMSO) 中以 1:1:1 的摩尔比溶液 3 小时,最终 DOTA 浓度为 1 M。接下来,将储备缓冲液(1mL)加入树脂(100mg)中,并让反应以温和的N2 起泡进行2小时。
注:1,4,7-三氮杂环壬烷-1,4,7-三乙酸(NOTA)也可用作 68Ga络合物的螯合剂。相同的程序可用于 NOTA 耦合。 - 使用DCM从顶部彻底冲洗树脂,并施加真空以同时除去残留的反应溶液。使用 DCM (1.5 mL) 冲洗树脂 3 次,然后用 MeOH (1.5 mL) 冲洗以收缩树脂。将树脂置于氮气下过夜,或在高真空下至少4小时,直到树脂变干。
- 将干燥的含 DPA 肽的树脂放入带螺旋盖的 2 mL 聚丙烯容器中。加入适当的裂解混合物(95/2.5/2.5 TFA/TIS/H2O体积;1 mL/100 mg树脂),并用螺旋盖密封容器。在20-25°C的通风橱中的轨道振荡器上轻轻搅拌反应2小时。
注意:由于三氟乙酸 (TFA) 具有高度腐蚀性,因此在穿着防护服的通风橱中制备三氟乙酸 (TFA)。 - 通过在通风橱中的氮气下蒸发除去大部分反式脂肪酸。通过加入乙醚(~1.5 mL/100 mg树脂)沉淀肽。
- 涡旋混合物以研磨肽并在室温(10,000× g,5分钟)下离心。小心地将溶剂从容器中倒出。重复步骤 1.7-1.8。
- 将残留物在打开的容器中风干10分钟。加入50%(体积/体积)乙腈水溶液,涡旋1-2秒以溶解产物(1mL/100mg树脂)。
- 通过过滤混合物除去树脂,然后使用 0.2 mL 50% (vol/vol) 乙腈水溶液洗涤树脂 2 次。混合滤液进行高效液相色谱(HPLC)纯化。使用以下HPLC条件。色谱柱:YMC-Triat-C18(内径 4.6 mm,150 mm,5 mm);溶剂梯度:溶剂A-去离子水;溶剂B-乙腈(0.1%TFA);流动时间:20分钟,用乙腈从10%到90%;流速:1 mL/min。
- 将收集的HPLC洗脱液在-80°C下冷冻过夜并冻干(-50°C和<1pa)。对于放射性标记,将固体肽溶解在终浓度为 1 mg/mL 的乙酸钠缓冲液(100 mM,pH 5.0)中作为储备缓冲液。
2. 68Ga放射性标记
注 68Ga是在南京第一医院(中国南京)使用 68Ge/68Ga发生器在内部产生的。
- 将 5 μL 储备缓冲液移液到带螺旋盖的 1.5 mL 聚丙烯容器中。向容器中加入 200 MBq [68Ga]GaCl3 (400 μL)。
- 涡旋混合物 5 秒。使用pH试纸测量pH值。用NaOH(0.1M)将pH调节至4-4.5。
注意:适当的pH值对于 68Ga和DOTA之间的络合至关重要。 - 将溶液在室温下孵育5-10分钟。在以下条件下,将反应混合物置于放射性HPLC中进行放射性标记产率分析:色谱柱:YMC-Triat-C18(内径4.6mm,150mm,5mm);溶剂梯度:溶剂A-去离子水;溶剂B-乙腈(0.1%TFA);流动时间:20分钟,用乙腈从10%到90%;流速:1 mL/min。
注意:放射性薄层色谱法(TLC)可用作检查放射性标记产率的替代方法。建议的TLC洗脱缓冲液为0.1 M Na3C6H5O7,pH 4。
3.示踪剂稳定性试验
- PBS示踪剂稳定性测试
- 将 [68Ga]DPA(10 μL,3.7 MBq,NaOAc 溶液)加入 PBS (990 μL) 中。在37°C下孵育1,2和4小时,轻微搅拌。
- 在每个时间点收集 200 μL 溶液。将其注入放射性HPLC进行分析。
- 小鼠血清中的示踪剂稳定性
- 将[68Ga]DPA(10μL,~3.7MBq,NaOAc溶液)加入小鼠血清(90μL,新鲜制备)中。在37°C下孵育1,2和4小时,轻微搅拌。
- 在每个时间点收集 20 μL 溶液。加入MeCN和水(100μL,1:1,v/v)。
- 将混合物离心10分钟(5,000× g,25°C)。使用放射性HPLC分析上清液。
4. 流式细胞术分析PD-L1表达
- 通过向 RPMI-1640 培养基补充 10% (vol/vol) 胎牛血清和 1% 青霉素-链霉素 (vol/vol) 来制备培养基。将U87MG细胞重悬于培养基中,并以105个细胞/孔的密度在12孔板中接种。将细胞置于培养箱(5%CO 2,37°C)中,培养至少24小时而不干扰。
- 用 0.5 mL PBS 洗涤细胞并加入 250 μL 胰蛋白酶-EDTA (0.25%)。将细胞放回培养箱(5%CO 2,37°C)2分钟。
- 加入 1 mL 培养基以阻止细胞解离。向细胞中加入培养基,通过上下移液将它们从培养皿中分离出来,并将它们收集在 1.5 mL 管中。将细胞离心5分钟(100× g)。
- 除去上清液并将细胞重悬于 1 mL PBS 中。将细胞离心5分钟(100× g)。再次重复此步骤。
- 用 3% 牛血清白蛋白 (BSA) 将异硫氰酸荧光素 (FITC) 偶联的 PD-L1 抗体稀释至 20 nmol/L。 加入细胞并在 4 °C 下孵育 1 小时。
- 将细胞离心5分钟(100× g),然后用冷PBS洗涤两次。使用流式细胞仪和分析软件分析PD-L1阳性细胞。
5. 免疫细胞化学
- 将U87MG细胞接种在玻璃底细胞培养皿(35mm)中,密度为每孔2.5×105 个细胞。当达到 60% 的汇合度时,吸出培养基并加入 1 mL PBS。轻轻摇晃几次,然后吸气。执行洗涤步骤 3 次。
- 在培养皿中加入 500 μL 4% 多聚甲醛。将细胞置于室温下并固定30分钟。
- 用PBS洗涤细胞3次。加入 1 mL 3% BSA(wt/vol,PBS 中),并在室温下封闭固定细胞 2 小时。
- 除去3%BSA,并将细胞与一抗PD-L1抗体(mAb,1:100,在3%BSA中稀释)在4°C下直接孵育过夜。
注意:用BSA封闭细胞后,不要用PBS洗涤。 - 用 3% BSA 缓冲液洗涤细胞 3 次。将细胞与FITC偶联的抗人IgG Fc二抗(1:500,在PBS中稀释)孵育1小时。
- 用PBS洗涤细胞3次。向细胞中加入 0.5 mL DAPI (1 μg/mL),并在室温下孵育 1 小时。用PBS洗涤染色的细胞3次,并使用共聚焦荧光显微镜观察。
6. 细胞摄取与抑制实验
- 细胞摄取实验
- 在 12 孔板中培养 U87MG 细胞,直至达到 80% 汇合度。取出培养基并用 0.5 mL PBS 洗涤细胞。
- 在新鲜培养基中将 [68Ga]DPA 稀释至 74 KBq/mL 浓度。向每个孔中加入 0.5 mL 稀释的 [68Ga]DPA 缓冲液。
- 将细胞与[68Ga] DPA在37°C下孵育不同持续时间(10,30,40和120分钟)。使用移液管吸出培养基。用PBS(0.5mL)洗涤细胞三次。
- 加入NaOH溶液(0.5 M,每孔300μL)裂解细胞。30 秒后,将粘性细胞裂解物收集在 1.5 mL 管中。
- 用 0.4 mL PBS 洗涤板两次。将洗涤液收集在上述 1.5 mL 管中。
- 启动自动伽马计数器内置电脑;将试管放入内置架子中。将所有样品装载到传送带上后,按 START 按钮。结果在内部软件中计算。读数记录每分钟衰减相关计数 (CPM)。
- 竞争性结合测定
- 在 12 孔板中培养 U87MG 细胞,直至达到 80% 汇合度。取出培养基并用 0.5 mL PBS 洗涤细胞。
- 在新鲜培养基中将 [68Ga]DPA 稀释至 74 KBq/mL 浓度。将适量的BMS202化合物溶解在10%DMSO中,得到10mM浓度(400μL)。
- 在 396 μL PBS 中稀释 4 μL 10 mM BMS202,以获得 100 μM 的浓度。 重复此步骤以产生各种浓度的 BMS202(1 μM、10 nM、100 pM 和 1 pM)。
- 向每个孔中加入 0.5 mL 稀释的 [68Ga]DPA 缓冲液(每孔 0.37 MBq)。向每个孔中加入 5 μL BMS202 溶液(每个浓度 3 个孔)。将细胞在37°C的细胞培养箱中孵育120分钟。
- 使用移液管吸出培养基。用 3 x 0.5 mL PBS 洗涤细胞。
- 加入NaOH溶液(0.5 M,每孔300μL)裂解细胞。30 秒后,将粘性细胞裂解物收集到 1.5 mL 管中。用 2 x 0.4 mL PBS 洗涤板。
- 将洗涤液收集在上述 1.5 mL 管中。将试管放入自动伽马计数器的内置架子中。
- 按照与步骤 6.1.6 相同的步骤操作。
7. PET成像
注意:使用微型 PET 扫描仪进行小动物 PET 成像,该扫描仪提供 159 个横向轴向切面,间隔 0.796 毫米(中心到中心),水平视野为 10 厘米,轴向视野为 12.7 厘米。在列表模式下收集的所有数据都组织成三维正弦图。然后将傅里叶重新组合成二维正弦图(帧×分钟:4 × 1、8 × 2、8 × 5)。
- 在本研究中使用雄性 5-8 周龄的 BALB/C 裸鼠。按照步骤 4.1-4.4 收集 U87MG 细胞并将细胞吸入 0.5 mL 注射器中。皮下注射细胞到小鼠体内(每个肿瘤1×10 6 个细胞,每只小鼠两个肿瘤)。注射后监测肿瘤生长,直到肿瘤体积为100-300mm3。
- 使用1%-2%(v / v)异氟醚(1mL / min)麻醉小鼠。打开加热装置,将PET的动物床保持在37°C。
- 将麻醉的小鼠放在PET机的动物床上的正确位置。将眼药膏涂抹在双眼上,以防止干燥。
注意:将小鼠保持在俯卧位,以避免在扫描过程中死亡。在整个成像过程中,使用预装的管 通过 鼻子给予异氟烷流量(1.0 mL / min)。 - 通过控制面板调整动物床的位置。通过预装的尾静脉导管静脉注射示踪剂(10-17 MBq / 100-200μL)。
- 使用参考软件在主机中创建扫描工作流(请参阅 材料表) 创建研究文件夹并根据制造商的协议设置采集协议。在 3D列表模式下对所有鼠标执行动态扫描(每只鼠标60分钟)。
- 按照制造商的协议定义直方图协议和重建协议。使用奈奎斯特截止值为 0.5 周期/像素的 Hanning 滤波器,通过滤波后背投重建 PET 动态图像(25-30 分钟和 55-60 分钟)。为所有小鼠生成最大强度投影 (MIP) 图像。
- 将协议组合到工作流中并运行工作流。按照制造商的协议,使用软件分析生成的三维图像。
注意:使用模拟软件选择感兴趣的体积。放射性根据注射时间进行衰变校正,并表示为总注射剂量/每克组织的百分比(% ID/g)。
8. 离体 生物分布
- 通过尾静脉注射给予携带U87MG的BALB / C裸鼠[68Ga]DPA(1.85 MBq / 100μL)。用1%-2%(v / v)异氟醚(1mL / min)麻醉小鼠,然后在注射5,30,60和120分钟后通过宫颈脱位处死三只小鼠。
注意:演示此程序的个人应接受颈椎脱位技术技能的培训,以确保迅速诱发意识丧失。这将确保本实验中的安乐死程序都是人道的。 - 确认死亡后,打开小鼠的胸壁。然后,敞开心扉。使用 1 mL 注射器抽血;将注射器中的血液挤压到放射免疫测定 (RIA) 管(直径 13 mm)中,用于伽马计数器。
- 切除主要器官和肿瘤,并将它们放入 RIA 管(直径 13 毫米)中用于伽马计数器。主要器官包括全血、心脏、胸腺、肝脏、脾脏、骨骼、胃、肾脏、肌肉、肠淋巴结、小肠、胰腺、睾丸、脑和肺。称量所有器官。
- 使用自动伽马计数器测量收集器官内的放射性,并对值进行衰变校正。计算每克湿组织的注射剂量百分比(% ID / g)。
9. 免疫组化
- 收集胶质瘤组织并用PBS清洗3次。将新鲜组织置于4%多聚甲醛中,并在4°C下固定过夜。
- 将固定组织嵌入石蜡中,并将其切成10μm的厚度。将切片置于培养箱(60°C)中并孵育2小时。通过在以下各孵育10分钟来脱蜡和水合:二甲苯(两次),无水酒精,95%酒精,90%酒精,80%酒精,75%酒精。
- 将切片放入0.01M柠檬酸钠中,加热至92-95°C。 保持温度40分钟,实现抗原修复。
- 向切片中加入200μLH2O2 溶液(3%),并在室温下灭活内过氧化物酶10分钟。通过在室温下用3%BSA处理2小时来阻断非特异性位点。
- 将一抗PD-L1抗体(mAb,1:100,用3%BSA稀释)中的切片在4°C下孵育过夜。
注意:用 BSA 阻塞后,不要用 PBS 清洗。 - 用 PBS 清洗部分 3 次。将切片与HRP标记的山羊抗兔二抗(1:500,在PBS中稀释)在室温下孵育1小时。
- 用PBS洗涤细胞3次。向切片中加入200μL3,3-二氨基联苯胺(DAB)工作溶液(溶液A:溶液B:溶液C = 1:1:18),并在黑暗中孵育5分钟。
- 用 PBS 清洗部分 3 次。加入500μL苏木精溶液(100%),在室温下孵育5分钟。用水清洗切片 30 秒。将切片放入分化溶液(75%酒精:HCL = 99:1)中30秒。用水清洗切片 1 分钟。
- 通过依次用75%酒精,80%酒精,90%酒精,95%酒精,无水酒精和二甲苯(两次)(每次10分钟)孵育来使样品脱水。使用中性树脂安装所有部分,并在光学显微镜下观察它们。
结果
[68Ga]DPA 放射性标记和稳定性
模型肽 DPA 是一种有效的 PD-L1 拮抗剂。DOTA-DPA纯度>95%,收率为68%。实验观察到DOTA-DPA的质量为1,073.3([M+2H]2+)。 68镓被认为是一种合适的放射性核素,用于标记用于 PET 成像的肽,因此被选为本研究对象。为了用 68Ga(半衰期:68分钟)对DPA进行放射性标记,合成了DOTA-PEG3-DPA(图1A)。DOTA被用作 68Ga放射性标记的螯合剂。为了将DOTA和DPA分开,PEG3被用作连接器。[68Ga]-DOTA-PEG3-DPA(在以下文本中称为[68Ga]DPA)显示出高放射化学产率(>95%)和放射化学纯度(>95%)(表1)。还使用HPLC进行了示踪剂稳定性测试,结果表明[68Ga]DPA在PBS和小鼠血清中都具有很好的稳定性。在37°C下孵育4小时后未检测到 68Ga分解或肽水解(图1B)。
PD-L1在U87MG细胞中的表达
先前的一项研究表明,PD-L1 表达增加与胶质母细胞瘤肿瘤患者生存率低相关,表明 PD-L1 可能是胶质母细胞瘤48 中显着的预后生物标志物和治疗靶点。因此,使用人胶质母细胞瘤细胞系U87MG建立肿瘤模型,以确定PET/CT中[68Ga]DPA对PD-L1肿瘤成像的疗效。流式细胞术结果表明,大约 60% 的 U87MG 细胞为 PD-L1 阳性(图 2A)。此外,免疫荧光染色证实了 PD-L1 在 U87MG 细胞中的强表达(图 2B)。总之,这些数据表明U87MG细胞系适合本研究。
[68Ga]DPA 的细胞摄取和特异性
U87MG细胞对[68Ga]DPA的摄取呈现出时间依赖性模式。当PD-L1抑制剂BMS202用作封闭剂时,[68Ga]DPA的结合部分和摄取显着降低(图3A)。竞争性结合试验进一步检查了BMS202与U87MG细胞的结合亲和力(Ki)。当使用 [68Ga]DPA 作为竞争品时,BMS202 的估计结合亲和力为 43.8 ± 8.6 nmol/L(图 3B)。
肿瘤模型的 [68Ga]DPA PET 成像
在U87MG荷瘤BALB/C裸鼠中进行[68Ga]DPA的PET成像。[68嘎]通过静脉注射给药DPA,直到U87MG肿瘤生长到100mm3。全身PET图像显示,注射30分钟和60分钟后,肿瘤中的[68Ga]DPA积聚量很高,肾脏和膀胱的积聚量最高(图4A)。为了确认 [68Ga]DPA 是否在 PD-L1 阳性肿瘤中特异性积累,使用另一种携带 PanNET 细胞系 Bon-1 的小鼠模型作为阴性对照。一项平行实验表明,在注射后60分钟,Bon-1肿瘤中的[68Ga]DPA积累很少(图4B)。
为了阐明这种差异,进行了免疫组织化学染色以分析肿瘤组织中PD-L1的表达。结果显示,U87MG细胞呈现出相当高的PD-L1表达(图5A,C),但Bon-1肿瘤没有(图5B,C)。这些数据与PET结果一致。因此,不同的肿瘤细胞生长状态可能导致不同的PD-L1表达(例如,组织坏死)。为了验证这一点,进行了苏木精和伊红 (H&E) 染色。正如预期的那样,在两个肿瘤组织之间观察到相似的细胞形态(图5D)。
[68Ga]DPA在U87MG肿瘤中的离体生物分布
还使用携带U87MG的小鼠进行了 离体 生物分布研究(表2)。结果显示血液和大多数分析器官(包括心脏、肝脏、肺和肌肉)的快速清除。肾脏积累的放射性量最高,从 5 分钟到 120 分钟的清除率为 0.12% ID/(g∙min)。肿瘤在所有时间点都表现出第二高的示踪剂摄取。此外,从注射后 5 分钟到 60 分钟,肿瘤呈现出较低的示踪剂清除率,为 0.027% ID/(g∙min)。血液的清除率为0.069% ID/(g∙min),而肌肉的清除率为0.037% ID/(g∙min)。
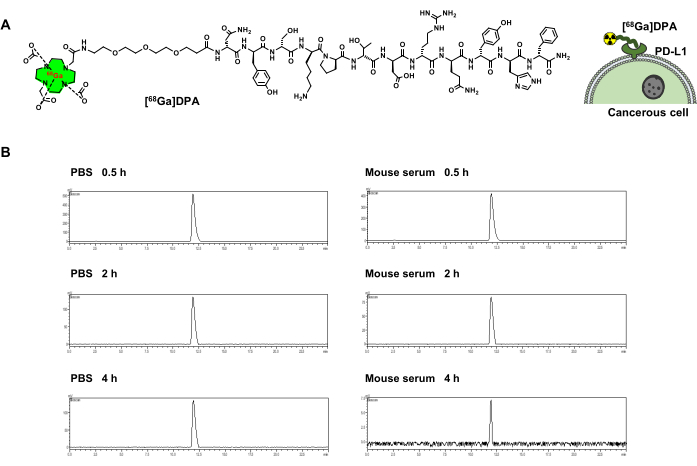
图 1:[68Ga]DPA 放射性标记和稳定性。 (A) [68Ga]DPA的化学结构及其与表达PD-L1的肿瘤细胞结合的示意图。(B) HPLC 曲线显示 [68Ga]DPA 与 PBS 或小鼠血清孵育 0.5、2 和 4 小时后的放射性。该图是从胡等人47修改而来的。缩写:DPA=十二肽拮抗剂;PD-L1 = 程序性死亡配体 1;PBS = 磷酸盐缓冲盐水;HPLC = 高效液相色谱法。 请点击这里查看此图的较大版本.
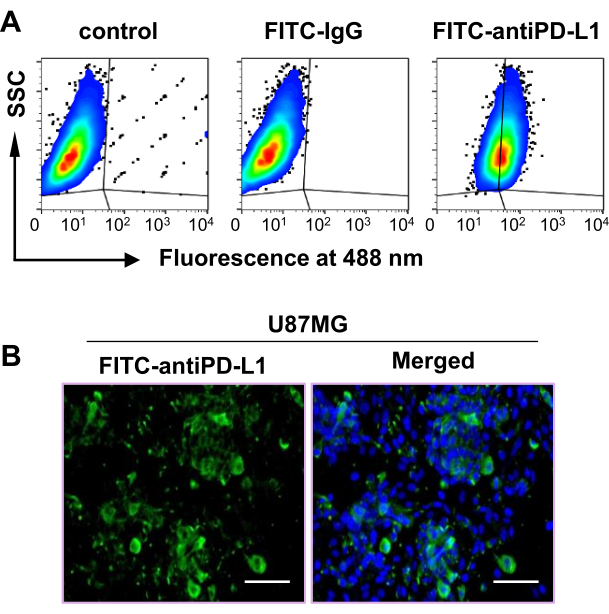
图2:PD-L1在U87MG细胞系中的表达。 (A)通过流式细胞术分析测量U87MG细胞系中PD-L1的表达。(B)免疫荧光染色法测定U87MG细胞中PD-L1的表达。比例尺 = 100 μm。该图是从胡等人47修改而来的。缩写:PD-L1 = 程序性死亡配体 1;SSC = 侧向散射;FITC = 异硫氰酸荧光素。 请点击这里查看此图的较大版本.
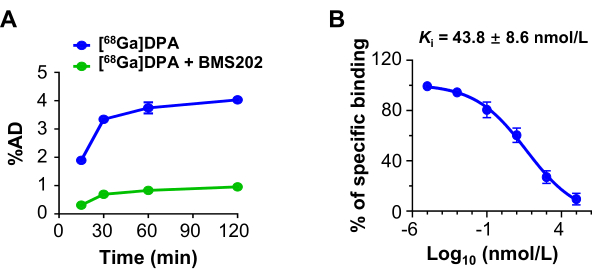
图 3:细胞摄取和抑制 [68Ga]DPA。 (A) 与 [68Ga]DPA (0.74 MBq/mL) 或 [68Ga]DPA (0.74 MBq /mL) + BMS202 (100 μmol/L) 孵育不同持续时间时 U87MG 细胞的摄取。(B) [68Ga]DPA (0.74 MBq /mL) 与 BMS202 孵育后与 U87MG 细胞的竞争性结合。Ki 值显示在面板中。该图是从胡等人47修改而来的。缩写:DPA=十二肽拮抗剂;%AD = 给药剂量(相对于结合部分)。 请点击这里查看此图的较大版本.

图 4:PD-L1 过表达 U87MG 肿瘤中 [68Ga]DPA 的 PET 成像。 (A,B) PET-CT 图像显示静脉注射 (~18.5 MBq) 30 分钟和 60 分钟后 [68Ga]DPA 在携带 U87MG 的小鼠 (A) 和 Bon-1 的小鼠(阴性对照 ,B)中的分布。显示了具有代表性的最大强度投影 (MIP)(上图)和横向 PET-CT 图像(下图)。肿瘤位置用白色虚线圆圈标记。该图由胡等人修改而来。47.缩写:DPA=十二肽拮抗剂;PD-L1 = 程序性死亡配体 1;PET-CT = 正电子发射断层扫描-计算机断层扫描;MIP = 最大强度投影;P.I. = 注射后。 请点击这里查看此图的较大版本.

图 5:[68Ga]DPA 处理肿瘤的免疫组织化学分析。 (甲、乙)PD-L1 在 (A) U87MG 和 (B) Bon-1 肿瘤中的全切片免疫组织化学图像。(C) A 和 B标记区域的放大图片。(D)U87MG和Bon-1肿瘤的H&E染色。比例尺 = 100 μm (C,D)。该图是从胡等人47修改而来的。缩写:DPA=十二肽拮抗剂;PD-L1 = 程序性死亡配体 1;H&E = 苏木精和伊红。 请点击这里查看此图的较大版本.
| 示 踪 剂 | [68嘎]DPA协议 |
| 放射化学产率 (%) | >95 |
| 摩尔活性 (GBq μmol-1) | 37 ± 8 |
| 放射化学纯度a (%) | >95 |
表1:[68Ga]DPA的放射性标记和质量控制。 [68Ga]DPA 的放射化学产率、摩尔活性和放射化学纯度。数据表示为标准差±均值 (n = 7)。此表是从胡等人47修改而来的。缩写:DPA=十二肽拮抗剂。 一个在优化条件下,通过反相HPLC分析[68Ga]DPA的放射化学纯度:1)色谱柱:YMC-Triat-C18(内径4.6 mm,150 mm,5 mm);2)溶剂梯度:溶剂A-去离子水;溶剂B-乙腈(0.1%三氟乙酸);流动时间:20分钟,用乙腈从10%到90%;流速为 1 mL/min。
| [68嘎]DPA协议 | ||||||||
| 5 分钟 | 30 分 | 60 分 | 120 分 | |||||
| 血 | 3.89 | ±0.43 | 1.55 | ±1.07 | 0.11 | ±0.02 | 0.05 | ±0.01 |
| 心 | 1.19 | ±0.39 | 0.52 | ±0.33 | 0.06 | ±0.02 | 0.05 | ±0.02 |
| 肝 | 1.06 | ±0.26 | 0.59 | ±0.43 | 0.19 | ±0.02 | 0.16 | ±0.04 |
| 脾 | 0.98 | ±0.14 | 0.68 | ±0.67 | 0.14 | ±0.06 | 0.09 | ±0.03 |
| 肺 | 1.64 | ±0.42 | 1.03 | ±0.9 | 0.13 | ±0.05 | 0.09 | ±0.02 |
| 肾 | 19.23 | ±1.95 | 16.13 | ±1.51 | 11.5 | ±0.44 | 5.2 | ±0.31 |
| 胃 | 1.54 | ±0.1 | 0.61 | ±0.35 | 0.08 | ±0.01 | 0.08 | ±0.03 |
| 肠的 | 0.72 | ±0.27 | 0.47 | ±0.35 | 0.08 | ±0.02 | 0.06 | ±0.03 |
| 胰腺 | 1.88 | ±0.28 | 0.77 | ±0.75 | 0.16 | ±0.03 | 0.13 | ±0.03 |
| 肌肉 | 2.21 | ±0.27 | 0.71 | ±0.37 | 0.18 | ±0.02 | 0.14 | ±0.04 |
| 骨 | 2.18 | ±0.11 | 0.85 | ±0.51 | 0.26 | ±0.09 | 0.14 | ±0.06 |
| 脑 | 0.19 | ±0.04 | 0.11 | ±0.08 | 0.03 | ±0.01 | 0.02 | ±0.01 |
| 瘤 | 4.5 | ±0.32 | 3.77 | ±0.27 | 2.99 | ±0.03 | 0.89 | ±0.19 |
| 脂肪 | 2.09 | ±0.49 | 0.81 | ±0.12 | 0.27 | ±0.07 | 0.1 | ±0.07 |
表2:U87MG荷瘤小鼠不同持续时间(每个时间点n = 3)后[68Ga]DPA的生物分布 。此表修改自 胡 et al.47。缩写:DPA=十二肽拮抗剂。
讨论
该方法中描述的关键步骤包括将 68Ga 有效标记为 DPA,并选择合适的 PET 成像时间窗口,该时间窗口必须与肿瘤中 DPA 的药效学模式完全匹配。
与 IHC 相比,PET 成像能够以无创方式实时检测全身 PD-L1 表达,从而可以可视化异质性肿瘤中的每个阳性区域 6,7。选择肽作为配体,以避免抗体和小分子的缺点。大分子量的抗体一般循环半衰期较长,对健康器官的毒性较高。小分子的清除通常太快,无法达到所需的肿瘤保留。肽的分子量介于抗体和小分子之间。这使得基于肽的放射性示踪剂能够以最小的毒性实现长期的肿瘤保留和良好的组织渗透13,49,50,51,52,53。重要的是,D-肽DPA的效用,而不是通常报道的L-肽,赋予[68Ga]DPA显著延长的代谢半衰期。此外,DPA在体内带正电和亲水,因此具有高溶解度,可以避免血液中的非特异性靶向,有利于生成具有高质量成像质量的PET图像。
值得注意的是,成功的 68Ga 放射性标记需要特定的 pH 值,并且没有过渡金属离子(如 Cu (II) 和 Fe (III) 阳离子)的干扰。在某些情况下,Cu2+ 污染会导致放射化学产率低。因此,确保所有容器和移液器吸头不被污染至关重要。此外,在该方法中,U87MG用于肿瘤接种。尽管PD-L1在U87MG异种移植物中的表达在先前的研究中得到了验证,但其表达在个体动物中有所不同。因此,示踪剂在U87MG肿瘤中的绝对摄取因个体小鼠而异。为确保肿瘤中有效的示踪剂摄取,必须选择具有适当肿瘤大小(500 mm3 <体积< 100 mm3)的动物进行PET扫描。
[68Ga]DPA 的局限性之一是,与其他几种 PD-L1 靶向肽(如 WL12)相比,DPA 与 PD-L1 的结合亲和力相对较低,这使得它不适合 PD-L1 表达相对较低的肿瘤26,47。D肽的进一步修饰将提高其特异性结合能力。此外,为了增强[68Ga]DPA的成像效果,可以优化注射策略的配方,例如,通过在[68Ga]DPA之前同时注射未标记的DPA来阻断非特异性结合位点54,55,56。
总之,本研究开发了一种非侵入性和实时方法,使用[68Ga]DPA作为放射性示踪剂来跟踪PD-L1在活体动物体内的分布。结果显示,[68Ga]DPA具有相对较高的体内特异性结合亲和力、良好的稳定性和出色的成像能力,表明[68Ga]DPA-PET是一种很有前途的可视化PD-L1过表达肿瘤的方法。此外,当用其他放射性核素(如 177Lu 和 225Ac)标记 DPA 时,该技术还可用于治疗 PD-L1 阳性肿瘤。因此,DPA放射性标记技术不仅克服了IHC依赖性诊断的局限性,而且为治疗提供了新的选择。
披露声明
没有宣布任何竞争利益。
致谢
本研究得到了中国医学科学院非营利性中央研究所基金(编号:2022-RC350-04)和中国医学科学院医学科学创新基金(编号:2021-I2M-1-026、2022-I2M-1-026-1、02120101、02130101和2022-I2M-2-002)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid (DOTA) | Merck | 60239-18-1 | 68Ga chelation |
| 3,3-diaminobenzidine (DAB) Kit | Sigma-Aldrich | D7304-1SET | Immunohistochemistry |
| anti-PD-L1 monoclonal antibody | Wuhan Proteintech | 17952-1-ap | Immunohistochemistry: primary antibody |
| BMS202 | Selleck | 1675203-84-5 | Competitive binding assay: inhibitor |
| BSA | Merck | V900933 | Immunofluorescent : blocking |
| DAPI | Merck | D9542 | Immunofluorescent: staining of nucleus |
| Dichloromethane (DCM) | Merck | 34856 | Solvent |
| DIPEA | Merck | 3439 | Peptide coupling |
| EDC·HCl | Merck | E6383 | Activation of DOTA |
| FBS | Gibco | 10099 | Cell culture: supplement |
| FITC-conjugated anti-human IgG Fc Antibody | Biolegend | 409310 | Immunofluorescent: secondary antibody |
| FITC-conjugated anti PD-L1 antibody | Biolegend | 393606 | Flow cytometry: direct antibody |
| HCTU | Energy Chemical | E070004-25g | Peptide coupling |
| HRP labeled goat anti-rabbit antibody | Servicebio | GB23303 | Immunohistochemistry: secondary antibody |
| Hydroxysuccinimide (NHS) | Merck | 130672 | Activation of DOTA |
| MeCN | Merck | PHR1551 | Solvent |
| Morpholine | Merck | 8.06127 | Fmoc- deprotection |
| NMP | Merck | 8.06072 | Solevent |
| Paraformaldehyde | Merck | 30525-89-4 | Fixation of tissues |
| PBS | Gibco | 10010023 | Cell culture: buffer |
| Penicillin-streptomycin | Gibco | 10378016 | Cell culture: supplement |
| RIA tube | PolyLab | P10301A | As tissue sample container |
| RPMI-1640 medium | Gibco | 11875093 | Cell culture: basic medium |
| Sodium acetate | Merck | 1.06264 | Salt for buffer |
| Trypsin-EDTA | Gibco | 25200056 | Cell culture: dissociation agent |
| U87MG cell line | Procell Life Science & Technology Co | CL-0238 | Cell model |
| Equipment | |||
| 68Ge/68Ga generator | Isotope Technologies Munich, ITM | Not applicable | Generation of [68Ga] |
| Autogamma counter | Perkin Elmer | Wizard2 | Detection of radioactivity |
| Confocal fluorescent microscopy | Keyence | Observation of immunofluorescent results | |
| Flow cytometer | Becton Dickinson, BD | LSRII | Monitoring the PD-L1 positive cells |
| High-performance liquid chromatography (HPLC) | SHIMAZU | LC-20AT | Purification of DPA peptide |
| PET scanner | Siemens Medical Solutions | Inveon MultiModality System | PET imaging |
| Optical microscopy | Nikon | Eclipse E100 | Observation of immunohistochemistry results |
| Solid phase peptide synthesizer | Promega Vac-Man Laboratory Vacuum Manifold | LOT#11101 | Synthesis of DPA-DOTA peptide |
| Software | |||
| ASIPro | Siemens Medical Solutions | Not applicable | Analysis of PET-CT results |
| FlowJo | Becton Dickinson, BD | FlowJo 7.6.1 | Analysis of the flow cytometer results |
| Inveon Acquisition Workplace (IAW) | Siemens Medical Solutions | Not applicable | Management of PET mechine |
| Prism | Graphpad | Prism 8.0 | Analysis of the data |
参考文献
- Doroshow, D. B., et al. PD-L1 as a biomarker of response to immune-checkpoint inhibitors. Natire Reviews Clinical Oncology. 18 (6), 345-362 (2021).
- Krutzek, F., Kopka, K., Stadlbauer, S. Development of radiotracers for imaging of the PD-1/PD-L1 axis. Pharmaceuticals. 15 (6), 747 (2022).
- Topalian, S. L., Drake, C. G., Pardoll, D. M. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell. 27 (4), 450-461 (2015).
- Pardoll, D. M. The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer. 12 (4), 252-264 (2012).
- Xiao, Z., et al. PEIGel: A biocompatible and injectable scaffold with innate immune adjuvanticity for synergized local immunotherapy. Materials Today Bio. 15, 100297 (2022).
- Teng, M. W. L., Ngiow, S. F., Ribas, A., Smyth, M. J. Classifying cancers based on T-cell infiltration and PD-L1. Cancer Research. 75 (11), 2139-2145 (2015).
- Dolled-Filhart, M., et al. Development of a companion diagnostic for pembrolizumab in non-small cell lung cancer using immunohistochemistry for programmed death ligand-1. Archives of Pathology & Laboratory Medicine. 140 (11), 1243-1249 (2016).
- Meng, X. J., Huang, Z. Q., Teng, F. F., Xing, L. G., Yu, J. M. Predictive biomarkers in PD-1/PD-L1 checkpoint blockade immunotherapy. Cancer Treatment Reviews. 41 (10), 868-876 (2015).
- Hakozaki, T., Hosomi, Y., Kitadai, R., Kitagawa, S., Okuma, Y. Efficacy of immune checkpoint inhibitor monotherapy for patients with massive non-small-cell lung cancer. Journal of Cancer Research and Clinical Oncology. 146 (11), 2957-2966 (2020).
- Haslam, A., Prasad, V. Estimation of the percentage of US patients with cancer who are eligible for and respond to checkpoint inhibitor immunotherapy drugs. Jama Network Open. 2 (5), 192535 (2019).
- Willmann, J. K., van Bruggen, N., Dinkelborg, L. M., Gambhir, S. S. Molecular imaging in drug development. Nature Reviews Drug Discovery. 7 (7), 591-607 (2008).
- Zhang, L., et al. Recent developments on PET radiotracers for TSPO and their applications in neuroimaging. Acta Pharmaceutica Sinica B. 11 (2), 373-393 (2021).
- Sun, J., et al. Imaging-guided targeted radionuclide tumor therapy: From concept to clinical translation. Advanced Drug Delivery Reviews. 190, 114538 (2022).
- Xu, M., et al. Preclinical study of a fully human Anti-PD-L1 antibody as a theranostic agent for cancer immunotherapy. Molecular Pharmaceutics. 15 (10), 4426-4433 (2018).
- Niemeijer, A. N., et al. Whole body PD-1 and PD-L1 positron emission tomography in patients with non-small-cell lung cancer. Nature Communications. 9 (1), 4664 (2018).
- Mayer, A. T., et al. Practical immuno-PET radiotracer design considerations for human immune checkpoint imaging. Journal of Nuclear Medicine. 58 (4), 538-546 (2017).
- Lv, G., et al. PET Imaging of tumor PD-L1 expression with a highly specific nonblocking single-domain antibody. Journal of Nuclear Medicine. 61 (1), 117-122 (2020).
- Li, D., et al. Immuno-PET imaging of 89Zr labeled anti-PD-L1 domain antibody. Molecular Pharmaceutics. 15 (4), 1674-1681 (2018).
- Lesniak, W. G., et al. PD-L1 detection in tumors using [(64)Cu]Atezolizumab with PET. Bioconjugate Chemistry. 27 (64), 2103-2110 (2016).
- Kristensen, L. K., et al. CD4(+) and CD8a(+) PET imaging predicts response to novel PD-1 checkpoint inhibitor: studies of Sym021 in syngeneic mouse cancer models. Theranostics. 9 (26), 8221-8238 (2019).
- Christensen, C., Kristensen, L. K., Alfsen, M. Z., Nielsen, C. H., Kjaer, A. Quantitative PET imaging of PD-L1 expression in xenograft and syngeneic tumour models using a site-specifically labelled PD-L1 antibody. European Journal of Nuclear Medicine and Molecular Imaging. 47 (5), 1302-1313 (2020).
- Bensch, F., et al. 89Zr-atezolizumab imaging as a non-invasive approach to assess clinical response to PD-L1 blockade in cancer. Nature Medicine. 24 (12), 1852-1858 (2018).
- Gonzalez Trotter, D. E., et al. In vivo imaging of the programmed death ligand 1 by 18F PET. Journal of Nuclear Medicine. 58 (11), 1852-1857 (2017).
- Lv, G., et al. Promising potential of a 18F-labelled small-molecular radiotracer to evaluate PD-L1 expression in tumors by PET imaging. Bioorganic Chemistry. 115, 105294 (2021).
- Miao, Y., et al. One-step radiosynthesis and initial evaluation of a small molecule PET tracer for PD-L1 imaging. Bioorganic & Medicinal Chemical Letters. 30 (24), 127572 (2020).
- Kumar, D., et al. Peptide-based PET quantifies target engagement of PD-L1 therapeutics. The Journal of Clinical Investigation. 129 (2), 616-630 (2019).
- Powles, T., et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature. 515 (7528), 558-562 (2014).
- Herbst, R. S., et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature. 515 (7528), 563-567 (2014).
- Marciscano, A. E., Gulley, J. L. Avelumab demonstrates promise in advanced NSCLC. Oncotarget. 8 (61), 102767-102768 (2017).
- Vaddepally, R. K., Kharel, P., Pandey, R., Garje, R., Chandra, A. B. Review of indications of FDA-approved immune checkpoint inhibitors per NCCN guidelines with the level of evidence. Cancers. 12 (3), 738 (2020).
- Antonia, S. J., et al. Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. The New England Journal of Medicine. 377 (20), 1919-1929 (2017).
- Wang, D. Y., et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis. JAMA Oncology. 4 (12), 1721-1728 (2018).
- Sgouros, G., Bodei, L., McDevitt, M. R., Nedrow, J. R. Radiopharmaceutical therapy in cancer: clinical advances and challenges. Nature Reviews Drug Discovery. 19 (9), 589-608 (2020).
- (US) M. M. M, et al. Macrocyclic inhibitors of the pd-1/pd-l1 and cd80(b7-1)/pd-l1 protein/protein interactions. United States patent. , (2014).
- Chatterjee, S., et al. Rapid PD-L1 detection in tumors with PET using a highly specific peptide. Biochemical and Biophysical Research Communications. 483 (1), 258-263 (2017).
- De Silva, R. A., et al. Peptide-based 68Ga-PET radiotracer for imaging PD-L1 expression in cancer. Molecular Pharmaceutics. 15 (9), 3946-3952 (2018).
- Lesniak, W. G., et al. Development of [18F]FPy-WL12 as a PD-L1 specific PET imaging peptide. Molecular Imaging. 18, 1536012119852189 (2019).
- Zhou, X., et al. First-in-humans evaluation of a PD-L1-binding peptide PET radiotracer in non-small cell lung cancer patients. Journal of Nuclear Medicine. 63 (4), 536-542 (2022).
- Hu, K., et al. Developing native peptide-based radiotracers for PD-L1 PET imaging and improving imaging contrast by pegylation. Chemical Communications. 55 (29), 4162-4165 (2019).
- Liu, H., et al. A novel small cyclic peptide-based 68Ga-Radiotracer for positron emission tomography imaging of PD-L1 expression in tumors. Molecular Pharmaceutics. 19 (1), 138-147 (2022).
- Rabideau, A. E., Pentelute, B. L. A D-amino acid at the N-terminus of a protein abrogates its degradation by the N-end rule pathway. ACS Central Science. 1 (8), 423-430 (2015).
- Uppalapati, M., et al. A potent D-protein antagonist of VEGF-A is nonimmunogenic, metabolically stable, and longer-circulating in vivo. ACS Chemical Biology. 11 (4), 1058-1065 (2016).
- Garton, M., et al. Method to generate highly stable D-amino acid analogs of bioactive helical peptides using a mirror image of the entire PDB. Proceedings of the National Academy of Sciences. 115 (7), 1505-1510 (2018).
- Jia, F. J., et al. D-amino acid substitution enhances the stability of antimicrobial peptide polybia-CP. Acta Biochimica et Biophysica Sinica. 49 (10), 916-925 (2017).
- Carmona, G., Rodriguez, A., Juarez, D., Corzo, G., Villegas, E. Improved protease stability of the antimicrobial peptide Pin2 substituted with D-amino acids. Protein Journal. 32 (6), 456-466 (2013).
- Feng, Z., Xu, B. Inspiration from the mirror: D-amino acid containing peptides in biomedical approaches. Biomolecular Concepts. 7 (3), 179-187 (2016).
- Hu, K., et al. Whole-body PET tracking of a d-dodecapeptide and its radiotheranostic potential for PD-L1 overexpressing tumors. Acta Pharmaceutica Sinica. B. 12 (3), 1363-1376 (2022).
- Qiu, X. Y., et al. PD-L1 confers glioblastoma multiforme malignancy via Ras binding and Ras/Erk/EMT activation. Biochimica Et Biophysica Acta. Molecular Basis of Disease. 1864, 1754-1769 (2018).
- Hu, K., et al. Development of a stable peptide-based PET tracer for detecting CD133-expressing cancer cells. ACS Omega. 7 (1), 334-341 (2021).
- Jin, Z. -. H., et al. Radiotheranostic agent 64Cu-cyclam-RAFT-c(-RGDfK-)4 for management of peritoneal metastasis in ovarian cancer. Clinical Cancer Research. 26 (23), 6230-6241 (2020).
- Hu, K., et al. Harnessing the PD-L1 interface peptide for positron emission tomography imaging of the PD-1 immune checkpoint. RSC Chemical Biology. 1 (4), 214-224 (2020).
- Hu, K., et al. PET imaging of VEGFR with a novel 64Cu-labeled peptide. ACS Omega. 5 (15), 8508-8514 (2020).
- Hu, K., et al. An in-tether chiral center modulates the helicity, cell permeability, and target binding affinity of a peptide. Angewandte Chemie International Edition. 55 (28), 8013-8017 (2016).
- Zhao, J., et al. Concurrent injection of unlabeled antibodies allows positron emission tomography imaging of programmed cell death ligand 1 expression in an orthotopic pancreatic tumor model. ACS Omega. 5 (15), 8474-8482 (2020).
- Moroz, A., et al. A preclinical assessment of 89Zr-atezolizumab identifies a requirement for carrier added formulations not observed with 89Zr-C4. Bioconjugate Chemistry. 29 (10), 3476-3482 (2018).
- Nedrow, J. R., et al. Imaging of programmed cell death ligand 1: impact of protein concentration on distribution of anti-PD-L1 SPECT agents in an immunocompetent murine model of melanoma. Journal of Nuclear Medicine. 58 (10), 1560-1566 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。