Method Article
Desarrollo de un trazador PET de péptido D marcado con 68galios para la obtención de imágenes de la expresión del ligando de muerte programada 1
* Estos autores han contribuido por igual
En este artículo
Resumen
Este estudio desarrolló un método no invasivo y en tiempo real para evaluar la distribución del ligando de muerte programada 1 en todo el cuerpo, basado en imágenes tomográficas por emisión de positrones del antagonista del D-docapéptido [68Ga]. Esta técnica tiene ventajas sobre la inmunohistoquímica convencional y mejora la eficiencia de la identificación de los pacientes apropiados que se beneficiarán de la terapia de bloqueo de puntos de control inmunitario.
Resumen
El desarrollo de la terapia de bloqueo de puntos de control inmunitario basada en la proteína de muerte celular programada 1 (PD-1)/ligando de muerte programada 1 (PD-L1) ha revolucionado las terapias contra el cáncer en los últimos años. Sin embargo, solo una fracción de los pacientes responde a los inhibidores de PD-1/PD-L1, debido a la expresión heterogénea de PD-L1 en las células tumorales. Esta heterogeneidad presenta un desafío en la detección precisa de células tumorales mediante el enfoque de inmunohistoquímica (IHQ) comúnmente utilizado. Esta situación requiere mejores métodos para estratificar a los pacientes que se beneficiarán de la terapia de bloqueo de puntos de control inmunitario, para mejorar la eficacia del tratamiento. La tomografía por emisión de positrones (PET) permite la visualización en tiempo real de la expresión de PD-L1 en todo el cuerpo de forma no invasiva. Por lo tanto, existe la necesidad de desarrollar trazadores radiomarcados para detectar la distribución de PD-L1 en tumores a través de imágenes PET.
En comparación con sus homólogos L, los péptidos dextrorotatorios (D) tienen propiedades como la resistencia proteolítica y una vida media metabólica notablemente prolongada. Este estudio diseñó un nuevo método para detectar la expresión de PD-L1 basado en imágenes PET de 68péptidos D dirigidos a PD-L1 marcados con Ga, un antagonista de D-dodecapéptido (DPA), en ratones portadores de tumores. Los resultados mostraron que el [68Ga]DPA puede unirse específicamente a los tumores que sobreexpresan PD-L1 in vivo, y mostraron una estabilidad favorable, así como una excelente capacidad de imagen, lo que sugiere que [68Ga]DPA-PET es un enfoque prometedor para la evaluación del estado de PD-L1 en tumores.
Introducción
El descubrimiento de las proteínas de los puntos de control inmunitario supuso un gran avance en la terapia tumoral y ha dado lugar a importantes avances en el desarrollo de la terapia de bloqueo de los puntos de control inmunitario1. La proteína de muerte celular programada 1 (PD-1) y el ligando de muerte programada 1 (PD-L1) son dianas farmacológicas potenciales con varios anticuerpos aprobados por la Administración de Alimentos y Medicamentos (FDA). La PD-1 se expresa en las células inmunitarias infiltrantes del tumor, como las células T CD4+, CD8+ y las células T reguladoras. PD-L1 es uno de los ligandos de PD-1, que está sobreexpresado en una variedad de células tumorales 2,3. La interacción entre PD-1 y PD-L1 inactiva PD-1, suprimiendo así la respuesta inmune antitumoral4. Estos hallazgos sugieren que la inhibición de PD-L1 puede mejorar el efecto letal de las células inmunitarias y eliminar las célulastumorales 5. Actualmente, la inmunohistoquímica cromogénica (IHQ) es el enfoque más utilizado para identificar a los pacientes que tienen más probabilidades de responder a la terapia con puntos de control inmunitario 6,7. Sin embargo, debido a la expresión heterogénea de PD-L1 en las células tumorales, los resultados de IHQ de las biopsias no pueden proporcionar información precisa sobre la expresión de PD-L1 en los pacientes8. Estudios previos han reportado que solo el 20%-40% de los pacientes obtienen beneficios a largo plazo de la terapia de bloqueo de puntos de control inmunológico 1,9,10. Por lo tanto, existe una necesidad urgente de desarrollar un nuevo método para eludir los resultados falsos negativos causados por la expresión heterogénea de estas proteínas de puntos de control inmunitario.
La tecnología de imagen molecular, como la tomografía por emisión de positrones (PET), permite la visualización en tiempo real de todo el cuerpo de forma no invasiva y, por lo tanto, puede superar al método convencional de IHQ 11,12,13. Los anticuerpos, péptidos y moléculas pequeñas radiomarcados son trazadores prometedores para monitorizar la expresión de PD-L1 en pacientes con cáncer 14,15,16,17,18,19,20,21,22,23,24,25. La Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) ha aprobado tres anticuerpos monoclonales terapéuticos PD-L1: avelumab, atezolizumab y durvalumab26. Los trazadores inmuno-PET basados en estos anticuerpos han sido bien documentados 27,28,29,30,31,32. Los ensayos clínicos de fase temprana han revelado un valor limitado para la aplicación clínica, debido a la farmacocinética desfavorable30. En comparación con los anticuerpos, los péptidos exhiben una eliminación más rápida de la sangre y los órganos de los órganos sanos, y pueden modificarse químicamente fácilmente33. Se han descrito múltiples péptidos con alta afinidad por PD-1/PD-L12; WL12 es un péptido reportado que muestra una unión específica a PD-L134. Se ha notificado que los trazadores radiomarcados, [64Cu]WL12, [68Ga]WL12 y [18F]FPyWL12, muestran una alta capacidad de focalización tumoral específica in vivo, lo que permite obtener imágenes de alta calidad de la expresión de PD-L1 en tumores 26,35,36,37. Además, la primera evaluación en humanos de WL12 radiomarcado ha demostrado que [68Ga]WL12 (quelado por NOTA) tiene un potencial seguro y eficiente para la obtención de imágenes clínicas de tumores38. Debido a su alta hidrofobicidad y alta absorción en el hígado sano, WL12 tiene un uso clínico limitado. Otros péptidos de radiomarcaje, como TPP1 y SETSKSF, que se unen específicamente a PD-L1, también han mostrado estabilidad y especificidad potenciales para visualizar la expresión de PD-L1 en todo el cuerpo39,40. Sin embargo, los péptidos no modificados son fácilmente degradados por las proteasas y son metabolizados rápidamente por el riñón. Los péptidos dextrorotarios (D) han sido ampliamente utilizados como mediadores efectivos, debido a la escasa estabilidad de los péptidos levógiros (L) 41,42,43. Los péptidos D son hiperresistentes a la degradación proteolítica y tienen vidas medias metabólicas notablemente prolongadas. En comparación con sus contrapartes L, los péptidos D muestran principalmente capacidades de unión específicas 44,45,46.
Este estudio diseñó un nuevo método para detectar la expresión de PD-L1, basado en imágenes PET de un péptido D dirigido a PD-L1 marcado con 68Ga, antagonista de D-dodecapéptido (DPA), en un modelo de ratón portador de tumores47. Primero se estudió la estabilidad de [68Ga]DPA en solución salina tamponada con fosfato (PBS) y suero de ratón, después de lo cual se probó la afinidad de unión de [68Ga]DPA en tumores que sobreexpresan PD-L1. Posteriormente, se realizaron imágenes por TEP en modelos de xenoinjerto de glioblastoma para confirmar si [68Ga]DPA era un trazador PET ideal para monitorear la expresión de PD-L1 en tumores. La combinación de imágenes PET y DPA no solo proporciona un nuevo enfoque para superar los desafíos asociados con la expresión heterogénea de PD-L1, sino que también sienta las bases para el desarrollo de radiotrazadores basados en péptidos D.
Protocolo
Los procedimientos experimentales con animales fueron aprobados por el Comité de Ética Animal de la Universidad Médica de Nanjing o los Institutos Nacionales de Ciencia y Tecnología Cuántica. Los experimentos con ratones se realizaron en estricto cumplimiento de las directrices institucionales del Comité para el Cuidado y Uso de Animales de Laboratorio.
1. Síntesis de péptidos
- Hinchar 100 mg de resina de 4-metilbenzhidrilamina (MBHA) (capacidad de carga de 0,37 mmol/g) en 1 mL de N-metil-2-pirrolidona (NMP) durante 30 min bajo un leve burbujeo de N2.
- Prepare un tampón de stock fresco que consista en aminoácidos protegidos con Fmoc (5.0 equiv), HCTU (4.9 equiv) y DIPEA (10.0 equiv) en 1 mL de NMP, y agréguelo a la resina (100 mg). Deje que la reacción de acoplamiento continúe durante 1,5-2 h.
- Preparar un tampón de desprotección que consiste en un 50% (vol/vol) de morfolina en NMP. Lavar la resina (100 mg) 2 x 30 min con 1 mL del tampón de desprotección en cada lavado para eliminar el grupo Fmoc en el grupo amina. Lave la resina con diclorometano (DCM; 1 ml) durante 1 minuto, retire el MCD y vuelva a lavar la resina con NMP (1 ml) durante 1 m. A continuación, retire el NMP y vuelva a lavar la resina con DCM durante 1 min.
NOTA: Todos los procedimientos de lavado se llevan a cabo bajo un leve burbujeo de N2 . Los procedimientos anteriores se repiten hasta el último aminoácido. - Para agregar ácido 1,4,7,10-tetraazaciclododecano-1,4,7,10-tetraacético (DOTA) al péptido, preactive el DOTA con clorhidrato de N-(3-dimetilaminopropil)-N-etilcarbodiimida (EDC· HCl) y N-hidroxisuccinimida (NHS). Incubar el tampón de existencias de DOTA/EDC· HCl/NHS a una relación molar de 1:1:1 en dimetilsulfóxido (DMSO) durante 3 h, con una concentración final de DOTA de 1 M. A continuación, agregue el tampón madre (1 mL) a la resina (100 mg) y deje que la reacción continúe durante 2 h con un suave burbujeo de N2.
NOTA: El ácido 1,4,7-triazaciclononano-1,4,7-triacético (NOTA) también se puede utilizar como quelante para la complejación de 68Ga. Los mismos procedimientos se pueden utilizar para el acoplamiento NOTA. - Enjuague bien la resina desde la parte superior con DCM y aplique una aspiradora para eliminar la solución de reacción residual simultáneamente. Enjuague la resina 3 veces con DCM (1,5 ml) y luego enjuague con MeOH (1,5 ml) para encoger la resina. Ponga la resina bajo nitrógeno durante la noche, o bajo alto vacío durante al menos 4 h, hasta que la resina se seque.
- Coloque la resina seca que contiene péptidos DPA en un recipiente de polipropileno de 2 ml con tapón de rosca. Añadir el cóctel de escisión adecuado (95/2,5/2,5 TFA/TIS/H2O de volumen; 1 mL/100 mg de resina) y sellar bien el recipiente con un tapón de rosca. Agitar suavemente la reacción en un agitador orbital en una campana extractora a 20-25 °C durante 2 h.
PRECAUCIÓN: Prepare ácido trifluoroacético (TFA) en una campana extractora con ropa protectora, debido a su naturaleza altamente corrosiva. - Elimine la mayor parte del AGT por evaporación bajo nitrógeno en la campana extractora. Precipitar los péptidos añadiendo éter dietílico (~1,5 ml/100 mg de resina).
- Agitar la mezcla para triturar los péptidos y centrifugar a temperatura ambiente (10.000 × g, 5 min). Vierta con cuidado el disolvente fuera del recipiente. Repita los pasos 1.7-1.8.
- Secar al aire el residuo en el recipiente abierto durante 10 min. Añadir un 50% (vol/vol) de acetonitrilo acuoso y vórtice durante 1-2 s para disolver los productos (1 mL/100 mg de resina).
- Retire la resina filtrando la mezcla y luego lave la resina 2 veces con 0,2 ml de acetonitrilo acuoso al 50% (vol/vol). Mezcle los filtrados para la purificación por cromatografía líquida de alta resolución (HPLC). Utilice las siguientes condiciones de HPLC. Columna: YMC-Triat-C18 (4,6 mm de diámetro interno [d.i.], 150 mm, 5 mm); gradiente de disolvente: agua desionizada A con disolvente; disolvente B-acetonitrilo (0,1% TFA); tiempo de flujo: 20 min, con acetonitrilo de 10% a 90%; caudal: 1 mL/min.
- Congelar los eluyentes de HPLC recogidos durante la noche a -80 °C y liofilizar (-50 °C y <1 pa). Para el radiomarcaje, disuelva el péptido sólido en tampón de acetato de sodio (100 mM, pH 5,0) a una concentración final de 1 mg/ml como tampón madre.
2. Radiomarcaje de 68Ga
NOTA 68Ga se generó internamente en el Primer Hospital de Nanjing (Nanjing, China) utilizando un generador de 68Ge/68Ga.
- Pipetear 5 μL de tampón de stock en un recipiente de polipropileno de 1,5 ml con tapón de rosca. Añada 200 MBq [68Ga]GaCl3 (400 μL) al recipiente.
- Agitar la mezcla durante 5 s. Mida el pH con tiras reactivas de pH. Ajuste el pH a 4-4,5 con NaOH (0,1 M).
NOTA: Un pH adecuado es fundamental para la complejación entre 68Ga y DOTA. - Incubar la solución a temperatura ambiente durante 5-10 min. Sométase la mezcla de reacción a radio-HPLC para el análisis del rendimiento del radiomarcaje en las siguientes condiciones: columna: YMC-Triat-C18 (4,6 mm de diámetro interior, 150 mm, 5 mm); gradiente de disolvente: agua desionizada A con disolvente; disolvente B-acetonitrilo (0,1% TFA); tiempo de flujo: 20 min, con acetonitrilo de 10% a 90%; caudal: 1 mL/min.
NOTA: La cromatografía de capa fina por radio (TLC) se puede utilizar como un enfoque alternativo para examinar el rendimiento del radiomarcaje. El tampón de elución TLC sugerido es 0,1 M, Na, 3, C, 6, H,5, O,7, pH 4.
3. Prueba de estabilidad del trazador
- Prueba de estabilidad del trazador en PBS
- Añadir [68Ga]DPA (10 μL, 3,7 MBq, en NaOAc) al PBS (990 μL). Incubar a 37 °C durante 1, 2 y 4 h con una ligera agitación.
- Recoja 200 μL de la solución en cada punto de tiempo. Inyéctelo en la radio-HPLC para su análisis.
- Estabilidad del trazador en suero de ratón
- Añadir [68Ga]DPA (10 μL, ~3,7 MBq, en NaOAc) al suero de ratón (90 μL, recién preparado). Incubar a 37 °C durante 1, 2 y 4 h con una ligera agitación.
- Recoja 20 μL de la solución en cada punto de tiempo. Añadir MeCN y agua (100 μL, 1:1, v/v).
- Centrifugar la mezcla durante 10 min (5.000 × g, 25 °C). Analice el sobrenadante mediante radio-HPLC.
4. Análisis de la expresión de PD-L1 mediante citometría de flujo
- Prepare el medio de cultivo suplementando el medio RPMI-1640 con suero fetal bovino al 10% (vol/vol) y penicilina-estreptomicina al 1% (vol/vol). Resuspender las células U87MG en medio de cultivo y sembrar en placas de 12 pocillos a una densidad de 105 células/pocillo. Colocar las células en una incubadora (5% CO2, 37 °C) y cultivar durante al menos 24 h sin molestar.
- Lavar las células con 0,5 mL de PBS y añadir 250 μL de tripsina-EDTA (0,25%). Vuelva a colocar las células en la incubadora (5% CO2, 37 °C) durante 2 min.
- Añadir 1 ml de medio de cultivo para detener la disociación celular. Agregue medio a las celdas para separarlas de los platos pipeteando hacia arriba y hacia abajo y recójalas en tubos de 1,5 ml. Centrifugar las células durante 5 minutos (100 × g).
- Retire el sobrenadante y vuelva a suspender las células en 1 ml de PBS. Centrifugar las células durante 5 min (100 × g). Repita este paso una vez más.
- Diluir el anticuerpo PD-L1 conjugado con isotiocianato de fluoresceína (FITC) con albúmina sérica bovina (BSA) al 3% a 20 nmol/L. Añadir a las células e incubar a 4 °C durante 1 h.
- Centrifugar las células durante 5 minutos (100 × g), seguido de un lavado con PBS frío dos veces. Analice las células positivas para PD-L1 utilizando un citómetro de flujo y un software de análisis.
5. Inmunocitoquímica
- Siembre las células U87MG en placas de cultivo celular con fondo de vidrio (35 mm) a una densidad de 2,5 × 105 células por pocillo. Cuando se alcance el 60% de confluencia, aspirar el medio de cultivo y añadir 1 mL de PBS. Agitar suavemente varias veces y aspirar. Realice el paso de lavado 3 veces.
- Añadir 500 μL de paraformaldehído al 4% a los platos. Coloque las celdas a temperatura ambiente y fíjelas durante 30 min.
- Lave las celdas 3 veces con PBS. Añadir 1 mL de BSA al 3% (peso/vol, en PBS) y bloquear las células fijas durante 2 h a temperatura ambiente.
- Eliminar el BSA al 3% e incubar directamente las células con el anticuerpo primario anti-PD-L1 (mAb, 1:100, diluido en BSA al 3%) durante la noche a 4 °C.
NOTA: Después de bloquear las células con BSA, no se lave con PBS. - Lave las celdas 3 veces con tampón BSA al 3%. Incubar las células con el anticuerpo secundario IgG Fc humano conjugado con FITC (1:500, diluido en PBS) durante 1 h.
- Lave las celdas 3 veces con PBS. Añadir 0,5 mL de DAPI (1 μg/mL) a las células e incubar a temperatura ambiente durante 1 h. Lave las células teñidas 3 veces con PBS y observe con un microscopio de fluorescencia confocal.
6. Experimento de captación e inhibición celular
- Experimento de captación celular
- Cultive las células U87MG en placas de 12 pocillos hasta alcanzar una confluencia del 80%. Retire el medio y lave las células con 0,5 ml de PBS.
- Diluir el [68Ga]DPA en medio fresco hasta una concentración de 74 KBq/mL. Agregue 0,5 ml del tampón [68Ga]DPA diluido a cada pocillo.
- Incubar las células con [68Ga]DPA a 37 °C durante diferentes duraciones (10, 30, 40 y 120 min). Aspire el medio con una pipeta. Lave las células con PBS (0,5 ml) tres veces.
- Añadir solución de NaOH (0,5 M, 300 μL por pocillo) para lisar las células. Después de 30 s, recoja los lisados de células viscosas en tubos de 1,5 ml.
- Lave la placa con 0,4 ml de PBS dos veces. Recoja la solución de lavado en el tubo de 1,5 ml anterior.
- Inicie la computadora incorporada del contador gamma automático; Coloque los tubos en el estante incorporado. Después de cargar todas las muestras en el transportador, presione el botón START. Los resultados se calculan en el software interno. La lectura registra los recuentos por minuto (CPM) correlacionados con la descomposición de cada tubo.
- Ensayo de unión competitivo
- Cultive las células U87MG en placas de 12 pocillos hasta alcanzar una confluencia del 80%. Retire el medio y lave las células con 0,5 ml de PBS.
- Diluir [68Ga]DPA en medio fresco hasta una concentración de 74 KBq/mL. Disuelva una cantidad adecuada de compuestos BMS202 en DMSO al 10% para obtener una concentración de 10 mM (400 μL).
- Diluir 4 μL de BMS202 10 mM en 396 μL de PBS para obtener una concentración de 100 μM. Repita este paso para obtener varias concentraciones de BMS202 (1 μM, 10 nM, 100 pM y 1 pM).
- Agregue 0,5 ml del tampón [68Ga]DPA diluido a cada pocillo (0,37 MBq por pocillo). Agregue 5 μL de las soluciones BMS202 a cada pocillo (tres pocillos para cada concentración). Incubar las células en una incubadora celular a 37 °C durante 120 min.
- Aspire el medio con una pipeta. Lave las células con 3 x 0,5 ml de PBS.
- Añadir la solución de NaOH (0,5 M, 300 μL por pocillo) para lisar las células. Después de 30 s, recoja los lisados de células viscosas en tubos de 1,5 ml. Lave la placa con 2 x 0,4 ml de PBS.
- Recoja la solución de lavado en el tubo de 1,5 ml anterior. Coloque los tubos en el estante incorporado del contador gamma automático.
- Siga los mismos procedimientos que en el paso 6.1.6.
7. Imágenes PET
NOTA: Realice imágenes PET de animales pequeños, utilizando un micro escáner PET que proporciona 159 secciones axiales transversales espaciadas a 0,796 mm (de centro a centro), con un campo de visión horizontal de 10 cm y un campo de visión axial de 12,7 cm. Todos los datos recopilados en el modo de lista se organizan en sinogramas tridimensionales. A continuación, el Fourier se vuelve a ensamblar en sinogramas bidimensionales (marco × min: 4 × 1, 8 × 2, 8 × 5).
- En este estudio, se utilizaron ratones desnudos BALB/C machos de 5 a 8 semanas de edad. Recoja las células U87MG siguiendo los pasos 4.1-4.4 y aspire las células en una jeringa de 0,5 ml. Por vía subcutánea, inyecte las células en los ratones (1 × 106 células por tumor, dos tumores por ratón). Controlar el crecimiento del tumor después de la inyección hasta que el volumen tumoral sea de 100-300 mm3.
- Anestesiar a los ratones con isoflurano al 1%-2% (v/v) (1 mL/min). Encienda el dispositivo de calefacción y mantenga la cama de PET a 37 °C.
- Coloque a los ratones anestesiados en la posición correcta en la cama del animal de la máquina PET. Aplique ungüento oftálmico en ambos ojos para prevenir la sequedad.
PRECAUCIÓN: Mantenga a los ratones en posición prona para evitar la muerte durante la exploración. Durante todo el proceso de obtención de imágenes, administre flujo de isoflurano (1,0 ml/min) a través de la nariz utilizando un tubo preinstalado. - Ajuste la posición de la cama del animal a través del panel de control. Inyectar los marcadores (10-17 MBq/100-200 μL) por vía intravenosa a través de un catéter de vena de cola preinstalado.
- Crear un flujo de trabajo de escaneo en un equipo host utilizando el software al que se hace referencia (consulte Tabla de materiales) Cree una carpeta de estudio y establezca el protocolo de adquisición según el protocolo del fabricante. Realice escaneos dinámicos (60 minutos para cada mouse) en todos los ratones en modo de lista 3D.
- Defina un protocolo de histograma y un protocolo de reconstrucción siguiendo el protocolo del fabricante. Utilice el filtro de Hanning con un corte de Nyquist de 0,5 ciclos/píxel para reconstruir imágenes dinámicas PET (25-30 min y 55-60 min) a través de retroproyección filtrada. Genere imágenes de proyección de máxima intensidad (MIP) para todos los ratones.
- Combine los protocolos en un flujo de trabajo y ejecute el flujo de trabajo. Analice las imágenes tridimensionales resultantes utilizando el software, siguiendo el protocolo del fabricante.
NOTA: Utilice el software de simulación para seleccionar los volúmenes de interés. La radiactividad se corrige por decaimiento al momento de la inyección y se presenta como el porcentaje de la dosis total de inyección/por gramo de tejido (% ID/g).
8. Biodistribución ex vivo
- Administrar [68Ga]DPA (1,85 MBq/100 μL) a los ratones desnudos portadores de U87MG con BALB/C a través de la inyección en la vena de la cola. Anestesiar a los ratones con isoflurano al 1%-2% (v/v) (1 ml/min), luego sacrificar tres ratones a través de la luxación cervical después de la inyección durante 5, 30, 60 y 120 min.
NOTA: Las personas que demuestren este procedimiento deben estar capacitadas en las habilidades técnicas de la dislocación cervical para garantizar que la pérdida de conciencia se induzca rápidamente. Esto asegurará que todos los procedimientos de eutanasia en este experimento se realicen de manera humana. - Después de que se confirme la muerte, abra la pared torácica de los ratones. Entonces, abre el corazón. Use una jeringa de 1 ml para extraer sangre; exprimir la sangre de la jeringa en un tubo de radioinmunoensayo (RIA) (13 mm de diámetro) para el contador gamma.
- Extirpar los órganos y tumores principales y colocarlos en tubos RIA (13 mm de diámetro) para el contador gamma. Los órganos principales incluyen la sangre total, el corazón, el timo, el hígado, el bazo, los huesos, el estómago, los riñones, los músculos, los ganglios linfáticos intestinales, el intestino delgado, el páncreas, los testículos, el cerebro y los pulmones. Pesa todos los órganos.
- Mida la radiactividad dentro de los órganos recolectados usando un contador de rayos gamma automáticos y corrija los valores de descomposición. Calcular el porcentaje de dosis inyectada por gramo de tejido húmedo (% ID/g).
9. Inmunohistoquímica
- Recoja los tejidos del glioma y lávelos 3 veces con PBS. Poner los pañuelos frescos en paraformaldehído al 4% y fijar durante la noche a 4 °C.
- Incrustar los tejidos fijados en parafina y seccionarlos hasta un grosor de 10 μm. Colocar las secciones en una incubadora (60 °C) e incubar durante 2 h. Desparafinar e hidratar las secciones incubando durante 10 min cada una en lo siguiente: xileno (dos veces), alcohol absoluto, 95% de alcohol, 90% de alcohol, 80% de alcohol, 75% de alcohol.
- Poner las secciones en citrato de sodio 0,01 M y calentarlas a 92-95 °C. Mantenga la temperatura durante 40 minutos para lograr la recuperación del antígeno.
- Añadir 200 μL de solución deH2O2 (3%) a las secciones e inactivar las endoperoxidasas durante 10 min a temperatura ambiente. Bloquear los sitios inespecíficos mediante tratamiento con BSA al 3% durante 2 h a temperatura ambiente.
- Incubar las secciones en el anticuerpo primario anti-PD-L1 (mAb, 1:100, diluido en BSA al 3%) durante la noche a 4 °C.
NOTA: Después de bloquear con BSA, no lave con PBS. - Lave las secciones 3 veces con PBS. Incubar las secciones con anticuerpo secundario anti-conejo de cabra marcado con HRP (1:500, diluido en PBS) a temperatura ambiente durante 1 h.
- Lave las celdas 3 veces con PBS. Añadir 200 μL de solución de trabajo de 3,3-diaminobencidina (DAB) (solución A: solución B: solución C = 1:1:18) a las secciones e incubar durante 5 min en la oscuridad.
- Lave las secciones 3 veces con PBS. Añadir 500 μL de solución de hematoxilina (100%) e incubar durante 5 min a temperatura ambiente. Lavar las secciones con agua durante 30 s. Poner las secciones en solución de diferenciación (alcohol al 75%:HCL = 99:1) durante 30 s. Lavar las secciones con agua durante 1 min.
- Deshidratar las muestras incubando secuencialmente con alcohol al 75%, alcohol al 80%, alcohol al 90%, alcohol al 95%, alcohol absoluto y xileno (dos veces) (10 min cada una). Monta todas las secciones con resina neutra y obsérvalas bajo un microscopio óptico.
Resultados
[68Ga]Radiomarcaje y estabilidad de DPA
El péptido modelo, DPA, es un antagonista eficaz de PD-L1. DOTA-DPA se obtuvo con una pureza del >95% y un rendimiento del 68%. La masa de DOTA-DPA se observa experimentalmente en 1.073,3 ([M+2H]2+). 68El galio se considera un radionúclido adecuado para marcar péptidos para la obtención de imágenes PET y, por lo tanto, se eligió para este estudio. Para radiomarcar DPA con 68Ga (vida media: 68 min), se sintetizó DOTA-PEG3-DPA (Figura 1A). DOTA se utilizó como quelante para el radiomarcaje de 68Ga. Para espaciar DOTA y DPA, se utilizó PEG3 como enlazador. El [68Ga]-DOTA-PEG3-DPA (denominado [68Ga]DPA en el siguiente texto) mostró un alto rendimiento radioquímico (>95%) y pureza radioquímica (>95%) (Tabla 1). También se realizó una prueba de estabilidad de trazadores mediante HPLC, y los resultados mostraron que [68Ga]DPA tenía una gran estabilidad tanto en PBS como en suero de ratón. La descomposición de 68Ga o la hidrólisis peptídica no se detectaron después de una incubación de 4 h a 37 °C (Figura 1B).
Expresión de PD-L1 en células U87MG
Un estudio previo mostró que un aumento de la expresión de PD-L1 se correlacionaba con una mala supervivencia de los pacientes en los tumores de glioblastoma, lo que indica que PD-L1 puede ser un biomarcador pronóstico notable y una diana terapéutica en el glioblastoma48. Por lo tanto, se utilizó una línea celular de glioblastoma humano, U87MG, para establecer un modelo tumoral con el fin de determinar la eficacia de [68Ga]DPA en la PET/TC para la obtención de imágenes tumorales de PD-L1. Los resultados de la citometría de flujo sugirieron que aproximadamente el 60% de las células U87MG eran positivas para PD-L1 (Figura 2A). Además, la tinción inmunofluorescente confirmó la fuerte expresión de PD-L1 en las células U87MG (Figura 2B). En conjunto, estos datos demostraron que la línea celular U87MG era adecuada para este estudio.
Absorción celular y especificidad de [68Ga]DPA
La captación de [68Ga]DPA por las células U87MG presentó un patrón dependiente del tiempo. Cuando se utilizó un inhibidor de PD-L1, BMS202, como agente bloqueante, la porción de unión y la captación de [68Ga]DPA se redujeron significativamente (Figura 3A). Un ensayo de unión competitivo examinó más a fondo la afinidad de unión (Ki) de BMS202 a las células U87MG. La afinidad de unión estimada fue de 43,8 ± 8,6 nmol/L para BMS202 cuando se utilizó [68Ga]DPA como competidor (Figura 3B).
[68Ga]Imágenes por TEP de DPA de modelos tumorales
Se realizaron imágenes PET de [68Ga]DPA en ratones desnudos U87MG portadores de tumores BALB/C. [68Ga] La DPA se administró mediante inyección intravenosa hasta que el tumor U87MG creció a 100 mm3. Las imágenes PET de cuerpo entero revelaron una alta acumulación de [68Ga]DPA en el tumor después de 30 y 60 min de la inyección, y mostraron la mayor acumulación en el riñón y la vejiga (Figura 4A). Para confirmar si [68Ga]DPA se acumulaba específicamente en tumores positivos para PD-L1, se utilizó otro modelo de ratón portador de la línea celular PanNET Bon-1 como control negativo. En un experimento paralelo se demostró poca acumulación de [68Ga]DPA en los tumores Bon-1 a los 60 minutos después de la inyección (Figura 4B).
Para aclarar esta diferencia, se realizó una tinción inmunohistoquímica para analizar la expresión de PD-L1 en los tejidos tumorales. Los resultados revelaron que las células U87MG presentaban una expresión considerable de PD-L1 (Figura 5A,C), pero no el tumor Bon-1 (Figura 5B,C). Estos datos fueron consistentes con los resultados de la PET. Por lo tanto, es posible que los diferentes estados de crecimiento de las células tumorales hayan dado lugar a una expresión diferente de PD-L1 (p. ej., necrosis tisular). Para comprobarlo, se realizó una tinción con hematoxilina y eosina (H&E). Como era de esperar, se observó una morfología celular similar entre los dos tejidos tumorales (Figura 5D).
Biodistribución ex vivo de [68Ga]DPA en tumores U87MG
El estudio de biodistribución ex vivo también se llevó a cabo con ratones portadores de U87MG (Tabla 2). Los resultados mostraron un rápido aclaramiento en la sangre y en la mayoría de los órganos analizados, incluidos el corazón, el hígado, los pulmones y los músculos. El riñón acumuló la mayor cantidad de radiactividad y mostró una tasa de aclaramiento de 0,12% ID/(g∙min) de 5 min a 120 min. El tumor exhibió la captación del segundo marcador más alta en todos los puntos temporales. Además, de 5 min a 60 min después de la inyección, el tumor presentó una tasa de aclaramiento del trazador más baja de 0,027% ID/(g∙min). Para la sangre, la tasa de aclaramiento fue de 0,069% ID/(g∙min), mientras que para el músculo, la tasa de aclaramiento fue de 0,037% ID/(g∙min).
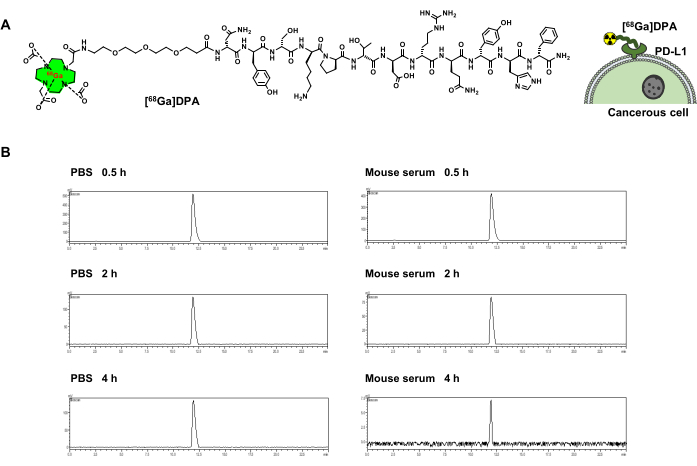
Figura 1: Radiomarcaje y estabilidad de [68Ga]DPA. (A) La estructura química de [68Ga]DPA y la representación esquemática de su unión a las células tumorales que expresan PD-L1. (B) Curvas de HPLC que muestran la radiactividad de [68Ga]DPA después de la incubación con PBS o suero de ratón durante 0,5, 2 y 4 h. Esta figura fue modificada a partir de Hu et al.47. Abreviaturas: DPA = antagonista de dodecapéptidos; PD-L1 = ligando de muerte programada 1; PBS = solución salina tamponada con fosfato; HPLC = cromatografía líquida de alta resolución. Haga clic aquí para ver una versión más grande de esta figura.
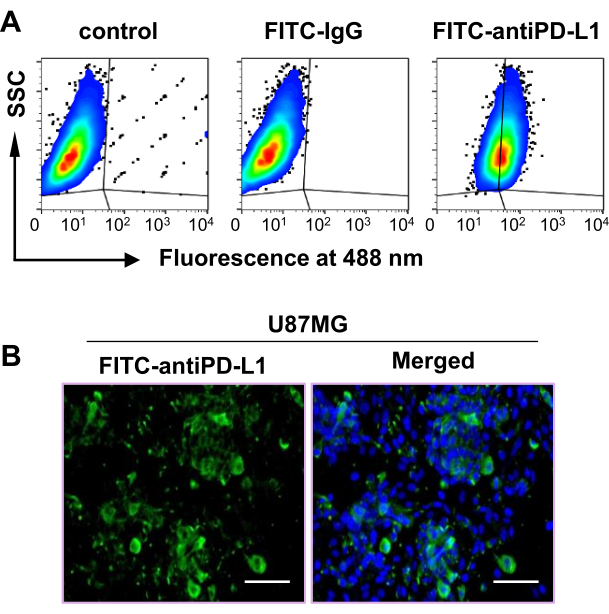
Figura 2: Expresión de PD-L1 en la línea celular U87MG. (A) La expresión de PD-L1 en la línea celular U87MG se midió mediante análisis de citometría de flujo. (B) La expresión de PD-L1 en células U87MG se midió mediante un ensayo de tinción de inmunofluorescencia. Barra de escala = 100 μm. Esta figura fue modificada a partir de Hu et al.47. Abreviaturas: PD-L1 = ligando de muerte programada 1; SSC = dispersión lateral; FITC = isotiocianato de fluoresceína. Haga clic aquí para ver una versión más grande de esta figura.
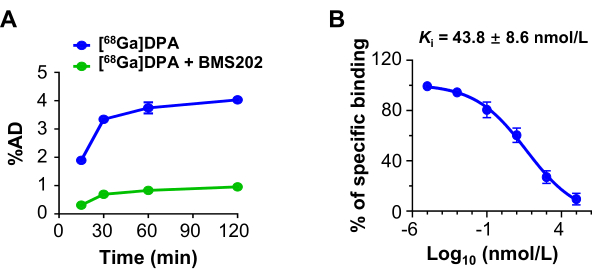
Figura 3: Absorción e inhibición celular de [68Ga]DPA. (A) La absorción de células U87MG cuando se incuban con [68Ga]DPA (0,74 MBq/mL) o [68Ga]DPA (0,74 MBq/mL) + BMS202 (100 μmol/L) durante diferentes duraciones. (B) Unión competitiva de [68Ga]DPA (0,74 MBq/mL) a las células U87MG después de la incubación con BMS202. El valor de Ki se muestra en el panel. Esta figura fue modificada a partir de Hu et al.47. Abreviaturas: DPA = antagonista de dodecapéptidos; %AD = dosis administrada (con respecto a la porción de unión). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Imágenes PET de [68Ga]DPA en tumores U87MG con sobreexpresión de PD-L1. (A,B) Imágenes de PET-CT que muestran la distribución de [68Ga]DPA en ratones portadores de U87MG (A) y ratones portadores de Bon-1 (control negativo, B) después de la inyección intravenosa (~18,5 MBq) durante 30 min y 60 min. Se presentan imágenes representativas de proyección de intensidad máxima (MIP) (panel superior) e imágenes de PET-TC transversal (panel inferior). Las posiciones de los tumores están marcadas con círculos discontinuos blancos. Esta cifra fue modificada a partir de Hu et al.47. Abreviaturas: DPA = antagonista de dodecapéptidos; PD-L1 = ligando de muerte programada 1; PET-CT = tomografía por emisión de positrones-tomografía computarizada; PMI = proyección de intensidad máxima; P.I. = post-inyección. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Análisis inmunohistoquímico de tumores tratados con [68Ga]DPA. (A,B) Imágenes inmunohistoquímicas de corte completo de PD-L1 en tumores (A) U87MG y (B) Bon-1. (C) Imágenes ampliadas de las áreas marcadas en A y B. (D) Tinción de H&E de U87MG y tumor Bon-1. Barras de escala = 100 μm (C,D). Esta figura fue modificada a partir de Hu et al.47. Abreviaturas: DPA = antagonista de dodecapéptidos; PD-L1 = ligando de muerte programada 1; H&E = hematoxilina y eosina. Haga clic aquí para ver una versión más grande de esta figura.
| Trazadores | [68Ga] DPA |
| Rendimiento radioquímico (%) | >95 |
| Actividad molar (GBq μmol-1) | 37 ± 8 |
| Pureza radioquímicaa (%) | >95 |
Tabla 1: Radiomarcaje y control de calidad de [68Ga]DPA. Rendimiento radioquímico, actividad molar y pureza radioquímica de [68Ga]DPA. Los datos se representan como la media ± DE (n = 7). Esta tabla fue modificada a partir de Hu et al.47. Abreviatura: DPA = antagonista de dodecapéptidos. unLa pureza radioquímica de [68Ga]DPA se analizó mediante HPLC de fase reversa en una condición optimizada: 1) columna: YMC-Triat-C18 (4,6 mm de diámetro interior, 150 mm, 5 mm); 2) gradiente de solvente: agua desionizada A con solvente; disolvente B-acetonitrilo (ácido trifluoroacético al 0,1%); tiempo de flujo: 20 min, con acetonitrilo de 10% a 90%; caudal de 1 mL/min.
| [68Ga] DPA | ||||||||
| 5 minutos | 30 minutos | 60 minutos | 120 minutos | |||||
| sangre | 3.89 | ±0.43 | 1.55 | ±1.07 | 0.11 | ±0.02 | 0.05 | ±0.01 |
| corazón | 1.19 | ±0.39 | 0.52 | ±0.33 | 0.06 | ±0.02 | 0.05 | ±0.02 |
| hígado | 1.06 | ±0.26 | 0.59 | ±0.43 | 0.19 | ±0.02 | 0.16 | ±0.04 |
| bazo | 0.98 | ±0.14 | 0.68 | ±0.67 | 0.14 | ±0.06 | 0.09 | ±0.03 |
| pulmón | 1.64 | ±0.42 | 1.03 | ±0.9 | 0.13 | ±0.05 | 0.09 | ±0.02 |
| riñón | 19.23 | ±1.95 | 16.13 | ±1.51 | 11.5 | ±0.44 | 5.2 | ±0.31 |
| estómago | 1.54 | ±0.1 | 0.61 | ±0.35 | 0.08 | ±0.01 | 0.08 | ±0.03 |
| intestinal | 0.72 | ±0.27 | 0.47 | ±0.35 | 0.08 | ±0.02 | 0.06 | ±0.03 |
| páncreas | 1.88 | ±0.28 | 0.77 | ±0.75 | 0.16 | ±0.03 | 0.13 | ±0.03 |
| músculo | 2.21 | ±0.27 | 0.71 | ±0.37 | 0.18 | ±0.02 | 0.14 | ±0.04 |
| hueso | 2.18 | ±0.11 | 0.85 | ±0.51 | 0.26 | ±0.09 | 0.14 | ±0.06 |
| cerebro | 0.19 | ±0.04 | 0.11 | ±0.08 | 0.03 | ±0.01 | 0.02 | ±0.01 |
| tumor | 4.5 | ±0.32 | 3.77 | ±0.27 | 2.99 | ±0.03 | 0.89 | ±0.19 |
| gordo | 2.09 | ±0.49 | 0.81 | ±0.12 | 0.27 | ±0.07 | 0.1 | ±0.07 |
Tabla 2: Biodistribución de [68Ga]DPA en ratones portadores de tumores U87MG después de la administración durante diferentes períodos (n = 3 por punto de tiempo). Esta tabla es una modificación de Hu et al.47. Abreviatura: DPA = antagonista de dodecapéptidos.
Discusión
Los pasos críticos descritos en este método incluyen el etiquetado eficiente de 68Ga a DPA y la elección de una ventana de tiempo adecuada para la obtención de imágenes PET, que debe coincidir perfectamente con el patrón farmacodinámico de DPA en el tumor.
A diferencia de la IHQ, la PET permite la detección en tiempo real de la expresión de PD-L1 en todo el cuerpo de forma no invasiva, lo que permite la visualización de cada área positiva en un tumor heterogéneo 6,7. Los péptidos se eligieron como ligandos para evitar las desventajas de los anticuerpos y las moléculas pequeñas. Los anticuerpos con grandes pesos moleculares generalmente tienen vidas medias circulantes largas, lo que causa una mayor toxicidad para los órganos sanos. La eliminación de moléculas pequeñas suele ser demasiado rápida para lograr la retención tumoral requerida. El peso molecular de los péptidos oscila entre el de los anticuerpos y el de las moléculas pequeñas. Esto permite que los radiotrazadores basados en péptidos logren tanto la retención tumoral a largo plazo como una buena penetración en el tejido con una toxicidad mínima 13,49,50,51,52,53. Es importante destacar que la utilidad del péptido D DPA, en lugar de los péptidos L comúnmente reportados, confiere al [68Ga]DPA una vida media metabólica notablemente prolongada. Además, el DPA tiene carga positiva e hidrofílico in vivo, por lo que tiene una alta solubilidad y puede evitar la focalización inespecífica en sangre, lo que facilita la generación de imágenes PET con alta calidad de imagen.
En particular, el radiomarcaje exitoso de 68Ga requiere un pH específico y sin interferencia de iones de metales de transición, como los cationes Cu (II) y Fe (III). En algunos casos, la contaminación por Cu2+ conduce a un bajo rendimiento radioquímico. Por lo tanto, es fundamental asegurarse de que todos los recipientes y puntas de pipeta no estén contaminados. Además, en este método, se utilizó U87MG para la inoculación tumoral. Aunque la expresión de PD-L1 en xenoinjertos U87MG se verificó en estudios previos, su expresión varía entre animales individuales. Por lo tanto, la captación absoluta del marcador en los tumores U87MG varió entre los ratones individuales. Para garantizar la captación eficaz del trazador en los tumores, se deben seleccionar animales con un tamaño tumoral adecuado (500 mm3 < volumen < 100 mm3) para la exploración PET.
Una de las limitaciones de [68Ga]DPA es que la afinidad de unión de DPA a PD-L1 es relativamente baja en comparación con otros péptidos dirigidos a PD-L1, como WL12, lo que lo hace inadecuado para tumores con una expresión relativamente baja de PD-L126,47. Una mayor modificación del péptido D mejorará su capacidad de unión específica. Además, para mejorar el efecto de imagen de [68Ga]DPA, la formulación de la estrategia de inyección puede optimizarse, por ejemplo, inyectando simultáneamente DPA no marcado antes de [68Ga]DPA para bloquear los sitios de unión inespecíficos 54,55,56.
En conclusión, este estudio desarrolló un método no invasivo y en tiempo real para rastrear la distribución de PD-L1 en todo el cuerpo de animales vivos utilizando [68Ga]DPA como radiotrazador. Los resultados revelaron una afinidad de unión específica in vivo relativamente alta, una estabilidad favorable y una excelente capacidad de obtención de imágenes de [68Ga]DPA, lo que sugiere que [68Ga]DPA-PET es un enfoque prometedor para visualizar tumores que sobreexpresan PD-L1. Además, esta técnica también se puede aplicar al tratamiento de tumores positivos para PD-L1 al marcar DPA con otros radionúclidos, como 177Lu y 225Ac. Por lo tanto, la técnica de radiomarcaje DPA no solo supera la limitación del diagnóstico dependiente de IHQ, sino que también proporciona una nueva opción de tratamiento.
Divulgaciones
No se declaran intereses contrapuestos.
Agradecimientos
Este estudio contó con el apoyo del Fondo del Instituto Central de Investigación sin fines de lucro de la Academia China de Ciencias Médicas (n.º 2022-RC350-04) y del Fondo de Innovación CAMS para Ciencias Médicas (n.º 2021-I2M-1-026, 2022-I2M-1-026-1, 02120101, 02130101 y 2022-I2M-2-002).
Materiales
| Name | Company | Catalog Number | Comments |
| 1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid (DOTA) | Merck | 60239-18-1 | 68Ga chelation |
| 3,3-diaminobenzidine (DAB) Kit | Sigma-Aldrich | D7304-1SET | Immunohistochemistry |
| anti-PD-L1 monoclonal antibody | Wuhan Proteintech | 17952-1-ap | Immunohistochemistry: primary antibody |
| BMS202 | Selleck | 1675203-84-5 | Competitive binding assay: inhibitor |
| BSA | Merck | V900933 | Immunofluorescent : blocking |
| DAPI | Merck | D9542 | Immunofluorescent: staining of nucleus |
| Dichloromethane (DCM) | Merck | 34856 | Solvent |
| DIPEA | Merck | 3439 | Peptide coupling |
| EDC·HCl | Merck | E6383 | Activation of DOTA |
| FBS | Gibco | 10099 | Cell culture: supplement |
| FITC-conjugated anti-human IgG Fc Antibody | Biolegend | 409310 | Immunofluorescent: secondary antibody |
| FITC-conjugated anti PD-L1 antibody | Biolegend | 393606 | Flow cytometry: direct antibody |
| HCTU | Energy Chemical | E070004-25g | Peptide coupling |
| HRP labeled goat anti-rabbit antibody | Servicebio | GB23303 | Immunohistochemistry: secondary antibody |
| Hydroxysuccinimide (NHS) | Merck | 130672 | Activation of DOTA |
| MeCN | Merck | PHR1551 | Solvent |
| Morpholine | Merck | 8.06127 | Fmoc- deprotection |
| NMP | Merck | 8.06072 | Solevent |
| Paraformaldehyde | Merck | 30525-89-4 | Fixation of tissues |
| PBS | Gibco | 10010023 | Cell culture: buffer |
| Penicillin-streptomycin | Gibco | 10378016 | Cell culture: supplement |
| RIA tube | PolyLab | P10301A | As tissue sample container |
| RPMI-1640 medium | Gibco | 11875093 | Cell culture: basic medium |
| Sodium acetate | Merck | 1.06264 | Salt for buffer |
| Trypsin-EDTA | Gibco | 25200056 | Cell culture: dissociation agent |
| U87MG cell line | Procell Life Science & Technology Co | CL-0238 | Cell model |
| Equipment | |||
| 68Ge/68Ga generator | Isotope Technologies Munich, ITM | Not applicable | Generation of [68Ga] |
| Autogamma counter | Perkin Elmer | Wizard2 | Detection of radioactivity |
| Confocal fluorescent microscopy | Keyence | Observation of immunofluorescent results | |
| Flow cytometer | Becton Dickinson, BD | LSRII | Monitoring the PD-L1 positive cells |
| High-performance liquid chromatography (HPLC) | SHIMAZU | LC-20AT | Purification of DPA peptide |
| PET scanner | Siemens Medical Solutions | Inveon MultiModality System | PET imaging |
| Optical microscopy | Nikon | Eclipse E100 | Observation of immunohistochemistry results |
| Solid phase peptide synthesizer | Promega Vac-Man Laboratory Vacuum Manifold | LOT#11101 | Synthesis of DPA-DOTA peptide |
| Software | |||
| ASIPro | Siemens Medical Solutions | Not applicable | Analysis of PET-CT results |
| FlowJo | Becton Dickinson, BD | FlowJo 7.6.1 | Analysis of the flow cytometer results |
| Inveon Acquisition Workplace (IAW) | Siemens Medical Solutions | Not applicable | Management of PET mechine |
| Prism | Graphpad | Prism 8.0 | Analysis of the data |
Referencias
- Doroshow, D. B., et al. PD-L1 as a biomarker of response to immune-checkpoint inhibitors. Natire Reviews Clinical Oncology. 18 (6), 345-362 (2021).
- Krutzek, F., Kopka, K., Stadlbauer, S. Development of radiotracers for imaging of the PD-1/PD-L1 axis. Pharmaceuticals. 15 (6), 747 (2022).
- Topalian, S. L., Drake, C. G., Pardoll, D. M. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell. 27 (4), 450-461 (2015).
- Pardoll, D. M. The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer. 12 (4), 252-264 (2012).
- Xiao, Z., et al. PEIGel: A biocompatible and injectable scaffold with innate immune adjuvanticity for synergized local immunotherapy. Materials Today Bio. 15, 100297 (2022).
- Teng, M. W. L., Ngiow, S. F., Ribas, A., Smyth, M. J. Classifying cancers based on T-cell infiltration and PD-L1. Cancer Research. 75 (11), 2139-2145 (2015).
- Dolled-Filhart, M., et al. Development of a companion diagnostic for pembrolizumab in non-small cell lung cancer using immunohistochemistry for programmed death ligand-1. Archives of Pathology & Laboratory Medicine. 140 (11), 1243-1249 (2016).
- Meng, X. J., Huang, Z. Q., Teng, F. F., Xing, L. G., Yu, J. M. Predictive biomarkers in PD-1/PD-L1 checkpoint blockade immunotherapy. Cancer Treatment Reviews. 41 (10), 868-876 (2015).
- Hakozaki, T., Hosomi, Y., Kitadai, R., Kitagawa, S., Okuma, Y. Efficacy of immune checkpoint inhibitor monotherapy for patients with massive non-small-cell lung cancer. Journal of Cancer Research and Clinical Oncology. 146 (11), 2957-2966 (2020).
- Haslam, A., Prasad, V. Estimation of the percentage of US patients with cancer who are eligible for and respond to checkpoint inhibitor immunotherapy drugs. Jama Network Open. 2 (5), 192535 (2019).
- Willmann, J. K., van Bruggen, N., Dinkelborg, L. M., Gambhir, S. S. Molecular imaging in drug development. Nature Reviews Drug Discovery. 7 (7), 591-607 (2008).
- Zhang, L., et al. Recent developments on PET radiotracers for TSPO and their applications in neuroimaging. Acta Pharmaceutica Sinica B. 11 (2), 373-393 (2021).
- Sun, J., et al. Imaging-guided targeted radionuclide tumor therapy: From concept to clinical translation. Advanced Drug Delivery Reviews. 190, 114538 (2022).
- Xu, M., et al. Preclinical study of a fully human Anti-PD-L1 antibody as a theranostic agent for cancer immunotherapy. Molecular Pharmaceutics. 15 (10), 4426-4433 (2018).
- Niemeijer, A. N., et al. Whole body PD-1 and PD-L1 positron emission tomography in patients with non-small-cell lung cancer. Nature Communications. 9 (1), 4664 (2018).
- Mayer, A. T., et al. Practical immuno-PET radiotracer design considerations for human immune checkpoint imaging. Journal of Nuclear Medicine. 58 (4), 538-546 (2017).
- Lv, G., et al. PET Imaging of tumor PD-L1 expression with a highly specific nonblocking single-domain antibody. Journal of Nuclear Medicine. 61 (1), 117-122 (2020).
- Li, D., et al. Immuno-PET imaging of 89Zr labeled anti-PD-L1 domain antibody. Molecular Pharmaceutics. 15 (4), 1674-1681 (2018).
- Lesniak, W. G., et al. PD-L1 detection in tumors using [(64)Cu]Atezolizumab with PET. Bioconjugate Chemistry. 27 (64), 2103-2110 (2016).
- Kristensen, L. K., et al. CD4(+) and CD8a(+) PET imaging predicts response to novel PD-1 checkpoint inhibitor: studies of Sym021 in syngeneic mouse cancer models. Theranostics. 9 (26), 8221-8238 (2019).
- Christensen, C., Kristensen, L. K., Alfsen, M. Z., Nielsen, C. H., Kjaer, A. Quantitative PET imaging of PD-L1 expression in xenograft and syngeneic tumour models using a site-specifically labelled PD-L1 antibody. European Journal of Nuclear Medicine and Molecular Imaging. 47 (5), 1302-1313 (2020).
- Bensch, F., et al. 89Zr-atezolizumab imaging as a non-invasive approach to assess clinical response to PD-L1 blockade in cancer. Nature Medicine. 24 (12), 1852-1858 (2018).
- Gonzalez Trotter, D. E., et al. In vivo imaging of the programmed death ligand 1 by 18F PET. Journal of Nuclear Medicine. 58 (11), 1852-1857 (2017).
- Lv, G., et al. Promising potential of a 18F-labelled small-molecular radiotracer to evaluate PD-L1 expression in tumors by PET imaging. Bioorganic Chemistry. 115, 105294 (2021).
- Miao, Y., et al. One-step radiosynthesis and initial evaluation of a small molecule PET tracer for PD-L1 imaging. Bioorganic & Medicinal Chemical Letters. 30 (24), 127572 (2020).
- Kumar, D., et al. Peptide-based PET quantifies target engagement of PD-L1 therapeutics. The Journal of Clinical Investigation. 129 (2), 616-630 (2019).
- Powles, T., et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature. 515 (7528), 558-562 (2014).
- Herbst, R. S., et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature. 515 (7528), 563-567 (2014).
- Marciscano, A. E., Gulley, J. L. Avelumab demonstrates promise in advanced NSCLC. Oncotarget. 8 (61), 102767-102768 (2017).
- Vaddepally, R. K., Kharel, P., Pandey, R., Garje, R., Chandra, A. B. Review of indications of FDA-approved immune checkpoint inhibitors per NCCN guidelines with the level of evidence. Cancers. 12 (3), 738 (2020).
- Antonia, S. J., et al. Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. The New England Journal of Medicine. 377 (20), 1919-1929 (2017).
- Wang, D. Y., et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis. JAMA Oncology. 4 (12), 1721-1728 (2018).
- Sgouros, G., Bodei, L., McDevitt, M. R., Nedrow, J. R. Radiopharmaceutical therapy in cancer: clinical advances and challenges. Nature Reviews Drug Discovery. 19 (9), 589-608 (2020).
- (US) M. M. M, et al. Macrocyclic inhibitors of the pd-1/pd-l1 and cd80(b7-1)/pd-l1 protein/protein interactions. United States patent. , (2014).
- Chatterjee, S., et al. Rapid PD-L1 detection in tumors with PET using a highly specific peptide. Biochemical and Biophysical Research Communications. 483 (1), 258-263 (2017).
- De Silva, R. A., et al. Peptide-based 68Ga-PET radiotracer for imaging PD-L1 expression in cancer. Molecular Pharmaceutics. 15 (9), 3946-3952 (2018).
- Lesniak, W. G., et al. Development of [18F]FPy-WL12 as a PD-L1 specific PET imaging peptide. Molecular Imaging. 18, 1536012119852189 (2019).
- Zhou, X., et al. First-in-humans evaluation of a PD-L1-binding peptide PET radiotracer in non-small cell lung cancer patients. Journal of Nuclear Medicine. 63 (4), 536-542 (2022).
- Hu, K., et al. Developing native peptide-based radiotracers for PD-L1 PET imaging and improving imaging contrast by pegylation. Chemical Communications. 55 (29), 4162-4165 (2019).
- Liu, H., et al. A novel small cyclic peptide-based 68Ga-Radiotracer for positron emission tomography imaging of PD-L1 expression in tumors. Molecular Pharmaceutics. 19 (1), 138-147 (2022).
- Rabideau, A. E., Pentelute, B. L. A D-amino acid at the N-terminus of a protein abrogates its degradation by the N-end rule pathway. ACS Central Science. 1 (8), 423-430 (2015).
- Uppalapati, M., et al. A potent D-protein antagonist of VEGF-A is nonimmunogenic, metabolically stable, and longer-circulating in vivo. ACS Chemical Biology. 11 (4), 1058-1065 (2016).
- Garton, M., et al. Method to generate highly stable D-amino acid analogs of bioactive helical peptides using a mirror image of the entire PDB. Proceedings of the National Academy of Sciences. 115 (7), 1505-1510 (2018).
- Jia, F. J., et al. D-amino acid substitution enhances the stability of antimicrobial peptide polybia-CP. Acta Biochimica et Biophysica Sinica. 49 (10), 916-925 (2017).
- Carmona, G., Rodriguez, A., Juarez, D., Corzo, G., Villegas, E. Improved protease stability of the antimicrobial peptide Pin2 substituted with D-amino acids. Protein Journal. 32 (6), 456-466 (2013).
- Feng, Z., Xu, B. Inspiration from the mirror: D-amino acid containing peptides in biomedical approaches. Biomolecular Concepts. 7 (3), 179-187 (2016).
- Hu, K., et al. Whole-body PET tracking of a d-dodecapeptide and its radiotheranostic potential for PD-L1 overexpressing tumors. Acta Pharmaceutica Sinica. B. 12 (3), 1363-1376 (2022).
- Qiu, X. Y., et al. PD-L1 confers glioblastoma multiforme malignancy via Ras binding and Ras/Erk/EMT activation. Biochimica Et Biophysica Acta. Molecular Basis of Disease. 1864, 1754-1769 (2018).
- Hu, K., et al. Development of a stable peptide-based PET tracer for detecting CD133-expressing cancer cells. ACS Omega. 7 (1), 334-341 (2021).
- Jin, Z. -. H., et al. Radiotheranostic agent 64Cu-cyclam-RAFT-c(-RGDfK-)4 for management of peritoneal metastasis in ovarian cancer. Clinical Cancer Research. 26 (23), 6230-6241 (2020).
- Hu, K., et al. Harnessing the PD-L1 interface peptide for positron emission tomography imaging of the PD-1 immune checkpoint. RSC Chemical Biology. 1 (4), 214-224 (2020).
- Hu, K., et al. PET imaging of VEGFR with a novel 64Cu-labeled peptide. ACS Omega. 5 (15), 8508-8514 (2020).
- Hu, K., et al. An in-tether chiral center modulates the helicity, cell permeability, and target binding affinity of a peptide. Angewandte Chemie International Edition. 55 (28), 8013-8017 (2016).
- Zhao, J., et al. Concurrent injection of unlabeled antibodies allows positron emission tomography imaging of programmed cell death ligand 1 expression in an orthotopic pancreatic tumor model. ACS Omega. 5 (15), 8474-8482 (2020).
- Moroz, A., et al. A preclinical assessment of 89Zr-atezolizumab identifies a requirement for carrier added formulations not observed with 89Zr-C4. Bioconjugate Chemistry. 29 (10), 3476-3482 (2018).
- Nedrow, J. R., et al. Imaging of programmed cell death ligand 1: impact of protein concentration on distribution of anti-PD-L1 SPECT agents in an immunocompetent murine model of melanoma. Journal of Nuclear Medicine. 58 (10), 1560-1566 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados