Method Article
Kemilüminesans Testi ile Pirinçte İmmün Yanıtta Reaktif Oksijen Türleri Üretiminin Gerçek Zamanlı Tespiti
Bu Makalede
Özet
Burada, patojenle ilişkili moleküler paternle tetiklenen immün yanıtta pirinç dokularında apoplastik reaktif oksijen türlerinin (ROS) üretiminin gerçek zamanlı tespiti için bir yöntem açıklanmaktadır. Bu yöntem basit, standartlaştırılmış ve kontrollü koşullar altında yüksek oranda tekrarlanabilir sonuçlar üretir.
Özet
Reaktif oksijen türleri (ROS), abiyotik ve biyotik streslerin algılanması da dahil olmak üzere çeşitli biyolojik süreçlerde hayati roller oynamaktadır. Patojen enfeksiyonu veya patojenle ilişkili kimyasallarla (patojenle ilişkili moleküler desenler [PAMP'ler]) meydan okuması üzerine, bir ROS patlaması da dahil olmak üzere bir dizi bağışıklık tepkisi, PAMP ile tetiklenen bağışıklık (PTI) olarak adlandırılan bitkilerde hızla indüklenir. Bir ROS patlaması, bir grup plazma zarı lokalize NADPH oksidaz-RBOH ailesi proteinleri tarafından katalize edilen ayırt edici bir PTI yanıtıdır. ROS'un büyük çoğunluğu, luminol bazlı bir kemilüminesans yöntemiyle kolayca ve istikrarlı bir şekilde tespit edilebilen hidrojen peroksit (H2O2) içerir. Kemilüminesans, luminolün veya türevinin (L-012 gibi), bir katalizörün etkisi altında ROS ile bir redoks reaksiyonuna maruz kaldığı foton üreten bir reaksiyondur. Bu makalede, pirinç dokularında PAMP inisitümü üzerine apoplast ROS üretimini gerçek zamanlı olarak tespit etmek için optimize edilmiş bir L-012 tabanlı kemilüminesans yöntemi açıklanmaktadır. Yöntem kolay, istikrarlı, standartlaştırılmış ve sıkı bir şekilde kontrol edilen koşullar altında yüksek oranda tekrarlanabilir.
Giriş
Reaktif oksijen türleri (ROS), süperoksit anyon radikalleri (O2-) ve türevleri, hidroksil radikalleri (OH-), hidrojen peroksit ve plastitlerde ve kloroplastlarda, mitokondrilerde, peroksizomlarda ve diğer hücre altı konumlarda sürekli olarak üretilen singlet oksijen veya oksidasyon-indirgeme reaksiyonlarının ürünleri dahil olmak üzere bir dizi kimyasal olarak aktif oksijen türevini içerir1 . ROS birçok biyolojik süreçte önemli rol oynar ve tüm bitkiler için gereklidir 2,3,4. ROS fonksiyonlarının geniş spektrumu, büyüme ve gelişmenin düzenlenmesinden abiyotik ve biyotik streslerin algılanmasına kadar değişir 5,6,7,8.
Bitki bağışıklık sisteminde, bitki hücresi plazma zarı-lokalize reseptörler-sözde örüntü tanıma reseptörleri (PRR'ler) - patojen kaynaklı kimyasalları-patojenle ilişkili moleküler paternleri (PAMP'ler) algılar. Bu tanıma, kalsiyum akışı, ROS patlaması ve MAPK kaskadı dahil olmak üzere bir dizi hızlı bağışıklık tepkisini tetikler; Bu nedenle, bu bağışıklık katmanı PAMP ile tetiklenen bağışıklık (PTI) olarak adlandırılır. ROS patlaması, PTI ileilgili çalışmalara yaygın olarak uygulanan 9,10 numaralı ayırt edici bir PTI yanıtıdır. PAMP'ler tarafından tetiklenen ROS üretimi, süperoksit dismutaz 8 tarafından kendiliğinden hidrojen peroksite (H2 O2) dönüştürülen süperoksit (O2-) üretmek için elektronları sitozolik NADPH veya NADH'den hücre dışı oksijene aktaran plazma zarında yerleşik NADPH oksidaz veya solunum patlaması oksidaz homolog(RBOH) ailesi proteinlerine atfedilir . PAMP tarafından tetiklenen ROS patlaması oldukça hızlıdır, PAMP tedavisinden sadece birkaç dakika sonra ortaya çıkar ve ~ 10-12 dakikada zirveye ulaşır. ROS moleküllerinin büyük çoğunluğu, bir kemilüminesans testi ile kolayca ve istikrarlı bir şekilde tespit edilebilen hidrojen peroksit (H2O2) içerir.
Kemilüminesansta, kemilüminesans reaktifi, uyarılmış durum ara ürünlerini üretmek için bir katalizörün etkisi altında aktif oksijenle reaksiyona girer. Daha sonra, üründeki elektronlar ışınımsal olmayan geçiş yoluyla zemin durumuna geri döner ve fotonlar yayar. Yaygın kemilüminesans reaktifleri luminol ve L-012'yi içerir ve luminol uygulamaya 11,12,13 hakimdir. Bununla birlikte, daha fazla araştırmacı ROS üretimini tespit etmek için L-012'yi seçmektedir, çünkü L-012, luminol'e kıyasla nötr veya nötr pH koşullarına yakın koşullar altında çok daha yüksek bir ışık emisyon verimliliğine sahiptir.
Bu yazıda, pirinç (Oryza sativa) doku-yaprak diskleri ve kılıfında PAMP'lerin ortaya çıkarılmasından sonra ROS üretiminin gerçek zamanlı tespiti için L-012'ye dayanan optimize edilmiş bir kemilüminesans yöntemi açıklanmaktadır. Burada sağlanan yöntem basit, kararlı ve standartlaştırılmıştır ve farklı deneysel ihtiyaçları karşılamak için oldukça uyarlanabilir. Bu yöntemle elde edilen veriler, sıkı bir şekilde kontrol edilen koşullar altında yüksek oranda tekrarlanabilir.
Protokol
NOT: Protokol farklı bitki dokularına uygulanabilir. Bu protokolde PAMP inisitümü üzerine ROS tespiti için pirinç kılıfı ve yaprak diskleri kullanılmıştır. Farklılıklar esas olarak örnekleme yönteminden kaynaklandığından, aşağıda yalnızca ortak prosedürler açıklanmış ve gerektiğinde belirli adımlardan bahsedilmiştir.
1. Bitki kültürü
- Kabuğu çıkarılmış pirinç tohumlarını 1 dakika boyunca% 70 etanol, daha sonra 1 saat boyunca% 40 sodyum hipoklorit (NaClO) ile sterilize edin. Ardından, kalan kloru gidermek için tohumları 5 kat steril suyla durulayın.
- Tohumları aseptik olarak 1/2 MS ortamında (2.37 g / L Murashige ve Skoog (MS) ortamı, 30 g / L sakaroz, 2.1 g / L fitajel, pH 5.7, otoklavlanmış) kaplayın.
- Pirinç kılıfı yönteminde, tohumları doğrudan steril cam kapta MS ortamı ile kaplayın.
- Yaprak disk yönteminde, tohumları MS plakalarında 5-7 gün bekletin ve büyüme matrisine veya toprağa nakledin (Şekil 1A).
- Fideleri 12 saat ışık / 12 saat karanlık fotoperiyot ile bir büyüme odasında büyütün.
2. Doku hazırlama ve ön tedavi
- Pirinç kılıfı
- 10 günlük pirinç fidelerinin kılıfını, ROS tahlilinden 1 gün önce ön işlem için keskin bir tıraş bıçağı veya cerrahi bıçakla 3 mm'lik parçalara ayırın (Şekil 1B).
- Beş kılıf segmentini, 10-12 saat boyunca 100 μL ddH 2 O içeren 96 delikli bir mikrotitre plakasınınbireysel bir kuyucuğuna, karanlıkta 25 ° C'de yerleştirin, bu da yara yaralanmasına bağlı iyon sızıntısının ve savunma tepkilerinin azalmasına izin verir (Şekil 2).
NOT: Elimitasyon çözeltisine maruz kalan tutarlı bir kesme yüzeyi alanı sağlamak için kesimlerin dikey tutulmasına özen gösterilmesi, yüksek oranda tekrarlanabilir sonuçlar elde etmek için önemli bir adımdır. Segmentleri yavaşça hareket ettirin. Segmentlerde, veri varyasyonu kaynağı olabilecek fazladan kesikler veya yaralar yapmayın. Prensip olarak, ROS değerinin değişimi büyük olduğu için her test en az beş çoğaltma içermelidir. Ne kadar çok çoğaltma kümesi olursa, veriler o kadar güvenilir olur.
- Yaprak disk
- 4-6 haftalık pirinç bitkilerinden yaprak disklerini (4 mm çapında) bir pistonla biyopsi zımba kullanarak kesin. Veri varyasyonunu azaltmak için yaprak disklerini her zaman ana yeke makinesinin ikinci yaprağının orta üçte birinden (üstten numaralandırılmış) kesin (Şekil 1C).
- Bir yaprak diskini, ön işlem için 10-12 saat boyunca 100 μL ddH 2 O içeren 96 deliklibir mikrotitre plakasının bireysel bir kuyucuğuna yerleştirin, bu da PAMP'ler tarafından ROS'un indüksiyonuna müdahale edebileceğinden yaralanma ile ilgili tepkilerin azalmasına izin verir (Şekil 2).
NOT: Yaprak diskleri yavaşça çalıştırın. Deneydeki disklerde veri varyasyonuna neden olabilecek fazladan kesikler veya yaralar açmayın. ROS'un indüksiyonu çoğunlukla kesilmiş kenarın hücrelerinden meydana gelir, çünkü pirinç dokularının yüzeyleri (yapraklar veya kılıflar) hidrofobik tabakalarla kaplıdır. Sadece kesilmiş kenarların hücreleri uyarılma çözeltisi ile temas halindedir (tartışma bölümüne bakınız). - Tüm yaprak disklerini, abaksiyel yüzey yukarı bakacak şekilde, yaprak tarafı ile ilişkili varyasyonları önlemek için su ön arıtımı için bir mikrotitre plakasının kuyularında yüzer halde tutun.

Şekil 1: Kılıf örneklemesi için pirinç fidelerinin büyüme durumu ve aşamaları ve tahlilde kullanılan pirinç kılıfı ve pirinç yapraklarının parçaları. (A) 10 gün boyunca steril koşullarda 1/2 MS ortamında yetiştirilen pirinç fideleri ROS testi için örneklenebilir. Sterilize edilmiş pirinç tohumları 1/2 MS ortamında kültürlendi ve 8,5 cm çapında ve 15 cm yüksekliğinde şeffaf cam şişede 12 saat ışık/12 saat karanlık fotoperiyotta yetiştirildi. (B) Yaprak kılıflarının örnekleme kısımlarının şematik diyagramı. Yaprak kılıfları 10 günlük pirinç fidelerinden kesildi. Yaprak kılıflarının pozisyonları köklerin üstünde ve ilk yaprağın altındaydı. (C) Yaprak disklerin örnekleme konumunun şematik diyagramı. Yaprak diskleri, herhangi bir büyüme aşamasında sağlıklı pirinç bitkilerinin ana yeke makinesinin ikinci yaprağının orta üçte birinden (üstten sayım) kesilebilir. Kısaltmalar: ROS = reaktif oksijen türleri; MS = Murashige ve Skoog. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Resim 2: Farklı Oryza sativa hatları ile ROS üretimini ölçmek için plaka kurulumunun şematik diyagramı. 96 delikli bir plaka kullanarak pirinç dokularının ön işlemi ve testi. Satır 1, Satır 2 ve Satır 3 (bir plakada sekiz satıra kadar) ilgilenilen herhangi bir malzeme, farklı çeşitler, mutantlar veya transgenik çizgiler olabilir. ROS yanıtını ölçmek için dokular PAMP (PAMP, beyaz) veya PAMP olmadan (ddH2O, gri) uyarılma solüsyonları ile uyarıldı. Test edilecek numuneler ne kadar fazla olursa, okumalar arasındaki zaman aralığının o kadar uzun olduğu belirtilmelidir. Kısaltmalar: ROS = reaktif oksijen türleri; PAMP = patojenle ilişkili moleküler patern; ddH2O = çift damıtılmış su. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
3. Uyarma çözeltisinin hazırlanması
- L-012 tozunu stok çözeltisini yapmak için ddH2O ile 20 mM (6.23 mg / mL) sulu çözelti halinde çözün. Daha sonra, çalışma çözeltisini 500 μM L-012'nin son konsantrasyonunda yapmak için stok çözeltisini 50 mM Tris HCl tamponu (pH 7.5) ile seyreltin. Stok çözeltisini donmuş halde tutun ve kullanmadan önce çalışma çözeltisine seyreltin.
- PAMP, L-012 ve yaban turpu peroksidaz (HRP; ddH2O'da 10 mg / mL) içeren elimitasyon çözeltisini hazırlayın. 10 mL'lik bir uyarılma çözeltisi için, 9,4 mL'lik 50 mM Tris HCl (pH 7,5) çözeltisini, 400 μL'lik L-012 çözeltisini, 100 μL'lik HRP'yi ve 100 μL'lik flg22'yi (PAMP;ddH2O'da 10 mM) karıştırın. Negatif kontrol için, PAMP yerine 100 μL ddH2O ekleyin.
NOT: Pirinç dokularında soğuk stresi önlemek için hazırlanan uyarma çözeltilerini oda sıcaklığında tutun. Diğer PAMP'ler de kitin (nihai konsantrasyonda 20 ng / mL) gibi gerektiğinde tedavi için kullanılabilir. L-012 ışığa duyarlı olduğundan, L-012 çözeltisi içeren tüm tüpleri alüminyum folyo ile örtün.
4. Yazılımı başlatmak ve protokolü referans verilen mikroplaka okuyucu ile kurmak (bkz.
NOT: Mikroplaka okuyucu yazılımının parametrelerinin ayarlanması biraz zaman alır. Uyandırma çözeltisini eklemeden önce makineyi ve protokolü hazırlamanız önerilir (devam etmek için tek bir tıklama).
- Yazılımı başlatın. Yeni bir protokol oluşturmak veya mevcut bir protokolü kullanmak için Denemeler düğmesini tıklayın.
- Plakayı ayarlamak için açılır pencerede Prosedür'ü tıklayın. İzlenecek plakadan kuyucukları seçin.
- Toplam çalışma süresini ve okuma aralığını ayarlamak için Kinetic'i Başlat'ı tıklatın. Deneme süresini, deneysel gereksinimlere bağlı olarak 35 dakika veya daha uzun bir süreye ayarlayın. Okumaları mümkün olduğunca sık elde etmek için Minimum Aralık'ı seçin. Entegrasyon süresi için, sinyal yoğunluğuna bağlı olarak 1 s veya daha uzun bir süre seçin.
NOT: Okuma aralığı, numune sayısına ve sinyal entegrasyon süresine bağlıdır. - Doğrula'ya tıklayın | Tamam ayarları onaylamak için.
- Açılır pencerede Yeni plakayı algıla'ya tıklayın ve yazılımın yükleme plakası iletişim kutusunu sormasını bekleyin. Test edilecek plakayı taşıyıcıya yerleştirin.
- Uyandırma sisteminin kurulmasını beklemek için burada durun (bir sonraki bölümde). Uyandırma sistemi hazır olur olmaz, okumaya başlamak için Çalıştır'a tıklayın.
5. Uyandırma sisteminin kurulması ve gerçek zamanlı ROS üretiminin ölçülmesi
- ddH2O'yu önceden işlenmiş dokuları içeren kuyucuklardan dikkatlice çıkarın, herhangi bir doku hasarı veya kurumasını önleyin.
- Dokuları içeren kuyucuklara 200 μL uyarma çözeltisi eklemek için çok kanallı bir pipet kullanın.
- Karıştırmak için hafifçe sallayın. Algılamayı başlatmak için Çalıştır'ı tıklatın.
NOT: PAMP tedavisi ile bitki dokuları çok hızlı bir şekilde yanıt verir ve ROS üretir. Bu nedenle, birden fazla tedavinin olduğu durumlarda, ameliyat süresini azaltmak için öncelikle PAMP'sız negatif kontrolün tedavi edilmesi önerilmektedir. Tedaviler arasındaki uyarılma gecikmesini azaltmak için mümkün olduğunca çabuk çalışın. Uyarma çözeltisinin eklenmesi ile tespitin başlaması arasındaki süre ne kadar kısa olursa, önemli deneysel verilerin yakalanması o kadar iyi olur.
Sonuçlar
Burada, flg22 işlemi ile üretilen ROS'u belirlemek için pirinç malzemesini örnek olarak alıyoruz. Uyarılmadan sonra ROS oluşumu geçicidir. Pirinçte, ROS üretimindeki artış ilk olarak 1-2 dakika içinde tespit edilmiş, 10-12 dakikada zirveye ulaşmış ve ~ 30-35 dakika içinde taban çizgisine geri dönmüştür (Şekil 3). PAMP'ın elicitation çözeltisinde bulunmadığı ve belirgin bir ROS indüksiyonu ile sonuçlanmadığı kontrol testi ile karşılaştırıldığında, spesifik bir ROS patlaması sadece flg22 veya kitin gibi diğer PAMP'ı içeren uyandırma çözeltisi olduğunda indüklenmiştir. Bu arada, toplam ROS miktarı eğriden hesaplanabilir (Şekil 4).
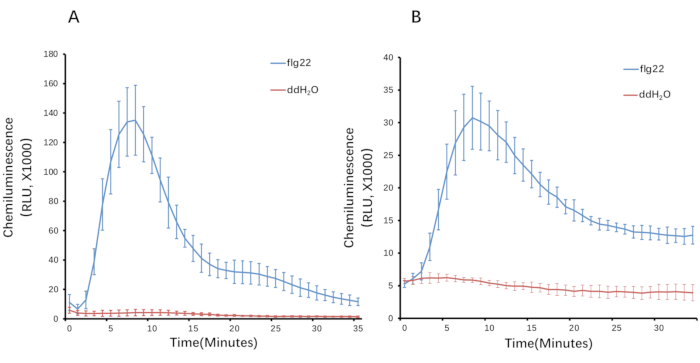
Şekil 3: Pirinç dokularında ROS indüksiyonu . (A) Yaprak diskler (4 mm çapında) ve (B) 3 mm uzunluğunda kılıflar kullanılarak flg22 ile ROS'u indükledi. ROS üretimi 35 dakika boyunca izlenir. Çubuklar, beş teknik tekrardan hesaplanan SD araçlarını gösterir. Okuma verileri bir e-tabloya aktarıldı. "ORTALAMA" ve "STDEV" formüllerini uygulayın. P", her veri noktası için çoğaltmalardan sırasıyla ortalama değeri ve standart hatayı hesaplamak için veri kümesine. Daha sonra, eğriler ROS değerlerinden oluşturuldu (ortalama değer ve standart hata). Kısaltmalar: ROS = reaktif oksijen türleri; flg22 = 22-amino asit flagellin peptid; ddH2O = çift damıtılmış su; RLU = bağıl lüminesans birimleri. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
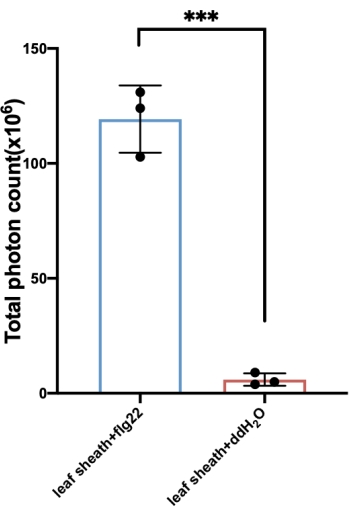
Şekil 4: Kılıfla üretilen toplam ROS miktarı. Toplam ROS miktarı genellikle testten elde edilen eğriden hesaplanır. Burada gösterilen toplam ROS miktarları Şekil 3A'ya karşılık gelen eğriden hesaplanmıştır. ROS değerlerinin toplam miktarını elde etmek için, oluşturulan toplam tutarı hesaplamak için "SUM" formülü uygulanarak birleştirilebilen her zaman aralığında oluşturulan ROS'u hesaplamak için karşılık gelen veri kümelerine "= (y̅ n+  n + 1) × zaman aralığı/2" formülünü uygulayın. Kısaltmalar: ROS = reaktif oksijen türleri; flg22 = 22-amino asit flagellin peptid; ddH2O = çift damıtılmış su. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
n + 1) × zaman aralığı/2" formülünü uygulayın. Kısaltmalar: ROS = reaktif oksijen türleri; flg22 = 22-amino asit flagellin peptid; ddH2O = çift damıtılmış su. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 5: Kesme kenarının açıkta kalan hücrelerinde ROS üretimi. Bir yaprak diskinin tek bir bütün veya iki yarısı, 96 delikli bir mikrotitre plakasının kuyucuklarına yerleştirildi, 10-12 saat boyunca 100 μL ddH2O ile ön işlemden geçirildi ve daha sonra ROS indüksiyonu için flg22 ile muamele edildi. İki yarım disk örneğinden elde edilen okuma değerleri, tüm yaprak diskinden (A) çok daha yüksektir. Ortalama olarak, iki yarım disk örneğinden elde edilen toplam değerler, tüm yaprak diskinden (B) ~ 1,6 katıdır; bu, numunelerin alanıyla değil, kenar uzunluğuyla orantılıdır. Bu sonuç, ROS'un esas olarak yara bölgesindeki hücrelerde üretildiğini desteklemektedir. Kısaltmalar: ROS = reaktif oksijen türleri; flg22 = 22-amino asit flagellin peptid; ddH2O = çift damıtılmış su. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışmanın amacı, pirinç dokularında PAMP'a yanıt olarak erken ROS üretimini ölçmek için oldukça etkili bir yöntem oluşturmaktır. Bu yöntem, işlenmiş pirinç dokularından üretilen apoplast ROS'un gerçek zamanlı olarak belirlenmesi için standartlaştırılmış bir prosedür sağlar. Bu yöntem kullanımda basit, düşük maliyetli, bileşimde berrak ve ticari kitlerden bağımsızdır. Bu yöntemi kullanarak, araştırmacılar bitkiler biyotik veya abiyotik streslere maruz kaldıklarında apoplast ROS'un gerçek zamanlı üretimini inceleyebilirler.
Bu protokolde, L-012, toksik olmayan bir kimyasal olduğu için kemilüminesans reaktifi olarak seçildi. Luminol, ROS üretimini tespit etmek için kemilüminesans testlerinde yaygın olarak kullanılmaktadır. Bununla birlikte, luminol ile pirinç ve diğer bitki dokularında ROS tespiti için uygun olmayan üç dezavantaj vardır: zayıf su çözünürlüğü, kısa tepki süresi ve sert reaksiyon pH'ı. Luminol sadece alkali koşullar altında ışık üretir, 9.5'te optimal bir pH ile, bitki hücreleri için çok sert ve istenmeyen tepkilere neden olur. Ek olarak, luminol, fizyolojik koşullar altında, nötr veya nötr pH'a yakın en yüksek ışıldayan hassasiyete sahip olan L-012'ninkinden çok daha düşük bir ışık emisyon verimliliğine sahiptir. Bu nedenle, L-012, ROS üretimini tespit etmek için canlı doku veya hücre sistemlerinde giderek daha fazla kullanılmaktadır.
PTI yanıtında ROS üretimi birçok iç veya dış faktörden etkilenir. Bu nedenle, PTI yanıtındaki ROS indüksiyonundaki varyasyon büyüktür. Varyasyonları mümkün olduğunca ortadan kaldırmak için, bu protokol test koşullarını sıkı bir şekilde kontrol etmek için önlemler alır. İlk olarak, protokoldeki uyarılma çözeltisine 50 mM'lik bir Tris-HCl tampon sistemi uygulandı. Bazı araştırmacılar ROS üretimini test etmek için tamponsuz sistemler kullansa da, bir tampon sisteminin veri tutarlılığı ve tekrarlanabilirlik açısından daha iyi bir performansa ve kontrol grubunda daha iyi bir taban çizgisine sahip olduğunu bulduk. İkincisi, yazarlar örnekleri mümkün olduğunca tutarlı bir şekilde almayı şiddetle tavsiye ediyorlar.
Dokular arasındaki tutarsızlık, veri çeşitliliğinin önemli bir kaynağıdır. Bu protokol, aynı kültür koşulları altında aynı yaprağın (sayı) veya sağlıklı bitkilerin kılıfının aynı pozisyonundan dokuların seçilmesini önerir. Yaprak disklerini her zaman ana yeke makinesinin ikinci yaprağının orta üçte birinden (üstten numaralandırılmış) keser ve farklı deney grupları veya farklı genotipler arasındaki tutarlılığı koruruz. Test dokusu olarak kılıf kullanıldığında, numune alma işlemi sırasında kılıfın kesilmesi dikey tutulmalıdır. Kesik eğikse, ortaya çıkan yara alanı tutarlı tutulamaz ve bu da kararsız deneysel sonuçlara yol açar. Üçüncüsü, dokular nazikçe ameliyat edilmeli ve aynı şekilde ön işlem görmelidir. Test dokularındaki yaralardan veya yaralanmalardan kaçınılmalıdır, çünkü yaralanma daha fazla hücreyi uyarılma çözeltisine maruz bırakacak ve bu da şüphesiz veri varyasyonuna neden olacaktır. Şekil 5'te gösterildiği gibi, ROS'un uyarılması esas olarak maruz kalan hücrelere atfedilir. Ek olarak, ROS üretiminin değeri, okumadan hemen önce yeni hasar meydana geldiğinde önemli ölçüde azalacaktır.
ROS'un bitki dokuları tarafından gerçek zamanlı üretimini tespit ederken göz önünde bulundurulması gereken bir diğer önemli faktör, sirkadiyen saatin etkisidir. Günün farklı saatlerinde okuma değerlerinde farklılıklar fark ettik. Sirkadiyen saatin ROS'un üretimini ve tepkisini ve ayrıca ROS ile ilişkili genlerin transkripsiyonel düzenlemesini etkileyebileceği kanıtlanmıştır. ROS seviyesi gün boyunca dalgalanır, öğlen saatlerinde zirveye ulaşır ve gece yarısı14'te düşer. Özetle, bu yüksek verimli prosedür, sirkadiyen saatin ROS üretimi üzerindeki etkisini önlemeye yardımcı olabilecek birden fazla numunenin aynı anda algılanmasını sağlar. Tekrarlanabilir sonuçlar elde etmek için, biyolojik replikaları günün aynı saatinde yapmanızı öneririz.
Açıklamalar
Yazarların açıklayacak çıkar çatışmaları yoktur.
Teşekkürler
Bu çalışma, Şangay Doğa Bilimleri Vakfı (Hibe Numarası: 21ZR1429300 / BS1500016), Şangay Jiao Tong Üniversitesi (Agri-X programı, Hibe Numarası: AF1500088/002), Şangay İşbirlikçi Tarım Tohumları İnovasyon Merkezi (Hibe Numarası: ZXWH2150201/001) tarafından Jiangbo Fan'a ve Shanghai Jiao Tong Üniversitesi Tıp-Mühendislik İşbirliği Projesi (hibe numarası: 21X010301734) tarafından Can Li'ye verilen hibelerle desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well microtiter plate | WHB | WHB-96-01 | |
| Ethanol absolute | Innochem | A43543 | |
| flg22 | Sangon Biotech | p20973 | PAMP |
| Gen5 | BioTek | software | |
| L-012 | FUJIFILM | 120-04891 | 8-amino-5-chloro-7-phenyl-2,3-dihydropyrido [3,4-d] pyridazine-1,4-dione, CAS #:143556-24-5 |
| Microplate reader | BioTek | Synergy 2 | |
| MS Medium | Solarbio | M8521 | |
| NaCLO | Aladdin | S101636 | |
| Peroxidase from horseradish (HRP) | Sigma | P8375 | |
| Phytagel | Sigma | P8169 | |
| Sampler | Miltex | 15110-40 | |
| Sucrose | Sangon Biotech | A502792 | |
| Tris | Sangon Biotech | A610195 |
Referanslar
- Gechev, T. S., Van Breusegem, F., Stone, J. M., Denev, I., Laloi, C. Reactive oxygen species as signals that modulate plant stress responses and programmed cell death. Bioessays. 28 (11), 1091-1101 (2006).
- Mittler, R. ROS are good. Trends in Plant Science. 22 (1), 11-19 (2017).
- Gilroy, S., et al. ROS, calcium, and electric signals: key mediators of rapid systemic signaling in plants. Plant Physiology. 171 (3), 1606-1615 (2016).
- Mittler, R., Vanderauwera, S., Gollery, M., Van Breusegem, F. Reactive oxygen gene network of plants. Trends in Plant Science. 9 (10), 490-498 (2004).
- Marino, D., Dunand, C., Puppo, A., Pauly, N. A burst of plant NADPH oxidases. Trends in Plant Science. 17 (1), 9-15 (2012).
- Mittler, R., Zandalinas, S. I., Fichman, Y., Van Breusegem, F. Reactive oxygen species signalling in plant stress responses. Nature Reviews Molecular Cell Biology. 23 (10), 663-679 (2022).
- Suzuki, N., Koussevitzky, S., Mittler, R., Miller, G. ROS and redox signalling in the response of plants to abiotic stress. Plant, Cell & Environment. 35 (2), 259-270 (2012).
- Suzuki, N., et al. Respiratory burst oxidases: the engines of ROS signaling. Current Opinion in Plant Biology. 14 (6), 691-699 (2011).
- Kadota, Y., Shirasu, K., Zipfel, C. Regulation of the NADPH oxidase RBOHD during plant immunity. Plant and Cell Physiology. 56 (8), 1472-1480 (2015).
- Segonzac, C., Zipfel, C. Activation of plant pattern-recognition receptors by bacteria. Current Opinion in Microbiology. 14 (1), 54-61 (2011).
- Roda, A., et al. Progress in chemical luminescence-based biosensors: A critical review. Biosensors and Bioelectronics. 76, 164-179 (2016).
- Hong, D., Joung, H. -. A., Lee, D. Y., Kim, S., Kim, M. -. G. Attomolar detection of cytokines using a chemiluminescence immunoassay based on an antibody-arrayed CMOS image sensor. Sensors and Actuators B: Chemical. 221, 1248-1255 (2015).
- Nishinaka, Y., et al. et al. new sensitive chemiluminescence probe, L-012, for measuring the production of superoxide anion by cells. Biochemical and Biophysical Research Communications. 193 (2), 554-559 (1993).
- Grundy, J., Stoker, C., Carre, I. A. Circadian regulation of abiotic stress tolerance in plants. Frontiers in Plant Science. 6, 648 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır