Method Article
זיהוי בזמן אמת של ייצור מיני חמצן תגובתי בתגובה חיסונית באורז עם בדיקת כימילומינסנציה
In This Article
Summary
במאמר זה אנו מתארים שיטה לזיהוי בזמן אמת של ייצור מיני חמצן תגובתי אפופלסטי (ROS) ברקמות אורז בתגובה חיסונית מולקולרית המופעלת על ידי תבניות מולקולריות הקשורות לפתוגן. שיטה זו פשוטה, סטנדרטית ומייצרת תוצאות הניתנות לשחזור בתנאים מבוקרים.
Abstract
מיני חמצן תגובתי (ROS) ממלאים תפקידים חיוניים במגוון תהליכים ביולוגיים, כולל חישה של עקה אביוטית וביוטית. עם זיהום פתוגן או אתגר עם כימיקלים הקשורים לפתוגן (דפוסים מולקולריים הקשורים לפתוגנים [PAMPs]), מערך של תגובות חיסוניות, כולל התפרצות ROS, מושרות במהירות בצמחים, אשר נקרא PAMP-triggered immunity (PTI). התפרצות ROS היא תגובת PTI בולטת, אשר מזרזת על ידי קבוצה של NADPH oxidases מקומי של קרום פלזמה - חלבונים ממשפחת RBOH. הרוב המכריע של ROS מורכב מי חמצן (H 2 O2), אשר ניתןלזהות בקלות ובהתמדה על ידי שיטת chemiluminescence מבוסס luminol. כימילומינסנציה היא תגובה המייצרת פוטונים שבה לומינול, או הנגזרת שלו (כגון L-012), עובר תגובת חמצון-חיזור עם ROS תחת פעולה של זרז. מאמר זה מתאר שיטה כימילומינסנציה אופטימלית מבוססת L-012 לזיהוי ייצור אפופלסט ROS בזמן אמת עם אליציטוט PAMP ברקמות אורז. השיטה קלה, יציבה, סטנדרטית וניתנת לשחזור בתנאים מבוקרים היטב.
Introduction
מיני חמצן תגובתי (ROS) כוללים סדרה של נגזרות חמצן פעילות מבחינה כימית, כולל רדיקלים של אניון סופראוקסיד (O2-) ונגזרותיו, רדיקלים הידרוקסילים (OH-), מי חמצן, ותוצרים של חמצן סינגלט או תגובות חיזור חמצון, המיוצרים באופן קבוע בפלסטידים ובכלורופלסטים, מיטוכונדריה, פרוקסיזומים ומקומות תת-תאיים אחרים1 . ROS ממלא תפקידים חשובים בתהליכים ביולוגיים רבים והם חיוניים לכל הצמחים 2,3,4. הספקטרום הרחב של תפקודי ROS משתנה מוויסות גדילה והתפתחות ועד לתפיסה של עקה אביוטית וביוטית 5,6,7,8.
במערכת החיסון של הצמח, קולטנים מקומיים של קרום הפלזמה של תאי הצמח - מה שמכונה קולטני זיהוי תבניות (PRR) - תופסים כימיקלים שמקורם בפתוגן - תבניות מולקולריות הקשורות לפתוגנים (PAMPs). זיהוי זה מעורר סדרה של תגובות חיסוניות מהירות, כולל זרם סידן, התפרצות ROS ומפל MAPK; לכן, שכבת חסינות זו נקראת PAMP-triggered immunity (PTI). התפרצות ROS היא תגובת PTI בולטת, שקביעתה מיושמת באופן נרחב במחקרים הקשורים ל- PTI 9,10. ייצור ROS המופעל על ידי PAMPs מיוחס לחלבונים ממשפחת NADPH oxidase (הומולוג של קרום הפלזמה), או RBOH (Respiratory burst oxidase homolog), אשר מעבירים אלקטרונים מ-NADPH ציטוסולי או NADH לחמצן חוץ-תאי כדי לייצר סופראוקסיד (O 2-) אשר מומר באופן ספונטני למי חמצן (H 2 O 2) על ידי סופראוקסיד דיסמוטאז8 . פרץ ROS המופעל על ידי PAMP הוא מהיר למדי, מופיע רק כמה דקות לאחר טיפול PAMP ומגיע לשיא של ~ 10-12 דקות. הרוב המכריע של מולקולות ROS מכילות מי חמצן (H 2 O2), אשר ניתן לזהות בקלות ובהתמדה באמצעות בדיקת כימילומינסנציה.
בכימילומינסנציה, מגיב הכימילומינסנציה מגיב עם חמצן פעיל, תחת פעולה של זרז, כדי לייצר את מתווכי המצב הנרגש. לאחר מכן, האלקטרונים במכפלה חוזרים למצב הקרקע באמצעות מעבר לא קרינתי ופולטים פוטונים. ריאגנטים כימילומינסנטיים נפוצים כוללים luminol ו- L-012, כאשר luminol שולט ביישום11,12,13. עם זאת, חוקרים נוספים בוחרים ב- L-012 כדי לזהות ייצור ROS, מכיוון של- L-012 יש יעילות פליטת אור גבוהה בהרבה בתנאי pH ניטרליים או כמעט ניטרליים בהשוואה ללומינול.
מאמר זה מתאר שיטת כימילומינסנציה אופטימלית, המבוססת על L-012, לזיהוי בזמן אמת של ייצור ROS לאחר חיסול PAMPs בדיסקים ובמעטפת של רקמות-עלי אורז (Oryza sativa). השיטה המסופקת כאן היא פשוטה, יציבה וסטנדרטית, והיא ניתנת להתאמה גבוהה כדי לענות על צרכים ניסיוניים שונים. הנתונים המתקבלים בשיטה זו ניתנים לשחזור גבוה בתנאים מבוקרים היטב.
Protocol
הערה: הפרוטוקול חל על רקמות צמחים שונות. נדן אורז ודיסקיות עלים שימשו בפרוטוקול זה לזיהוי ROS עם אליציטוט PAMP. מכיוון שהבדלים נובעים בעיקר משיטת הדגימה, רק ההליכים הנפוצים מתוארים להלן, כאשר שלבים ספציפיים מוזכרים במידת הצורך.
1. תרבות צמחים
- לעקר את זרעי האורז dehusked עם 70% אתנול במשך 1 דקות, ולאחר מכן עם 40% hypochlorite נתרן (NaClO) במשך 1 שעה. לאחר מכן, שטפו את הזרעים 5x במים סטריליים כדי להסיר שאריות כלור.
- צלחת את הזרעים aseptly על 1/2 MS בינוני (2.37 גרם / ליטר Murashige ו Skoog (MS) בינוני, 30 גרם / ליטר סוכרוז, 2.1 גרם / ליטר phytagel, pH 5.7, autoclaved).
- בשיטת נדן האורז, ישירות צלחת את הזרעים בכלי זכוכית סטרילי עם MS בינוני.
- בשיטת דיסק העלים, ציפו את הזרעים על צלחות טרשת נפוצה במשך 5-7 ימים ושתלו אותם במטריצת גדילה או באדמה (איור 1A).
- לגדל את השתילים בחדר צמיחה עם 12 שעות אור / 12 שעות כהה.
2. הכנת רקמות וטיפול מקדים
- נדן אורז
- חתכו את הנדן משתילי אורז בני 10 ימים למקטעים של 3 מ"מ עם סכין גילוח חד או להב כירורגי לטיפול מקדים יום אחד לפני בדיקת ROS (איור 1B).
- הניחו חמישה מקטעי נדן בבאר נפרדת של צלחת מיקרוטיטר בת 96 בארות המכילה 100 μL של ddH 2 O למשך 10-12 שעות, בחושך בטמפרטורה של 25°C, מה שמאפשר לדליפת יונים הקשורה לפציעה ולתגובות ההגנה לשכך (איור 2).
הערה: הקפדה על חיתוכים אנכיים כדי להבטיח שטח פנים חיתוך עקבי החשוף לפתרון האליציטוט היא צעד חשוב להשגת תוצאות הניתנות לשחזור ברמה גבוהה. הזיזו את המקטעים בעדינות. אל תבצע חתכים או פצעים נוספים במקטעים, שעלולים להוות מקור לשונות נתונים. כעיקרון, כל בדיקה חייבת להכיל לפחות חמישה עותקים משוכפלים מכיוון שהשונות של ערך ה- ROS גדולה. ככל שקיימים יותר עותקים משוכפלים, כך הנתונים אמינים יותר.
- דיסק עלה
- חותכים את דיסקיות העלים (בקוטר 4 מ"מ) מצמחי אורז בני 4-6 שבועות באמצעות ניקוב ביופסיה עם בוכנה. חתכו תמיד דיסקיות עלים מהשליש האמצעי של העלה השני (ממוספר מלמעלה) של העלה הראשי כדי לצמצם את השונות בנתונים (איור 1C).
- הניחו דיסקית עלה אחת בבאר בודדת של צלחת מיקרוטיטר בעלת 96 בארות המכילה 100 μL של ddH 2 O למשך10-12 שעות לטיפול מקדים, מה שמאפשר לתגובות הקשורות לפציעה לשכוך מאחר שהן עלולות להפריע להשראת ROS על-ידי PAMPs (איור 2).
הערה: הפעל את דיסקיות העלים בעדינות. אין לבצע חתכים או פצעים נוספים על הדיסקים בניסוי, דבר שעלול לגרום לשינויים בנתונים. השראת ROS מתרחשת בעיקר מתאי הקצה החתוך, שכן פני השטח של רקמות האורז (עלים או נדן), מכוסים בשכבות הידרופוביות. רק התאים של הקצוות החתוכים נמצאים במגע עם פתרון האליציטוט (עיין בסעיף הדיון). - שמור את כל דיסקות העלים צפות, כאשר פני השטח האבקסיאליים פונים כלפי מעלה, בבארות של צלחת מיקרוטיטר לטיפול מקדים במים כדי למנוע שינויים הקשורים לצד העלים.

איור 1: מצב הגידול והשלבים של שתילי אורז לדגימת נדן וחלקים מנדן האורז ועלי האורז ששימשו בבדיקה. (A) שתילי אורז הגדלים על 1/2 MS בינוני בתנאים סטריליים במשך 10 ימים ניתן לדגום עבור בדיקת ROS. זרעי אורז מעוקרים גודלו בתרבית בינונית של 1/2 MS וגודלו בפוטופריוד בהיר של 12 שעות / 12 שעות כהות בבקבוקון זכוכית שקוף, בקוטר 8.5 ס"מ ובגובה 15 ס"מ. (B) תרשים סכמטי של חלקי הדגימה של נדני עלים. נדני עלים נחתכו משתילי אורז בני 10 ימים. מיקומי נדן העלים היו מעל השורשים ומתחת לעלה הראשון. (C) תרשים סכמטי של מיקום הדגימה של דיסקיות עלים. ניתן לחתוך את דיסקיות העלים מהשליש האמצעי של העלה השני (ספירה מלמעלה) של המעבד הראשי של צמחי אורז בריאים בכל שלב צמיחה. קיצורים: ROS = מיני חמצן תגובתי; MS = Murashige ו Skoog. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: תרשים סכמטי של מערך הלוחות למדידת ייצור ROS עם קווים שונים של Oryza sativa. טיפול מקדים ובדיקה של רקמות אורז באמצעות צלחת 96 באר. קו 1, קו 2 וקו 3 (עד שמונה קווים על צלחת אחת) יכולים להיות כל חומר מעניין, זנים שונים, מוטנטים או קווים טרנסגניים. הרקמות עוררו באמצעות תמיסות אליציטוט עם PAMP (PAMP, לבן) או ללא PAMP (ddH2O, אפור) כדי למדוד תגובת ROS. יש לציין כי ככל שהדגימות ייבדקו יותר, כך מרווח הזמן בין הקריאות ארוך יותר. קיצורים: ROS = מיני חמצן תגובתי; PAMP = תבנית מולקולרית הקשורה לפתוגן; ddH2O = מים מזוקקים כפול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. הכנת פתרון האליציטוט
- יש להמיס אבקת L-012 בתמיסה מימית של 20 מילימטר (6.23 מ"ג/מ"ל) עם ddH2O ליצירת תמיסת המלאי. לאחר מכן, דלל את תמיסת המלאי עם מאגר 50 mM Tris HCl (pH 7.5) כדי להפוך את פתרון העבודה בריכוז הסופי של 500 μM L-012. שמור את תמיסת המלאי קפואה ומדוללת לתמיסת העבודה לפני השימוש.
- הכינו את תמיסת האליציטוט המכילה PAMP, L-012 ופרוקסידז חזרת (HRP; 10 מ"ג/מ"ל ב-ddH2O). לקבלת תמיסת אליסיטציה של 10 מ"ל, יש לערבב 9.4 מ"ל של תמיסת Tris HCl (pH 7.5) של 50 mM, 400 μL של תמיסת L-012, 100 μL של HRP ו-100 μL של flg22 (PAMP; 10 mM ב-ddH2O). עבור הבקרה השלילית, הוסף 100 μL של ddH2O במקום PAMP.
הערה: שמור את תמיסות האליציטוט המוכנות בטמפרטורת החדר כדי למנוע לחץ קר על רקמות האורז. PAMPs אחרים יכולים לשמש גם לטיפול לפי הצורך, כגון כיטין (20 ng / mL בריכוז הסופי). מכיוון ש- L-012 רגיש לאור, כסה את כל הצינורות המכילים תמיסת L-012 ברדיד אלומיניום.
4. הפעלת התוכנה והגדרת הפרוטוקול עם קורא המיקרו-צלחות המופנה (ראה טבלת חומרים)
הערה: לוקח קצת זמן להגדיר את הפרמטרים של תוכנת קורא microplate. מומלץ להכין את המכונה והפרוטוקול (קליק אחד כדי להמשיך) לפני הוספת פתרון האליציטוט.
- הפעל את התוכנה. לחץ על הלחצן ניסויים כדי ליצור פרוטוקול חדש או להשתמש בפרוטוקול קיים.
- לחץ על Procedure בחלון המוקפץ כדי להגדיר את הצלחת. בחר את הבארות מהצלחת שיש לנטר.
- לחץ על Start Kinetic כדי להגדיר את זמן הריצה הכולל ואת מרווח הזמן לקריאה. הגדר את זמן ההפעלה ל- 35 דקות או יותר, בהתאם לדרישות הניסוי. כדי להשיג קריאות בתדירות גבוהה ככל האפשר, בחר מרווח זמן מינימלי. עבור זמן שילוב, בחר 1 s או יותר, בהתאם לעוצמת האות.
הערה: מרווח הקריאה תלוי במספר הדגימות ובמשך שילוב האותות. - לחץ על אמת | אישור כדי לאשר את ההגדרות.
- לחץ על זהה את הצלחת החדשה בחלון המוקפץ והמתן עד שהתוכנה תבקש את תיבת הדו-שיח של צלחת הטעינה. הניחו את הצלחת לבדיקה על המנשא.
- עצרו כאן כדי להמתין להקמת מערכת האליציטוט (בסעיף הבא). ברגע שמערכת האליציטוט מוכנה, לחץ על הפעל כדי להתחיל בקריאה.
5. הקמת מערכת אליסיטציה ומדידת ייצור ROS בזמן אמת
- בזהירות להסיר את ddH2O מן הבארות המכילות את הרקמות שטופלו מראש, הימנעות כל נזק רקמות או התייבשות.
- השתמש פיפטה רב ערוצית כדי להוסיף 200 μL של פתרון elicitation לבארות המכילות את הרקמות.
- נערו בעדינות כדי לערבב. לחץ על הפעל כדי להתחיל בזיהוי.
הערה: עם טיפול PAMP, רקמות הצמח מגיבות ומייצרות ROS מהר מאוד. לכן, מוצע לטפל תחילה בבקרה השלילית ללא PAMP כדי לקצר את זמן הניתוח, כאשר ישנם טיפולים מרובים. לפעול במהירות האפשרית כדי להפחית את עיכוב האליסיטציה בין הטיפולים. ככל שהזמן בין הוספת פתרון האליציטוט לתחילת הגילוי קצר יותר, כך לכידת נתוני ניסוי חשובים תהיה טובה יותר.
תוצאות
כאן, אנו לוקחים חומר אורז כדוגמה כדי לקבוע את ROS המיוצר עם טיפול flg22. הדור של ROS לאחר אליציטוט הוא חולף. באורז, העלייה בייצור ROS זוהתה לראשונה תוך 1-2 דקות, הגיעה לשיא של 10-12 דקות, וחזרה לקו הבסיס תוך ~30-35 דקות (איור 3). בהשוואה למבחן הביקורת, שבו PAMP נעדר בתמיסת האליסיטציה וכתוצאה מכך לא היה אינדוקציה ברורה של ROS, פרץ ROS ספציפי נגרם רק כאשר תמיסת האליציטוט הכילה flg22, או PAMP אחר, כגון כיטין. בינתיים, ניתן לחשב את הסכום הכולל של ROS מהעקומה (איור 4).
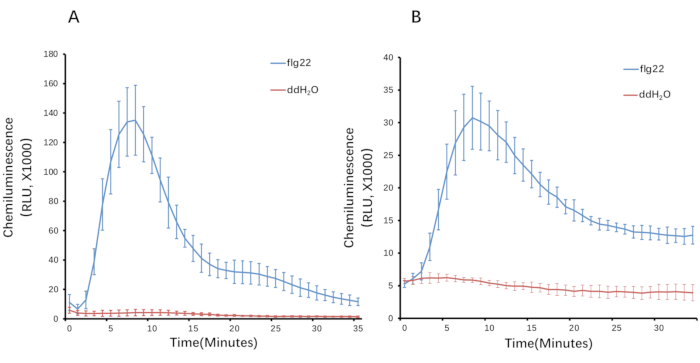
איור 3: השראת ROS ברקמות אורז. (A) דיסקיות עלים (בקוטר 4 מ"מ) ו-(B) נדנים באורך 3 מ"מ שימשו להשראת ROS על ידי flg22. דור ROS מנוטר במשך 35 דקות. עמודות מציינות את אמצעי SD המחושבים מחמש חזרות טכניות. נתוני הקריאה יובאו לגיליון אלקטרוני. החל את הנוסחאות "AVERAGE" ו- "STDEV. P" לערכת הנתונים כדי לחשב את הערך הממוצע ואת שגיאת התקן, בהתאמה, מהעותקים המשוכפלים עבור כל נקודת נתונים. לאחר מכן, העקומות נוצרו מערכי ROS (ערך ממוצע ושגיאת תקן). קיצורים: ROS = מיני חמצן תגובתי; FLG22 = פפטיד 22-חומצת אמינו שוטון; ddH2O = מים מזוקקים כפול; RLU = יחידות הארה יחסיות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
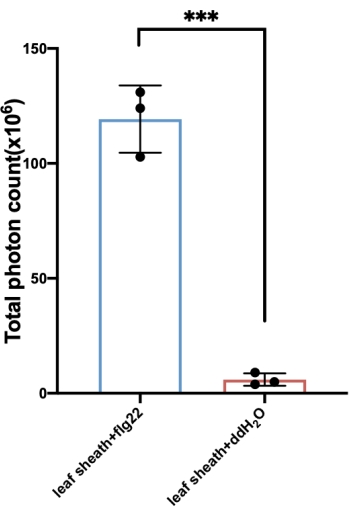
איור 4: הכמות הכוללת של ROS שנוצר עם הנדן. הסכום הכולל של ROS מחושב בדרך כלל מהעקומה המתקבלת מהבדיקה. סכומי ה-ROS הכוללים המוצגים כאן חושבו מהעקומה המתאימה לאיור 3A. כדי לקבל את הסכום הכולל של ערכי ROS, החל את הנוסחה "= (y̅ n+  n + 1) × מרווח זמן/2" על ערכות הנתונים המתאימות כדי לחשב את ה- ROS שנוצר בכל מרווח זמן, שניתן לשלב על-ידי החלת הנוסחה "SUM" כדי לחשב את הסכום הכולל שנוצר. קיצורים: ROS = מיני חמצן תגובתי; FLG22 = פפטיד 22-חומצת אמינו שוטון; ddH2O = מים מזוקקים כפול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
n + 1) × מרווח זמן/2" על ערכות הנתונים המתאימות כדי לחשב את ה- ROS שנוצר בכל מרווח זמן, שניתן לשלב על-ידי החלת הנוסחה "SUM" כדי לחשב את הסכום הכולל שנוצר. קיצורים: ROS = מיני חמצן תגובתי; FLG22 = פפטיד 22-חומצת אמינו שוטון; ddH2O = מים מזוקקים כפול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: ייצור ROS בתאים החשופים של הקצה החתוך. חצאי שלם אחד או שניים של דיסקת עלה הוכנסו לבארות של צלחת מיקרוטיטר 96 בארות, טופלו מראש עם 100 μL של ddH2O במשך 10-12 שעות, ולאחר מכן טופלו עם flg22 עבור אינדוקציה ROS. ערכי הקריאה משתי דגימות חצאי הדיסק גבוהים בהרבה מאלה של דיסק העלה כולו (A). בממוצע, הערכים הכוללים משתי דגימות חצי הדיסק הם ~ פי 1.6 מכלל דיסק העלה (B), שהוא פרופורציונלי לאורך הקצה, לא לשטח, של הדגימות. תוצאה זו תומכת בכך ש-ROS נוצרים בעיקר בתאים באתר הפצע. קיצורים: ROS = מיני חמצן תגובתי; FLG22 = פפטיד 22-חומצת אמינו שוטון; ddH2O = מים מזוקקים כפול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
מטרת מחקר זה הייתה לבסס שיטה יעילה ביותר לכימות ייצור מוקדם של ROS בתגובה ל-PAMP ברקמות אורז. שיטה זו מספקת הליך סטנדרטי לקביעה בזמן אמת של אפופלסט ROS המיוצר מרקמות אורז מטופלות. שיטה זו פשוטה בתפעול, נמוכה בעלות, ברורה בהרכב, ובלתי תלויה בערכות מסחריות. באמצעות שיטה זו, חוקרים יכולים לחקור את הייצור בזמן אמת של אפופלסט ROS כאשר צמחים נתונים לעקה ביוטית או אביוטית.
בפרוטוקול זה, L-012 נבחר כמגיב כימילומינסנציה מכיוון שהוא כימיקל לא רעיל. Luminol נמצא בשימוש נרחב במבחני chemiluminescence כדי לזהות ייצור ROS. עם זאת, ישנם שלושה חסרונות עם לומינול, מה שהופך אותו ללא מתאים לזיהוי ROS באורז וברקמות צמחים אחרות: מסיסות מים ירודה, משך תגובה קצר ו- pH תגובה קשה. לומינול מייצר אור רק בתנאים בסיסיים, עם pH אופטימלי של 9.5, שהוא קשה מדי לתאי צמח וגורם לתגובות לא רצויות. בנוסף, ללומינול יעילות פליטת אור נמוכה בהרבה מזו של L-012, בעל רגישות האור הגבוהה ביותר בתנאים פיזיולוגיים, ברמת חומציות ניטרלית או כמעט ניטרלית. לפיכך, L-012 משמש יותר ויותר ברקמות חיות או במערכות תאים כדי לזהות ייצור ROS.
ייצור ROS בתגובת PTI מושפע מגורמים פנימיים או חיצוניים רבים. לפיכך, השונות באינדוקציה של ROS בתגובת PTI היא גדולה. כדי למנוע וריאציות ככל האפשר, פרוטוקול זה נוקט אמצעים כדי לשלוט היטב בתנאי הבדיקה. ראשית, מערכת חיץ Tris-HCl של 50 mM יושמה על פתרון האליציטוט בפרוטוקול. למרות שחלק מהחוקרים משתמשים במערכות ללא אגירה כדי לבדוק ייצור ROS, מצאנו שלמערכת מאגר יש ביצועים טובים יותר ביחס לעקביות נתונים ויכולת שחזור וקו בסיס טוב יותר בקבוצת הביקורת. שנית, המחברים ממליצים בחום לקחת דגימות באופן עקבי ככל האפשר.
חוסר העקביות בין הרקמות הוא מקור עיקרי לשונות נתונים. פרוטוקול זה ממליץ לבחור רקמות מאותו מיקום של אותו עלה (מספר) או נדן של צמחים בריאים באותם תנאי תרבית. אנו תמיד חותכים דיסקיות עלים מהשליש האמצעי של העלה השני (ממוספר מלמעלה) של העלה הראשי ושומרים על עקביות בין קבוצות ניסוי שונות או גנוטיפים שונים. בעת שימוש בנדן כרקמת הבדיקה, יש לשמור על חתך הנדן אנכי במהלך תהליך הדגימה. אם החתך הוא אלכסוני, אזור הפצע שנוצר לא יכול להישמר עקבי, מה שיוביל לתוצאות ניסוי לא יציבות. שלישית, יש לנתח את הרקמות בעדינות ולטפל בהן באותו אופן. פצעים או פציעות על רקמות הבדיקה יש להימנע, שכן פצע יחשוף תאים רבים יותר לפתרון אליציטוט, אשר ללא ספק לגרום וריאציה נתונים. כפי שניתן לראות באיור 5, האליציטוט של ROS מיוחס בעיקר לתאים חשופים. בנוסף, הערך של ייצור ROS יופחת באופן דרמטי כאשר נזק חדש קורה ממש לפני הקריאה.
גורם חשוב נוסף שיש לקחת בחשבון בעת זיהוי ייצור בזמן אמת של ROS על ידי רקמות צמחים הוא ההשפעה של השעון הצירקדי. שמנו לב להבדלים בערכי הקריאה בשעות שונות של היום. הוכח כי השעון הביולוגי יכול להשפיע על הייצור והתגובה של ROS, כמו גם על ויסות השעתוק של גנים הקשורים ל- ROS. רמת ה-ROS משתנה לאורך היום, מגיעה לשיא בצהריים ויורדת בחצות14. לסיכום, הליך בעל תפוקה גבוהה זה מאפשר זיהוי סימולטני של דגימות מרובות, מה שיכול לסייע במניעת השפעת השעון הצירקדי על ייצור ROS. כדי להשיג תוצאות הניתנות לשחזור, אנו ממליצים לבצע שכפולים ביולוגיים באותה שעה ביום.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מקרן שנחאי למדעי הטבע (מספר מענק: 21ZR1429300/BS1500016), אוניברסיטת שנגחאי ג'יאו טונג (תוכנית Agri-X, מספר מענק: AF1500088/002), מרכז החדשנות השיתופית של שנחאי של זרעים חקלאיים (מספר מענק: ZXWH2150201/001) לג'יאנגבו פאן, ועל ידי פרויקט שיתוף הפעולה הרפואי-הנדסי של אוניברסיטת ג'יאו טונג בשנגחאי (מספר מענק: 21X010301734) לקאן לי.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well microtiter plate | WHB | WHB-96-01 | |
| Ethanol absolute | Innochem | A43543 | |
| flg22 | Sangon Biotech | p20973 | PAMP |
| Gen5 | BioTek | software | |
| L-012 | FUJIFILM | 120-04891 | 8-amino-5-chloro-7-phenyl-2,3-dihydropyrido [3,4-d] pyridazine-1,4-dione, CAS #:143556-24-5 |
| Microplate reader | BioTek | Synergy 2 | |
| MS Medium | Solarbio | M8521 | |
| NaCLO | Aladdin | S101636 | |
| Peroxidase from horseradish (HRP) | Sigma | P8375 | |
| Phytagel | Sigma | P8169 | |
| Sampler | Miltex | 15110-40 | |
| Sucrose | Sangon Biotech | A502792 | |
| Tris | Sangon Biotech | A610195 |
References
- Gechev, T. S., Van Breusegem, F., Stone, J. M., Denev, I., Laloi, C. Reactive oxygen species as signals that modulate plant stress responses and programmed cell death. Bioessays. 28 (11), 1091-1101 (2006).
- Mittler, R. ROS are good. Trends in Plant Science. 22 (1), 11-19 (2017).
- Gilroy, S., et al. ROS, calcium, and electric signals: key mediators of rapid systemic signaling in plants. Plant Physiology. 171 (3), 1606-1615 (2016).
- Mittler, R., Vanderauwera, S., Gollery, M., Van Breusegem, F. Reactive oxygen gene network of plants. Trends in Plant Science. 9 (10), 490-498 (2004).
- Marino, D., Dunand, C., Puppo, A., Pauly, N. A burst of plant NADPH oxidases. Trends in Plant Science. 17 (1), 9-15 (2012).
- Mittler, R., Zandalinas, S. I., Fichman, Y., Van Breusegem, F. Reactive oxygen species signalling in plant stress responses. Nature Reviews Molecular Cell Biology. 23 (10), 663-679 (2022).
- Suzuki, N., Koussevitzky, S., Mittler, R., Miller, G. ROS and redox signalling in the response of plants to abiotic stress. Plant, Cell & Environment. 35 (2), 259-270 (2012).
- Suzuki, N., et al. Respiratory burst oxidases: the engines of ROS signaling. Current Opinion in Plant Biology. 14 (6), 691-699 (2011).
- Kadota, Y., Shirasu, K., Zipfel, C. Regulation of the NADPH oxidase RBOHD during plant immunity. Plant and Cell Physiology. 56 (8), 1472-1480 (2015).
- Segonzac, C., Zipfel, C. Activation of plant pattern-recognition receptors by bacteria. Current Opinion in Microbiology. 14 (1), 54-61 (2011).
- Roda, A., et al. Progress in chemical luminescence-based biosensors: A critical review. Biosensors and Bioelectronics. 76, 164-179 (2016).
- Hong, D., Joung, H. -A., Lee, D. Y., Kim, S., Kim, M. -G. Attomolar detection of cytokines using a chemiluminescence immunoassay based on an antibody-arrayed CMOS image sensor. Sensors and Actuators B: Chemical. 221, 1248-1255 (2015).
- Nishinaka, Y., et al. et al. new sensitive chemiluminescence probe, L-012, for measuring the production of superoxide anion by cells. Biochemical and Biophysical Research Communications. 193 (2), 554-559 (1993).
- Grundy, J., Stoker, C., Carre, I. A. Circadian regulation of abiotic stress tolerance in plants. Frontiers in Plant Science. 6, 648(2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved