Method Article
Détection en temps réel de la production d’espèces réactives de l’oxygène dans la réponse immunitaire dans le riz avec un test de chimiluminescence
Dans cet article
Résumé
Ici, nous décrivons une méthode pour la détection en temps réel de la production d’espèces réactives apoplastiques de l’oxygène (ROS) dans les tissus de riz dans la réponse immunitaire déclenchée par un modèle moléculaire associé à des agents pathogènes. Cette méthode est simple, standardisée et génère des résultats hautement reproductibles dans des conditions contrôlées.
Résumé
Les espèces réactives de l’oxygène (ROS) jouent un rôle essentiel dans une variété de processus biologiques, y compris la détection des stress abiotiques et biotiques. En cas d’infection pathogène ou de provocation par des produits chimiques associés à des agents pathogènes (profils moléculaires associés aux agents pathogènes [PAMPs]), un éventail de réponses immunitaires, y compris une explosion de ROS, est rapidement induit chez les plantes, ce qui est appelé immunité déclenchée par PAMP (PTI). Un sursaut ROS est une réponse PTI caractéristique, qui est catalysée par un groupe de NADPH oxydases localisées dans la membrane plasmique - les protéines de la famille RBOH. La grande majorité des ROS comprennent du peroxyde d’hydrogène (H2O2), qui peut être facilement et régulièrement détecté par une méthode de chimiluminescence à base de luminol. La chimiluminescence est une réaction produisant des photons dans laquelle le luminol, ou son dérivé (tel que L-012), subit une réaction redox avec ROS sous l’action d’un catalyseur. Cet article décrit une méthode de chimiluminescence optimisée basée sur L-012 pour détecter la production d’apoplast ROS en temps réel lors de l’obtention de PAMP dans les tissus de riz. La méthode est facile, stable, standardisée et hautement reproductible dans des conditions fermement contrôlées.
Introduction
Les espèces réactives de l’oxygène (ROS) comprennent une série de dérivés de l’oxygène chimiquement actifs, y compris les radicaux anioniques superoxydes (O2-) et ses dérivés, les radicaux hydroxyles (OH-), le peroxyde d’hydrogène et les produits de l’oxygène singulet ou des réactions d’oxydoréduction qui sont constamment produits dans les plastes et les chloroplastes, les mitochondries, les peroxysomes et d’autres emplacements subcellulaires1 . Les ROS jouent un rôle important dans de nombreux processus biologiques et sont essentiels pour toutes les plantes 2,3,4. Le large spectre des fonctions ROS varie de la régulation de la croissance et du développement à la perception des stress abiotiques et biotiques 5,6,7,8.
Dans le système immunitaire des plantes, les récepteurs localisés de la membrane plasmique des cellules végétales - appelés récepteurs de reconnaissance de formes (PRR) - perçoivent les profils moléculaires associés aux agents pathogènes (PAMPs) dérivés de produits chimiques dérivés d’agents pathogènes. Cette reconnaissance déclenche une série de réponses immunitaires rapides, y compris l’afflux de calcium, l’éclatement des ROS et la cascade MAPK; ainsi, cette couche d’immunité est appelée immunité déclenchée par la PAMP (PTI). Le sursaut ROS est une réponse PTI caractéristique, dont la détermination est largement appliquée aux études liées à la PTI 9,10. La production de ROS déclenchée par les PAMP est attribuée à la NADPH oxydase résidant dans la membrane plasmique, ou aux protéines homologues de la famille des oxydases respiratoires éclatées (RBOH), qui transfèrent des électrons du NADPH cytosolique ou du NADH à l’oxygène extracellulaire pour produire du superoxyde (O2-) qui est spontanément converti en peroxyde d’hydrogène (H2O2) par la superoxyde dismutase8 . Le rafale ROS déclenchée par PAMP est assez rapide, apparaissant seulement quelques minutes après le traitement PAMP et culminant à ~10-12 min. La grande majorité des molécules ROS comprennent du peroxyde d’hydrogène (H2O2), qui peut être facilement et régulièrement détecté par un test de chimiluminescence.
En chimiluminescence, le réactif de chimiluminescence réagit avec l’oxygène actif, sous l’action d’un catalyseur, pour produire les intermédiaires à l’état excité. Ensuite, les électrons du produit reviennent à l’état fondamental par transition non radiative et émettent des photons. Les réactifs de chimiluminescence courants comprennent le luminol et le L-012, le luminol dominant l’application11,12,13. Cependant, de plus en plus de chercheurs choisissent L-012 pour détecter la production de ROS, car le L-012 a une efficacité d’émission de lumière beaucoup plus élevée dans des conditions de pH neutre ou quasi neutre par rapport au luminol.
Cet article décrit une méthode de chimiluminescence optimisée, basée sur L-012, pour la détection en temps réel de la production de ROS après l’obtention de PAMP dans les tissus et la gaine des tissus du riz (Oryza sativa). La méthode fournie ici est simple, stable et standardisée, et est hautement adaptable pour répondre à différents besoins expérimentaux. Les données obtenues avec cette méthode sont hautement reproductibles dans des conditions fermement contrôlées.
Protocole
NOTE: Le protocole est applicable à différents tissus végétaux. La gaine de riz et les disques foliaires ont été utilisés dans ce protocole pour la détection des ROS lors de l’obtention du PAMP. Étant donné que les différences résultent principalement de la méthode d’échantillonnage, seules les procédures communes sont décrites ci-dessous, des étapes spécifiques étant mentionnées chaque fois que nécessaire.
1. Culture végétale
- Stériliser les graines de riz décortiquées avec de l’éthanol à 70% pendant 1 min, puis avec de l’hypochlorite de sodium (NaClO) à 40% pendant 1 h. Ensuite, rincez les graines 5x avec de l’eau stérile pour éliminer le chlore résiduel.
- Plaquer les graines de façon aseptique sur milieu 1/2 MS (2,37 g/L milieu Murashige et Skoog (MS), 30 g/L de saccharose, 2,1 g/L de phytagel, pH 5,7, autoclavé).
- Dans la méthode de la gaine de riz, plaquez directement les graines dans le récipient en verre stérile avec le milieu MS.
- Dans la méthode du disque foliaire, plaquer les graines sur des plaques de SEP pendant 5 à 7 jours et les transplanter dans la matrice de croissance ou le sol (figure 1A).
- Cultivez les plants dans une salle de croissance avec une photopériode de lumière de 12 h / 12 h de photopériode.
2. Préparation et prétraitement des tissus
- Gaine de riz
- Couper la gaine des plants de riz âgés de 10 jours en segments de 3 mm à l’aide d’une lame de rasoir tranchante ou d’une lame chirurgicale pour le prétraitement 1 jour avant le test ROS (Figure 1B).
- Placer cinq segments de gaine dans un puits individuel d’une plaque de microtitrage de 96 puits contenant 100 μL de ddH2O pendant 10-12 h, dans l’obscurité à 25 °C, ce qui permet aux fuites d’ions liées aux blessures et aux réponses de défense de s’atténuer (Figure 2).
REMARQUE: Prendre soin de garder les coupes verticales pour assurer une surface de coupe constante exposée à la solution de déclenchement est une étape importante pour obtenir des résultats hautement reproductibles. Déplacez les segments doucement. Ne faites pas de coupures ou de plaies supplémentaires sur les segments, ce qui pourrait être une source de variation des données. En principe, chaque essai doit contenir au moins cinq répétitions car la variation de la valeur ROS est importante. Plus il y a de réplications, plus les données sont fiables.
- Disque de feuille
- Couper les disques foliaires (4 mm de diamètre) des plants de riz âgés de 4 à 6 semaines à l’aide d’un poinçon de biopsie avec un piston. Coupez toujours les disques foliaires du tiers médian de la deuxième feuille (numérotés à partir du haut) du motoculteur principal pour réduire la variation des données (figure 1C).
- Placer un disque foliaire dans un puits individuel d’une plaque de microtitrage de 96 puits contenant 100 μL de ddH2O pendant 10 à12heures pour le prétraitement, ce qui permet de réduire les réactions liées aux blessures car celles-ci pourraient interférer avec l’induction de ROS par les PAMP (Figure 2).
REMARQUE: Utilisez les disques de feuilles doucement. Ne faites pas de coupures ou de plaies supplémentaires sur les disques dans l’expérience, ce qui pourrait entraîner une variation des données. L’induction de ROS se produit principalement à partir des cellules du bord coupé, car les surfaces des tissus de riz (feuilles ou gaines) sont recouvertes de couches hydrophobes. Seules les cellules des bords coupés sont en contact avec la solution d’élicitation (voir la section discussion). - Gardez tous les disques foliaires flottants, avec la surface abaxiale tournée vers le haut, dans les puits d’une plaque de microtitrage pour le prétraitement de l’eau afin d’éviter toute variation associée au côté des feuilles.

Figure 1 : État de croissance et stades des plants de riz pour l’échantillonnage de la gaine et des parties de la gaine de riz et des feuilles de riz utilisées dans l’essai. (A) Les plants de riz cultivés sur 1/2 milieu MS dans des conditions stériles pendant 10 jours peuvent être échantillonnés pour le dosage ROS. Les graines de riz stérilisées ont été cultivées sur milieu 1/2 MS et cultivées en photopériode de 12 h de lumière / 12 h de foncé dans un flacon en verre transparent, de 8,5 cm de diamètre et 15 cm de hauteur. (B) Schéma de principe des parties de prélèvement des gaines foliaires. Les gaines foliaires ont été coupées à partir de plants de riz âgés de 10 jours. Les positions des gaines foliaires étaient au-dessus des racines et au-dessous de la première feuille. C) Schéma de principe de la position d’échantillonnage des disques foliaires. Les disques foliaires peuvent être coupés à partir du tiers médian de la deuxième feuille (compter à partir du haut) du motoculteur principal des plants de riz sains à n’importe quel stade de croissance. Abréviations : ROS = espèces réactives de l’oxygène; MS = Murashige et Skoog. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2: Schéma de la configuration de la plaque pour mesurer la production de ROS avec différentes lignées d’Oryza sativa. Prétraitement et test des tissus de riz à l’aide d’une plaque de 96 puits. La ligne 1, la ligne 2 et la ligne 3 (jusqu’à huit lignes sur une plaque) peuvent être n’importe quel matériau d’intérêt, différents cultivars, mutants ou lignées transgéniques. Les tissus ont été stimulés avec des solutions de déclenchement avec PAMP (PAMP, blanc) ou sans PAMP (ddH2O, gris) pour mesurer la réponse ROS. Il convient de noter que plus il y a d’échantillons à tester, plus l’intervalle de temps entre les lectures est long. Abréviations : ROS = espèces réactives de l’oxygène; PAMP = profil moléculaire associé à un agent pathogène; ddH2O = eau bidistillée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Préparation de la solution d’élicitation
- Dissoudre la poudre de L-012 dans une solution aqueuse de 20 mM (6,23 mg/mL) avec duddH2Opour obtenir la solution mère. Ensuite, diluer la solution mère avec un tampon Tris HCl de 50 mM (pH 7,5) pour obtenir la solution de travail à la concentration finale de 500 μM L-012. Conserver la solution mère congelée et diluer dans la solution de travail avant utilisation.
- Préparer la solution provoquée contenant de la PAMP, de la L-012 et de la peroxydase de raifort (HRP; 10 mg/mL dans ddH2O). Pour une solution élicitationnelle de 10 mL, mélanger 9,4 mL de solution de Tris HCl (pH 7,5) à 50 mM, 400 μL de la solution de L-012, 100 μL de HRP et 100 μL de flg22 (PAMP; 10 mM dans ddH2O). Pour le témoin négatif, ajouter 100 μL deddH2Oau lieu de PAMP.
REMARQUE: Conservez les solutions de déclenchement préparées à température ambiante pour éviter le stress dû au froid sur les tissus du riz. D’autres PAMP peuvent également être utilisés pour le traitement au besoin, comme la chitine (20 ng/mL en concentration finale). Puisque le L-012 est sensible à la lumière, couvrir tous les tubes contenant une solution de L-012 avec une feuille d’aluminium.
4. Démarrage du logiciel et configuration du protocole avec le lecteur de microplaques référencé (voir le tableau des matériaux)
REMARQUE: Il faut un certain temps pour configurer les paramètres du logiciel de lecteur de microplaques. Il est recommandé de préparer la machine et le protocole (un clic pour continuer) avant d’ajouter la solution d’élicitation.
- Démarrez le logiciel. Cliquez sur le bouton Expériences pour créer un protocole ou utiliser un protocole existant.
- Cliquez sur Procédure dans la fenêtre contextuelle pour configurer la plaque. Sélectionnez les puits de la plaque à surveiller.
- Cliquez sur Démarrer Kinetic pour configurer la durée totale d’exécution et l’intervalle de lecture. Définissez la durée d’exécution sur 35 min ou plus, selon les exigences expérimentales. Pour obtenir des lectures aussi souvent que possible, sélectionnez Intervalle minimum. Pour le temps d’intégration, choisissez 1 s ou plus, en fonction de l’intensité du signal.
REMARQUE: L’intervalle de lecture dépend du nombre d’échantillons et de la durée d’intégration du signal. - Cliquez sur Valider | OK pour confirmer les paramètres.
- Cliquez sur Détecter la nouvelle plaque dans la fenêtre contextuelle et attendez que le logiciel invite la boîte de dialogue de la plaque de charge. Placez la plaque à tester sur le support.
- Arrêtez-vous ici pour attendre que le système d’élicitation soit établi (dans la section suivante). Dès que le système d’élicitation est prêt, cliquez sur Exécuter pour commencer la lecture.
5. Mise en place du système d’élicitation et mesure de la production de ROS en temps réel
- Retirez délicatement leddH2Odes puits contenant les tissus prétraités, en évitant toute lésion tissulaire ou dessiccation.
- Utilisez une pipette multicanal pour ajouter 200 μL de la solution de déclenchement aux puits contenant les tissus.
- Secouer doucement pour mélanger. Cliquez sur Exécuter pour lancer la détection.
REMARQUE: Avec le traitement PAMP, les tissus végétaux répondent et produisent des ROS très rapidement. Par conséquent, il est suggéré que le contrôle négatif sans PAMP soit traité en premier pour réduire la durée de l’opération, lorsqu’il y a plusieurs traitements. Opérer le plus rapidement possible pour réduire le délai d’obtention entre les traitements. Plus le temps entre l’ajout de la solution d’élicitation et le début de la détection est court, meilleure sera la saisie des données expérimentales importantes.
Résultats
Ici, nous prenons l’exemple du riz pour déterminer les ROS produites avec le traitement flg22. La génération de ROS après déclenchement est transitoire. Dans le riz, l’augmentation de la production de ROS a été détectée pour la première fois en 1-2 min, a culminé à 10-12 min, et est revenue à la ligne de base en ~30-35 min (Figure 3). Par rapport à l’essai de contrôle, dans lequel le PAMP était absent de la solution de déclenchion, ce qui n’a entraîné aucune induction ROS évidente, un sursaut ROS spécifique n’a été induit que lorsque la solution de déclenchement contenant flg22, ou d’autres PAMP, tels que la chitine. Pendant ce temps, la quantité totale de ROS peut être calculée à partir de la courbe (Figure 4).
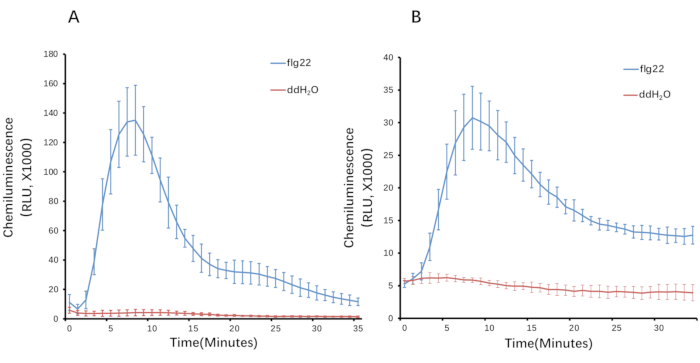
Figure 3 : Induction de ROS dans les tissus du riz. (A) Des disques foliaires (4 mm de diamètre) et (B) des gaines de 3 mm de long ont été utilisés pour induire les ROS par flg22. La production ROS est surveillée pendant 35 min. Les barres indiquent les moyennes de l’écart-type calculées à partir de cinq répétitions techniques. Les données de lecture ont été importées dans une feuille de calcul. Appliquez les formules « MOYENNE » et « STDEV ». P » au jeu de données pour calculer la valeur moyenne et l’erreur-type, respectivement, à partir des réplications pour chaque point de données. Ensuite, les courbes ont été générées à partir des valeurs ROS (valeur moyenne et erreur type). Abréviations : ROS = espèces réactives de l’oxygène; FLG22 = peptide de flagelline à 22 acides aminés; ddH2O = eau bidistillée; RLU = unités de luminescence relative. Veuillez cliquer ici pour voir une version agrandie de cette figure.
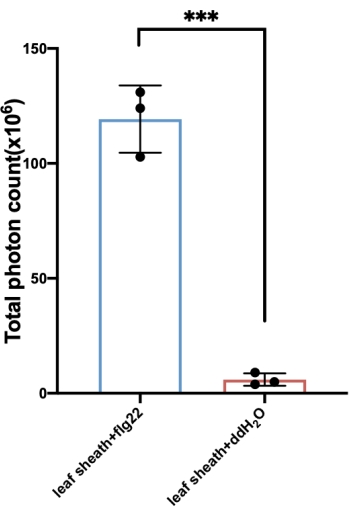
Figure 4 : La quantité totale de ROS générée avec la gaine. La quantité totale de ROS est généralement calculée à partir de la courbe obtenue à partir de l’essai. Les MDE totales indiquées ici ont été calculées à partir de la courbe correspondant à la figure 3A. Pour obtenir la quantité totale de valeurs ROS, appliquez la formule « = (y̅ n+  n + 1) intervalle de temps ×/2 » aux jeux de données correspondants pour calculer les ROS générés à chaque intervalle de temps, qui peuvent être combinés en appliquant la formule « SUM » pour calculer la quantité totale générée. Abréviations : ROS = espèces réactives de l’oxygène; FLG22 = peptide de flagelline à 22 acides aminés; ddH2O = eau bidistillée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
n + 1) intervalle de temps ×/2 » aux jeux de données correspondants pour calculer les ROS générés à chaque intervalle de temps, qui peuvent être combinés en appliquant la formule « SUM » pour calculer la quantité totale générée. Abréviations : ROS = espèces réactives de l’oxygène; FLG22 = peptide de flagelline à 22 acides aminés; ddH2O = eau bidistillée. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Production de ROS dans les cellules exposées du bord coupé. Une seule ou deux moitiés d’un disque foliaire ont été placées dans les puits d’une plaque de microtitrage de 96 puits, prétraitées avec 100 μL deddH2O pendant 10-12 h, puis traitées avec flg22 pour l’induction ROS. Les valeurs de lecture des deux échantillons de demi-disque sont beaucoup plus élevées que celles du disque feuille entier (A). En moyenne, les valeurs totales des deux échantillons de demi-disque sont ~1,6 fois supérieures à celles du disque feuille entier (B), ce qui est proportionnel à la longueur du bord, et non à la surface, des échantillons. Ce résultat confirme que les ROS sont principalement générées dans les cellules du site de la plaie. Abréviations : ROS = espèces réactives de l’oxygène; FLG22 = peptide de flagelline à 22 acides aminés; ddH2O = eau bidistillée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le but de cette étude était d’établir une méthode très efficace pour quantifier la production précoce de ROS en réponse au PAMP dans les tissus du riz. Cette méthode fournit une procédure normalisée pour la détermination en temps réel de l’apoplast ROS produit à partir de tissus de riz traités. Cette méthode est simple à utiliser, peu coûteuse, claire dans sa composition et indépendante des kits commerciaux. Grâce à cette méthode, les chercheurs peuvent étudier la production en temps réel d’apoplast ROS lorsque les plantes sont soumises à des stress biotiques ou abiotiques.
Dans ce protocole, le L-012 a été choisi comme réactif de chimiluminescence car il s’agit d’un produit chimique non toxique. Le luminol est largement utilisé dans les tests de chimiluminescence pour détecter la production de ROS. Cependant, le luminol présente trois inconvénients, qui le rendent impropre à la détection des ROS dans le riz et d’autres tissus végétaux: une faible solubilité dans l’eau, une courte durée de réponse et un pH de réaction sévère. Le luminol ne produit de la lumière que dans des conditions alcalines, avec un pH optimal à 9,5, ce qui est trop dur pour les cellules végétales et induit des réponses indésirables. De plus, le luminol possède une efficacité d’émission lumineuse beaucoup plus faible que celle du L-012, qui possède la sensibilité luminescente la plus élevée dans des conditions physiologiques, à pH neutre ou quasi neutre. Ainsi, le L-012 est de plus en plus utilisé dans les tissus vivants ou les systèmes cellulaires pour détecter la production de ROS.
La production de ROS dans la réponse PTI est influencée par de nombreux facteurs internes ou externes. Ainsi, la variation de l’induction des ROS dans la réponse PTI est importante. Pour éliminer autant que possible les variations, ce protocole prend des mesures pour contrôler fermement les conditions d’essai. Tout d’abord, un système tampon Tris-HCl de 50 mM a été appliqué à la solution d’élicitation dans le protocole. Bien que certains chercheurs utilisent des systèmes sans tampon pour tester la production de ROS, nous avons constaté qu’un système tampon a une meilleure performance en ce qui concerne la cohérence et la reproductibilité des données et une meilleure base de référence dans le groupe témoin. Deuxièmement, les auteurs suggèrent fortement de prélever des échantillons aussi régulièrement que possible.
L’incohérence entre les tissus est une source majeure de variation des données. Ce protocole recommande de choisir des tissus à partir de la même position de la même feuille (nombre) ou gaine de plantes saines dans les mêmes conditions de culture. Nous coupons toujours les disques foliaires du tiers médian de la deuxième feuille (numérotés à partir du haut) du motoculteur principal et maintenons la cohérence entre différents groupes expérimentaux ou différents génotypes. Lors de l’utilisation de la gaine comme tissu d’essai, la coupe de la gaine doit être maintenue verticale pendant le processus d’échantillonnage. Si la coupure est oblique, la surface de la plaie résultante ne peut pas être maintenue constante, ce qui entraînera des résultats expérimentaux instables. Troisièmement, les tissus doivent être opérés en douceur et prétraités de la même manière. Les plaies ou les blessures sur les tissus d’essai doivent être évitées, car les blessures exposeront davantage de cellules à la solution de déclenchion, ce qui entraînera sans aucun doute une variation des données. Comme le montre la figure 5, l’obtention de ROS est principalement attribuée aux cellules exposées. En outre, la valeur de la production de ROS sera considérablement réduite lorsque de nouveaux dommages se produiront juste avant la lecture.
Un autre facteur important à prendre en compte lors de la détection de la production en temps réel de ROS par les tissus végétaux est l’effet de l’horloge circadienne. Nous avons remarqué des différences dans les valeurs de lecture à différents moments de la journée. Il a été prouvé que l’horloge circadienne peut affecter la production et la réponse des ROS, ainsi que la régulation transcriptionnelle des gènes liés aux ROS. Le niveau de ROS fluctue tout au long de la journée, atteignant un pic à midi et plongeant à minuit14. En résumé, cette procédure à haut débit permet la détection simultanée de plusieurs échantillons, ce qui peut aider à éviter l’effet de l’horloge circadienne sur la production de ROS. Pour obtenir des résultats reproductibles, nous recommandons d’effectuer des réplications biologiques au même moment de la journée.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par des subventions de la Shanghai Natural Science Foundation (numéro de subvention: 21ZR1429300 / BS1500016), de l’Université Jiao Tong de Shanghai (programme Agri-X, numéro de subvention: AF1500088/002), du Shanghai Collaborative Innovation Center of Agri-Seeds (numéro de subvention: ZXWH2150201/001) à Jiangbo Fan et par le projet de collaboration médico-ingénierie de l’Université Jiao Tong de Shanghai (numéro de subvention: 21X010301734) à Can Li.
matériels
| Name | Company | Catalog Number | Comments |
| 96-well microtiter plate | WHB | WHB-96-01 | |
| Ethanol absolute | Innochem | A43543 | |
| flg22 | Sangon Biotech | p20973 | PAMP |
| Gen5 | BioTek | software | |
| L-012 | FUJIFILM | 120-04891 | 8-amino-5-chloro-7-phenyl-2,3-dihydropyrido [3,4-d] pyridazine-1,4-dione, CAS #:143556-24-5 |
| Microplate reader | BioTek | Synergy 2 | |
| MS Medium | Solarbio | M8521 | |
| NaCLO | Aladdin | S101636 | |
| Peroxidase from horseradish (HRP) | Sigma | P8375 | |
| Phytagel | Sigma | P8169 | |
| Sampler | Miltex | 15110-40 | |
| Sucrose | Sangon Biotech | A502792 | |
| Tris | Sangon Biotech | A610195 |
Références
- Gechev, T. S., Van Breusegem, F., Stone, J. M., Denev, I., Laloi, C. Reactive oxygen species as signals that modulate plant stress responses and programmed cell death. Bioessays. 28 (11), 1091-1101 (2006).
- Mittler, R. ROS are good. Trends in Plant Science. 22 (1), 11-19 (2017).
- Gilroy, S., et al. ROS, calcium, and electric signals: key mediators of rapid systemic signaling in plants. Plant Physiology. 171 (3), 1606-1615 (2016).
- Mittler, R., Vanderauwera, S., Gollery, M., Van Breusegem, F. Reactive oxygen gene network of plants. Trends in Plant Science. 9 (10), 490-498 (2004).
- Marino, D., Dunand, C., Puppo, A., Pauly, N. A burst of plant NADPH oxidases. Trends in Plant Science. 17 (1), 9-15 (2012).
- Mittler, R., Zandalinas, S. I., Fichman, Y., Van Breusegem, F. Reactive oxygen species signalling in plant stress responses. Nature Reviews Molecular Cell Biology. 23 (10), 663-679 (2022).
- Suzuki, N., Koussevitzky, S., Mittler, R., Miller, G. ROS and redox signalling in the response of plants to abiotic stress. Plant, Cell & Environment. 35 (2), 259-270 (2012).
- Suzuki, N., et al. Respiratory burst oxidases: the engines of ROS signaling. Current Opinion in Plant Biology. 14 (6), 691-699 (2011).
- Kadota, Y., Shirasu, K., Zipfel, C. Regulation of the NADPH oxidase RBOHD during plant immunity. Plant and Cell Physiology. 56 (8), 1472-1480 (2015).
- Segonzac, C., Zipfel, C. Activation of plant pattern-recognition receptors by bacteria. Current Opinion in Microbiology. 14 (1), 54-61 (2011).
- Roda, A., et al. Progress in chemical luminescence-based biosensors: A critical review. Biosensors and Bioelectronics. 76, 164-179 (2016).
- Hong, D., Joung, H. -. A., Lee, D. Y., Kim, S., Kim, M. -. G. Attomolar detection of cytokines using a chemiluminescence immunoassay based on an antibody-arrayed CMOS image sensor. Sensors and Actuators B: Chemical. 221, 1248-1255 (2015).
- Nishinaka, Y., et al. et al. new sensitive chemiluminescence probe, L-012, for measuring the production of superoxide anion by cells. Biochemical and Biophysical Research Communications. 193 (2), 554-559 (1993).
- Grundy, J., Stoker, C., Carre, I. A. Circadian regulation of abiotic stress tolerance in plants. Frontiers in Plant Science. 6, 648 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon