Method Article
Sığır Oositinde Mitokondriyal DNA'yı Azaltmak için Biseksiyon Kullanımı
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, bir sığır oositindeki mitokondriyal DNA kopya sayılarını önemli ölçüde azaltmak için bir protokol sunuyoruz (P < 0.0001). Bu yöntem, oosit mitokondrisini önemli ölçüde azaltmak için santrifüjleme ve biseksiyon kullanır ve yeniden yapılandırılmış türler arası somatik hücre nükleer transfer embriyolarında gelişme şansının artmasına izin verebilir.
Özet
Türler arası somatik hücre nükleer transferi (iSCNT), nesli tükenmekte olan türleri kurtarmak için kullanılabilir, ancak yeniden yapılandırılmış embriyoda iki ayrı mitokondriyal DNA (mtDNA) popülasyonu bulunur: biri alıcı ooplazmasında ve diğeri donör somatik hücrede. Bu mitokondriyal heteroplazmi, embriyo ve fetüste gelişimsel sorunlara yol açabilir. El yapımı klonlama protokolleri, mtDNA kopya sayısını azaltmak için kullanılabilecek ve yeniden yapılandırılmış bir embriyodaki mitokondriyal heteroplazmi derecesini azaltan oosit biseksiyonunu içerir. Reddedilmiş, olgun sığır oositlerinin santrifüjlenmesi, yumurtanın bir kutbunda görünür bir mitokondri-yoğun fraksiyon üretti. Oositlerin zonae pellucidae'leri bir pronaz çözeltisine maruz bırakılarak çıkarıldı. Biseksiyon, görünür mitokondri fraksiyonunu çıkarmak için bir mikrobıçak kullanılarak gerçekleştirildi. qPCR, tüm oositlerden ve biseke edilmiş ooplastlardan ekstrakte edilen DNA örneklerinde bulunan mtDNA'yı ölçmek için kullanıldı ve biseksiyondan önce ve sonra mtDNA kopya sayılarının karşılaştırılmasını sağladı. Kopya sayıları, döngü eşik değerleri, standart bir eğrinin regresyon çizgisi formülü ve mtDNA PCR ürünlerinin ve genomik PCR ürünlerinin ilgili boyutlarını içeren bir oran kullanılarak hesaplandı. Bir sığır oositinin ortalama mtDNA kopya sayısı (± standart sapma) 137.904 ± 94.768 (n = 38) idi. Bir mitokondri tükenmiş ooplastın ortalama mtDNA kopya sayısı 8,442 ± 13,806'dır (n = 33). Mitokondri bakımından zengin bir ooplastta bulunan ortalama mtDNA kopyaları 79.390 ± 58.526 mtDNA kopyasıydı (n = 28). Bu hesaplanan ortalamalar arasındaki farklar, santrifüjleme ve müteakip biseksiyonun, orijinal oosit ile karşılaştırıldığında mitokondri tükenmiş ooplastta bulunan mtDNA kopya sayılarını önemli ölçüde azaltabileceğini göstermektedir (P < 0.0001, tek yönlü ANOVA tarafından belirlenir). mtDNA'daki azalma, yeniden yapılandırılmış bir embriyodaki mitokondriyal heteroplazmi derecesini azaltmalı ve muhtemelen standart embriyonik ve fetal gelişimi teşvik etmelidir. Somatik donör hücreden mitokondriyal ekstrakt ile takviye de başarılı embriyonik gelişim elde etmek için gerekli olabilir.
Giriş
Somatik hücre nükleer transferi (SCNT), bir hayvandan enüklee edilmiş bir oositin ve aynı türdeki bir hayvandan bir somatik hücrenin füzyonunu içerir. Çoğu durumda, oosit ve somatik hücre aynı türden kaynaklanır ve canlı doğum oranları %6'nın altındadır1. Bazı araştırmalar, iki farklı türden kaynaklanan somatik bir hücre ve oositin füzyonunu içeren türler arası SCNT'nin (iSCNT) kullanımını içerir. Bu çalışmalarda, canlı doğum oranları SCNT'den bile daha düşüktür - tipik olarak% 1'den azdır1. Bununla birlikte, iSCNT, nesli tükenmekte olan türleri kurtarma yöntemi olarak kullanılma kapasitesine sahiptir, çünkü bu hayvanlardan gelen somatik hücreler germ hücrelerinden daha erişilebilirdir1. iSCNT'de kullanılan alıcı oositler genellikle inekler, domuzlar ve fareler gibi evcil veya yaygın laboratuvar türleridir. Şimdiye kadar yapılan bazı girişimler başarılı bir şekilde canlı genç üretmişlerdir, ancak üretilen yavrular intrajenerik hayvanlar olmuştur (alıcı oosit türleri ve donör hücre türleri aynı cinsin üyeleriydi)2,3,4. Interjenerik modeller (farklı cinslerdeki hayvanlardan bir oosit ve somatik hücre kullanan) henüz canlı hayvanlar üretmemiştir ve yeniden yapılandırılmış embriyoların çoğu, in vitro gelişimin 8-16 hücre aşamasında tutuklanır 5,6,7,8. Bu embriyonik gelişimsel arrestin olası bir açıklaması, embriyolarda mitokondriyal heteroplazminin ortaya çıkmasıdır - tek bir hücrede birden fazla mitokondri DNA (mtDNA) tipinin varlığı. Heteroplazmi, embriyoda veya canlı hayvanda gelişimsel verimsizlik veya başarısızlık gibi sorunlara yol açabilir1. Patogenez, hayvanın yaşamının ilerleyen dönemlerinde de ortaya çıkabilir9. Bu sorun SCNT yavrularında da mevcut olmasına rağmen, iSCNT embriyolarındaki interspesifik bileşen sorunu daha da kötüleştirmektedir.
Embriyonik mtDNA iki farklı türden geldiğinde, çoğunluğu temsil eden alıcı oosit mitokondri, donör hücrenin çekirdeği1,10 ile verimli veya etkili bir şekilde çalışmaz. iSCNT'de kullanılan iki tür arasındaki daha büyük taksonomik boşluklar muhtemelen bu sorunu yoğunlaştırır; Üretilen intrajenerik canlı yavruların (Bos taurus oositleri kullanan Bos gaurus ve Bos indicus yavruları) yanı sıra geleneksel SCNT yoluyla üretilen yavruların (örneğin, Ovis koç oositleri kullanan Yumurtalık Koç yavruları) kimera olduğu gösterilmiştir (bu hayvanlarda iki kişiden mtDNAmevcuttu 11,12,13). Yine de, interjenerik SCNT embriyoları 14,15'ten çok daha fazla geliştiler. Oosit mitokondrisi ile donör hücrenin çekirdeği arasındaki bilgi alışverişi, intrajenerik embriyoda interjenerik embriyodan daha başarılı olabilir16.
Olgun bir sığır oositindeki mtDNA miktarı, bir somatik hücrede bulunan miktardan yaklaşık 100 kat daha fazladır12. Bu oranın azaltılması, somatik hücreli mitokondrinin yeniden yapılandırılmış embriyo içinde çoğalmasını teşvik edebilir ve daha büyük bir üretken mitokondri popülasyonunun bulunmasına izin verebilir16. Bu da gelişmekte olan embriyonun gereksinimlerini karşılamak için daha fazla enerji sağlayabilir15. Oosit veya embriyonun mtDNA kopya sayısını azaltmak için yapılan önceki girişimler arasında kimyasal uygulama, mikromanipülasyon ve yumurta veya embriyonun donör hücre türlerinden16,17,18,19,20 ek mitokondri ile takviye edilmesi yer almaktadır. Bununla birlikte, kimyasal uygulama (2',3'-dideoksisitidin gibi) embriyonik gelişim için ideal değildir ve oosit mtDNA kopya sayılarını yaklaşık yarı yarıya18 oranında azaltmıştır. Mikromanipülasyon ile önceki oosit mtDNA indirgemesi, oositin mtDNA17'sinin sadece% 64'ünü çıkarmıştır. Donör hücre mitokondrisinin takviyesi uygulanabilir bir seçenek olsa da, kullanımı henüz iSCNT çalışmaları21'de canlı bir interjenerik hayvan üretmemiştir.
Oosit mtDNA kopya sayısını azaltmak için biseksiyon kullanımı henüz yayınlanmış çalışmalarda kullanılmamıştır. Ooblastları somatik bir hücre ile kaynaştırmak amacıyla oositlerin ikiye bölünmesi, tipik olarak polar cismi ve metafaz plakasını metafaz II (MII) oositinden çıkarma yöntemi olarak kullanılan el yapımı klonlamanın (HMC) öncülü. HMC, keçiler, sığırlar, domuzlar, koyunlar ve atlar22,23,24,25,26 dahil olmak üzere çeşitli türlerde başarıyla yavru üretmiştir, ancak tipik olarak biseksiyondan önce bir santrifüjleme adımı içermez. Yumurtanın yüksek hızlı santrifüjlenmesinin entegre edilmesi, oositin bir kutbunda mitokondrinin (ve dolayısıyla mtDNA'nın) izolasyonuna izin verir, bu da daha sonra bu mitokondri-yoğun fraksiyonları çıkarmak için bir mikrobıçak kullanılarak ikiye bölünebilir. İki mitokondri tükenmiş ooplast, HMC'de olduğu gibi, oosit türlerinden önemli ölçüde daha az mtDNA içeren yeniden yapılandırılmış bir embriyo oluşturmak için somatik bir hücre ile kaynaştırılabilir.
Bu protokolle cevaplamaya çalıştığımız soru, daha az heteroplazmik mtDNA içeren uygulanabilir bir yeniden yapılandırılmış embriyo üretmek için sığır oositindeki mtDNA'nın nasıl azaltılacağıdır. Bu protokolde oositler santrifüj edilmiş ve ikiye bölünmüştür. Ooplast ve bozulmamış oosit mtDNA kopya sayıları, bu tekniğin sığır oositinin mtDNA kopya sayısını azaltmadaki etkinliğini belirlemek için hesaplandı.
Protokol
Aşağıdaki protokol, Utah Eyalet Üniversitesi tarafından sağlanan hayvan bakımı ve etik kurallarına uymaktadır.
1. Medya hazırlığı
- Yumurta elleçlemeden önce, Tablo 1'de açıklandığı gibi aşağıdaki çözeltileri hazırlayın: 400 μL Hyaluronidaz Çözeltisi, 500 μL T2 ortamı, 1.020 μL T20 ortamı ve 800 μL T10 ortamı.
- T10 ortamını dört delikli bir plakanın iki kuyucuğuna, kuyu başına 400 μL'ye bölün. Bir kuyuyu "M" ile, ikincisini "MR" ile etiketleyin. Biseksiyon sonrasına kadar%5'lik bir CO 2 inkübatörüne yerleştirin.
- HEPES (HSOF) ile 500 μL Sitochalasin B (CB) / Sentetik Oviduktal Sıvı hazırlayın. Ayrı bir 1,5 mL santrifüj tüpüne 50 μL CB/HSOF çözeltisi alın.
- 40 μL pronaz çözeltisi hazırlayın. 2.680 x g'de en az 30 s santrifüj. Süpernatantın 20 μL'sini 20 μL T2 ile yeni bir santrifüj tüpüne karıştırın; bu, seyreltilmiş, 5 mg / mL pronaz çözeltisi oluşturur.
- 3 mL HSOF hazırlayın. Bir arama plakasında, ayrı ayrı dört adet 400 μL damla biriktirin; Bu plakayı bir stereomikroskop altına yerleştirin.
- 500 μL CB / T20 çözeltisi hazırlayın.
2. Sığır oositlerinin in vitro olgunlaşması (IVM)
- IVM: Kültür aspire edilen kümülüs-oosit kompleksleri (COC'ler) 38.5 °C'de, %10 FBS,0.26 IU/mL FSH ve 100 U/mL penisilin/streptomisin içeren dört kuyucuklu bir olgunlaşma ortamı kabında 21 saat boyunca %5 CO 2 inkübatörde.
- Yumurtaları inkar etmek için aşağıdaki adımları uygulayın.
- 200 μL'lik bir pipet kullanarak istenen sayıda COC'yi toplayın ve bunları 1,5 μL'lik bir santrifüj tüpünün altına yerleştirin.
- Oositlerle birlikte santrifüj tüpüne aynı hacimde 0.6 mg / mL hyaluronidaz ekleyin (yani, oositlerin ve IVM ortamının hacmi 100 μL ise, 100 μL hyaluronidaz ekleyin).
- Tüm kümülüs hücreleri çıkarılana kadar çözeltiyi kabarcıklar oluşturmadan yukarı ve aşağı pipetleyin.
- Yumurtaların olgunlaşmasını kontrol edin.
- Pipet, arama plakasındaki dört HSOF damlasından birinden oosit/hyaluronidaz çözeltisine 200 μL HSOF eklemek için kullanın.
- Yumurtaları hyaluronidaz / HSOF damlasından aktarın ve kullanılmayan 400 μL HSOF damlasına yerleştirin. Hyaluronidaz ve kümülüs hücresi kalıntılarının giderilmesine yardımcı olmak için iki ek HSOF damlası ile yıkayın.
- Bir ağız pipeti (veya 10 μL pipet ve uç) ve yüksek mikroskobik büyütme kullanarak, polar vücut varlığına göre yumurtaları yuvarlayın ve seçin.
- Yumurtaları ayıkladıktan sonra, ikiye bölünecek istenen sayıda MII oositini toplayın ve bunları 400 μL HSOF damlasına yerleştirin.
NOT: Yumurtalar 30 dakikadan daha uzun süre inkübatörün dışındaysa, oositler tekrar bir olgunlaşma ortamı kuyusuna yerleştirilebilir ve en az 30 dakika dinlenmek üzere CO2 kontrollü bir inkübatöre yerleştirilebilir. Biseke edilecek yumurta sayısını, inkübasyon dışındaki süreyi en aza indirmek için yaklaşık 30 dakika içinde biseksiyonu bitirmek için mümkün olan bir miktarla sınırlandırın. Ooblastlar somatik bir hücre ile kaynaştırılacak, aktive edilecek ve embriyo olarak kültürlenecekse, oositler şu anda enüklee edilmelidir.
3. Yumurtaların santrifüjlenmesi
NOT: Oositler inkübatöre olgunlaşma ortamında yerleştirildiyse, onları en son toplandıkları HSOF damlasına taşıyın.
- Bir ağız pipeti kullanarak, seçilen olgun oositleri HSOF damlasından toplayın ve bunları HSOF / CB çözeltisinin 50 μL'sini içeren 1,5 mL tüpe yerleştirin. Yumurtaları 12 dakika boyunca 15.000 x g'de santrifüj yapın.
NOT: Santrifüj tüpünde kabarcıkların bulunması zararlı değildir. - Yumurtalar santrifüj edilirken, biseksiyon plakasını hazırlayın.
- Deseni 60 mm'lik bir petri kabının kapağında (damla başına 20 μL) Şekil 1'de gösterildiği gibi yapın ve damlaları mineral yağ ile tamamen örtün.
- İnce uçlu bir işaretleyici kullanarak, Şekil 2'de gösterildiği gibi çanağın altındaki çizgileri işaretleyin.
- Pronaz damlasının etrafına bir kutu ve CB / T20 damlaları ile T20 damlalarının alt sırası arasında bir çizgi çizin.
- Mikrodamlaların ozmolarite değişikliklerini önlemek için santrifüjleme tamamlanana kadar kabı opak bir kapakla örtün.
- Santrifüjleme tamamlanır tamamlanmaz, çözelti içindeki yumurtaları toplamak için 200 μL'lik bir pipet kullanın ve bunları dört adet 400 μL HSOF damlası ile yeni bir arama plakasının boş bir kısmına taşıyın.
- Yumurtaları toplayın ve dört HSOF damlasından yıkayın.
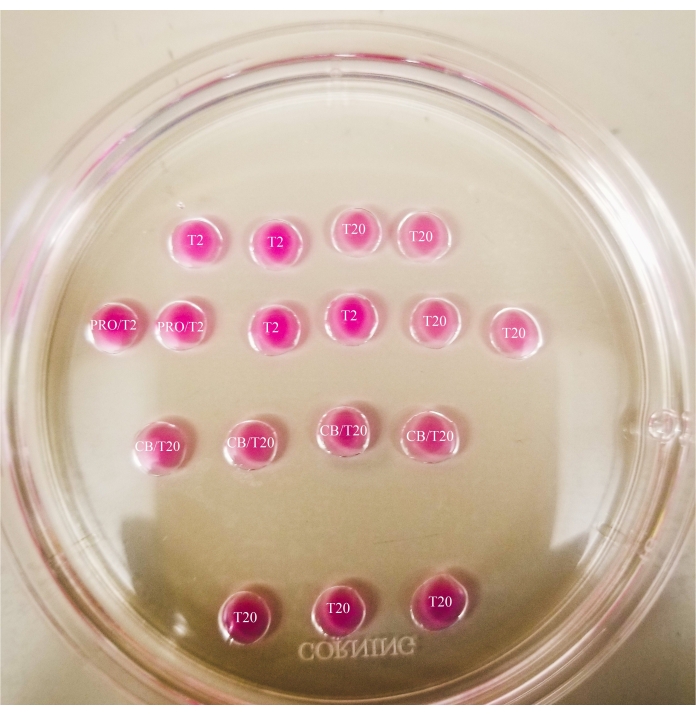
Resim 1: Bisection plakası. Gösterilen tüm damlalar 20 μL hacme sahiptir. Plaka 60 mm çapa sahiptir. Damlalar tamamen mineral yağ ile kaplanmıştır. Oositler ilk önce en üstteki ve en soldaki T2 damlasına yerleştirilecektir (burada bir yıldızla gösterilir). PRO/T2: 10 μL pronaz ve 10 μL T2, mikrodamlalar oluşturulmadan önce birleştirilir. CB / T20: 1 mL T20 başına 1 μL sitokalasin B, mikrodamlalar oluşturmadan önce birleştirilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 2: İşaretli biseksiyon plakası. Mikroskop altında yapılan gözlemler ve oosit ve ooplast transferleri için konum referansları sağlamak amacıyla plakanın altına ince uçlu bir işaretleyici ile çizgiler çizilir. Oositler ilk önce en üstteki ve en soldaki T2 damlasına yerleştirilecektir (burada bir yıldızla gösterilir). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. Biseksiyon için oositin hazırlanması
NOT: Aşağıdaki işlem, oositlerin biseksiyon için hazırlanmasını içerir.
- Isıtma aşamasını 37 °C'ye getirin.
- Santrifüjlü yumurtaları HSOF damlasından biseksiyon plakasının sol üst T2 damlasına taşımak için bir ağız pipeti kullanın, ardından yumurtaları üst sıradaki sonraki üç damladan (T2, T20, T20) yıkayın.
- Yumurtaları pronaz damlalarından birine koyun, aralarında çok az temas olduğundan veya hiç temas olmadığından emin olun.
NOT: Zona pellucida'nın çıkarılması değişen miktarlarda zaman alabilir, ancak tipik olarak bir ısıtma aşamasının kullanılmasıyla 30-120 s arasında gerçekleşir. Isıtma aşamasının olmaması bu süreyi uzatacaktır. - Zonae pellucidae'de belirgin bir deformasyon olana kadar oositleri gözlemleyin (bkz. Şekil 3).
- Tek bir oosit zona pellucida deforme olduğunda, bu oositi komşu T2 damlasına taşıyın. Ek oositler deforme olurken, tüm oositler pronazdan çıkarılıp T2 damlasına yerleştirilene kadar tekrarlayın.
- Pellucida bölgesinin sadece ince bir tabakası kalana kadar yumurtaları gözlemleyin.
- Yumurtaları sıradaki sonraki üç damla boyunca yıkayın (T2, T20, T20), ardından CB / T20 damlaları içinde dikey çizgiler halinde biriktirin (bkz. Şekil 4).
- Dikey çizgilerde daha az oosit ile başlayın ve biseksiyon becerileri ilerledikçe damla başına oosit sayısını artırın.
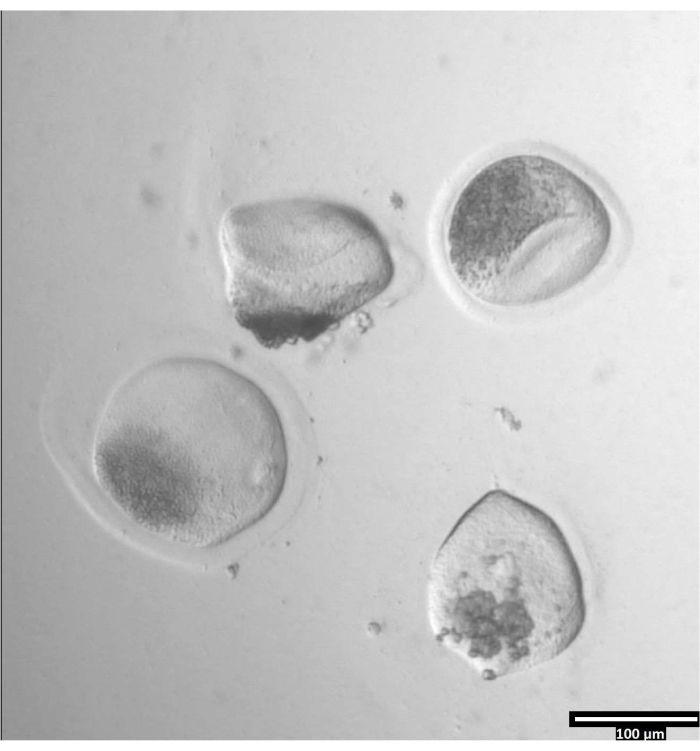
Şekil 3: Pronaz kullanılarak zona pellucida'nın çıkarılması. (80x) Bir oosit zona pellucida, pronaz zona pellucida'yı oositin bitişik T2 damlasına taşınması için yeterince etkilediğinde deforme olmaya başlayacaktır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: Biseksiyon damlalarında oosit oryantasyonu . (80x) Zonasız oositler, bieksiyondan önce her CB / T20 damlasında dikey bir yönde biriktirilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5. Yumurtaların biseksiyonu
- Oositler içeren ilk, en soldaki CB / T20 (biseksiyon) damlasına odaklanın ve yumurtaları döndürmek için bir ağız pipeti kullanın, böylece her oositin mitokondri yoğun kısmı mikroskopun koluna doğru veya uzağa bakar.
NOT: Mitokondri yoğun kısım, santrifüjlemeyi takiben oositin en karanlık kısmı olarak görünen lipitler içermeyecektir. - Mikrobıçağın ucunu, mitokondri yoğun kısmın hemen üzerindeki boşluğa paralel olarak, en üstteki oositin soluna yerleştirin. Bıçağın ucunu aynı yerde tutarak, yumurtanın içinden tamamen kesmek için bıçağı dikkatlice indirin.
- Mitokondri yoğun ooplast ve mitokondri indirgenmiş ooplastın boyut olarak benzer olduğundan emin olun; biseksiyon, iki ooplast üretmek için her oositi ikiye bölmelidir.
NOT: Tek bir oositten üretilen ooplastların karşılaştırmalı boyutları araştırma hedeflerine göre değişebilir; mitokondri indirgenmiş ooplastlar somatik bir hücre ile kaynaştırılacaksa, hacimleri mitokondri yoğun ooplastlardan daha büyük olmalıdır. - Bıçağın oositi mitokondri yoğun kısmın üstünde ve lipit yoğun kısmın altında, santrifüjlü oositin en berrak segmentinde ikiye böldüğünden emin olun.
- Mitokondri yoğun ooplast ve mitokondri indirgenmiş ooplastın boyut olarak benzer olduğundan emin olun; biseksiyon, iki ooplast üretmek için her oositi ikiye bölmelidir.
- Bıçağı kaldırırken, aynı çizginin korunduğundan ve bıçağın ucunun aynı yerde kaldığından emin olun, ardından ucu plakadan yavaşça kaldırın.
- İlk biseksiyon damlasındaki tüm oositler için biseksiyon adımlarını tekrarlayın. Ek damlalarda oositler varsa, kalan yumurtaları yönlendirin ve ikiye bölün.
- Bir ağız pipeti kullanarak, ilk biseksiyon damlasından mitokondri indirgenmiş ooplastları toplayın. Bunları plakanın alt satırında bulunan sol taraftaki T20 damlasına yerleştirin. Kalan tüm biseksiyon damlaları için tekrarlayın.
NOT: Mitokondri indirgenmiş ooplastlar, yumurtanın geri kalanından daha koyu renkli lipitler içerecektir. - Bir ağız pipeti kullanarak, ilk biseksiyon damlasından mitokondri yoğun ooplastları toplayın. Bunları plakanın alt satırında bulunan sağ taraftaki T20 damlasına yerleştirin. Kalan tüm biseksiyon damlaları için tekrarlayın.
NOT: Mitokondri yoğun bölgeler, görünüşte açık gri olacak görünür bir organel konglomerasyonuna sahip olacaktır. - T10 dört kuyucuklu tabağı inkübatörden alın. Bir ağız pipeti kullanarak, tüm mitokondri indirgenmiş ooplastları "MR" etiketli kuyuya taşıyın ve mitokondri yoğun ooblastları "M" etiketli kuyuya taşıyın.
- Dört delikli plakayı CO2 kontrollü inkübatöre geri yerleştirin. Ooblastların mtDNA'nın nicelleştirilmesinden önce en az 30 dakika dinlenmesine izin verin.
6. mtDNA'nın nicelleştirilmesi
- Tek tek örneklerden (tek oositler, tek mitokondri-yoğun ooplastlar, tek mitokondri-tükenmiş ooplastlar) DNA çıkarmak için küçük bir numuneden materyal çıkarmak için tasarlanmış bir DNA ekstraksiyon kiti kullanın.
- DNA'nın her bir örnekten başarıyla çıkarıldığından emin olmak için seçtiğiniz bir DNA niceleme yöntemini kullanın. Kantitatif polimeraz zincir reaksiyonu (qPCR) o anda tamamlanmayacaksa, ekstrakte edilen DNA'yı -80 ° C'lik bir dondurucuda etiketli bir tüpte dondurun.
- qPCR gerçekleştirme
- Astar dizileri ile birlikte her qPCR tüpüne eklenecek her bir reaktifin hacmini belirlemek için Tablo 2'ye bakın. Bu primerler, sığır mtDNA'sının 12S bölgesini yükseltmek için tasarlanmıştır.
- İlk denatürasyon süresini 10 dakika için ayarlayın, ardından 35 döngü: 94 ° C'de 30 s denatürasyon, 60 ° C'de 15 s tavlama ve 72 ° C'de 15 s uzatma. Reaksiyon tamamlandığında, döngü eşiği (Ct) değerlerini kaydedin.
NOT: Göreceli mtDNA kopya numarası değerlerini elde etmek için, katlanarak artan, bilinen mtDNA kopya numaralarına sahip örnekler kullanılarak standart bir eğri üretilmelidir. Döngü eşik değerlerinin daha sonra göreceli mtDNA kopya sayılarını belirlemek için aşağıdaki formüller kullanılarak manipüle edilmesi gerekir. - Aşağıdaki denklemi kullanarak DNA'nın konsantrasyonunu elde edin:
DNA konsantrasyonu = (10 (Ct-intercept/slope)) x test edilmiş hacim - Aşağıdaki denklemi kullanarak kopya numarasını edinin:
Kopya numarası =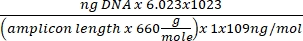
- Aşağıdaki denklemi kullanarak kopya numarasını edinin:
Hücre başına kopyalama sayısı = 2 x

Şekil 5: Somatik hücre mtDNA standart eğrisi. Bu standart eğri, qPCR reaktifleri ve protokol adım 6.3'te açıklandığı gibi program kullanılarak sığır somatik hücrelerinin logaritmik konsantrasyonlarının mtDNA nicelleştirilmesiyle oluşturulmuştur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Kantitatif PCR (qPCR) sonuçları, her bir ooplastta bulunan mtDNA'nın göreceli miktarlarını belirlemek için kullanılır. Tarif edilen reaksiyon, sığır mtDNA'sının 12S bölgesini büyütmek için tasarlanmıştır.
Biseksiyon başarılı olursa, tüm oositlerden ve mitokondri yoğun ooblastlardan alınan örnekler benzer Ct değerlerine sahip olacaktır. Mitokondri indirgenmiş ooplastlardan alınan örnekler, diğer iki gruptan alınan örneklere kıyasla daha yüksek Ct değerlerine sahip olacaktır. Başarılı biseksiyon sonuçlarını gösteren bir Ct grafiği aşağıda gösterilmiştir. Bu sonuçlar, biseksiyonun mitokondri ile indirgenmiş ooblastlardaki mtDNA içeriğini etkili bir şekilde azalttığını göstermektedir (Şekil 6).
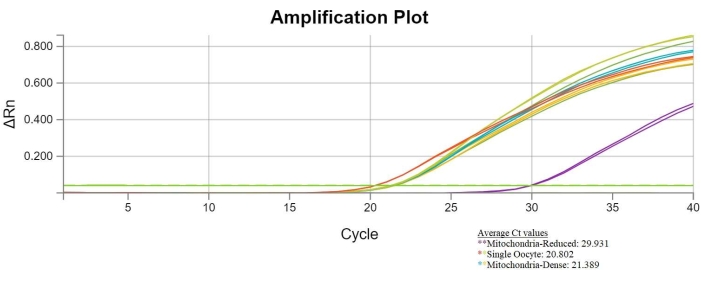
Şekil 6: Başarılı biseksiyon qPCR sonuçları. Döngü sayısı ve floresanı karşılaştıran grafik, tek oositlerin, mitokondri indirgenmiş ooplastların (mor çizgilerle temsil edilir) ve mitokondri yoğun ooplastların döngü eşik değerlerini görüntüler. Mitokondri indirgenmiş ooblastların Ct değerleri ortalama 29.931 (mor çizgiler), tek oositlerin ortalama Ct değeri 20.802 (kırmızı ve yeşil çizgiler) ve mitokondri yoğun ooplastların ortalama Ct değeri 21.389'dur (mavi ve altın çizgiler). Mitokondri indirgenmiş ooplast örneklerinin artmış Ct değerleri, bu örneklerdeki mtDNA kopya sayısında bir azalma olduğunu göstermektedir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Başarısız biseksiyon sonuçlarını gösteren bir Ct grafiği Şekil 7'de gösterilmiştir. Bu sonuçlar, biseksiyonun mitokondri indirgenmiş ooplastlardaki mtDNA içeriğini etkili bir şekilde azaltmadığını göstermektedir:

Şekil 7: Başarısız biseksiyon qPCR sonuçları. Döngü sayısı ve floresanı karşılaştıran çizgi grafik, hepsi 20.232-20.757 aralığında Ct değerlerine sahip olan tek oositlerin (koyu yeşil ve açık yeşil çizgiler), mitokondri indirgenmiş ooplastların (mor çizgiler) ve mitokondri yoğun ooplastların (mavi ve altın çizgiler) döngü eşik değerlerini görüntüler. Bu, mitokondri indirgenmiş ooplast örneklerinde mtDNA kopya sayısında önemli bir değişiklik olmadığını gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Standart bir eğrinin üretilmesini ve sağlanan mtDNA kopya sayısı formüllerinin kullanılmasını takiben, bu protokol kullanılarak ortalama %93.88'lik bir oosit mtDNA redüksiyonu sağlanmıştır (Şekil 8).

Şekil 8: Bütün oositlerden, mitokondri indirgenmiş ooplastlardan ve mitokondri yoğun ooplastlardan elde edilen göreceli mitokondriyal DNA kopya sayılarını karşılaştıran kutu grafiği. Bütün oositler (n=38), mitokondri indirgenmiş ooplastlar (n=34) ve mitokondri yoğun ooplastlar (n=29). Mitokondri indirgenmiş ooplastlar, diğer iki gruba kıyasla anlamlı derecede daha az kopya sayısına sahiptir (P < 0.001). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Çözüm | Toplam Hacim | Çözücü | Çözünür |
| Hyaluronidal Çözeltisi | 400 μL | 1 mL M-199 | 0.6 mg Hyaluronudaz |
| T2 Medya | 500 μL | M-199 Serisi | %2 Fetal Sığır Serumu (v/v) |
| T20 Medya | 1020 μL | M-199 Serisi | %20 Fetal Sığır Serumu (v/v) |
| T10 Medya | 800 μL | 400 μL T2 | 400 μL T20 |
| CB/HSOF | 500 μL | 499.5 μL HEPES (HSOF) ile Sentetik Oviduktal Sıvı | 0.5 μL 10 mg/mL Sitokalasin B (CB) |
| Pronaz Çözeltisi | 40 μL | 1 mL M-199 | 10 mg pronaz |
| T20/CB | 500 μL | 499,5 μL T20 | 0.5 μL 10 mg/mL CB |
Tablo 1: Gerekli çözümler. Protokol içinde gerekli olan her çözelti için hacimlerde çözünen maddeler ve çözücüler sağlar.
| Reaktif | Hacim |
| qPCR ana karışımı | 10 μL |
| İleri astar | 0,6 μL |
| Ters astar | 0,6 μL |
| DNA örneği | 4,4 μL |
| DNaz içermeyen su | 4,4 μL |
| Toplam Hacim | 20 μL |
| İleri Astar GGGCTACATTCTCTACACCAAG | |
| Ters Astar GTGCTTCATGGCCTAATTCAAC | |
Tablo 2: Kantitatif PCR bileşimi. Her kantitatif PCR tüpü için gerekli olan tüm reaktiflerin ileri ve geri primer dizilerini ve hacimlerini sağlar.
Tartışmalar
Daha önce oositlerde mtDNA kopya sayılarını azaltmak için kullanılan yöntemlerin dezavantajları vardır. Mitokondrilerin oositlerden mikromanipülasyon temelli uzaklaştırılması, mtDNA kopya sayılarını ortalama %64 oranında azaltır27. Daha önce enükleasyon için kullanılan benzersiz bir yöntem, küçük çaplı Pasteur pipetlerin kullanılmasını ve bir mikrodamla ortam ile çevresindeki mineral yağ arasındaki sınırda zona pellucida içermeyen bir oositin bölünmesini içerir. Oosit santrifüjlemesinin kullanımı ile birlikte, bu yaklaşım uygulanabilir mitokondri indirgenmiş ooplastlarüretebilir 28. Bununla birlikte, santrifüjleme ve bu oosit bölme yönteminin kombinasyonunun embriyo ürettiği henüz bildirilmemiştir. Kimyasal mitokondri indirgeme yöntemleri (oositlerin bir mtDNA sentez inhibitörü olan 2′,3′-dideoksisitine (ddC) maruz kalması gibi), oosit mtDNA kopya sayılarını% 50'ye kadar azaltmıştır ve COC'lerin in vitro olgunlaşma (IVM) sırasında 40 saatten fazla kimyasala maruz kalmasını gerektirir16,27. Domuz oositlerinin ddC takviyeli bir ortamda 40 saat boyunca inkübe edilmesi, yeniden yapılandırılmış embriyolar16 için sorun yaratmamış olsa da, sığır oositlerinin 20-22 saatlik IVM'leri veya sonraki embriyonik gelişimleri sırasında ddC'ye maruz kalmaları ile ilgili henüz yayınlanmış veriler yoktur. Bu yazıda açıklanan yöntem, göreceli mtDNA kopya sayısını yaklaşık% 93.88 oranında azaltarak, ortalama 45.565 ± 37.169 kopyadan (ortalama ± SD) 8.396 ± 13.287'ye düşürmektedir.
Protokoldeki birkaç adım, bir yumurtanın mitokondri DNA (mtDNA) kopya sayısını etkili bir şekilde azaltmak açısından tatmin edici sonuçlar elde etmek için kritik öneme sahiptir. Yumurtaları optimize edilmiş hızda (15.000 x g) ve zamanda (12 dakika) santrifüjlemek, her oositin bir kutbunda daha konsantre bir mitokondri fraksiyonu oluşturacaktır. HEPES (CB / HSOF) çözeltisi (50 μL) ile Sitokalasin B / Sentetik Oviduktal Sıvının doğru hacmi, santrifüjleme nedeniyle oosit lizisini muhtemelen ortadan kaldıracaktır. Santrifüjlemeyi takiben, zona pellucida (ZP) bir pronaz çözeltisine maruz bırakılarak çıkarılır; ZP'nin tamamen çıkarılması daha hassas biseksiyon sağlayacaktır ve ayrıca kalan kümülüs hücrelerini oositlerden ayırmalıdır. ZP'yi çıkarırken mikroskopta bir ısıtma aşamasının kullanılması isteğe bağlıdır, ancak ZP'nin çıkarılmasını en az 1 dakika hızlandırır. Zona pellucida içermeyen (ZF) oositlerin biseksiyon damlalarında oryantasyonu, onları doğru bir şekilde biseke etmek için kritik öneme sahiptir. Her oositin bir kutbunda bulunan mitokondri fraksiyonu açıkça görülebilmeli ve biseksiyondan önce yumurtanın üstünde veya altında yer almalıdır. Karşı kutup koyu lipit damlacıkları içerecektir. Biseksiyonu takiben, ooplastların seçimi ve doğru sınıflandırılması (mitokondri-yoğun veya mitokondri-tükenmiş olarak), biseksiyonun doğru bir değerlendirmesini elde etmek için çok önemlidir. Hangi Metafaz II (MII) oositlerinin bisekt edileceğinin seçilmesi de önemlidir. Kullanılan oositlerin küresel olmasını ve homojen sitoplazmaya sahip olmasını sağlamak, muhtemelen her oosit ve ooplastta bulunan mtDNA kopya sayılarında bir fark yaratacaktır. Bireysel kantitatif polimeraz zincir reaksiyonlarını (qPCR) tasarlarken ve sentezlerken, her reaksiyonda doğru primerlerin ve reaktif konsantrasyonlarının kullanılmasını sağlamak, doğru sonuçlar elde etmek için önemlidir. Standart bir eğri üretilirse, mümkün olduğunca hassas bir şekilde oluşturulmalı ve daha fazla doğruluk elde etmek için tüm reaksiyonlar üçlü olarak gerçekleştirilmelidir. Her qPCR fazının süreleri ve sıcaklıkları her çalışma için aynı kalmalıdır.
Protokolü takip ederken bazı sorunlar ortaya çıkabilir. Biseksiyon plakasına yağ eklerken, damlaların sadece kaplandığından emin olun; Çok fazla yağ pipet kullanımını daha az verimli hale getirirken, çok az yağ damlaların buharlaşmasına neden olacaktır. Bu buharlaşma, çözeltilerin ozmolaritesinde bir değişikliğe neden olur ve bu da oositlere ve ooplastlara zararlı olabilir. Oositler ZP'nin sindirimini takiben lize olurlarsa, bu muhtemelen kişisel deneyim ve gözlemlere dayanarak aşağıdakilerden birine veya her ikisine de bağlıdır: oositler öngörülen süre ve hız için santrifüj edilmedi ve / veya oositler çok uzun süre pronaza maruz kaldı. Bazı ZF oositleri, biseksiyon damlaları içinde tamamen küresel bir şekil kazanamayabilir. Tüm ZF oositlerinin biseksiyon için en uygun şekilde konumlandırılamayacağını unutmayın. Bu durumda, üç seçenek vardır: ZF oositlerine küresel bir şekil kazanmaları için ek süre verin; biseksiyondan önce oositleri mikrobıçakla daha dik bir konumda yavaşça tutun; doğru konumlandırılamayan yumurtaları ikiye bölmeyin. Biseksiyondan sonra hangi ooplastların mitokondri yoğun veya mitokondri tükenmiş olduğunun belirlenmesi nicelleştirme sonuçlarını etkileyecektir. Ooplastları sınıflandırmak zorsa, ikiye bölünecek yumurtaları, mitokondri fraksiyonu her zaman damlanın üstüne veya altına doğru işaret edecek şekilde konumlandırın ve / veya kutuplarından birinde yumurtanın karanlık bir kısmını arayın (bu lipit damlacıkları mitokondri fraksiyonunun karşı kutbunda yoğunlaşır). Bazen, ooplastlar birbirine ve / veya plakadaki mikrobıçak tarafından yapılan girintiye yapışabilir. Bazen, ooplastlara küresel bir şekli yeniden kazanmaları için ek süre sağlamak, ayırmaya yardımcı olacaktır. Diğer seçenekler arasında plakaya hafifçe dokunmak, pipetin içine ve dışına nazikçe emmek ve/veya ooplastları nazikçe ayırmak için pipetin kenarını kullanmak sayılabilir.
Bu mtDNA kopya sayısı azaltma yönteminin sınırlamaları vardır; biri oosit kaynağına dayanır, diğeri ise ZP'nin oositten çıkarılmasından kaynaklanmaktadır. Oosit kaynağı (hayvanın kendisi, spesifik yumurtalık ve spesifik folikül), bu spesifik oosit içindeki mtDNA kopya sayılarını büyük ölçüde etkileyecektir. Tek bir oositin ortalama mtDNA kopya sayısı etrafında büyük bir standart sapma vardır, bu da kopya sayısının ne kadar değişken olabileceğini gösterir. Birçok tek oosit kantiksiyon reaksiyonu, ooplastlar ve diğer oositlerle karşılaştırılacak sağlam bir tek oosit standart kopya sayısına sahip olmak için gereklidir. Büyük standart sapma aynı zamanda ooplastın oosit ile karşılaştırılmasını daha az mutlak hale getirir, çünkü ooplastın kopya sayısı orijinli oosit ile karşılaştırılamaz.
Oositin zonae pellucidae'sinin sindirimi, ortaya çıkan ZF oosit ve oospats'ı, zonae pellucidae'lerinin çıkarılmasından önce olduğundan çok daha kırılgan hale getirir. Bu kırılganlık, özellikle bir mikroblade kullanımı ile ooplastların ve ZF oositlerinin kendilerinin daha yüksek lizis oranlarına yol açar - büyük miktarda özen ve hassasiyet kullanılmalıdır. Oplastlar füzyon için kullanılırsa, füzyon girişiminde bulunulmadan önce biseksiyondan sonra dinlenmeleri gerekir. Aksi takdirde, ooplastların çoğu muhtemelen lize olacaktır. Mitokondri tükenmiş ooplastlar, mitokondri yoğun muadillerinden daha hassas olma eğilimindedir. Oositin mikrotübülleri, santrifüjleme sırasında mitokondri ile oositin aynı kutbuna göç etme eğilimindedir, bu da mitokondri tükenmiş ooplastları daha az yapısal bileşenle bırakır29. Diğer oosit organellerinin bu protokolde ooplast üretmek için kullanılan santrifüjleme ve biseksiyon kombinasyonundan olumsuz etkilenip etkilenmediğini belirlemek için ek araştırma ve boyama gereklidir.
Oosit mitokondrisindeki azalma, sonuçta ortaya çıkan bir iSCNT embriyosunda oosit türünün mitokondrisini azaltacak, bu nedenle yeniden yapılandırılmış embriyoda mitokondri heteroplazmi insidansını azaltacaktır. Embriyonun gelişme şansı karşılaştırmalı olarak artacaktır, ancak gelişim sırasında enerji gereksinimlerini karşılamak için muhtemelen donör hücre türlerinden mitokondri takviyesi gerektirecektir. Şimdiye kadar, interjenerik haçlar kullanan iSCNT girişimleri canlı yavrular üretmemiştir. iSCNT embriyolarında heteroplazminin azalması başarılı gebelik olasılığını artırabilir. iSCNT, nesli tükenmekte olan30 olarak sınıflandırılan 40.000 türün bazılarının kurtarılmasına yardımcı olabilecek bir yöntemdir. Bu türlerden gelen somatik hücreler tipik olarak germ hücrelerinden daha erişilebilir olduğundan, iSCNT bu somatik hücreleri, yerli türlerden oositlerle birlikte kullanabilir. İntrajenerik girişimler canlı hayvan üretmede başarılı olmuştur 31,32,33, ancak yavrular mtDNA için tipik olarak kimeriktir ve intrajenerik bir oosit kaynağı bulmak her zaman mümkün değildir. mtDNA kopya sayılarını azaltmak amacıyla oositlerin biseksiyonu, ardından bu ooblastların interspesifik bir somatik hücre ile füzyonu, iSCNT embriyolarında kimerizmi ve heteroplazmiyi azaltacaktır. Bu azalmalar nedeniyle, tarif edilen yöntemin kullanılması, interjenerik canlı doğumların ve nesli tükenmekte olan türlerin devamının daha büyük bir potansiyeline izin verir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Yazarlar, Utah Eyalet Üniversitesi'ndeki meslektaşlarına, San Diego Hayvanat Bahçesi'ndeki Üreme Bilimleri araştırmacılarına ve Genus PLC'deki Dr. Rebecca Krişer'e teşekkür etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tubes | Fisher Scientific | 5408129 | |
| 60 mm dish | Sigma-Aldrich | D8054 | |
| Centrifuge | Eppendorf | 5424 | |
| Cytochalasin B | Sigma-Aldrich | C6762 | |
| Fetal Bovine Serum | Sigma-Aldrich | F2442 | |
| M199 Media | Sigma-Aldrich | M4530 | |
| Mineral Oil | Sigma-Aldrich | M8410 | |
| Mini Centrifuge | SCILOGEX | D1008 | |
| mtDNA Primer: Forward (12S) | GGGCTACATTCTCTACACCAAG | ||
| mtDNA Primer: Reverse (12S) | GTGCTTCATGGCCTAATTCAAC | ||
| NanoDrop Spectrophotometer | Thermo Scientific | ND2000 | |
| Opthalmic Scalpel with Aluminum Handle | PFM Medical | 207300633 | Microblade for bisection |
| Protease/pronase | Sigma-Aldrich | P5147 | |
| QIAamp DNA Micro Kit | Qiagen | 56304 | |
| QuantStudio™ 3 - 96-Well 0.2-mL | ThermoFisher | A28567 | |
| Search plate | Fisher Scientific | FB0875711A | |
| SYBR Green qPCR Master Mix | ThermoFisher | K0221 | qPCR master mix |
| Synthetic Oviductal Fluid with HEPES (HSOF) | |||
| ThermoPlate | Tokai Hit | TPi-SMZSSX | Heating stage |
Referanslar
- Loi, P., Modlinski, J. A., Ptak, G. Interspecies somatic cell nuclear transfer: A salvage tool seeking first aid. Theriogenology. 76 (2), 217-228 (2011).
- Wani, N. A., Vettical, B. S., Hong, S. B. First cloned Bactrian camel (camelus bactrianus) calf produced by interspecies somatic cell nuclear transfer: A step towards preserving the critically endangered wild Bactrian camels. PLOS ONE. 12 (5), 0177800(2017).
- Oh, H. J., et al. Cloning endangered gray wolves (canis lupus) from somatic cells collected postmortem. Theriogenology. 70 (4), 638-647 (2008).
- Srirattana, K., et al. Full-term development of gaur-bovine interspecies somatic cell nuclear transfer embryos: Effect of trichostatin a treatment. Cellular Reprogramming. 14 (3), 248-257 (2012).
- Kwon, D. K., et al. Blastocysts derived from adult fibroblasts of a rhesus monkey (macaca mulatta) using interspecies somatic cell nuclear transfer. Zygote. 19 (3), 199-204 (2011).
- Lee, E., et al. Production of cloned sei whale (Balaenoptera borealis) embryos by interspecies somatic cell nuclear transfer using enucleated pig oocytes. Journal of Veterinary Science. 10 (4), 285(2009).
- Lorthongpanich, C., Laowtammathron, C., Chan, A. W., Kedutat-Cairns, M., Parnpai, R. Development of interspecies cloned monkey embryos reconstructed with bovine enucleated oocytes. Journal of Reproduction and Development. 54 (5), 306-313 (2008).
- Hong, S. G., et al. Production of transgenic canine embryos using interspecies somatic cell nuclear transfer. Zygote. 20 (1), 67-72 (2011).
- Stewart, J. B., Chinnery, P. F. The dynamics of mitochondrial DNA heteroplasmy: Implications for human health and disease. Nature Reviews Genetics. 16 (9), 530-542 (2015).
- Takeda, K. Mitochondrial DNA transmission and confounding mitochondrial influences in cloned cattle and pigs. Reproductive Medicine and Biology. 12 (2), 47-55 (2013).
- Lanza, R. P., et al. Cloning of an endangered species (Bos Gaurus) using interspecies nuclear transfer. Cloning. 2 (2), 79-90 (2000).
- Evans, M. J., et al. Mitochondrial DNA genotypes in nuclear transfer-derived cloned sheep. Nature Genetics. 23 (1), 90-93 (1999).
- Meirelles, F. V., et al. Complete replacement of the mitochondrial genotype in a Bos indicus calf reconstructed by nuclear transfer to a Bos taurus oocyte. Genetics. 158 (1), 351-356 (2001).
- Beyhan, Z., Iager, A. E., Cibelli, J. B. Interspecies nuclear transfer: Implications for embryonic stem cell biology. Cell Stem Cell. 1 (5), 502-512 (2007).
- Lagutina, I., Fulka, H., Lazzari, G., Galli, C. Interspecies somatic cell nuclear transfer: advancements and problems. Cellular Reprogramming. 15 (5), 374-384 (2013).
- Jiang, Y., et al. Interspecies somatic cell nuclear transfer is dependent on compatible mitochondrial DNA and reprogramming factors. PLoS ONE. 6 (4), 14805(2011).
- Chiaratti, M. R., et al. Embryo mitochondrial DNA depletion is reversed during early embryogenesis in cattle. Biology of Reproduction. 82 (1), 76-85 (2010).
- Spikings, E. C., Alderson, J., John, J. C. Regulated mitochondrial DNA replication during oocyte maturation is essential for successful porcine embryonic development. Biology of Reproduction. 76 (2), 327-335 (2007).
- Cagnone, G. L., et al. Restoration of normal embryogenesis by mitochondrial supplementation in pig oocytes exhibiting mitochondrial DNA deficiency. Scientific Reports. 6 (1), 1-15 (2016).
- Spikings, E. C., Alderson, J., John, J. C. Regulated mitochondrial DNA replication during oocyte maturation is essential for successful porcine embryonic development. Biology of Reproduction. 76 (2), 327-335 (2007).
- Ferreira, A. F., et al. Does supplementation with mitochondria improve oocyte competence? A systematic review. Reproduction. 161 (3), 269-287 (2021).
- Bhat, M. H., et al. Live birth of a pashmina goat kid after transfer of handmade cloned embryos. Journal of Reproduction and Development. , (2019).
- Tecirlioglu, R. T., et al. Birth of a cloned calf derived from a vitrified hand-made cloned embryo. Reproduction, Fertility and Development. 15 (7), 361(2003).
- Zhang, P., et al. Handmade cloned transgenic piglets expressing the nematode fat-1 gene. Cellular Reprogramming. 14 (3), 258-266 (2012).
- Zhang, P., et al. Handmade cloned transgenic sheep rich in omega-3 fatty acids. PLOS ONE. 8 (2), 55941(2013).
- Lagutina, I., et al. Somatic cell nuclear transfer in horses: Effect of oocyte morphology, embryo reconstruction method and donor cell type. Reproduction. 130 (4), 559-567 (2005).
- Chiaratti, M. R., et al. Embryo mitochondrial DNA depletion is reversed during early embryogenesis in cattle. Biology of Reproduction. 82 (1), 76-85 (2010).
- Hosseini, S. M., et al. and efficient method of manual oocyte enucleation using a pulled pasteur pipette. In Vitro Cellular and Developmental Biology - Animal. 49 (8), 569-575 (2013).
- Zampolla, T., Spikings, E., Rawson, D., Zhang, T. Cytoskeleton proteins F-actin and tubulin distribution and interaction with mitochondria in the granulosa cells surrounding stage III zebrafish (danio rerio) oocytes. Theriogenology. 76 (6), 1110-1119 (2011).
- International Union for Conservation of Nature. The IUCN Red List of Threatened Species. International Union for Conservation of Nature. , (2021).
- Berg, D. K., Li, C., Asher, G., Wells, D. N., Oback, B. Red deer cloned from antler stem cells and their differentiated progeny. Biology of Reproduction. 77 (3), 384-394 (2007).
- Gómez, M. C., et al. Birth of African wildcat cloned kittens born from domestic cats. Cloning and Stem Cells. 6 (3), 247-258 (2004).
- Lanza, R. P., et al. Cloning of an endangered species (Bos gaurus) using interspecies nuclear transfer. Cloning. 2 (2), 79-90 (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır