Method Article
Использование бисекции для уменьшения митохондриальной ДНК в бычьем ооците
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем протокол для значительного снижения числа копий митохондриальной ДНК в яйцеклетке крупного рогатого скота (P < 0,0001). Этот метод использует центрифугирование и бисекцию для существенного уменьшения митохондрий ооцитов и может обеспечить повышенную вероятность развития у реконструированных эмбрионов межвидового переноса ядер соматических клеток.
Аннотация
Межвидовой перенос ядра соматических клеток (iSCNT) может быть использован для спасения исчезающих видов, но в реконструированном эмбрионе существуют две различные популяции митохондриальной ДНК (мтДНК): одна в ооплазме-реципиенте и одна в донорской соматической клетке. Эта митохондриальная гетероплазма может привести к проблемам развития у эмбриона и плода. Протоколы клонирования ручной работы включают бисекцию ооцитов, которая может быть использована для уменьшения числа копий мтДНК, снижения степени митохондриальной гетероплазмы у реконструированного эмбриона. Центрифугирование обнаженных, зрелых бычьих ооцитов произвело видимую митохондриально-плотную фракцию на одном полюсе ооцита. Zonae pellucidae ооцитов удаляли воздействием проназного раствора. Бисекцию проводили с использованием микробелка для удаления видимой фракции митохондрий. qPCR использовался для количественной оценки мтДНК, присутствующей в образцах ДНК, извлеченных из цельных ооцитов и бисекционных оопластов, обеспечивая сравнение числа копий мтДНК до и после бисекции. Числа копий были рассчитаны с использованием пороговых значений цикла, формулы линии регрессии стандартной кривой и соотношения, которое включало соответствующие размеры продуктов ПЦР мтДНК и геномных продуктов ПЦР. Один бычий яйцеклет имел среднее число копий мтДНК (± стандартное отклонение) 137 904 ± 94 768 (n = 38). Один истощенный митохондриями оопласт имел среднее число копий мтДНК 8 442 ± 13 806 (n = 33). Средние копии мтДНК, присутствующие в богатом митохондриями оопласте, составили 79 390 ± 58 526 копиями мтДНК (n = 28). Различия между этими рассчитанными средними показателями указывают на то, что центрифугирование и последующая бисекция могут значительно уменьшить количество копий мтДНК, присутствующих в истощенном митохондриями оопласте, по сравнению с исходным ооцитом (P < 0,0001, определяемого односторонним ANOVA). Снижение мтДНК должно снизить степень митохондриальной гетероплазмы у реконструированного эмбриона, возможно, способствуя стандартному эмбриональному и фетальному развитию. Добавление митохондриального экстракта из соматической донорской клетки также может иметь важное значение для достижения успешного эмбрионального развития.
Введение
Перенос ядра соматических клеток (SCNT) включает слияние энуклеированного ооцита одного животного и соматической клетки животного одного вида. В большинстве случаев ооциты и соматические клетки происходят от одного и того же вида, а показатели рождаемости ниже 6%1. Некоторые исследования включают использование межвидового SCNT (iSCNT), который включает в себя слияние соматической клетки и ооцита, которые происходят от двух разных видов. В этих исследованиях уровень рождаемости даже ниже, чем в SCNT - обычно менее 1%1. Тем не менее, iSCNT имеет возможность использоваться в качестве метода спасения исчезающих видов, поскольку соматические клетки этих животных более доступны, чем их половые клетки1. Реципиентные ооциты, используемые в iSCNT, часто являются домашними или распространенными лабораторными видами, такими как коровы, свиньи и мыши. Некоторые попытки, предпринятые до сих пор, успешно произвели живого молодняка, хотя полученное потомство было внутриродовыми животными (виды ооцитов-реципиентов и донорских клеток были членами одного рода)2,3,4. Межродовые модели (в которых используются ооциты и соматические клетки животных разных родов) еще не произвели живых животных, и большинство реконструированных эмбрионов останавливаются на 8-16 клеточной стадии развития in vitro 5,6,7,8. Одним из возможных объяснений этой остановки эмбрионального развития является возникновение митохондриальной гетероплазмы в эмбрионах - наличие более одного типа ДНК митохондрий (мтДНК) в одной клетке. Гетероплазма может привести к таким проблемам, как неэффективность развития или неудача у эмбриона или у живого животного1. Патогенез также может произойти позже в жизни животного9. Хотя эта проблема также присутствует у потомства SCNT, межвидовой компонент в эмбрионах iSCNT усугубляет проблему.
Когда эмбриональная мтДНК поступает из двух разных видов, митохондрии реципиентов ооцитов, которые представляют большинство, не работают эффективно или результативно с ядром донорской клетки 1,10. Большие таксономические разрывы между двумя видами, используемыми в iSCNT, вероятно, усиливают эту проблему; внутриродовое живое потомство (потомство Bos gaurus и Bos indicus с использованием ооцитов Bos taurus), а также потомство, полученное с помощью традиционного SCNT (например, потомство Ovis aries с использованием ооцитов Ovis) были химерами (мтДНК от двух особей присутствовала у этих животных 11,12,13). Тем не менее, они развивались намного дальше, чем межродовые эмбрионы SCNT14,15. Обмен информацией между митохондриями ооцитов и ядром донорской клетки может быть более успешным во внутриродовом эмбрионе, чем в межродовом эмбрионе16.
Количество мтДНК в зрелом бычьем ооците примерно в 100 раз больше, чем количество, обнаруженное в одной соматической клетке12. Снижение этого соотношения может стимулировать размножение митохондрий соматических клеток внутри реконструированного эмбриона, что позволяет увеличить популяцию продуктивных митохондрий16. Это, в свою очередь, может обеспечить больше энергии для удовлетворения потребностей развивающегося эмбриона15. Предыдущие попытки уменьшить число копий мтДНК ооцита или эмбриона включают химическое применение, микроманипуляцию и дополнение ооцита или эмбриона дополнительными митохондриями из донорских клеток 16,17,18,19,20. Однако химическое применение (например, 2',3'-дидеоксицитидин) не идеально подходит для эмбрионального развития и снижает число копий мтДНК ооцитов примерно наполовину18. Предыдущее снижение мтДНК ооцитов путем микроманипуляции удаляло в среднем 64% мтДНК17 ооцита. Хотя добавление митохондрий донорских клеток может быть жизнеспособным вариантом, его использование еще не произвело живого межродового животного в исследованиях iSCNT21.
Применение бисекции для уменьшения числа копий мтДНК ооцитов еще не использовалось в опубликованных исследованиях. Бисектирование ооцитов с целью слияния оопластов с соматической клеткой является предпосылкой ручного клонирования (HMC), которое обычно использует бисекцию в качестве метода удаления полярного тела и метафазной пластины из метафазного II (MII) ооцита. HMC успешно произвел потомство у нескольких видов, включая коз, крупный рогатый скот, свиней, овец и лошадей 22,23,24,25,26, но обычно не включает стадию центрифугирования до бисекции. Интеграция высокоскоростного центрифугирования ооцита позволяет выделить митохондрии (и, следовательно, мтДНК) на одном полюсе ооцита, который затем может быть разделен пополам с помощью микробелла для удаления этих митохондриально-плотных фракций. Два истощенных митохондриями оопласта затем могут быть слиты с соматической клеткой, как в случае с HMC, чтобы сформировать реконструированный эмбрион, который содержит значительно меньше мтДНК из видов ооцитов.
Вопрос, на который мы пытаемся ответить с помощью этого протокола, заключается в том, как уменьшить мтДНК в бычьем ооците, чтобы произвести жизнеспособный реконструированный эмбрион, который содержит меньше гетероплазматической мтДНК. В этом протоколе ооциты центрифугировали и делили пополам. Количество копий мтДНК ooplast и интактных ооцитов было рассчитано для определения эффективности этого метода в снижении числа копий мтДНК мтДНК крупного рогатого скота.
протокол
Следующий протокол соответствует руководящим принципам ухода за животными и этики, предоставленным Университетом штата Юта.
1. Подготовка СМИ
- Перед обработкой яйцеклеток готовят следующие растворы, как описано в таблице 1: 400 мкл раствора гиалуронидазы, 500 мкл среды Т2, 1020 мкл среды T20 и 800 мкл среды T10.
- Разделите среду Т10 на две скважины четырехлуночной пластины, по 400 мкл на скважину. Пометьте одну скважину буквой «М», а вторую — «MR». Поместите в инкубатор с 5%CO2 до окончания бисекции.
- Приготовьте 500 мкл цитохалазина B (CB) / синтетической яйцеводной жидкости с HEPES (HSOF). Aliquot 50 мкл раствора CB/HSOF в отдельную центрифужную трубку объемом 1,5 мл.
- Приготовить 40 мкл раствора проназы. Центрифуга не менее 30 с при 2,680 х г. Смешайте 20 мкл надосадочного вещества с 20 мкл Т2 с новой центрифужной трубкой; образует разбавленный раствор проназы 5 мг/мл.
- Подготовьте 3 мл HSOF. На поисковую табличку отдельно нанесите четыре капли по 400 мкл; поместите эту пластину под стереомикроскоп.
- Приготовить 500 мкл раствора CB/T20.
2. Созревание in vitro (IVM) бычьих ооцитов
- IVM: Культивирование аспирированных кучево-ооцитарных комплексов (КОК) при 38,5 °C в 5% инкубатореCO2 в течение 21 ч в четырехлуночной посуде из сред созревания, содержащей 10% FBS, 0,26 МЕ/мл ФСГ и 100 ЕД/мл пенициллина/стрептомицина.
- Выполните следующие шаги, чтобы обнажить ооциты.
- Соберите желаемое количество КОК с помощью пипетки объемом 200 мкл и положите их на дно трубки центрифуги объемом 1,5 мкл.
- Добавьте тот же объем 0,6 мг/мл гиалуронидазы в центрифужную трубку с ооцитами (т.е., если объем ооцитов и сред IVM составляет 100 мкл, добавьте 100 мкл гиалуронидазы).
- Пипетка раствором вверх и вниз без образования пузырьков, пока все кучевые клетки не будут удалены.
- Проверьте созревание ооцитов.
- Используйте пипетку, чтобы добавить 200 мкл HSOF из одной из четырех капель HSOF на поисковой пластине в раствор ооцитов / гиалуронидазы.
- Перенесите ооциты из капли гиалуронидазы/HSOF и поместите их в неиспользованные 400 мкл капли HSOF. Промыть их двумя дополнительными каплями HSOF, чтобы помочь в удалении остатков гиалуронидазы и кучевых клеток.
- Используя ротовую пипетку (или пипетку и наконечник 10 мкл) и высокое микроскопическое увеличение, сверните и выберите ооциты на основе присутствия полярного тела.
- После сортировки ооцитов соберите желаемое количество ооцитов MII, подлежащих разделению пополам, и поместите их в 400 мкл капли HSOF.
ПРИМЕЧАНИЕ: Если ооциты находились вне инкубатора более 30 мин, ооциты могут быть помещены обратно в колодец среды созревания и помещены в инкубатор, контролируемыйCO2, для отдыха в течение не менее 30 минут. Ограничьте количество ооцитов, подлежащих разделению пополам, до количества, которое можно закончить пополам примерно через 30 мин, чтобы свести к минимуму время вне инкубации. Если оопласты должны быть слиты с соматической клеткой, активированы и культивированы как эмбрионы, ооциты должны быть энуклеированы в это время.
3. Центрифугирование ооцитов
ПРИМЕЧАНИЕ: Если ооциты были помещены в инкубатор в среде созревания, переместите их в каплю HSOF, из которой они были собраны в последний раз.
- Используя ротовую пипетку, соберите отобранные зрелые ооциты из капли HSOF и поместите их в пробирку объемом 1,5 мл, содержащую 50 мкл раствора HSOF/CB. Центрифугировать ооциты при 15 000 х г в течение 12 мин.
ПРИМЕЧАНИЕ: Присутствие пузырьков в трубке центрифуги не вредно. - Пока ооциты центрифугируются, подготовьте бисекционную пластину.
- Нанесите рисунок, как показано на рисунке 1 , на крышку чашки Петри толщиной 60 мм (20 мкл на каплю) и полностью накройте капли минеральным маслом.
- С помощью маркера с тонким наконечником отметьте линии под блюдом, как показано на рисунке 2.
- Нарисуйте коробку вокруг капли проназы и линию между каплями CB/T20 и нижним рядом капель T20.
- Накройте блюдо непрозрачной крышкой до завершения центрифугирования для предотвращения изменения осмолярности микрокапель.
- Как только центрифугирование будет завершено, используйте пипетку объемом 200 мкл для сбора ооцитов в растворе и переместите их в пустую часть новой поисковой пластины с четырьмя каплями HSOF 400 мкл.
- Соберите и промойте ооциты через четыре капли HSOF.
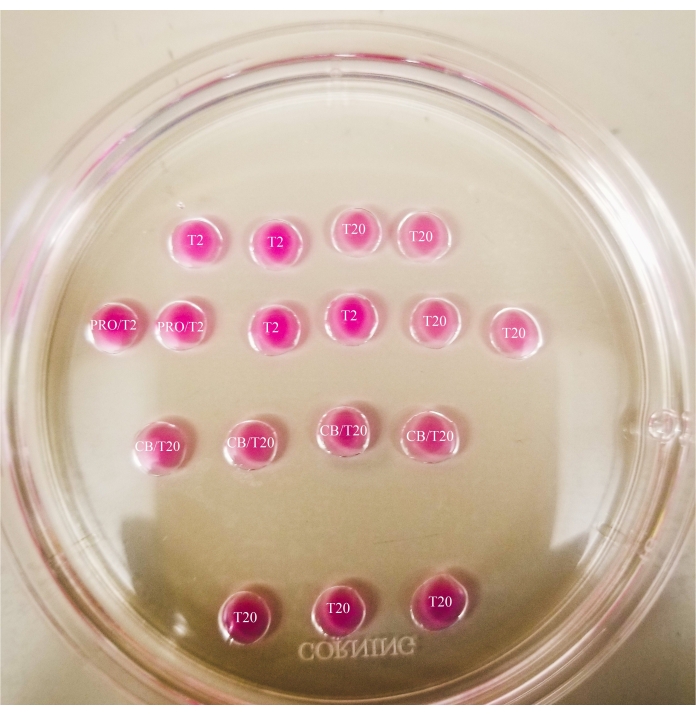
Рисунок 1: Бисекционная пластина. Все показанные капли имеют объем 20 мкл. Пластина имеет диаметр 60 мм. Капли были полностью покрыты минеральным маслом. Ооциты сначала будут помещены в самую верхнюю и самую левую каплю Т2 (обозначенную здесь звездой). PRO/T2: 10 мкл проназы и 10 мкл Т2, объединенные перед созданием микрокапель. CB/T20: 1 мкл цитохалазина B на 1 мл T20, объединенный до создания микрокапель. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Маркированная бисекционная пластина. Линии рисуются маркером с тонким наконечником на нижней части пластины, чтобы обеспечить ссылки на местоположение для наблюдений и переносов ооцитов и оопластов, сделанных под микроскопом. Ооциты сначала будут помещены в самую верхнюю и самую левую каплю Т2 (обозначенную здесь звездой). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Подготовка ооцита к бисекции
ПРИМЕЧАНИЕ: Следующий процесс включает подготовку ооцитов к бисекции.
- Включите ступень нагрева до 37 °C.
- Используйте ротовую пипетку, чтобы переместить центрифугированные ооциты из капли HSOF в верхнюю левую каплю T2 бисекционной пластины, затем промыть ооциты через следующие три капли в верхнем ряду (T2, T20, T20).
- Депонируйте яйцеклетки в одной из проназных капель, гарантируя, что между ними практически нет контакта.
ПРИМЕЧАНИЕ: Удаление пеллюцидной зоны может занять различное количество времени, но обычно происходит между 30-120 с с использованием стадии нагрева. Отсутствие нагревательной ступени продлится и на этот раз. - Наблюдайте за ооцитами до тех пор, пока не произойдет явная деформация zonae pellucidae (см. Рисунок 3).
- Как только один oocyte zona pellucida деформируется, переместите этот ооцит в соседнюю каплю Т2. Повторяйте по мере того, как дополнительные ооциты деформируются, пока все ооциты не будут удалены из проназы и помещены в каплю Т2.
- Наблюдают за ооцитами до тех пор, пока не останется только тонкий слой зоны пеллюцида.
- Промойте ооциты через следующие три капли внутри ряда (T2, T20, T20), затем отложите их вертикальными линиями внутри капель CB/T20 (см. Рисунок 4).
- Начните с меньшего количества ооцитов в вертикальных линиях и увеличьте количество ооцитов на каплю по мере развития навыков бисекции.
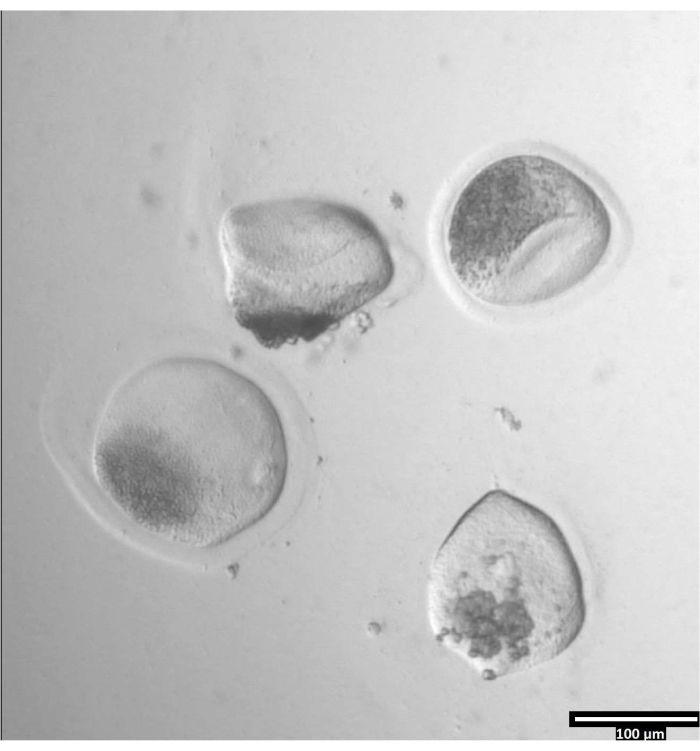
Рисунок 3: Удаление пеллюцидной зоны с помощью проназы. (80x) Ооцитная зона пеллюцида начнет казаться деформированной, когда проназа повлияла на зону пеллюцида достаточно, чтобы ооцит был перемещен в соседнюю каплю Т2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Ориентация ооцитов в бисекционных каплях. (80x) Беззона-свободные ооциты откладываются в почти вертикальной ориентации в пределах каждой капли CB/T20 до бисекции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Бисекция ооцитов
- Сосредоточьтесь на первой, самой левой капле CB / T20 (бисекция), которая содержит ооциты, и используйте пипетку рта для вращения ооцитов, так что плотная часть каждого ооцита либо обращена к руке микроскопа, либо от нее.
ПРИМЕЧАНИЕ: Митохондриально-плотная часть не будет содержать липидов, которые появляются как самая темная часть ооцита после центрифугирования. - Положите кончик микробелка слева от самой верхней яйцеклетки, в соответствии с пространством непосредственно над митохондриями -плотной частью. Держа кончик лезвия в том же месте, осторожно опустите лезвие, чтобы разрезать весь путь через ооцит.
- Убедитесь, что митохондриально-плотный оопласт и митохондриально-восстановленный оопласт похожи по размеру; Бисекция должна разрезать каждый ооцит пополам, чтобы получить два оопласта.
ПРИМЕЧАНИЕ: Сравнительные размеры оопластов, полученных из одного ооцита, могут варьироваться в зависимости от целей исследования; если митохондриально-восстановленные оопласты должны быть слиты с соматической клеткой, их объем должен быть больше, чем у митохондрий-плотных оопластов. - Убедитесь, что лезвие делит ооцит пополам над митохондриально-плотной частью и ниже липидно-плотной части, в самом чистом сегменте центрифугированного ооцита.
- Убедитесь, что митохондриально-плотный оопласт и митохондриально-восстановленный оопласт похожи по размеру; Бисекция должна разрезать каждый ооцит пополам, чтобы получить два оопласта.
- При подъеме лезвия убедитесь, что та же линия поддерживается, и что кончик лезвия остается на том же месте, затем осторожно поднимите наконечник с пластины.
- Повторите этапы бисекции для всех ооцитов в пределах первой капли бисекции. Если ооциты присутствуют в дополнительных каплях, ориентируйте и разделяйте пополам оставшиеся ооциты.
- Используя ротовую пипетку, соберите митохондриально-восстановленные оопласты с первой капли бисекции. Поместите их в левую каплю T20, расположенную в нижнем ряду пластины. Повторите для всех оставшихся капель бисекции.
ПРИМЕЧАНИЕ: Митохондриальные оопласты будут содержать липиды, которые имеют более темный цвет, чем остальная часть ооцита. - Используя ротовую пипетку, соберите митохондриально-плотные оопласты с первой капли бисекции. Поместите их в правую каплю T20, расположенную в нижнем ряду пластины. Повторите для всех оставшихся капель бисекции.
ПРИМЕЧАНИЕ: Митохондриально-плотные области будут иметь видимый конгломерат органелл, которые будут светло-серыми по внешнему виду. - Извлеките блюдо T10 из четырех лунок из инкубатора. Используя ротовую пипетку, переместите все митохондриальные оопласты в хорошо обозначенный «MR» и переместите митохондриально-плотные оопласты в хорошо обозначенный «M».
- Поместите пластину из четырех скважин обратно в инкубатор, контролируемый CO2. Дайте оопластам отдохнуть не менее 30 минут до количественной оценки мтДНК.
6. Количественная оценка мтДНК
- Используйте набор для экстракции ДНК, предназначенный для извлечения материала из небольшого образца для извлечения ДНК из отдельных образцов (одиночные ооциты, одиночные митохондриально-плотные оопласты, одиночные митохондриальные оопласты).
- Используйте метод количественной оценки ДНК по выбору, чтобы гарантировать, что ДНК была успешно извлечена из каждого образца. Если количественная полимеразная цепная реакция (qPCR) не будет завершена в это время, заморозьте извлеченную ДНК в меченой пробирке в морозильной камере с температурой -80 °C.
- Выполнение qPCR
- Обратитесь к таблице 2 , чтобы определить объем каждого реагента, добавляемого к каждой трубке qPCR, вместе с последовательностями праймеров. Эти грунтовки предназначены для усиления области 12S бычьей мтДНК.
- Установите начальное время денатурации на 10 мин, за которыми последуют 35 циклов: 30 с денатурации при 94 °C, 15 с отжига при 60 °C и 15 с расширения при 72 °C. Когда реакция завершена, запишите значения порогового значения цикла (Ct).
ПРИМЕЧАНИЕ: Для получения относительных значений числа копий мтДНК должна быть получена стандартная кривая с использованием образцов с известными количествами номеров копий мтДНК, которые увеличиваются экспоненциально. Затем необходимо манипулировать пороговыми значениями цикла, используя следующие формулы для определения относительных номеров копий мтДНК. - Получите концентрацию ДНК, используя уравнение ниже:
Концентрация ДНК = (10(Ct-перехват/наклон)) x тестируемый объем - Получите номер копии, используя приведенное ниже уравнение:
Номер копии =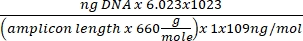
- Получите номер копии, используя приведенное ниже уравнение:
Количество копий на ячейку = 2 x

Рисунок 5: Стандартная кривая мтДНК соматических клеток. Эта стандартная кривая была создана путем количественного определения логарифмических концентраций логарифмических концентраций соматических клеток крупного рогатого скота с использованием реагентов и программы qPCR, как описано на этапе протокола 6.3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Количественные результаты ПЦР (qPCR) используются для определения относительных количеств мтДНК, присутствующих в каждом оопласте. Описанная реакция предназначена для усиления области 12S бычьей мтДНК.
Если бисекция прошла успешно, образцы из целых ооцитов и митохондриально-плотных оопластов будут иметь аналогичные значения Ct . Образцы из митохондриально-восстановленных оопластов будут иметь более высокие значения Ct по сравнению с образцами из двух других групп. График Ct, показывающий успешные результаты бисекции, показан ниже. Эти результаты показывают, что бисекция действительно эффективно снижала содержание мтДНК в митохондриальных оопластах (рисунок 6).
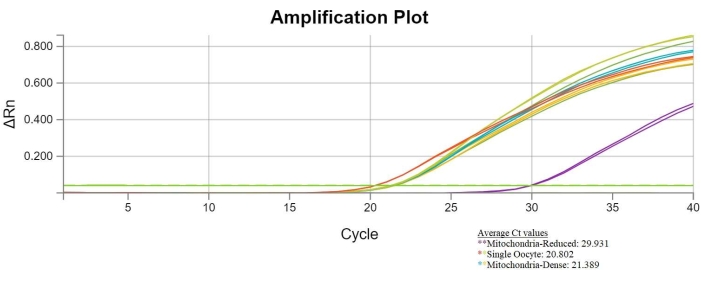
Рисунок 6: Успешные результаты бисекции qPCR. График сравнения числа цикла и флуоресценции отображает пороговые значения цикла одиночных ооцитов, митохондриально-восстановленных оопластов (представленных фиолетовыми линиями) и митохондриально-плотных оопластов. Значения Ct митохондриально-восстановленных оопластов имеют в среднем 29,931 (фиолетовые линии), в то время как среднее значение Ct отдельных ооцитов составляет 20,802 (красная и зеленая линии), а среднее значение Ct митохондриально-плотных оопластов составляет 21,389 (синие и золотые линии). Увеличение значений Ct образцов митохондрий-восстановленных оопластов указывает на уменьшение числа копий мтДНК в этих образцах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
График Ct, показывающий неудачные результаты бисекции, показан на рисунке 7. Эти результаты показывают, что бисекция не эффективно снижала содержание мтДНК в митохондриальных оопластах:

Рисунок 7: Неудачные результаты бисекции qPCR. Линейный график, сравнивающий число цикла и флуоресценцию, отображает пороговые значения цикла одиночных ооцитов (темно-зеленые и светло-зеленые линии), митохондриально-восстановленных оопластов (фиолетовые линии) и митохондриально-плотных оопластов (синие и золотые линии), все из которых имеют значения Ct в диапазоне 20,232-20,757. Это указывает на отсутствие значительного изменения числа копий мтДНК в образцах митохондрий-редуцированных оопластов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
После получения стандартной кривой и использования предоставленных формул числа копий мтДНК с использованием этого протокола было достигнуто среднее снижение мтДНК ооцитов на 93,88% (рисунок 8).

Рисунок 8: Boxplot, сравнивающий относительное количество копий митохондриальной ДНК, полученных из целых ооцитов, митохондриально-восстановленных оопластов и митохондриально-плотных оопластов. Целые ооциты (n = 38), митохондриально-восстановленные оопласты (n = 34) и митохондриально-плотные оопласты (n = 29). Митохондриально-редуцированные оопласты имеют значительно меньшее количество копий по сравнению с двумя другими группами (P < 0,001). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Решение | Общий объем | Растворитель | Растворенное вещество |
| Раствор гиалуронидазы | 400 мкл | 1 мл M-199 | 0,6 мг гиалуронидазы |
| Т2 Медиа | 500 мкл | М-199 | 2% фетальная бычья сыворотка (v/v) |
| Т20 Медиа | 1020 мкл | М-199 | 20% фетальная бычья сыворотка (v/v) |
| Т10 Медиа | 800 мкл | 400 мкл T2 | 400 мкл T20 |
| CB/HSOF | 500 мкл | 499,5 мкл синтетической яйцеводной жидкости с HEPES (HSOF) | 0,5 мкл 10 мг/мл цитохалазина B (CB) |
| Проназное решение | 40 мкл | 1 мл M-199 | 10 мг проназы |
| Т20/КБ | 500 мкл | 499.5 мкл T20 | 0,5 мкл 10 мг/мл CB |
Таблица 1: Требуемые решения. Предоставляет объемы растворенных веществ и растворителей для каждого раствора, требуемого в рамках протокола.
| Реагент | Том |
| Мастер-микс qPCR | 10 мкл |
| Грунтовка вперед | 0.6 мкл |
| Обратная грунтовка | 0.6 мкл |
| Образец ДНК | 4.4 мкл |
| Вода без ДНКазы | 4.4 мкл |
| Общий объем | 20 мкл |
| Букварь форварда GGGCTACATTCTCTACCAAG | |
| Обратная грунтовка GTGCTTCATGGCCTAATTCAAC | |
Таблица 2: Количественный состав ПЦР. Обеспечивает прямые и обратные последовательности праймеров и объемы всех реагентов, необходимых для каждой количественной трубки ПЦР.
Обсуждение
Методы, ранее использовавшиеся для снижения количества копий мтДНК в ооцитах, имеют свои недостатки. Удаление митохондрий из ооцитов на основе микроманипуляции снижает число копий мтДНК в среднем на 64%27. Уникальный метод, ранее использовавшийся для энуклеации, предполагает использование пипеток Пастера малого диаметра и расщепление зоны пеллюцидного ооцита на границе между микрокапью среды и окружающим минеральным маслом. Наряду с использованием центрифугирования ооцитов, этот подход может производить жизнеспособные митохондриально-восстановленные оопласты28. Тем не менее, комбинация центрифугирования и этого метода расщепления ооцитов еще не была зарегистрирована для производства эмбрионов. Химические методы восстановления митохондрий (такие как воздействие на ооциты 2',3'-дидеоксицитидина (ddC), ингибитора синтеза мтДНК) снизили количество копий мтДНК ооцитов до 50% и требуют, чтобы КОК подвергались воздействию химического вещества в течение более 40 ч во время созревания in vitro (IVM)16,27. Хотя инкубация ооцитов свиней в среде, дополненной ddC, в течение 40 ч не представляла проблем для реконструированных эмбрионов16, еще нет опубликованных данных о воздействии бычьих яйцеклеток на ddC во время их 20-22 ч IVM или любого последующего эмбрионального развития. Метод, описанный в данной работе, уменьшает относительное число копий мтДНК примерно на 93,88%, в среднем с 45 565 ± 37 169 копий (среднее ± SD) до 8 396 ± 13 287.
Несколько шагов в рамках протокола имеют решающее значение для получения удовлетворительных результатов с точки зрения эффективного снижения числа копий ДНК митохондрий (мтДНК) яйцеклетки. Центрифугирование ооцитов с оптимизированной скоростью (15 000 х г) и временем (12 мин) создаст более концентрированную фракцию митохондрий на одном полюсе каждого ооцита. Правильный объем цитохалазина B / синтетической яйцеводной жидкости с раствором HEPES (CB / HSOF) (50 мкл), вероятно, устранит лизис ооцитов из-за центрифугирования. После центрифугирования зону пеллюцида (ZP) удаляют путем воздействия раствора проназы; полное удаление ZP обеспечит более точную бисекцию, а также должно отделить любые оставшиеся кучевые клетки от ооцитов. Использование нагревательной ступени на микроскопе при снятии ZP является необязательным, но ускоряет удаление ZP по крайней мере на 1 мин. Ориентация ооцитов без пеллюцида (ZF) в каплях бисекции имеет решающее значение для их точного разделения пополам. Фракция митохондрий, обнаруженная на одном полюсе каждого ооцита, должна быть хорошо видна и расположена либо в верхней, либо в нижней части яйцеклетки до бисекции. Противоположный полюс будет содержать темные липидные капли. После бисекции отбор и правильная классификация оопластов (как митохондрий-плотных или митохондрий-истощенных) имеет решающее значение для получения точной оценки бисекции. Выбор того, какие метафазные II (MII) ооциты должны делиться пополам, также важен. Обеспечение того, чтобы используемые ооциты были сферическими и имели однородную цитоплазму, вероятно, будет иметь значение в количестве копий мтДНК, содержащихся в каждой яйцеклетке и оопласте. При проектировании и синтезе отдельных количественных полимеразных цепных реакций (qPCR) для получения точных результатов важно обеспечить использование правильных праймеров и концентраций реагентов. Если стандартная кривая получена, она должна быть создана как можно точнее, и все реакции должны быть выполнены в трех экземплярах для достижения большей точности. Время и температура каждой фазы qPCR должны оставаться одинаковыми для каждого запуска.
Некоторые проблемы могут возникнуть при следовании протоколу. При добавлении масла в бисекционную пластину убедитесь, что капли просто покрыты; слишком много масла сделает использование пипетки менее эффективным, в то время как слишком мало приведет к испарению капель. Это испарение вызовет изменение осмолярности растворов, что может быть вредным для ооцитов и оопластов. Если ооциты лизируются после переваривания ZP, это, вероятно, связано с одним или обоими из следующего, основываясь на личном опыте и наблюдениях: ооциты не центрифугировались в течение предписанного времени и скорости, и / или ооциты подвергались воздействию проназы слишком долго. Некоторые Ооциты ZF могут не восстановить полностью сферическую форму в каплях бисекции. Имейте в виду, что не все Ооциты ZF смогут быть оптимально позиционированы для бисекции. В этом случае есть три варианта: дать ZF-ооцитам дополнительное время для восстановления сферической формы; осторожно удерживать ооциты в более вертикальном положении с микролезеном перед бисекцией; не делите пополам ооциты, которые не могут быть правильно позиционированы. Определение того, какие оопласты являются митохондриально-плотными или истощенными митохондриями после бисекции, повлияет на результаты количественной оценки. Если классификация оопластов затруднена, расположите ооциты, которые будут разделены пополам, так, чтобы фракция митохондрий либо всегда была направлена к вершине или нижней части капли, и / или ищите темную часть ооцита на одном из его полюсов (эти липидные капли сосредоточены на противоположном полюсе от фракции митохондрий). Иногда оопласты могут прилипать друг к другу и / или углублению, сделанному микролезком в пластине. Иногда предоставление оопластам дополнительного времени для восстановления сферической формы поможет с разделением. Другие варианты включают осторожное постукивание по пластине, осторожное всасывание их внутрь и из пипетки и / или использование края пипетки для осторожного разделения оопластов.
Этот метод уменьшения числа копий мтДНК имеет свои ограничения; один основан на источнике ооцитов, а другой обусловлен удалением ZP из ооцита. Источник ооцитов (само животное, конкретный яичник и конкретный фолликул) будет сильно влиять на количество копий мтДНК в этом конкретном ооците. Существует большое стандартное отклонение вокруг среднего числа копий мтДНК одного ооцита, указывающее, насколько переменным может быть число копий. Многие реакции количественной оценки одиночных ооцитов должны иметь надежное стандартное число копий одного ооцита, которое будет сравниваться с оопластами и другими ооцитами. Значительное стандартное отклонение также делает сравнение оопласта с ооцитом менее абсолютным, так как число копий оопласта нельзя сравнивать с его ооцитом происхождения.
Переваривание zonae pellucidae ооцита делает полученные ZF-ооциты и оопласты гораздо более хрупкими, чем они были до удаления их zonae pellucidae. Эта хрупкость приводит к более высоким скоростям лизиса оопластов и самих ооцитов ZF, особенно с использованием микробелла - необходимо использовать большую осторожность и точность. Если оопласты используются для сращивания, они требуют отдыха после бисекции, прежде чем можно будет попытаться сращивание. В противном случае многие из оопластов, скорее всего, будут лизироваться. Оопласты, истощенные митохондриями, как правило, более деликатные, чем их митохондриально-плотные аналоги. Микротрубочки ооцита имеют тенденцию мигрировать с митохондриями к тому же полюсу ооцита во время центрифугирования, что оставляет истощенные митохондриями оопласты с меньшим количеством структурных компонентов29. Необходимы дополнительные исследования и окрашивание, чтобы определить, оказывают ли другие органеллы ооцитов негативное влияние комбинации центрифугирования и бисекции, используемых для получения оопластов в этом протоколе.
Уменьшение митохондрий ооцитов уменьшило бы митохондрии видов ооцитов в полученном эмбрионе iSCNT, тем самым уменьшая частоту гетероплазмы митохондрий в этом реконструированном эмбрионе. Шансы эмбриона на развитие значительно возрастут, но, вероятно, потребуют дополнения митохондрий от видов донорских клеток для удовлетворения энергетических потребностей во время развития. До сих пор попытки iSCNT, которые использовали межродовые скрещивания, не дали живого потомства. Снижение гетероплазмы у эмбрионов iSCNT может увеличить вероятность успешной беременности. iSCNT - это метод, который может помочь спасти некоторые из 40 000 видов, классифицированных как находящиеся под угрозой исчезновения30. Поскольку соматические клетки этих видов, как правило, более доступны, чем их половые клетки, iSCNT может использовать эти соматические клетки вместе с ооцитами домашних видов. Внутриродовые попытки были успешными в производстве живых животных 31,32,33, хотя потомство, как правило, химерно для мтДНК, и найти источник внутриродовых ооцитов не всегда возможно. Бисекция ооцитов с целью уменьшения числа копий мтДНК с последующим слиянием этих оопластов с межвидовой соматической клеткой уменьшила бы химеризм и гетероплазму у эмбрионов iSCNT. Из-за этих сокращений использование описанного метода позволяет увеличить потенциал межродовых живорождений и сохранение исчезающих видов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить своих коллег из Университета штата Юта, исследователей репродуктивных наук в зоопарке Сан-Диего и доктора Ребекку Кришер из Genus PLC.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tubes | Fisher Scientific | 5408129 | |
| 60 mm dish | Sigma-Aldrich | D8054 | |
| Centrifuge | Eppendorf | 5424 | |
| Cytochalasin B | Sigma-Aldrich | C6762 | |
| Fetal Bovine Serum | Sigma-Aldrich | F2442 | |
| M199 Media | Sigma-Aldrich | M4530 | |
| Mineral Oil | Sigma-Aldrich | M8410 | |
| Mini Centrifuge | SCILOGEX | D1008 | |
| mtDNA Primer: Forward (12S) | GGGCTACATTCTCTACACCAAG | ||
| mtDNA Primer: Reverse (12S) | GTGCTTCATGGCCTAATTCAAC | ||
| NanoDrop Spectrophotometer | Thermo Scientific | ND2000 | |
| Opthalmic Scalpel with Aluminum Handle | PFM Medical | 207300633 | Microblade for bisection |
| Protease/pronase | Sigma-Aldrich | P5147 | |
| QIAamp DNA Micro Kit | Qiagen | 56304 | |
| QuantStudio™ 3 - 96-Well 0.2-mL | ThermoFisher | A28567 | |
| Search plate | Fisher Scientific | FB0875711A | |
| SYBR Green qPCR Master Mix | ThermoFisher | K0221 | qPCR master mix |
| Synthetic Oviductal Fluid with HEPES (HSOF) | |||
| ThermoPlate | Tokai Hit | TPi-SMZSSX | Heating stage |
Ссылки
- Loi, P., Modlinski, J. A., Ptak, G. Interspecies somatic cell nuclear transfer: A salvage tool seeking first aid. Theriogenology. 76 (2), 217-228 (2011).
- Wani, N. A., Vettical, B. S., Hong, S. B. First cloned Bactrian camel (camelus bactrianus) calf produced by interspecies somatic cell nuclear transfer: A step towards preserving the critically endangered wild Bactrian camels. PLOS ONE. 12 (5), 0177800(2017).
- Oh, H. J., et al. Cloning endangered gray wolves (canis lupus) from somatic cells collected postmortem. Theriogenology. 70 (4), 638-647 (2008).
- Srirattana, K., et al. Full-term development of gaur-bovine interspecies somatic cell nuclear transfer embryos: Effect of trichostatin a treatment. Cellular Reprogramming. 14 (3), 248-257 (2012).
- Kwon, D. K., et al. Blastocysts derived from adult fibroblasts of a rhesus monkey (macaca mulatta) using interspecies somatic cell nuclear transfer. Zygote. 19 (3), 199-204 (2011).
- Lee, E., et al. Production of cloned sei whale (Balaenoptera borealis) embryos by interspecies somatic cell nuclear transfer using enucleated pig oocytes. Journal of Veterinary Science. 10 (4), 285(2009).
- Lorthongpanich, C., Laowtammathron, C., Chan, A. W., Kedutat-Cairns, M., Parnpai, R. Development of interspecies cloned monkey embryos reconstructed with bovine enucleated oocytes. Journal of Reproduction and Development. 54 (5), 306-313 (2008).
- Hong, S. G., et al. Production of transgenic canine embryos using interspecies somatic cell nuclear transfer. Zygote. 20 (1), 67-72 (2011).
- Stewart, J. B., Chinnery, P. F. The dynamics of mitochondrial DNA heteroplasmy: Implications for human health and disease. Nature Reviews Genetics. 16 (9), 530-542 (2015).
- Takeda, K. Mitochondrial DNA transmission and confounding mitochondrial influences in cloned cattle and pigs. Reproductive Medicine and Biology. 12 (2), 47-55 (2013).
- Lanza, R. P., et al. Cloning of an endangered species (Bos Gaurus) using interspecies nuclear transfer. Cloning. 2 (2), 79-90 (2000).
- Evans, M. J., et al. Mitochondrial DNA genotypes in nuclear transfer-derived cloned sheep. Nature Genetics. 23 (1), 90-93 (1999).
- Meirelles, F. V., et al. Complete replacement of the mitochondrial genotype in a Bos indicus calf reconstructed by nuclear transfer to a Bos taurus oocyte. Genetics. 158 (1), 351-356 (2001).
- Beyhan, Z., Iager, A. E., Cibelli, J. B. Interspecies nuclear transfer: Implications for embryonic stem cell biology. Cell Stem Cell. 1 (5), 502-512 (2007).
- Lagutina, I., Fulka, H., Lazzari, G., Galli, C. Interspecies somatic cell nuclear transfer: advancements and problems. Cellular Reprogramming. 15 (5), 374-384 (2013).
- Jiang, Y., et al. Interspecies somatic cell nuclear transfer is dependent on compatible mitochondrial DNA and reprogramming factors. PLoS ONE. 6 (4), 14805(2011).
- Chiaratti, M. R., et al. Embryo mitochondrial DNA depletion is reversed during early embryogenesis in cattle. Biology of Reproduction. 82 (1), 76-85 (2010).
- Spikings, E. C., Alderson, J., John, J. C. Regulated mitochondrial DNA replication during oocyte maturation is essential for successful porcine embryonic development. Biology of Reproduction. 76 (2), 327-335 (2007).
- Cagnone, G. L., et al. Restoration of normal embryogenesis by mitochondrial supplementation in pig oocytes exhibiting mitochondrial DNA deficiency. Scientific Reports. 6 (1), 1-15 (2016).
- Spikings, E. C., Alderson, J., John, J. C. Regulated mitochondrial DNA replication during oocyte maturation is essential for successful porcine embryonic development. Biology of Reproduction. 76 (2), 327-335 (2007).
- Ferreira, A. F., et al. Does supplementation with mitochondria improve oocyte competence? A systematic review. Reproduction. 161 (3), 269-287 (2021).
- Bhat, M. H., et al. Live birth of a pashmina goat kid after transfer of handmade cloned embryos. Journal of Reproduction and Development. , (2019).
- Tecirlioglu, R. T., et al. Birth of a cloned calf derived from a vitrified hand-made cloned embryo. Reproduction, Fertility and Development. 15 (7), 361(2003).
- Zhang, P., et al. Handmade cloned transgenic piglets expressing the nematode fat-1 gene. Cellular Reprogramming. 14 (3), 258-266 (2012).
- Zhang, P., et al. Handmade cloned transgenic sheep rich in omega-3 fatty acids. PLOS ONE. 8 (2), 55941(2013).
- Lagutina, I., et al. Somatic cell nuclear transfer in horses: Effect of oocyte morphology, embryo reconstruction method and donor cell type. Reproduction. 130 (4), 559-567 (2005).
- Chiaratti, M. R., et al. Embryo mitochondrial DNA depletion is reversed during early embryogenesis in cattle. Biology of Reproduction. 82 (1), 76-85 (2010).
- Hosseini, S. M., et al. and efficient method of manual oocyte enucleation using a pulled pasteur pipette. In Vitro Cellular and Developmental Biology - Animal. 49 (8), 569-575 (2013).
- Zampolla, T., Spikings, E., Rawson, D., Zhang, T. Cytoskeleton proteins F-actin and tubulin distribution and interaction with mitochondria in the granulosa cells surrounding stage III zebrafish (danio rerio) oocytes. Theriogenology. 76 (6), 1110-1119 (2011).
- International Union for Conservation of Nature. The IUCN Red List of Threatened Species. International Union for Conservation of Nature. , (2021).
- Berg, D. K., Li, C., Asher, G., Wells, D. N., Oback, B. Red deer cloned from antler stem cells and their differentiated progeny. Biology of Reproduction. 77 (3), 384-394 (2007).
- Gómez, M. C., et al. Birth of African wildcat cloned kittens born from domestic cats. Cloning and Stem Cells. 6 (3), 247-258 (2004).
- Lanza, R. P., et al. Cloning of an endangered species (Bos gaurus) using interspecies nuclear transfer. Cloning. 2 (2), 79-90 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены