Method Article
Endojen Drosophila Geçici Reseptör Potansiyel Kanallarının Saflaştırılması
Bu Makalede
Özet
INAD protein kompleksinin montaj mekanizmasına dayanarak, bu protokolde, endojen Drosophila TRP kanalını saflaştırmak için modifiye edilmiş bir afinite saflaştırma artı rekabet stratejisi geliştirilmiştir.
Özet
Drosophila fototransdüksiyonu, bilinen en hızlı G proteinine bağlı sinyal yollarından biridir. Bu kaskadının özgüllüğünü ve verimliliğini sağlamak için, kalsiyum (Ca2+)-geçirgen katyon kanalı, geçici reseptör potansiyeli (TRP), iskele proteinine sıkıca bağlanır, inaktivasyon-sonrası-potansiyel D (INAD) ve göze özgü protein kinaz C (ePKC) ve fosfolipaz Cβ / No reseptör potansiyeli A (PLCβ / NORPA) ile büyük bir sinyal protein kompleksi oluşturur. Bununla birlikte, Drosophila TRP kanalının biyokimyasal özellikleri belirsizliğini korumaktadır. INAD protein kompleksinin montaj mekanizmasına dayanarak, endojen TRP kanalını saflaştırmak için modifiye edilmiş bir afinite saflaştırma artı rekabet stratejisi geliştirilmiştir. İlk olarak, saflaştırılmış histidin (His) etiketli NORPA 863-1095 fragmanı Ni-boncuklara bağlandı ve endojen INAD protein kompleksini Drosophila kafa homojenatlarından aşağı çekmek için yem olarak kullanıldı. Daha sonra, TRP kanalı ile rekabet etmek için Ni-boncuklara aşırı saflaştırılmış glutatyon S-transferaz (GST) etiketli TRP 1261-1275 parçası eklendi. Son olarak, süpernatanttaki TRP kanalı, boyut dışlama kromatografisi ile aşırı TRP 1261-1275 peptidinden ayrıldı. Bu yöntem, Drosophila TRP kanalının geçit mekanizmasını hem biyokimyasal hem de yapısal açılardan incelemeyi mümkün kılar. Saflaştırılmış Drosophila TRP kanallarının elektrofizyoloji özellikleri gelecekte de ölçülebilir.
Giriş
Fototransdüksiyon, emilen fotonların nöronların elektriksel kodlarına dönüştürüldüğü bir süreçtir. Sadece opsinleri ve aşağıdaki G proteinine bağlı sinyal kaskadını hem omurgalılarda hem de omurgasızlarda iletir. Drosophila'da, beş PDZ alanını kullanarak, iskele proteini inaktivasyonu-sonrası-sonrası-potansiyel D (INAD), geçici bir reseptör potansiyeli (TRP) kanalı, fosfolipaz Cβ / No reseptör potansiyeli A (PLCβ / NORPA) ve göze özgü protein kinaz C (ePKC) 1'den oluşan bir supramoleküler sinyal kompleksi düzenler. Bu supramoleküler sinyal kompleksinin oluşumu, Drosophila fototransdüksiyon makinelerinin doğru hücre altı lokalizasyonunu, yüksek verimliliğini ve özgüllüğünü garanti eder. Bu komplekste, ışığa duyarlı TRP kanalları, NORPA'nın aşağı akış efektörleri olarak işlev görür ve kalsiyum akışına ve fotoreseptörlerin depolarizasyonuna aracılık eder. Önceki çalışmalar, Drosophila TRP kanalının açılmasına protonlar, yerel lipit ortamının bozulması veya mekanik kuvvet 2,3,4 aracılık ettiğini göstermiştir. Drosophila TRP kanalı ayrıca kalmodulin5 ile etkileşime girer ve kalsiyum tarafından hem pozitif hem de negatif geri besleme 6,7,8 ile modüle edilir.
Şimdiye kadar, Drosophila TRP ve TRP benzeri (TRPL) kanalların geçit mekanizması üzerine yapılan elektrofizyoloji çalışmaları, eksize edilmiş membran yamalarına, ayrışmış vahşi tip Drosophila fotoreseptörlerinden tüm hücre kayıtlarına ve S2, SF9 veya HEK hücrelerindehetero-eksprese kanallara dayanıyordu. Tam uzunluktaki Drosophila TRP kanalının yapısal bilgileri de belirsizliğini koruyor. Saflaştırılmış proteinin elektrofizyolojik özelliklerini yeniden yapılandırılmış bir membran ortamında incelemek ve tam uzunluktaki Drosophila TRP kanalının yapısal bilgisini elde etmek için, saflaştırılmış tam uzunlukta TRP kanallarının elde edilmesi, memeli TRP kanalı çalışmalarında kullanılan metodolojilere benzer şekilde gerekli ilk adımdır14,15,16,17.
Son zamanlarda, INAD protein kompleksi18,19,20'nin montaj mekanizmasına dayanarak, TRP kanalını streptavidin boncukları5 ile Drosophila kafa homojenatlarından arındırmak için bir afinite saflaştırma artı rekabet stratejisi geliştirilmiştir. Streptavidin boncuklarının düşük kapasitesi ve pahalı maliyeti göz önüne alındığında, burada His-etiketli yem proteinini ve buna karşılık gelen düşük maliyetli Ni-boncukları çok daha yüksek kapasiteye sahip kullanan gelişmiş bir saflaştırma protokolü tanıtılmıştır. Önerilen yöntem, TRP kanalının geçit mekanizmasını yapısal açılardan incelemeye ve TRP kanalının elektrofizyolojik özelliklerini saflaştırılmış proteinlerle ölçmeye yardımcı olacaktır.
Protokol
1. GST etiketli TRP ve Onun etiketli NORPA parçalarının saflaştırılması
- GST etiketli TRP 1261-1275 parçasını saflaştır
- CaCl 2 ısı şoku dönüşüm yöntemi 21'i kullanarak pGEX 4T-1 TRP 1261-1275 plazmid10'u Escherichia coli (E. coli)BL21 (DE3) hücrelerine dönüştürün. Tek bir koloniye 10 mL Luria Bertani (LB) ortamında aşılayın ve 37 ° C'de gece boyunca büyüyün. Daha sonra, 10 mL tohumlama kültürünü 37 ° C'de 1 L LB ortamında yükseltin.
- Hücrelerin optik yoğunluğu (OD600) 0.5'e ulaştıktan sonra, hücreleri 16 ° C'ye soğutun ve hedef proteinin aşırı ekspresyonunu indüklemek ve 18 saat boyunca 16 ° C'de inkübe etmek için 0.1 mM izopropil β-D-1-tiyogalaktopiranosid (IPTG; son konsantrasyon) ekleyin.
- Aşırı ekspresyondan sonra, 3.993 × g'de santrifüjleme ile 1 L kültürlenmiş hücreyi 20 dakika boyunca pelet ve 40 mL fosfat tamponlu salin (PBS) tamponunda yeniden askıya alır.
- Yeniden askıya alınan hücreleri, 4 °C'de önceden soğutulmuş yüksek basınçlı bir homojenizatöre yükleyin. Homojenizatör basıncını yavaşça 800 bar'a yükseltin. Giriş musluğunu açın ve yeniden askıya alınan hücrelerin dairesel olarak çok dar yarıklara sahip bir valften geçmesine izin verin.
NOT: Hücreler, büyük bir basınç düşüşü ve kavitasyonun neden olduğu yüksek kesme kuvvetleri ile homojenize edilir. - Bir yerçekimi akış kolonuna 5 mL glutatyon boncuk yükleyin ve boncukları toplam üç kez 50 mL PBS tamponu ile yıkayın.
- Hücre lizatını yüksek basınçlı homojenizatörden 48.384 x g'de santrifüj yapın. Santrifüjlü hücre lizatının (40 mL) süpernatantını, yerçekimi akış sütunundaki dengelenmiş glutatyon boncuklarına ekleyin ve 4 ° C'de 30 dakika boyunca inkübe edin. Glutatyon boncuklarını her 10 dakikada bir yeniden askıya alın.
- 30 dakikalık inkübasyondan sonra, boncukları ve akış fraksiyonunu ayırmak için sütun çıkış musluğunu açın. Akış kesirini atın. Kalan glutatyon boncuklarını 50 mL PBS tamponu ile iki kez durulayın.
- Glutatyon boncuklarına 15 mL elüsyon tamponu ekleyin ve 30 dakika boyunca kuluçkaya yatırın. Boncukları her 10 dakikada bir yeniden askıya alın.
- 30 dakikalık inkübasyondan sonra, GST etiketli TRP 1261-1275 parçasını 50 mL'lik bir konik tüp içinde boşaltın ve 50 mM Tris (pH 7.5, 100 mM NaCl, 1 mM EDTA, 1 mM DTT) tamponu kullanılarak dengelenen bir boyut hariç tutma sütununa (hazırlama sınıfı) yükleyin.
- Boyut hariç tutma sütununun elüsyon akış hızını 3 mL/dk'da tutun. Salınan proteinleri 5 mL/tüp oranında toplayın.
- UV absorpsiyon sinyallerini 280 nm'de analiz ederek boyut dışlama sütunundaki hedef proteinin zirvesini tanımlayın ve SDS-PAGE jel analizi ile doğrulayın (elektroforez parametreleri: istifleme jeli için 150 V; çözme jeli için 200 V). Jeli Coomassie mavisi R250 ile sabitleyin.
- Saflaştırılmış GST etiketli TRP 1261-1275 parçasını, masa üstü soğutulmuş bir santrifüjde 4 °C'de 3.000 x g'de santrifüj edilmiş 15 mL ultrafiltrasyon spin sütunu kullanarak boyut hariç tutma sütunundan 1 mL'ye yoğunlaştırın.
- Bira-Lambert Yasasını kullanarak konsantre protein konsantrasyonunu belirleyin. GST etiketli TRP 1261-1275 parçasının UV emilimini bir spektrofotometre kullanarak 280 nm'de ölçün.
- Protein dizilerini Protparam programına (https://web.expasy.org/protparam/) aktararak 280 nm'de yok olma katsayısını elde edin. Tipik olarak, GST etiketli TRP 1261-1275'in 1 L kültürü, 1 mL 600 μM protein (6 x 10-7 mol) verir. Gerekli malzemeler için Tablo 1'e bakınız.
- Onun etiketli NORPA 863-1095 parçasının saflaştırılması
- CaCl 2 ısı şoku dönüşüm yöntemi 21'i kullanarak pETM.3C NORPA 863-1095 plazmid20'yi E. coli BL21 (DE3) hücrelerine dönüştürün. Tek bir koloniyi 10 mL LB ortamında aşılayın ve 37 ° C'de gece boyunca büyüyün. Daha sonra, 10 mL tohumlama kültürünü 37 ° C'de 1 L LB ortamında yükseltin.
- Hücrelerin OD600'ü 0.5'e ulaştıktan sonra, hücreleri 16 ° C'ye soğutun ve hedef proteinin aşırı ekspresyonunu indüklemek ve 18 saat boyunca 16 ° C'de inkübe etmek için 0.1 mM IPTG (son konsantrasyon) ekleyin.
- Aşırı ekspresyondan sonra, 20 dakika boyunca 3.993 x g'de santrifüjleme ile 1 L kültürlenmiş hücreyi toplayın ve 40 mL bağlanma tamponunda yeniden askıya alın. Daha sonra, yeniden askıya alınmış hücreleri, adım 1.1.4'te açıklandığı gibi 4 ° C'de yüksek basınçlı bir homojenizatörde lize edin.
- Bir yerçekimi akış kolonuna 5 mL Ni-boncuk yükleyin ve 50 mL bağlayıcı tamponla üç kez yıkayın.
- Hücre lizatını yüksek basınçlı homojenizatörden 48.384 x g'de santrifüj yapın. Santrifüjlü hücre lizatının süpernatantını, yerçekimi akış sütunundaki dengelenmiş Ni-boncuklarına ekleyin ve 4 ° C'de 30 dakika boyunca inkübe edin. Ni-boncukları her 10 dakikada bir yeniden askıya alın.
- 30 dakikalık inkübasyondan sonra, boncukları ve akış fraksiyonunu ayırmak için sütun çıkış musluğunu açın. Akış fraksiyonunu atın ve kalan Ni-boncukları 50 mL yıkama tamponu ile iki kez yıkayın.
- Ni-boncuklara 15 mL elüsyon tamponu ekleyin ve 30 dakika kuluçkaya yatırın. Ni-boncukları her 10 dakikada bir yeniden askıya alın.
- 30 dakikalık inkübasyondan sonra, salınımlı His-etiketli NORPA 863-1095 parçasını 50 mL'lik bir konik tüpte toplayın ve 50 mM Tris (pH 7.5, 100 mM NaCl, 1 mM EDTA, 1 mM DTT) kullanılarak dengelenen bir boyut hariç tutma sütununa (hazırlama sınıfı) yükleyin.
- Boyut hariç tutma sütununun elüsyon akış hızını 3 mL/dk'da tutun. Salınan proteini 5 mL / tüp oranında toplayın.
- UV absorpsiyon sinyallerini 280 nm'de analiz ederek boyut dışlama sütunundaki hedef proteinin zirvesini tanımlayın ve SDS-PAGE jel analizi ile doğrulayın (elektroforez parametreleri: istifleme jeli için 150 V; çözme jeli için 200 V). Coomassie mavi R250 kullanarak jeli lekeleyin.
- Saflaştırılmış His etiketli NORPA 863-1095 parçasını, masa üstü soğutulmuş bir santrifüjde 4 °C'de 3.000 x g'de santrifüj edilmiş 15 mL ultrafiltrasyon spin sütunu kullanarak boyut hariç tutma sütunundan 1 mL'ye konsantre edin.
- Bira-Lambert Yasasını kullanarak konsantre protein konsantrasyonunu belirleyin. Bir spektrofotometre kullanarak His-etiketli NORPA 863-1095 parçasının UV emilimini 280 nm'de ölçün.
- Protein dizilerini Protparam programına (https://web.expasy.org/protparam/) aktararak 280 nm'de yok olma katsayısını elde edin. Tipik olarak, His-etiketli NORPA 863-1095 fragmanının 1 L kültürü, 1 mL 600 μM protein (6 x 10-7 mol) verir. Gerekli malzemeler için Tablo 2'ye bakınız.
2. Drosophila kafalarının hazırlanması
- CO 2 anestezi yöntemi22,23'ü kullanarak yetişkin sinekleri 50 mL konik santrifüjleme tüplerinde toplayın; hemen sıvı azotta 10 dakika dondurun ve -80 ° C'lik bir dondurucuda saklayın.
- Yeterli sayıda sinek topladıktan sonra, sineklerin bacaklarını, kafalarını, kanatlarını ve vücutlarını ayırmak için donmuş 50 mL konik tüpleri elle kuvvetlice sallayın. Karışımı sıralı olarak istiflenmiş üç adet önceden soğutulmuş paslanmaz çelik eleğe (sırasıyla 20/30/40 ağ boyutu) aktarın ve elekleri sallayın.
- Daha sonra, kafalar 40 örgülü elek içinden geçemediğinden, sinek kafalarını 40 örgülü elek dışına süpürmek, 50 mL konik tüplere aktarmak ve -80 ° C'de saklamak için bir fırça kullanın.
- Sinekleri ve kafalarını sürekli olarak toplayın ve deney için gerekli miktara (0,5 g) ulaşana kadar -80 ° C'lik bir dondurucuda saklayın. Tipik olarak, 0.5 g kafa toplamak için, 50 mL'lik bir konik tüpte 35 mL sinek gerekir. Gerekli malzemeler için Tablo 3'e bakınız.
3. Drosophila TRP kanal saflaştırma
- Toplam 0,5 g kafa tartın ve önceden soğutulmuş bir harç havanesi kullanarak sıvı azotta tamamen homojenize edin. Homojenize edilmiş kafaları 10x v/w lizis tamponunda (5 mL) çözün, 20 dakika boyunca 4 °C'de bir çalkalayıcıda inkübe edin ve ardından 4 °C'de 20 dakika boyunca 20.817 x g'de santrifüj yapın.
- Spin-down süpernatantını ("20817 g S", Şekil 4) toplayın ve 4 ° C'de 60 dakika boyunca 100.000 x g'de santrifüj yapın. Aşağıdaki aşağı çekme testi için spin-down süpernatantını ("100.000 g S", Şekil 4) kullanın.
- Yerçekimi akış sütununa 1 mL Ni-boncuk ekleyin ve boncukları 4 ° C'de 10 mL çift damıtılmış H2O (ddH2O) ile toplam üç kez yıkayın. Boncukları, 4 ° C'de üç kez 10 sütun hacimli lizis tamponu ile dengeleyin.
- Ni-kolonuna 500 μL 600 μM saflaştırılmış His-etiketli NORPA 863-1095 proteini (3 x 10-7 mol) ekleyin ve 4 ° C'de 30 dakika boyunca inkübe edin. Boncukları her 10 dakikada bir yeniden askıya alın.
- Boncukları ve akış fraksiyonunu ayırmak için sütun çıkış musluğunu açın. SDS-PAGE analizi için akış kesirini alın (NORPA F, Şekil 4). Bu bölümde, yem proteinleri Ni-boncuklar üzerinde hareketsiz hale getirilir.
- Ni-boncukları 4 °C'de 10 kolon hacimli lizis tamponu (10 mL) ile yıkayın ve SDS-PAGE analizi için yıkama fraksiyonunu saklayın (Yıkama 1, Şekil 4A). Yukarıdaki adımları tekrarlayın ve SDS-PAGE analizi için numuneyi saklayın (Yıkama 2, Şekil 4A). Bu bölümde, Ni-boncuklar üzerindeki aşırı yem proteinleri uzaklaştırılır.
- 100.000 x g santrifüjlemeden sonra Drosophila kafa homojenatının süpernatantını, 4 ° C'de Ni-sütununa ekleyin, burada His etiketli NORPA 863-1095 parçası hareketsiz hale getirilmiştir.
- Süpernatantı Ni-boncuklarla 4 ° C'de 30 dakika boyunca inkübe edin. Boncukları her 10 dakikada bir yeniden askıya alın. Ardından, boncukları ve akış fraksiyonunu ayırmak için sütun çıkış musluğunu açın.
- SDS-PAGE analizi için süpernatantı toplayın (Dro kafa lizisi F, Şekil 4A). Bu bölümde, kafa homojenatlarındaki INAD protein kompleksleri (INAD / TRP / ePKC), Ni-boncuklar üzerindeki hareketsiz NORPA 863-1095 parçaları tarafından yakalanır.
- Ni-boncukları 4 °C'de 10 sütun hacimli lizis tamponu (10 mL) ile yıkayın ve SDS-PAGE analizi için süpernatantı yerçekimi çökelmesinden uzak tutun (Yıkama 3, Şekil 4A). Yukarıdaki adımları tekrarlayın ve SDS-PAGE analizi için süpernatantı toplayın (Yıkama 4, Şekil 4A). Bu bölümde, Ni-boncuklar üzerindeki bağlanmamış proteinler uzaklaştırılır.
- Ni-boncuklara 500 μL 600 μM GST etiketli TRP 1261-1275 protein (3 x 10-7 mol) ekleyin ve 4 ° C'de 20 dakika kuluçkaya yatırın. Boncukları her 10 dakikada bir yeniden askıya alın.
- Endojen Drosophila TRP kanalını içeren yerçekimi sütunundan (TRP E1, Şekil 4B) salınan fraksiyonu toplayın. Yukarıdaki adımları tekrarlayın ve elüsyon fraksiyonunu toplayın (TRP E2, Şekil 4B). Bu adımda, GST etiketli TRP 1261-1275 parçalarını rakip olarak kullanarak, TRP kanalları Ni-boncuklar üzerindeki yakalanan INAD protein komplekslerinden (INAD / TRP / ePKC) salınır.
- Ni-boncukları 10 sütun hacimli bağlayıcı tamponla (10 mL; Tablo 1) 4 °C'de ve SDS-PAGE analizi için yıkama fraksiyonunu toplayın (Yıkama 5, Şekil 4B).
- Ni-boncuklara 500 μL elüsyon tamponu (Tablo 1) ekleyin ve 4 ° C'de 20 dakika kuluçkaya yatırın. Yerçekimi akış kolonundan elüsyon fraksiyonunu toplayın (NORPA E1, Şekil 4B). Yukarıdaki adımları tekrarlayın ve elüsyon fraksiyonunu toplayın (NORPA E2, Şekil 4B).
- Elüsyon tamponunu kullanarak, INAD / ePKC protein kompleksleri ile birlikte His-etiketli NORPA 863-1095 fragmanını etkisiz hale getirin. Ardından, Ni-boncukları 500 μL bağlayıcı tamponda yeniden askıya alın.
- Elüsyonun verimliliğini analiz etmek ve elute tamponun çalışıp çalışmadığını değerlendirmek için SDS-PAGE'i (Coomassie mavisi R250 ile boyanmış) çalıştırmak için yeniden askıya alınmış Ni-boncukları alın (boncuklar, Şekil 4B). Gerekli malzemeler için Tablo 4'e bakınız.
4. Drosophila TRP kanalının boyut hariç tutma kolon saflaştırılması
- Protein saflaştırma sistemine bir boyut hariç tutma sütunu (analitik sınıf) takın. Kolonu 0,45 μm filtre ile filtrelenen sütun tamponu (50 mM Tris-HCl pH 7,5, 150 mM NaCl, 2 mM DTT, 0,75 mM DDM) ile dengeleyin.
- TRP E1 ve E2 fraksiyonunu 3.14. adımdan itibaren, soğutulmuş bir santrifüjde 4 °C'de 3.000 x g'de santrifüjlenmiş 4 mL ultrafiltrasyon spin sütunu kullanarak konsantre edin.
- Numune döngüsünü kolon tamponuyla durulayın ve numuneyi numune döngüsüne yükleyin. Numuneyi boyut hariç tutma kolonuna enjekte edin ve proteinleri uygun bir akış hızıyla (0,5 mL / dak) süzün.
- Hedef proteinin zirvesini 280 nm'de absorpsiyonla tanımlayın ve saflaştırılmış endojen Drosophila TRP kanalını tespit etmek için bir SDS-PAGE jeli çalıştırın (Şekil 5). Gerekli malzemeler için Tablo 5'e bakınız.
Sonuçlar
Bu makalede, endojen Drosophila TRP kanalını saflaştırmak için bir protein saflaştırma yöntemi gösterilmiştir (Şekil 1).
İlk olarak, yem ve rakip proteinleri elde etmek için rekombinant protein ekspresyonu ve saflaştırma uygulanır. Daha sonra, GST etiketli bir TRP 1261-1275 fragmanı, LB ortamındaki E. coli BL21 (DE3) hücrelerinde eksprese edilir ve glutatyon boncukları ve bir boyut hariç tutma sütunu kullanılarak saflaştırılır (Şekil 2). Örnekler, Coomassie mavi R250 boyaması ile SDS-PAGE analizi kullanılarak doğrulandı. SDS-PAGE numune hazırlama işleminde, 30 μL protein numunesi 10 μL 4x yükleme boyası ile karıştırılır ve 10 dakika boyunca 100 °C'de kaynatılır. Daha sonra, 15 μL haşlanmış numune her bir kuyucuğa ayrı ayrı yüklenir. Onun etiketli NORPA 863-1095 fragmanı da benzer şekilde LB ortamındaki E. coli BL21 (DE3) hücrelerinde eksprese edilir ve Ni-boncuklar ve boyut hariç tutma sütunu ile saflaştırılır (Şekil 3). Saflaştırılmış GST etiketli TRP 1261-1275 ve Onun etiketli NORPA 863-1095, endojen Drosophila TRP kanalının saflaştırılması için yoğunlaşmıştır.
İkincisi, Drosophila kafaları önceden soğutulmuş bir harç-havane kullanılarak sıvı azotta toplanır ve homojenize edilir ve daha sonra 10x v / w lizis tamponunda çözülür (Tablo 4). Çözünmüş kafa homojenatı, 20 dakika boyunca 4 ° C'de bir çalkalayıcıda inkübe edilir ve 4 ° C'de 20 dakika boyunca 20.817 x g'de santrifüj edilir. Spin-down süpernatant (20817 g S, Şekil 4A) toplanır ve 4 ° C'de 60 dakika boyunca 100.000 x g'de daha da santrifüj edilir. İkinci spin-down süpernatant (100.000 g S, Şekil 4A) sonraki pull-down testi için kullanılır.
Son olarak, pull-down ve rekabet testi ilkelerine dayanarak, endojen TRP kanalını saflaştırmak için afinite saflaştırma artı rekabet stratejisi kullanılır. Saflaştırılmış His-etiketli NORPA 863-1095 fragmanı Ni-boncuklara bağlanır ve endojen INAD protein komplekslerini Drosophila kafa homojenatlarından aşağı çekmek için yem olarak kullanılır. Daha sonra, Ni-boncuklar üzerindeki yakalanan INAD komplekslerinden TRP kanalı için rekabet etmek üzere aşırı saflaştırılmış GST etiketli TRP 1261-1275 parçası eklenir (TRP E1, TRP E2, Şekil 4B). Sonunda, salınan TRP kanalı, aşırı GST etiketli TRP 1261-1275 peptidinden boyut dışlama kromatografisi ile ayrılır (Şekil 5). SDS-PAGE numune hazırlama işleminde, 30 μL protein numunesi 10 μL 4x yükleme boyası ile karıştırılır ve 10 dakika boyunca 100 °C'de kaynatılır. Daha sonra, 15 μL numune her bir kuyucuğa ayrı ayrı yüklenir. Bir yan ürün olarak, INAD-ePKC-NORPA 863-1095 kompleksleri, TRP 1261-1275 peptid yarışmasından sonra Ni-boncukların salınmasıyla da elde edilebilir (NORPA E1, NORAP E2, Şekil 4B). Bu yöntemi kullanarak, 0.5 g sinek kafalarından nihai saflaştırılmış Drosophila TRP kanalının tipik verimi, 50 μL 3 μM TRP proteinidir (1.5 x 10-10 mol). Daha saflaştırılmış TRP kanallarına ihtiyaç duyulursa, sinek kafaları, Ni-boncuklar, yem proteini ve rakip miktarını buna uygun olarak artırın.

Şekil 1: Endojen Drosophila TRP kanalının saflaştırılması için şematik diyagram . (A) Saflaştırılmış His-etiketli NORPA 863-1095 proteinleri Ni-boncuklar üzerinde hareketsiz hale getirilmiştir. (B) Drosophila kafaları homojenize edilir ve 100.000 x g santrifüjlemeden sonra spin-down süpernatant, NORPA 863-1095 proteininin endojen INAD protein komplekslerini (INAD / TRP / ePKC) yakalamak için yem görevi gördüğü NORPA'ya bağlı Ni-boncuklara eklenir. (C) GST etiketli TRP 1261-1275 fragmanı, yakalanan INAD protein komplekslerinden endojen Drosophila TRP kanalı için rekabet etmek üzere eklenir. (D) Salınan TRP proteini, aşırı GST etiketli TRP 1261-1275 fragmanını ayırmak için bir boyut hariç tutma sütunu ile daha da saflaştırılır. Kırmızı oklar, sırasıyla TRP kanalının ve GST etiketli TRP 1261-1275 parçasının elüsyon konumlarını vurgular. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: GST etiketli TRP-CT 1261-1275 proteininin glutatyon boncuklar ve boyut dışlama kromatografisi ile saflaştırılması. (A) GST etiketli TRP-CT 1261-1275 proteininin boyut dışlama sütununda saflaştırma profili (hazırlama sınıfı). Fraksiyonlar 5 mL/tüpte toplanır. Ok pozisyonundaki fraksiyonlar (tüpler 44-48), endojen TRP kanalının aşağıdaki saflaştırılması için toplanır ve konsantre edilir. (B) Glutatyon boncuk afinite saflaştırmasında GST etiketli TRP 1261-1275 parçasını gösteren Coomassie mavi R250 lekeli SDS-PAGE jeli ve müteakip boyut hariç tutma sütun saflaştırması. Ok, GST etiketli TRP 1261-1275 parçasının SDS-PAGE jelindeki konumunu vurgular. Kısaltmalar: P: E. coli'den pelet. PBS tamponunda homojenizasyon ve 48.384 x g'de santrifüjleme sonrasında BL21 (DE3) hücre lizatı; S: E. coli'den süpernatant. 48.384 x g'da homojenizasyon ve santrifüjleme sonrası BL21 (DE3) hücre lizatı; F: 4 ° C'de 30 dakika boyunca glutatyon boncuklarla inkübe edilen önceki S fraksiyonundan sonra akış fraksiyonu; W1 ve W2: PBS tamponunun 10 sütun hacmine göre birinci ve ikinci yıkama fraksiyonu; B: Geri süspansiyonlu glutatyon boncukları üzerindeki salınımsız protein, elüsyon verimliliğini değerlendirmek için SDS-PAGE jeli ile analiz edilir; E: elüsyon tamponu ile glutatyon boncuklarından elüsyon fraksiyonu. GST etiketli protein saflaştırması için tampon tarifi Tablo 1'de açıklanmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: His-etiketli NORPA 863-1095 proteininin Ni-boncuklar ve boyut dışlama kromatografisi ile saflaştırılması. (A) Bir boyut hariç tutma sütununda His etiketli NORPA 863-1095 proteininin saflaştırma profili. Akış hızı = 3 mL/dak. Fraksiyonlar 5 mL/tüpte toplanır. Ok pozisyonundaki fraksiyonlar (tüpler 44-49), endojen TRP kanalının aşağıdaki saflaştırılması için toplanır ve konsantre edilir. (B) Ni kolon saflaştırma ve müteakip boyut dışlama kolon saflaştırmasında His-etiketli NORPA 863-1095 proteinini gösteren Coomassie mavi R250 lekeli SDS-PAGE jeli. Ok, His-etiketli NORPA 863-1095 proteininin SDS-PAGE jelindeki konumunu vurgular. Kısaltmalar: P: E. coli'den pelet. BL21 (DE3) hücre lizatı, bağlanma tamponunda homojenizasyon ve 48.384 x g'de santrifüjleme işleminden sonra; S: E. coli'den süpernatant fraksiyon. 48.384 x g'da homojenizasyon ve santrifüjleme sonrası BL21 (DE3) hücre lizatı; F: Önceki S fraksiyonundan sonraki akış fraksiyonu, 4 ° C'de 30 dakika boyunca Ni-boncuklarla inkübe edilir; W1 ve W2: 10 kolon hacimli yıkama tamponu ile birinci ve ikinci yıkama fraksiyonu; B: Elüsyondan sonra yeniden askıya alınan Ni-boncuklar üzerindeki salınımsız protein; E: Elüsyon tamponu ile Ni-boncuklardan elüsyon fraksiyonları. His etiketli protein saflaştırması için tampon tarifi Tablo 2'de listelenmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: Endojen Drosophila TRP kanalının saflaştırılması. Her adımdan toplanan örnekler SDS-PAGE ile analiz edilir ve Coomassie mavi R-250 boyası ile boyanır. (A) 20817 g S: 20.817 x g santrifüjlemeden sonra başın süpernatant fraksiyonu homojenleşir; NORPA F: His-etiketli NORPA 863-1095 parça bağlamasından sonra Ni-boncukların akış kesri; Wash1 ve Wash2: Has etiketli NORPA 863-1095 bağlamasından sonra Ni-boncukların lizis tamponu ile birinci ve ikinci yıkama fraksiyonları; 100.000 g S: önceki 20.817 g S süpernatant, 100.000 x g'de daha fazla santrifüj edilir ve süpernatant SDS-PAGE için toplanır; Dro kafa lizisi F: 100.000 g S numune ile inkübasyondan sonra Ni-boncukların akış fraksiyonu; Wash3 ve Wash4: 100.000 g S numune ile inkübasyondan sonra Ni-boncukların fraksiyonlarının lizis tamponu ile yıkanması. (B) TRP E1 ve E2: GST etiketli TRP 1261-1275 parçasına göre birinci ve ikinci salınımlı TRP kanal kesirleri; Wash5: GST etiketli TRP 1261-1275 ile rekabetten sonra tamponu bağlayarak Ni-boncukların fraksiyonlarını yıkamak; NORPA E1 ve E2: yakalanan INAD / ePKC komplekslerine sahip His-etiketli NORPA 863-1095 parçalarının birinci ve ikinci elüsyon fraksiyonu; boncuklar: elüsyon tampon işleminden sonra yeniden askıya alınmış Ni-boncuklarda kalan salınımsız protein. Endojen Drosophila TRP kanal saflaştırması için tampon tarifi Tablo 4'te açıklanmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
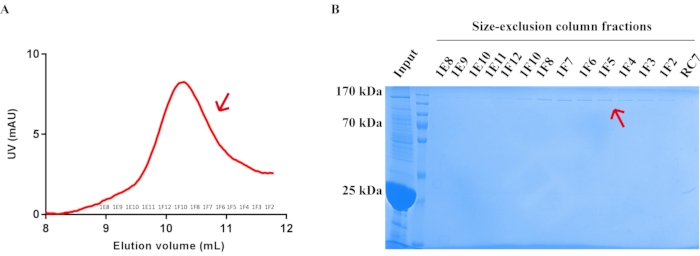
Şekil 5: Endojen Drosophila TRP kanal proteininin boyut dışlama kromatografisi ile saflaştırılması. (A) Endojen Drosophila TRP kanal proteininin boyut dışlama sütunundaki saflaştırma profili. Akış hızı = 0,5 mL/dak. Fraksiyonlar 0.5 mL/tüpte toplandı. Ok pozisyonundaki fraksiyonlar (1E8-1F2) toplandı ve konsantre edildi. (B) Boyut dışlama kolon saflaştırmasından sonra endojen Drosophila TRP kanal proteinini gösteren Coomassie mavi R-250 lekeli SDS-PAGE jeli. Saflaştırılmış endojen Drosophila TRP kanal proteininin konumu kırmızı okla vurgulanır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tablo 1: GST etiketli TRP 1261-1275 parçasının saflaştırılması için gerekli malzemeler. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 2: His-etiketli NORPA 863-1095 parçasının saflaştırılması için gerekli malzemeler. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 3: Drosophila başlıklarının hazırlanması için gerekli materyaller. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 4: Drosophila TRP kanalının saflaştırılması için gerekli malzemeler. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 5: Drosophila TRP kanalının boyut hariç tutma kolon saflaştırması için gerekli malzemeler. Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Beş PDZ alanı içeren INAD, Drosophila fototransdüksiyon makinelerinin temel organizatörüdür. Önceki çalışmalar, INAD PDZ3'ün TRP kanalı C-terminal kuyruğuna zarif bir özgüllükle bağlandığını göstermiştir (KD = 0.3 μM)18. INAD PDZ45 tandem, NORPA 863-1095 fragmanı ile son derece yüksek bir bağlanma afinitesi ile etkileşime girer (KD = 30 nM). Bu bulgular, NORPA CC-PBM parçasının aşağı çekme yemi olarak kullanılmasını sağlayan afinite saflaştırma artı rekabet stratejisini tasarlamak için sağlam bir biyokimyasal temel sağlarken, TRP C-terminal kuyruğu (parça 1261-1275) rekabetçi bir reaktif olarak işlev görür. Bu nedenle, bu yöntem için ilk kritik nokta, INAD kompleksinin montaj mekanizmasını anlamak ve yeterli NORPA ve TRP parçaları elde etmektir. Aynı zamanda TRP kanalı, membrandan ekstrakte edilmesi ve çözelti içinde stabilize edilmesi gereken membran proteini olduğu için deterjan kullanımı bu yöntemin ikinci kritik noktasıdır. TRP kanalları24,25'in yapısal ve fonksiyonel çalışmaları için popüler bir deterjan olarak, bu yöntemde n-Dodecyl-B-D-Maltoside (DDM) kullanılır. Saflaştırma sonuçları tatmin edici değilse, yem proteininin, rakip proteinin ve deterjanın niteliklerinin dikkatlice kontrol edilmesi gerekir. Ek olarak, TRP kanallarının ekstraksiyon verimliliği, TRP antikoru kullanılarak batı lekesi ile izlenebilir.
Önceki bir çalışmada5, TRP kanalını laboratuarda rutin saflaştırmayı sınırlayan sinek kafası ekstraktlarından arındırmak için pahalı streptavidin boncukları kullanılmıştır. Bu nedenle, yöntemi maliyeti düşürmek ve verimi artırmak için Ni-boncuklarla birleştirilmiş His-etiketli bir NORPA 863-1095 parçası kullanılarak geliştirilmiştir. Şu anda, geliştirilmiş yöntemdeki saflaştırılmış TRP kanalının verimleri, saflaştırılmış TRP kanallarının tetramerler oluşturduğu (veriler gösterilmemiştir) bir iletim elektron mikroskobu (TEM) negatif boyama deneyi yapmak için yeterlidir, bu da saflaştırma işleminin TRP kanallarının tetramer oluşumunu bozmadığını gösterir. Bu nedenle, bu protokol gelecekteki kriyo-EM ve elektrofizyoloji deneyleri için potansiyel olarak uygun olacaktır.
Bununla birlikte, deneylerde kullanılan rakipler (NORPA 863-1095 fragmanı, TRP 1261-1275 fragmanı) vahşi tip proteinlerle benzer bağlanma afinitelerine sahip olduklarından, bu yöntemin sınırlaması, hedef proteini aşağı çekmek için büyük rekabetçi proteinlerin ve boncukların kullanılması gerektiğidir. Yemi büyük ölçekte saflaştıramayan laboratuvarlar için uygun olmayacaktır.
Bu yöntemin gelecekteki potansiyel bir uygulaması, Cryo-EM tekniklerini kullanarak Drosophila TRP kanalının yapısal bilgilerini incelemek olacaktır. Ek olarak, yapay çift katmanlı lipit membranındaki saflaştırılmış endojen TRP kanallarının elektrofizyolojik özelliklerinin ölçülmesi de mümkündür. Ayrıca, bu yeniden yapılandırılmış model sisteminde, saflaştırılmış endojen TRP kanallarının elektrofizyolojik özelliklerini, INAD kompleks bileşimini ve lipit bileşimini modüle ederek karakterize etmek ilginç olacaktır. Son olarak, yapısal bilgi ve elektrofizyolojik özelliklerle birleştirildiğinde, TRP kanalının geçit ve düzenleme mekanizmaları gelecekte dikkatlice incelenebilir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (No. 31870746), Shenzhen Temel Araştırma Hibeleri (JCYJ20200109140414636) ve Guangdong Eyaleti, Çin Doğa Bilimleri Vakfı (No. 2021A1515010796) tarafından W. L. L. tarafından desteklenmiştir. LetPub'a (www.letpub.com) bu makalenin hazırlanması sırasındaki dilbilimsel yardımları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bacterial strains | |||
| BL21(DE3) Competent Cells | Novagen | 69450 | Protein overexpression |
| Experiment models | |||
| D.melanogaster: W1118 strain | Bloomington Drosophila Stock Center | BDSC:3605 | Drosophila head preparation |
| Material | |||
| 20/30/40 mesh stainless steel sieves | Jiufeng metal mesh company | GB/T6003.1 | Drosophila head preparation |
| 30% Acrylamide-N,N′-Methylenebisacrylamide(29:1) | Lablead | A3291 | SDS-PAGE gel preparation |
| Ammonium Persulfate | Invitrogen | HC2005 | SDS-PAGE gel preparation |
| Cocktail protease inhibitor | Roche | 05892953001 | Protease inhibitor |
| Coomassie brilliant blue R-250 | Sangon Biotech | A100472-0025 | SDS-PAGE gel staining |
| DL-Dithiothreitol (DTT) | Sangon Biotech | A620058-0100 | Size-exclusion column buffer preparation |
| Ethylenediaminetetraacetic acid disodium salt (EDTA) | Sangon Biotech | A500838-0500 | Size-exclusion column buffer preparation |
| Glycine | Sangon Biotech | A610235-0005 | SDS-PAGE buffer preparation |
| Glutathione Sepharose 4 Fast Flow beads | Cytiva | 17513202 | Affinity chromatography |
| Imidazole | Sangon Biotech | A500529-0001 | Elution buffer preparation for Ni-column |
| Isopropyl-beta-D-thiogalactopyranoside (IPTG) | Sangon Biotech | A600168-0025 | Induction of protein overexpression |
| LB Broth Powder | Sangon Biotech | A507002-0250 | E.coli. cell culture |
| L-Glutathione reduced (GSH) | Sigma-aldrich | G4251-100G | Elution buffer preparation for Glutathione beads |
| Ni-Sepharose excel beads | Cytiva | 17371202 | Affinity chromatography |
| N-Dodecyl beta-D-maltoside (DDM) | Sangon Biotech | A610424-001 | Detergent for protein purification |
| N,N,N',N'-Tetramethylethylenediamine (TEMED) | Sigma-aldrich | T9281-100ML | SDS-PAGE gel preparation |
| PBS | Sangon Biotech | E607008-0500 | Homogenization buffer for E.coli. cell |
| PMSF | Lablead | P0754-25G | Protease inhibitor |
| Prestained protein marker | Thermo Scientific | 26619/26616 | Prestained protein ladder |
| Size exclusion column (preparation grade) | Cytiva | 28989336 | HiLoad 26/60 Superdex 200 PG column |
| Size exclusion column (analytical grade) | Cytiva | 29091596 | Superose 6 Increase 10/300 GL column |
| Sodium chloride | Sangon Biotech | A501218-0001 | Protein purification buffer preparation |
| Sodium dodecyl sulfate (SDS) | Sangon Biotech | A500228-0001 | SDS-PAGE gel/buffer preparation |
| Tris base | Sigma-aldrich | T1503-10KG | Protein purification buffer preparation |
| Ultrafiltration spin column | Millipore | UFC901096/801096 | Protein concentration |
| Equipment | |||
| Analytical Balance | DENVER | APX-60 | Metage of Drosophila head |
| Desk-top high-speed refrigerated centrifuge for 15mL and 50mL conical centrifugation tubes | Eppendorf | 5810R | Protein concentration |
| Desk-top high-speed refrigerated centrifuge 1.5mL centrifugation tubes | Eppendorf | 5417R | Centrifugation of Drosophila head lysate after homogenization |
| Empty gravity flow column (Inner Diameter=1.0cm) | Bio-Rad | 738-0015 | TRP protein purification |
| Empty gravity flow column (Inner Diameter=2.5cm) | Bio-Rad | 738-0017 | Bait and competitor protein purification from E.coli. |
| Gel Documentation System | Bio-Rad | Universal Hood II Gel Doc XR System | SDS-PAGE imaging |
| High-speed refrigerated centrifuge | Beckman coulter | Avanti J-26 XP | Centrifugation of E.coli. cells/cell lysate |
| High pressure homogenizer | UNION-BIOTECH | UH-05 | Homogenization of E.coli. cells |
| Liquid nitrogen tank | Taylor-Wharton | CX-100 | Drosophila head preparation |
| Protein purification system | Cytiva | AKTA purifier | Protein purification |
| Refrigerator (-80°C) | Thermo | 900GP | Drosophila head preparation |
| Spectrophotometer | MAPADA | UV-1200 | OD600 measurement of E.coli. cells |
| Spectrophotometer | Thermo Scientific | NanoDrop 2000c | Determination of protein concentration |
| Ultracentrifuge | Beckman coulter | Optima XPN-100 Ultracentrifuge | Ultracentrifugation |
Referanslar
- Tsunoda, S., et al. A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature. 388 (6639), 243-249 (1997).
- Huang, J., et al. Activation of TRP channels by protons and phosphoinositide depletion in Drosophila photoreceptors. Current Biology: CB. 20 (3), 189-197 (2010).
- Chyb, S., Raghu, P., Hardie, R. C. Polyunsaturated fatty acids activate the Drosophila light-sensitive channels TRP and TRPL. Nature. 397 (6716), 255-259 (1999).
- Hardie, R. C., Franze, K. Photomechanical responses in Drosophila photoreceptors. Science. 338 (6104), 260-263 (2012).
- Chen, W., et al. Calmodulin binds to Drosophila TRP with an unexpected mode. Structure. 29 (4), 330-344 (2021).
- Hardie, R. C. Effects of intracellular Ca2+ chelation on the light response in Drosophila photoreceptors. Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology. 177 (6), 707-721 (1995).
- Scott, K., Sun, Y., Beckingham, K., Zuker, C. S. Calmodulin regulation of Drosophila light-activated channels and receptor function mediates termination of the light response in vivo. Cell. 91 (3), 375-383 (1997).
- Hardie, R. C., Minke, B. Phosphoinositide-mediated phototransduction in Drosophila photoreceptors: the role of Ca2+ and trp. Cell Calcium. 18 (4), 256-274 (1995).
- Delgado, R., et al. Light-induced opening of the TRP channel in isolated membrane patches excised from photosensitive microvilli from Drosophila photoreceptors. Neuroscience. 396, 66-72 (2019).
- Lev, S., Katz, B., Minke, B. The activity of the TRP-like channel depends on its expression system. Channels (Austin). 6 (2), 86-93 (2012).
- Hardie, R. C., Raghu, P. Activation of heterologously expressed Drosophila TRPL channels: Ca2+ is not required and InsP3 is not sufficient. Cell Calcium. 24 (3), 153-163 (1998).
- Gutorov, R., et al. Modulation of transient receptor potential C channel activity by cholesterol. Frontiers in Pharmacology. 10, 1487(2019).
- Yagodin, S., et al. Thapsigargin and receptor-mediated activation of Drosophila TRPL channels stably expressed in a Drosophila S2 cell line. Cell Calcium. 23 (4), 219-228 (1998).
- Guo, W., Chen, L. Recent progress in structural studies on canonical TRP ion channels. Cell Calcium. 83, 102075(2019).
- Li, X., Fine, M. TRP channel: The structural era. Cell Calcium. 87, 102191(2020).
- Liao, M., Cao, E., Julius, D., Cheng, Y. Structure of the TRPV1 ion channel determined by electron cryo-microscopy. Nature. 504 (7478), 107-112 (2013).
- Cao, E., Liao, M., Cheng, Y., Julius, D. TRPV1 structures in distinct conformations reveal activation mechanisms. Nature. 504 (7478), 113-118 (2013).
- Liu, W., et al. The INAD scaffold is a dynamic, redox-regulated modulator of signaling in the Drosophila eye. Cell. 145 (7), 1088-1101 (2011).
- Ye, F., Liu, W., Shang, Y., Zhang, M. An exquisitely specific PDZ/target recognition revealed by the structure of INAD PDZ3 in complex with TRP channel. Structure. 24 (3), 383-391 (2016).
- Ye, F., et al. An unexpected INAD PDZ tandem-mediated plcβ binding in Drosophila photo receptors. eLife. 7, (2018).
- Rahimzadeh, M., Sadeghizadeh, M., Najafi, F., Arab, S., Mobasheri, H. Impact of heat shock step on bacterial transformation efficiency. Molecular Biology Research Communications. 5 (4), 257-261 (2016).
- Ashburner, M., Golic, K. G., Hawley, S. Drosophila: A laboratory handbook. Second Edition. 80 (2), The Quarterly Review of Biology. (2005).
- Nicolas, G., Sillans, D. Immediate and latent effects of carbon dioxide on insects. Annual Review of Entomology. 34 (1), 97-116 (1989).
- Arachea, B. T., et al. Detergent selection for enhanced extraction of membrane proteins. Protein Expression and Purification. 86 (1), 12-20 (2012).
- Hellmich, U. A., Gaudet, R. Structural biology of TRP channels. Handbook of Experimental Pharmacology. 223, 963-990 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır