Method Article
טיהור של תעלות פוטנציאליות של קולטן חולף דרוזופילה אנדוגנית
In This Article
Summary
בהתבסס על מנגנון ההרכבה של קומפלקס החלבון INAD, בפרוטוקול זה פותחה אסטרטגיית טיהור זיקה משופרת בתוספת אסטרטגיית תחרות כדי לטהר את ערוץ ה- TRP האנדוגני Drosophila .
Abstract
פוטו-טרנסדוקציה של דרוזופילה היא אחד ממסלולי האיתות המצומדים לחלבון G המהירים ביותר הידועים. כדי להבטיח את הספציפיות והיעילות של מפל זה, תעלת הקטיון החדירה של הסידן (Ca2+), פוטנציאל הקולטן הארעי (TRP), נקשרת בחוזקה לחלבון הפיגום, D (INAD) ללא הפסקה-ללא-אחרי-פוטנציאל, ויוצרת קומפלקס גדול של חלבון איתות עם חלבון קינאז C ספציפי לעין (ePKC) ופוטנציאל פוספוליפאז Cβ/No קולטן A (PLCβ/NORPA). עם זאת, התכונות הביוכימיות של ערוץ ה- TRP של דרוזופילה עדיין אינן ברורות. בהתבסס על מנגנון ההרכבה של קומפלקס חלבוני INAD, פותחה אסטרטגיית טיהור זיקה שונה בתוספת אסטרטגיית תחרות כדי לטהר את ערוץ ה- TRP האנדוגני. ראשית, שבר ההיסטידין המטוהר (שלו) מתויג NORPA 863-1095 נקשר לחרוזי Ni ושימש כפיתיון למשיכת קומפלקס חלבון INAD אנדוגני מראש דרוזופילה הומוגנטים. לאחר מכן, גלוטתיון S-transferase (GST) מטוהר יתר על המידה מתויג TRP 1261-1275 קטע נוסף ל- Ni-beads כדי להתחרות בערוץ TRP. לבסוף, תעלת ה-TRP בסופר-נטנט הופרדה מהפפטיד המוגזם TRP 1261-1275 על ידי כרומטוגרפיית אי-הכללת גודל. שיטה זו מאפשרת לחקור את מנגנון הגטינג של תעלת ה-TRP Drosophila מזוויות ביוכימיות ומבניות כאחד. את התכונות האלקטרופיזיולוגיות של תעלות TRP דרוזופילה מטוהרות ניתן למדוד גם בעתיד.
Introduction
פוטו-טרנסדוקציה היא תהליך שבו פוטונים נספגים מומרים לקודים חשמליים של נוירונים. הוא מעביר באופן בלעדי אופסינים ואת מפל האיתות המצומד לחלבון G הבא הן אצל בעלי חוליות והן אצל חסרי חוליות. ב-Drosophila, על-ידי שימוש בחמשת תחומי ה-PDZ שלה, פיגום חלבון ההשבתה-ללא-אחרי-פוטנציאל D (INAD) מארגן קומפלקס איתות סופראמולקולרי, המורכב מתעלת פוטנציאל קולטן חולף (TRP), פוספוליפאז Cβ/ללא פוטנציאל קולטן A (PLCβ/NORPA), וחלבון קינאז C ספציפי לעין (ePKC)1. היווצרותו של קומפלקס איתות סופראמולקולרי זה מבטיחה לוקליזציה תת-תאית נכונה, יעילות גבוהה וספציפיות של מכונות פוטו-טרנסדוקציה של דרוזופילה. בקומפלקס זה, ערוצי TRP רגישים לאור פועלים כאפקטים במורד הזרם של NORPA ומתווכים את זרם הסידן ואת הדה-פולריזציה של פוטורצפטורים. מחקרים קודמים הראו כי פתיחת ערוץ ה-TRP של דרוזופילה מתווכת על ידי פרוטונים, שיבוש של סביבת השומנים המקומית או כוח מכני 2,3,4. ערוץ ה- TRP של Drosophila מקיים אינטראקציה גם עם calmodulin5 ומווסת על ידי סידן על ידי משוב חיובי ושליליכאחד 6,7,8.
עד כה, מחקרים אלקטרופיזיולוגיים על מנגנון הגידור של תעלות Drosophila TRP ו-TRP דמויות TRP (TRPL) התבססו על טלאי ממברנה שנכרתה, הקלטות של תאים שלמים מפוטורצפטורים מסוג Drosophila מסוג פרא מנותקים, ותעלות הטרו-ביטוי בתאי S2, SF9 או HEK 2,9,10,11,12,13, אך לא בערוצים מטוהרים. גם המידע המבני של ערוץ ה-TRP Drosophila באורך מלא עדיין אינו ברור. על מנת לחקור את התכונות האלקטרופיזיולוגיות של חלבון מטוהר בסביבת ממברנה משוחזרת ולקבל מידע מבני של תעלת ה- Drosophila TRP באורך מלא, קבלת תעלות TRP מטוהרות באורך מלא היא הצעד הראשון הנחוץ, בדומה למתודולוגיות המשמשות במחקרי תעלות TRP של יונקים 14,15,16,17.
לאחרונה, בהתבסס על מנגנון ההרכבה של קומפלקס חלבוני INAD 18,19,20, פותחה לראשונה אסטרטגיית טיהור זיקה בתוספת תחרות כדי לטהר את תעלת ה-TRP מהומוגנטים של ראש דרוזופילה על ידי חרוזי סטרפטווידין 5. בהתחשב בקיבולת הנמוכה ובהעלות היקרה של חרוזי סטרפטווידין, מוצג כאן פרוטוקול טיהור משופר המשתמש בחלבון הפיתיון המתויג שלו ובחרוזי Ni תואמים בעלות נמוכה עם קיבולת גבוהה בהרבה. השיטה המוצעת תסייע לחקור את מנגנון ה-gating של תעלת ה-TRP מזוויות מבניות ולמדוד את התכונות האלקטרופיזיולוגיות של תעלת ה-TRP באמצעות חלבונים מטוהרים.
Protocol
1. טיהור מקטעי TRP המתויגים ב-GST ושברי NORPA המתויגים שלו
- לטהר את שבר TRP 1261-1275 המתויג ב-GST
- הפוך את pGEX 4T-1 TRP 1261-1275 פלסמיד10 לתאי Escherichia coli (E. coli) BL21 (DE3) באמצעות שיטת התמרת הלם חום CaCl2 21. לחסן מושבה בודדת ב 10 מ"ל של לוריא ברטאני בינוני (LB) ולגדול בן לילה ב 37 °C (84 °F). לאחר מכן, הגבר את 10 מ"ל של תרבות הזריעה ב-1 ליטר של LB בינוני ב-37 מעלות צלזיוס.
- לאחר שהצפיפות האופטית (OD600) של התאים מגיעה ל-0.5, יש לקרר את התאים ל-16°C ולהוסיף 0.1 mM איזופרופיל β-D-1-thiogalactopyranoside (IPTG; ריכוז סופי) כדי לגרום לביטוי יתר של חלבון המטרה ולדגום בטמפרטורה של 16 מעלות צלזיוס למשך 18 שעות.
- לאחר הבעת יתר, גלולה 1 ליטר של תאים בתרבית על ידי צנטריפוגה ב 3,993 × גרם במשך 20 דקות ו resuspend ב 40 מ"ל של 40 מ"ל של מאגר מלוחים (PBS) חצוף פוספט.
- טען את התאים המחודשים בהומוגנייזר בלחץ גבוה מקורר מראש בטמפרטורה של 4 מעלות צלזיוס. לאט לאט להגדיל את לחץ הומוגנייזר ל 800 בר. פתח את ברז הכניסה ותן לתאים המוחזרים לעבור באופן מעגלי דרך שסתום עם חריצים צרים מאוד.
הערה: התאים הומוגניים על ידי כוחות הגזירה הגבוהים הנגרמים על ידי ירידת לחץ גדולה וקוויטציה. - טענו 5 מ"ל של חרוזי גלוטתיון לעמוד זרימת כבידה ושטפו את החרוזים עם 50 מ"ל של חיץ PBS בסך הכל שלוש פעמים.
- צנטריפוגה התא ליזט מההומוגנייזר בלחץ גבוה ב 48,384 x g. הוסיפו את הסופרנאטנט של הליסאט התא הצנטריפוגי (40 מ"ל) לחרוזי הגלוטתיון המשוזנים בעמודת זרימת הכבידה ודגרו במשך 30 דקות בטמפרטורה של 4 מעלות צלזיוס. החייאת חרוזי הגלוטתיון כל 10 דקות.
- לאחר 30 דקות של דגירה, פתחו את ברז היציאה של העמודה כדי להפריד בין החרוזים לשבר הזרימה. יש להשליך את שבר הזרימה. שטפו פעמיים את חרוזי הגלוטתיון הנותרים עם 50 מ"ל של מאגר PBS.
- מוסיפים 15 מ"ל של חיץ אלוטיון לחרוזי הגלוטתיון ודגירה למשך 30 דקות. החייאת החרוזים כל 10 דקות.
- לאחר 30 דקות של דגירה, הורידו את שבר TRP 1261-1275 המתויג ב-GST בצינור חרוטי של 50 מ"ל וטענו בעמודת אי-הכללת גודל (ציון הכנה), אשר משוווית באמצעות חיץ 50 mM Tris (pH 7.5, 100 mM NaCl, 1 mM EDTA, 1 mM DTT).
- שמור על קצב זרימת האלוטציה של עמודת אי-הכללת הגודל ל- 3 מ"ל לדקה. אספו את החלבונים החמקמקים בקצב של 5 מ"ל/שפופרת.
- זהה את השיא של חלבון המטרה בעמודת אי-הכללת הגודל על-ידי ניתוח אותות ספיגת ה-UV ב-280 ננומטר ואמת על-ידי ניתוח ג'ל SDS-PAGE (פרמטרים של אלקטרופורזה: 150 וולט עבור ג'ל הערימה; 200 וולט לג'ל הפירוק). הכתימו את הג'ל בכחול Coomassie R250.
- מרכז את שבר TRP 1261-1275 המטוהר המתויג ב-GST מעמודת אי-הכללת הגודל ל-1 מ"ל באמצעות עמודת ספין אולטרה-סינון של 15 מ"ל עם צנטריפוגה של 3,000 x g ב-4 °C בצנטריפוגה בקירור שולחנית.
- קבעו את ריכוז החלבון המרוכז באמצעות חוק באר-למברט. מדוד את ספיגת ה- UV של שבר TRP 1261-1275 המתויג ב- GST ב- 280 ננומטר באמצעות ספקטרופוטומטר.
- קבל את מקדם ההכחדה ב-280 ננומטר על ידי ייבוא רצפי החלבונים לתוכנית Protparam (https://web.expasy.org/protparam/). בדרך כלל, תרבית 1 L של TRP 1261-1275 המתויג ב-GST מניבה 1 מ"ל של 600 מיקרומטר חלבון (6 x 10-7 מול). ראה טבלה 1 לחומרים הדרושים.
- טיהור קטע NORPA 863-1095 המתויג שלו
- הפוך את pETM.3C NORPA 863-1095 פלסמיד20 לתאי E. coli BL21 (DE3) באמצעות שיטת התמרת הלם חום CaCl21. לחסן מושבה בודדת ב 10 מ"ל של LB בינוני ולגדול בן לילה ב 37 °C (84 °F). לאחר מכן, הגבר את תרבות הזריעה של 10 מ"ל ב-1 ליטר של LB בינוני ב-37 מעלות צלזיוס.
- לאחר שה-OD600 של התאים מגיע ל-0.5, קררו את התאים ל-16 מעלות צלזיוס והוסיפו 0.1 mM IPTG (ריכוז סופי) כדי לגרום לביטוי יתר של חלבון המטרה ולדגירה ב-16 מעלות צלזיוס למשך 18 שעות.
- לאחר ביטוי יתר, גלולה 1 L של תאים בתרבית על ידי צנטריפוגה ב 3,993 x g במשך 20 דקות ו resuspend ב 40 מ"ל של חיץ קשירת. לאחר מכן, lyse את התאים resuspendeded בהומוגנייזר בלחץ גבוה ב 4 °C כפי שתואר בשלב 1.1.4.
- טען 5 מ"ל של חרוזי Ni לתוך עמוד זרימת כבידה ושטף שלוש פעמים עם 50 מ"ל של חיץ מחייב.
- צנטריפוגה התא ליזט מההומוגנייזר בלחץ גבוה ב 48,384 x g. הוסף את הסופרנאטנט של התא הצנטריפוגי lysate לחרוזי Ni שיווי המשקל בעמוד זרימת הכבידה ודגירה במשך 30 דקות בטמפרטורה של 4 מעלות צלזיוס. בצעו החייאה של חרוזי ה-Ni כל 10 דקות.
- לאחר 30 דקות של דגירה, פתחו את ברז היציאה של העמודה כדי להפריד בין החרוזים לשבר הזרימה. יש להשליך את השבר העובר בזרימה ולשטוף את חרוזי ה-Ni הנותרים פעמיים עם 50 מ"ל של חיץ שטיפה.
- הוסיפו 15 מ"ל של חיץ אלוטיון לחרוזי ה-Ni ודגרו במשך 30 דקות. בצעו החייאה של חרוזי ה-Ni כל 10 דקות.
- לאחר 30 דקות של דגירה, אספו את קטע ה-NORPA 863-1095 המתויג שלו בצינור חרוטי של 50 מ"ל וטענו לעמודת הרחקת גודל (דרגת הכנה), המשווקת באמצעות 50 mM Tris (pH 7.5, 100 mM NaCl, 1 mM EDTA, 1 mM DTT).
- שמור על קצב זרימת האלוטציה של עמודת אי-הכללת הגודל ל- 3 מ"ל לדקה. אספו את החלבון הבוקע בקצב של 5 מ"ל/צינור.
- זהה את השיא של חלבון המטרה בעמודת אי-הכללת הגודל על-ידי ניתוח אותות ספיגת ה-UV ב-280 ננומטר ואמת על-ידי ניתוח ג'ל SDS-PAGE (פרמטרים של אלקטרופורזה: 150 וולט עבור ג'ל הערימה; 200 וולט לג'ל הפירוק). הכתימו את הג'ל באמצעות כחול Coomassie R250.
- מרכז את שבר NORPA 863-1095 המטוהר שלו מתויג שלו מעמודת אי-הכללת הגודל ל-1 מ"ל באמצעות עמודת ספין אולטרה-סינון של 15 מ"ל עם צנטריפוגה של 3,000 x g ב-4 °C בצנטריפוגה בקירור שולחנית.
- קבעו את ריכוז החלבון המרוכז באמצעות חוק באר-למברט. מדוד את קליטת ה- UV של שבר NORPA 863-1095 המתויג שלו ב- 280 ננומטר באמצעות ספקטרופוטומטר.
- קבל את מקדם ההכחדה ב-280 ננומטר על ידי ייבוא רצפי החלבונים לתוכנית Protparam (https://web.expasy.org/protparam/). בדרך כלל, תרבית L אחת של שבר NORPA 863-1095 המתויג שלו מניבה 1 מ"ל של 600 מיקרומטר של חלבון (6 x 10-7 מול). ראה טבלה 2 לחומרים הדרושים.
2. הכנת ראשי דרוזופילה
- לאסוף זבובים בוגרים בצינורות צנטריפוגה חרוטית של 50 מ"ל באמצעות שיטת ההרדמה CO 22,23; מיד לקפוא חנקן נוזלי למשך 10 דקות ולאחסן במקפיא -80 מעלות צלזיוס.
- לאחר איסוף מספר מספיק של זבובים, לנער במרץ את הצינורות החרוטיים הקפואים של 50 מ"ל ביד כדי להפריד את הרגליים, הראש, הכנפיים והגוף של הזבובים. מעבירים את התערובת לשלוש מסננות נירוסטה מקוררות מראש בערימה רציפה (גודל רשת 20/30/40, בהתאמה) ומנערים את המסננות.
- לאחר מכן, מכיוון שהראשים אינם יכולים לעבור דרך מסננת 40 הרשתות, השתמש במברשת כדי לטאטא את ראשי הזבובים מהמסננת בת 40 הרשת, להעביר אותם לצינורות חרוטיים של 50 מ"ל ולאחסן אותם בטמפרטורה של −80 מעלות צלזיוס.
- אספו ברציפות את הזבובים ואת ראשיהם ואחסנו אותם במקפיא של -80 מעלות צלזיוס עד שיגיעו לכמות הנדרשת לניסויים (0.5 גרם). בדרך כלל, כדי לאסוף 0.5 גרם של ראשים, 35 מ"ל של זבובים בצינור חרוטי 50 מ"ל נדרשים. ראה טבלה 3 לחומרים הדרושים.
3. דרוזופילה TRP טיהור ערוצי TRP
- שוקלים בסך הכל 0.5 גרם של ראשים ומומוגניים לחלוטין בחנקן נוזלי באמצעות הדברת טיט מקוררת מראש. ממיסים את הראשים ההומוגניים ב-10x v/w lysis buffer (5 מ"ל), דגירה בשייקר בטמפרטורה של 4 מעלות צלזיוס למשך 20 דקות, ולאחר מכן צנטריפוגה ב-20,817 x g למשך 20 דקות בטמפרטורה של 4 מעלות צלזיוס.
- אספו את הסופרנט בעל הספין-מטה ("20817 גרם S", איור 4) והוסיפו לו צנטריפוגה ב-100,000 x גרם למשך 60 דקות ב-4 מעלות צלזיוס. השתמשו בסופר-נאטאנט בעל הספין-מטה ("100,000 גרם S", איור 4) לצורך הבדיקה הבאה.
- הוסיפו 1 מ"ל של חרוזי Ni לעמוד זרימת הכבידה ושטפו את החרוזים ב-10 מ"ל של H2O מזוקק כפול (ddH2O) ב-4 מעלות צלזיוס בסך הכל שלוש פעמים. שיווי משקל את החרוזים עם 10 נפחי עמודים של מאגר ליזיס שלוש פעמים בטמפרטורה של 4 מעלות צלזיוס.
- הוסף 500 μL של 600 μM מטוהר חלבון NORPA 863-1095 המתויג שלו (3 x 10-7 מול) לתוך עמוד ה- Ni ודגירה במשך 30 דקות ב 4 °C (4 °C). החייאת החרוזים כל 10 דקות.
- פתח את הקשת יציאת העמודה כדי להפריד בין החרוזים לשבר הזרימה. קח את השבר הזורם-דרך עבור ניתוח SDS-PAGE (NORPA F, איור 4). בחלק זה, חלבוני הפיתיון משותקים על חרוזי ה- Ni.
- שטפו את חרוזי ה-Ni ב-10 נפחי עמודים של מאגר ליזיס (10 מ"ל) בטמפרטורה של 4 מעלות צלזיוס ושמרו על חלק הכביסה לניתוח SDS-PAGE (שטיפה 1, איור 4A). חזור על השלבים שלעיל ושמור את הדגימה לניתוח SDS-PAGE (Wash 2, איור 4A). בחלק זה, חלבוני הפיתיון המופרזים על חרוזי ה- Ni מוסרים.
- הוסף את ה-supernatant של ראש Drosophila homogenate לאחר צנטריפוגה של 100,000 x g לתוך עמודת ה-Ni ב-4 °C, שם השתתק קטע ה-NORPA 863-1095 המתויג שלו.
- דגירה של הסופרנאטנט עם חרוזי ה- Ni בטמפרטורה של 4 מעלות צלזיוס למשך 30 דקות. החייאת החרוזים כל 10 דקות. לאחר מכן, פתח את ההקשה על שקע העמודה כדי להפריד בין החרוזים לשבר הזרימה.
- אסוף את ה-supernatant לניתוח SDS-PAGE (Dro head lysis F, איור 4A). בחלק זה, קומפלקסי החלבון INAD (INAD/TRP/ePKC) בהומוגנטים הראשיים נלכדים על ידי שברי NORPA 863-1095 המשותקים על חרוזי Ni.
- שטפו את חרוזי ה-Ni ב-10 נפחי עמודים של מאגר ליזיס (10 מ"ל) בטמפרטורה של 4 מעלות צלזיוס ושמרו על ה-supernatant מפני משקעי כוח הכבידה לצורך ניתוח SDS-PAGE (Wash 3, איור 4A). חזור על השלבים שלעיל ואסוף את חומר העל לניתוח SDS-PAGE (שטיפה 4, איור 4A). בחלק זה, החלבונים הלא מאוגדים על חרוזי Ni מוסרים.
- הוסף 500 μL של 600 μM של חלבון TRP 1261-1275 המתויג ב- GST (3 x 10-7 מול) לתוך חרוזי Ni ואינקובציה למשך 20 דקות ב- 4 °C (4 °C ). החייאת החרוזים כל 10 דקות.
- אספו את השבר הסמוי מעמודת הכבידה (TRP E1, איור 4B), המכילה את תעלת ה-TRP האנדוגנית Drosophila . חזור על השלבים שלעיל ואסוף את שבר האלוהות (TRP E2, איור 4B). בשלב זה, על ידי שימוש בשברי TRP 1261-1275 המתויגים ב-GST כמתחרה, ערוצי ה-TRP מתרחקים מקומפלקסי החלבון INAD שנלכדו (INAD/TRP/ePKC) על חרוזי ה-Ni.
- לשטוף את חרוזי Ni עם 10 נפחי עמודים של מאגר כריכה (10 מ"ל; טבלה 1) בטמפרטורה של 4 מעלות צלזיוס ואסוף את שבר הכביסה לניתוח SDS-PAGE (שטיפה 5, איור 4B).
- הוסף 500 μL של מאגר elution (טבלה 1) לתוך חרוזי Ni ודגירה במשך 20 דקות ב 4 °C (74 °F). אסוף את שבר ההתרוממות מעמודת זרימת הכבידה (NORPA E1, איור 4B). חזור על השלבים שלעיל, ואסוף את שבר ההתרוממות (NORPA E2, איור 4B).
- באמצעות חיץ האלוהות, התרחקו מקטע NORPA 863-1095 המתויג שלו, המלווה בקומפלקסים של חלבוני INAD/ePKC. לאחר מכן, החיזרו את חרוזי ה-Ni ב-500 μL של מאגר קשירה.
- קחו לדוגמה את חרוזי ה-Ni המחודשים כדי להריץ את ה-SDS-PAGE (המוכתמים על-ידי Coomassie Blue R250) כדי לנתח את היעילות של ה-elution ולהעריך אם המאגר הגנוז עובד (חרוזים, איור 4B). ראה טבלה 4 לחומרים הדרושים.
4. טיהור עמודת אי-הכללת גודל של ערוץ TRP Drosophila
- התקן עמודת אי-הכללת גודל (כיתה אנליטית) במערכת טיהור החלבונים. אזן את העמודה עם מאגר העמודות (50 mM Tris-HCl pH 7.5, 150 mM NaCl, 2 mM DTT, 0.75 mM DDM), המסונן על ידי מסנן 0.45 מיקרומטר.
- מרכז את שבר ה-TRP E1 וה-E2 משלב 3.14 באמצעות עמודת ספין אולטרה-סינון של 4 מ"ל, עם צנטריפוגה של 3,000 x גרם ב-4 מעלות צלזיוס בצנטריפוגה מקוררת.
- שטפו את לולאת הדגימה עם מאגר העמודות וטענו את הדגימה ללולאת הדגימה. הזריקו את הדגימה לעמודת אי-הכללת הגודל והוסיפו לחלבונים קצב זרימה תקין (0.5 מ"ל/דקה).
- זהה את שיא חלבון המטרה על ידי ספיגה של 280 ננומטר והפעל ג'ל SDS-PAGE כדי לזהות את תעלת ה-TRP האנדוגנית המטוהרת Drosophila TRP (איור 5). ראה טבלה 5 לחומרים הדרושים.
תוצאות
במאמר זה, שיטת טיהור חלבונים מוכחת כדי לטהר את ערוץ ה-TRP האנדוגני Drosophila (איור 1).
ראשית, ביטוי וטיהור חלבונים רקומביננטיים מיושמים כדי להשיג את הפיתיון ואת החלבונים המתחרים. לאחר מכן, מקטע TRP 1261-1275 המתויג ב-GST מבוטא בתאי E. coli BL21 (DE3) במדיום LB ומטוהר באמצעות חרוזי גלוטתיון ועמודת אי-הכללת גודל (איור 2). הדגימות אומתו באמצעות ניתוח SDS-PAGE עם צביעת R250 כחולה של Coomassie. בתהליך הכנת הדגימה של SDS-PAGE, 30 μL של דגימת חלבון מעורבב עם 10 μL של 4x צבע טעינה מבושל ב 100 °C (66 °F) למשך 10 דקות. לאחר מכן, 15 μL של דגימה מבושלת נטענת בנפרד לתוך כל באר. מקטע NORPA 863-1095 המתויג שלו מתבטא באופן דומה גם בתאי E. coli BL21 (DE3) במדיום LB ומטוהר על ידי חרוזי Ni ועמודת הרחקת גודל (איור 3). TRP 1261-1275 המתויג ב-GST מטוהר ו-NORPA 863-1095 המתויגים ב-GST מרוכזים לטיהור ערוץ ה-TRP האנדוגני Drosophila .
שנית, ראשי דרוזופילה נאספים ומוגזמים בחנקן נוזלי באמצעות מזיק טיט מקורר מראש, ולאחר מכן מומסים במאגר 10x v/w lysis (טבלה 4). הראש המומס הומוגנט מודגר בשייקר בטמפרטורה של 4 מעלות צלזיוס למשך 20 דקות וצנטריפוגה ב-20,817 x גרם למשך 20 דקות ב-4 מעלות צלזיוס. הסופרנט בעל הספין-מטה (20817 גרם S, איור 4A) נאסף ונעשה צנטריפוגה נוספת במהירות של 100,000 x גרם למשך 60 דקות ב-4 מעלות צלזיוס. ה-supernatant השני עם ספין-דאון (100,000 גרם S, איור 4A) משמש לבדיקה הבאה של משיכה כלפי מטה.
לבסוף, בהתבסס על העקרונות של משיכה למטה ובדיקת תחרות, טיהור הזיקה בתוספת אסטרטגיית התחרות משמשים לטיהור ערוץ ה- TRP האנדוגני. השבר המטוהר של NORPA 863-1095, המתויג שלו, קשור לחרוזי Ni ומשמש כפיתיון למשיכת קומפלקסים אנדוגניים של חלבוני INAD מהומוגנטים של ראש דרוזופילה . לאחר מכן, נוסף מקטע TRP 1261-1275 מתויג יתר על המידה ב-GST כדי להתחרות על ערוץ ה-TRP ממתחמי ה-INAD שנלכדו ב-Ni-beads (TRP E1, TRP E2, איור 4B). בסופו של דבר, תעלת ה-TRP המרופטת מופרדת מהפפטיד TRP 1261-1275 המתויג יתר על המידה ב-GST על-ידי כרומטוגרפיית אי-הכללת גודל (איור 5). בתהליך הכנת הדגימה של SDS-PAGE, 30 μL של דגימת חלבון מעורבב עם 10 μL של 4x צבע טעינה מבושל ב 100 °C (66 °F) למשך 10 דקות. לאחר מכן, 15 μL של דגימה נטען בנפרד לתוך כל באר. כתוצר לוואי, ניתן להשיג את קומפלקסי INAD-ePKC-NORPA 863-1095 גם על ידי הבלטת חרוזי ה-Ni לאחר תחרות הפפטידים TRP 1261-1275 (NORPA E1, NORAP E2, איור 4B). באמצעות שיטה זו, התשואה האופיינית של תעלת ה-TRP הסופית המטוהרת של Drosophila מ-0.5 גרם ראשי זבובים היא 50 μL של 3 μM TRP חלבון (1.5 x 10-10 מול). אם יש צורך בתעלות TRP מטוהרות יותר, הגדל את כמות ראשי הזבובים, חרוזי Ni, חלבון הפיתיון והמתחרה בהתאם.

איור 1: הדיאגרמה הסכמטית לטיהור תעלת ה-TRP האנדוגנית Drosophila TRP. (A) חלבוני NORPA 863-1095 מטוהרים המתויגים שלו משותקים על חרוזי ה-Ni. (B) ראשי דרוזופילה הם הומוגניים והסופרנט בעל הספין-מטה לאחר צנטריפוגה של 100,000 x g מתווסף לחרוזי ה-Ni הקשורים ל-NORPA, כאשר החלבון NORPA 863-1095 משמש כפיתיון ללכידת קומפלקסי החלבון INAD האנדוגניים (INAD/TRP/ePKC). (C) מקטע TRP 1261-1275 המתויג ב-GST מתווסף כדי להתחרות על תעלת ה-TRP האנדוגנית Drosophila מקומפלקסי החלבון INAD שנתפסו. (D) חלבון ה-TRP המבוקע מטוהר עוד יותר על-ידי עמודת אי-הכללת גודל כדי להפריד בין מקטע TRP 1261-1275 המתויג יתר על המידה ב-GST. החצים האדומים מדגישים את מיקומי האלוטיון של ערוץ TRP ומקטע TRP 1261-1275 המתויג ב-GST, בהתאמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: טיהור של חלבון TRP-CT 1261-1275 המתויג ב-GST על-ידי חרוזי גלוטתיון וכרומטוגרפיה של אי-הכללת גודל. השברים נאספים ב-5 מ"ל/צינור. השברים במיקום החץ (צינורות 44-48) נאספים ומרוכזים לטיהור הבא של תעלת ה- TRP האנדוגנית. (B) ג'ל SDS-PAGE מוכתם ב-SDS-PAGE בצבע כחול Coomassie המציג את קטע TRP 1261-1275 המתויג ב-GST בטיהור הזיקה של גלוטתיון-חרוזים ובהמשך טיהור עמודת אי-הכללת גודל. החץ מדגיש את מיקומו של קטע TRP 1261-1275 המתויג ב-GST בג'ל SDS-PAGE. קיצורים: P: גלולה מ- E. coli. BL21 (DE3) ליזט תא לאחר הומוגניזציה במאגר PBS וצנטריפוגה ב 48,384 x g; S: סופרנאטנט מ- E. coli. BL21 (DE3) ליזט תא לאחר הומוגניזציה וצנטריפוגה ב 48,384 x g; F: שבר זרימה-דרך לאחר שבר S הקודם דגירה עם חרוזי גלוטתיון במשך 30 דקות בטמפרטורה של 4 מעלות צלזיוס; W1 ו- W2: שבר הכביסה הראשון והשני על ידי 10 נפחי עמודים של מאגר PBS; B: חלבון לא מלוטש על חרוזי הגלוטתיון שעברו החייאה מנותח על ידי ג'ל SDS-PAGE כדי להעריך את יעילות האלוטציה; E: שבר אלוטיון מחרוזי גלוטתיון על ידי חיץ אלוטיון. מתכון המאגר לטיהור חלבונים המתויג ב-GST מתואר בטבלה 1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: טיהור של חלבון NORPA 863-1095 המתויג שלו על ידי חרוזי Ni וכרומטוגרפיה של הרחקת גודל. קצב זרימה = 3 מ"ל לדקה. השברים נאספים ב-5 מ"ל/צינור. השברים במיקום החץ (צינורות 44-49) נאספים ומרוכזים לטיהור הבא של תעלת ה- TRP האנדוגנית. (B) ג'ל SDS-PAGE מוכתם בכחול Coomassie R250 המציג את החלבון NORPA 863-1095 המתויג שלו בטיהור עמודי Ni וטיהור עמודת אי הכללת גודל לאחר מכן. החץ מדגיש את המיקום של חלבון NORPA 863-1095 המתויג שלו בג'ל SDS-PAGE. קיצורים: P: גלולה מ- E. coli. BL21 (DE3) ליזט תא לאחר הומוגניזציה במאגר קישור וצנטריפוגה ב 48,384 x g; S: שבר סופרנאטנטי מ- E. coli. BL21 (DE3) ליזט תא לאחר הומוגניזציה וצנטריפוגה ב 48,384 x g; F: שבר זרימה-דרך לאחר שבר S הקודם הוא דגירה עם חרוזי Ni למשך 30 דקות ב 4 °C (64 °F); W1 ו- W2: שבר הכביסה הראשון והשני על ידי 10 נפחי עמודים של מאגר כביסה; B: חלבון לא מתרומם על חרוזי ה-Ni-beadsuspended שעברו החייאה לאחר האלוטציה; E: שברים אלוטיים מחרוזי Ni על ידי מאגר האלוטיון. מתכון המאגר לטיהור החלבון המתויג שלו מופיע בטבלה 2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: טיהור ערוץ TRP דרוזופילה אנדוגני . הדגימות שנאספו מכל שלב מנותחות על ידי SDS-PAGE ומוכתמות בצבע כחול R-250 של Coomassie. (A) 20817 g S: חלק סופרנאטנטי של הומוגנטים בראש לאחר צנטריפוגה של 20,817 x g ; NORPA F: שבר זרימה דרך של חרוזי Ni לאחר קשירה של מקטע NORPA 863-1095 המתויג שלו; Wash1 ו- Wash2: שברירי הכביסה הראשונה והשנייה של חרוזי Ni על ידי מאגר lysis לאחר כריכת NORPA 863-1095 המתויגת שלו; 100,000 גרם S: הסופרנטנט הקודם של 20,817 גרם S הוא צנטריפוגה נוספת ב-100,000 x g והסופרנטנט נאסף עבור SDS-PAGE; Dro head lysis F: חלק זרימה דרך של חרוזי Ni לאחר הדגירה עם דגימת 100,000 גרם S; Wash3 ו- Wash4: שטיפת שברים של חרוזי Ni על ידי חיץ ליזיס לאחר הדגירה עם דגימת S של 100,000 גרם. (B) TRP E1 ו- E2: שבר ערוץ ה- TRP הראשון והשני על ידי קטע TRP 1261-1275 המתויג ב- GST; Wash5: שטיפת שברים של חרוזי Ni על ידי מאגר כריכה לאחר תחרות על ידי TRP 1261-1275 המתויג ב- GST; NORPA E1 ו-E2: השבר הראשון והשני של מקטעי NORPA 863-1095 המתויגים שלו עם קומפלקסים INAD/ePKC שנתפסו; חרוזים: חלבון לא מרופט השוהה בחרוזי Ni-beadsuspended שעברו החייאה לאחר טיפול במאגרי אלוטיון. מתכון החיץ לטיהור תעלות TRP דרוזופילה אנדוגניות מתואר בטבלה 4. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
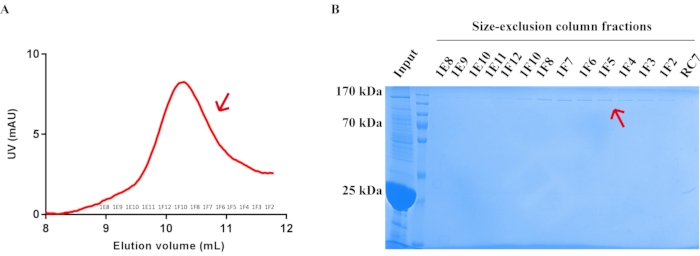
איור 5: טיהור של חלבון תעלת TRP דרוזופילה אנדוגני על ידי כרומטוגרפיית אי-הכללת גודל. (A) פרופיל טיהור של חלבון ערוץ TRP דרוזופילה אנדוגני בעמודת אי הכללת גודל. קצב זרימה = 0.5 מ"ל לדקה. השברים נאספו ב-0.5 מ"ל/צינור. השברים בעמדת החץ (1E8-1F2) נאספו והתרכזו. (B) ג'ל SDS-PAGE מוכתם R-250 בצבע כחול Coomassie המציג את חלבון תעלת ה-TRP האנדוגנית Drosophila TRP לאחר טיהור עמודת אי הכללת הגודל. המיקום של חלבון ערוץ TRP אנדוגני מטוהר Drosophila מודגש על ידי החץ האדום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
טבלה 1: החומרים הדרושים לטיהור קטע TRP 1261-1275 המתויג ב-GST. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: החומרים הדרושים לטיהור קטע NORPA 863-1095 המתויג שלו. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: החומרים הדרושים להכנת ראשי דרוזופילה.
טבלה 4: חומרים הדרושים לטיהור ערוץ TRP של Drosophila. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 5: החומרים הדרושים לטיהור עמודת אי הכללת הגודל של ערוץ ה- TRP של Drosophila. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
INAD, המכיל חמישה תחומי PDZ, הוא מארגן הליבה של מכונות פוטו-טרנסדוקציה של דרוזופילה. מחקרים קודמים הראו כי INAD PDZ3 נקשר לזנב מסוף C של ערוץ TRP עם ספציפיות מעודנת (KD = 0.3 μM)18. INAD PDZ45 טנדם מקיים אינטראקציה עם שבר NORPA 863-1095 עם זיקת קשירה גבוהה במיוחד (KD = 30 ננומטר). ממצאים אלה מספקים בסיס ביוכימי מוצק לתכנון טיהור הזיקה בתוספת אסטרטגיית התחרות, המאפשרת למקטע NORPA CC-PBM לשמש כפיתיון הנשלף, בעוד שזנב מסוף TRP C (שבר 1261-1275) מתפקד כריאגנט תחרותי. לכן, הנקודה הקריטית הראשונה לשיטה זו היא להבין את מנגנון ההרכבה של קומפלקס INAD ולקבל מספיק שברי NORPA ו- TRP. יחד עם זאת, מכיוון שתעלת ה- TRP היא חלבון הממברנה שיש לחלץ מהממברנה ולייצב אותה בתמיסה, השימוש בחומר ניקוי הוא הנקודה הקריטית השנייה בשיטה זו. כחומר ניקוי פופולרי למחקרים מבניים ותפקודיים של ערוצי TRP24,25, n-Dodecyl-B-D-Maltoside (DDM) משמש בשיטה זו. אם תוצאות הטיהור אינן משביעות רצון, יש לבדוק היטב את התכונות של חלבון הפיתיון, החלבון המתחרה וחומרי הניקוי. בנוסף, ניתן לעקוב אחר יעילות המיצוי של תעלות ה- TRP על ידי כתם מערבי באמצעות נוגדן TRP.
במחקר קודם5, חרוזי סטרפטווידין יקרים שימשו לטיהור תעלת ה-TRP מתמציות ראש זבוב, מה שמגביל את הטיהור השגרתי במעבדה. לכן, השיטה שופרה על ידי שימוש בשבר NORPA 863-1095 המתויג שלו יחד עם חרוזי Ni כדי להפחית עלויות ולהגדיל את התשואה. נכון לעכשיו, התפוקות של תעלת ה-TRP המטוהרת בשיטה המשופרת מספיקות כדי לבצע ניסוי צביעה שלילי של מיקרוסקופ אלקטרונים (TEM), שבו תעלות ה-TRP המטוהרות יוצרות טטרמרים (נתונים שלא מוצגים), מה שמצביע על כך שתהליך הטיהור אינו משבש את היווצרות הטטרמרים של תעלות TRP. לכן, פרוטוקול זה יתאים באופן פוטנציאלי לניסויים עתידיים של cryo-EM ואלקטרופיזיולוגיה.
עם זאת, מכיוון שלמתחרים המשמשים בניסויים (מקטע NORPA 863-1095, שבר TRP 1261-1275) יש זיקות קשות דומות לחלבונים מסוג בר, המגבלה של שיטה זו היא שיש להשתמש בחלבונים וחרוזים תחרותיים מסיביים כדי למשוך את חלבון המטרה. זה לא יהיה נוח למעבדות שלא יכולות לטהר את הפיתיון בקנה מידה גדול.
יישום עתידי פוטנציאלי של שיטה זו יהיה ללמוד את המידע המבני של ערוץ TRP Drosophila באמצעות טכניקות Cryo-EM. בנוסף, מדידת התכונות האלקטרופיזיולוגיות של תעלות TRP אנדוגניות מטוהרות בקרום השומנים הדו-שכבתיים המלאכותיים היא גם אפשרית. יתר על כן, במערכת מודלים משוחזרת זו, יהיה מעניין לאפיין את התכונות האלקטרופיזיולוגיות של תעלות TRP אנדוגניות מטוהרות על ידי ויסות ההרכב המורכב של INAD והרכב השומנים. לבסוף, בשילוב עם מידע מבני ותכונות אלקטרופיזיולוגיות, ניתן לבחון היטב את מנגנוני הגידור והוויסות של ערוץ ה- TRP בעתיד.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין (מס '31870746), מענקי מחקר בסיסיים של שנזן (JCYJ20200109140414636), והקרן למדעי הטבע של מחוז גואנגדונג, סין (מס '2021A1515010796) ל- W. L. אנו מודים ל-LetPub (www.letpub.com) על עזרתה הלשונית במהלך הכנת כתב יד זה.
Materials
| Name | Company | Catalog Number | Comments |
| Bacterial strains | |||
| BL21(DE3) Competent Cells | Novagen | 69450 | Protein overexpression |
| Experiment models | |||
| D.melanogaster: W1118 strain | Bloomington Drosophila Stock Center | BDSC:3605 | Drosophila head preparation |
| Material | |||
| 20/30/40 mesh stainless steel sieves | Jiufeng metal mesh company | GB/T6003.1 | Drosophila head preparation |
| 30% Acrylamide-N,N′-Methylenebisacrylamide(29:1) | Lablead | A3291 | SDS-PAGE gel preparation |
| Ammonium Persulfate | Invitrogen | HC2005 | SDS-PAGE gel preparation |
| Cocktail protease inhibitor | Roche | 05892953001 | Protease inhibitor |
| Coomassie brilliant blue R-250 | Sangon Biotech | A100472-0025 | SDS-PAGE gel staining |
| DL-Dithiothreitol (DTT) | Sangon Biotech | A620058-0100 | Size-exclusion column buffer preparation |
| Ethylenediaminetetraacetic acid disodium salt (EDTA) | Sangon Biotech | A500838-0500 | Size-exclusion column buffer preparation |
| Glycine | Sangon Biotech | A610235-0005 | SDS-PAGE buffer preparation |
| Glutathione Sepharose 4 Fast Flow beads | Cytiva | 17513202 | Affinity chromatography |
| Imidazole | Sangon Biotech | A500529-0001 | Elution buffer preparation for Ni-column |
| Isopropyl-beta-D-thiogalactopyranoside (IPTG) | Sangon Biotech | A600168-0025 | Induction of protein overexpression |
| LB Broth Powder | Sangon Biotech | A507002-0250 | E.coli. cell culture |
| L-Glutathione reduced (GSH) | Sigma-aldrich | G4251-100G | Elution buffer preparation for Glutathione beads |
| Ni-Sepharose excel beads | Cytiva | 17371202 | Affinity chromatography |
| N-Dodecyl beta-D-maltoside (DDM) | Sangon Biotech | A610424-001 | Detergent for protein purification |
| N,N,N',N'-Tetramethylethylenediamine (TEMED) | Sigma-aldrich | T9281-100ML | SDS-PAGE gel preparation |
| PBS | Sangon Biotech | E607008-0500 | Homogenization buffer for E.coli. cell |
| PMSF | Lablead | P0754-25G | Protease inhibitor |
| Prestained protein marker | Thermo Scientific | 26619/26616 | Prestained protein ladder |
| Size exclusion column (preparation grade) | Cytiva | 28989336 | HiLoad 26/60 Superdex 200 PG column |
| Size exclusion column (analytical grade) | Cytiva | 29091596 | Superose 6 Increase 10/300 GL column |
| Sodium chloride | Sangon Biotech | A501218-0001 | Protein purification buffer preparation |
| Sodium dodecyl sulfate (SDS) | Sangon Biotech | A500228-0001 | SDS-PAGE gel/buffer preparation |
| Tris base | Sigma-aldrich | T1503-10KG | Protein purification buffer preparation |
| Ultrafiltration spin column | Millipore | UFC901096/801096 | Protein concentration |
| Equipment | |||
| Analytical Balance | DENVER | APX-60 | Metage of Drosophila head |
| Desk-top high-speed refrigerated centrifuge for 15mL and 50mL conical centrifugation tubes | Eppendorf | 5810R | Protein concentration |
| Desk-top high-speed refrigerated centrifuge 1.5mL centrifugation tubes | Eppendorf | 5417R | Centrifugation of Drosophila head lysate after homogenization |
| Empty gravity flow column (Inner Diameter=1.0cm) | Bio-Rad | 738-0015 | TRP protein purification |
| Empty gravity flow column (Inner Diameter=2.5cm) | Bio-Rad | 738-0017 | Bait and competitor protein purification from E.coli. |
| Gel Documentation System | Bio-Rad | Universal Hood II Gel Doc XR System | SDS-PAGE imaging |
| High-speed refrigerated centrifuge | Beckman coulter | Avanti J-26 XP | Centrifugation of E.coli. cells/cell lysate |
| High pressure homogenizer | UNION-BIOTECH | UH-05 | Homogenization of E.coli. cells |
| Liquid nitrogen tank | Taylor-Wharton | CX-100 | Drosophila head preparation |
| Protein purification system | Cytiva | AKTA purifier | Protein purification |
| Refrigerator (-80°C) | Thermo | 900GP | Drosophila head preparation |
| Spectrophotometer | MAPADA | UV-1200 | OD600 measurement of E.coli. cells |
| Spectrophotometer | Thermo Scientific | NanoDrop 2000c | Determination of protein concentration |
| Ultracentrifuge | Beckman coulter | Optima XPN-100 Ultracentrifuge | Ultracentrifugation |
References
- Tsunoda, S., et al. A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature. 388 (6639), 243-249 (1997).
- Huang, J., et al. Activation of TRP channels by protons and phosphoinositide depletion in Drosophila photoreceptors. Current Biology: CB. 20 (3), 189-197 (2010).
- Chyb, S., Raghu, P., Hardie, R. C. Polyunsaturated fatty acids activate the Drosophila light-sensitive channels TRP and TRPL. Nature. 397 (6716), 255-259 (1999).
- Hardie, R. C., Franze, K. Photomechanical responses in Drosophila photoreceptors. Science. 338 (6104), 260-263 (2012).
- Chen, W., et al. Calmodulin binds to Drosophila TRP with an unexpected mode. Structure. 29 (4), 330-344 (2021).
- Hardie, R. C. Effects of intracellular Ca2+ chelation on the light response in Drosophila photoreceptors. Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology. 177 (6), 707-721 (1995).
- Scott, K., Sun, Y., Beckingham, K., Zuker, C. S. Calmodulin regulation of Drosophila light-activated channels and receptor function mediates termination of the light response in vivo. Cell. 91 (3), 375-383 (1997).
- Hardie, R. C., Minke, B. Phosphoinositide-mediated phototransduction in Drosophila photoreceptors: the role of Ca2+ and trp. Cell Calcium. 18 (4), 256-274 (1995).
- Delgado, R., et al. Light-induced opening of the TRP channel in isolated membrane patches excised from photosensitive microvilli from Drosophila photoreceptors. Neuroscience. 396, 66-72 (2019).
- Lev, S., Katz, B., Minke, B. The activity of the TRP-like channel depends on its expression system. Channels (Austin). 6 (2), 86-93 (2012).
- Hardie, R. C., Raghu, P. Activation of heterologously expressed Drosophila TRPL channels: Ca2+ is not required and InsP3 is not sufficient. Cell Calcium. 24 (3), 153-163 (1998).
- Gutorov, R., et al. Modulation of transient receptor potential C channel activity by cholesterol. Frontiers in Pharmacology. 10, 1487(2019).
- Yagodin, S., et al. Thapsigargin and receptor-mediated activation of Drosophila TRPL channels stably expressed in a Drosophila S2 cell line. Cell Calcium. 23 (4), 219-228 (1998).
- Guo, W., Chen, L. Recent progress in structural studies on canonical TRP ion channels. Cell Calcium. 83, 102075(2019).
- Li, X., Fine, M. TRP channel: The structural era. Cell Calcium. 87, 102191(2020).
- Liao, M., Cao, E., Julius, D., Cheng, Y. Structure of the TRPV1 ion channel determined by electron cryo-microscopy. Nature. 504 (7478), 107-112 (2013).
- Cao, E., Liao, M., Cheng, Y., Julius, D. TRPV1 structures in distinct conformations reveal activation mechanisms. Nature. 504 (7478), 113-118 (2013).
- Liu, W., et al. The INAD scaffold is a dynamic, redox-regulated modulator of signaling in the Drosophila eye. Cell. 145 (7), 1088-1101 (2011).
- Ye, F., Liu, W., Shang, Y., Zhang, M. An exquisitely specific PDZ/target recognition revealed by the structure of INAD PDZ3 in complex with TRP channel. Structure. 24 (3), 383-391 (2016).
- Ye, F., et al. An unexpected INAD PDZ tandem-mediated plcβ binding in Drosophila photo receptors. eLife. 7, (2018).
- Rahimzadeh, M., Sadeghizadeh, M., Najafi, F., Arab, S., Mobasheri, H. Impact of heat shock step on bacterial transformation efficiency. Molecular Biology Research Communications. 5 (4), 257-261 (2016).
- Ashburner, M., Golic, K. G., Hawley, S. Drosophila: A laboratory handbook. Second Edition. 80 (2), The Quarterly Review of Biology. (2005).
- Nicolas, G., Sillans, D. Immediate and latent effects of carbon dioxide on insects. Annual Review of Entomology. 34 (1), 97-116 (1989).
- Arachea, B. T., et al. Detergent selection for enhanced extraction of membrane proteins. Protein Expression and Purification. 86 (1), 12-20 (2012).
- Hellmich, U. A., Gaudet, R. Structural biology of TRP channels. Handbook of Experimental Pharmacology. 223, 963-990 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved