Method Article
Purificação dos canais potenciais do receptor transitório Endogenous Drosophila
Neste Artigo
Resumo
Com base no mecanismo de montagem do complexo proteico INAD, neste protocolo, foi desenvolvida uma purificação de afinidade modificada mais estratégia de concorrência para purificar o canal endogenso Drosophila TRP.
Resumo
A fototransdução de drosophila é uma das vias de sinalização mais rápidas conhecidas por proteína G. Para garantir a especificidade e eficiência dessa cascata, o canal de cáção de cálcio (Ca2+)permeável, o potencial de receptor transitório (TRP), liga-se firmemente à proteína do andaime, inativação-não-pós-potencial D (INAD), e forma um grande complexo proteico de sinalização com proteína específica dos olhos quinase C (ePKC) e phospholipase Cβ/No receptor potencial A (PLC/NORPA). No entanto, as propriedades bioquímicas do canal Drosophila TRP permanecem incertas. Com base no mecanismo de montagem do complexo proteico INAD, foi desenvolvida uma purificação de afinidade modificada mais estratégia de concorrência para purificar o canal endorfário. Primeiro, o fragmento de histidina purificada (His)-tagged NORPA 863-1095 foi vinculado a ni-contas e usado como isca para puxar para baixo o complexo proteico inad endógeno de Dphila cabeça homogeneiza. Em seguida, o fragmento TRP 1261-1275 com a marca excessiva purificada foi adicionado às contas ni para competir com o canal TRP. Finalmente, o canal TRP no supernante foi separado do peptídeo TRP 1261-1275 excessivo por cromatografia de exclusão de tamanho. Este método permite estudar o mecanismo de gating do canal Drosophila TRP a partir de ângulos bioquímicos e estruturais. As propriedades de eletrofisiologia dos canais TRP de Drosophila purificados também podem ser medidas no futuro.
Introdução
Fototransdução é um processo onde fótons absorvidos são convertidos em códigos elétricos de neurônios. Ele retransmite exclusivamente opsinas e a seguinte cascata de sinalização acoplada à proteína G em ambos os vertebrados e invertebrados. Em Drosophila, usando seus cinco domínios PDZ, a inativação de proteína de andaime-não-pós-potencial D (INAD) organiza um complexo de sinalização supramolecular, que consiste em um canal de receptores transitórios (TRP), phospholipase Cβ/No receptor potencial A (PLCβ/NORPA) e proteína específica dos olhos quinase C (ePKC)1. A formação deste complexo de sinalização supramolecular garante a localização subcelular correta, alta eficiência e especificidade das máquinas de fototransdução de Drosophila. Neste complexo, canais TRP sensíveis à luz atuam como efeitos a jusante da NORPA e mediam o fluxo de cálcio e a despolarização dos fotorreceptores. Estudos anteriores mostraram que a abertura do canal Drosophila TRP é mediada por prótons, interrupção do ambiente lipídedo local ou força mecânica 2,3,4. O canal Drosophila TRP também interage com a calmodulina5 e é modulado pelo cálcio pelo feedback positivo e negativo 6,7,8.
Até agora, estudos de eletrofisiologia sobre o mecanismo de gating dos canais Drosophila TRP e TRP-like (TRPL) foram baseados em patches de membrana excisada, gravações de células inteiras de fotorreceptores drosophila dissociados e canais hetero-expressos em células S2, SF9 ou HEK 2,9,10,11,12,13, mas não em canais purificados. As informações estruturais do canal TRP Drosophila de comprimento completo também permanecem incertas. Para estudar as propriedades eletrofisiológicas da proteína purificada em um ambiente de membrana reconstituída e obter informações estruturais do canal TRP Drosophila de comprimento completo, obter canais de TRP purificados é o primeiro passo necessário, semelhante às metodologias utilizadas nos estudos do canal TRP mamífera 14,15,16,17.
Recentemente, com base no mecanismo de montagem do complexo proteico INAD 18,19,20, uma estratégia de purificação de afinidade mais competição foi desenvolvida pela primeira vez para purificar o canal TRP a partir de homogeneizados da cabeça de Drosophila por contas streptavidin 5. Considerando a baixa capacidade e o custo caro das contas streptavidin, um protocolo de purificação melhorado é introduzido aqui que usa proteína isca sua marcada e contas ni-beads de baixo custo correspondentes com capacidade muito maior. O método proposto ajudará a estudar o mecanismo de gating do canal TRP a partir de ângulos estruturais e a medir as propriedades eletrofisiológicas do canal TRP com proteínas purificadas.
Protocolo
1. Purificação de fragmentos TRP com etiqueta GST e norpa com sua marca
- Purificar fragmento TRP 1261-1275 com marca GST
- Transforme as células pGEX 4T-1 TRP 1261-1275 plasmid10 em células Escherichia coli (E. coli) BL21 (DE3) usando o método de transformação de choque térmico CaCl2 21. Inocular uma única colônia em 10 mL de Luria Bertani (LB) média e crescer durante a noite a 37 °C. Em seguida, amplie os 10 mL de cultura de semeadura em 1 L de meio LB a 37 °C.
- Após a densidade óptica (OD600) das células atingir 0,5, resfriar as células a 16 °C e adicionar 0,1 mM isopropílico β-D-1-thiogalactopyranoside (IPTG; concentração final) para induzir a superexpressão da proteína alvo e incubar a 16 °C para 18 h.
- Após a superexpressão, pelota 1 L de células cultivadas por centrifugação a 3.993 × g por 20 min e resuspend em 40 mL de tampão salino tampão tampão de fosfato (PBS).
- Carregue as células resuspended em um homogeneizador de alta pressão pré-resfriado a 4 °C. Aumente lentamente a pressão do homogeneizador para 800 bar. Abra a torneira de entrada e deixe as células resuspendedas passarem circularmente por uma válvula com fendas muito estreitas.
NOTA: As células são homogeneizadas pelas forças de alto corte causadas por uma grande queda de pressão e cavitação. - Carregue 5 mL de contas de glutationa em uma coluna de fluxo gravitacional e lave as contas com 50 mL de tampão PBS para um total de três vezes.
- Centrifugar o lise celular do homogeneizador de alta pressão a 48.384 x g. Adicione o sobrenante do liseato celular centrifugado (40 mL) às contas de glutationa equilibradas na coluna de fluxo de gravidade e incubar por 30 min a 4 °C. Resuspend as contas de glutationa a cada 10 minutos.
- Após 30 minutos de incubação, abra a torneira da saída da coluna para separar as contas e a fração de fluxo. Descarte a fração de fluxo. Enxágüe as contas restantes de glutationa duas vezes com 50 mL de tampão PBS.
- Adicione 15 mL de tampão de eluição às contas de glutationa e incubar por 30 min. Resuspend as contas a cada 10 minutos.
- Após 30 minutos de incubação, elute o fragmento TRP 1261-1275 marcado pelo GST em um tubo cônico de 50 mL e carga em uma coluna de exclusão de tamanho (grau de preparação), que é equilibrado usando 50 mM Tris (pH 7,5, 100 mM NaCl, 1 mM EDTA, 1 mM DTT) tampão.
- Mantenha a taxa de fluxo de elução da coluna de exclusão de tamanho para 3 mL/min. Coletar as proteínas elucidas à taxa de 5 mL/tubo.
- Identifique o pico da proteína alvo na coluna de exclusão de tamanho analisando os sinais de absorção UV a 280 nm e verifique pela análise do gel SDS-PAGE (parâmetros de eletroforese: 150 V para o gel de empilhamento; 200 V para o gel de resolução). Manche o gel com R250 azul Coomassie.
- Concentre o fragmento de TRP 1261-1275 com etiqueta GST purificada da coluna de exclusão de tamanho para 1 mL usando uma coluna de rotação de ultrafiltração de 15 mL centrifuada a 3.000 x g a 4 °C em uma centrífuga refrigerada de mesa.
- Determine a concentração de proteína concentrada usando a Lei Beer-Lambert. Meça a absorção UV do fragmento TRP 1261-1275 marcado pelo GST a 280 nm usando um espectotômetro.
- Obtenha o coeficiente de extinção em 280 nm importando as sequências proteicas para o programa Protparam (https://web.expasy.org/protparam/). Tipicamente, 1 cultura L de TRP com marca GST 1261-1275 produz 1 mL de 600 μM de proteína (6 x 10-7 mol). Consulte a Tabela 1 para os materiais necessários.
- Purificação do fragmento NORPA 863-1095 com sua marca
- Transforme as células pETM.3C NORPA 863-1095 plasmid20 em células E. coli BL21 (DE3) usando o método de transformação de choque térmico CaCl2 21. Inocular uma única colônia em 10 mL de meio LB e crescer durante a noite a 37 °C. Em seguida, amplie a cultura de semeadura de 10 mL em 1 L de meio LB a 37 °C.
- Após o OD600 das células atingir 0,5, esfrie as células a 16 °C e adicione 0,1 mM IPTG (concentração final) para induzir a superexpressão da proteína alvo e incubar a 16 °C por 18 h.
- Após a superexpressão, pelota 1 L de células cultivadas por centrifugação a 3.993 x g por 20 min e resuspend em 40 mL de tampão de ligação. Em seguida,lise as células resuspended em um homogeneizador de alta pressão a 4 °C como descrito na etapa 1.1.4.
- Carregue 5 mL de ni-contas em uma coluna de fluxo de gravidade e lave três vezes com 50 mL de tampão de ligação.
- Centrifugar o lise celular do homogeneizador de alta pressão a 48.384 x g. Adicione o sobrenante da célula centrifugada lysate às contas ni equilibradas na coluna de fluxo de gravidade e incubar por 30 min a 4 °C. Resuspend as contas Ni a cada 10 minutos.
- Após 30 minutos de incubação, abra a torneira da saída da coluna para separar as contas e a fração de fluxo. Descarte a fração de fluxo e lave as contas ni restantes duas vezes com 50 mL de tampão de lavagem.
- Adicione 15 mL de tampão de eluição às contas ni e incubar por 30 minutos. Resuspend as contas Ni a cada 10 minutos.
- Após 30 minutos de incubação, colete o fragmento NORPA 863-1095 com etiqueta de Seu elucido em um tubo cônico de 50 mL e carregue em uma coluna de exclusão de tamanho (grau de preparação), que é equilibrada usando 50 mM Tris (pH 7,5, 100 mM NaCl, 1 mM EDTA, 1 mM DTT).
- Mantenha a taxa de fluxo de elução da coluna de exclusão de tamanho para 3 mL/min. Coletar a proteína elucida à taxa de 5 mL/tubo.
- Identifique o pico da proteína alvo na coluna de exclusão de tamanho analisando os sinais de absorção UV a 280 nm e verifique pela análise do gel SDS-PAGE (parâmetros de eletroforese: 150 V para o gel de empilhamento; 200 V para o gel de resolução). Manche o gel usando R250 azul Coomassie.
- Concentre o fragmento NORPA 863-1095 com sua marca purificada da coluna de exclusão de tamanho para 1 mL usando uma coluna de rotação de ultrafiltração de 15 mL centrifugada a 3.000 x g a 4 °C em uma centrífuga refrigerada de mesa.
- Determine a concentração de proteína concentrada usando a Lei Beer-Lambert. Meça a absorção UV do fragmento NORPA 863-1095 com marcação UV a 280 nm usando um espectrômetro.
- Obtenha o coeficiente de extinção em 280 nm importando as sequências proteicas para o programa Protparam (https://web.expasy.org/protparam/). Tipicamente, 1 L cultura de seu fragmento NORPA 863-1095 produz 1 mL de 600 μM de proteína (6 x 10-7 mol). Consulte a Tabela 2 para os materiais necessários.
2. Preparação de cabeças de Drosophila
- Coletar moscas adultas em tubos de centrifugação cônica de 50 mL utilizando o método de anestesia DE CO2 2 22,23; congele imediatamente o nitrogênio líquido por 10 minutos e armazene em um congelador de -80°C.
- Depois de coletar um número suficiente de moscas, agite vigorosamente os tubos cônicos congelados de 50 mL à mão para separar as pernas, cabeças, asas e corpos das moscas. Transfira a mistura para três peneiras de aço inoxidável pré-resfriadas (tamanho de malha 20/30/40, respectivamente) e agite as peneiras.
- Em seguida, uma vez que as cabeças não podem passar pela peneira de 40 malhas, use um pincel para varrer as cabeças de mosca da peneira de 40 malhas, transfira-as para tubos cônicos de 50 mL e armazene-as a −80 °C.
- Colete continuamente as moscas e suas cabeças e armazene-as em um congelador de -80 °C até atingir a quantidade necessária para experimentação (0,5 g). Normalmente, para coletar 0,5 g de cabeças, são necessários 35 mL de moscas em um tubo cônico de 50 mL. Consulte a Tabela 3 para obter os materiais necessários.
3. Purificação do canal Drosophila TRP
- Pesar um total de 0,5 g de cabeças e homogeneizar completamente em nitrogênio líquido usando um pilão de argamassa pré-resfriado. Dissolva as cabeças homogeneizadas em 10x v/w tampão de lise (5 mL), incubar em um agitador a 4 °C por 20 min e, em seguida, centrífuga a 20.817 x g por 20 min a 4 °C.
- Colete o supernante spin-down ("20817 g S", Figura 4) e centrifuse-o ainda mais a 100.000 x g por 60 min a 4 °C. Use o supernatante spin-down ("100.000 g S", Figura 4) para o seguinte ensaio de recuo.
- Adicione 1 mL de ni-contas na coluna de fluxo de gravidade e lave as contas com 10 mL de H2O destilado duplo (ddH2O) a 4 °C para um total de três vezes. Equilibre as contas com 10 volumes de coluna de tampão de lise três vezes a 4 °C.
- Adicione 500 μL de 600 μM purificado Sua proteína NORPA 863-1095 (3 x 10-7 mol) na coluna Ni e incubar por 30 min a 4 °C. Resuspend as contas a cada 10 minutos.
- Abra a torneira de saída da coluna para separar as contas e a fração de fluxo. Pegue a fração de fluxo para análise SDS-PAGE (NORPA F, Figura 4). Nesta seção, as proteínas iscas são imobilizadas nas contas ni.
- Lave as contas ni com 10 volumes de coluna de tampão de lise (10 mL) a 4 °C e mantenha a fração de lavagem para análise SDS-PAGE (Wash 1, Figura 4A). Repita as etapas acima e mantenha a amostra para análise SDS-PAGE (Wash 2, Figura 4A). Nesta seção, as proteínas de isca excessivas nas contas-de-ni são removidas.
- Adicione o supernatante da cabeça de Drosophila homogeneizado após centrifugação de 100.000 x g na coluna Ni a 4 °C, onde o fragmento NORPA 863-1095 marcado foi imobilizado.
- Incubar o supernante com as contas ni a 4 °C por 30 min. Resuspend as contas a cada 10 minutos. Em seguida, abra a torneira de saída da coluna para separar as contas e a fração de fluxo.
- Colete o supernatante para análise SDS-PAGE (Dro head lysis F, Figure 4A). Nesta seção, os complexos proteicos INAD (INAD/TRP/ePKC) na cabeça homogeneizados são capturados pelos fragmentos norpa 863-1095 imobilizados nas contas-de-ni.
- Lave as contas ni com 10 volumes de coluna de tampão de lise (10 mL) a 4 °C e mantenha o sobrenatante da precipitação gravitacional para análise SDS-PAGE (Wash 3, Figure 4A). Repita as etapas acima e colete o supernatante para análise SDS-PAGE (Wash 4, Figura 4A). Nesta seção, as proteínas não ligadas nas contas ni são removidas.
- Adicione 500 μL de 600 μM de proteína TRP 1261-1275 com etiqueta GST (3 x 10-7 mol) nas contas ni e incubar por 20 min a 4 °C. Resuspend as contas a cada 10 minutos.
- Colete a fração elucida da coluna de gravidade (TRP E1, Figura 4B), que contém o canal erógeno Drosophila TRP. Repita as etapas acima e colete a fração de eluição (TRP E2, Figura 4B). Nesta etapa, utilizando os fragmentos TRP 1261-1275 marcados pelo GST como concorrente, os canais TRP são elucidos dos complexos proteicos INAD capturados (INAD/TRP/ePKC) nas contas Ni.
- Lave as contas ni com 10 volumes de coluna de tampão de ligação (10 mL; Tabela 1) a 4 °C e coletar a fração de lavagem para análise SDS-PAGE (Wash 5, Figura 4B).
- Adicione 500 μL de tampão de eluição (Tabela 1) nas contas ni e incubar por 20 min a 4 °C. Recolher a fração de elução da coluna de fluxo gravitacional (NORPA E1, Figura 4B). Repita as etapas acima e colete a fração de eluição (NORPA E2, Figura 4B).
- Utilizando o tampão de elução, elute o fragmento NORPA 863-1095 marcado por Sua marca acompanhado dos complexos proteicos INAD/ePKC. Em seguida, resuspende as contas Ni em 500 μL de buffer de ligação.
- Leve as ni-contas resuspended para executar o SDS-PAGE (manchado por R250 azul Coomassie) para analisar a eficiência da elução e avaliar se o buffer elute funciona (contas, Figura 4B). Consulte a Tabela 4 para obter os materiais necessários.
4. Purificação da coluna de exclusão de tamanho do canal Drosophila TRP
- Instale uma coluna de exclusão de tamanho (grau analítico) no sistema de purificação de proteínas. Equilibre a coluna com o tampão da coluna (50 mM Tris-HCl pH 7.5, 150 mM NaCl, 2 mM DTT, 0,75 mM DDM), que é filtrado por um filtro de 0,45 μm.
- Concentre a fração TRP E1 e E2 a partir da etapa 3.14 usando uma coluna de rotação de ultrafiltração de 4 mL, centrifugada a 3.000 x g a 4 °C em uma centrífuga refrigerada.
- Enxágüe o laço amostral com o tampão da coluna e carregue a amostra no laço amostral. Injete a amostra na coluna de exclusão de tamanho e elute as proteínas com uma taxa de fluxo adequada (0,5 mL/min).
- Identifique o pico da proteína alvo por absorção a 280 nm e execute um gel SDS-PAGE para detectar o canal 1RP endógeno e endógeno purificado (Figura 5). Consulte a Tabela 5 para obter os materiais necessários.
Resultados
Neste artigo, demonstra-se um método de purificação de proteínas para purificar o canal Drosophila TRP endógeno (Figura 1).
Em primeiro lugar, a expressão e purificação da proteína recombinante são aplicadas para obter a isca e proteínas concorrentes. Em seguida, um fragmento TRP 1261-1275 marcado pelo GST é expresso em células E. coli BL21 (DE3) em média LB e purificado usando contas de glutationa e uma coluna de exclusão de tamanho (Figura 2). As amostras foram verificadas utilizando-se análise SDS-PAGE com coloração R250 azul Coomassie. No processo de preparação da amostra SDS-PAGE, 30 μL de amostra de proteína é misturado com 10 μL de corante de carregamento 4x e fervido a 100 °C por 10 min. Em seguida, 15 μL de amostra cozida é carregado individualmente em cada poço. O fragmento NORPA 863-1095 com sua marca também é expresso da mesma forma em células E. coli BL21 (DE3) em média LB e purificado por ni-contas e coluna de exclusão de tamanho (Figura 3). O TRP 1261-1275 com marca GST purificada e o seu NORPA 863-1095 estão concentrados para a purificação do canal endógeno Drosophila TRP.
Em segundo lugar, as cabeças de Drosophila são coletadas e homogeneizadas em nitrogênio líquido usando um pilão de argamassa pré-resfriado e, em seguida, dissolvidas em tampão de 10x v/w lysis (Tabela 4). A homogeneidade da cabeça dissolvida é incubada em um shaker a 4 °C por 20 min e centrifulada a 20.817 x g por 20 min a 4 °C. O supernanato spin-down (20817 g S, Figura 4A) é coletado e ainda centrifusado a 100.000 x g por 60 min a 4 °C. O segundo supernante spin-down (100.000 g S, Figura 4A) é usado para o ensaio de puxar para baixo subsequente.
Finalmente, com base nos princípios do ensaio de pull-down e concorrência, a estratégia de purificação de afinidade mais concorrência é usada para purificar o canal TRP endógeno. O fragmento norpa 863-1095 purificado é vinculado a ni-contas e usado como isca para puxar para baixo os complexos proteicos INAD endógenos de homogeneizados da cabeça de Drosophila . Em seguida, o fragmento TRP 1261-1275 com etiqueta GST excessivamente purificado é adicionado para competir pelo canal TRP dos complexos INAD capturados nas contas Ni (TRP E1, TRP E2, Figura 4B). No final, o canal TRP elucido é separado do peptídeo TRP 1261-1275 com exclusão excessiva do GST por cromatografia de exclusão de tamanho (Figura 5). No processo de preparação da amostra SDS-PAGE, 30 μL de amostra de proteína é misturado com 10 μL de corante de carregamento 4x e fervido a 100 °C por 10 min. Em seguida, os 15 μL da amostra são carregados individualmente em cada poço. Como subproduto, os complexos inad-ePKC-NORPA 863-1095 também podem ser obtidos pela eluição das Ni-contas após a competição de peptídeos TRP 1261-1275 (NORPA E1, NORAP E2, Figura 4B). Usando este método, o rendimento típico do canal TRP Drosophila purificado final a partir de 0,5 g fly heads é de 50 μL de 3 μM de proteína TRP (1,5 x 10-10 mol). Se forem necessários canais TRP mais purificados, aumente a quantidade de cabeças de mosca, ni-contas, proteína de isca e concorrente correspondentemente.

Figura 1: O diagrama esquemático para purificação do canal Endogenso Drosophila TRP. (A) Proteínas NORPA 863-1095 purificadas são imobilizadas nas contas-de-ni. (B) As cabeças de drosophila são homogeneizadas e a supernasceção spin-down após 100.000 x g centrifugação é adicionada às ni-contas ligadas à NORPA, onde a proteína NORPA 863-1095 age como isca para capturar os complexos proteicos inadógenos endógenos (INAD/TRP/ePKC). (C) O fragmento TRP 1261-1275 marcado pelo GST é adicionado para competir pelo canal 1rp endógeno Drosophila dos complexos proteicos INAD capturados. (D) A proteína TRP elucida é purificada por uma coluna de exclusão de tamanho para separar o fragmento TRP 1261-1275 com etiqueta GST. As setas vermelhas destacam as posições de elução do canal TRP e do fragmento TRP 1261-1275 marcado pelo GST, respectivamente. Clique aqui para ver uma versão maior desta figura.

Figura 2: Purificação da proteína TRP-CT 1261-1275 marcada pelo GST por contas de glutationa e cromatografia de exclusão de tamanho. (A) Perfil de purificação da proteína TRP-CT 1261-1275 com etiqueta GST em uma coluna de exclusão de tamanho (grau de preparação). As frações são coletadas a 5 mL/tubo. As frações na posição de seta (tubos 44-48) são coletadas e concentradas para a seguinte purificação do canal endorfário endógeno. (B) O gel SDS-PAGE azul coomassie manchando mostrando o fragmento TRP 1261-1275 com etiquetas GST na purificação de afinidade glutathione-contas e posterior purificação da coluna de exclusão de tamanho. A seta destaca a posição do fragmento TRP 1261-1275 marcado pelo GST no gel SDS-PAGE. Abreviaturas: P: pelota de E. coli. Bl21 (DE3) liseto celular após homogeneização em tampão PBS e centrifugação a 48.384 x g; S: supernaspe de E. coli. Bl21 (DE3) celular lysate após homogeneização e centrifugação a 48.384 x g; F: fração de fluxo após fração S anterior incubada com contas de glutationa por 30 min a 4 °C; W1 e W2: a primeira e segunda fração de lavagem por 10 volumes de coluna de buffer PBS; B: Proteína não elucida nas contas de glutathione resuspended é analisada pelo gel SDS-PAGE para avaliar a eficiência de eluição; E: fração de eluição de contas de glutationa por tampão de eluição. A receita tampão para a purificação de proteínas marcada pelo GST está descrita na Tabela 1. Clique aqui para ver uma versão maior desta figura.

Figura 3: Purificação da proteína NORPA 863-1095 marcada por Ni-contas e cromatografia de exclusão de tamanho. (A) Perfil de purificação da proteína NORPA 863-1095 marcada em uma coluna de exclusão de tamanho. Taxa de fluxo = 3 mL/min. As frações são coletadas a 5 mL/tubo. As frações na posição de seta (tubos 44-49) são coletadas e concentradas para a seguinte purificação do canal TRP endógeno. (B) O gel R250 manchado de pórivo R250 manchado mostrando a proteína NORPA 863-1095 marcada por Sua marca na purificação da coluna Ni e posterior purificação da coluna de exclusão de tamanho. A seta destaca a posição da proteína NORPA 863-1095 marcada no gel SDS-PAGE. Abreviaturas: P: pelota de E. coli. Bl21 (DE3) liseto celular após homogeneização em tampão de ligação e centrifugação a 48.384 x g; S: fração supernante de E. coli. Bl21 (DE3) celular lysate após homogeneização e centrifugação a 48.384 x g; F: fração de fluxo após a fração S anterior ser incubada com ni-contas por 30 min a 4 °C; W1 e W2: a primeira e segunda fração de lavagem por 10 volumes de coluna de tampão de lavagem; B: Proteína não elucida nas contas nisuspended resusgaspadas após a eluição; E: frações de eluição de ni-contas pelo buffer de eluição. A receita tampão para a purificação de proteínas sua marcada está listada na Tabela 2. Clique aqui para ver uma versão maior desta figura.

Figura 4: Purificação do canal Endogenso Drosophila TRP. As amostras coletadas de cada etapa são analisadas pela SDS-PAGE e manchadas com corante R-250 azul Coomassie. (A) 20817 g S: fração sobrenascedora de homogeneiza a cabeça após centrifugação de 20.817 x g ; NORPA F: fração de fluxo de ni-contas após a vinculação do fragmento NORPA 863-1095 com sua marca; Wash1 e Wash2: a primeira e segunda frações de lavagem de ni-contas por tampão de lise após a vinculação NORPA 863-1095 marcadas por Sua; 100.000 g S: o supernanato S anterior de 20.817 g é ainda mais centrifuga a 100.000 x g e o supernante é coletado para SDS-PAGE; Dro head lysis F: flow-through fração de Ni-beads após a incubação com a amostra de 100.000 g S; Wash3 e Wash4: lavando frações de ni-contas por tampão de lise após incubação com amostra de 100.000 g S. (B) TRP E1 e E2: as frações do primeiro e segundo canais TRP elucidos pelo fragmento TRP 1261-1275 marcado pelo GST; Wash5: lavar frações de ni-contas por buffer de vinculação após a concorrência pelo TRP 1261-1275 marcado pelo GST; NORPA E1 e E2: a primeira e segunda fração de eluição dos fragmentos NORPA 863-1095 capturados com complexos INAD/ePKC capturados; contas: proteína não eluvada permanecendo nas contas ni-suspended resusgaspadas após o tratamento tampão de eluição. A receita tampão para purificação do canal Drosophila TRP endógeno está descrita na Tabela 4. Clique aqui para ver uma versão maior desta figura.
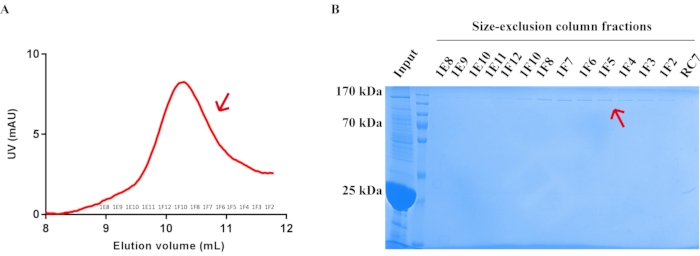
Figura 5: Purificação da proteína do canal Drosophila TRP endógeno por cromatografia de exclusão de tamanho. (A) Perfil de purificação da proteína do canal Drosophila TRP endógeno na coluna de exclusão de tamanho. Taxa de fluxo = 0,5 mL/min. As frações foram coletadas a 0,5 mL/tubo. As frações na posição de seta (1E8-1F2) foram coletadas e concentradas. (B) Coomassie azul R-250 manchado SDS-PAGE gel mostrando a proteína do canal Drosophila TRP endógeno após a purificação da coluna de exclusão de tamanho. A posição da proteína purificada do canal Drosophila TRP é destacada pela seta vermelha. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Materiais necessários para a purificação do fragmento TRP 1261-1275 marcado pelo GST. Clique aqui para baixar esta Tabela.
Tabela 2: Materiais necessários para a purificação do fragmento NORPA 863-1095 marcado. Clique aqui para baixar esta Tabela.
Tabela 3: Materiais necessários para a preparação de cabeças de Drosophila . Clique aqui para baixar esta Tabela.
Tabela 4: Materiais necessários para a purificação do canal Drosophila TRP. Clique aqui para baixar esta Tabela.
Tabela 5: Materiais necessários para a purificação da coluna de exclusão de tamanho do canal Drosophila TRP. Clique aqui para baixar esta Tabela.
Discussão
INAD, que contém cinco domínios PDZ, é o principal organizador das máquinas de fototransdução Drosophila. Estudos anteriores mostraram que o INAD PDZ3 se liga à cauda terminal C do canal TRP com especificidade requintada (KD = 0,3 μM)18. Inad PDZ45 tandem interage com o fragmento NORPA 863-1095 com uma afinidade de ligação extremamente alta (KD = 30 nM). Esses achados fornecem uma base bioquímica sólida para projetar a purificação de afinidade mais a estratégia de concorrência, o que permite que o fragmento NORPA CC-PBM seja usado como isca de recuo, enquanto a cauda do terminal C TRP (fragmento 1261-1275) funciona como um reagente competitivo. Portanto, o primeiro ponto crítico para este método é entender o mecanismo de montagem do complexo INAD e obter fragmentos NORPA e TRP suficientes. Ao mesmo tempo, uma vez que o canal TRP é a proteína da membrana que precisa ser extraída da membrana e estabilizada na solução, o uso de detergente é o segundo ponto crítico deste método. Como um detergente popular para estudos estruturais e funcionais dos canais TRP24,25, n-Dodecyl-B-D-Maltoside (DDM) é usado neste método. Se os resultados da purificação não forem satisfatórios, as qualidades da proteína da isca, da proteína concorrente e do detergente precisam ser verificadas cuidadosamente. Além disso, a eficiência de extração dos canais TRP pode ser rastreada por mancha ocidental usando o anticorpo TRP.
Em um estudo anterior,5, contas de streptavidina caras foram usadas para purificar o canal TRP de extratos de cabeça de mosca, o que limita a purificação de rotina no laboratório. Portanto, o método foi melhorado usando um fragmento NORPA 863-1095 marcado com sua marca, juntamente com ni-contas para reduzir custos e aumentar o rendimento. Atualmente, os rendimentos do canal TRP purificado no método melhorado são suficientes para realizar um experimento de coloração negativa do microscópio eletrônico de transmissão (TEM), no qual os canais TRP purificados formam tetramers (dados não mostrados), indicando que o processo de purificação não interrompe a formação de tetramer dos canais TRP. Portanto, este protocolo será potencialmente adequado para futuros experimentos crio-EM e eletrofisiologia.
No entanto, uma vez que os concorrentes utilizados nos experimentos (fragmento NORPA 863-1095, fragmento TRP 1261-1275) têm afinidades de ligação semelhantes com proteínas do tipo selvagem, a limitação deste método é que proteínas e contas competitivas maciças devem ser usadas para puxar para baixo a proteína alvo. Não será conveniente para laboratórios que não podem purificar a isca em grande escala.
Uma possível aplicação futura deste método será estudar as informações estruturais do canal Drosophila TRP usando técnicas Cryo-EM. Além disso, a medição das propriedades eletrofisiológicas dos canais de TRP endógenos purificados na membrana lipídica bicamada artificial também é viável. Além disso, neste sistema de modelo reconstituído, será interessante caracterizar as propriedades eletrofisiológicas dos canais de TRP endógenos purificados, modulando a composição complexa do INAD e a composição lipídica. Finalmente, combinados com informações estruturais e propriedades eletrofisiológicas, os mecanismos de gating e regulação do canal TRP podem ser cuidadosamente examinados no futuro.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de Ciência Natural da China (No. 31870746), Shenzhen Basic Research Grants (JCYJ2020200109140414636) e Fundação de Ciência Natural da Província de Guangdong, China (nº 2021A1515010796) a W. L. Agradecemos a LetPub (www.letpub.com) por sua assistência linguística durante a elaboração deste manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Bacterial strains | |||
| BL21(DE3) Competent Cells | Novagen | 69450 | Protein overexpression |
| Experiment models | |||
| D.melanogaster: W1118 strain | Bloomington Drosophila Stock Center | BDSC:3605 | Drosophila head preparation |
| Material | |||
| 20/30/40 mesh stainless steel sieves | Jiufeng metal mesh company | GB/T6003.1 | Drosophila head preparation |
| 30% Acrylamide-N,N′-Methylenebisacrylamide(29:1) | Lablead | A3291 | SDS-PAGE gel preparation |
| Ammonium Persulfate | Invitrogen | HC2005 | SDS-PAGE gel preparation |
| Cocktail protease inhibitor | Roche | 05892953001 | Protease inhibitor |
| Coomassie brilliant blue R-250 | Sangon Biotech | A100472-0025 | SDS-PAGE gel staining |
| DL-Dithiothreitol (DTT) | Sangon Biotech | A620058-0100 | Size-exclusion column buffer preparation |
| Ethylenediaminetetraacetic acid disodium salt (EDTA) | Sangon Biotech | A500838-0500 | Size-exclusion column buffer preparation |
| Glycine | Sangon Biotech | A610235-0005 | SDS-PAGE buffer preparation |
| Glutathione Sepharose 4 Fast Flow beads | Cytiva | 17513202 | Affinity chromatography |
| Imidazole | Sangon Biotech | A500529-0001 | Elution buffer preparation for Ni-column |
| Isopropyl-beta-D-thiogalactopyranoside (IPTG) | Sangon Biotech | A600168-0025 | Induction of protein overexpression |
| LB Broth Powder | Sangon Biotech | A507002-0250 | E.coli. cell culture |
| L-Glutathione reduced (GSH) | Sigma-aldrich | G4251-100G | Elution buffer preparation for Glutathione beads |
| Ni-Sepharose excel beads | Cytiva | 17371202 | Affinity chromatography |
| N-Dodecyl beta-D-maltoside (DDM) | Sangon Biotech | A610424-001 | Detergent for protein purification |
| N,N,N',N'-Tetramethylethylenediamine (TEMED) | Sigma-aldrich | T9281-100ML | SDS-PAGE gel preparation |
| PBS | Sangon Biotech | E607008-0500 | Homogenization buffer for E.coli. cell |
| PMSF | Lablead | P0754-25G | Protease inhibitor |
| Prestained protein marker | Thermo Scientific | 26619/26616 | Prestained protein ladder |
| Size exclusion column (preparation grade) | Cytiva | 28989336 | HiLoad 26/60 Superdex 200 PG column |
| Size exclusion column (analytical grade) | Cytiva | 29091596 | Superose 6 Increase 10/300 GL column |
| Sodium chloride | Sangon Biotech | A501218-0001 | Protein purification buffer preparation |
| Sodium dodecyl sulfate (SDS) | Sangon Biotech | A500228-0001 | SDS-PAGE gel/buffer preparation |
| Tris base | Sigma-aldrich | T1503-10KG | Protein purification buffer preparation |
| Ultrafiltration spin column | Millipore | UFC901096/801096 | Protein concentration |
| Equipment | |||
| Analytical Balance | DENVER | APX-60 | Metage of Drosophila head |
| Desk-top high-speed refrigerated centrifuge for 15mL and 50mL conical centrifugation tubes | Eppendorf | 5810R | Protein concentration |
| Desk-top high-speed refrigerated centrifuge 1.5mL centrifugation tubes | Eppendorf | 5417R | Centrifugation of Drosophila head lysate after homogenization |
| Empty gravity flow column (Inner Diameter=1.0cm) | Bio-Rad | 738-0015 | TRP protein purification |
| Empty gravity flow column (Inner Diameter=2.5cm) | Bio-Rad | 738-0017 | Bait and competitor protein purification from E.coli. |
| Gel Documentation System | Bio-Rad | Universal Hood II Gel Doc XR System | SDS-PAGE imaging |
| High-speed refrigerated centrifuge | Beckman coulter | Avanti J-26 XP | Centrifugation of E.coli. cells/cell lysate |
| High pressure homogenizer | UNION-BIOTECH | UH-05 | Homogenization of E.coli. cells |
| Liquid nitrogen tank | Taylor-Wharton | CX-100 | Drosophila head preparation |
| Protein purification system | Cytiva | AKTA purifier | Protein purification |
| Refrigerator (-80°C) | Thermo | 900GP | Drosophila head preparation |
| Spectrophotometer | MAPADA | UV-1200 | OD600 measurement of E.coli. cells |
| Spectrophotometer | Thermo Scientific | NanoDrop 2000c | Determination of protein concentration |
| Ultracentrifuge | Beckman coulter | Optima XPN-100 Ultracentrifuge | Ultracentrifugation |
Referências
- Tsunoda, S., et al. A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature. 388 (6639), 243-249 (1997).
- Huang, J., et al. Activation of TRP channels by protons and phosphoinositide depletion in Drosophila photoreceptors. Current Biology: CB. 20 (3), 189-197 (2010).
- Chyb, S., Raghu, P., Hardie, R. C. Polyunsaturated fatty acids activate the Drosophila light-sensitive channels TRP and TRPL. Nature. 397 (6716), 255-259 (1999).
- Hardie, R. C., Franze, K. Photomechanical responses in Drosophila photoreceptors. Science. 338 (6104), 260-263 (2012).
- Chen, W., et al. Calmodulin binds to Drosophila TRP with an unexpected mode. Structure. 29 (4), 330-344 (2021).
- Hardie, R. C. Effects of intracellular Ca2+ chelation on the light response in Drosophila photoreceptors. Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology. 177 (6), 707-721 (1995).
- Scott, K., Sun, Y., Beckingham, K., Zuker, C. S. Calmodulin regulation of Drosophila light-activated channels and receptor function mediates termination of the light response in vivo. Cell. 91 (3), 375-383 (1997).
- Hardie, R. C., Minke, B. Phosphoinositide-mediated phototransduction in Drosophila photoreceptors: the role of Ca2+ and trp. Cell Calcium. 18 (4), 256-274 (1995).
- Delgado, R., et al. Light-induced opening of the TRP channel in isolated membrane patches excised from photosensitive microvilli from Drosophila photoreceptors. Neuroscience. 396, 66-72 (2019).
- Lev, S., Katz, B., Minke, B. The activity of the TRP-like channel depends on its expression system. Channels (Austin). 6 (2), 86-93 (2012).
- Hardie, R. C., Raghu, P. Activation of heterologously expressed Drosophila TRPL channels: Ca2+ is not required and InsP3 is not sufficient. Cell Calcium. 24 (3), 153-163 (1998).
- Gutorov, R., et al. Modulation of transient receptor potential C channel activity by cholesterol. Frontiers in Pharmacology. 10, 1487(2019).
- Yagodin, S., et al. Thapsigargin and receptor-mediated activation of Drosophila TRPL channels stably expressed in a Drosophila S2 cell line. Cell Calcium. 23 (4), 219-228 (1998).
- Guo, W., Chen, L. Recent progress in structural studies on canonical TRP ion channels. Cell Calcium. 83, 102075(2019).
- Li, X., Fine, M. TRP channel: The structural era. Cell Calcium. 87, 102191(2020).
- Liao, M., Cao, E., Julius, D., Cheng, Y. Structure of the TRPV1 ion channel determined by electron cryo-microscopy. Nature. 504 (7478), 107-112 (2013).
- Cao, E., Liao, M., Cheng, Y., Julius, D. TRPV1 structures in distinct conformations reveal activation mechanisms. Nature. 504 (7478), 113-118 (2013).
- Liu, W., et al. The INAD scaffold is a dynamic, redox-regulated modulator of signaling in the Drosophila eye. Cell. 145 (7), 1088-1101 (2011).
- Ye, F., Liu, W., Shang, Y., Zhang, M. An exquisitely specific PDZ/target recognition revealed by the structure of INAD PDZ3 in complex with TRP channel. Structure. 24 (3), 383-391 (2016).
- Ye, F., et al. An unexpected INAD PDZ tandem-mediated plcβ binding in Drosophila photo receptors. eLife. 7, (2018).
- Rahimzadeh, M., Sadeghizadeh, M., Najafi, F., Arab, S., Mobasheri, H. Impact of heat shock step on bacterial transformation efficiency. Molecular Biology Research Communications. 5 (4), 257-261 (2016).
- Ashburner, M., Golic, K. G., Hawley, S. Drosophila: A laboratory handbook. Second Edition. 80 (2), The Quarterly Review of Biology. (2005).
- Nicolas, G., Sillans, D. Immediate and latent effects of carbon dioxide on insects. Annual Review of Entomology. 34 (1), 97-116 (1989).
- Arachea, B. T., et al. Detergent selection for enhanced extraction of membrane proteins. Protein Expression and Purification. 86 (1), 12-20 (2012).
- Hellmich, U. A., Gaudet, R. Structural biology of TRP channels. Handbook of Experimental Pharmacology. 223, 963-990 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados