Method Article
内因性 ショウジョウバエ 一過性受容器電位チャネルの精製
要約
INADタンパク質複合体の組み立て機構に基づいて、このプロトコールでは、内因性 ショウジョウバエ TRPチャネルを精製するための改変アフィニティー精製プラス競合戦略が開発された。
要約
ショウジョウバエ の光形質導入は、既知の最速のGタンパク質結合シグナル伝達経路の1つである。このカスケードの特異性と効率を確保するために、カルシウム(Ca2+)透過性陽イオンチャネル、一過性受容器電位(TRP)は、足場タンパク質に強固に結合し、不活性化後電位D(INAD)、および眼特異的プロテインキナーゼC(ePKC)およびホスホリパーゼCβ/無受容体電位A(PLCβ/NORPA)との大きなシグナル伝達タンパク質複合体を形成する。しかしながら、 ショウジョウバエ TRPチャネルの生化学的特性は依然として不明である。INADタンパク質複合体の集合機構に基づいて、内因性TRPチャネルを精製するための改変アフィニティー精製+競合戦略が開発された。まず、精製ヒスチジン(His)タグ付きNORPA 863-1095フラグメントをNiビーズに結合させ、 ショウジョウバエ 頭部ホモジネートから内因性INADタンパク質複合体をプルダウンするための餌として使用した。次いで、過剰に精製されたグルタチオンSトランスフェラーゼ(GST)タグ付きTRP 1261〜1275フラグメントをNiビーズに添加し、TRPチャネルと競合させた。最後に、上清中のTRPチャネルを、サイズ排除クロマトグラフィーによって過剰なTRP 1261〜1275ペプチドから分離した。この方法は、 ショウジョウバエ TRPチャネルのゲーティング機構を生化学的および構造的角度の両方から研究することを可能にする。精製 ショウジョウバエ TRPチャネルの電気生理学的特性は、将来的にも測定することができる。
概要
光形質導入は、吸収された光子がニューロンの電気コードに変換されるプロセスです。脊椎動物と無脊椎動物の両方でオプシンと以下のGタンパク質結合シグナル伝達カスケードを独占的に中継する。ショウジョウバエでは、5つのPDZドメインを用いて、足場タンパク質不活性化後電位D(INAD)が、一過性受容器電位(TRP)チャネル、ホスホリパーゼCβ/No受容体電位A(PLCβ/NORPA)、および眼特異的プロテインキナーゼC(ePKC)からなる超分子シグナル伝達複合体を組織する1。この超分子シグナル伝達複合体の形成は、ショウジョウバエの光形質導入機構の正しい細胞内局在化、高効率、および特異性を保証する。この複合体において、光感受性TRPチャネルは、NORPAの下流エフェクターとして作用し、カルシウム流入および光受容体の脱分極を媒介する。以前の研究は、ショウジョウバエTRPチャネルの開放がプロトン、局所脂質環境の破壊、または機械的力によって媒介されることを示した2,3,4。ショウジョウバエTRPチャネルはまた、カルモジュリン5と相互作用し、正および負の両方のフィードバック6,7,8によってカルシウムによって調節される。
これまでのところ、ショウジョウバエTRPおよびTRP様(TRPL)チャネルのゲーティング機構に関する電気生理学的研究は、摘出された膜パッチ、解離した野生型ショウジョウバエ光受容体からの全細胞記録、およびS2、SF9、またはHEK細胞2、9、10、11、12、13におけるヘテロ発現チャネルに基づいていたが、精製チャネルでは基づいていなかった。全長ショウジョウバエTRPチャネルの構造情報も不明のままである。再構成された膜環境における精製タンパク質の電気生理学的特性を研究し、全長ショウジョウバエTRPチャネルの構造情報を得るためには、哺乳動物のTRPチャネル研究で使用される方法論と同様に、精製全長TRPチャネルを得ることは必要な第1ステップである14、15、16、17。
最近、INADタンパク質複合体18、19、20の集合機構に基づいて、ストレプトアビジンビーズ5によってショウジョウバエ頭部ホモジネートからTRPチャネルを精製するためのアフィニティー精製プラス競合戦略が最初に開発された。ストレプトアビジンビーズの低容量で高価なコストを考慮して、Hisタグ付き餌タンパク質と、はるかに高い容量の対応する低コストのNiビーズを使用する改良された精製プロトコルがここで紹介されています。提案手法は,TRPチャネルのゲーティング機構を構造的角度から研究し,精製タンパク質を用いてTRPチャネルの電気生理学的性質を測定するのに役立つ.
プロトコル
1. GSTタグ付きTRPおよびHISタグ付きNORPAフラグメントの精製
- GST タグ付き TRP 1261-1275 フラグメントを精製する
- CaCl2ヒートショック形質転換法21を用いてpGEX 4T-1 TRP 1261-1275プラスミド10を大腸菌(E.coli)BL21(DE3)細胞に形質転換する。10mLのルリア・ベルターニ(LB)培地に単一コロニーを接種し、37°Cで一晩生育させる。 次いで、37°Cで1LのLB培地に10 mLの播種培養物を増幅する。
- 細胞の光学濃度(OD600)が0.5に達した後、細胞を16°Cまで冷却し、0.1mMイソプロピルβ-D-1-チオガラクトピラノシド(IPTG;最終濃度)を加えて標的タンパク質の過剰発現を誘導し、16°Cで18時間インキュベートする。
- 過剰発現後、培養細胞のペレット1 Lを3,993 × gで20分間遠心分離し、40 mLのリン酸緩衝生理食塩水(PBS)緩衝液に再懸濁した。
- 再懸濁セルを4°Cで予冷した高圧ホモジナイザーに負荷する。 ホモジナイザーの圧力をゆっくりと800バールまで上げます。入口タップを開き、再懸濁されたセルを非常に狭いスリットを備えたバルブに円形に通過させます。
注:セルは、大きな圧力降下およびキャビテーションによって引き起こされる高いせん断力によって均質化される。 - 5 mLのグルタチオンビーズを重力フローカラムにロードし、50 mLのPBSバッファーでビーズを合計3回洗浄します。
- 高圧ホモジナイザーから細胞溶解液を48,384 x gで遠心分離 する。遠心分離した細胞溶解液(40mL)の上清を重力フローカラム内の平衡化グルタチオンビーズに加え、4°Cで30分間インキュベートした。 グルタチオンビーズを10分ごとに再懸濁する。
- 30分間のインキュベーション後、カラム出口タップを開き、ビーズとフロースルー画分を分離した。フロースルー分数を破棄します。残りのグルタチオンビーズを50mLのPBS緩衝液で2回すすいでください。
- 15mLの溶出バッファーをグルタチオンビーズに加え、30分間インキュベートする。ビーズを10分ごとに再懸濁します。
- 30分間のインキュベーション後、GSTタグ付きTRP 1261-1275フラグメントを50mL円錐管で溶出し、50mMトリス(pH7.5、100mM NaCl、1mM EDTA、1mM DTT)バッファーを使用して平衡化されたサイズ排除カラム(調製グレード)に負荷をかけます。
- サイズ排除カラムの溶出流速を 3 mL/minに保ちます。溶出したタンパク質を5mL/チューブの割合で回収します。
- 280 nmのUV吸収シグナルを分析してサイズ排除カラム内の標的タンパク質のピークを特定し、SDS-PAGEゲル分析(電気泳動パラメータ:スタッキングゲルで150 V、分割ゲルで200 V)で検証します。クーマシーブルーR250でゲルを染色します。
- 精製GSTタグ付きTRP 1261-1275フラグメントを、卓上冷蔵遠心分離機中で4°Cで3,000 x g で遠心分離した15 mL限外ろ過スピンカラムを用いて、サイズ排除カラムから1 mLに濃縮する。
- 濃縮タンパク質の濃度は、ビール・ランバートの法則を用いて決定する。分光光度計を用いて、280nmにおけるGSTタグ付きTRP 1261-1275フラグメントのUV吸収を測定する。
- タンパク質配列をProtparamプログラム(https://web.expasy.org/protparam/)にインポートして、280nmにおける吸光係数を得る。典型的には、GSTタグ付きTRP 1261-1275の1 L培養物は、1 mLの600 μMのタンパク質(6 x 10-7 mol)を生じる。必要な材料については、 表 1 を参照してください。
- 彼のタグ付きNORPA 863-1095フラグメントの精製
- CaCl2ヒートショック形質転換法21を用いてpETM.3C NORPA 863-1095プラスミド20を大腸菌BL21(DE3)細胞に形質転換する。10mLのLB培地にシングルコロニーを接種し、37°Cで一晩生育させる。 その後、37°Cで1 LのLB培地で10 mLの播種培養物を増幅する。
- 細胞のOD600が0.5に達したら、細胞を16 °Cまで冷却し、0.1mM IPTG(最終濃度)を加えて標的タンパク質の過剰発現を誘導し、16°Cで18時間インキュベートする。
- 過剰発現後、培養細胞のペレット1 Lを3,993 x gで20分間遠心分離し、40 mLの結合バッファーに再懸濁した。次に、ステップ1.1.4で説明したように、再懸濁した細胞を4°Cの高圧ホモジナイザーで溶解する。
- 5 mLのNiビーズを重力フローカラムにロードし、50 mLの結合バッファーで3回洗浄します。
- 高圧ホモジナイザーから細胞溶解液を48,384 x gで遠心分離 する。遠心分離した細胞溶解液の上清を重力フローカラムで平衡化したNiビーズに加え、4°Cで30分間インキュベートする。 Niビーズを10分ごとに再懸濁します。
- 30分間のインキュベーション後、カラム出口タップを開き、ビーズとフロースルー画分を分離した。フロースルー画分を捨て、残りのNiビーズを50mLの洗浄バッファーで2回洗浄します。
- Niビーズに15mLの溶出バッファーを加え、30分間インキュベートする。Niビーズを10分ごとに再懸濁します。
- 30分間のインキュベーション後、溶出したHisタグ付きNORPA 863-1095フラグメントを50mL円錐管に集め、サイズ排除カラム(調製グレード)にロードし、50mM Tris(pH 7.5、100 mM NaCl、1 mM EDTA、1 mM DTT)を用いて平衡化します。
- サイズ排除カラムの溶出流速を 3 mL/minに保ちます。溶出したタンパク質を5mL/チューブの割合で回収します。
- 280 nmのUV吸収シグナルを分析してサイズ排除カラム内の標的タンパク質のピークを特定し、SDS-PAGEゲル分析(電気泳動パラメータ:スタッキングゲルで150 V、分割ゲルで200 V)で検証します。クマシーブルーR250を使用してゲルを染色します。
- 精製されたHisタグ付きNORPA 863-1095フラグメントを、卓上冷蔵遠心分離機で4°Cで3,000 x g で遠心分離した15 mL限外ろ過スピンカラムを使用して、サイズ排除カラムから1 mLに濃縮します。
- 濃縮タンパク質の濃度は、ビール・ランバートの法則を用いて決定する。分光光度計を用いて、280nmにおけるHisタグ付きNORPA 863-1095フラグメントのUV吸収を測定する。
- タンパク質配列をProtparamプログラム(https://web.expasy.org/protparam/)にインポートして、280nmにおける吸光係数を得る。典型的には、Hisタグ付きNORPA 863-1095フラグメントの1 L培養物は、1 mLの600 μMのタンパク質(6 x 10-7 mol)を生じる。必要な材料については、 表 2 を参照してください。
2. ショウジョウバエ の頭の調製
- CO2麻酔法22、23を用いて50mL円錐形遠心分離チューブに成虫のハエを集める。直ちに液体窒素で10分間凍結し、-80°Cの冷凍庫に保管してください。
- 十分な数のハエを集めた後、凍った50mLの円錐形のチューブを手で激しく振って、ハエの足、頭、翼、体を分離します。混合物を3つの順次積み重ねられた予め冷却されたステンレス鋼篩(それぞれ20/30/40メッシュサイズ)に移し、ふるいを振盪する。
- 次に、ヘッドは40メッシュのふるいを通れないので、ブラシを使ってフライヘッドを40メッシュのふるいから掃き取り、50mLの円錐形チューブに移し、-80°Cで保管します。
- ハエとその頭を連続的に集め、実験に必要な必要量(0.5g)に達するまで-80°Cの冷凍庫に保管します。典型的には、0.5gの頭部を集めるために、50mLの円錐形チューブに35mLのハエが必要である。必要な材料については、 表 3 を参照してください。
ショウ ジョウバエ TRPチャネル精製
- 合計0.5gのヘッドを計量し、予め冷却された乳鉢乳棒を使用して液体窒素中で完全に均質化する。ホモジナイズしたヘッドを10x v/w溶解バッファー(5mL)に溶解し、シェーカー中で4°Cで20分間インキュベートした後、20,817 x g で4°Cで20分間遠心分離します。
- スピンダウン上清(「20817 g S」、 図4)を回収し、さらに100,000 x g で4°Cで60分間遠心分離します。 スピンダウン上清(「100,000 g S」、 図4)を次のプルダウンアッセイに使用します。
- 重力フローカラムに1 mLのNiビーズを加え、4°Cで10 mLの二重蒸留H2O(ddH2O)で合計3回ビーズを洗浄します。ビーズを10カラム容量の溶解バッファーで4°Cで3回平衡化します。
- 500 μL の精製 His-タグ付き NORPA 863-1095 タンパク質 (3 x 10-7 mol) を Ni カラムに加え、4 °Cで 30 分間インキュベートします。 ビーズを10分ごとに再懸濁します。
- カラム出口タップを開き、ビーズとフロースルー画分を分離します。SDS-PAGE分析のフロースルー分率を取ります(NORPA F、 図4)。このセクションでは、餌タンパク質をNiビーズに固定化します。
- Niビーズを4°Cで10カラム容量の溶解バッファー(10mL)で洗浄し、洗浄画分をSDS-PAGE分析のために保持する(Wash 1、 図4A)。上記の手順を繰り返し、SDS-PAGE分析用のサンプルを保管してください(洗浄2、 図4A)。このセクションでは、Niビーズ上の過剰な餌タンパク質が除去される。
- 100,000 x g遠心分離後のショウジョウバエ頭ホモジネートの上清を4°CのNiカラムに加え、そこでHisタグ付きNORPA 863-1095フラグメントが固定化された。
- 上清をNiビーズと共に4°Cで30分間インキュベートする。ビーズを10分ごとに再懸濁します。次いで、カラム出口タップを開き、ビーズとフロースルー画分を分離する。
- SDS-PAGE分析のために上清を採取する(ドロ頭溶解F、 図4A)。このセクションでは、頭部ホモジネート中のINADタンパク質複合体(INAD/TRP/ePKC)が、Niビーズ上の固定化NORPA 863-1095フラグメントによって捕捉される。
- Ni ビーズを 4 °C で 10 カラム容量の溶解バッファー (10 mL) で洗浄し、SDS-PAGE 分析のために上清を重力沈殿から守ります (Wash 3、 図 4A)。上記の手順を繰り返し、SDS-PAGE分析のために上清を回収する(洗浄4、 図4A)。このセクションでは、Niビーズ上の未結合タンパク質を除去します。
- GST タグ付き TRP 1261-1275 タンパク質 (3 x 10-7 mol) の 600 μM を 500 μL の Ni ビーズに加え、4 °C で 20 分間 インキュベートします。 ビーズを10分ごとに再懸濁します。
- 溶出画分を重力カラム(TRP E1、 図4B)から回収し、これは内因性 ショウジョウバエ TRPチャネルを含む。以上の工程を繰り返し、溶出画分を回収する(TRP E2、 図4B)。このステップでは、GSTタグ付きTRP 1261-1275フラグメントを競合物質として使用することにより、Niビーズ上の捕捉されたINADタンパク質複合体(INAD/TRP/ePKC)からTRPチャネルが溶出されます。
- Niビーズを10カラム容量の結合バッファー(10mL; 表1)4°Cで、SDS-PAGE分析のために洗浄画分を回収した(洗浄5、 図4B)。
- 500 μLの溶出バッファー(表1)をNiビーズに加え、4°Cで20分間インキュベートします。 重力フローカラムから溶出画分を回収する(NORPA E1、 図4B)。以上の工程を繰り返し、溶出画分を回収した(NORPA E2、 図4B)。
- 溶出バッファーを使用して、INAD/ePKC タンパク質複合体を伴った His-タグ付き NORPA 863-1095 フラグメントを溶出します。次に、Niビーズを500μLの結合バッファーに再懸濁する。
- 再懸濁Niビーズを取り出し、SDS-PAGE(クーマシーブルーR250で染色)を実行し、溶出の効率を分析し、溶出バッファーが機能するかどうかを評価します(ビーズ、 図4B)。必要な材料については、 表 4 を参照してください。
ショウ ジョウバエ TRPチャネルのサイズ排除カラム精製
- タンパク質精製システムにサイズ排除カラム(分析グレード)を設置します。カラムをカラムバッファー (50 mM Tris-HCl pH 7.5、150 mM NaCl、2 mM DTT、0.75 mM DDM) で平衡化し、0.45 μm フィルターでろ過します。
- ステップ3.14からのTRP E1およびE2画分を4mL限外濾過スピンカラムを用いて濃縮し、冷蔵遠心分離機中で4°Cで3,000 x g で遠心分離した。
- カラムバッファーでサンプルループをリンスし、サンプルをサンプルループにロードします。サンプルをサイズ排除カラムに注入し、適切な流速(0.5 mL/min)でタンパク質を溶出します。
- 280nmでの吸収により標的タンパク質のピークを同定し、SDS-PAGEゲルをランさせて精製された内因性 ショウジョウバエ TRPチャネルを検出した(図5)。必要な材料については、 表 5 を参照してください。
結果
この記事では、内因性の ショウジョウバエ TRPチャネルを精製するためのタンパク質精製方法が実証されています(図1)。
まず、組換えタンパク質の発現および精製を適用して、餌および競合タンパク質を得る。次いで、GSTタグ付きTRP 1261-1275フラグメントをLB培地中の 大腸菌 BL21(DE3)細胞で発現させ、グルタチオンビーズおよびサイズ排除カラムを用いて精製した(図2)。サンプルを、クーマシーブルーR250染色によるSDS−PAGE分析を用いて検証した。SDS-PAGEサンプル調製プロセスでは、30μLのタンパク質サンプルを10μLの4xローディング色素と混合し、100°Cで10分間煮沸します。次いで、15μLのゆでサンプルを各ウェルに個別にロードする。Hisタグ付きNORPA 863-1095フラグメントは、LB培地中の 大腸菌 BL21(DE3)細胞でも同様に発現し、Niビーズおよびサイズ排除カラムによって精製されます(図3)。精製されたGSTタグ付きTRP 1261-1275およびHisタグ付きNORPA 863-1095は、内因性 ショウジョウバエ TRPチャネルの精製のために濃縮される。
第二に、 ショウジョウバエ の頭部を採取し、予め冷却した乳鉢乳棒を用いて液体窒素中でホモジナイズし、次いで10x v/w溶解バッファーに溶解する(表4)。溶解したヘッドホモジネートをシェーカー中で4°Cで20分間インキュベートし、20,817 x g で4°Cで20分間遠心分離する。 スピンダウン上清(20817g S、 図4A)を回収し、さらに100,000 x g で4°Cで60分間遠心分離する。 第2のスピンダウン上清(100,000g S、 図4A)は、その後のプルダウンアッセイに使用される。
最後に、プルダウンアッセイおよび競合アッセイの原理に基づいて、アフィニティー精製プラス競合戦略を使用して、内因性TRPチャネルを精製します。精製されたHisタグ付きNORPA 863-1095フラグメントは、Niビーズに結合し、 ショウジョウバエ 頭部ホモジネートから内因性INADタンパク質複合体をプルダウンするための餌として使用される。次いで、過剰に精製されたGSTタグ付きTRP 1261〜1275フラグメントが、Niビーズ上に捕捉されたINAD複合体からTRPチャネルを競合するために添加される(TRP E1、TRP E2、 図4B)。最後に、溶出されたTRPチャネルは、サイズ排除クロマトグラフィーによって過剰なGSTタグ付きTRP 1261-1275ペプチドから分離される(図5)。SDS-PAGEサンプル調製プロセスでは、30μLのタンパク質サンプルを10μLの4xローディング色素と混合し、100°Cで10分間煮沸します。次に、15 μLのサンプルを各ウェルに個別にロードします。副生成物として、INAD−ePKC−NORPA 863−1095複合体は、TRP 1261−1275ペプチド競合後にNiビーズを溶出することによっても得ることができる(NORPA E1、NORAP E2、 図4B)。この方法を用いて、0.5gのフライヘッドからの最終精製 ショウジョウバエ TRPチャネルの典型的な収量は、50μLの3μM TRPタンパク質(1.5 x 10〜10 モル)である。より精製されたTRPチャネルが必要な場合は、それに応じて、フライヘッド、Niビーズ、餌タンパク質、および競合他社の量をスケールアップします。

図1:内因性ショウジョウバエTRPチャネルの精製のための模式図(A)精製されたHisタグ付きNORPA 863-1095タンパク質がNiビーズに固定化されている。(B)ショウジョウバエの頭部をホモジナイズし、100,000 x g遠心分離後のスピンダウン上清をNORPA結合Niビーズに添加し、NORPA 863-1095タンパク質が餌として作用して内因性INADタンパク質複合体(INAD/TRP/ePKC)を捕捉する。(c)GSTタグ付きTRP 1261-1275フラグメントを付加して、捕捉されたINADタンパク質複合体から内因性ショウジョウバエTRPチャネルを競合させる。(d)溶出したTRPタンパク質をサイズ排除カラムによりさらに精製し、過剰なGSTタグ付きTRP 1261-1275断片を分離する。赤い矢印は、TRPチャネルおよびGSTタグ付きTRP 1261-1275フラグメントの溶出位置をそれぞれ強調表示しています。この図の拡大版を表示するには、ここをクリックしてください。

図2:グルタチオンビーズおよびサイズ排除クロマトグラフィーによるGSTタグ付きTRP-CT 1261-1275タンパク質の精製(A)サイズ排除カラムにおけるGSTタグ付きTRP-CT 1261-1275タンパク質の精製プロファイル(調製グレード)。画分は5mL/チューブで収集されます。矢印位置の画分(チューブ44〜48)を回収し、内因性TRPチャネルの以下の精製のために濃縮する。(b)グルタチオンビーズアフィニティー精製およびその後のサイズ排除カラム精製におけるGSTタグ付きTRP 1261〜1275フラグメントを示すクマシーブルーR250染色SDS−PAGEゲル。矢印は、SDS-PAGEゲル中のGSTタグ付きTRP 1261-1275フラグメントの位置を強調表示します。略語:P:大腸菌由来のペレット。BL21(DE3)細胞溶解液をPBS緩衝液中でホモジナイズし、48,384 x gで遠心分離した後;S:大腸菌からの上清。BL21(DE3)ホモジナイズおよび48,384 x gでの遠心分離後の細胞ライセート;F:前のS画分をグルタチオンビーズと共に4°Cで30分間インキュベートした後のフロースルー画分;W1およびW2:10カラム容量のPBS緩衝液による第1および第2の洗浄画分;B:再懸濁グルタチオンビーズ上の未溶出タンパク質をSDS-PAGEゲルにより分析し、溶出効率を評価し;E:溶出緩衝液によるグルタチオンビーズからの溶出画分。GSTタグ付きタンパク質精製のための緩衝液レシピを表1に記載する。この図の拡大版を表示するには、ここをクリックしてください。

図3:Niビーズおよびサイズ排除クロマトグラフィーによるHisタグ付きNORPA 863-1095タンパク質の精製(A)サイズ排除カラムにおけるHisタグ付きNORPA 863-1095タンパク質の精製プロファイル。流量 = 3 mL/分。画分は5mL/チューブで収集されます。矢印位置の画分(チューブ44〜49)を回収し、内因性TRPチャネルの以下の精製のために濃縮する。(b)Niカラム精製およびその後のサイズ排除カラム精製におけるHisタグ付きNORPA 863-1095タンパク質を示すクマシーブルーR250染色SDS−PAGEゲル。矢印は、SDS-PAGEゲル中のHISタグ付きNORPA 863-1095タンパク質の位置を強調表示している。略語:P:大腸菌由来のペレット。BL21(DE3)結合緩衝液中でのホモジナイゼーション後の細胞溶解物および48,384 x gでの遠心分離;S:大腸菌からの上清画分。BL21(DE3)ホモジナイズおよび48,384 x gでの遠心分離後の細胞ライセート;F:前のS画分がNiビーズと共に4°Cで30分間インキュベートされた後のフロースルー画分;W1およびW2:10カラム容量の洗浄バッファーによる第1および第2の洗浄画分;B:溶出後の再懸濁Niビーズ上の未溶出タンパク質;E:溶出緩衝液によるNiビーズからの溶出画分。Hisタグ付きタンパク質精製のための緩衝液レシピを表2に列挙する。この図の拡大版を表示するには、ここをクリックしてください。

図4:内因性 ショウジョウバエ TRPチャネルの精製。 各ステップから収集されたサンプルをSDS-PAGEで分析し、クーマシーブルーR-250染料で染色します。(a)20817g S:20,817 x g 遠心分離後の頭部ホモジネートの上清画分;NORPA F:Hisタグ付きNORPA 863-1095フラグメント結合後のNiビーズのフロースルー画分;Wash1およびWash2:Hisタグ付きNORPA 863-1095結合後の溶解緩衝液によるNiビーズの第1および第2の洗浄画分;100,000 g S:前の20,817 g S上清をさらに100,000 x g で遠心分離し、上清をSDS-PAGE用に回収する。ドロ頭溶解F:100,000g Sサンプルとのインキュベーション後のNiビーズのフロースルー画分;Wash3およびWash4:100,000g Sサンプルとのインキュベーション後の溶解緩衝液によるNiビーズの画分の洗浄。(b)TRP E1およびE2:GSTタグ付きTRP 1261-1275フラグメントによって第1および第2に溶出されたTRPチャネル画分;Wash5:GSTタグ付きTRP 1261-1275による競合後の結合緩衝液によるNiビーズの画分の洗浄;NORPA E1およびE2:捕捉されたINAD/ePKC複合体を有するHisタグ付きNORPA 863-1095フラグメントの第1および第2の溶出画分;ビーズ:溶出バッファー処理後に再懸濁Niビーズ中に滞留する未溶出タンパク質。内因性 ショウジョウバエ TRPチャネル精製のための緩衝レシピを 表4に記載する。 この図の拡大版を表示するには、ここをクリックしてください。
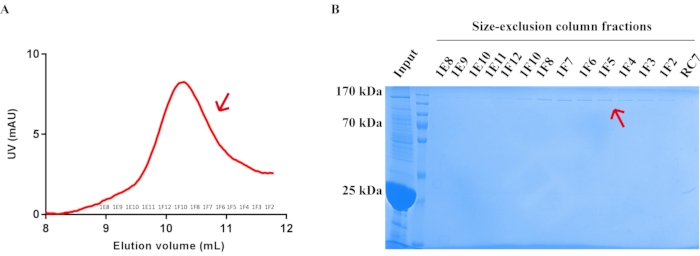
図5:サイズ排除クロマトグラフィーによる内因性 ショウジョウバエ TRPチャネルタンパク質の精製。 (a)サイズ排除カラムにおける内因性 ショウジョウバエ TRPチャネルタンパク質の精製プロファイル。流量 = 0.5 mL/分。画分を0.5 mL/チューブで回収した。矢印位置の画分(1E8-1F2)を回収し、濃縮した。(b)サイズ排除カラム精製後の内因性 ショウジョウバエ TRPチャネルタンパク質を示すクマシーブルーR−250染色SDS−PAGEゲル。精製された内因性ショウ ジョウバエ TRPチャネルタンパク質の位置は、赤い矢印で強調表示されている。 この図の拡大版を表示するには、ここをクリックしてください。
表1:GSTタグ付きTRP 1261〜1275フラグメントの精製に必要な物質。この表をダウンロードするには、ここをクリックしてください。
表2:Hisタグ付きNORPA 863-1095フラグメントの精製に必要な材料。この表をダウンロードするには、ここをクリックしてください。
表 3: ショウジョウバエの頭部の準備に必要な材料。この表をダウンロードするには、ここをクリックしてください。
表 4: ショウジョウバエ TRP チャネルの精製に必要な材料。この表をダウンロードするには、ここをクリックしてください。
表 5: ショウジョウバエ TRP チャネルのサイズ排除カラム精製に必要な材料。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
5つのPDZドメインを含むINADは、ショウジョウバエの光形質導入機構の中核をなす組織者です。以前の研究では、INAD PDZ3がTRPチャネルC末端尾部に絶妙な特異性(KD=0.3μM)で結合することを示していました18。INAD PDZ45タンデムは、非常に高い結合親和性(KD=30nM)を有するNORPA 863−1095断片と相互作用する。これらの知見は、アフィニティー精製と競合戦略を設計するための強固な生化学的基盤を提供し、ノルパCC-PBMフラグメントをプルダウンベイトとして使用することを可能にし、TRP C末端尾部(フラグメント1261-1275)は競合試薬として機能する。したがって、この方法の最初の臨界点は、INAD複合体の集合機構を理解し、十分なNORPAおよびTRP断片を得ることである。同時に、TRPチャネルは膜から抽出して溶液中で安定化する必要がある膜タンパク質であるため、洗剤の使用はこの方法の第2の臨界点である。TRPチャネル24,25の構造的および機能的研究のための一般的な洗剤として、n−ドデシル−B−D−マルトシド(DDM)がこの方法で使用される。精製結果が満足のいくものでない場合は、餌タンパク質、競合タンパク質、および洗剤の品質を慎重にチェックする必要があります。さらに、TRPチャネルの抽出効率は、TRP抗体を用いたウェスタンブロットによって追跡することができる。
以前の研究5では、高価なストレプトアビジンビーズを使用して、フライヘッド抽出物からTRPチャネルを精製し、実験室での日常的な精製を制限した。したがって、この方法は、Hisタグ付きNORPA 863-1095フラグメントをNiビーズと組み合わせて使用して、コストを削減し、収率を増加させることによって改善された。現在、改良された方法における精製TRPチャネルの収率は、透過型電子顕微鏡(TEM)陰性染色実験を実施するのに十分であり、そこでは、精製TRPチャネルは四量体を形成し(データは示さず)、精製プロセスがTRPチャネルの四量体形成を妨害しないことを示す。したがって、このプロトコルは、将来のクライオEMおよび電気生理学実験に潜在的に適している可能性があります。
しかし、実験で使用した競合物質(NORPA 863-1095フラグメント、TRP 1261-1275フラグメント)は野生型タンパク質と同様の結合親和性を有するため、この方法の限界は、標的タンパク質をプルダウンするために大量の競合タンパク質およびビーズを使用しなければならないことである。餌を大規模に浄化できないラボには不便です。
この方法の将来の潜在的な応用は、Cryo-EM技術を用いて ショウジョウバエ TRPチャネルの構造情報を研究することである。加えて、人工二重層脂質膜における精製された内因性TRPチャネルの電気生理学的特性を測定することも実行可能である。さらに、この再構成されたモデルシステムにおいて、INAD複合体組成および脂質組成を調節することによって、精製された内因性TRPチャネルの電気生理学的特性を特徴付けることは興味深いであろう。最後に、構造情報および電気生理学的特性と組み合わせることで、TRPチャネルのゲーティングおよび調節機構を将来慎重に調べることができる。
開示事項
著者らには開示するものは何もありません。
謝辞
この研究は、中国国家自然科学財団(第31870746号)、深セン基礎研究費補助金(JCYJ20200109140414636)、および中国広東省自然科学財団(第2021A1515010796号)の支援を受けてW. L.私たちは、この原稿の準備中に言語的支援をしてくれたLetPub(www.letpub.com)に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Bacterial strains | |||
| BL21(DE3) Competent Cells | Novagen | 69450 | Protein overexpression |
| Experiment models | |||
| D.melanogaster: W1118 strain | Bloomington Drosophila Stock Center | BDSC:3605 | Drosophila head preparation |
| Material | |||
| 20/30/40 mesh stainless steel sieves | Jiufeng metal mesh company | GB/T6003.1 | Drosophila head preparation |
| 30% Acrylamide-N,N′-Methylenebisacrylamide(29:1) | Lablead | A3291 | SDS-PAGE gel preparation |
| Ammonium Persulfate | Invitrogen | HC2005 | SDS-PAGE gel preparation |
| Cocktail protease inhibitor | Roche | 05892953001 | Protease inhibitor |
| Coomassie brilliant blue R-250 | Sangon Biotech | A100472-0025 | SDS-PAGE gel staining |
| DL-Dithiothreitol (DTT) | Sangon Biotech | A620058-0100 | Size-exclusion column buffer preparation |
| Ethylenediaminetetraacetic acid disodium salt (EDTA) | Sangon Biotech | A500838-0500 | Size-exclusion column buffer preparation |
| Glycine | Sangon Biotech | A610235-0005 | SDS-PAGE buffer preparation |
| Glutathione Sepharose 4 Fast Flow beads | Cytiva | 17513202 | Affinity chromatography |
| Imidazole | Sangon Biotech | A500529-0001 | Elution buffer preparation for Ni-column |
| Isopropyl-beta-D-thiogalactopyranoside (IPTG) | Sangon Biotech | A600168-0025 | Induction of protein overexpression |
| LB Broth Powder | Sangon Biotech | A507002-0250 | E.coli. cell culture |
| L-Glutathione reduced (GSH) | Sigma-aldrich | G4251-100G | Elution buffer preparation for Glutathione beads |
| Ni-Sepharose excel beads | Cytiva | 17371202 | Affinity chromatography |
| N-Dodecyl beta-D-maltoside (DDM) | Sangon Biotech | A610424-001 | Detergent for protein purification |
| N,N,N',N'-Tetramethylethylenediamine (TEMED) | Sigma-aldrich | T9281-100ML | SDS-PAGE gel preparation |
| PBS | Sangon Biotech | E607008-0500 | Homogenization buffer for E.coli. cell |
| PMSF | Lablead | P0754-25G | Protease inhibitor |
| Prestained protein marker | Thermo Scientific | 26619/26616 | Prestained protein ladder |
| Size exclusion column (preparation grade) | Cytiva | 28989336 | HiLoad 26/60 Superdex 200 PG column |
| Size exclusion column (analytical grade) | Cytiva | 29091596 | Superose 6 Increase 10/300 GL column |
| Sodium chloride | Sangon Biotech | A501218-0001 | Protein purification buffer preparation |
| Sodium dodecyl sulfate (SDS) | Sangon Biotech | A500228-0001 | SDS-PAGE gel/buffer preparation |
| Tris base | Sigma-aldrich | T1503-10KG | Protein purification buffer preparation |
| Ultrafiltration spin column | Millipore | UFC901096/801096 | Protein concentration |
| Equipment | |||
| Analytical Balance | DENVER | APX-60 | Metage of Drosophila head |
| Desk-top high-speed refrigerated centrifuge for 15mL and 50mL conical centrifugation tubes | Eppendorf | 5810R | Protein concentration |
| Desk-top high-speed refrigerated centrifuge 1.5mL centrifugation tubes | Eppendorf | 5417R | Centrifugation of Drosophila head lysate after homogenization |
| Empty gravity flow column (Inner Diameter=1.0cm) | Bio-Rad | 738-0015 | TRP protein purification |
| Empty gravity flow column (Inner Diameter=2.5cm) | Bio-Rad | 738-0017 | Bait and competitor protein purification from E.coli. |
| Gel Documentation System | Bio-Rad | Universal Hood II Gel Doc XR System | SDS-PAGE imaging |
| High-speed refrigerated centrifuge | Beckman coulter | Avanti J-26 XP | Centrifugation of E.coli. cells/cell lysate |
| High pressure homogenizer | UNION-BIOTECH | UH-05 | Homogenization of E.coli. cells |
| Liquid nitrogen tank | Taylor-Wharton | CX-100 | Drosophila head preparation |
| Protein purification system | Cytiva | AKTA purifier | Protein purification |
| Refrigerator (-80°C) | Thermo | 900GP | Drosophila head preparation |
| Spectrophotometer | MAPADA | UV-1200 | OD600 measurement of E.coli. cells |
| Spectrophotometer | Thermo Scientific | NanoDrop 2000c | Determination of protein concentration |
| Ultracentrifuge | Beckman coulter | Optima XPN-100 Ultracentrifuge | Ultracentrifugation |
参考文献
- Tsunoda, S., et al. A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature. 388 (6639), 243-249 (1997).
- Huang, J., et al. Activation of TRP channels by protons and phosphoinositide depletion in Drosophila photoreceptors. Current Biology: CB. 20 (3), 189-197 (2010).
- Chyb, S., Raghu, P., Hardie, R. C. Polyunsaturated fatty acids activate the Drosophila light-sensitive channels TRP and TRPL. Nature. 397 (6716), 255-259 (1999).
- Hardie, R. C., Franze, K. Photomechanical responses in Drosophila photoreceptors. Science. 338 (6104), 260-263 (2012).
- Chen, W., et al. Calmodulin binds to Drosophila TRP with an unexpected mode. Structure. 29 (4), 330-344 (2021).
- Hardie, R. C. Effects of intracellular Ca2+ chelation on the light response in Drosophila photoreceptors. Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology. 177 (6), 707-721 (1995).
- Scott, K., Sun, Y., Beckingham, K., Zuker, C. S. Calmodulin regulation of Drosophila light-activated channels and receptor function mediates termination of the light response in vivo. Cell. 91 (3), 375-383 (1997).
- Hardie, R. C., Minke, B. Phosphoinositide-mediated phototransduction in Drosophila photoreceptors: the role of Ca2+ and trp. Cell Calcium. 18 (4), 256-274 (1995).
- Delgado, R., et al. Light-induced opening of the TRP channel in isolated membrane patches excised from photosensitive microvilli from Drosophila photoreceptors. Neuroscience. 396, 66-72 (2019).
- Lev, S., Katz, B., Minke, B. The activity of the TRP-like channel depends on its expression system. Channels (Austin). 6 (2), 86-93 (2012).
- Hardie, R. C., Raghu, P. Activation of heterologously expressed Drosophila TRPL channels: Ca2+ is not required and InsP3 is not sufficient. Cell Calcium. 24 (3), 153-163 (1998).
- Gutorov, R., et al. Modulation of transient receptor potential C channel activity by cholesterol. Frontiers in Pharmacology. 10, 1487(2019).
- Yagodin, S., et al. Thapsigargin and receptor-mediated activation of Drosophila TRPL channels stably expressed in a Drosophila S2 cell line. Cell Calcium. 23 (4), 219-228 (1998).
- Guo, W., Chen, L. Recent progress in structural studies on canonical TRP ion channels. Cell Calcium. 83, 102075(2019).
- Li, X., Fine, M. TRP channel: The structural era. Cell Calcium. 87, 102191(2020).
- Liao, M., Cao, E., Julius, D., Cheng, Y. Structure of the TRPV1 ion channel determined by electron cryo-microscopy. Nature. 504 (7478), 107-112 (2013).
- Cao, E., Liao, M., Cheng, Y., Julius, D. TRPV1 structures in distinct conformations reveal activation mechanisms. Nature. 504 (7478), 113-118 (2013).
- Liu, W., et al. The INAD scaffold is a dynamic, redox-regulated modulator of signaling in the Drosophila eye. Cell. 145 (7), 1088-1101 (2011).
- Ye, F., Liu, W., Shang, Y., Zhang, M. An exquisitely specific PDZ/target recognition revealed by the structure of INAD PDZ3 in complex with TRP channel. Structure. 24 (3), 383-391 (2016).
- Ye, F., et al. An unexpected INAD PDZ tandem-mediated plcβ binding in Drosophila photo receptors. eLife. 7, (2018).
- Rahimzadeh, M., Sadeghizadeh, M., Najafi, F., Arab, S., Mobasheri, H. Impact of heat shock step on bacterial transformation efficiency. Molecular Biology Research Communications. 5 (4), 257-261 (2016).
- Ashburner, M., Golic, K. G., Hawley, S. Drosophila: A laboratory handbook. Second Edition. 80 (2), The Quarterly Review of Biology. (2005).
- Nicolas, G., Sillans, D. Immediate and latent effects of carbon dioxide on insects. Annual Review of Entomology. 34 (1), 97-116 (1989).
- Arachea, B. T., et al. Detergent selection for enhanced extraction of membrane proteins. Protein Expression and Purification. 86 (1), 12-20 (2012).
- Hellmich, U. A., Gaudet, R. Structural biology of TRP channels. Handbook of Experimental Pharmacology. 223, 963-990 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved