Method Article
Toprak Örneklerinden İntomopatojenik Mantarların İzolasyonu ve Seçimi ve Böcek Zararlılarına Karşı Mantar Virülansının Değerlendirilmesi
Bu Makalede
Özet
Burada, toprak örneklerinden entomopatojenik mantarların (EPF) izole edilmesi ve seçilmesi için kullanılan yemek kurdu (Tenebrio molitor)-yem sistemine dayanan bir protokol sunuyoruz. Sahada zararlı mikrobiyal kontrolü için fizyolojik özelliklere göre yüksek strese dayanıklı EPF seçmek için etkili bir konidia sayısı (ECN) formülü kullanılır.
Özet
İntomopatojenik mantarlar (EPF), entegre haşere yönetimi için mikrobiyal kontrol ajanlarından biridir. Yerel veya istilacı zararlıları kontrol etmek için, yerli EPF'yi izole etmek ve seçmek önemlidir. Bu nedenle, bu çalışmada böcek yemi (yemek kurdu, Tenebrio molitor) sistemi ile birlikte toprak yem yöntemi bazı değişikliklerle kullanılmıştır. İzole EPF daha sonra tarım zararlısı Spodoptera litura'ya karşı virülans testine tabi tutuldu. Ayrıca, potansiyel EPF suşları morfolojik ve moleküler tanımlamalara tabi tutulmuştır. Ek olarak, konidia üretimi ve termotolerans tahlilleri umut verici EPF suşları için yapıldı ve karşılaştırıldı; bu veriler laboratuvar sıralaması için etkili konidia sayısı (ECN) formülüne daha da ikame edilmiştir. Toprak yemi-yemek kurdu sistemi ve ECN formülü, böcek türlerinin değiştirilmesi ve ticarileştirme ve saha uygulamasının değerlendirilmesi için daha fazla stres faktörü entegre edilerek geliştirilebilir. Bu protokol, EPF seçimi için hızlı ve verimli bir yaklaşım sağlar ve biyolojik kontrol ajanları üzerindeki araştırmaları geliştirecektir.
Giriş
Şu anda, entomopatojenik mantarlar (EPF) tarım, orman ve bahçecilik zararlılarının mikrobiyal kontrolünde yaygın olarak kullanılmaktadır. EPF'nin avantajları geniş konak çeşitleri, iyi çevresel adaptasyon kabiliyeti, çevre dostu doğası ve entegre haşere yönetimi için sinerjik etkiyi göstermek için diğer kimyasallarla birlikte kullanılabilmesidir1,2. Bir haşere kontrol ajanı olarak uygulama için, çok sayıda EPF'yi hastalıklı böceklerden veya doğal ortamdan izole etmek gerekir.
Bu organizmaların konaklarından örneklemesi, EPF'nin doğal konaklarda coğrafi dağılımını ve yaygınlık oranını anlamaya yardımcı olur3,4,5. Bununla birlikte, mantar enfekte böceklerin toplanması genellikle alandaki çevresel faktörler ve böcek popülasyonları ile sınırlıdır4. Böcek konakçılarının EPF enfeksiyonundan sonra öleceği ve daha sonra toprağa düşeceği göz önüne alındığında, EPF'nin toprak örneklerinden izole edilmesi istikrarlı bir kaynak olabilir3,6. Örneğin, saprofitlerin büyüme için kaynakları olarak ölü konağı kullandıkları bilinmektedir. Toprak yemi ve seçici orta sistemler, EPF'yi topraktan tespit etmek ve izole etmek için yaygın olarak kullanılmıştır3,4,7,8,9,10.
Seçici ortam yönteminde, seyreltilmiş toprak çözeltisi, bakterilerin büyümesini engellemek için geniş spektrumlu antibiyotikler (örneğin, kloramfenikol, tetrasiklin veya streptomisin) içeren bir ortama kaplanır2,3,9,11. Bununla birlikte, bu yöntemin türün çeşitliliğini ve yoğunluğunu bozabileceği ve birçok mikrobiyal topluluğun aşırı veya az tahmin edilmesine neden olabileceği bildirilmiştir6. Ayrıca, izole suşlar daha az patojeniktir ve izolasyon sırasında saprofitlerle rekabet eder. EPF'yi seyreltilmiş toprak çözeltisinden izole etmek zordur3. Seçici bir ortam kullanmak yerine, toprak yem yöntemi EPF'yi 2-3 hafta saklanabilen enfekte ölü böceklerden izole eder, böylece daha verimli ve standart bir EPF ayırma yöntemi sağlar3,4,7,6. Yöntemin kullanımı kolay olduğundan, çeşitli patojenik suşları düşük maliyetle izole edebilirsiniz4. Bu nedenle, birçok araştırmacı tarafından yaygın olarak kullanılmaktadır.
Farklı böcek yem sistemleri karşılaştırıldıktan sonra, Beauveria bassiana ve Metarhizium anisopliae, Hemiptera, Lepidoptera, Blattella ve Coleoptera6,12,13,14'e ait böceklerde bulunan en yaygın EPF türleridir. Bu böcek yemleri arasında, Galleria mellonella (Sipariş Lepidoptera) ve Tenebrio molitor (sipariş Coleoptera) beauveria ve Metarhizium spp. Bu nedenle, G. mellonella ve T. molitor genellikle böcek yemleme için kullanılır. Yıllar içinde, Amerika Birleşik Devletleri Tarım Bakanlığı (USDA) bir EPF Kütüphanesi (EPF kültürlerinin Tarımsal Araştırma Hizmeti Koleksiyonu, ARSEF) 4081 Beauveria spp., 18 Clonostachys spp., 878 Cordyceps spp., 2473 Metarhizium spp., 226 Purpureocillium spp. türü dahil olmak üzere çok çeşitli türler içerir. ve 13 Pochonia türü. Bir diğer EPF Kütüphanesi ise Amerika Birleşik Devletleri'ndeki Vermont Üniversitesi'nden Entomoloji Araştırma Laboratuvarı (ERL) tarafından 30 yıllığına inşa edilmiştir. Amerika Birleşik Devletleri, Avrupa, Asya, Afrika ve Orta Doğu16'dan 1345 EPF suşunu içerir.
Tayvan'daki yerel veya istila zararlılarını kontrol etmek için, yerli EPF'nin izolasyonu ve seçimi gereklidir. Bu nedenle, bu protokolde, toprak yem yönteminin prosedürünü değiştirdik ve tanımladık ve böcek yemi (yemek kurdu, Tenebrio molitor) sistemi ile birleştirdik17. Bu protokole dayanarak bir EPF kütüphanesi kuruldu. Ön EPF izolatları için iki tur tarama (aşılamanın nicelleştirilmesi) yapıldı. EPF izolatları böceklere patojeniklik gösterdi. Potansiyel suşlar morfolojik ve moleküler tanımlamalara tabi tutuldu ve termotolerans ve konidiyal üretim tahlilleri ile daha fazla analiz edildi. Ayrıca, etkili bir konidia sayısı (ECN) kavramı da önerildi. ECN formülü ve ana bileşen analizi (PCA) kullanılarak, potansiyel suşlar EPF kütüphanesinin kurulması ve taranmasının sürecini tamamlamak için simüle edilmiş çevresel basınç altında analiz edildi. Daha sonra, umut verici EPF suşlarının patojenitesi hedef haşere için test edildi (örneğin, Spodoptera litura). Mevcut protokol, termotolerans ve konidiyal üretim verilerini, EPF ile ilgili araştırmalar için standart bir sıralama sistemi olarak kullanılabilecek ECN formülüne ve PCA analizine entegre eder.
Protokol
NOT: Tüm akış çizelgesi Şekil 1'de gösterilmiştir.
1. Potansiyel Entomopatojenik mantarların izolasyonu ve seçimi (EPF)
- Toprak örneğini toplayın
- Yüzey toprağının 1 cm'lik kısmını çıkarın ve ardından her örnekleme alanından bir kürek kullanarak toprağı 5-10 cm derinlikte toplayın.
NOT: Örnekleme alanları, yapay olarak püskürtülen EPF suşlarının kirlenmesini önlemek için dağ, orman veya seyrek nüfuslu alanlar olacaktır. Toprak numunelerinin toplanması için alanların yüzeyde oğla kaplı olduğundan emin olun. Kuru toprak veya nemli toprak bu deney için uygun değildir. - GPS, yükseklik, alan türü, yıllık sıcaklık, yıllık yağış, toplama süresi (mevsim), toprak tipi ve pH değeri dahil olmak üzere her örnekleme alanının ayrıntılarını kaydedin.
- 100 g toprak örneğini plastik bir torbaya toplayın ve 3 saat içinde laboratuvarda mantar izolasyon protokolüne tabi tutarsanız oda sıcaklığında muhafaza edin.
NOT: Numune 3 saat içinde kullanılamıyorsa, toprağı karanlık koşullarda oda sıcaklığında saklayın. Deney hemen yapılmazsa, toprak örneği protokolün başlangıcına kadar 1 hafta boyunca 4 °C'de saklanabilir18,19.
- Yüzey toprağının 1 cm'lik kısmını çıkarın ve ardından her örnekleme alanından bir kürek kullanarak toprağı 5-10 cm derinlikte toplayın.
- EPF'yi yemek kurdu ile yemleme ve izole etme (Tenebrio molitor)
- Toprak örneğinin 100 g'ını plastik bir kaba yerleştirin (kapak çapı = 8,5 cm, yükseklik = 12,5 cm) ve ardından 2 hafta boyunca karanlıkta oda sıcaklığında toprak yüzeyine 5 yemek kurdu yerleştirin.
NOT: Diğer plastik bardak kapları da kullanılabilir. Topraklar çok kuruysa (çatlak veya kumlu), topraklara sterilize edilmiş ddH2O (yaklaşık 5-10 mL) püskürtün. T. molitor larvalarının vücut uzunluğu c.a. 2.5 cm (14. instar) mantar izole ekranlarında yardımcı olur20. - Larvaları mortalite ve mikoz için günlük olarak gözlemleyin ve kaydedin; ölü larvaları mantar izolasyonu için 2 haftaya kadar bardakta tutun.
NOT: Toprak örneklerindeki mantar konidia sporları, yukarıdaki işlem sırasında yemek kurdu larvalarına yapışacaktır. Mantar mikozu, hyphae intersegmental membrandan büyüdükçe gözlenecek ve daha sonra tüm vücut miselyum ile kaplanacaktır. Sporülasyon 7 gün sonra başlayacak ve mantar enfeksiyonunun rengi konidia kütlesinin rengine değişecektir. - Ölü böcekleri temiz bir banka aktarın ve konidia toplamak için steril bir kürdan kullanın. Laboratuvarda çeyrek mukavemetli Sabouraud dekstroz agar orta (1/4 SDA) plaka (55 mm) üzerinde çizgi21. Mantarların birincil kültürünü elde etmek için kültür plakasını 7 gün boyunca 25 ° C'de kuluçkaya yatırın.
NOT: 1/4 SDA plakası aşağıdaki gibi hazırlanır: 200 mL H2O'da 1,5 g Sabouraud dekstroz suyu ve 3 g agar karıştırın ve ardından 20 dakika sterilize edin. Katılaşmadan önce her 55 mm Petri kabına Aliquot 1/4 SDA. Katılaştırılmış 1/4 SDA plakalar kullanıma kadar 4 °C'de saklanır. - Her birincil kültür mantarını laminer bir akışta bir 55 mm 1/4 SDA plakasında yeniden çizin ve tek bir mantar kolonisi elde etmek için kültür plakasını 7 gün boyunca 25 °C'de kuluçkaya yatırın.
- Bu yeniden izolasyonu ~2-3 kez tekrarlayın ve tek ve saf morfolojik mantar kolonileri elde etmek için ışık mikroskopisi altında gözlemleyin.
NOT: T. molitor-bait kullanarak tüm EPF'yi izole edin ve aşağıdaki bölümde açıklandığı gibi saklayın. Ayırma, koruma, saf kültür ve çizgileme sonraki bölümlerde laminer bir akışta yapılmalıdır.
- Toprak örneğinin 100 g'ını plastik bir kaba yerleştirin (kapak çapı = 8,5 cm, yükseklik = 12,5 cm) ve ardından 2 hafta boyunca karanlıkta oda sıcaklığında toprak yüzeyine 5 yemek kurdu yerleştirin.
- EPF yalıtlarını depolama
- Her izole saf mantar kültürlü plakanın kenarındaki 5 mm'lik agar bloklarından 3'ünü mantar boreriyle kesin ve bir kopya olarak 1,5 mL mikro santrifüj tüpüne yerleştirin.
NOT: 2. virülans testinden sonra EPF suşlarının depolanması için her mantar yalıtımı için üç çoğaltma önerilir. Depolama alanı sınırlıysa moleküler tanımlama da önerilir. - Bir mikropipette kullanarak 1,5 mL mikro santrifüj tüpüne 250 μL% 0,03 yüzey aktif çözelti (Malzeme Tablosu) ve 250 μL% 60 gliseol ekleyin; sonra, 10 s için girdap.
- 1,5 mL mikro santrifüj tüpünü parafin filmi ile kapatın ve 24 saat boyunca -20 °C buzdolabında ön soğutmayın. Daha sonra, önceden havalandırılmış mantar stoklarını kriyoprezervasyon için -80 °C buzdolabına aktarın.
NOT: Bölüm 1.4'te ekstra saf mantar kültürü plakaları (kriyo ile korunmuş örneklerin yanı sıra) kullanılmıştır.
- Her izole saf mantar kültürlü plakanın kenarındaki 5 mm'lik agar bloklarından 3'ünü mantar boreriyle kesin ve bir kopya olarak 1,5 mL mikro santrifüj tüpüne yerleştirin.
- Mantar izoleleri için 1. patojeniklik ekranı
- Beş T. molitor larvasını doğrudan 25 ° C'deki her saf mantar kültür plakasının yüzeyine yerleştirin.
- Mikozu ve mortaliteyi 10 gün boyunca gözlemleyin ve kaydedin. Daha fazla analiz için mantar izole seçin.
NOT: %100 mortaliteye neden olan mantar izolatları, T. molitor larvalarına virülanslarını doğrulamak için 2. virülans testi için seçilir. Alternatif olarak, araştırmacı kriterleri kendi çalışmalarına göre ayarlayabilir.
- Mantar izolatlarının 2. virülans testi
NOT: 1. patojenite ekranına dayanarak, seçilen mantar izolatlarını 2. virülans testi için -80 °C'den kurtarın. 2. virülans testinin amacı, seçilen mantar izolatlarının 1.- Her mantarın konidiasını 1 dakika boyunca girdapla izole edin ve bir hemositometre kullanarak konidia sayısını sayın.
- Konidia süspansiyonu% 0,03 yüzey aktif çözeltisinde (Malzeme Tablosu) 1 x 107 konidia/ mL konsantrasyonuna ayarlayın.
- Mantar süspansiyonunun 10 μL'lik kısmını 55 mm 1/4 SDA plakaya yayın ve karanlıkta 25 °C'de 7 gün boyunca büyüyün.
- Beş T. molitor larvasını doğrudan her saf mantar kültür plakasının yüzeyine yerleştirin (c.a. 6 x 107 conidia). Plakaları parafin filmi ile kapatın ve karanlıkta 25 °C'de kuluçkaya yatırın.
- Mikozu ve mortaliteyi 10 gün boyunca gözlemleyin ve kaydedin.
- Her mantar izolesi için testi (adım 1.51'den 1.5.5'e) üç taraflı olarak tekrarlayın.
NOT: %100 mortaliteye neden olan mantar izolatları, zararlıyı hedeflemek için virülanslarını doğrulamak için 3.
- Hedef haşere için mantar izolelerinin 3. virülans testi (örnek olarak Spodoptera litura )
- Hedef zararlılara karşı virülansı test etmek için 2. virülanstan seçilen izolatlarla 1.5.2 ile 1.5.6 adımlarını tekrarlayın.
- Her mantar izolesinin LT50'sini hesaplayın22.
NOT: Her mantar izolatının LT50'si , R stüdyosu (sürüm 3.4.1) kullanılarak genelleştirilmiş doğrusal modeller (GLM'ler) aracılığıyla hesaplanmıştır; yarıbinomial hata dağılımı ve günlük bağlantısı işlevi, aşırı dağıtımı hesaba katmak için kullanılabilir.
2. EPF'nin moleküler tanımlaması
- Mantar genomik DNA'sının çıkarılması
- 7 günlük 1/4 SDA plakadan c.a. 1 cm2 EPF toplayın.
- Mantar genomik DNA'sını, üreticinin talimatlarına göre bir mantar genomik DNA ekstraksiyon kiti kullanarak çıkarın23 (Malzeme Masası).
- PCR amplifikasyonu ve DNA dizilimi
- Aşağıdaki PCR programı ile PCR Master Mix (2x), ITS1F /ITS4R astar seti24 (Tablo 1) kullanarak DNA örneğinin PCR'si ile Fungal ITS bölgesini güçlendirin: 1 dakika için 94 °C, ve ardından 30 s için 94 °C 35 döngü, 30 s için 55 °C ve 1 dakika için 72 °C, ardından 72 °C'de 7 dakikalık son uzatma.
NOT: ITS1F/ITS4R astar seti cins seviyesi tanımlaması içindir. - PCR'yi ticari sıralama hizmetine göre sıralayın.
- NCBI veritabanında benzer mantarlar için NCBI BLAST aramasını kullanın ve filogenetik analiz için göreli mantar türü türlerini seçin.
NOT: Metarhizium veya Beauveria cinsine ait mantar türleri tef-983F/tef-2218R astar seti25 ile tür seviyesine daha fazla tanımlanmalıdır (2.1.1 ila 2.2.3 arası tekrar adımlar). Metarhizium veya Beauveria cinsine ait olmayan mantarlar için, DNA lyase (APN2), beta tubulin (BTUB), RNA polimeraz II en büyük alt ünlem (RPB1), RNA polimeraz II ikinci büyük alt bira (RPB2) ve çeviri uzama faktörü 1 alfanın (TEF)3' kısmı dahil olmak üzere türleri tanımlamak için diğer moleküler belirteçler kullanılabilir. .
- Aşağıdaki PCR programı ile PCR Master Mix (2x), ITS1F /ITS4R astar seti24 (Tablo 1) kullanarak DNA örneğinin PCR'si ile Fungal ITS bölgesini güçlendirin: 1 dakika için 94 °C, ve ardından 30 s için 94 °C 35 döngü, 30 s için 55 °C ve 1 dakika için 72 °C, ardından 72 °C'de 7 dakikalık son uzatma.
- Filogenetik analiz
- 2.2.2 ve 2.2.3 adımlarındaki birden çok diziyi hizalamak için ClustalX 2.1 software27'yi kullanın. GeneDoc28 ile rezerve edilen diziler bölgesini manuel olarak kırpın.
- Mega7 software29 tarafından yapılan filogenetik analizi minimum evrim (ME), Komşu Birleştirme (NJ) ve maksimum olasılık (ML) yöntemlerine göre gerçekleştirin.
NOT: Her üç yöntemin de gerçekleştirilmesi, sınıflandırma durumunun onaylanmasına ve doğru bir şekilde sonuçlandırılmasına yardımcı olabilir. 1. patojenite ekranı tarafından taranılan mantar izolatları cins düzeyinde moleküler tanımlama için kullanılır. 2. virülans testi ile taranan mantar izolatları tür düzeyinde moleküler ve morfolojik tanımlama için kullanılır.
3. EPF'nin morfolojik tanımlaması
- Mantar kolonisi morfolojisinin gözlemlenmesi
- Mantar kültürü koloni büyümesini 7 gün boyunca yakalamak ve kolonilerin büyümesini, formunu (kabarık, sıkı) ve rengini kaydetmek için bir kamera kullanın.
- Konidia ve konidiophores gözlemi
- Konidia'yı aşı döngüsü ile saf kültür mantar kolonisinden kazıyın ve sporları% 0.1 Tween 80 çözeltisi ile cam bir kaydırağa aktarın. Daha sonra, konidianın hafif mikroskobik gözlemi için bir kapakla örtün.
- Mantar kolonisinin kenarındaki hyphal telinin 5 mm2'lik bir agar bloğunu kesmek için bir neşter kullanın ve ardından agar bloğunu cam bir kaydırağa aktarın.
- Temizliği aşağıdaki gibi yapın: Agar bloğuna% 0.1 Ara 80 çözeltisini plastik bir damlalık ile ekleyin ve fazla konidianın çoğunu cımbız kullanarak yıkayın. Ardından, hafifmikroskopik gözlem için bir kapakla örtün.
NOT: %0,1 Ara 80, mantar türlere ve hidrofobikliğe bağlı olarak başka bir güçlü yüzey aktif madde (Malzeme Masası) ile değiştirilebilir. - Farklı mantar izolatları arasındaki farkları karşılaştırmak için konidia ve konidiophores'un genişliğini ve uzunluğunu ölçün ve kaydedin.
- R stüdyosu (sürüm 3.4.1) kullanarak her bir gerinimin konidiyal genişliğini ve uzunluğunu analiz etmek için Welch'in ANOVA testini ve Games-Howell testini (post-hoc testi) kullanın.
NOT: Morfolojik karakterlerin veri analizi vakalara göre ayarlanabilir. 3. virülans testi ile taranan mantar izolatları, 4. ve 5. bölümlerde fizyolojik karakterizasyon ve ECN sıralaması için kullanılmaktadır.
4. Konidiyal verimlilik ve termotolerans araştırması
- Conidial üretim tahlil
- Seçilen mantarı 10 gün boyunca karanlıkta 25 ± 1 °C'de 1/4 SDA ortamında kültüre edin.
- Mantar izolesinin konidial süspansiyonunun 1 mL'sini% 0,03 yüzey aktif çözeltide hazırlayın ve yukarıda açıklandığı gibi 1 x 107 konidia / mL'ye ayarlayın.
- 1/4 SDA'ya 10 μL konidial süspansiyondan oluşan üç damlacık bırakın ve mantarların sporülasyonunu saymak için 7, 10 ve 14 gün boyunca karanlıkta 25 °C'de kuluçkaya yatırın.
NOT: 10 μL, 7-14 gün boyunca mantar büyümesinden sonra mantar sporülasyonu ile 5 mm bloğu toplamak için en iyi hacimdir. - Mantar borerini kullanarak 5 mm'lik agar bloğunu koloninin merkezinden ayırın ve her zaman noktasında 1,5 mL mikro santrifüj tüpünde %0,03 yüzey aktif çözeltisinin (Malzeme Masası) 1 mL'sine aktarın.
- Tüp 15 dakika boyunca oda sıcaklığında 3.000 rpm'de girdap ve konidia sayısını saymak için bir hemositometre kullanın.
NOT: Sayım için kullanılan formül, en küçük hücrenin 25 karesi başına konidia sayısıdır (boyut = 0,025 mm2; oda derinliği = 0,1 mm):
5 karede toplam conidia no ÷ 80 × (4 × 106) - Her ayırma için üç kez tekrarlayın.
- Termotolerans tahlil
- Seçilen mantarı 10 gün boyunca karanlıkta 25 ± 1 °C'de 1/4 SDA ortamında kültüre edin.
- Mantar izolesinin konidial süspansiyonunun 1 mL'sini% 0,03 yüzey aktif çözeltide hazırlayın ve yukarıda açıklandığı gibi 1 x 107 konidia / mL'ye ayarlayın.
- Konidial süspansiyonu vorteks edin ve 45 °C kuru banyoda 0, 30, 60, 90 ve 120 dakika ısıtın. 55 mm 1/4 SDA ortamına 5 μL'lik üç damlacık bırakın ve ısıya maruz kalma sonrası her zaman noktasında 18 saat boyunca 25 ± 1 °C'de kuluçkaya yatırın.
NOT: Bölgeye daha iyi odaklanabilmek için mantar damlacıklarını yaymaktan kaçının. - Çimlenme oranını belirlemek için 200x ışık mikroskopisi altında rastgele seçilmiş beş alana sahip çimlenmiş konidia sporlarının sayısını sayın.
- Her yalıt için üç çoğaltma gerçekleştirin.
5. Etkili konidia sayısı (ECN) sıralaması
- ECN hesaplaması
NOT: Toplam ECN21'i hesaplamadan önce her potansiyel mantar suşunun konidiyal üretim ve termotolerans verilerini elde edin.- Her zaman noktasında konidial üretimin kat değişimini (FC) hesaplayın:

burada, x = veri toplama için zaman noktası; ncp = büyümenin her gününden sonra konidia sayısı; ve I = tohumlu conidia'nın ilk sayısı. - Aşağıdaki formülü kullanarak her zaman noktasında stres tedavisi altındaki conidia numarasını hesaplayın:

Nerede, y = tedavi altındaki zaman noktasının ECN'si; TT0 = ısı stresine maruz olmayan konidia çimlenme oranı (= 0 dk ısıl işlem çimlenme oranı); TTz = stres katsayısı, farklı ısıl işlem zamanlarında konidia çimlenme oranıdır (z). - Aşağıdaki formülü kullanarak toplam ECN'yi hesaplayın:

- Her mantar suşunun ECN'sini karşılaştırın.
- Her zaman noktasında konidial üretimin kat değişimini (FC) hesaplayın:
- Mantar suşlarının ana bileşen analizi (PCA)
NOT: PCA analizi ECN'nin sıralamasını doğrular ve fizyolojik karakter değerleri arasındaki korelasyonun anlaşılmasına yardımcı olur. ECN değerlerini karşılaştırın ve daha yüksek ECN değerlerine sahip EPF yalıtlarını seçin. - Kodlama ile PCA oluşturmak için R yazılımını kullanın:
PCA veri dosyasını #Input
a = read.table("PCA.csv",sep=',',header=T)- # Örnek veriler işlenerek
row.names(a) <- c("NCHU-9","NCHU-11", "NCHU-64", "NCHU-69", "NCHU-95", "NCHU-113")
X=satır.adları(a)
df<- a[2:11] - #PCA hesaplama
pca <- prcomp(df, merkez = DOĞRU, ölçek = DOĞRU)
vars <- (pca$sdev)^2
pc1_percent = vars[1] / sum(vars)
pc2_percent = vars[2] / sum(vars)
değer = pca$x - PCA görselleştirme dosyasını #Output
png(dosya = 'pca.png', yükseklik = 2000, genişlik = 2000, res = 300)
NOT: ECN sıralamasını onaylamak için ana bileşen analizini (PCA) yürütmek için 7 ila 14 gün düzenli üretim ve tüm termotolerans verilerini kullanın.
- # Örnek veriler işlenerek
- ECN veya PCA'ya dayalı en iyi performans gösteren mantar suşlarını seçin ve daha fazla araştırma için hedef zararlıların virülans testini gerçekleştirin.
Sonuçlar
Potansiyel Entomopathogenic mantarların izolasyonu ve seçimi (EPF)
Tenebrio molitor aracılı Entomopathogenic mantarlar (EPF) kütüphane yapım yöntemi kullanılarak, böcek öldürme aktivitesi olmayan mantarların sayısı hariç tutulur; böylece, EPF'nin izolasyon verimliliği ve seçimi büyük ölçüde artırılabilir. Bu yöntemin uygulanması sırasında örnekleme alanlarının bilgileri, toprak örnekleri ve mantar çimlenme oranları kaydedilmiştir (Tablo 2). Önceki verilerimize dayanarak, 172 toprak örneğinden toplam 101 mantar izolat elde edildi ve bu da% 64'lük yüksek bir izolasyon verimliliğine işaret etti. 101 mantar izolatları arasında, 26 izolat 1. patojeniklik taramasından sonra T. molitor'a (%100 mortalite) karşı insektisidal aktivite gösterdi, bu nedenle mantar izolatlarının ortadan kaldırılması 26/101 = % 25.7 idi. 2. virülans testinde, 26 mantar izolatının T. molitor'a karşı yüksek virülansı daha da gösterilmiştir, bunlardan 12'si T. molitor larvalarına karşı yüksek patojeniklik göstermiştir (aşılama sonrası 5 günde% 100 mortalite) (Şekil 2A). Bunlar, tarım zararlılarına karşı virülans testini değerlendirmek için kullanıldı. 3. virülans testi mortalitesi ve LT50 verilerine dayanarak, toplam altı mantar izolatları (NCHU-9, 11, 64, 69, 95 ve 113), fizyolojik test ve etkili konidia sayısı (ECN) kullanılarak değerlendirilen Spodoptera litura (LT50 = 2.94, 2.22, 2.84, 2.57, 2.96 ve 1.13) karşısında hızlı böcek öldürme aktivitesi ortaya koydu .şekil olarak değerlendirildi.
EPF'nin moleküler tanımlaması
Mantar taksonomik pozisyonlarını daha iyi anlamak için 1. patojenite taramasından 26 izolat ITS bölgesine dayalı moleküler analize tabi tutulmuştır (Şekil 3A). Sonuç, bu mantar izolatlarının Beauveria, Clonostachys, Fusarium, Cordyceps, Penicillium, Purpureocillium ve Metarhizium dahil olmak üzere yedi cinse açıkça ayrılabileceğini göstermiştir (Şekil 3A). ITS1-5.8S-ITS2 bölgesine dayanarak, EPF cinsi sınıflandırması doğru bir şekilde doğrulanırken, tür seviyesi hala ayırt edilemez. Bu nedenle, tef bölgesinin sırası, tarım zararlılarına karşı virülans testinden izole edilen 12 umut verici EPF için tür seviyesini açıkça sınıflandırmak için kullanılır. 12 izolatın moleküler tanımlaması, 11 izolatın Metarhizium'a ait olduğunu ve M. lepidiotae (NCHU-9, NCHU-102), M. pinghaense (NCHU-10, NCHU-11, NCHU-30, NCHU-32, NCHU-64), M. brunneum (NCHU-27, NCHU-29) ve M. anisopliae (NCHU-69, NCHU-95). Kalan izolat B. australis (NCHU-113) (Şekil 3B,C) olarak tanımlanmıştır. Yukarıdaki sonuca göre, tef dizi bölgesi Metarhizium cinsini tür düzeyinde etkili bir şekilde ayırt edebilirken, diğer türlerin türleri ayırt etmek için moleküler belirteçler olarak diğer dizi bölgelerini bulması gerekir.
EPF'nin morfolojik tanımlaması
Mantar morfolojik gözlemlerinin temizleme yöntemi (adım 3.2.3) sayesinde, konidiophores yapıları% 0.1 Ara 80 çözeltisi (Şekil 4A) ile net bir şekilde görülebilir ve bu gözlemler yapının boyutunu ölçmek ve bir fotoğraf kaydı almak için bir ölçüt görevi görebilir. Konidianın rengi, şekli ve düzeni, koloni konidiasının mikroskobik gözlemleri ile görülebilir (Şekil 4B,C). Gözlemden sonra, konidia ve konidiophore şekillerinin boyutları daha da ölçülebilir ve istatistiksel olarak karşılaştırılabilir (Tablo 3).
Konidiyal verimliliğin araştırılması, termotolerans ve ECN sıralaması
Önceki rapor21 tarafından önerilen ECN formülü, yüksek stres toleranslı EPF tabanlı fizyolojik karakterin seçilmesine yardımcı olabilir. ECN, her EPF'nin konidia üretimi ve termotolerans verilerini birleştirir (Şekil 5A,B), ECN değeri yüksek olduğunda mantar suşunun yüksek canlılığı anlamına gelir (Şekil 5). Ayrıca, ECN formülünden elde edilen sonuçları doğrulamak için ana bileşen analizi (PCA) görselleştirmesi kullanılmıştır. Sonuç, PCA ve ECN arasında yüksek bir koordinasyon olduğunu ortaya koydu ve ECN formülünün canlılıkla ilgili parametrelerin hiyerarşisini ve mantarların saha uygulaması ve daha fazla ticarileştirmeye yönelik gelişme potansiyelini değerlendirmek için kullanılabileceğini düşündürdü (Şekil 5C, D).

Şekil 1: Tenebrio molitor aracılı Entomopathogenic mantar (EPF) kütüphane yapımının illüstrasyonu. Bölüm 1: Toprak örneğinden mantar izolasyonu; Bölüm 2: Patojenite ve virülans bazlı tarama ve mantar tanımlama; Bölüm 3. Fizyolojik karakterizasyon ve mantar sıralaması. ECN = Etkili konidia sayısı; ve PCA = Ana bileşen analizi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
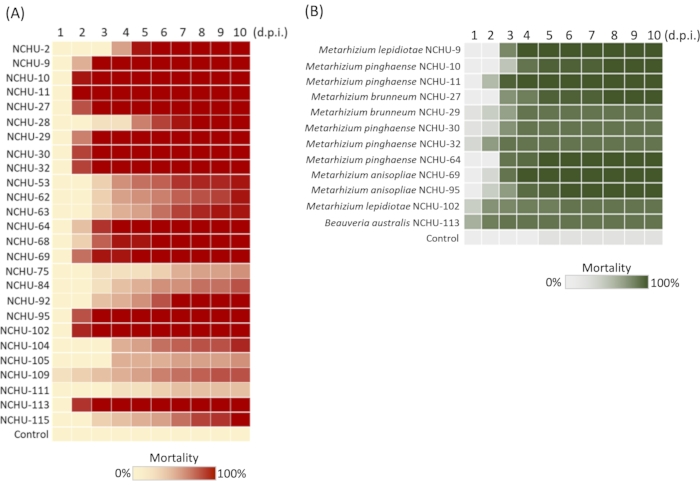
Şekil 2: Umut verici Entomopathogenic mantarların (EPF) seçimi için yemek kurtlarının ve Spodoptera liturasının mortalitesi izole edilir. (A) 26 seçilmiş mantar 2. 12 hızlı öldürme ve yüksek virülans mantar izolatlarının mikozları paralel olarak gösterilmiştir. (B) S. litura'ya karşı virülans testi için 12 mantar izolat seçildi. Her mantar suşu üzerinde test üç kez tekrarlandı. d.p.i. = aşılama sonrası gün. Modifiye şekil ve gösterge Fronteris21'in izniyle yeniden üretildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
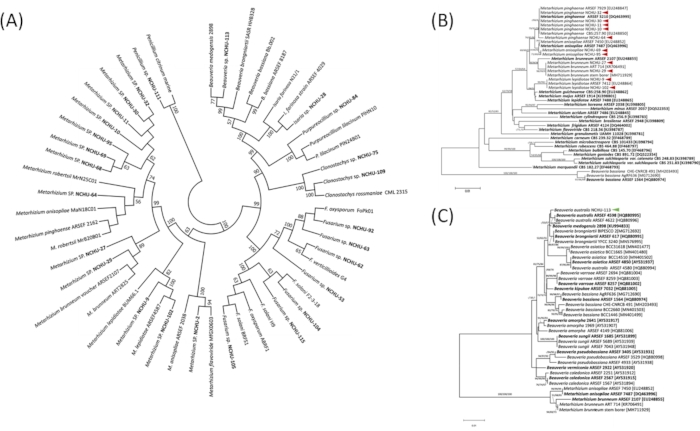
Şekil 3:Entomopathogenic mantarların (EPF) filogenetik analizi, ITS bölgesine ve (B-C) Türler düzeyinde tef'e dayalı olarak (A) Cins düzeyinde suşlar. ITS bölgesi ve tef'in filogenetik analizi maksimum olasılık (ML), minimum evrim (ME) ve komşu birleştirme (NJ) yöntemleri kullanılarak oluşturulmuştır. 1.000 kopya kullanılarak filogenelerin sağlamlığını değerlendirmek için bootstrap analizleri yapıldı ve dalların üzerinde %50'den büyük bootstrap oranları belirtilmiştir. Kalın = Eski tip suşlar. Kırmızı ve yeşil oklar gelecek vaat eden EPF'yi gösterir. Modifiye şekil ve gösterge Fronteris21'in izniyle yeniden üretildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Entomopatojenik mantarların (EPF) (M. anisopliae) morfolojisinin mikroskobik incelemesi. Yıkamadan sonra konidiophores (A) gözlemi. (B) Konidia şekli ve renginin gözlemlenmesi. (C) M. anisopliae'nin konidia ve spor dizeleri (SS) demetlerinin düzenlenmesi; Cp = konidiophores; cc = silindirik konidia. Ölçek çubuğu = 10 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: Altı potansiyel izolatın fizyolojik karakterizasyonu ve etkili konidia sayısı (ECN) analizi. (A) Konidial üretim tahlili. (B) Termotolerans tahlil. (C) ECN değerlerinin çubuk arsası. (D) Ana bileşen analizi her bir gerinimin dağılımını gösterdi. Modifiye şekil ve gösterge Fronteris21'in izniyle yeniden üretildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Astar adı | Amplicon Boyutu (bp) | Sıra(5'-3') | Bölge | Referans | |
| ITS1F | 550 | TCCGTAGGTGAACCTGCGG | ONUN | 25 | |
| ITS4R | TCCTCCGCTTATTGATATGC | ||||
| tef-983F | 1000 | GCYCCYGGHCAYCGTGAYTTYAT | Tef | 26, 27, 41, 42 | |
| tef-2218R | ATGACACCRACRGCRACRGTYTG | ||||
Tablo 1: Mantar tanımlama için astar çiftleri.
Tablo 2: Tenebrio molitor aracılı EPF kütüphane yapım yöntemi için kaydedilen parametreler aşağıda listelenmiştir. NIU = Ulusal ilan Üniversitesi kampüsü. NCHU = Ulusal Chung Hsing Üniversitesi kampüsü. Değiştirilmiş tablo ve gösterge Fronteris21'in izniyle yeniden üretildi. Bu Tabloyu indirmek için lütfen tıklayınız.
| Tür | Soy | Phialides μm±SD* | Conidia μm±SD* |
| Metarhizium lepidiotae | NCHU-9 | Silindirik, 7.3±0.67b×2.4±0.36a | Silindirik, 6.5±0.45a×2.7±0.13b |
| Metarhizium pinghaense | NCHU-11 | Silindirik, 8.6±0.68ab×2.6±0.30a | Silindirik, 6.3±0.41b×2.7±0.16b |
| Metarhizium pinghaense | NCHU-64 | Silindirik, 10±5±1.54a×2.4±0.32a | Silindirik, 6.8±0.53a×2.9±0.31a |
| Metarhizium anisopliae | NCHU-69 | Silindirik, 9.4±1.58a×2.7±0.32a | Silindirik, 6.3±0.34b×2.6±0.19b |
| Metarhizium anisopliae | NCHU-95 | Silindirik, 9.6±0.87a×2.6±0.29a | Silindirik, 6.0±0.82b×2.9±0.29a |
| Beauveria australis | NCHU-113 | Elipsoid, NA×2.6±0.57 | Globose, 2.3±0.24×2.3±0.24 |
| *İstatistiksel analizler Welch'in ANOVA testini temel alarak R stüdyosu kullanılarak gerçeklendirilmiştır. | |||
| § Fronteris'in izniyle değiştirilmiş tablo ve gösterge çoğaltıldı (23). | |||
Tablo 3: Altı umut verici entomopatojenik mantar izolatının morfolojik gözlemlerine bir örnek. İstatistiksel analiz, Welch'in ANOVA testini temel alarak R stüdyosu kullanılarak gerçekleştirildi. Değiştirilmiş tablo ve gösterge Fronteris21'in izniyle yeniden üretildi.
Tartışmalar
Böcek kontrolü için entomopatojenik mantarlar (EPF) kullanılmıştır. EPF30,31,32'yi yalıtmak, seçmek ve tanımlamak için çeşitli yöntemler vardır. Farklı böcek yem yöntemlerini karşılaştıran Beauveria bassiana ve Metarhizium anisopliae genellikle böcek yemlerinde bulundu6,12,13,14. Bu böcek yemleri arasında Galleria mellonella ve Tenebrio molitor, Beauveria ve Metarhizium spp'nin yüksek iyileşme oranlarını gösterdi. Nitekim EPF'nin toprak örneklerinden izolesi için bir kolaylık yöntemi olarak yemek kurdu (T. molitor)-bait yönteminin faydası gösterilmiştir17,21. Bununla birlikte, yem olarak kullanılan böceklerin belirli mantar türlerini izole etmek için önyargıyı göstereceği bildirilmiştir3,33. Bu nedenle, EPF'yi toprak örneklerinden yemlemek için farklı böcek türlerinin (yani Galleria mellonella ve T. molitor birlikte) kombinasyonu EPF34'ün çeşitliliğini artırabilir.
Böcek öldürme aktivitesini değerlendirmek için, daha fazla çalışma için gelecek vaat eden mantar suşlarını seçmek için mevcut protokolde yemek kurdu (T. molitor) tarafından iki tur tarama vardır. Bu işlemi takiben, toprak örneklerinden izole edilen mantar izolelerinin sayısı önemli ölçüde azaltılabilir ve 1. ve 2. taramadan sonra yüksek böcek öldürücü aktivite gösteren mantar izoleleri ile sınırlandırılabilir. Bir sonraki tarama turu için mantar izolelerinin büyük ölçüde azaltılması zaman maliyetinden ve emek tüketenden tasarruf sağlar. Seçilen mantar izolatlarının, yemek kurdu (T. molitor) ve tütün kesme kurdu (Spodoptera litura) arasında benzer patojeniklik eğilimleri gösterdiği ve farklı böcek türlerinin patojenitesinin tutarlı bir şekilde test edildiğini gösterdiği ve diğer mahsul zararlılarına daha da genişletilebileceği de belirtilebilir21. Ek olarak, ECN'nin fizyolojik testlere dayanarak hesaplanması, mahsul alanlarında kullanılacak potansiyel mantar suşlarının seçimini kolaylaştırabilir. Diğer raporlarda da benzer seçici yöntemlerden bahsedilirken, abiyotik ve gerinim özellikleri gibi faktörlere yer verilmiştir12,8,31,35,36,37. Bu nedenle, bu suşlar mantar çimlenmesinin performansı üzerinde bir etkiye ve böylece ticarileştirilmesine neden olan çevresel faktörlerden etkilenebilir. Bu sonuç aynı zamanda sahadaki laboratuvar suşlarının uygulanamamasının ana nedenidir38.
Morfolojik tanımlamadan, konidiophore'un net yapısını bulmaya ve her mantar suşunun farklı özelliklerini gözlemlemeye yönelik daha fazla çaba gösterilmelidir. Çalışmalar zor morfolojik tanımlamayı çözmek için çeşitli yöntemler içerebilir39. Bununla birlikte, morfolojik tanımlama yakından ilişkili mantar türlerini ayırt edemez; bu nedenle, moleküler tanımlama verilerini entegre etmek gerekir. İç transkriptli ara (ITS) bölgesi cins düzeyinde ayrımcılık gösterirken, tür seviyesindeki tanımlama için diğer moleküler belirteçlere (yani, Metarhizium için tef, Beauveria bloğu) ihtiyaç duyulmaktadır26,40,41.
Fizyolojik karakterizasyonda, deneylerin standart sapmasını azaltmak için, maks. rpm'de en az 10 dakika boyunca makine veya manuel girdap önerilir21. İyice karıştırılan konidia süspansiyonu, termotolerans tahlil ve konidial üretim test sonuçlarının tutarlılığını artıracaktır. Öte yandan, konidial üretim tahlilinde, farklı zamanda kültürlü plaka üzerinde sabit bir alan altında (bu çalışmada mantar kolonisinin orta kısmında 5 mm blok) sayılan konidia sayısı, farklı mantar türlerinin ve hatta farklı suşların hyphae'nin büyüme kompaktlığının farklı performansını ortaya çıkardığı sorununu gündeme getirmiştir, bu da örneklemenin temsil edilmemesine neden olabilir. Bu nedenle, konidia üretimi için titiz bir test yöntemi, tüm mantar kolonisinin konidia sayısını doğru bir şekilde saymak ve büyüme alanıyla normalleşmek gibi sorunu iyileştirebilir42.
Etkili konidia sayısı (ECN) formülü, EPF konidia karşı çevresel stresin etkisine dayanarak tasarlanmıştır, yani ticarileştirme için umut verici mantar suşlarını seçmek için vahşi ortam koşulu altında konidia simüle eder21. Bu protokolde, konidia üretimi ve ısıl işlem verileri, önceki çalışmadan sonra gelecek vaat eden her mantar suşunun toplam ECN değerinin hesaplanmasında kullanılmıştır21. Ayrıca, sıcaklık dışında doğal bir ortamda, nem, ultraviyole radyasyon (UV) ve konakçı gibi diğer çevresel stres konidia çimlenmesini etkileyebilir. Özellikle, UV stresi konidia çimlenmesini etkileyen ana faktördür, çünkü UV tarafından üretilen yüksek enerjili serbest radikaller (peroksitler, hidroksil grupları ve singlet oksijen gibi) patojenikliği ve mikrobiyal pestisitlerin kalıcılığını azaltabilir43. Böylece, UV stresi gelecekte ECN formülüne daha da dahil edilebilir. UV stresini önlemek için, formül konidia44,45,46 UV toleransını artırmak için yağ veya sodyum aljinat içermelidir, bu da potansiyel suşların haşere kontrolü için pratikliğe sahip olduğunu doğrular47.
Mevcut protokol, T. molitor aracılı EPF kütüphanesi oluşturmak için potansiyel EPF suşlarının hızlı ve hassas bir şekilde yalıtilmesi için bir yöntem sağlamıştır. Bu temeldir ve biyolojik kontrol araştırmalarının geliştirilmesi için gereklidir. Ayrıca, ECN formülü, araştırmacıların EPF'nin potansiyelini kavramalarına ve tarım sistemlerinde kullanılmak üzere bir meta haline geliştirmelerine yardımcı olmak için esnek bir şekilde geliştirilebilir.
Açıklamalar
Yazarlar bu çalışmada çıkar çatışması olmadığını beyanlarlar.
Teşekkürler
Bu araştırma Bilim ve Teknoloji Bakanlığı'ndan (MOST) Grant 109-2313-B-005 -048 -MY3 tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agar Bacteriological grade | BIOMAN SCIENTIFIC Co., Ltd. | AGR001 | Suitable in most cell culture/molecular, biology applications. |
| AGAROSE, Biotechnology Grade | BIOMAN SCIENTIFIC Co., Ltd. | AGA001 | For DNA electrophoresis. |
| BioGreen Safe DNA Gel Buffer | BIOMAN | SDB001T | |
| Brass cork borer | Dogger | D89A-44001 | |
| Canon kiss x2 | Canon | EOS 450D | For record strain colony morphology |
| Constant temperature incubator | Yihder Co., Ltd. | LE-509RD | Fungal keeping. |
| cubee Mini-Centrifuge | GeneReach | MC-CUBEE | |
| DigiGel 10 Digital Gel Image System | TOPBIO | DGIS-12S | |
| Finnpipette F2 0.2 to 2 µL Pipette | Thermo Scientific | 4642010 | |
| Finnpipette F2 1 to 10 µL Pipette | Thermo Scientific | 4642030 | |
| Finnpipette F2 10 to 100 µL Pipette | Thermo Scientific | 4642070 | |
| Finnpipette F2 100 to 1000 µL Pipette | Thermo Scientific | 4642090 | |
| Finnpipette F2 2 to 20 µL Pipette | Thermo Scientific | 4642060 | |
| Finnpipette F2 20 to 200 µL Pipette | Thermo Scientific | 4642080 | |
| GeneAmp PCR System 9700 | Applied Biosystems | 4342718 | |
| GenepHlow Gel/PCR Kit | Geneaid | DFH100 | |
| Genius Dry Bath Incubator | Major Science | MD-01N | |
| Graduated Cylinder Custom A 100mL | SIBATA | SABP-1195906 | Measure the volume of reagents. |
| Hand tally counter | SDI | NO.1055 | |
| Hemocytometer | bioman | AP-0650010 | Calculate the number of spore |
| Inoculating loop | Dogger | D8GA-23000 | |
| lid | IDEAHOUSE | RS92004 | |
| Micro cover glass | MUTO PURE CHEMICALS CO.,LTD | 24241 | |
| Microscope imaging system | SAGE VISION CO.,LTD | SGHD-3.6C | |
| Microscope Slides | DOGGER | DG75001-07105 | |
| Mupid-2plus DNA Gel Electrophoresis | ADVANCE | AD110 | |
| Nikon optical microscope | SAGE VISION CO.,LTD | Eclipse CI-L | |
| Plastic cup | IDEAHOUSE | CS60016 | |
| Presto Mini gDNA Yeast Kit | Geneaid | GYBY300 | Fungal genomic DNA extraction kit |
| Sabouraud Dextrose Broth (Sabouraud Liquid Medium) | HiMedia Leading BioSciences Company | M033 | Used for cultivation of yeasts, moulds and aciduric microorganisms. |
| Scalpel Blade No.23 | Swann-Morton | 310 | |
| Scalpel Handle No.4 | AGARWAL SURGICALS | SSS -FOR-01-91 | |
| Shovel | Save & Safe | A -1580242 -00 | |
| Silwet L-77 | bioman(phytotech) | S7777 | Surfactant |
| Sorvall Legend Micro 17 Microcentrifuge | Thermo Scientific | 75002403 | |
| Steel Tweezers | SIPEL ELECTRONIC SA | GG-SA | |
| Sterile Petri Dish | BIOMAN SCIENTIFIC Co., Ltd. | 1621 | Shallow cylindrical containers with fitted lids, specifically for microbiology or cell culture use. |
| ThermoCell MixingBlock | BIOER | MB-101 | |
| Tween 80 | FUJIFILM Wako Pure Chemical Corporation | 164-21775 | |
| TwinGuard ULT Freezer | Panasonic Healthcare Holdings Co., Ltd. | MDF-DU302VX | -80°C sample stored. |
| Vertical floor type cabinet | Chih Chin | BSC-3 | Fungal operating culturing. |
| Vortex Genie II | Scientific | SIG560 | |
| Zipper storage bags | Save & Safe | A -1248915 -00 | |
| 100 bp DNA Ladder | Geneaid | DL007 | |
| -20°C Freezer | FRIGIDAIRE | Frigidaire FFFU21M1QW | -20°C sample and experimental reagents stored. |
| 2X SuperRed PCR Master Mix | TOOLS | TE-SR01 | |
| 50X TAE Buffer | BIOMAN | TAE501000 |
Referanslar
- Wraight, S. P., Carruthers, R. I. Biopesticides: use and Delivery. , Springer. 233-269 (1999).
- Chase, A., Osborne, L., Ferguson, V. Selective isolation of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae from an artificial potting medium. Florida Entomologist. , 285-292 (1986).
- Meyling, N. V. Methods for isolation of entomopathogenic fungi from the soil environment. University of Copenhagen. , Frederiksberg Denmark. Department of Ecology 1-18 (2007).
- Zimmermann, G. The 'Galleria bait method'for detection of entomopathogenic fungi in soil. Journal of applied Entomology. 102 (1-5), 213-215 (1986).
- Schneider, S., Widmer, F., Jacot, K., Kölliker, R., Enkerli, J. Spatial distribution of Metarhizium clade 1 in agricultural landscapes with arable land and different semi-natural habitats. Applied Soil Ecology. 52, 20-28 (2012).
- Hallouti, A., et al. Diversity of entomopathogenic fungi associated with Mediterranean fruit fly (Ceratitis capitata (Diptera: Tephritidae)) in Moroccan Argan forests and nearby area: impact of soil factors on their distribution. BMC Ecology. 20 (1), 1-13 (2020).
- Meyling, N. V., Eilenberg, J. Occurrence and distribution of soil borne entomopathogenic fungi within a single organic agroecosystem. Agriculture, Ecosystems and Environment. 113 (1-4), 336-341 (2006).
- Skalický, A., Bohatá, A., Šimková, J., Osborne, L. S., Landa, Z. Selection of indigenous isolates of entomopathogenic soil fungus Metarhizium anisopliae under laboratory conditions. Folia Microbiologica. 59 (4), 269-276 (2014).
- Veen, K., Ferron, P. A selective medium for the isolation of Beauveria tenella and of Metarrhizium anisopliae. Journal of Invertebrate Pathology. 8 (2), 268-269 (1966).
- Goettel, M., Inglis, D. Manual of Techniques in Insect Pathology. Lacy, L. , Academic. Amsterdam. 213-249 (1997).
- Luz, C., Netto, M. C. B., Rocha, L. F. N. In vitro susceptibility to fungicides by invertebrate-pathogenic and saprobic fungi. Mycopathologia. 164 (1), 39-47 (2007).
- Mantzoukas, S., et al. Trapping entomopathogenic fungi from vine terroir soil samples with insect baits for controlling serious pests. Applied Sciences. 10 (10), 3539(2020).
- Goble, T., Dames, J., Hill, M., Moore, S. The effects of farming system, habitat type and bait type on the isolation of entomopathogenic fungi from citrus soils in the Eastern Cape Province, South Africa. BioControl. 55 (3), 399-412 (2010).
- Nishi, O., Iiyama, K., Yasunaga-Aoki, C., Shimizu, S. Isolation of entomopathogenic fungi from soil by using bait method with termite, Reticulitermes speratus. Enotomotech. 35, 21-26 (2011).
- Castrillo, L. ARS Collection of Entomopathogenic Fungal Cultures (ARSEF). , (2014).
- Fungal database WorldWide Collection of Entomopathogenic Fungi. University of Vermont. , Available from: http://www.uvm.edu/~entlab/Fungus.html (2019).
- Kim, J. C., et al. Tenebrio molitor-mediated entomopathogenic fungal library construction for pest management. Journal of Asia-Pacific Entomology. 21 (1), 196-204 (2018).
- Keyser, C. A., Henrik, H., Steinwender, B. M., Meyling, N. V. Diversity within the entomopathogenic fungal species Metarhizium flavoviride associated with agricultural crops in Denmark. BMC Microbiology. 15 (1), 1-11 (2015).
- Quesada-Moraga, E., Navas-Cortés, J. A., Maranhao, E. A., Ortiz-Urquiza, A., Santiago-Álvarez, C. Factors affecting the occurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycological Research. 111 (8), 947-966 (2007).
- Park, J. B., et al. Developmental characteristics of Tenebrio molitor larvae (Coleoptera: Tenebrionidae) in different instars. International Journal of Industrial Entomology. 28 (1), 5-9 (2014).
- Chang, J. -C., et al. Construction and selection of an entomopathogenic fungal library from soil samples for controlling Spodoptera litura. Frontiers in Sustainable Food Systems. 5, 15(2021).
- Podder, D., Ghosh, S. K. A new application of Trichoderma asperellum as an anopheline larvicide for eco friendly management in medical science. Scientific reports. 9 (1), 1-15 (2019).
- Geneaid Biotech Ltd. Presto Mini gDNA Yeast, Ver. 04.27.17. , Available from: https://www.geneaid.com/data/files/1605664221308055331.pdf (2021).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR protocols: A guide to methods and applications. 18 (1), 315-322 (1990).
- Kepler, R. M., Humber, R. A., Bischoff, J. F., Rehner, S. A. Clarification of generic and species boundaries for Metarhizium and related fungi through multigene phylogenetics. Mycologia. 106 (4), 811-829 (2014).
- Kepler, R. M. A phylogenetically-based nomenclature for Cordycipitaceae (Hypocreales). IMA Fungus. 8 (2), 335-353 (2017).
- National Resource for Biomedical Supercomputing. GeneDoc: a tool for editing and annotating multiple sequence alignments. Pittsburgh Supercomputing Center's National Resource for Biomedical Supercomputing. , Available from: http://www.nrbsc.org/downloads (1997).
- Thompson, J. D., Gibson, T. J., Plewniak, F., Jeanmougin, F., Higgins, D. G. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research. 25 (24), 4876-4882 (1997).
- Kumar, S., Stecher, G., Tamura, K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution. 33 (7), 1870-1874 (2016).
- Herlinda, S., Mulyati, S. I. Selection of isolates of entomopathogenic fungi and the bioefficacy of their liquid production against Leptocorisa oratorius nymphs. Microbiology Indonesia. 2 (3), 9(2008).
- Herlinda, S., Irsan, C., Mayasari, R., Septariani, S. Identification and selection of entomopathogenic fungi as biocontrol agents for Aphis gossypii from South Sumatra. Microbiology Indonesia. 4 (3), 137-142 (2010).
- Montes-Bazurto, L. G., Peteche-Yonda, Y., Medina-Cardenas, H. C., Bustillo-Pardey, A. E. Selection of entomopathogenic fungi for the biological control of Demotispa neivai (Coleoptera: Chrysomelidae) in oil palm plantations in Colombia. Journal of Entomological Science. 55 (3), 388-404 (2020).
- Shin, T. -Y., Choi, J. -B., Bae, S. -M., Koo, H. -N., Woo, S. -D. Study on selective media for isolation of entomopathogenic fungi. International Journal of Industrial Entomology. 20 (1), 7-12 (2010).
- Sharma, L., Oliveira, I., Torres, L., Marques, G. Entomopathogenic fungi in Portuguese vineyards soils: Suggesting a 'Galleria-Tenebrio-bait method'as bait-insects Galleria and Tenebrio significantly underestimate the respective recoveries of Metarhizium (robertsii) and Beauveria (bassiana). MycoKeys. (38), 1(2018).
- Rodríguez, M., Gerding, M., France, A. Selección de Hongos Entomopatógenos para el Control de Varroa destructor (Acari: Varroidae). Chilean journal of agricultural research. 69 (4), 534-540 (2009).
- Yang, H., et al. Persistence of Metarhizium (Hypocreales: Clavicipitaceae) and Beauveria bassiana (Hypocreales: Clavicipitaceae) in tobacco soils and potential as biocontrol agents of Spodoptera litura (Lepidoptera: Noctuidae). Environmental entomology. 48 (1), 147-155 (2019).
- Muñiz-Reyes, E., Guzmán-Franco, A. W., Sánchez-Escudero, J., Nieto-Angel, R. Occurrence of entomopathogenic fungi in tejocote (C rataegus mexicana) orchard soils and their pathogenicity against R hagoletis pomonella. Journal of Applied Microbiology. 117 (5), 1450-1462 (2014).
- Lacey, L. A., et al. Goettel Insect pathogens as biological control agents: Back to the future. Journal of Invertebrate Pathology. 132, 1-41 (2015).
- Humber, R. A. Manual of techniques in insect pathology. , Elsevier. 153-185 (1997).
- Rehner, S. A., Buckley, E. A Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia. 97 (1), 84-98 (2005).
- Quandt, C. A., et al. Phylogenetic-based nomenclatural proposals for Ophiocordycipitaceae (Hypocreales) with new combinations in Tolypocladium. IMA fungus. 5 (1), 121-134 (2014).
- Shah, F. A., Wang, C. S., Butt, T. M. Nutrition influences growth and virulence of the insect-pathogenic fungus Metarhizium anisopliae. FEMS Microbiology Letters. 251 (2), 259-266 (2005).
- Ignoffo, C. Environmental factors affecting persistence of entomopathogens. Florida Entomologist. , 516-525 (1992).
- Rodrigues, I. W., Forim, M., Da Silva, M., Fernandes, J., Batista Filho, A. Effect of ultraviolet radiation on fungi Beauveria bassiana and Metarhizium anisopliae, pure and encapsulated, and bio-insecticide action on Diatraea saccharalis. Advances in Entomology. 4 (3), 151-162 (2016).
- Paula, A. R., Ribeiro, A., Lemos, F. J. A., Silva, C. P., Samuels, R. I. Neem oil increases the persistence of the entomopathogenic fungus Metarhizium anisopliae for the control of Aedes aegypti (Diptera: Culicidae) larvae. Parasites and Vectors. 12 (1), 1-9 (2019).
- Morley-Davies, J., Moore, D., Prior, C. Screening of Metarhizium and Beauveria spp. conidia with exposure to simulated sunlight and a range of temperatures. Mycological Research. 100 (1), 31-38 (1996).
- Rangel, D. E., Braga, G. U., Flint, S. D., Anderson, A. J., Roberts, D. W. Variations in UV-B tolerance and germination speed of Metarhizium anisopliae conidia produced on insects and artificial substrates. Journal of Invertebrate Pathology. 87 (2-3), 77-83 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır