Method Article
토양 샘플에서 내토모 병원성 곰팡이의 격리 및 선택 및 곤충 해충에 대한 곰팡이 독성의 평가
요약
여기서 우리는 토양 샘플에서 entomopathogenic 균류 (EPF)를 분리하고 선택하는 데 사용 된 식사 벌레 (Tenebrio molitor)-미끼 시스템을 기반으로 프로토콜을 제시합니다. 효과적인 코니디아 번호(ECN) 포뮬러는 현장에서 해충 미생물 조절을 위한 생리적 특성에 기초하여 높은 스트레스 내성 EPF를 선택하는 데 사용된다.
초록
내토모병원성 균류(EPF)는 통합 해충 관리를 위한 미생물 방제제 중 하나입니다. 지역 해충 또는 침습 해충을 제어하려면 토착 EPF를 분리하고 선택하는 것이 중요합니다. 따라서, 곤충 미끼(mealworm, Tenebrio molitor) 시스템과 결합된 토양 미끼 방법은 일부 수정과 함께 본 연구에서 사용되었다. 고립된 EPF는 농업 해충 스포드옵테라 리투라에 대한 독성 검사를 받았다. 더욱이, 잠재적인 EPF 균주는 형태학적 및 분자 식별을 실시하였다. 또한, 코니아 생성 및 열온성 분석은 유망한 EPF 균주에 대해 수행되었고 비교; 이러한 데이터는 실험실 순위를 위한 효과적인 코니디아 번호(ECN)의 공식으로 더 대체되었다. 토양 미끼-식사 웜 시스템과 ECN 포뮬러는 곤충 종을 대체하고 상용화 및 현장 응용 평가를 위해 더 많은 스트레스 요인을 통합하여 개선할 수 있습니다. 이 프로토콜은 EPF 선택에 대한 빠르고 효율적인 접근 방식을 제공하고 생물학적 제어 제에 대한 연구를 향상시킬 것입니다.
서문
현재, 내토모병원성 균류(EPF)는 농업, 숲 및 원예 해충의 미생물 대조에 널리 사용되고 있다. EPF의 장점은 넓은 숙주 범위, 좋은 환경 적응성, 환경 친화적 인 특성이며, 통합 해충 관리를위한 시너지 효과를 보여주기 위해 다른 화학 물질과 함께 사용할 수 있다는 것입니다1,2. 해충 방제제로서 의신청의 경우, 병든 곤충이나 자연 환경으로부터 많은 수의 EPF를 분리할 필요가 있다.
그들의 호스트에서 이 유기체의 견본은 자연 호스트에 있는 EPF의 지리적 분포 그리고 보급 비율을 이해하는 데 도움이 3,4,5. 그러나, 곰팡이 감염 곤충의 수집은 일반적으로 분야에서 환경 요인과 곤충 인구에 의해 제한됩니다4. 곤충 호스트가 EPF 감염 후 죽고 토양에 빠질 것이라는 점을 고려할 때 토양 샘플에서 EPF를 분리하는 것은 안정적인 자원이 될 수 있습니다3,6. 예를 들어, 사프로피테는 죽은 호스트를 성장을 위한 자원으로 사용하는 것으로 알려져 있습니다. 토양 미끼 및 선택적 중간 시스템은 토양으로부터 EPF를 검출하고 분리하는 데 널리 사용되어 왔다3,4,7,8,9,10.
선택적 중간 방법에서, 희석된 토양 용액은 박테리아의 성장을 저해하기 위해 광범위한 항생제(예를 들어, 클로람페니콜, 테트라사이클린 또는 연쇄상 구균신)를 포함하는 매체에 도금된다2,3,9,11. 그러나, 이 방법은 긴장의 다양성과 밀도를 왜곡할 수 있고 많은 미생물 지역 사회의 과소 또는 과소 추정을 일으키는 원인이 될 수 있다는 것을 보고되었습니다6. 더욱이, 고립된 긴장은 더 적은 병원성이고 격리 도중 saprophytes와 경쟁합니다. 희석된 토양 용액으로부터 EPF를 분리하기 어렵다3. 선별적 배지를 사용하는 대신, 토양 미끼 방법은 감염된 죽은 곤충으로부터 EPF를 분리하여 2-3주 동안 보관할 수 있어 보다 효율적이고 표준적인 EPF 분리 방법을 제공한다3,4,7,6. 이 방법은 조작이 용이하기 때문에, 저렴한 비용으로 다양한 병원성 균주를 분리할 수 있다. 따라서 많은 연구자들이 널리 사용합니다.
곤충 미끼 시스템의 다른 유형을 비교하면, 보베리아 bassiana와 Metarhizium 애니소플리아는 헤미트라, 레피도페라, 블라텔라 및 콜옵테라6,12,13,14에 속하는 곤충에서 발견되는 가장 일반적인 EPF 종입니다. 이 곤충 미끼 중, 갤러리아 멜로넬라 (순서 레피도페라) 테네리오 몰리터 (주문 콜로페라) 보베리아와 Metarhizium spp의 높은 복구 비율을 보여줍니다., 다른 곤충에 비해. 따라서 G. 멜론넬라와 T. 몰리터는 곤충 미끼에 일반적으로 사용됩니다. 수년에 걸쳐, 미국 농무부(USDA)는 4081종의 보베리아 스PP, 18종의 클로노스타치스 스PP, 878종의 동충하하초 스PP, 2473종의 메흐라이즈 퍼실(Metarhizpurium)을 포함한 다양한 종을 포함하는 EPF 도서관(EPF 문화, ARSEF의 농업 연구 서비스 컬렉션)을 설립했습니다. 그리고 13 종의 포코니아 spp. 또 다른 EPF 도서관은 미국 버몬트 대학교에서 30년 동안 곤충학 연구소(ERL)에 의해 지어졌습니다. 여기에는 미국, 유럽, 아시아, 아프리카 및 중동 116의 EPF 균주 1345개균이 포함됩니다.
대만의 지역 또는 침공 해충을 통제하려면 원주민 EPF의 고립과 선택이 필요합니다. 따라서, 본 프로토콜에서, 우리는 토양 미끼 방법의 절차를 수정하고 설명하고 곤충 미끼 (식사 벌레, 테네리오 몰리토르) 시스템과 결합17. 이 프로토콜에 따라 EPF 라이브러리가 설정되었습니다. 예비 EPF 분리를 위해 2회 선별(접종의 정량화)이 수행되었다. EPF 분리는 곤충에 대한 병원성을 보였다. 잠재적인 균주는 형태학적 및 분자 식별을 실시하고 열성 편협및 편정 생산 분석에 의해 추가 분석되었다. 또한 효과적인 코니디아 번호(ECN)의 개념도 제안되었다. ECN 공식 및 주 성분 분석(PCA)을 사용하여, 잠재적인 균주는 EPF 라이브러리를 설치하고 선별하는 과정을 완료하기 위해 시뮬레이션된 환경 압력하에서 분석되었습니다. 그 후, 유망한 EPF 균주의 병원성은 표적 해충(예를 들어, 스포드옵테라 리투라)에 대해 시험하였다. 현재 프로토콜은 ECN 포뮬러 및 PCA 분석에 열편도 및 원전 생산 데이터를 통합하여 EPF 관련 연구를 위한 표준 순위 시스템으로 사용할 수 있습니다.
프로토콜
참고: 전체 순서도는 그림 1에 표시됩니다.
1. 잠재적인 내토모병원성 균류(EPF)의 격리 및 선택
- 토양 샘플 수집
- 표면 토양의 1cm를 제거한 다음 각 샘플링 부위의 삽을 사용하여 5-10cm 깊이 내에 있는 토양을 수집합니다.
참고: 샘플링 사이트는 인위적으로 분사된 EPF 균주의 오염을 피하기 위해 산, 숲 또는 인구밀도가 낮은 지역이 될 것입니다. 토양 샘플 수집 영역이 표면에 잡초로 덮여 있는지 확인합니다. 건조 토양 또는 습한 토양이 실험에 적합하지 않습니다. - GPS, 고도, 필드 유형, 연간 온도, 연간 강수량, 수집 시간(계절), 토양 유형 및 pH 값을 포함한 각 샘플링 사이트의 세부 정보를 기록합니다.
- 토양 샘플 100g을 비닐 봉지에 모아 3시간 이내에 실험실에서 곰팡이 격리 프로토콜을 적용하면 실온에서 유지하십시오.
참고: 3시간 이내에 시료를 사용할 수 없는 경우, 토양을 어두운 조건에서 실온에 보관하십시오. 실험이 즉시 수행되지 않으면, 토양 샘플은 프로토콜18,19의 시작까지 1주일 동안 4°C로 저장될 수 있다.
- 표면 토양의 1cm를 제거한 다음 각 샘플링 부위의 삽을 사용하여 5-10cm 깊이 내에 있는 토양을 수집합니다.
- 미끼와 식사 벌레와 EPF를 분리 (테네브리오 몰리토르)
- 토양 샘플 100g을 플라스틱 컵(캡 직경 = 8.5cm, 높이 = 12.5cm)에 넣고 2주 동안 어둠 속에서 실온에서 토양 표면에 5개의 밀웜을 놓습니다.
참고: 다른 유형의 플라스틱 컵 용기도 사용할 수 있습니다. 토양이 너무 건조 (금이 또는 모래), 토양에 멸균 ddH2O (약 5-10 mL)를 스프레이하는 경우. T. 몰리토르 애벌레의 몸 길이 c.a. 2.5cm (14 번째 인스타)는 곰팡이 분리 스크린20에 도움이됩니다. - 필멸의 성과와 근시를 위해 매일 애벌레를 관찰하고 기록한다. 곰팡이 격리를 위해 2 주까지 죽은 애벌레를 컵에 보관하십시오.
참고 : 토양 샘플의 곰팡이 코니디아 포자 위의 과정에서 식사 벌레 애벌레에 부착됩니다. 곰팡이 진균증은 최면이 세그먼트 간 막에서 성장함에 따라 관찰되고 몸 전체가 균소로 덮여 있습니다. 포자는 7 일 후에 시작하고 곰팡이 감염의 색깔은 코니디아 질량의 색깔로 변경됩니다. - 죽은 곤충을 깨끗한 벤치로 옮기고 멸균 이쑤시개를 사용하여 코니디아를 수집합니다. 실험실21에서 사부라우 덱스트로스 식기 매체(1/4 SDA) 플레이트(55mm)를 분기 강도로 줄이세요. 균류의 1차 배양을 얻기 위해 7일 동안 25°C에서 배양판을 배양한다.
참고: 1/4 SDA 플레이트는 다음과 같이 준비됩니다: 사부라우 덱스트로스 국물 1.5g과 3 g의 Agar를 H2O 200mL에 혼합한 다음 20분 동안 멸균합니다. Aliquot 1/4 SDA를 각 55mm 페트리 접시에 넣고 응고하기 전에. 고화된 1/4 SDA 플레이트는 사용전까지 4°C로 저장됩니다. - 각 1차 배양균을 1개 55mm 1/4 SDA 플레이트에 재줄이 하여 7일 동안 25°C에서 배양판을 배양하여 곰팡이의 단일 콜로니를 얻습니다.
- 이 재절연 ~2-3 번 반복 하 고 단일 및 순수한 형태 학적 곰팡이 식민지를 얻기 위해 가벼운 현미경 검사에서 관찰.
참고: T. 몰리토르 미끼를 사용하여 모든 EPF를 분리하고 다음 섹션에 설명된 대로 저장합니다. 분리, 보존, 순수한 문화 및 줄무늬는 후속 섹션의 라미나르 흐름에서 수행해야 합니다.
- 토양 샘플 100g을 플라스틱 컵(캡 직경 = 8.5cm, 높이 = 12.5cm)에 넣고 2주 동안 어둠 속에서 실온에서 토양 표면에 5개의 밀웜을 놓습니다.
- EPF 분리 저장
- 코르크 보어로 각 고립 된 순수 곰팡이 배양 플레이트의 가장자리에있는 5mm 천막 블록 중 3 개를 자르고 복제된 대로 1.5 mL 마이크로 원심 분리튜브에 넣습니다.
참고: 2차 독성 테스트 후 EPF 균주 저장에 각 곰팡이 분리에 대한 세 가지 복제본이 권장됩니다. 저장 공간이 제한된 경우에도 분자 식별을 권장합니다. - 마이크로파이펫을 사용하여 1.5mL 마이크로 원심분리기 튜브에 0.03% 계면활성제 용액(재료표) 및 60% 글리세롤 250 μL을 추가합니다. 그런 다음, 10 초 동안 소용돌이.
- 1.5mL 마이크로 원심분리기 튜브를 파라핀 필름으로 밀봉하고 -20°C 냉장고에서 24시간 동안 미리 식힙니다. 그런 다음 미리 냉각된 곰팡이 주식을 -80°C 냉장고로 전송하여 냉동 보존을 위해 합니다.
참고: 여분의 순수한 곰팡이 배양 플레이트(저온 보존 샘플 제외)가 1.4절에 사용되었습니다.
- 코르크 보어로 각 고립 된 순수 곰팡이 배양 플레이트의 가장자리에있는 5mm 천막 블록 중 3 개를 자르고 복제된 대로 1.5 mL 마이크로 원심 분리튜브에 넣습니다.
- 곰팡이 분리를위한 첫 번째 병원성 화면
- 5 T . 몰리토르 애벌레를 25°C에서 각각의 순수 곰팡이 배양 판의 표면에 직접 놓습니다.
- 10일 동안 근균과 필멸의 삶을 관찰하고 기록한다. 추가 분석을 위해 곰팡이 격리를 선택합니다.
참고: 100% 사망률을 유발하는 곰팡이 분리는 T. molitor 애벌레에 대한 그들의 독성을 확인하기 위해 2 차 독성 검사에 선택됩니다. 또는, 연구원은 그들의 자신의 연구 결과에 따라 기준을 조정할 수 있습니다.
- 곰팡이 분리의 2 차 독성 테스트
참고: 1차 병원성 스크린을 기반으로, 2차 독성 검사를 위해 -80°C에서 선택된 곰팡이 분리를 회수한다. 2차 적발성 검사의 목적은 1차 심사 후 선택된 곰팡이 분리물의 병원성을 정량화하는 것이다.- 각 곰팡이의 코니아를 1 분 동안 피류하여 분리하고 혈류계를 사용하여 코니디아수를 계산합니다.
- 코니디아 서스펜션을 0.03% 계면활성제 용액(재료표)에서 1 x 107 코니디아/mL 농도로 조정합니다.
- 곰팡이 현탁액의 10 μL을 55mm 1/4 SDA 플레이트에 분산시키고 어둠 속에서 25 °C에서 7 일 동안 자랍니다.
- 5 개의 T. 몰리토르 애벌레를 각각의 순수한 곰팡이 배양 판 (c.a. 6 x 107 코니디아)의 표면에 직접 놓습니다. 파라핀 필름으로 판을 밀봉하고 어둠 속에서 25 °C에서 배양하십시오.
- 10일 동안 근균과 필멸의 삶을 관찰하고 기록한다.
- 각 곰팡이 격리에 대해 트리플리케이트에서 테스트(1.51단계에서 1.5.5단계까지)를 반복합니다.
참고: 100% 사망률을 유발하는 곰팡이 분리는 해충을 표적으로 하는 그들의 독성을 확인하기 위하여 3차 독성 시험을 위해 선택됩니다.
- 대상 해충에 대한 곰팡이 격리의 제 3 의 독성 테스트 (예를 들어 Spodoptera 리투라 )
- 대상 해충에 대한 독성을 테스트하기 위해 2차 독성에서 선택된 격리를 사용하여 1.5.2 ~ 1.5.6단계를 반복합니다.
- 각 곰팡이 분리22의 LT50을 계산합니다.
참고: 각 곰팡이 분리의 LT50 은 R 스튜디오(버전 3.4.1)를 사용하여 일반화된 선형 모델(GLM)을 통해 계산되었습니다. 준시비노미알 오류 분포 및 로그 링크 기능을 사용하여 과잉 분산을 설명할 수 있습니다.
2. EPF의 분자 식별
- 곰팡이 게놈 DNA 추출
- 7일 1/4 SDA 플레이트에서 c.a. 1cm2 EPF를 수집합니다.
- 제조업체의 지침23(재료 표)에 따라 곰팡이 게놈 DNA 추출 키트를 사용하여 곰팡이 게놈 DNA를 추출하십시오.
- PCR 증폭 및 DNA 염기서열 분석
- PCR 마스터 믹스(2x), ITS1F/ITS4R 프라이머 세트24(표 1)를 사용하여 DNA 샘플21의 PCR에 의한 곰팡이 ITS 영역을 증폭시 다음 PCR 프로그램과 함께: 94°C 1분, 30대 55°C, 72°C의 경우 7°C, 72°C를 7°C로 1분, 7°C로 1분 연장했다.
참고: ITS1F/ITS4R 프라이머 세트는 속 수준 식별을 위한 것입니다. - 상용 시퀀싱 서비스로 PCR을 시퀀싱합니다.
- NCBI 데이터베이스에서 유사한 곰팡이에 대한 NCBI BLAST 검색을 사용하고 계통 유전학 분석을위한 상대 곰팡이 유형 종을 선택합니다.
참고: 메타리지움 또는 보베리아 속에 속하는 곰팡이 종은 tef-983F/tef-2218R 프라이머 세트25(반복 단계 2.1.1 ~ 2.2.3)로 종 수준으로 더 확인되어야 합니다. 제네라 메타리슘 또는 보베리아에 속하지 않는 곰팡이의 경우, DNA 리아아제(APN2), 베타 튜룰린(BTUB), RNA 폴리머라제 II 최대 서브유닛(RPB1), RNA 폴리머라제 II 제2의 서브유닛(RPB2), 및 번역 연구 1(26)의 3'부분을 포함한 종을 식별하는 데 다른 분자 마커를 사용할 수 있습니다. .
- PCR 마스터 믹스(2x), ITS1F/ITS4R 프라이머 세트24(표 1)를 사용하여 DNA 샘플21의 PCR에 의한 곰팡이 ITS 영역을 증폭시 다음 PCR 프로그램과 함께: 94°C 1분, 30대 55°C, 72°C의 경우 7°C, 72°C를 7°C로 1분, 7°C로 1분 연장했다.
- 필로유전학 분석
- ClustalX 2.1 software27 을 사용하여 2.2.2 단계 및 2.2.3 단계에서 여러 시퀀스를 정렬합니다. GeneDoc28을 사용하여 보존된 서열 영역을 수동으로 다듬습니다.
- 최소 진화(ME), 이웃-조인(NJ), 최대 가능성(ML) 방법에 기초하여 MEGA7 software29 에 의한 물리유전학 적 분석을 수행한다.
참고: 세 가지 방법을 모두 수행하면 분류 상태를 확인하고 정확하게 마무리하는 데 도움이 될 수 있습니다. 1차 병원성 스크린에 의해 가려진 곰팡이 격리는 속 수준에서 분자 식별을 위해 사용됩니다. 2차 독성 검사에 의해 스크리핑된 곰팡이 격리는 종 수준 분자 및 형태학적 식별에 사용됩니다.
3. EPF의 형태학적 식별
- 곰팡이 식민지 형태 의 관찰
- 7 일 동안 곰팡이 문화 식민지 성장을 캡처하고, 성장, 형태 (푹신한, 단단한), 식민지의 색상을 기록하기 위해 카메라를 사용합니다.
- 코니디아와 코니디오포레스의 관찰
- 순수한 배양 곰팡이 식민지에서 코니디아를 접종 루프로 긁어 내고 포자를 0.1 % Tween 80 용액으로 유리 슬라이드로 옮긴다. 그런 다음, 코니디아의 가벼운 현미경 관찰을위한 커버 슬립으로 덮는다.
- 메스를 사용하여 곰팡이 식민지 가장자리의 최면 가닥의 5mm2 천 블록을 잘라낸 다음 한천 블록을 유리 슬라이드로 옮길 수 있습니다.
- 다음과 같이 청소 수행 : 플라스틱 드롭퍼와 함께 한천 블록에 0.1 % Tween 80 용액을 추가하고 핀셋을 사용하여 여분의 코니디아의 대부분을 씻어. 그런 다음, 가벼운 현미경 관찰을위한 커버 슬립으로 덮습니다.
참고: 0.1% Tween 80은 곰팡이 종 및 소수성에 따라 또 다른 강력한 계면활성제(재료 표)로 대체될 수 있습니다. - 코니디아와 코니디오포어의 폭과 길이를 측정하고 기록하여 다른 곰팡이 분리물의 차이를 비교합니다.
- 웰치의 ANOVA 테스트 및 게임-하웰 테스트(포스트 혹 테스트)를 사용하여 R 스튜디오(버전 3.4.1)를 사용하여 각 변형의 원건폭과 길이를 분석합니다.
참고: 형태학적 문자에 대한 데이터 분석은 경우에 따라 조정할 수 있습니다. 제3 회 독성 검사로 선별된 곰팡이 분리는 4항과 5절에서 생리적 특성화 및 ECN 순위에 사용된다.
4. 편도 생산성 및 열성 편협에 대한 조사
- 정온 생산 분석
- 10일 동안 25± 1°C에서 1/4 SDA 배지에서 선택된 곰팡이를 배양한다.
- 상기와 같이 0.03% 계면활성제 용액으로 균골 분리의 간편한 서스펜션 1mL을 준비하고 1 x 107 코니디아/mL로 조정한다.
- 1/4 SDA에 10 μL의 3방울을 떨어뜨리고 7일, 10일 및 14일 동안 어둠 속에서 25°C에서 배양하여 곰팡이의 포자를 계산합니다.
참고: 10 μL은 7-14일 동안 곰팡이 가루가 자생한 후 곰팡이 포자화로 5mm 블록을 수집하는 가장 좋은 부피입니다. - 코르크 보어를 사용하여 식민지 의 중심에서 5mm 한천 블록을 분리하고 각 시점에서 1.5mL 마이크로 원심 분리기 튜브에서 0.03 % 계면 활성제 용액 (재료 테이블)의 1 mL로 전송합니다.
- 15 분 동안 실온에서 3,000 rpm에서 튜브를 소용돌이시키고 혈류계를 사용하여 코니디아 수를 계산합니다.
참고: 계산에 사용되는 수식은 가장 작은 셀의 25제곱당 코니디아 수(크기 = 0.025 mm2; 챔버 깊이 = 0.1 mm)입니다.
5 칸÷ 80 × (4 × 106)에서 코니디아의 총 No - 각 격리에 대해 세 번 반복합니다.
- 열성 편도 분석
- 10일 동안 25± 1°C에서 1/4 SDA 배지에서 선택된 곰팡이를 배양한다.
- 0.03% 계면활성제 용액으로 곰팡이 분리의 간편한 서스펜션 1mL을 준비하고 위에서 설명한 바와 같이 1 x 107 코니디아/mL로 조정한다.
- 원근 현탁액을 소용돌이시키고 0, 30, 60, 90 및 120 분 동안 45 ° C 건조 목욕으로 가열합니다. 매 시간 포인트에 55mm 1/4 SDA 배지에 5μL의 3방울을 떨어뜨리고 18h에 대해 25 ± 1°C에서 25± 1°C로 배양한다.
참고: 곰팡이 방울을 확산하여 부위에 더 잘 집중할 수 있도록 하지 마십시오. - 발아 율을 결정하기 위해 200x 광 현미경 검사법 에서 무작위로 선택된 5개의 필드와 발아 코니디아 포자의 수를 계산합니다.
- 각 격리에 대해 세 개의 복제를 수행합니다.
5. 유효 코니디아 번호 (ECN) 순위
- ECN 계산
참고: 총 ECN21을 계산하기 전에 각 잠재적 곰팡이 균주의 원열 생산 및 열온성 데이터를 가져옵니다.- 각 시점에서 정중 생산의 접이식(FC)을 계산합니다.

여기서, x = 데이터 수집을 위한 시간 지점; ncp = 성장의 매일 후 코니디아의 수; 그리고 나는 = 시드 코니디아의 초기 번호. - 다음 공식을 사용하여 각 시점에서 스트레스 치료 하에서 코니디아 번호를 계산합니다.

여기서, y = 치료 중인 시점의 ECN; TT0 = 열 응력 (= 0 분 열 처리의 발아 속도)을 겪지 않는 코니디아의 발아 속도; TTz = 응력 계수는 열처리(z)의 상이한 시기에 코니디아 발아율이다. - 다음 수식을 사용하여 총 ECN을 계산합니다.

- 각 곰팡이 균주의 ECN을 비교합니다.
- 각 시점에서 정중 생산의 접이식(FC)을 계산합니다.
- 곰팡이 균주의 주요 성분 분석 (PCA)
참고: PCA 분석은 ECN의 순위를 확인하고 생리적 특성 값 사이의 상관 관계를 이해하는 데 도움이됩니다. ECN 값을 비교하고 ECN 값이 더 높은 EPF 격리를 선택합니다. - R 소프트웨어를 사용하여 코딩하여 PCA를 만듭니다.
#Input PCA 데이터 파일
a = read.table ("PCA.csv", 9월=',헤더=T)- # 샘플 데이터 처리
row.name.(a) <-c("NCHU-9",NCHU-11", "NCHU-64", "NCHU-69", "NCHU-95", "NCHU-113")
X=행.이름(a)
df<- a[2:11] - #PCA 계산
pca <- prcomp (df, 중앙 = TRUE, 스케일 = TRUE)
<- (pca$sdev)^2
pc1_percent = vars[1] / 합계(vars)
pc2_percent = vars[2] / 합계 (vars)
값 = pca$x - #Output PCA 시각화 파일
png(파일 = 'pca.png', 높이 = 2000, 너비 = 2000, res = 300)
참고: 7~14일 간의 원전 생산 및 모든 열온성 데이터를 사용하여 ECN 순위를 확인하기 위해 주 성분 분석(PCA)을 실행합니다.
- # 샘플 데이터 처리
- ECN 또는 PCA에 따라 가장 성과가 좋은 곰팡이 균주를 선택하고 추가 연구를 위해 대상 해충의 독성 테스트를 수행합니다.
결과
격리 및 선택 잠재적 인 엔토모병원성 균류 (EPF)
테네리오 몰리토르 매개 엔토모병원성 균류(EPF) 라이브러리 시공 방법을 사용하여 곤충 살상 활동이 없는 곰팡이의 수는 제외될 것이다. 따라서, EPF의 격리 효율과 선택은 크게 증가 될 수있다. 이 방법의 적용 동안 샘플링 부위, 토양 샘플 및 곰팡이 발아 율의 정보가 기록되었습니다(표 2). 우리의 이전 데이터를 바탕으로, 총 101 곰팡이 격리는 64 %의 높은 절연 효율을 나타내는 172 토양 샘플에서 얻어졌다. 101개의 곰팡이 격리 중, 26개의 격리는 1차 병원성 검사 후 T. molitor(100% 사망률)에 대한 살충활성을 보였으며, 따라서 곰팡이 분리의 제거는 26/101 = 25.7%였다. 제2독성 시험에서는, 26의 곰팡이가 T. molitor에 대하여 격리된 높게 입증되었다, 12는 T. molitor 애벌레에 대하여 높은 병원성을 보였다 (5 일 사후 접종에서 100% 사망) (그림 2A). 이들은 농업 해충에 대하여 독성 시험을 평가하기 위하여 이용되었습니다. 제3차 독성 검사 사망률 및 LT50의 데이터를 기반으로, 총 6개의 곰팡이 분리물(NCHU-9, 11, 64, 69, 95 및 113)은 스포드옵테라 리투라(LT50 = 2.94, 2.22, 2.84, 2.57, 2.96 및 1.13)에 대한 신속한 곤충 학살 활성을 밝혀냈으며, 이는 생리학적제(2.13)를 이용하여 효과적이고( 2.13)를 이용하여 평가하였다.
EPF의 분자 식별
곰팡이 분류학적 위치를 더 잘 이해하기 위해, 제1 병원 성 스크리닝에서 26개의 분리제가 ITS 부위에 기초한 분자 분석을 실시하였다(도 3A). 결과는 이 곰팡이 분리가 명확하게 보벨리아, 클로노스타치, 푸사리움, 동충하초, 페니실륨, 푸르퓨로실륨 및 메타리슘 (그림 3A)를 포함하여 7개의 제네라로 분할될 수 있었다는 것을 보여주었습니다. ITS1-5.8S-ITS2 지역에 기초하여, EPF의 속 분류는 정확하게 확인되었으며, 종 수준은 여전히 구별할 수 없다. 따라서, 테프 영역의 서열은 농업 해충에 대한 독성 검사로부터 분리된 12개의 유망한 EPF에 대한 종 수준을 명확하게 분류하는 데 사용된다. 12개의 분리물의 분자 식별은 11개의 격리가 메타리슘 에 속하고 4종을 포함하고 있다는 것을 보여주었습니다, M. lepidiotae (NCHU-9, NCHU-102), M. 핑하엔세 (NCHU-10, NCHU-11, NCHU-30, NCHU-32, NCHU-64), M. brunneum (NCHU-27, NCHU-29), M. 애니소밀리아 (NCHU-69), 및 M. 아니소피아 ( NCHU-69) 나머지 분리는 B. 오스트랄리스 (NCHU-113)로 확인되었다(그림 3B, C). 상기 결과에 따르면, 테프 의 서열 영역은 종 수준에서 메타리슘 속을 효과적으로 구별할 수 있으며, 다른 종들은 종을 구별하기 위해 분자 마커로서 다른 서열 영역을 찾아야 한다.
EPF의 형태학적 식별
곰팡이 형태학적 관측의 세정 방법(3.2.3단계)을 통해, 코니디오포어의 구조는 0.1% Tween 80 용액(도 4A)으로 명확하게 볼 수 있었고, 이러한 관측은 구조의 크기를 측정하고 사진 기록을 취하는 벤치마크역할을 할 수 있다. 코니디아의 색상, 모양 및 배열은 콜로니디아의 미세한 관찰을 통해 볼 수 있습니다 (도 4B, C). 관찰 후, 코니디아와 코니디오포어 모양의 크기를 더 측정하고 통계적으로 비교할 수 있습니다(표 3).
원근생산성 조사, 열성편성 및 ECN 순위 조사
이전 보고서에 의해 제안된 ECN 공식21, 높은 스트레스 허용 오차 EPF 기반 생리적 특성의 선택에 도움이 될 수 있습니다. ECN은 각 EPF(그림 5A, B)의 코니디아 생산 및 열온성 데이터를 결합하여 ECN 값이 높을 때 곰팡이 균주의 높은 생존력을 의미합니다(그림 5). 또한, 주 성분 분석(PCA) 시각화를 사용하여 ECN 수식으로부터의 결과를 검증하였다. 그 결과 PCA와 ECN 간의 높은 조정이 밝혀졌으며, ECN 공식을 사용하여 생존 가능성 관련 매개 변수의 계층 구조와 현장 응용 및 추가 상용화에 대한 곰팡이의 개발 잠재력을 평가할 수 있음을 시사합니다(그림 5C,D).

그림 1: 테네리오 몰리토르 매개 엔토모병원성 균류(EPF) 라이브러리 시공의 그림. Part 1: 토양 시료로부터의 곰팡이 격리; 2부: 병원성 및 독성 기반 검진 및 곰팡이 식별; 3부. 생리적 특성화 및 곰팡이 순위. ECN = 효과적인 코니디아 번호; 및 PCA = 주 성분 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
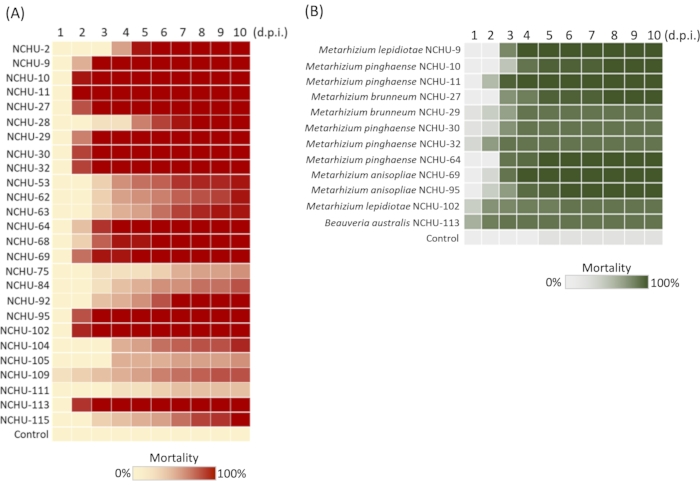
그림 2: 유망한 엔토모병원성 균류(EPF) 분리를 위한 식사벌레와 스포드옵테라 리투라 의 사망률. (A) 26-선택된 곰팡이 2차 식사벌레 독성 검사; 12 급속한 살인과 높은 독성 곰팡이 분리의 진균체가 병렬로 표시됩니다. (B) 12 곰팡이 분리기 는 S. litura에 대한 독성 검사를 위해 선택되었다. 각 곰팡이 균주에 대한 테스트는 세 번 반복되었다. d.p.i. = 일 사후 접종. 프론테리스21의 허가하에 재현된 수정된 그림과 범례. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
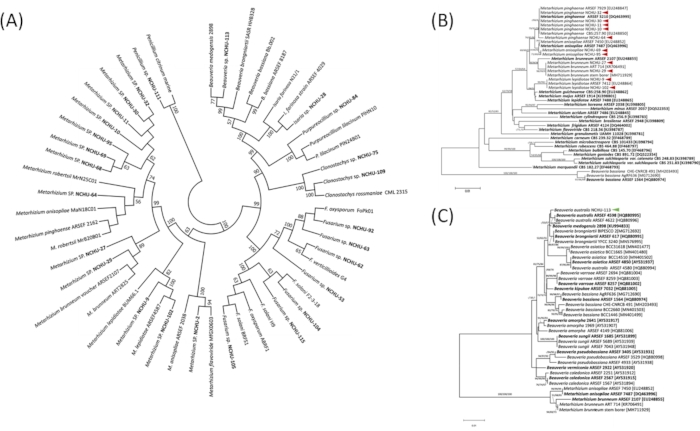
도 3: 내토모병원성 균류(EPF)의 식물학적 분석은 (A) 의 심균 수준에서 의 균주(A) IS 영역 및 (B-C) 종 수준에 기초하여 tef에 기초한다. ITS 영역 및 tef 의 물리 유전학 분석은 최대 가능성 (ML), 최소 진화 (ME), 및 이웃 결합 (NJ) 방법을 사용하여 구성되었다. 부트스트랩 분석은 1,000개의 복제를 사용하여 필로겐의 견고성을 평가하기 위해 수행되었으며, 50% 이상의 부트스트랩 비율은 분기 위에 표시됩니다. 굵은 = 전형 균주. 빨간색과 녹색 화살표는 유망한 EPF를 나타냅니다. 프론테리스21의 허가하에 재현된 수정된 그림과 범례. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: 내모병원성 균류(EPF)의 현미경 검사(M. 아니소플리아) 형태. 세탁 후 의 관찰 (A) (B) 코니디아 모양과 색의 관찰. (C) M. 아니소필리아의 포자 문자열 (SS)의 코니디아 및 번들 배열; Cp = conidiophores; cc = 원통형 원미성 원미. 스케일 바 = 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 6개의 잠재적 분리및 효과적인 코니디아 수(ECN) 분석의 생리적 특성화. (A) 편성 생산 분석. (B) 열성 편도 분석. (C) ECN 값의 막대 플롯입니다. (D) 주 성분 분석은 각 변형의 분포를 보였다. 프론테리스21의 허가하에 재현된 수정된 그림과 범례. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 프라이머 이름 | 앰플리슨 크기 (bp) | 시퀀스(5'-3') | 부위 | 참조 | |
| ITS1F | 550 | TCCGTAGGTGAACCTGCGG | 그 | 25 | |
| ITS4R | TCCCCGCTTATT가ATATGC | ||||
| tef-983F | 1000 | GCYCCYGGHCAYCGTGAYTGAYTTYAT | tef | 26, 27, 41, 42 | |
| tef-2218R | ATGACACCRACRCRCRTYTG | ||||
표 1: 곰팡이 식별을위한 프라이머 쌍.
표 2: 테네리오 몰리토르 매개 EPF 라이브러리 시공 방법에 대해 기록된 매개 변수는 다음과 같습니다. NIU = 국립 일란 대학의 캠퍼스. NCHU = 국립 청싱 대학교 캠퍼스. 프론테리스21의 허가하에 재현된 수정된 테이블과 범례. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
| 종 | 거르다 | 피알리데스 μm±SD* | 코니디아 μm±SD* |
| 메타리지움 렙바케 | NCHU-9 | 원통형, 7.3±0.67b×2.4±0.36a | 원통형, 6.5±0.45a×2.7±0.13b |
| 메타리지움 핑하엔세 | NCHU-11 | 원통형, 8.6±0.68ab×2.6±0.30a | 원통형, 6.3±0.41b×2.7±0.16b |
| 메타리지움 핑하엔세 | NCHU-64 | 원통형, 10.5±1.54a×2.4±0.32a | 원통형, 6.8±0.53a×2.9±0.31a |
| 메타리슘 애니소플리아 | NCHU-69 | 원통형, 9.4±1.58a×2.7±0.32a | 원통형, 6.3±0.34b×2.6±0.19b |
| 메타리슘 애니소플리아 | NCHU-95 | 원통형, 9.6±0.87a×2.6±0.29a | 원통형, 6.0±0.82b×2.9±0.29a |
| 보베리아 오스트랄리스 | NCHU-113 | 타원, NA×2.6±0.57 | 글로보스, 2.3±0.24×2.3±0.24 |
| *통계 분석은 R 스튜디오를 사용하여 웰치의 ANOVA 테스트를 기반으로 수행되었습니다. | |||
| § 프론테리스 (23)의 허가하에 복제 된 표 및 전설. | |||
표 3: 6개의 유망한 내피증 성 곰팡이 분리의 형태학적 관측의 예. 통계 분석은 R 스튜디오를 사용하여 웰치의 ANOVA 테스트를 기반으로 수행되었습니다. 프론테리스21의 허가하에 재현된 수정된 테이블과 범례.
토론
곤충병원성 균류(EPF)는 곤충 조절에 사용되어 왔다. EPF30,31,32를 분리, 선택 및 식별하는 몇 가지 방법이 있습니다. 곤충 미끼 방법의 다른 종류를 비교, 보베리아 bassiana와 Metarhizium 애니소플리아 곤충 미끼에서 일반적으로 발견 되었다6,12,13,14. 이 곤충 미끼 중, 갤러리아 멜로넬라와 테네브리오 몰리토르는 보베리아와 메타리슘 spp의 높은 회복률을 보였다. 실제로, 식사벌레(T. molitor)-미끼 방법의 유용성은 토양 샘플17,21로부터 EPF를 분리하는 편의성 방법으로 입증되었다. 그럼에도 불구하고 곤충을 미끼로 사용하면 특정 곰팡이 종을 분리하는 편견을 보일 것으로 보고되었습니다3,33. 따라서, 토양 샘플로부터 EPF를 미끼로 다른 곤충 종(즉, 갤러리아 멜로넬라 및 T. 몰리터)의 조합은 EPF34의 다양성을 증가시킬 수 있다.
곤충 살인 활동을 평가하기 위해, 추가 연구를 위한 유망한 곰팡이 균주를 선택하는 현재 프로토콜에 있는 식사벌레(T. molitor)에 의한 두 차례의 검사가 있습니다. 이 과정에 따라 토양 샘플로부터 격리된 곰팡이 격리의 수는 1차 및 2차 검진 후 높은 살충활성을 보인 곰팡이 분리로 극적으로 감소하고 제한될 수 있다. 다음 스크리닝 을 위해 곰팡이 분리의 큰 감소는 시간 비용과 인건비를 절약 할 수 있습니다. 또한 선택된 곰팡이 분리제가 다른 곤충 종의 병원성 테스트를 입증하고 다른 작물 해충21로 확장 될 수 있음을 입증, 식사 벌레 (T. molitor)와 담배 컷웜 (Spodoptera litura) 사이의 병원성의 유사한 추세를 보여 주었다 주목할 수 있습니다. 또한, 생리적 시험에 기초한 ECN의 계산은 작물 밭에서 사용될 잠재적인 곰팡이 균주의 선택을 용이하게 할 수 있다. 유사한 선택적 방법은 다른 보고서에 의해 언급되었으며, 비생물및 균주 특성과 같은 요인은 12,8,31,35,36,37로 포함되지 않았다. 따라서, 이러한 균주는 곰팡이 발아의 성능에 영향을 초래하고 그로 인하여 상용화하는 어려움을 초래하는 환경 요인에 의해 영향을 받을 수 있다. 이 결과는 또한 필드에 있는 실험실 긴장의 부가 성에 대한 주된 이유입니다38.
형태학적 식별에서, 추가 노력은 conidiophore의 명확한 구조를 찾아내고 각 곰팡이 긴장의 다른 특성을 관찰하는 쪽으로 지시되어야 합니다. 연구는 어려운 형태 학적 식별을 해결하기위한 다양한 방법을 포함 할 수있다39. 그러나, 형태학적 식별은 밀접하게 관련된 곰팡이 종을 구별하지 못합니다. 따라서 분자 식별데이터를 통합할 필요가 있다. 내부 전사 스페이서(ITS) 지역은 속 수준 차별을 보였으며, 다른 분자 마커(즉, 메타리슘용 테프, 보베리아블록)는 종 수준에서의 식별을 위해 필요하다26,40,41종에서 식별하기 위해 필요하다.
생리적 특성화에서, 실험의 표준 편차를 감소시키기 위해, 최대 rpm에서 적어도 10 분 동안 기계 또는 수동 소용돌이가 제안된다21. 철저하게 혼합 된 코니디아 현탁액은 열성 편도 분석 및 원건 성 생산 분석 결과의 일관성을 증가시킬 것입니다. 한편, 원한생산 분석에서, 정량적 영역(본 연구에서 곰팡이 식민지의 중심 부분의 5mm 블록)의 세어진 코니디아 번호는 상이한 정시에 배양된 플레이트에서 다른 곰팡이 종과 균주까지 도합된 효혈의 성장 압축력의 다른 성능을 드러내는 문제점을 제기하고, 샘플링의 비대표성으로 이어질 수 있습니다. 따라서, 코니디아 생산을 위한 엄격한 시험 방법은 전체 곰팡이 식민지의 코니디아 수를 정확하게 계산하고 성장 영역과 정상화하는 등의 문제를 개선할 수 있다42.
효과적인 코니디아 번호(ECN) 포뮬러는 EPF 코니디아에 대한 환경 스트레스의 영향에 기초하여 설계되었으며, 즉 야생 환경의 조건하에서 코니아를 시뮬레이션하여 상용화를 위한 유망한 곰팡이 균주를 선택한다21. 본 프로토콜에서, 코니디아 생산 및 열처리의 데이터는 이전 연구21에 이어, 각각의 유망한 곰팡이 균주의 총 ECN 값의 계산을 위해 사용되었다21. 또한, 자연 환경 하에서, 온도를 제외한 습도, 자외선(UV) 및 호스트와 같은 다른 환경 스트레스는 코니디아 발아에 영향을 미칠 수 있다. 특히, UV 스트레스는 UV에 의해 생성된 고에너지 활성산소(과산화물, 하이드록실 군 및 단일 산소와 같은)가 미생물 살충제의 병원성과 지속성을 감소시킬 수 있기 때문에 코니디아 발아에 영향을 미치는 주요 인자이다. 따라서, UV 응력은 향후 ECN 포뮬러에 더 포함될 수 있다. UV 응력을 피하기 위해, 포뮬러는 conidia4,45,46의 UV 내성을 증가시키기 위해 오일 또는 알기네이트 나트륨을 포함해야하며, 이는 잠재적 인 균주가 해충 방제47에 대한 실용성을 가지고 있음을 확인합니다.
본 프로토콜은 T. molitor 매개 EPF 라이브러리를 구성하는 잠재적EPF 균주의 빠르고 정밀한 격리방법을 제공했습니다. 이것은 기초이며 생물학적 통제 연구의 발달에 필요합니다. 또한, ECN 공식은 연구원이 EPF의 잠재력을 파악하고 농업 시스템에 사용하기 위한 상품으로 개발할 수 있도록 유연하게 개선될 수 있습니다.
공개
저자는 이 작품에 관련된 이해 상충이 없다고 선언합니다.
감사의 말
이 연구는 그랜트에 의해 지원되었다 109-2313-B-005 -048 -MY3 과학기술부에서 (MOST).
자료
| Name | Company | Catalog Number | Comments |
| Agar Bacteriological grade | BIOMAN SCIENTIFIC Co., Ltd. | AGR001 | Suitable in most cell culture/molecular, biology applications. |
| AGAROSE, Biotechnology Grade | BIOMAN SCIENTIFIC Co., Ltd. | AGA001 | For DNA electrophoresis. |
| BioGreen Safe DNA Gel Buffer | BIOMAN | SDB001T | |
| Brass cork borer | Dogger | D89A-44001 | |
| Canon kiss x2 | Canon | EOS 450D | For record strain colony morphology |
| Constant temperature incubator | Yihder Co., Ltd. | LE-509RD | Fungal keeping. |
| cubee Mini-Centrifuge | GeneReach | MC-CUBEE | |
| DigiGel 10 Digital Gel Image System | TOPBIO | DGIS-12S | |
| Finnpipette F2 0.2 to 2 µL Pipette | Thermo Scientific | 4642010 | |
| Finnpipette F2 1 to 10 µL Pipette | Thermo Scientific | 4642030 | |
| Finnpipette F2 10 to 100 µL Pipette | Thermo Scientific | 4642070 | |
| Finnpipette F2 100 to 1000 µL Pipette | Thermo Scientific | 4642090 | |
| Finnpipette F2 2 to 20 µL Pipette | Thermo Scientific | 4642060 | |
| Finnpipette F2 20 to 200 µL Pipette | Thermo Scientific | 4642080 | |
| GeneAmp PCR System 9700 | Applied Biosystems | 4342718 | |
| GenepHlow Gel/PCR Kit | Geneaid | DFH100 | |
| Genius Dry Bath Incubator | Major Science | MD-01N | |
| Graduated Cylinder Custom A 100mL | SIBATA | SABP-1195906 | Measure the volume of reagents. |
| Hand tally counter | SDI | NO.1055 | |
| Hemocytometer | bioman | AP-0650010 | Calculate the number of spore |
| Inoculating loop | Dogger | D8GA-23000 | |
| lid | IDEAHOUSE | RS92004 | |
| Micro cover glass | MUTO PURE CHEMICALS CO.,LTD | 24241 | |
| Microscope imaging system | SAGE VISION CO.,LTD | SGHD-3.6C | |
| Microscope Slides | DOGGER | DG75001-07105 | |
| Mupid-2plus DNA Gel Electrophoresis | ADVANCE | AD110 | |
| Nikon optical microscope | SAGE VISION CO.,LTD | Eclipse CI-L | |
| Plastic cup | IDEAHOUSE | CS60016 | |
| Presto Mini gDNA Yeast Kit | Geneaid | GYBY300 | Fungal genomic DNA extraction kit |
| Sabouraud Dextrose Broth (Sabouraud Liquid Medium) | HiMedia Leading BioSciences Company | M033 | Used for cultivation of yeasts, moulds and aciduric microorganisms. |
| Scalpel Blade No.23 | Swann-Morton | 310 | |
| Scalpel Handle No.4 | AGARWAL SURGICALS | SSS -FOR-01-91 | |
| Shovel | Save & Safe | A -1580242 -00 | |
| Silwet L-77 | bioman(phytotech) | S7777 | Surfactant |
| Sorvall Legend Micro 17 Microcentrifuge | Thermo Scientific | 75002403 | |
| Steel Tweezers | SIPEL ELECTRONIC SA | GG-SA | |
| Sterile Petri Dish | BIOMAN SCIENTIFIC Co., Ltd. | 1621 | Shallow cylindrical containers with fitted lids, specifically for microbiology or cell culture use. |
| ThermoCell MixingBlock | BIOER | MB-101 | |
| Tween 80 | FUJIFILM Wako Pure Chemical Corporation | 164-21775 | |
| TwinGuard ULT Freezer | Panasonic Healthcare Holdings Co., Ltd. | MDF-DU302VX | -80°C sample stored. |
| Vertical floor type cabinet | Chih Chin | BSC-3 | Fungal operating culturing. |
| Vortex Genie II | Scientific | SIG560 | |
| Zipper storage bags | Save & Safe | A -1248915 -00 | |
| 100 bp DNA Ladder | Geneaid | DL007 | |
| -20°C Freezer | FRIGIDAIRE | Frigidaire FFFU21M1QW | -20°C sample and experimental reagents stored. |
| 2X SuperRed PCR Master Mix | TOOLS | TE-SR01 | |
| 50X TAE Buffer | BIOMAN | TAE501000 |
참고문헌
- Wraight, S. P., Carruthers, R. I. Biopesticides: use and Delivery. , Springer. 233-269 (1999).
- Chase, A., Osborne, L., Ferguson, V. Selective isolation of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae from an artificial potting medium. Florida Entomologist. , 285-292 (1986).
- Meyling, N. V. Methods for isolation of entomopathogenic fungi from the soil environment. University of Copenhagen. , Frederiksberg Denmark. Department of Ecology 1-18 (2007).
- Zimmermann, G. The 'Galleria bait method'for detection of entomopathogenic fungi in soil. Journal of applied Entomology. 102 (1-5), 213-215 (1986).
- Schneider, S., Widmer, F., Jacot, K., Kölliker, R., Enkerli, J. Spatial distribution of Metarhizium clade 1 in agricultural landscapes with arable land and different semi-natural habitats. Applied Soil Ecology. 52, 20-28 (2012).
- Hallouti, A., et al. Diversity of entomopathogenic fungi associated with Mediterranean fruit fly (Ceratitis capitata (Diptera: Tephritidae)) in Moroccan Argan forests and nearby area: impact of soil factors on their distribution. BMC Ecology. 20 (1), 1-13 (2020).
- Meyling, N. V., Eilenberg, J. Occurrence and distribution of soil borne entomopathogenic fungi within a single organic agroecosystem. Agriculture, Ecosystems and Environment. 113 (1-4), 336-341 (2006).
- Skalický, A., Bohatá, A., Šimková, J., Osborne, L. S., Landa, Z. Selection of indigenous isolates of entomopathogenic soil fungus Metarhizium anisopliae under laboratory conditions. Folia Microbiologica. 59 (4), 269-276 (2014).
- Veen, K., Ferron, P. A selective medium for the isolation of Beauveria tenella and of Metarrhizium anisopliae. Journal of Invertebrate Pathology. 8 (2), 268-269 (1966).
- Goettel, M., Inglis, D. Manual of Techniques in Insect Pathology. Lacy, L. , Academic. Amsterdam. 213-249 (1997).
- Luz, C., Netto, M. C. B., Rocha, L. F. N. In vitro susceptibility to fungicides by invertebrate-pathogenic and saprobic fungi. Mycopathologia. 164 (1), 39-47 (2007).
- Mantzoukas, S., et al. Trapping entomopathogenic fungi from vine terroir soil samples with insect baits for controlling serious pests. Applied Sciences. 10 (10), 3539(2020).
- Goble, T., Dames, J., Hill, M., Moore, S. The effects of farming system, habitat type and bait type on the isolation of entomopathogenic fungi from citrus soils in the Eastern Cape Province, South Africa. BioControl. 55 (3), 399-412 (2010).
- Nishi, O., Iiyama, K., Yasunaga-Aoki, C., Shimizu, S. Isolation of entomopathogenic fungi from soil by using bait method with termite, Reticulitermes speratus. Enotomotech. 35, 21-26 (2011).
- Castrillo, L. ARS Collection of Entomopathogenic Fungal Cultures (ARSEF). , (2014).
- Fungal database WorldWide Collection of Entomopathogenic Fungi. University of Vermont. , Available from: http://www.uvm.edu/~entlab/Fungus.html (2019).
- Kim, J. C., et al. Tenebrio molitor-mediated entomopathogenic fungal library construction for pest management. Journal of Asia-Pacific Entomology. 21 (1), 196-204 (2018).
- Keyser, C. A., Henrik, H., Steinwender, B. M., Meyling, N. V. Diversity within the entomopathogenic fungal species Metarhizium flavoviride associated with agricultural crops in Denmark. BMC Microbiology. 15 (1), 1-11 (2015).
- Quesada-Moraga, E., Navas-Cortés, J. A., Maranhao, E. A., Ortiz-Urquiza, A., Santiago-Álvarez, C. Factors affecting the occurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycological Research. 111 (8), 947-966 (2007).
- Park, J. B., et al. Developmental characteristics of Tenebrio molitor larvae (Coleoptera: Tenebrionidae) in different instars. International Journal of Industrial Entomology. 28 (1), 5-9 (2014).
- Chang, J. -C., et al. Construction and selection of an entomopathogenic fungal library from soil samples for controlling Spodoptera litura. Frontiers in Sustainable Food Systems. 5, 15(2021).
- Podder, D., Ghosh, S. K. A new application of Trichoderma asperellum as an anopheline larvicide for eco friendly management in medical science. Scientific reports. 9 (1), 1-15 (2019).
- Geneaid Biotech Ltd. Presto Mini gDNA Yeast, Ver. 04.27.17. , Available from: https://www.geneaid.com/data/files/1605664221308055331.pdf (2021).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR protocols: A guide to methods and applications. 18 (1), 315-322 (1990).
- Kepler, R. M., Humber, R. A., Bischoff, J. F., Rehner, S. A. Clarification of generic and species boundaries for Metarhizium and related fungi through multigene phylogenetics. Mycologia. 106 (4), 811-829 (2014).
- Kepler, R. M. A phylogenetically-based nomenclature for Cordycipitaceae (Hypocreales). IMA Fungus. 8 (2), 335-353 (2017).
- National Resource for Biomedical Supercomputing. GeneDoc: a tool for editing and annotating multiple sequence alignments. Pittsburgh Supercomputing Center's National Resource for Biomedical Supercomputing. , Available from: http://www.nrbsc.org/downloads (1997).
- Thompson, J. D., Gibson, T. J., Plewniak, F., Jeanmougin, F., Higgins, D. G. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research. 25 (24), 4876-4882 (1997).
- Kumar, S., Stecher, G., Tamura, K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution. 33 (7), 1870-1874 (2016).
- Herlinda, S., Mulyati, S. I. Selection of isolates of entomopathogenic fungi and the bioefficacy of their liquid production against Leptocorisa oratorius nymphs. Microbiology Indonesia. 2 (3), 9(2008).
- Herlinda, S., Irsan, C., Mayasari, R., Septariani, S. Identification and selection of entomopathogenic fungi as biocontrol agents for Aphis gossypii from South Sumatra. Microbiology Indonesia. 4 (3), 137-142 (2010).
- Montes-Bazurto, L. G., Peteche-Yonda, Y., Medina-Cardenas, H. C., Bustillo-Pardey, A. E. Selection of entomopathogenic fungi for the biological control of Demotispa neivai (Coleoptera: Chrysomelidae) in oil palm plantations in Colombia. Journal of Entomological Science. 55 (3), 388-404 (2020).
- Shin, T. -Y., Choi, J. -B., Bae, S. -M., Koo, H. -N., Woo, S. -D. Study on selective media for isolation of entomopathogenic fungi. International Journal of Industrial Entomology. 20 (1), 7-12 (2010).
- Sharma, L., Oliveira, I., Torres, L., Marques, G. Entomopathogenic fungi in Portuguese vineyards soils: Suggesting a 'Galleria-Tenebrio-bait method'as bait-insects Galleria and Tenebrio significantly underestimate the respective recoveries of Metarhizium (robertsii) and Beauveria (bassiana). MycoKeys. (38), 1(2018).
- Rodríguez, M., Gerding, M., France, A. Selección de Hongos Entomopatógenos para el Control de Varroa destructor (Acari: Varroidae). Chilean journal of agricultural research. 69 (4), 534-540 (2009).
- Yang, H., et al. Persistence of Metarhizium (Hypocreales: Clavicipitaceae) and Beauveria bassiana (Hypocreales: Clavicipitaceae) in tobacco soils and potential as biocontrol agents of Spodoptera litura (Lepidoptera: Noctuidae). Environmental entomology. 48 (1), 147-155 (2019).
- Muñiz-Reyes, E., Guzmán-Franco, A. W., Sánchez-Escudero, J., Nieto-Angel, R. Occurrence of entomopathogenic fungi in tejocote (C rataegus mexicana) orchard soils and their pathogenicity against R hagoletis pomonella. Journal of Applied Microbiology. 117 (5), 1450-1462 (2014).
- Lacey, L. A., et al. Goettel Insect pathogens as biological control agents: Back to the future. Journal of Invertebrate Pathology. 132, 1-41 (2015).
- Humber, R. A. Manual of techniques in insect pathology. , Elsevier. 153-185 (1997).
- Rehner, S. A., Buckley, E. A Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia. 97 (1), 84-98 (2005).
- Quandt, C. A., et al. Phylogenetic-based nomenclatural proposals for Ophiocordycipitaceae (Hypocreales) with new combinations in Tolypocladium. IMA fungus. 5 (1), 121-134 (2014).
- Shah, F. A., Wang, C. S., Butt, T. M. Nutrition influences growth and virulence of the insect-pathogenic fungus Metarhizium anisopliae. FEMS Microbiology Letters. 251 (2), 259-266 (2005).
- Ignoffo, C. Environmental factors affecting persistence of entomopathogens. Florida Entomologist. , 516-525 (1992).
- Rodrigues, I. W., Forim, M., Da Silva, M., Fernandes, J., Batista Filho, A. Effect of ultraviolet radiation on fungi Beauveria bassiana and Metarhizium anisopliae, pure and encapsulated, and bio-insecticide action on Diatraea saccharalis. Advances in Entomology. 4 (3), 151-162 (2016).
- Paula, A. R., Ribeiro, A., Lemos, F. J. A., Silva, C. P., Samuels, R. I. Neem oil increases the persistence of the entomopathogenic fungus Metarhizium anisopliae for the control of Aedes aegypti (Diptera: Culicidae) larvae. Parasites and Vectors. 12 (1), 1-9 (2019).
- Morley-Davies, J., Moore, D., Prior, C. Screening of Metarhizium and Beauveria spp. conidia with exposure to simulated sunlight and a range of temperatures. Mycological Research. 100 (1), 31-38 (1996).
- Rangel, D. E., Braga, G. U., Flint, S. D., Anderson, A. J., Roberts, D. W. Variations in UV-B tolerance and germination speed of Metarhizium anisopliae conidia produced on insects and artificial substrates. Journal of Invertebrate Pathology. 87 (2-3), 77-83 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유