Method Article
Reçine Destekli Yakalama, Protein Thiol Oksidasyonunun Çoklanmış Niceliği için İzobarik Tandem Kütle Etiketi Etiketleme ile Birleştirildiğinde
Bu Makalede
Özet
Protein tiol oksidasyonunun normal fizyolojik ve patofizyolojik koşullar altında önemli etkileri vardır. Reçine destekli yakalama, izobarik etiketleme ve kütle spektrometrisini kullanan, proteinlerin geri dönüşümlü olarak oksitlenmiş sistein kalıntılarının bölgeye özgü tanımlanmasını ve nicelleştirilmesini sağlayan kantitatif bir redoks proteomik yönteminin ayrıntılarını açıklıyoruz.
Özet
Protein tiolleri üzerindeki geri dönüşümlü oksidatif modifikasyonlar son zamanlarda hücresel fonksiyonun önemli aracıları olarak ortaya çıkmıştır. Burada, proteom seviyesinde oksitlenmiş protein tiyollerinin çoklanmış stokiyometrik nicelleştirilmesine izin vermek için tandem kütle etiketi (TMT) izobarik etiketleme ve sıvı kromatografi-tandem kütle spektrometrisi (LC-MS / MS) ile birlikte reçine destekli yakalama (RAC) kullanan kantitatif bir redoks proteomik yönteminin ayrıntılı prosedürünü açıklamaktayız. Oksitlenmiş sistein kalıntıları hakkındaki bölgeye özgü kantitatif bilgiler, bu tür modifikasyonların fonksiyonel etkileri hakkında ek bilgi sağlar.
İş akışı, kültürlenmiş hücreler (örneğin, memeli, prokaryotik) ve başlangıçta lize edilen / homojenize edilen ve yapay oksidasyonu önlemek için alkillenen serbest tiollerle birlikte tüm dokular (örneğin, kalp, akciğer, kas) dahil olmak üzere birçok numune türüne uyarlanabilir. Oksitlenmiş protein tiolleri daha sonra indirgenir ve bir tiol-afinite reçinesi tarafından yakalanır, bu da devam eden sindirim, etiketleme ve yıkama prosedürlerinin ek protein / peptit transferi olmadan gerçekleştirilmesine izin vererek iş akışı adımlarını kolaylaştırır ve basitleştirir. Son olarak, etiketli peptitler, tüm proteom boyunca tiol oksidasyonu ile ilgili kapsamlı stokiyometrik değişiklikleri ortaya çıkarmak için LC-MS / MS tarafından salınır ve analiz edilir. Bu yöntem, protein tiol oksidasyonu ile ilgili fizyolojik ve patofizyolojik durumlar altında redoksa bağımlı regülasyonun rolünün anlaşılmasını büyük ölçüde geliştirir.
Giriş
Homeostatik koşullar altında, hücreler hem prokaryotlara hem de ökaryotlara uzanan metabolizma ve sinyal 1,2,3 gibi süreçleri kolaylaştırmaya yardımcı olan reaktif oksijen, azot veya kükürt türleri üretir. Bu reaktif türlerin fizyolojik seviyeleri, 'eustress' olarak da bilinen düzgün hücresel fonksiyon için gereklidir1,4. Buna karşılık, oksidanlarda oksidanlar ve antioksidanlar arasında dengesizliğe yol açan bir artış, oksidatif strese veya hücresel hasara yol açan "sıkıntıya" neden olabilir1. Oksidanlar, protein, DNA, RNA ve lipitler dahil olmak üzere farklı biyomolekülleri değiştirerek sinyalleri biyolojik yollara dönüştürür. Özellikle, proteinlerin sistein kalıntıları, farklı oksidan türlerine karşı reaktif olan sistein üzerindeki tiol grubu nedeniyle oksidasyona eğilimli oldukça reaktif bölgelerdir5. Bu, nitrosilasyon (SNO), glutatyonilasyon (SSG), sülfenilasyon (SOH), persülfidasyon (SSH), polisülfidasyon (SSnH), asilasyon ve disülfidler dahil olmak üzere sistein için çeşitli geri dönüşümlü redoks bazlı posttranslasyonel modifikasyonlara (PTM'ler) yol açar. Sistein oksidasyonunun geri dönüşümsüz formları arasında sülfinilasyon (S02H) ve sülfonilasyon (S3H) bulunur.
Sistein kalıntılarının geri dönüşümlü oksidatif modifikasyonları, daha fazla geri dönüşümsüz oksidasyonu önleyen koruyucu rollere hizmet edebilir veya aşağı akış hücresel yolları için sinyal molekülleri olarak işlev görebilir 6,7. Bazı tiol redoks PTM'lerinin geri dönüşümlülüğü, sistein bölgelerinin "redoks anahtarları" olarak işlev görmesine izin verir8,9, burada bu bölgelerin redoks durumundaki değişiklikler, geçici süreçlerdeki rollerini düzenlemek için protein fonksiyonunu değiştirir. Redoks PTM'lerin10'un modülatör etkileri, kataliz 12, protein-protein etkileşimleri 13, konformasyon değişikliği 14, metal iyonu koordinasyonu 15 veya farmakolojik inhibitör bağlama 16 dahil olmak üzere protein fonksiyonu 11'in birçok alanında gözlenmiştir. Ek olarak, redoks PTM'ler, transkripsiyon17, translasyon18 veya metabolizma19 gibi yolları düzenleyen proteinlerin sistein bölgelerinde rol oynar. Redoks PTM'lerinin protein fonksiyonu ve biyolojik süreçler üzerindeki etkisi göz önüne alındığında, redoks durumunun bozulmasına yanıt olarak bir sistein bölgesinin maruz kaldığı oksidasyonun derecesini ölçmek önemlidir.
Değişmiş redoks durumlarına sahip sistein bölgelerinin tanımlanması, normal ve bozulmuş koşullar arasında bölgeye özgü düzeyde oksidasyon durumunun karşılaştırılmasına odaklanmıştır. Katlama değişimi ölçümleri genellikle hangi bölgelerin önemli ölçüde değiştirildiğini belirlemek için kullanılır, çünkü bu, kullanıcıların hangi sistein bölgelerinin çalışma için fizyolojik olarak önemli olabileceğini yorumlamalarına yardımcı olur. Alternatif olarak, belirli bir numune tipi boyunca geri dönüşümlü tiol oksidasyonunun stokiyometrik ölçümleri, hücresel oksidasyona ilişkin fizyolojik durumun genel bir resmini verir, bu da genellikle göz ardı edilen ve az kullanılan önemli bir ölçümdür. Modifikasyon stokiyometrisi, modifiye tiyolün yüzdesinin toplam protein tiol (modifiye edilmiş ve değiştirilmemiş) 20,21'e oranı olarak ölçülmesine dayanır. Sonuç olarak, stokiyometrik ölçümler, özellikle kütle spektrometrisi kullanıldığında, kıvrım değişiminden daha hassas bir ölçüm sunar. Oksidasyondaki artışın önemi, belirli bir sistein bölgesinin PTM doluluğunu belirlemek için stokiyometri kullanılarak daha kolay tespit edilebilir. Örneğin, tiol oksidasyonunda 3 kat artış,% 1 ila% 3 kadar küçük veya% 30 ila% 90 kadar büyük bir geçişten kaynaklanabilir. Sadece% 1 dolulukta olan bir bölge için oksidasyonda 3 kat artış, bir proteinin işlevi üzerinde çok az etkiye sahip olabilir; ancak, dinlenme durumunda% 30 doluluğa sahip bir site için 3 kat artış daha önemli ölçüde etkilenebilir. Stokiyometrik ölçümler, toplam oksitlenmiş tioller ile protein glutatyonilasyonu (SSG) ve nitrosilasyon (SNO) dahil olmak üzere spesifik oksidatif modifikasyonlar arasında yapıldığında, spesifik modifikasyon tiplerine göre oranları ve nicel bilgileri ortaya çıkarabilir.
Geri dönüşümlü tiol oksidasyonu tipik olarak düşük bollukta bir posttranslasyonel modifikasyon olduğundan, bu modifikasyonları içeren proteinlerin biyolojik örneklerden zenginleştirilmesi için çoklu yaklaşımlar geliştirilmiştir. Jaffrey ve diğerleri tarafından geliştirilen ve biyotin anahtar tekniği (BST)22 olarak adlandırılan erken bir yaklaşım, modifiye edilmemiş tiyollerin alkilasyon yoluyla bloke edildiği, geri dönüşümlü olarak modifiye edilmiş tiollerin yeni ortaya çıkan serbest tiollere indirgendiği, yeni ortaya çıkan serbest tiollerin biyotin ile etiketlendiği ve etiketli proteinlerin streptavidin afinitesi pulldown ile zenginleştirildiği birçok adımı içerir. Bu teknik, birçok çalışmada SNO ve SSG'nin profilini çıkarmak için kullanılmıştır ve diğer geri dönüşümlü tiol oksidasyon formları için prob 23,24'e uyarlanabilir. BST, farklı tersinir tiol oksidasyon formlarını araştırmak için kullanılmış olsa da, bu yaklaşımla ilgili bir endişe, zenginleştirmenin, biyotinillenmemiş proteinlerin streptavidin'e spesifik olmayan bağlanmasından etkilenmesidir. Laboratuvarımızda geliştirilen reçine destekli yakalama (RAC)25,26 (Şekil 1) adlı alternatif bir yaklaşım, biyotin-streptavidin sistemi aracılığıyla tiol gruplarının zenginleştirilmesi sorununu aşmaktadır.
Geri dönüşümlü olarak oksitlenmiş tiyollerin indirgenmesini takiben, yeni ortaya çıkan serbest tiollere sahip proteinler, serbest tiol gruplarını kovalent olarak yakalayan ve sistein içeren proteinlerin BST'den daha spesifik zenginleşmesine izin veren tiol-afinite reçinesi ile zenginleştirilir. RAC'yi izobarik etiketleme ve kütle spektrometresindeki son gelişmelerin çoklama gücü ile birleştirmek, proteom çapında geri dönüşümlü olarak oksitlenmiş sistein kalıntılarının zenginleştirilmesi, tanımlanması ve nicelleştirilmesi için sağlam ve hassas bir iş akışı yaratır. Kütle spektrometresindeki son gelişmeler, tiol redoks proteomunun çok daha derin profillenmesini sağlayarak protein tiol oksidasyonunun hem nedeninin hem de etkisinin anlaşılmasını sağlamıştır27. Sahaya özgü nicel verilerden elde edilen bilgiler, geri dönüşümlü oksidatif modifikasyonların mekanik etkileri ve aşağı yönlü etkileri hakkında daha fazla çalışmaya izin verir28. Bu iş akışının kullanılması, SSG seviyelerinin yaşa göre farklılık gösterdiği yaşlanma gibi normal fizyolojik olaylarla ilgili olarak geri dönüşümlü sistein oksidasyonunun fizyolojik etkileri hakkında fikir vermiştir. SSG üzerindeki yaşlanma etkileri, mitokondriyal fonksiyonu artıran ve yaşlı farelerde SSG seviyelerini azaltan ve genç farelere daha benzer bir SSG profiline sahip olmalarına neden olan yeni bir peptid olan SS-31 (elamipretid) kullanılarak kısmen tersine çevrildi29.
Nanopartikül maruziyetine atfedilen patofizyolojik koşulların, bir fare makrofaj modelinde SSG'yi içerdiği gösterilmiştir. Kütle spektrometrisi ile birlikte RAC kullanarak, yazarlar SSG seviyelerinin oksidatif stres derecesi ve makrofaj fagositik fonksiyonunun bozulması ile doğrudan ilişkili olduğunu göstermiştir. Veriler ayrıca, farklı derecelerde oksidatif strese neden olan farklı mühendislik nanomalzemelerine yanıt olarak yola özgü farklılıkları da ortaya koydu30. Yöntem ayrıca, fotosentetik siyanobakterilerdeki günlük döngülerin tiol oksidasyonuna ilişkin etkilerini incelemek için uygulandığı prokaryotik türlerde de faydasını kanıtlamıştır. Elektron taşınması, karbon fiksasyonu ve glikoliz dahil olmak üzere çeşitli önemli biyolojik işlemlerde tiol oksidasyonunda geniş değişiklikler gözlenmiştir. Ayrıca, ortogonal validasyon yoluyla, bu oksidatif modifikasyonların düzenleyici rollerini düşündüren birkaç önemli fonksiyonel bölgenin modifiye edildiği doğrulanmıştır6.
Burada, proteinlerin toplam oksitlenmiş sistein tiyollerinin zenginleştirilmesi ve bunların sonraki etiketlemesi ve stokiyometrik nicelleştirilmesi için RAC yaklaşımının faydasını gösteren standartlaştırılmış bir iş akışının ayrıntılarını açıklıyoruz (Şekil 1). Bu iş akışı, hücre kültürleri27,30 ve tüm dokular (örneğin, iskelet kası, kalp, akciğer) 29,31,32,33 dahil olmak üzere farklı örnek tiplerinde redoks durumu çalışmalarında uygulanmıştır. Buraya dahil edilmemiş olsa da, RAC protokolü, daha önce de belirtildiği gibi SSG, SNO ve S-asilasyonu dahil olmak üzere geri dönüşümlü redoks modifikasyonlarının spesifik formlarının araştırılması için kolayca uyarlanmıştır 25,29,34.
Protokol
Hayvan veya insan örnekleri/dokuları ile ilgili protokolde açıklanan tüm prosedürler, insan ve hayvan araştırmaları etik komitesinin kurumsal kılavuzları tarafından onaylanmış ve takip edilmiştir.
1. Numune homojenizasyonu/lizisi
- Dondurulmuş doku örnekleri
- Bir cam mikroskop üzerinde dondurulmuş dokuyu (~ 30 mg) kıymak, önceden soğutulmuş bir tıraş bıçağı ve forseps kullanarak kuru buz üzerinde kaydırır. Kıyılmış dokuyu 700 μL tampon A içeren önceden soğutulmuş 5 mL yuvarlak tabanlı polistiren bir tüpe aktarın (bakınız Tablo 1) ve ışıktan korunmuş 30 dakika boyunca buz üzerinde inkübe edin.
- Dokuyu 30 s boyunca veya elde tutulan bir doku homojenizatörü ile tamamen homojenize edilene kadar bozun. Numuneleri buz üzerine yerleştirin ve köpüğün 10 dakika daha azalmasına izin verin.
NOT: Kuru buz üzerine yerleştirilmiş alüminyum fırın tepsisi, dokunun ilk işlenmesi/kıyılması için sabit bir çalışma yüzeyi ve platform sağlar.
- Alternatif olarak, başlangıç malzemesi olarak 100 mm'lik kültür tabaklarında yapışkan hücre kültürleri kullanın.
- Hücreleri buz üzerinde tutun ve hücreleri 100 mM NEM içeren 10 mL buz gibi soğuk PBS ile iki kez durulamak için serolojik bir pipet kullanın.
- 1 mL soğuk homojenizasyon/lizis tamponu ekleyerek ve sert hücre kazıyıcı ile kuvvetlice kazıyarak hücreleri lize edin. Bir mikropipet kullanarak lizatı 2 mL'lik bir santrifüj tüpüne aktarın.
NOT: Durulama tamponu ve lizis tamponu, farklı boyuttaki kültür kaplarına göre ölçeklendirilebilir. Tipik olarak, 2-5 milyon hücre gereklidir; Bununla birlikte, bu, belirli hücre tipleri için lizis verimliliğine ve protein verimine bağlı olarak değişir. Homojenizasyon tamponu, toplam tioller için analiz edilen numuneler için NEM olmadan hazırlanabilir.
- Elde edilen homojenatı (adım 1.1.2 veya 1.2.2) bir mikropipet kullanarak 2 mL'lik bir santrifüj tüpüne aktarın ve 10 dakika boyunca 4 °C'de tam hızda (≥16.000 × g) santrifüj yapın.
- Süpernatantı (hücre kültürü için ~700 μL veya ~1 mL) bir mikropipet kullanarak 5 mL'lik konik bir mikrosantrifüj tüpüne aktarın ve karanlıkta 55 ° C'de 30 dakika boyunca 850 rpm'de sallanarak inkübe edin.
- Bir cam serolojik pipet kullanarak, numunelere 4 mL buz gibi soğuk aseton ekleyin ve proteinin çökeltilmesi ve fazla N-etilmaleimidin uzaklaştırılması için gece boyunca -20 ° C'de inkübe edin.
2. Reçine destekli yakalama
- Çökeltilmiş protein peletlerini 10 dakika boyunca 4 °C'de 20.500 × g'da santrifüj yaparak, asetonu boşaltarak, kalan asetonu bir mikropipet kullanarak çıkararak ve bir cam serolojik pipet kullanarak 3 mL taze, buz gibi soğuk aseton ekleyerek asetonla iki kez yıkayın. Karıştırmak için birkaç kez ters çevirin. İkinci yıkamadan sonra, peletlerin 1-2 dakika boyunca hava ile kurumasına izin verin, yeniden süspansiyon zorlaşabileceğinden aşırı kurumamaya dikkat edin.
- Bir mikropipet kullanarak, 1 mL tampon B ekleyin ( Tablo 1'e bakınız) ve 250 W çıkışlı ve kısa girdaplı bir banyo sonikatör kullanarak bir seferde 15-30 s tekrarlanan sonikasyon kullanarak proteini çözün. Üreticinin protokolüne göre bikinkoninik asit (BCA) testini kullanarak protein konsantrasyonunu ölçün.
- Daha ileri işlemler için numuneler arasındaki protein konsantrasyonlarını standartlaştırmak ve NEM'in tamamen uzaklaştırılmasını sağlamak için, 500 μg proteini bir mikropipet kullanarak 0,5 mL 10 kDa santrifüj filtreye aktarın ve resüsitasyon tamponu ile 500 μL'lik bir son hacme ayarlayın.
- Santrifüj filtredeki hacim 100 μL'den az olana kadar oda sıcaklığında 14.000 × g'da santrifüj. 2 dakika boyunca 1.000 × g'da santrifüj yapın ve C tamponunu kullanarak 500 μL'lik bir son hacme ayarlayın (bkz. Tablo 1).
- Bir mikropipet kullanarak 20 mM'lik son konsantrasyona 20 μL 500 mM ditiyotreitol (DTT) ekleyerek ve numuneleri 850 rpm'de sallarken 37 ° C'de 30 dakika boyunca inkübe ederek protein tiollerini azaltın.
- İndirgemeden sonra, numuneleri bir mikropipet kullanarak 0,5 mL 10 kDa santrifüj filtrelere ve oda sıcaklığında 14.000 × g'da 15 dakika boyunca santrifüj ile veya santrifüj filtresindeki hacim 100 μL'den az olana kadar aktarın.
- Santrifüjlemeyi ve 2.6. adımda 500 μL'ye eklemeyi üç kez tekrarlayın ve dördüncü santrifüjlemeden sonra, filtreyi bir toplama tüpünde ters çevirerek ve 2 dakika boyunca 1.000 × g'de santrifüj yaparak numuneleri toplayın.
- BCA testini üreticinin protokolüne göre kullanarak protein konsantrasyonunu ölçün.
- Bu tampon değişimi sırasında, bir mikro terazi kullanarak uygun miktarda reçineyi (30 mg/numune) tartarak ve 50 mL'lik bir santrifüj tüpüne aktararak tiol-afiniteli reçineyi hazırlayın. Daha sonra, serolojik bir pipet kullanarak, 30 mg / mL reçinenin son konsantrasyonu için su ekleyin ve reçinenin uygun şekilde hidrasyonu için ajitasyonla oda sıcaklığında 1 saat boyunca inkübe edin.
NOT: Yukarıda bahsedilen tiol afiniteli reçine, üretici tarafından durdurulmuştur. Bu tiol afiniteli reçine için olası bir yedek ticari olarak temin edilebilir. Bununla birlikte, bu değiştirme yaklaşık 5 kat daha az bağlama kapasitesine sahiptir (bkz. Alternatif olarak, tiol-afinite reçinesi, 2-(piridildiyo) etilamin hidroklorür ve N-hidroksisüksinimidle aktive edilmiş reçine kullanılarak sentezlenebilir (Ek Bilgilere bakınız).- Reçinenin hidrasyonundan sonra, spin kolonlarını bir vakum manifolduna yerleştirin ve her kolona bir mikropipet kullanarak reçine bulamacının 500 μL'sini aktarın. Suyun uzaklaştırılması için vakum uygulayın; Sütun başına toplam 30 mg reçine elde etmek için bu adımı bir kez tekrarlayın. Alternatif olarak, bunun için vakum manifoldunu ve tüm reçine yıkama ve elüsyon adımlarını kullanmak yerine 2 dakika boyunca 1.000 × g'da santrifüj yapın.
NOT: Delik boyutunu artırmak için 1000 μL'lik pipet ucunun ucunun kesilmesi, reçinenin aktarılmasına yardımcı olur. Reçinenin askıda kalmasını ve homojen ve eşit miktarda reçinenin her sütuna aktarılmasını sağlamak için pipetleme arasında tritürasyon yapılması önemlidir. - Reçineyi, bir mikropipetle 500 μL ultra saf su ekleyerek ve suyun uzaklaştırılması için vakum uygulayarak yıkayın; bunu 5 kez tekrarlayın. Daha sonra, reçineyi 500 μL tampon E ile 5 kez yıkayın (bkz. Tablo 1).
NOT: Alternatif olarak, sonraki tüm yıkama adımları için vakum manifoldu yerine 2 dakika boyunca 1.000 x g'de santrifüjleme kullanılabilir. Tüm ilerleyen yıkama adımları 500 μL'lik bir hacimle gerçekleştirilir. Kolona yıkama tamponları eklerken, sıçramayı ve reçine kaybını önlerken reçineyi tamamen askıya almak için yeterli kuvvetle dikkatlice ekleyin; bu, reçinenin tam ve verimli bir şekilde yıkanmasını sağlar.
- Reçinenin hidrasyonundan sonra, spin kolonlarını bir vakum manifolduna yerleştirin ve her kolona bir mikropipet kullanarak reçine bulamacının 500 μL'sini aktarın. Suyun uzaklaştırılması için vakum uygulayın; Sütun başına toplam 30 mg reçine elde etmek için bu adımı bir kez tekrarlayın. Alternatif olarak, bunun için vakum manifoldunu ve tüm reçine yıkama ve elüsyon adımlarını kullanmak yerine 2 dakika boyunca 1.000 × g'da santrifüj yapın.
- Bir mikropipet kullanarak, her indirgenmiş numuneden 150 μg proteini yeni bir tüpe aktarın ve 120 μL tampon C'nin son hacmine ayarlayın (bkz. Tablo 1). Protein çözeltisini bir mikropipet kullanarak reçineyi içeren tıkanmış bir sıkma kolonuna aktarın, kapağı kolona yerleştirin ve oda sıcaklığında 850 rpm'de çalkalayarak 2 saat inkübe edin.
- Reçineyi 25 mM HEPES, pH 7.0 ile beş kez yıkayın; 8 M üre; bunu 2 M NaCl ile beş kez takip etti; bunu% 0.1 trifloroasetik asit (TFA) ile% 80 asetonitril (ACN) ile beş kez; ve son olarak 25 mM HEPES, pH 7.7 ile beş kez, adım 2.8.2'de açıklandığı gibi ve fişi değiştirin.
NOT: Numuneler, adım 4.1'de açıklandığı gibi protein seviyesinde (örneğin, SDS-poliakrilamid jel elektroforezi (SDS-PAGE), batı lekesi) analiz için burada salınabilir.
3. Reçine üzerinde triptik sindirim ve TMT etiketleme
- Numune başına 6-8 μg için yeterli sıralama dereceli modifiye tripsin çözeltisini, C tamponunda 0,5 μg/μL'lik bir konsantrasyonda çözündürerek hazırlayın (bkz. Tablo 1), böylece son hacim numune başına en az 120 μL'ye izin verir. Bir mikropipet kullanarak, bu tripsin çözeltisinden 120 μL'yi numunelere ekleyin ve 850 rpm'de çalkalayarak 37 ° C'de gece boyunca inkübe edin.
NOT: Sindirim verimliliğini artırmak için, ertesi gün tripsin çözeltisini çıkarıp taze çözelti ile değiştirerek ek bir sindirim adımı eklenebilir ve sindirime 2 saat devam edilebilir. - Reçineyi 25 mM HEPES, pH 7.0 ile beş kez yıkayın; bunu beş kez 2 M NaCl; bunu% 0.1 TFA ile% 80 ACN ile beş kez; bunu 25 mM HEPES, pH 7.7 ile üç kez takip etti. Son olarak, reçineyi 50 mM trietil amonyum bikarbonat tampon (TEAB) ile iki kez yıkayın ve fişi değiştirin.
- TMT etiketleme reaktiflerini, 16.000 × g'lık bir santrifüj kullanarak kısa bir süre dönmeden önce oda sıcaklığına ısınmalarına izin vererek hazırlayın. Bir mikropipet kullanarak TMT etiketleme reaktifinin her şişesine 150 μL susuz ACN ekleyin. Reaktifi tamamen çözündürmek için şişeleri oda sıcaklığında 5 dakika boyunca 850 rpm'ye ayarlanmış bir termomikser üzerinde inkübe edin. Kısaca vorteks yapın ve reaktifi toplamak için 16.000 × g'de aşağı doğru döndürün.
- Bir mikropipet kullanarak, yıkanmış reçineye 40 μL 100 mM TEAB ekleyin, daha sonra çözünmüş TMT reaktifinden 70 μL ekleyin ve oda sıcaklığında 850 rpm'de çalkalayarak 1 saat inkübe edin. Kalan TMT reaktifini -80 °C'de saklayın.
NOT: Her biyolojik numuneye atanan ayrı ayrı TMT etiketlerini not alın (Şekil 1). - Reçineyi beş kez% 0.1 TFA ile% 80 ACN ile, üç kez 100 mM amonyum bikarbonat tamponu (ABC), pH 8.0 ile ve iki kez daha önce tarif edildiği gibi suyla yıkayın ve tapayı değiştirin.
4. Peptit elüsyonu
- Bir mikropipet kullanarak her kolona 100 mM ABC, pH 8.0'da 100 μL 20 mM DTT ekleyerek etiketli peptitleri süzün ve 850 rpm'ye ayarlanmış bir termomikser üzerinde 30 dakika boyunca oda sıcaklığında inkübe edin.
NOT: DTT eklendikten sonra, reçine kümelenecektir. Reçine, kümeleri parçalamak ve peptitlerin tamamen elüsyonunu sağlamak için bir pipet ucu ile bozulabilir. - Bu inkübasyondan sonra, sütunu katı faz ekstraksiyonu (SPE) için tasarlanmış bir vakum manifolduna yerleştirin, vakum uygulayın ve numuneleri 5 mL'lik bir mikrosantrifüj tüpüne boşaltın. Bu adımı bir kez tekrarlayın.
- Son olarak,% 0.1 TFA ile 100 μL% 80 ACN ekleyin, oda sıcaklığında 10 dakika inkübe edin ve aynı 5 mL santrifüj tüpüne sürün. Tüm fraksiyonları aynı 5 mL mikrosantrifüj tüpünde toplayın.
NOT: Numune kaybını önlemek için, elüsyon için düşük bağlayıcı tüpler kullanılmalı ve hacimler tek bir 5 mL'lik tüp için 4,0 mL'lik bir hacimde veya altında tutulmalıdır. - Salınan numuneleri kuruyana kadar bir vakum yoğunlaştırıcısına yerleştirin. Kuru peptitleri -80 ° C'de saklayın ve daha sonra tekrar askıya alın.
NOT: Numuneler ayrı ayrı da salınabilir ve numuneler birleştirilmeden önce peptid seviyesinde analiz için SDS-PAGE tarafından bir aliquot çıkarılabilir ve analiz edilebilir.
5. Peptit alkilasyonu ve tuzdan arındırma/temizleme
- Bir mikropipet kullanarak küçük hacimli 100 mM ABC tamponu, pH 8.0 (500 μL'den büyük değil) ekleyerek kurutulmuş peptitleri yeniden askıya alın. Çözünür hale getirmek ve 2 mL'lik bir tüpe aktarmak için 250 W çıkışlı ve vorteksli bir banyo sonicator kullanarak bir seferde 15-30 s için tekrarlanan sonikasyon kullanın.
NOT: Eklenecek 100 mM ABC, pH 8.0 hacmi, DTT'yi 150 mM'lik bir molaritede yeniden askıya almak için gereken hacme dayanır. Kullanıcıların, adım 4.1'de orijinal olarak eklenenlere bağlı olarak örneklemlerinde bulunan DTT miktarını belirlemeleri gerekir. - 1:4 molar DTT:IAA oranı elde etmek için bir mikropipet kullanılarak ABC'de çözünmüş yeterli konsantre stok çözeltisi (600 mM) iyodoasetamid (IAA) ekleyin ve numuneleri RT'de 850 rpm'de çalkalayarak 1 saat inkübe edin.
- Bir mikropipet kullanarak konsantre TFA (%10) ekleyerek numuneleri pH < 3'e asitleştirin ve üreticinin talimatlarına göre ters fazlı temizleme kullanarak numunenin tuzunu alma işlemi gerçekleştirin.
- Temiz peptitleri kuruyana kadar bir vakum yoğunlaştırıcıya yerleştirin. Kuru peptitleri daha fazla analize kadar -80 ° C'de saklayın.
6. Sıvı kromatografisi-tandem kütle spektrometresi
- Kurutulmuş peptitleri, 250 W çıkışlı bir banyo sonicator kullanarak bir seferde 15-30 s için tekrarlanan sonikasyon ve % 3 ACN içeren 20-40 μL suda vorteks kullanarak askıya alın. Üreticinin protokolüne göre bir BCA testi yaparak peptid konsantrasyonunu belirleyin.
- Numuneleri daha önce açıklandığı gibi ters fazlı LC ve MS/MS ile ayırın6 ve MS1 spektrumlarını 400-2000 m/z aralığında kaydedin. İzobarik olarak etiketlenmiş peptitlerin analizi için raporlayıcı iyon yoğunluğu bilgilerini elde etmek için yüksek enerjili çarpışma ayrışmasının (HCD) kullanılmasını sağlayın. Enstrüman çalıştırma koşulları 27,30 ve MS verilerinin analizi 27,31 hakkında daha fazla ayrıntı için önceki raporların yöntemler bölümlerine bakın.
NOT: Peptit örneklerini analiz etmek için farklı LC-MS/MS sistemleri veya ayarları kullanılabilir. Peptit tanımlamanın kapsamı ve hassasiyeti, kullanılan belirli sisteme ve ayarlara bağlı olacaktır.
Sonuçlar
Protokolün tamamlanması, daha önce oksitlenmiş sistein içeren peptitlerin, genellikle% >95 özgüllük 27,35,36 ile oldukça spesifik zenginleşmesine neden olacaktır. Bununla birlikte, protokolün birkaç önemli adımı özel dikkat gerektirir, örneğin, yapay oksidasyonu ve yapay olarak oksitlenmiş tiyollerin spesifik olmayan zenginleşmesini yasaklayan numune lizisi/homojenizasyonundan önce serbest tiollerin ilk blokajı25. Numuneler, protokolün çeşitli aşamalarında ve hem proteinlerin hem de peptitlerin SDS-PAGE analizi de dahil olmak üzere farklı yöntemlerle analiz edilebilir. SDS-PAGE, toplam tiol numunelerinin, tedaviler / uyaranlar nedeniyle farklı oksidasyon seviyelerini belirlemek için numuneler arasında oran-metrik karşılaştırmalara olanak tanıdığı numunelerin kalitatif analizine izin verir (Şekil 2A). Tek tek proteinlerin oksidasyon seviyelerini daha fazla araştırmak için, SDS-PAGE jelleri batı lekelenmesine maruz kalabilir36 (Şekil 2B). Bu, model sisteminin daha ayrıntılı olarak analiz edilmesini, destekleyici veriler ve ağlar ve biyolojik yollar hakkında daha fazla hipotez üretilmesini sağlar. Bu yöntemler/destekleyici veriler, LC-MS/MS gibi daha derinlemesine analizlerden önce beklenen yanıtları doğrulamak için kalite kontrol olarak da kullanılabilir. LC-MS/MS tarafından analiz edilen sistein içeren peptitlerin Reporter iyon yoğunlukları, bireysel Cys saha seviyelerinde tiol oksidasyon stokiyometrisini ölçmek için kullanılabilir (Şekil 2C, D).
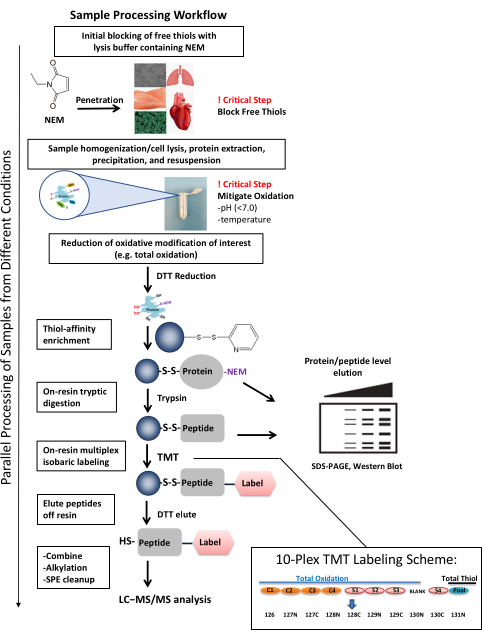
Şekil 1: Örnek işleme iş akışı. Numune işleme iş akışı, çeşitli numune tiplerinde ve biyolojik sistemlerde tiol oksidasyonunu araştırmak için uyarlanabilir. İş akışı, hem protein hem de peptit seviyelerinde (örneğin, SDS-PAGE, batı lekesi) oksidasyonun araştırılmasına ve ayrıca kütle spektrometrisi ile birlikte HPLC kullanılarak bireysel sistein bölgelerinin kantitatif, bölgeye özgü tanımlanması için derin kapsama alanına izin verir. Numune işleme, kaliteli, tutarlı verilerin oluşturulması için birkaç kritik adımın tamamlanması da dahil olmak üzere üç gün gibi kısa bir sürede tamamlanabilir. TMT etiketleme yoluyla numune çoklaması, aynı anda birden fazla numunenin paralel olarak işlenmesini sağlar. Temsili 10-plex TMT etiketleme şeması, toplam tiol kanalından potansiyel çapraz konuşma göz önünde bulundurularak numunelerin nasıl düzenlenebileceğini göstermektedir. TMT reaktiflerinin izotopik safsızlıklarıyla, yüksek yoğunluklu bir kanalın sinyal yoğunluğu (total-tiol gibi), düşük sinyal yoğunluğuna sahip başka bir kanala katkıda bulunabilir ve niceliğini etkileyebilir37. Şemada, havuzlanmış bir toplam tiol kanalının (kontrol ve deneysel örneklerin bir kombinasyonu) yüksek seviyelerde Cys-peptid içermesi bekleniyor ve kanal 130N'de bir sinyale sahip olacak 131N ile etiketleniyor. Bu nedenle, 130N kanalı deneyde kullanılmaz. TMT etiketleri tarafından oluşturulan kanal çapraz konuşması miktarı, reaktifin karşılık gelen bir partisi için üreticinin analiz sertifikalarında bulunabilir. Bu rakam Guo ve ark., Nature Protocols, 201425'ten uyarlanmıştır. Kısaltmalar: NEM = N-ethylmaleimide; DTT = ditiyotreitol; SDS-PAGE = sodyum dodesilsülfat poliakrilamid jel elektroforezi; SPE = katı faz ekstraksiyonu; LC-MS/MS = sıvı kromatografisi-tandem kütle spektrometrisi; TMT = tandem kütle etiketi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
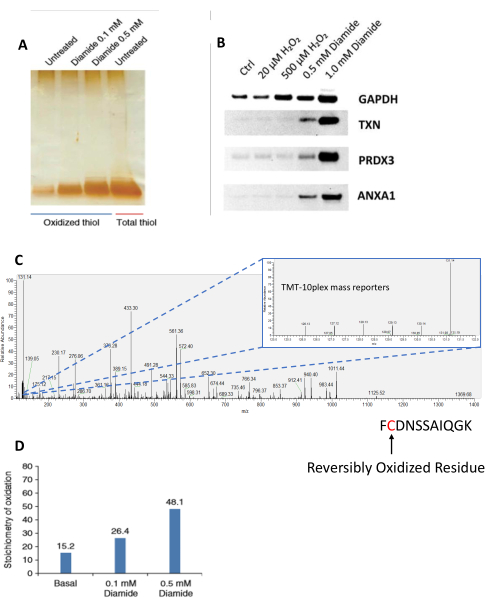
Şekil 2: RAC zenginleştirmesinden peptidlerin analizi. (A) Kimyasal oksidan, diamid ile muamele edilmiş RAW 264.7 hücrelerinden oksitlenmiş peptitlerin SDS-PAGE analizi, artan konsantrasyonlarda (0.1 ve 0.5 mM) 30 dakika boyunca ve toplam peptid tiolleri. Bu alt şekil ve alt şekil D, Guo ve ark., Nature Protocols, 2014 25'ten uyarlanmıştır. Peptitler gümüş boyama ile görselleştirildi. (B) RAW 264.7 hücreleri, artan konsantrasyonlarda eksojen oksidanlarla (hidrojen peroksit ve diamid) muamele edildi. Elde edilen SSG ile zenginleştirilmiş protein elüatı SDS-PAGE ile ayrıldı ve daha sonra bireysel proteinler (GAPDH, TXN, PRDX3 ve ANXA1) için batı lekesi ile araştırıldı. Bu alt rakam Su ve ark., Serbest Radikal Biyoloji ve Tıp, 201436'dan uyarlanmıştır. (C) Xcalibur yazılımında görüntülenen sistein içeren bir peptidin temsili MS / MS spektrum verileri. Yerleşik MS / MS görüntüsü, her TMT kanalında aynı peptid için karşılık gelen muhabir iyon yoğunluklarını gösterir. Bu deneyde, toplam tiol örneği, deneyde kullanılan tüm kanalların en yüksek yoğunluğuna sahip olan TMT etiketi 131N'ye atanmıştır. (D) LC-MS/MS ile ölçülen iTRAQ etiketli, zenginleştirilmiş, oksitlenmiş peptitlerin stokiyometrisi. Toplam tiol kanalı, oksidasyonun stokiyometrisini, her bir numunenin raporlayıcı iyon yoğunluğunun total-tiol kanalınınkine kıyasla oranına dayanarak hesaplamak için bir referans olarak kullanılmıştır. Kısaltmalar: RAC = reçine destekli yakalama; SDS-PAGE = sodyum dodesilsülfat poliakrilamid jel elektroforezi; Ctrl = kontrol; GAPDH = gliseraldehit 3-fosfat dehidrojenaz; TXN = tioredoksin; PRDX3 = tioredoksine bağımlı peroksit redüktaz; ANXA1 = Ek A1; LC-MS/MS = sıvı kromatografisi-tandem kütle spektrometrisi; MS/MS = tandem kütle spektrometrisi; TMT = tandem kütle etiketi; iTRAQ = göreceli ve mutlak nicelik için izobarik etiket. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Arabellek adı | Amaç | Içeriği |
| Arabellek A | Lizis/homojenizasyon | 250 mM 2-(N-morfolino)etansülfonik asit (MES), pH 6.0; % 1 sodyum dodesilsülfat (SDS); % 1 Triton X-100; ve 100 mM N-etilmaleimid (NEM) |
| Tampon B | Protein çökeltmesi ve ilk tampon değişimini takiben ressüspansiyon | 250 mM 4-(2-hidroksietil)-1-piperazineetansülfonik asit (HEPES), pH 7.0; 8 M üre; %0,1 SDS |
| Tampon C | Sistein içeren proteinlerin indirgenmesi / zenginleştirilmesi / sindirimi | 25 mM HEPES, pH 7,7; 1 M üre; %0,1 SDS |
| Tampon D | İndirgemeyi takiben ikinci tampon değişimi | 25 mM HEPES, pH 7.0, 8 M üre; %0,1 SDS |
| Tampon E | Hidrasyondan sonra reçinenin yıkanması | 25 mM HEPES, pH 7,7 |
Tablo 1. Arabelleklerin listesi
Ek Bilgiler. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Reçine destekli yakalama, sistein kalıntılarının oksidatif modifikasyonlarının araştırılması için çeşitli numune tiplerinde ve biyolojik sistemlerde kullanılmıştır25,29,30. Bu yöntem, SDS-PAGE ve batı leke analizi kullanılarak proteinler ve peptitler ve ayrıca kütle spektrometrisi kullanılarak bireysel sistein bölgeleri de dahil olmak üzere çoklu seviyelerde ve okumalarda numunelerin değerlendirilmesine izin verir. Numune tipine veya son noktaya bakılmaksızın, yöntem nihayetinde sistein içeren proteinlerin ve peptitlerin yüksek verimli ve spesifik olarak zenginleştirilmesine izin verir38. RAC'yi kullanarak, bir pertürbasyonun ardından farklı model sistemlerde binlerce sistein bölgesinin oksidasyon durumundaki değişiklikleri belirledik.
Yorucu kas kasılmalarına maruz kalan farelerde, 2.200 S-glutatyonilasyon bölgesi tanımlanmıştır ve yarısından fazlası S-glutatiyonilasyon seviyelerini önemli ölçüde değiştirmiştir32. RAC ayrıca, bir fotosentez inhibitörüne veya farklı ışık koşullarına maruz kaldıktan sonra siyanobakterilerde >2.100 bölgenin geri dönüşümlü tiol oksidasyonunu profillemek için de kullanılmıştır6. Son zamanlarda, dinlenme koşulları altında RAW 264.7 makrofaj hücrelerinde >4.000 sistein bölgesinin toplam geri dönüşümlü tiol oksidasyonunu ve S-glutatyonilasyonunu profilledik27. Benzer şekilde, Behring ve ark. epidermal büyüme faktörü stimülasyonunu takiben A431 hücrelerinde ~ 4.200 sistein bölgesinin oksidasyonunu ölçtü39. Bu çalışmalar, geri dönüşümlü tiol oksidasyonuna maruz kalan birçok sistein bölgesini (en az birkaç bin) tanımlamak için RAC'nin sağlamlığını göstermektedir. Ek olarak, örneklerin fraksiyonasyonu, bir deneyden elde edilen peptitlerin kapsamını artırabilir.
Model sisteminin biyolojik tepkilerini doğrulamak için pozitif veya negatif kontrol örneklerinin kullanılabileceği deneysel kontrollerin dışında, tiyollerin oksidasyonuna paralel olarak toplam tiol zenginleştirme gerçekleştirilebilir. Bu toplam tiol örneği, hem stokiyometrik karşılaştırmalar hem de deneysel veya işlenmiş örneklerin karşılaştırılabileceği bir temel sağlar. Kısacası, bu toplam tiol örneği, belirli bir numunedeki belirli bir Cys bölgesi için toplam sistein tiol sayısının bir ölçümünü sağlar. Bu kavram, oksitlenmiş sistein40'a karşı karşılaştırma için "toplam sistein içeriğini" temsil eden tamamen indirgenmiş tioller içeren örnekler üreten OxiTMT yöntemi tarafından da benimsenmiştir.
OxiTMT'nin aksine, RAC, iodoTMT'nin pleks sayısı ile sınırlı değildir ve bu nedenle, bir çalışmada kullanılan çoklu örneklem tiplerinin tiol içeriğini daha iyi temsil etmek için daha fazla toplam tiol kanalı içerebilir. Ek olarak, protein bolluklarının farklı numune tiplerinde değişip değişmediğini kontrol etmek için tiol redoks proteomik iş akışına paralel olarak küresel bir numune hazırlanması (zenginleştirmeye tabi değildir) gerekebilir. Yöntem, birden fazla redoks modifikasyonu türüne uyarlanabildiğinden, ilginin spesifik modifikasyonu için uygun kontroller dikkate alınmalıdır. Örneğin, ultraviyole ışık ve cıva klorür, SNO'yu proteinlerden ayırmada etkilidir ve SNO 7,25'in ölçümü için etkili bir negatif kontrol oluşturur. SSG modifiye proteinleri araştırmak için etkili bir kontrol, indirgeme adımı sırasında glutaredoksin enziminin indirgeme kokteylinden ihmal edilmesidir. Glutaredoksinin nispeten yüksek özgüllüğü nedeniyle, ihmali SSG modifiye proteinlerin indirgenmesini ortadan kaldırır ve disülfür değişimine girmelerini ve nihayetinde son analizde zenginleştirilmelerini önler36.
RAC iş akışında, kaliteli, yeniden üretilebilir verilerin oluşturulması için temel olan birkaç adım vardır. İlk önemli adımlardan biri ve en önemlisi,41,42 gibi geniş bir pH aralığında hızla reaksiyona giren membran geçirgen alkilleyici ajan N-etilmaleimid (NEM) kullanılarak serbest tiyollerin alkillenmesi / bloke edilmesidir. Bu adım, numune işleme sırasında yeni ortaya çıkan tiyollerin oksitlenmesini yasaklar ve disülfit değişim zenginleştirmesi sırasında yapay olarak oksitlenmiş bu tiollerin spesifik olmayan zenginleşmesini azaltır. Yetersiz alkilasyon, önceki bir rapor6'da tanımlandığı gibi, artmış bir arka plan ve yanlış pozitif sinyale neden olacaktır.
Bununla birlikte, yüksek reaktivitesi ve serbest tiolleri bloke etme kabiliyeti nedeniyle, kalan herhangi bir NEM'in reçine kuplajına bağlanabileceği ve müdahale edebileceği ve sonuçta protein bağlanmasındaki azalma nedeniyle sinyal kaybına neden olabileceği zenginleştirmeden önce numunelerden tamamen çıkarılmasını sağlamak için de dikkatli olunmalıdır. Bu, aseton çökeltmesi ve moleküler ağırlık kesme filtreleri kullanılarak birkaç tur tampon değişimi gerçekleştirilerek gerçekleştirilir. Protokol boyunca uygun pH'ın izlenmesi ve sürdürülmesi de çok önemlidir. Disülfit karıştırmasını ve zenginleştirmeden önce karışık disülfürlerin oluşumunu azaltmak için 6.0'lık bir pH korunur. Ekstra özen gösterilmesi gereken diğer adımlar, uygun zenginleştirme ve elüsyon için sırasıyla 7.7 ve 8.0 pH değerlerinin gerekli olduğu zenginleştirme ve elüsyon adımlarını içerir. Bu adımlar sırasında hatalı pH değerleri, sinyalin azalmasına veya kaybına neden olur.
Bugüne kadar, en çok kullanılan yöntem olan biyotin anahtar tekniği43,44 de dahil olmak üzere, sistein tiol oksidasyonunu incelemek için yaygın olarak kullanılan RAC dışında birçok kimya tabanlı yöntem vardır. RAC de dahil olmak üzere tüm bu yöntemlerin ortak noktalarından biri, oksitlenmiş sisteinlerin tespiti için dolaylı yöntemlere dayanmalarıdır. Tespit için orijinal oksitlenmiş tiolün kimyasal olarak modifiye edilmiş ara ürünlerine güvenirler. Bununla birlikte, RAC'yi diğer yöntemlerden ayıran önemli bir özellik, oksitlenmiş tiyollerin spesifik sistein bölgeleri hakkında çoklu, kantitatif veriler toplama yeteneğidir.
Yöntem, reçineye kovalent olarak bağlanmış proteinler / peptitler ile gerçekleştirilir, bu da ilerleyen adımların (örneğin, indirgeme, etiketleme, yıkama, sindirim) daha fazla işlem yapmadan gerçekleştirilmesini sağlar. Çoğullanmış örneklerde LC-MS/MS gerçekleştirilerek, proteom genelinde keşiflere olanak tanıyan veri kümeleri oluşturulur. Belirli bir tedavinin veya uyaranın çoklu örnek grupları arasındaki etkileri, yeni mekanizmaların ve yolların keşfedilmesini sağlayan küresel düzeyde gözlenmektedir. Temel iş akışı, son kullanıcıların özel ihtiyaçlarına ve ilgi alanlarına son derece uyarlanabilir. Kütle spektrometresi verilerinde gözlenen bulguların ortogonal olarak doğrulanması bir zorluk olmaya devam etmektedir. Belirli bir bölgenin sahaya yönelik mutagenezisi ve bunun sonucunda ortaya çıkan etkileri araştıran tahlillerin kullanılması yaygın ancak emek yoğun bir yaklaşımdır.
Biyolojik olarak anlamlı olabilecek aday bölgeleri taramak için, biyoinformatik çalışmalar, bir sitenin aktif bir bölgeye yakınlığı veya ikincil yapı27 gibi yüksek oksidasyon seviyesine sahip bir sitenin özellikleri hakkında daha fazla bilgi edinmek için kullanılabilir. Moleküler dinamik simülasyonları, redoks modifikasyonlarının protein yapısı üzerindeki etkilerini modelleyebildikleri ve bir proteinin fonksiyonunun nasıl etkilenebileceğine dair fikir verebildikleri için gelecekteki çalışmalarda büyük değer taşıyabilirler13,45. Bu sağlam stratejiyi uygulayarak, bilimsel topluluğun bu yöntemi kendi benzersiz model sistemlerine uyarlayarak fayda sağlayacağını ve redoks biyolojisi hakkındaki mevcut bilgiyi birçok farklı model ve biyolojik sisteme genişleteceğini umuyoruz.
Açıklamalar
Yazarlar, finansal veya başka türlü hiçbir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Çalışmanın bazı bölümleri NIH Grants R01 DK122160, R01 HL139335 ve U24 DK112349 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-(Pyridyldithio)ethylamine hydrochloride | Med Chem Express | HY-101794 | Reagent for in-house resin synthesis |
| 2.0 mL LoBind centrifuge tubes | Eppendorf | 22431048 | |
| 5.0 mL LoBind centrifuge tubes | Eppendorf | 30108310 | |
| 5.0 mL round bottom tubes | Falcon | 352054 | |
| Acetone | Fisher Scientific | A949-1 | |
| Acetonitrile | Sigma Aldrich | 34998 | |
| Activated Thiol–Sepharose 4B | Sigma Aldrich | T8512 | Potential replacement for thiol-affinity resin |
| Amicon Ultra 0.5 mL centrifugal filter | Millipore Sigma | UFC5010BK | |
| Ammonium bicarbonate | Sigma Aldrich | 09830 | |
| Bicinchonicic acid (BCA) | Thermo Scientific | 23227 | Protein Assay Reagent |
| Centrifuge | Eppendorf | 5810R | |
| Centrifuge | Eppendorf | 5415R | |
| Dithiothreitol (DTT) | Thermo Scientific | 20291 | |
| EDTA | Sigma Aldrich | E5134 | |
| HEPES buffer | Sigma Aldrich | H4034 | |
| Homogenizer | BioSpec Products | 985370 | |
| Iodoacetimide (IAA) | Sigma Aldrich | I1149 | |
| N-ethylmaleimide | Sigma Aldrich | 4259 | |
| NHS-Activated Sepharose 4 Fast Flow | Cytiva | 17-0906-01 | Reagent for in-house resin synthesis |
| QIAvac 24 Plus vacuum manifold | Qiagen | 19413 | |
| Sodium chloride | Sigma Aldrich | S3014 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | L6026 | |
| Sonicator | Branson | 1510R-MT | |
| Spin columns | Thermo Scientific | 69705 | |
| Strata C18-E reverse phase columns | Phenomenex | 8B-S001-DAK | Peptide desalting |
| Thermomixer | Eppendorf | 5355 | |
| Thiopropyl Sepharose 6B | GE Healthcare | 17-0420-01 | Thiol-affinity resin; *Production of Thiopropyl Sepharose 6B resin has been discontinued by the manufacturer (see protocol for details). |
| TMT isobaric labels (16 plex) | Thermo Scientific | A44522 | Peptide labeling reagent; available in multiple formats |
| Triethylammonium bicarbonate buffer (TEAB) | Sigma Aldrich | T7408 | |
| Trifluoroacetic acid (TFA) | Sigma Aldrich | T6508 | |
| Triton X-100 | Sigma Aldrich | T8787 | |
| Trypsin | Promega | V5820 | |
| Urea | Sigma Aldrich | U5378 | |
| Vacufuge Plus speedvac | Eppendorf | 22820001 | vacuum concentrator |
| Vortex mixer | Scientific Industries | SI-0236 |
Referanslar
- Sies, H., Jones, D. P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nature Reviews Molecular Cell Biology. 21 (7), 363-383 (2020).
- Adams, L., Franco, M. C., Estevez, A. G. Reactive nitrogen species in cellular signaling. Experimental Biology and Medicine. 240 (6), 711-717 (2015).
- Olson, K. R. The biological legacy of sulfur: A roadmap to the future. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 252, 110824 (2021).
- Sies, H. Oxidative eustress: on constant alert for redox homeostasis. Redox Biology. 41, 101867 (2021).
- Poole, L. B. The basics of thiols and cysteines in redox biology and chemistry. Free Radical Biology & Medicine. 80, 148-157 (2015).
- Guo, J., et al. Proteome-wide light/dark modulation of thiol oxidation in cyanobacteria revealed by quantitative site-specific redox proteomics. Molecular & Cellular Proteomics. 13 (12), 3270-3285 (2014).
- Shi, X., Qiu, H. Post-translational S-nitrosylation of proteins in regulating cardiac oxidative stress. Antioxidants. 9 (11), 1051 (2020).
- Fra, A., Yoboue, E. D., Sitia, R. Cysteines as redox molecular switches and targets of disease. Frontiers in Molecular Neuroscience. 10, 167 (2017).
- Klomsiri, C., Karplus, P. A., Poole, L. B. Cysteine-based redox switches in enzymes. Antioxidants & Redox Signaling. 14 (6), 1065-1077 (2011).
- Go, Y. M., Jones, D. P. The redox proteome. Journal of Biological Chemistry. 288 (37), 26512-26520 (2013).
- Bak, D. W., Bechtel, T. J., Falco, J. A., Weerapana, E. Cysteine reactivity across the subcellular universe. Current Opinion in Chemical Biology. 48, 96-105 (2019).
- Skryhan, K., et al. The role of cysteine residues in redox regulation and protein stability of Arabidopsis thaliana starch synthase 1. PLoS One. 10 (9), 0136997 (2015).
- Su, Z., et al. Global redox proteome and phosphoproteome analysis reveals redox switch in Akt. Nature Communications. 10 (1), 5486 (2019).
- Liebthal, M., Schuetze, J., Dreyer, A., Mock, H. -. P., Dietz, K. -. J. Redox conformation-specific protein-protein interactions of the 2-cysteine peroxiredoxin in Arabidopsis. Antioxidants. 9 (6), 515 (2020).
- Pace, N. J., Weerapana, E. Zinc-binding cysteines: diverse functions and structural motifs. Biomolecules. 4 (2), 419-434 (2014).
- Schwartz, P. A., et al. Covalent EGFR inhibitor analysis reveals importance of reversible interactions to potency and mechanisms of drug resistance. Proceedings of the National Academy of Sciences of the United States of America. 111 (1), 173 (2014).
- Sevilla, E., Bes, M. T., González, A., Peleato, M. L., Fillat, M. F. Redox-based transcriptional regulation in prokaryotes: revisiting model mechanisms. Antioxidants & Redox Signaling. 30 (13), 1651-1696 (2018).
- Topf, U., et al. Quantitative proteomics identifies redox switches for global translation modulation by mitochondrially produced reactive oxygen species. Nature Communications. 9 (1), 324 (2018).
- Gao, X. -. H., et al. Discovery of a redox thiol switch: implications for cellular energy metabolism. Molecular & Cellular Proteomics. 19 (5), 852-870 (2020).
- Prus, G., Hoegl, A., Weinert, B. T., Choudhary, C. Analysis and interpretation of protein post-translational modification site stoichiometry. Trends in Biochemical Sciences. 44 (11), 943-960 (2019).
- Zhang, T., Gaffrey, M. J., Li, X., Qian, W. J. Characterization of cellular oxidative stress response by stoichiometric redox proteomics. American Journal of Physiology. Cell Physiology. 320 (2), 182-194 (2021).
- Jaffrey, S. R., Erdjument-Bromage, H., Ferris, C. D., Tempst, P., Snyder, S. H. Protein S-nitrosylation: a physiological signal for neuronal nitric oxide. Nature Cell Biology. 3 (2), 193-197 (2001).
- Alcock, L. J., Perkins, M. V., Chalker, J. M. Chemical methods for mapping cysteine oxidation. Chemical Society Reviews. 47 (1), 231-268 (2018).
- Li, R., Kast, J. Biotin switch assays for quantitation of reversible cysteine oxidation. Methods in Enzymology. 585, 269-284 (2017).
- Guo, J., et al. Resin-assisted enrichment of thiols as a general strategy for proteomic profiling of cysteine-based reversible modifications. Nature Protocols. 9 (1), 64-75 (2014).
- Liu, T., et al. High-throughput comparative proteome analysis using a quantitative cysteinyl-peptide enrichment technology. Analytical Chemistry. 76 (18), 5345-5353 (2004).
- Duan, J., et al. Stochiometric quantification of the thiol redox proteome of macrophages reveals subcellular compartmentalization and susceptibility to oxidative perturbations. Redox Biology. 36, 101649 (2020).
- Mitchell, A. R., et al. Redox regulation of pyruvate kinase M2 by cysteine oxidation and S-nitrosation. Biochemical Journal. 475 (20), 3275-3291 (2018).
- Campbell, M. D., et al. Improving mitochondrial function with SS-31 reverses age-related redox stress and improves exercise tolerance in aged mice. Free Radical Biology & Medicine. 134, 268-281 (2019).
- Duan, J., et al. Quantitative profiling of protein S-glutathionylation reveals redox-dependent regulation of macrophage function during nanoparticle-induced oxidative stress. ACS Nano. 10 (1), 524-538 (2016).
- Wang, J., et al. Protein thiol oxidation in the rat lung following e-cigarette exposure. Redox Biology. 37, 101758 (2020).
- Kramer, P. A., et al. Fatiguing contractions increase protein S-glutathionylation occupancy in mouse skeletal muscle. Redox Biology. 17, 367-376 (2018).
- Chiao, Y. A., et al. Late-life restoration of mitochondrial function reverses cardiac dysfunction in old mice. Elife. 9, 55513 (2020).
- Forrester, M. T., et al. Site-specific analysis of protein S-acylation by resin-assisted capture. Journal of Lipid Research. 52 (2), 393-398 (2011).
- Su, D., et al. Quantitative site-specific reactivity profiling of S-nitrosylation in mouse skeletal muscle using cysteinyl peptide enrichment coupled with mass spectrometry. Free Radical Biology & Medicine. 57, 68-78 (2013).
- Su, D., et al. Proteomic identification and quantification of S-glutathionylation in mouse macrophages using resin-assisted enrichment and isobaric labeling. Free Radical Biology & Medicine. 67, 460-470 (2014).
- Searle, B. C., Yergey, A. L. An efficient solution for resolving iTRAQ and TMT channel cross-talk. Journal of Mass Spectrometry. 55 (8), 4354 (2020).
- Duan, J., Gaffrey, M. J., Qian, W. J. Quantitative proteomic characterization of redox-dependent post-translational modifications on protein cysteines. Molecular BioSystems. 13 (5), 816-829 (2017).
- Behring, J. B., et al. Spatial and temporal alterations in protein structure by EGF regulate cryptic cysteine oxidation. Science Signaling. 13 (615), 7315 (2020).
- Shakir, S., Vinh, J., Chiappetta, G. Quantitative analysis of the cysteine redoxome by iodoacetyl tandem mass tags. Analytical and Bioanalytical Chemistry. 409 (15), 3821-3830 (2017).
- Gorin, G., Martic, P. A., Doughty, G. Kinetics of the reaction of N-ethylmaleimide with cysteine and some congeners. Archives of Biochemistry and Biophysics. 115 (3), 593-597 (1966).
- Hsu, M. -. F., et al. Distinct effects of N-ethylmaleimide on formyl peptide- and cyclopiazonic acid-induced Ca2+ signals through thiol modification in neutrophils. Biochemical Pharmacology. 70 (9), 1320-1329 (2005).
- Li, R., Huang, J., Kast, J. Identification of total reversible cysteine oxidation in an atherosclerosis model using a modified biotin switch assay. Journal of Proteome Research. 14 (5), 2026-2035 (2015).
- Wang, J., et al. Integrated dissection of cysteine oxidative post-translational modification proteome during cardiac hypertrophy. Journal of Proteome Research. 17 (12), 4243-4257 (2018).
- Patra, K. K., Bhattacharya, A., Bhattacharya, S. Molecular dynamics investigation of a redox switch in the anti-HIV protein SAMHD1. Proteins. 87 (9), 748-759 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır