Method Article
Captura asistida por resina junto con etiquetado de etiqueta de masa isobárica en tándem para la cuantificación multiplexada de la oxidación de la proteína tiol
En este artículo
Resumen
La oxidación de la proteína tiol tiene implicaciones significativas en condiciones fisiológicas y fisiopatológicas normales. Describimos los detalles de un método cuantitativo de proteómica redox, que utiliza captura asistida por resina, etiquetado isobárico y espectrometría de masas, lo que permite la identificación y cuantificación de proteínas de cisteína oxidadas reversibles.
Resumen
Las modificaciones oxidativas reversibles en los tioles proteicos han surgido recientemente como mediadores importantes de la función celular. Aquí describimos el procedimiento detallado de un método cuantitativo de proteómica redox que utiliza la captura asistida por resina (RAC) en combinación con el etiquetado isobárico de etiqueta de masa en tándem (TMT) y la cromatografía líquida-espectrometría de masas en tándem (LC-MS / MS) para permitir la cuantificación estoquiométrica multiplexada de tioles de proteínas oxidadas a nivel de proteoma. La información cuantitativa específica del sitio sobre residuos de cisteína oxidada proporciona información adicional sobre los impactos funcionales de tales modificaciones.
El flujo de trabajo es adaptable a través de muchos tipos de muestras, incluidas las células cultivadas (por ejemplo, mamíferos, procariotas) y tejidos enteros (por ejemplo, corazón, pulmón, músculo), que inicialmente se lisan / homogeneizan y con tioles libres alquilados para evitar la oxidación artificial. Los tioles de proteínas oxidadas se reducen y capturan mediante una resina de afinidad por tiol, que agiliza y simplifica los pasos del flujo de trabajo al permitir que los procedimientos de digestión, etiquetado y lavado se realicen sin transferencia adicional de proteínas / péptidos. Finalmente, los péptidos marcados son eluyidos y analizados por LC-MS / MS para revelar cambios estequiométricos completos relacionados con la oxidación del tiol en todo el proteoma. Este método mejora en gran medida la comprensión del papel de la regulación dependiente de redox en estados fisiológicos y fisiopatológicos relacionados con la oxidación de proteínas tiol.
Introducción
En condiciones homeostáticas, las células generan especies reactivas de oxígeno, nitrógeno o azufre que ayudan a facilitar procesos, como el metabolismo y la señalización 1,2,3, extendiéndose tanto a procariotas como a eucariotas. Los niveles fisiológicos de estas especies reactivas son necesarios para la función celular adecuada, también conocida como "eustrés"1,4. Por el contrario, un aumento de oxidantes que conduce a un desequilibrio entre oxidantes y antioxidantes puede causar estrés oxidativo, o "angustia"1, que conduce al daño celular. Los oxidantes transducen señales a las vías biológicas modificando diferentes biomoléculas, incluyendo proteínas, ADN, ARN y lípidos. En particular, los residuos de cisteína de las proteínas son sitios altamente reactivos propensos a la oxidación debido al grupo tiol en la cisteína, que es reactivo hacia diferentes tipos de oxidantes5. Esto da lugar a una amplia gama de modificaciones postraduccionales reversibles basadas en redox (PTM) para cisteína, incluyendo nitrosilación (SNO), glutationilación (SSG), sulfenilación (SOH), persulfuración (SSH), polisulfuración (SSnH), acilación y disulfuros. Las formas irreversibles de oxidación de cisteína incluyen sulfinilación (SO2H) y sulfonilación (SO3H).
Las modificaciones oxidativas reversibles de los residuos de cisteína pueden desempeñar funciones protectoras que impiden una mayor oxidación irreversible o servir como moléculas de señalización para las vías celulares aguas abajo 6,7. La reversibilidad de algunos PTM redox de tiol permite que los sitios de cisteína funcionen como "interruptores redox"8,9, en los que los cambios en el estado redox de estos sitios alteran la función de las proteínas para regular su papel en los procesos transitorios. Los efectos moduladores de los PTMs redox 10 se han observado en muchos aspectos de la función proteica11, incluyendo catálisis12, interacciones proteína-proteína 13, cambio de conformación 14, coordinación de iones metálicos 15 o unión de inhibidores farmacológicos 16. Además, los PTM redox están involucrados en sitios de cisteína de proteínas que regulan vías como la transcripción17, la traducción 18 o el metabolismo19. Dado el impacto que los PTM redox tienen en la función de las proteínas y los procesos biológicos, es importante cuantificar el grado de oxidación que sufre un sitio de cisteína en respuesta a una perturbación del estado redox.
La identificación de sitios de cisteína con estados redox alterados se centra en la comparación del estado de oxidación a nivel específico del sitio entre condiciones normales y perturbadas. Las mediciones de cambio de pliegue a menudo se utilizan para determinar qué sitios están alterados significativamente, ya que esto ayuda a los usuarios a interpretar qué sitios de cisteína pueden ser fisiológicamente significativos para el estudio. Alternativamente, las mediciones estequiométricas de la oxidación reversible del tiol a través de un tipo de muestra específico dan una imagen general del estado fisiológico con respecto a la oxidación celular, una medida importante que a menudo se pasa por alto y se infrautiliza. La estequiometría de modificación se basa en cuantificar el porcentaje de tiol modificado como relación con la proteína tiol total (modificada y no modificada)20,21. Como resultado, las mediciones estequiométricas ofrecen una medición más precisa que el cambio de pliegue, especialmente cuando se utiliza espectrometría de masas. La importancia del aumento en la oxidación se puede determinar más fácilmente mediante el uso de estequiometría para determinar la ocupación de PTM de un sitio particular de cisteína. Por ejemplo, un aumento de 3 veces en la oxidación del tiol podría resultar de una transición de tan solo 1% a 3% o tan grande como 30% a 90%. Un aumento de 3 veces en la oxidación para un sitio que está solo al 1% de ocupación puede tener poco impacto en la función de una proteína; Sin embargo, un aumento de 3 veces para un sitio con una ocupación del 30% en estado de reposo puede verse afectado de manera más sustancial. Las mediciones estequiométricas, cuando se realizan entre tioles oxidados totales y modificaciones oxidativas específicas, incluida la glutationilación de proteínas (SSG) y la nitrosilación (SNO), pueden revelar proporciones e información cuantitativa con respecto a tipos de modificación específicos.
Debido a que la oxidación reversible del tiol es típicamente una modificación postraduccional de baja abundancia, se han desarrollado múltiples enfoques para el enriquecimiento de proteínas que contienen estas modificaciones a partir de muestras biológicas. Un enfoque temprano ideado por Jaffrey y otros, llamado la técnica de cambio de biotina (BST)22, implica múltiples pasos en los que los tioles no modificados se bloquean a través de alquilación, los tioles modificados reversiblemente se reducen a tioles libres nacientes, los tioles libres nacientes se marcan con biotina y las proteínas marcadas se enriquecen con la tirada de afinidad de estreptavidina. Esta técnica se ha utilizado para perfilar SNO y SSG en muchos estudios y se puede adaptar para sondear otras formas de oxidación reversible de tiol23,24. Si bien BST se ha utilizado para investigar diferentes formas de oxidación reversible de tiol, una preocupación con este enfoque es que el enriquecimiento se ve afectado por la unión no específica de proteínas no biotiniladas a la estreptavidina. Un enfoque alternativo desarrollado en nuestro laboratorio, llamado captura asistida por resina (RAC)25,26 (Figura 1), evita el problema del enriquecimiento de grupos tiol a través del sistema biotina-estreptavidina.
Tras la reducción de los tioles oxidados reversiblemente, las proteínas con tioles libres nacientes se enriquecen con la resina de afinidad tiol, que captura covalentemente los grupos tiol libres, lo que permite un enriquecimiento más específico de proteínas que contienen cisteína que el BST. El acoplamiento de RAC con el poder de multiplexación de los recientes avances en el etiquetado isobárico y la espectrometría de masas crea un flujo de trabajo robusto y sensible para el enriquecimiento, identificación y cuantificación de residuos de cisteína oxidados reversiblemente a nivel de proteoma en todo el proteoma. Los avances recientes en espectrometría de masas han permitido un perfil mucho más profundo del proteoma redox de tiol, aumentando la comprensión tanto de la causa como del efecto de la oxidación de la proteína tiol27. La información obtenida de datos cuantitativos específicos del sitio permite estudios adicionales de los impactos mecanicistas y los efectos posteriores de las modificaciones oxidativas reversibles28. La utilización de este flujo de trabajo ha proporcionado información sobre los impactos fisiológicos de la oxidación reversible de cisteína con respecto a los eventos fisiológicos normales, como el envejecimiento, en los que los niveles de SSG diferían con respecto a la edad. Los efectos del envejecimiento sobre la SSG se revirtieron parcialmente utilizando SS-31 (elamipretide), un nuevo péptido que mejora la función mitocondrial y reduce los niveles de SSG en ratones envejecidos, lo que hace que tengan un perfil de SSG más similar al de los ratones jóvenes29.
Se ha demostrado que las condiciones fisiopatológicas atribuidas a la exposición a nanopartículas involucran SSG en un modelo de macrófagos de ratón. Usando RAC junto con espectrometría de masas, los autores mostraron que los niveles de SSG estaban directamente correlacionados con el grado de estrés oxidativo y el deterioro de la función fagocítica de los macrófagos. Los datos también revelaron diferencias específicas de la vía en respuesta a diferentes nanomateriales diseñados que inducen diferentes grados de estrés oxidativo30. El método también ha demostrado su utilidad en especies procariotas, donde se aplicó para estudiar los efectos de los ciclos diurnos en cianobacterias fotosintéticas con respecto a la oxidación del tiol. Se observaron amplios cambios en la oxidación del tiol en varios procesos biológicos clave, incluido el transporte de electrones, la fijación de carbono y la glucólisis. Además, a través de la validación ortogonal, se confirmó la modificación de varios sitios funcionales clave, lo que sugiere roles reguladores de estas modificaciones oxidativas6.
Aquí, describimos los detalles de un flujo de trabajo estandarizado (Figura 1), demostrando la utilidad del enfoque RAC para el enriquecimiento de tioles de cisteína oxidada total de proteínas y su posterior etiquetado y cuantificación estequiométrica. Este flujo de trabajo se ha implementado en estudios del estado redox en diferentes tipos de muestras, incluyendo cultivos celulares27,30 y tejidos enteros (por ejemplo, músculo esquelético, corazón, pulmón)29,31,32,33. Aunque no se incluye aquí, el protocolo RAC también se adapta fácilmente para la investigación de formas específicas de modificaciones redox reversibles, incluyendo SSG, SNO y S-acilación, como se mencionó anteriormente25,29,34.
Protocolo
Todos los procedimientos descritos en el protocolo relacionados con muestras/tejidos animales o humanos fueron aprobados y siguieron las directrices institucionales del comité de ética de investigación humana y animal.
1. Homogeneización/lisis de la muestra
- Muestras de tejido congelado
- Picar tejido congelado (~ 30 mg) en un portaobjetos de microscopio de vidrio sobre hielo seco con una cuchilla de afeitar preenfriada y pinzas. Transfiera el tejido picado a un tubo de poliestireno de fondo redondo preenfriado de 5 ml que contenga 700 μL de tampón A (ver Tabla 1) e incube en hielo durante 30 minutos, protegido de la luz.
- Interrumpir el tejido durante 30 s o hasta que esté completamente homogeneizado con un homogeneizador de tejido de mano. Coloque las muestras en hielo y deje que la espuma disminuya durante otros 10 minutos.
NOTA: Una bandeja para hornear de aluminio colocada sobre hielo seco proporciona una superficie de trabajo estable y una plataforma para el procesamiento / picado inicial del tejido.
- Alternativamente, utilice cultivos celulares adherentes en placas de cultivo de 100 mm como material de partida.
- Mantenga las células en hielo y use una pipeta serológica para enjuagar las células dos veces con 10 ml de PBS helado que contiene 100 mM NEM.
- Lise las células agregando 1 ml de tampón de homogeneización/lisis en frío y raspando vigorosamente con un raspador celular rígido. Transfiera el lisado a un tubo de centrífuga de 2 ml utilizando una micropipeta.
NOTA: El tampón de enjuague y el tampón de lisis se pueden escalar en consecuencia a recipientes de cultivo de diferentes tamaños. Por lo general, se requieren de 2 a 5 millones de células; Sin embargo, esto varía dependiendo de la eficiencia de lisis y el rendimiento de proteínas para tipos de células específicas. El tampón de homogeneización puede prepararse sin NEM para las muestras que se analizan para detectar tioles totales.
- Transvasar el homogeneizado resultante (paso 1.1.2 o 1.2.2) a un tubo centrífugo de 2 ml utilizando una micropipeta y centrifugar a toda velocidad (≥16.000 × g) a 4 °C durante 10 min.
- Transfiera el sobrenadante (~700 μL o ~1 ml para cultivo celular) utilizando una micropipeta a un tubo de microcentrífuga cónica de 5 ml e incube durante 30 min a 55 °C en la oscuridad con agitación a 850 rpm.
- Usando una pipeta serológica de vidrio, añadir 4 ml de acetona helada a las muestras e incubar a -20 °C durante la noche para la precipitación de proteínas y la eliminación del exceso de N-etilmaleimida.
2. Captura asistida por resina
- Lavar los gránulos de proteína precipitada dos veces con acetona centrifugando a 20.500 × g a 4 °C durante 10 min, decantando la acetona, eliminando cualquier resto de acetona con una micropipeta y añadiendo 3 ml de acetona fresca helada con una pipeta serológica de vidrio. Invertir varias veces para mezclar. Después del segundo lavado, deje que los gránulos se sequen al aire durante 1-2 minutos, teniendo cuidado de no secarse demasiado, ya que la resuspensión puede ser difícil.
- Usando una micropipeta, agregue 1 ml de tampón B (ver Tabla 1) y solubilice la proteína usando sonicación repetida durante 15-30 s a la vez usando un sonicador de baño con una salida de 250 W y vórtice breve. Mida la concentración de proteína utilizando el ensayo de ácido bicinchonínico (BCA) de acuerdo con el protocolo del fabricante.
- Para estandarizar las concentraciones de proteínas en las muestras para su posterior procesamiento y garantizar la eliminación completa de NEM, transfiera 500 μg de proteína a un filtro centrífugo de 0,5 ml de 10 kDa utilizando una micropipeta y ajuste a un volumen final de 500 μL con tampón de resuspensión.
- Centrifugar a 14.000 × g a temperatura ambiente hasta que el volumen en el filtro centrífugo sea inferior a 100 μL. Recoja las muestras invirtiendo el filtro en un tubo de recolección. Centrifugar a 1.000 × g durante 2 min y ajustar a un volumen final de 500 μL utilizando el tampón C (ver Tabla 1).
- Reducir los tioles proteicos añadiendo 20 μL de 500 mM de ditiotritol (DTT) utilizando una micropipeta hasta una concentración final de 20 mM e incubando las muestras durante 30 min a 37 °C mientras agitamos a 850 rpm.
- Después de la reducción, transferir las muestras con una micropipeta a filtros centrífugos de 0,5 ml de 10 kDa y centrifugar durante 15 min a 14.000 × g a temperatura ambiente o hasta que el volumen en el filtro centrífugo sea inferior a 100 μL. Añadir el tampón D (véase el cuadro 1) para que el volumen del filtro centrífugo sea inferior a 500 μL.
- Repita la centrifugación y la adición a 500 μL en el paso 2.6 tres veces, y después de la cuarta centrifugación, recoja las muestras invirtiendo el filtro en un tubo de recolección y centrifugando a 1.000 × g durante 2 min.
- Mida la concentración de proteína utilizando el ensayo BCA de acuerdo con el protocolo del fabricante.
- Durante este intercambio tampón, prepare la resina de afinidad tiol pesando la cantidad adecuada de resina (30 mg/muestra) utilizando una microbalanza y transfiriéndola a un tubo centrífugo de 50 ml. A continuación, utilizando una pipeta serológica, añadir agua para una concentración final de 30 mg/ml de resina e incubar a temperatura ambiente durante 1 h con agitación para una correcta hidratación de la resina.
NOTA: La resina de tiol-afinidad mencionada anteriormente ha sido descontinuada por el fabricante. Un posible reemplazo para esta resina de tiol-afinidad está disponible comercialmente. Sin embargo, este reemplazo tiene una capacidad de unión casi 5 veces menor (consulte la Información complementaria). Alternativamente, la resina de afinidad por el tiol se puede sintetizar utilizando clorhidrato de etilamina 2-(piridilditio) y resina activada por N-hidroxisuccinimida (consulte la Información complementaria).- Después de la hidratación de la resina, coloque las columnas de centrifugado en un colector de vacío y transfiera 500 μL de la suspensión de resina utilizando una micropipeta a cada columna. Aplicar vacío para la eliminación de agua; Repita este paso una vez para obtener un total de 30 mg de resina por columna. Alternativamente, centrifugar a 1.000 × g durante 2 minutos en lugar de utilizar el colector de vacío para este y todos los pasos de lavado y elución de resina.
NOTA: Cortar el extremo de una punta de pipeta de 1000 μL para aumentar el tamaño del orificio ayuda con la transferencia de la resina. Es importante triturar entre pipeteos para garantizar que la resina permanezca suspendida y se transfieran cantidades homogéneas e iguales de resina a cada columna. - Lave la resina añadiendo 500 μL de agua ultrapura con una micropipeta y aplicando vacío para eliminar el agua; Repita esto 5 veces. Luego, lave la resina 5 veces con 500 μL de tampón E (ver Tabla 1).
NOTA: Alternativamente, se puede utilizar la centrifugación a 1.000 x g durante 2 minutos en lugar de un colector de vacío para todos los pasos de lavado posteriores. Todos los pasos de lavado se realizan con un volumen de 500 μL. Al agregar tampones de lavado a la columna, agregue cuidadosamente con suficiente fuerza para resuspender completamente la resina evitando salpicaduras y pérdida de resina; Esto permite un lavado completo y eficiente de la resina.
- Después de la hidratación de la resina, coloque las columnas de centrifugado en un colector de vacío y transfiera 500 μL de la suspensión de resina utilizando una micropipeta a cada columna. Aplicar vacío para la eliminación de agua; Repita este paso una vez para obtener un total de 30 mg de resina por columna. Alternativamente, centrifugar a 1.000 × g durante 2 minutos en lugar de utilizar el colector de vacío para este y todos los pasos de lavado y elución de resina.
- Utilizando una micropipeta, transferir 150 μg de proteína de cada muestra reducida a un nuevo tubo y ajustar a un volumen final de 120 μL de tampón C (ver Tabla 1). Transfiera la solución de proteína usando una micropipeta a una columna de centrifugado tapada que contenga la resina, coloque la tapa en la columna e incube durante 2 h a temperatura ambiente agitando a 850 rpm.
- Lave la resina cinco veces con 25 mM HEPES, pH 7.0; 8 M de urea; seguido de cinco veces con 2 M NaCl; seguido de cinco veces con acetonitrilo al 80% (ACN) con ácido trifluoroacético (TFA) al 0,1%; y finalmente cinco veces con 25 mM HEPES, pH 7.7, como se describe en el paso 2.8.2 y reemplace el enchufe.
NOTA: Las muestras pueden ser eluyidas aquí para su análisis a nivel de proteína (p. ej., electroforesis en gel de poliacrilamida SDS-POLIACRILAMIDA (SDS-PAGE), WESTERN BLOT) como se describe en el paso 4.1.
3. Digestión tríptica sobre resina y etiquetado TMT
- Preparar suficiente solución de tripsina modificada de grado secuencial para 6-8 μg por muestra solubilizándola a una concentración de 0,5 μg/μL en tampón C (ver Tabla 1) de modo que el volumen final permita al menos 120 μL por muestra. Con ayuda de una micropipeta, añadir 120 μL de esta solución de tripsina a las muestras e incubar durante la noche a 37 °C agitando a 850 rpm.
NOTA: Para aumentar la eficiencia de la digestión, se puede incluir un paso de digestión adicional al día siguiente retirando la solución de tripsina y reemplazándola con una solución fresca, y continuar la digestión durante 2 h. - Lave la resina cinco veces con 25 mM HEPES, pH 7.0; seguido de cinco veces 2 M NaCl; seguido de cinco veces con 80% ACN con 0.1% TFA; seguido de tres veces con 25 mM HEPES, pH 7.7. Finalmente, lave la resina dos veces con tampón de bicarbonato de trietilo amonio (TEAB) de 50 mM y reemplace el tapón.
- Prepare los reactivos de etiquetado TMT dejándolos calentar primero a temperatura ambiente antes de girar brevemente usando una centrífuga a 16,000 × g. Añadir 150 μL de ACN anhidra a cada vial de reactivo de marcado TMT utilizando una micropipeta. Incubar los viales a temperatura ambiente en un termomezclador ajustado a 850 rpm durante 5 min para solubilizar completamente el reactivo. Vórtice brevemente y gire hacia abajo a 16,000 × g para recolectar el reactivo.
- Con una micropipeta, añadir 40 μL de TEAB de 100 mM a la resina lavada, añadir a continuación 70 μL del reactivo TMT disuelto e incubar durante 1 h a temperatura ambiente con agitación a 850 rpm. Conservar cualquier reactivo TMT restante a -80 °C.
NOTA: Tome nota de las etiquetas TMT individuales asignadas a cada muestra biológica (Figura 1). - Lave la resina cinco veces con 80% de ACN con 0.1% de TFA, tres veces con tampón de bicarbonato de amonio (ABC) de 100 mM, pH 8.0 y dos veces con agua como se describió anteriormente y reemplace el tapón.
4. Elución peptídica
- Eluya los péptidos marcados añadiendo 100 μL de 20 mM de TDT en 100 mM ABC, pH 8,0, a cada columna con una micropipeta e incubar a temperatura ambiente durante 30 min en un termomezclador ajustado a 850 rpm.
NOTA: Después de la adición de TDT, la resina se agrupará. La resina se puede interrumpir con una punta de pipeta para romper los grupos y garantizar la elución completa de los péptidos. - Después de esta incubación, coloque la columna en un colector de vacío destinado a la extracción en fase sólida (SPE), aplique vacío y eluya las muestras en un tubo de microcentrífuga de 5 ml. Repita este paso una vez.
- Finalmente, agregue 100 μL de 80% de ACN con 0.1% de TFA, incubar durante 10 minutos a temperatura ambiente y eluir en el mismo tubo de centrífuga de 5 ml. Recoja todas las fracciones en el mismo tubo de microcentrífuga de 5 ml.
NOTA: Para evitar la pérdida de muestra, se deben usar tubos de baja unión para la elución, y los volúmenes deben mantenerse en o por debajo de un volumen de 4.0 ml para un solo tubo de 5 ml. - Coloque las muestras eluyidas en un concentrador de vacío hasta que estén secas. Conservar los péptidos secos a -80 °C y resuspenderlos posteriormente.
NOTA: Las muestras también pueden ser eluyidas por separado, y una alícuota puede ser removida y analizada por SDS-PAGE para su análisis a nivel de péptido antes de combinar las muestras.
5. Alquilación peptídica y desalinización/limpieza
- Resuspender los péptidos secos añadiendo un pequeño volumen de tampón ABC de 100 mM, pH 8,0 (no superior a 500 μL), utilizando una micropipeta. Use sonicación repetida durante 15-30 s a la vez usando un sonicador de baño con una salida de 250 W y vórtice para solubilizar y transferir a un tubo de 2 ml.
NOTA: El volumen de 100 mM ABC, pH 8.0 que se agregará se basa en el volumen necesario para resuspender la TDT a una molaridad de 150 mM. Los usuarios deberán determinar la cantidad de TDT presente en su muestra en función de lo que se agregó originalmente en el paso 4.1. - Añadir suficiente solución madre concentrada (600 mM) de yodoacetamida (IAA) disuelta en ABC utilizando una micropipeta para lograr una relación molar 1:4 de DTT:IAA e incubar las muestras a RT durante 1 h con agitación a 850 rpm.
- Acidificar las muestras a pH < 3 añadiendo TFA concentrado (10%) utilizando una micropipeta y realizar la desalinización de la muestra mediante limpieza de fase inversa de acuerdo con las instrucciones del fabricante.
- Coloque los péptidos limpios en un concentrador de vacío hasta que estén secos. Conservar los péptidos secos a -80 °C hasta su posterior análisis.
6. Cromatografía líquida-espectrometría de masas en tándem
- Resuspender los péptidos secos mediante sonicación repetida durante 15-30 s a la vez utilizando un sonicador de baño con una salida de 250 W y vórtice en 20-40 μL de agua que contiene 3% de ACN. Determine la concentración de péptidos realizando un ensayo de BCA de acuerdo con el protocolo del fabricante.
- Separar las muestras por fase inversa LC y MS/MS como se describió anteriormente6 y registrar los espectros MS1 en el rango m/z de 400-2000. Asegúrese de que la disociación colisional de alta energía (HCD) se utiliza para obtener información de intensidad de iones reporteros para el análisis de péptidos marcados isobáricamente. Consulte las secciones de métodos de informes anteriores para obtener más detalles sobre las condiciones de funcionamiento del instrumento 27,30 y el análisis de los datos de EM27,31.
NOTA: Se pueden utilizar diferentes sistemas o configuraciones LC-MS/MS para analizar las muestras de péptidos. La cobertura y la sensibilidad de la identificación de péptidos dependerán del sistema particular y la configuración utilizada.
Resultados
La finalización del protocolo resultará en un enriquecimiento altamente específico de péptidos que contienen cisteína previamente oxidados, a menudo con una especificidad del >95% 27,35,36. Sin embargo, varios pasos clave del protocolo requieren atención especial, por ejemplo, el bloqueo inicial de tioles libres antes de la lisis/homogeneización de la muestra, que prohíbe la oxidación artificial y el enriquecimiento no específico de tioles oxidados artificialmente25. Las muestras pueden analizarse en varias etapas del protocolo y por diferentes métodos, incluido el análisis SDS-PAGE de proteínas y péptidos. SDS-PAGE permite el análisis cualitativo de muestras en las que las muestras de tiol total permiten comparaciones métricas entre muestras para determinar diferentes niveles de oxidación debido a tratamientos / estímulos (Figura 2A). Para investigar más a fondo los niveles de oxidación de proteínas individuales, los geles SDS-PAGE pueden someterse a western blot36 (Figura 2B). Esto permite analizar el sistema modelo con mayor detalle, generando datos de apoyo y más hipótesis sobre redes y vías biológicas. Estos métodos/datos de apoyo también se pueden utilizar como control de calidad para confirmar las respuestas esperadas antes de un análisis más profundo, como LC-MS/MS. Las intensidades de iones reporteros de péptidos que contienen cisteína analizados por LC-MS/MS se pueden utilizar para cuantificar la estequiometría de oxidación de tiol a niveles individuales del sitio Cys (Figura 2C, D).
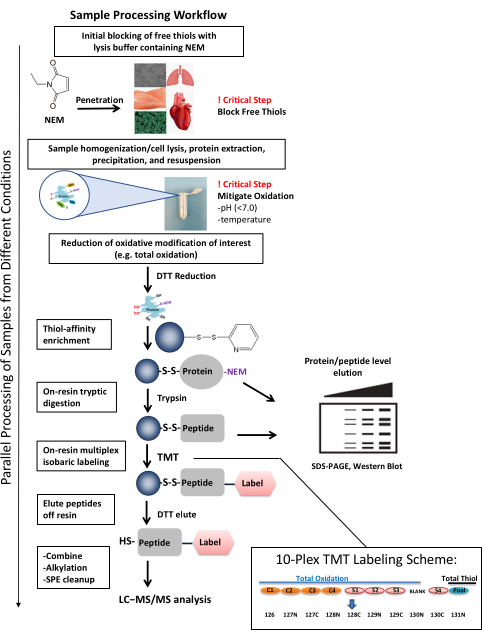
Figura 1: Flujo de trabajo de procesamiento de muestras. El flujo de trabajo de procesamiento de muestras es adaptable para investigar la oxidación del tiol en varios tipos de muestras y sistemas biológicos. El flujo de trabajo permite la investigación de la oxidación tanto a nivel de proteína como de péptido (por ejemplo, SDS-PAGE, western blot), así como una cobertura profunda para la identificación cuantitativa y específica del sitio de sitios individuales de cisteína utilizando HPLC junto con espectrometría de masas. El procesamiento de muestras se puede completar en tan solo tres días, incluida la finalización de varios pasos críticos para la generación de datos consistentes y de calidad. La multiplexación de muestras a través del etiquetado TMT permite el procesamiento de múltiples muestras en paralelo al mismo tiempo. El esquema representativo de etiquetado TMT 10-plex ilustra cómo se pueden organizar las muestras teniendo en cuenta la posible diafonía del canal de tiol total. Con las impurezas isotópicas de los reactivos TMT, la intensidad de señal de un canal con alta intensidad (como el tiol total) puede contribuir a otro canal con baja intensidad de señal e influir en su cuantificación37. En el esquema, se espera que un canal de tiol total agrupado (una combinación de muestras de control y experimentales) contenga altos niveles de péptidos Cys y esté marcado con 131N, que tendrá una señal en el canal 130N. Por lo tanto, el canal 130N no se utiliza en el experimento. La cantidad de diafonía de canal creada por las etiquetas TMT se puede encontrar en los certificados de análisis del fabricante para un lote correspondiente del reactivo. Esta figura ha sido adaptada de Guo et al., Nature Protocols, 201425. Abreviaturas: NEM = N-etilmaleimida; TDT = ditiothreitol; SDS-PAGE = electroforesis en gel de poliacrilamida dodecilsulfato de sodio; SPE = extracción en fase sólida; LC-MS/MS = cromatografía líquida-espectrometría de masas en tándem; TMT = etiqueta de masa en tándem. Haga clic aquí para ver una versión más grande de esta figura.
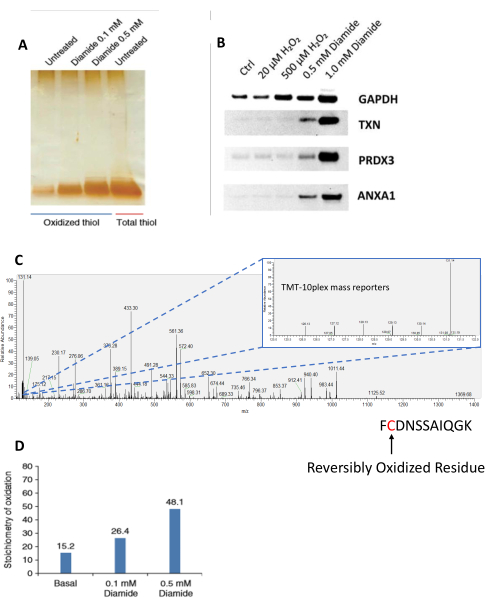
Figura 2: Análisis de péptidos a partir del enriquecimiento de RAC. (A) Análisis SDS-PAGE de péptidos oxidados de células RAW 264.7 tratadas con el oxidante químico, diamida, durante 30 min a concentraciones crecientes (0.1 y 0.5 mM) y tioles peptídicos totales. Esta subfigura y subfigura D están adaptadas de Guo et al., Nature Protocols, 2014 25. Los péptidos fueron visualizados por tinción de plata. (B) Las células RAW 264.7 fueron tratadas con oxidantes exógenos (peróxido de hidrógeno y diamida) a concentraciones crecientes. El eluido de proteína enriquecido con SSG resultante se separó mediante SDS-PAGE y posteriormente se probó mediante Western blot para proteínas individuales (GAPDH, TXN, PRDX3 y ANXA1). Esta subfigura está adaptada de Su et al., Free Radical Biology and Medicine, 201436. (C) Datos representativos del espectro MS/MS de un péptido que contiene cisteína vistos en el software Xcalibur. La imagen MS/MS insertada muestra las intensidades de iones reporteros correspondientes para el mismo péptido en cada canal TMT. En este experimento, la muestra de tiol total se asignó a la etiqueta TMT 131N, que tiene la intensidad más alta de todos los canales utilizados en el experimento. (D) Estequiometría de péptidos oxidados, enriquecidos y marcados con iTRAQ medidos por LC-MS/MS. El canal de tiol total se utilizó como referencia para calcular la estequiometría de oxidación basada en la relación de la intensidad de iones reporteros de cada muestra en comparación con la del canal de tiol total. Abreviaturas: RAC = captura asistida por resina; SDS-PAGE = electroforesis en gel de poliacrilamida dodecilsulfato de sodio; Ctrl = control; GAPDH = gliceraldehído 3-fosfato deshidrogenasa; TXN = tiorredoxina; PRDX3 = peróxido reductasa dependiente de tiorredoxina; ANXA1 = anexina A1; LC-MS/MS = cromatografía líquida-espectrometría de masas en tándem; MS/MS = espectrometría de masas en tándem; TMT = etiqueta de masa en tándem; iTRAQ = etiqueta isobárica para cuantificación relativa y absoluta. Haga clic aquí para ver una versión más grande de esta figura.
| Nombre del búfer | Propósito | Contenido |
| Búfer A | Lisis/homogeneización | 250 mM de ácido 2-(N-morfolino)etanosulfónico (MES), pH 6,0; dodecilsulfato de sodio (SDS) al 1%; 1% Triton X-100; y 100 mM de N-etilmaleimida (NEM) |
| Búfer B | Resuspensión después de la precipitación de proteínas y el primer intercambio de tampón | 250 mM de ácido 4-(2-hidroxietil)-1-piperazinaetanosulfónico (HEPES), pH 7,0; 8 M de urea; 0,1% SDS |
| Búfer C | Reducción/ Enriquecimiento/ Digestión de proteínas que contienen cisteína | 25 mM HEPES, pH 7,7; 1 M de urea; 0,1% SDS |
| Búfer D | Segundo intercambio de búfer después de la reducción | 25 mM HEPES, pH 7,0, 8 M urea; 0,1% SDS |
| Búfer E | Lavado de la resina después de la hidratación | 25 mM HEPES, pH 7.7 |
Tabla 1. Lista de buffers
Información complementaria. Haga clic aquí para descargar este archivo.
Discusión
La captura asistida por resina se ha utilizado en una variedad de tipos de muestras y sistemas biológicos para la investigación de modificaciones oxidativas de residuos de cisteína25,29,30. Este método permite la evaluación de muestras en múltiples niveles y lecturas, incluyendo proteínas y péptidos utilizando SDS-PAGE y análisis de Western blot, así como sitios individuales de cisteína utilizando espectrometría de masas. Independientemente del tipo de muestra o del criterio de valoración final, el método permite, en última instancia, un enriquecimiento altamente eficiente y específico de proteínas y péptidos que contienen cisteína38. Usando RAC, hemos identificado cambios en el estado de oxidación de hasta varios miles de sitios de cisteína en diferentes sistemas modelo después de una perturbación.
En ratones sometidos a contracciones musculares fatigantes, se identificaron 2.200 sitios de S-glutathionylation, con más de la mitad con niveles significativamente alterados de S-glutathionylation 32. RAC también se ha utilizado para perfilar la oxidación reversible de tiol de >2.100 sitios en cianobacterias después de la exposición a un inhibidor de la fotosíntesis o diferentes condiciones de luz6. Recientemente, perfilamos la oxidación total reversible de tiol y la S-glutationilación de >4.000 sitios de cisteína en células macrófagas RAW 264.7 en condiciones de reposo27. Del mismo modo, Behring et al. cuantificaron la oxidación de ~ 4.200 sitios de cisteína en células A431 después de la estimulación del factor de crecimiento epidérmico39. Estos estudios demuestran la robustez del RAC para identificar muchos sitios de cisteína (al menos varios miles) que experimentan oxidación reversible de tiol. Además, el fraccionamiento de muestras puede mejorar la cobertura de péptidos recuperados de un experimento.
Fuera de los controles experimentales, en los que se pueden emplear muestras de control positivas o negativas para confirmar las respuestas biológicas del sistema modelo, el enriquecimiento total de tiol puede realizarse en paralelo con la oxidación de tioles. Esta muestra de tiol total proporciona tanto comparaciones estequiométricas como una línea de base a partir de la cual se pueden comparar muestras experimentales o tratadas. En resumen, esta muestra de tiol total proporciona una medida del número total de tioles de cisteína para un sitio Cys dado en una muestra dada. Este concepto también fue adoptado por el método OxiTMT, que genera muestras que contienen tioles totalmente reducidos que representan "contenido total de cisteína" para su comparación con cisteínas oxidadas40.
A diferencia de OxiTMT, RAC no está limitado por el número plex de iodoTMT y, por lo tanto, puede incorporar más canales de tiol totales para representar mejor el contenido de tiol de múltiples tipos de muestras utilizadas en un estudio. Además, puede ser necesario preparar una muestra global (no sujeta a enriquecimiento) en paralelo con el flujo de trabajo de proteómica redox de tiol para verificar si las abundancias de proteínas están alteradas en diferentes tipos de muestras. Como el método es adaptable a múltiples tipos de modificaciones redox, se deben considerar controles adecuados para la modificación específica de interés. Por ejemplo, la luz ultravioleta y el cloruro de mercurio son efectivos para separar el SNO de las proteínas, creando un control negativo efectivo para la medición del SNO 7,25. Un control eficaz para investigar las proteínas modificadas con SSG es la omisión de la enzima glutaredoxina del cóctel de reducción durante la etapa de reducción. Debido a la especificidad relativamente alta de la glutaredoxina, su omisión elimina la reducción de las proteínas modificadas con SSG y evita que sufran intercambio de disulfuro y, en última instancia, se enriquezcan en el análisis final36.
Hay varios pasos dentro del flujo de trabajo para RAC que son fundamentales para la generación de datos reproducibles y de calidad. Uno de los primeros pasos cruciales, y el más importante, es la alquilación/bloqueo de tioles libres utilizando el agente alquilante permeable a la membrana, N-etilmaleimida (NEM), que reacciona rápidamente en un amplio rango de pH41,42. Este paso prohíbe que los tioles nacientes se oxiden durante el procesamiento de la muestra y mitiga el enriquecimiento no específico de estos tioles oxidados artificialmente durante el enriquecimiento por intercambio de disulfuro. La alquilación inadecuada dará lugar a un aumento de fondo y a una señal de falsos positivos, como se identificó en un informe anterior6.
Sin embargo, debido a su alta reactividad y capacidad para bloquear los tioles libres, también se debe tener precaución para garantizar su eliminación completa de las muestras antes del enriquecimiento, donde cualquier NEM restante puede unirse e interferir con el acoplamiento de resina, lo que finalmente resulta en la pérdida de señal debido a una disminución en la unión a proteínas. Esto se logra realizando precipitaciones de acetona y varias rondas de intercambio de tampón utilizando filtros de corte de peso molecular. Monitorear y mantener un pH adecuado durante todo el protocolo también es crucial. Se mantiene un pH de 6.0 para mitigar la mezcla de disulfuro y la formación de disulfuros mixtos antes del enriquecimiento. Otros pasos en los que se debe tener especial cuidado incluyen los pasos de enriquecimiento y elución, en los que se requieren valores de pH de 7.7 y 8.0 para un enriquecimiento y una elución adecuados, respectivamente. Los valores erróneos de pH durante estos pasos resultarán en una disminución o pérdida de señal.
Hasta la fecha, hay muchos métodos basados en la química aparte de RAC que son ampliamente utilizados para estudiar la oxidación de la cisteína tiol, incluido el método más utilizado, la técnica de cambio de biotina43,44. Una cosa que todos estos métodos tienen en común, incluido el RAC, es que se basan en métodos indirectos para la detección de cisteínas oxidadas. Se basan en intermediarios modificados químicamente del tiol oxidado original para su detección. Sin embargo, un atributo clave que distingue a RAC de otros métodos es la capacidad de recopilar datos cuantitativos multiplexados sobre sitios específicos de cisteína de tioles oxidados.
El método se realiza con proteínas/péptidos unidos covalentemente a la resina, lo que permite llevar a cabo los pasos de procedimiento (por ejemplo, reducción, etiquetado, lavado, digestión) sin manipulación adicional. Al realizar LC-MS/MS en muestras multiplexadas, se generan conjuntos de datos que permiten descubrimientos en todo el proteoma. Los efectos de un tratamiento o estímulo específico en múltiples grupos de muestra se observan a nivel global, lo que permite el descubrimiento de nuevos mecanismos y vías. El flujo de trabajo fundamental es altamente adaptable a las necesidades específicas y áreas de interés de los usuarios finales. La validación ortogonal de los hallazgos observados en los datos de espectrometría de masas sigue siendo un desafío. La mutagénesis dirigida al sitio de un sitio específico y la utilización de ensayos que investigan los efectos consecuentes es un enfoque común pero laborioso.
Para seleccionar sitios candidatos que pueden ser biológicamente significativos, se pueden utilizar estudios bioinformáticos para aprender más sobre las características de un sitio con un alto nivel de oxidación, como la proximidad de un sitio a un sitio activo o estructura secundaria27. Las simulaciones de dinámica molecular pueden resultar de gran valor en estudios futuros, ya que pueden modelar los efectos de las modificaciones redox en la estructura de las proteínas y proporcionar información sobre cómo la función de una proteína puede verse afectada13,45. Al implementar esta sólida estrategia, esperamos que la comunidad científica se beneficie al adaptar este método a su propio sistema modelo único y ampliar el conocimiento actual de la biología redox a través de muchos modelos y sistemas biológicos diferentes.
Divulgaciones
Los autores declaran no tener conflictos de intereses, financieros o de otro tipo.
Agradecimientos
Partes del trabajo fueron apoyadas por las subvenciones de los NIH R01 DK122160, R01 HL139335 y U24 DK112349
Materiales
| Name | Company | Catalog Number | Comments |
| 2-(Pyridyldithio)ethylamine hydrochloride | Med Chem Express | HY-101794 | Reagent for in-house resin synthesis |
| 2.0 mL LoBind centrifuge tubes | Eppendorf | 22431048 | |
| 5.0 mL LoBind centrifuge tubes | Eppendorf | 30108310 | |
| 5.0 mL round bottom tubes | Falcon | 352054 | |
| Acetone | Fisher Scientific | A949-1 | |
| Acetonitrile | Sigma Aldrich | 34998 | |
| Activated Thiol–Sepharose 4B | Sigma Aldrich | T8512 | Potential replacement for thiol-affinity resin |
| Amicon Ultra 0.5 mL centrifugal filter | Millipore Sigma | UFC5010BK | |
| Ammonium bicarbonate | Sigma Aldrich | 09830 | |
| Bicinchonicic acid (BCA) | Thermo Scientific | 23227 | Protein Assay Reagent |
| Centrifuge | Eppendorf | 5810R | |
| Centrifuge | Eppendorf | 5415R | |
| Dithiothreitol (DTT) | Thermo Scientific | 20291 | |
| EDTA | Sigma Aldrich | E5134 | |
| HEPES buffer | Sigma Aldrich | H4034 | |
| Homogenizer | BioSpec Products | 985370 | |
| Iodoacetimide (IAA) | Sigma Aldrich | I1149 | |
| N-ethylmaleimide | Sigma Aldrich | 4259 | |
| NHS-Activated Sepharose 4 Fast Flow | Cytiva | 17-0906-01 | Reagent for in-house resin synthesis |
| QIAvac 24 Plus vacuum manifold | Qiagen | 19413 | |
| Sodium chloride | Sigma Aldrich | S3014 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | L6026 | |
| Sonicator | Branson | 1510R-MT | |
| Spin columns | Thermo Scientific | 69705 | |
| Strata C18-E reverse phase columns | Phenomenex | 8B-S001-DAK | Peptide desalting |
| Thermomixer | Eppendorf | 5355 | |
| Thiopropyl Sepharose 6B | GE Healthcare | 17-0420-01 | Thiol-affinity resin; *Production of Thiopropyl Sepharose 6B resin has been discontinued by the manufacturer (see protocol for details). |
| TMT isobaric labels (16 plex) | Thermo Scientific | A44522 | Peptide labeling reagent; available in multiple formats |
| Triethylammonium bicarbonate buffer (TEAB) | Sigma Aldrich | T7408 | |
| Trifluoroacetic acid (TFA) | Sigma Aldrich | T6508 | |
| Triton X-100 | Sigma Aldrich | T8787 | |
| Trypsin | Promega | V5820 | |
| Urea | Sigma Aldrich | U5378 | |
| Vacufuge Plus speedvac | Eppendorf | 22820001 | vacuum concentrator |
| Vortex mixer | Scientific Industries | SI-0236 |
Referencias
- Sies, H., Jones, D. P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nature Reviews Molecular Cell Biology. 21 (7), 363-383 (2020).
- Adams, L., Franco, M. C., Estevez, A. G. Reactive nitrogen species in cellular signaling. Experimental Biology and Medicine. 240 (6), 711-717 (2015).
- Olson, K. R. The biological legacy of sulfur: A roadmap to the future. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 252, 110824 (2021).
- Sies, H. Oxidative eustress: on constant alert for redox homeostasis. Redox Biology. 41, 101867 (2021).
- Poole, L. B. The basics of thiols and cysteines in redox biology and chemistry. Free Radical Biology & Medicine. 80, 148-157 (2015).
- Guo, J., et al. Proteome-wide light/dark modulation of thiol oxidation in cyanobacteria revealed by quantitative site-specific redox proteomics. Molecular & Cellular Proteomics. 13 (12), 3270-3285 (2014).
- Shi, X., Qiu, H. Post-translational S-nitrosylation of proteins in regulating cardiac oxidative stress. Antioxidants. 9 (11), 1051 (2020).
- Fra, A., Yoboue, E. D., Sitia, R. Cysteines as redox molecular switches and targets of disease. Frontiers in Molecular Neuroscience. 10, 167 (2017).
- Klomsiri, C., Karplus, P. A., Poole, L. B. Cysteine-based redox switches in enzymes. Antioxidants & Redox Signaling. 14 (6), 1065-1077 (2011).
- Go, Y. M., Jones, D. P. The redox proteome. Journal of Biological Chemistry. 288 (37), 26512-26520 (2013).
- Bak, D. W., Bechtel, T. J., Falco, J. A., Weerapana, E. Cysteine reactivity across the subcellular universe. Current Opinion in Chemical Biology. 48, 96-105 (2019).
- Skryhan, K., et al. The role of cysteine residues in redox regulation and protein stability of Arabidopsis thaliana starch synthase 1. PLoS One. 10 (9), 0136997 (2015).
- Su, Z., et al. Global redox proteome and phosphoproteome analysis reveals redox switch in Akt. Nature Communications. 10 (1), 5486 (2019).
- Liebthal, M., Schuetze, J., Dreyer, A., Mock, H. -. P., Dietz, K. -. J. Redox conformation-specific protein-protein interactions of the 2-cysteine peroxiredoxin in Arabidopsis. Antioxidants. 9 (6), 515 (2020).
- Pace, N. J., Weerapana, E. Zinc-binding cysteines: diverse functions and structural motifs. Biomolecules. 4 (2), 419-434 (2014).
- Schwartz, P. A., et al. Covalent EGFR inhibitor analysis reveals importance of reversible interactions to potency and mechanisms of drug resistance. Proceedings of the National Academy of Sciences of the United States of America. 111 (1), 173 (2014).
- Sevilla, E., Bes, M. T., González, A., Peleato, M. L., Fillat, M. F. Redox-based transcriptional regulation in prokaryotes: revisiting model mechanisms. Antioxidants & Redox Signaling. 30 (13), 1651-1696 (2018).
- Topf, U., et al. Quantitative proteomics identifies redox switches for global translation modulation by mitochondrially produced reactive oxygen species. Nature Communications. 9 (1), 324 (2018).
- Gao, X. -. H., et al. Discovery of a redox thiol switch: implications for cellular energy metabolism. Molecular & Cellular Proteomics. 19 (5), 852-870 (2020).
- Prus, G., Hoegl, A., Weinert, B. T., Choudhary, C. Analysis and interpretation of protein post-translational modification site stoichiometry. Trends in Biochemical Sciences. 44 (11), 943-960 (2019).
- Zhang, T., Gaffrey, M. J., Li, X., Qian, W. J. Characterization of cellular oxidative stress response by stoichiometric redox proteomics. American Journal of Physiology. Cell Physiology. 320 (2), 182-194 (2021).
- Jaffrey, S. R., Erdjument-Bromage, H., Ferris, C. D., Tempst, P., Snyder, S. H. Protein S-nitrosylation: a physiological signal for neuronal nitric oxide. Nature Cell Biology. 3 (2), 193-197 (2001).
- Alcock, L. J., Perkins, M. V., Chalker, J. M. Chemical methods for mapping cysteine oxidation. Chemical Society Reviews. 47 (1), 231-268 (2018).
- Li, R., Kast, J. Biotin switch assays for quantitation of reversible cysteine oxidation. Methods in Enzymology. 585, 269-284 (2017).
- Guo, J., et al. Resin-assisted enrichment of thiols as a general strategy for proteomic profiling of cysteine-based reversible modifications. Nature Protocols. 9 (1), 64-75 (2014).
- Liu, T., et al. High-throughput comparative proteome analysis using a quantitative cysteinyl-peptide enrichment technology. Analytical Chemistry. 76 (18), 5345-5353 (2004).
- Duan, J., et al. Stochiometric quantification of the thiol redox proteome of macrophages reveals subcellular compartmentalization and susceptibility to oxidative perturbations. Redox Biology. 36, 101649 (2020).
- Mitchell, A. R., et al. Redox regulation of pyruvate kinase M2 by cysteine oxidation and S-nitrosation. Biochemical Journal. 475 (20), 3275-3291 (2018).
- Campbell, M. D., et al. Improving mitochondrial function with SS-31 reverses age-related redox stress and improves exercise tolerance in aged mice. Free Radical Biology & Medicine. 134, 268-281 (2019).
- Duan, J., et al. Quantitative profiling of protein S-glutathionylation reveals redox-dependent regulation of macrophage function during nanoparticle-induced oxidative stress. ACS Nano. 10 (1), 524-538 (2016).
- Wang, J., et al. Protein thiol oxidation in the rat lung following e-cigarette exposure. Redox Biology. 37, 101758 (2020).
- Kramer, P. A., et al. Fatiguing contractions increase protein S-glutathionylation occupancy in mouse skeletal muscle. Redox Biology. 17, 367-376 (2018).
- Chiao, Y. A., et al. Late-life restoration of mitochondrial function reverses cardiac dysfunction in old mice. Elife. 9, 55513 (2020).
- Forrester, M. T., et al. Site-specific analysis of protein S-acylation by resin-assisted capture. Journal of Lipid Research. 52 (2), 393-398 (2011).
- Su, D., et al. Quantitative site-specific reactivity profiling of S-nitrosylation in mouse skeletal muscle using cysteinyl peptide enrichment coupled with mass spectrometry. Free Radical Biology & Medicine. 57, 68-78 (2013).
- Su, D., et al. Proteomic identification and quantification of S-glutathionylation in mouse macrophages using resin-assisted enrichment and isobaric labeling. Free Radical Biology & Medicine. 67, 460-470 (2014).
- Searle, B. C., Yergey, A. L. An efficient solution for resolving iTRAQ and TMT channel cross-talk. Journal of Mass Spectrometry. 55 (8), 4354 (2020).
- Duan, J., Gaffrey, M. J., Qian, W. J. Quantitative proteomic characterization of redox-dependent post-translational modifications on protein cysteines. Molecular BioSystems. 13 (5), 816-829 (2017).
- Behring, J. B., et al. Spatial and temporal alterations in protein structure by EGF regulate cryptic cysteine oxidation. Science Signaling. 13 (615), 7315 (2020).
- Shakir, S., Vinh, J., Chiappetta, G. Quantitative analysis of the cysteine redoxome by iodoacetyl tandem mass tags. Analytical and Bioanalytical Chemistry. 409 (15), 3821-3830 (2017).
- Gorin, G., Martic, P. A., Doughty, G. Kinetics of the reaction of N-ethylmaleimide with cysteine and some congeners. Archives of Biochemistry and Biophysics. 115 (3), 593-597 (1966).
- Hsu, M. -. F., et al. Distinct effects of N-ethylmaleimide on formyl peptide- and cyclopiazonic acid-induced Ca2+ signals through thiol modification in neutrophils. Biochemical Pharmacology. 70 (9), 1320-1329 (2005).
- Li, R., Huang, J., Kast, J. Identification of total reversible cysteine oxidation in an atherosclerosis model using a modified biotin switch assay. Journal of Proteome Research. 14 (5), 2026-2035 (2015).
- Wang, J., et al. Integrated dissection of cysteine oxidative post-translational modification proteome during cardiac hypertrophy. Journal of Proteome Research. 17 (12), 4243-4257 (2018).
- Patra, K. K., Bhattacharya, A., Bhattacharya, S. Molecular dynamics investigation of a redox switch in the anti-HIV protein SAMHD1. Proteins. 87 (9), 748-759 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados