Method Article
Harzgestützte Erfassung in Verbindung mit isobarer Tandem-Massenmarkierung für eine multiplexige Quantifizierung der Proteinthioloxidation
In diesem Artikel
Zusammenfassung
Die Proteinthioloxidation hat unter normalen physiologischen und pathophysiologischen Bedingungen erhebliche Auswirkungen. Wir beschreiben die Details einer quantitativen Redox-Proteomik-Methode, die harzgestützten Einfang, isobare Markierung und Massenspektrometrie verwendet, um eine ortsspezifische Identifizierung und Quantifizierung von reversibel oxidierten Cysteinresten von Proteinen zu ermöglichen.
Zusammenfassung
Reversible oxidative Modifikationen an Proteinthiolen haben sich kürzlich als wichtige Mediatoren der Zellfunktion herausgestellt. Hierin beschreiben wir das detaillierte Verfahren einer quantitativen Redox-Proteomik-Methode, die harzgestützten Einfang (RAC) in Kombination mit isobarer Tandem-Massenmarkierung (TMT) und Flüssigkeitschromatographie-Tandem-Massenspektrometrie (LC-MS / MS) verwendet, um eine gemultiplexte stöchiometrische Quantifizierung oxidierter Proteinthiole auf Proteomebene zu ermöglichen. Die standortspezifischen quantitativen Informationen zu oxidierten Cysteinresten liefern zusätzliche Einblicke in die funktionellen Auswirkungen solcher Modifikationen.
Der Arbeitsablauf kann an viele Probentypen angepasst werden, einschließlich kultivierter Zellen (z. B. Säugetierzellen, Prokaryoten) und ganzer Gewebe (z. B. Herz, Lunge, Muskel), die zunächst lysiert/homogenisiert und mit freien Thiolen alkyliert werden, um eine künstliche Oxidation zu verhindern. Die oxidierten Proteinthiole werden dann reduziert und von einem Thiol-Affinitätsharz erfasst, das die Arbeitsschritte rationalisiert und vereinfacht, indem die fortschreitenden Verdauungs-, Markierungs- und Waschvorgänge ohne zusätzlichen Transfer von Proteinen / Peptiden durchgeführt werden können. Schließlich werden die markierten Peptide eluiert und mittels LC-MS/MS analysiert, um umfassende stöchiometrische Veränderungen im Zusammenhang mit der Thioloxidation über das gesamte Proteom aufzudecken. Diese Methode verbessert das Verständnis der Rolle der redoxabhängigen Regulation unter physiologischen und pathophysiologischen Zuständen im Zusammenhang mit der Proteinthioloxidation erheblich.
Einleitung
Unter homöostatischen Bedingungen erzeugen Zellen reaktive Sauerstoff-, Stickstoff- oder Schwefelspezies, die dazu beitragen, Prozesse wie Stoffwechsel und Signalübertragung 1,2,3 zu erleichtern, die sich sowohl auf Prokaryoten als auch auf Eukaryoten erstrecken. Die physiologischen Ebenen dieser reaktiven Spezies sind für die ordnungsgemäße Zellfunktion notwendig, auch bekannt als "Eustress"1,4. Im Gegensatz dazu kann ein Anstieg der Oxidationsmittel, der zu einem Ungleichgewicht zwischen Oxidationsmitteln und Antioxidantien führt, oxidativen Stress oder "Distress"1 verursachen, der zu Zellschäden führt. Oxidantien leiten Signale an biologische Signalwege weiter, indem sie verschiedene Biomoleküle modifizieren, einschließlich Protein, DNA, RNA und Lipide. Insbesondere Cysteinreste von Proteinen sind hochreaktive Stellen, die aufgrund der Thiolgruppe auf Cystein, die gegenüber verschiedenen Arten von Oxidationsmitteln reaktiv ist, oxidationsanfällig sind5. Dies führt zu einer Vielzahl von reversiblen redoxbasierten posttranslationalen Modifikationen (PTMs) für Cystein, einschließlich Nitrosylierung (SNO), Glutathionylierung (SSG), Sulfenylierung (SOH), Persulfidierung (SSH), Polysulfidierung (SSnH), Acylierung und Disulfiden. Irreversible Formen der Cysteinoxidation umfassen Sulfinylierung (SO2H) und Sulfonylierung (SO3H).
Reversible oxidative Modifikationen von Cysteinresten können eine schützende Rolle spielen, die eine weitere irreversible Oxidation verhindert, oder als Signalmoleküle für nachgeschaltete zelluläre Signalwege dienen 6,7. Die Reversibilität einiger Thiol-Redox-PTMs ermöglicht es Cysteinstellen, als "Redoxschalter"8,9 zu fungieren, wobei Änderungen im Redoxzustand dieser Stellen die Proteinfunktion verändern, um ihre Rolle in transienten Prozessen zu regulieren. Die modulatorischen Wirkungen von Redox-PTMs 10 wurden in vielen Aspekten der Proteinfunktion 11 beobachtet, einschließlich Katalyse 12, Protein-Protein-Interaktionen13, Konformationsänderung14, Metallionenkoordination 15 oder pharmakologische Inhibitorbindung 16. Darüber hinaus sind Redox-PTMs an Cysteinstellen von Proteinen beteiligt, die Wege wie Transkription 17, Translation18 oder Stoffwechsel19 regulieren. Angesichts des Einflusses, den Redox-PTMs auf die Proteinfunktion und biologische Prozesse haben, ist es wichtig, das Ausmaß der Oxidation zu quantifizieren, das eine Cysteinstelle als Reaktion auf eine Störung des Redoxzustands erfährt.
Die Identifizierung von Cysteinstellen mit veränderten Redoxzuständen konzentriert sich auf den Vergleich der Oxidationsstufe auf der standortspezifischen Ebene zwischen normalen und gestörten Bedingungen. Faltenänderungsmessungen werden häufig verwendet, um festzustellen, welche Stellen signifikant verändert sind, da dies den Benutzern hilft, zu interpretieren, welche Cysteinstellen für die Studie physiologisch bedeutsam sein können. Alternativ liefern stöchiometrische Messungen der reversiblen Thioloxidation über einen bestimmten Probentyp hinweg ein allgemeines Bild des physiologischen Zustands in Bezug auf die zelluläre Oxidation, eine wichtige Messung, die oft übersehen und nicht ausreichend genutzt wird. Die Modifikationsstöchiometrie basiert auf der Quantifizierung des Prozentsatzes des modifizierten Thiols im Verhältnis zum Gesamtproteinthiol (modifiziert und unmodifiziert)20,21. Infolgedessen bieten stöchiometrische Messungen eine präzisere Messung als Faltenänderungen, insbesondere bei Verwendung der Massenspektrometrie. Die Bedeutung der Zunahme der Oxidation kann leichter durch die Stöchiometrie ermittelt werden, um die PTM-Belegung einer bestimmten Cysteinstelle zu bestimmen. Zum Beispiel könnte ein 3-facher Anstieg der Thioloxidation aus einem Übergang von nur 1% zu 3% oder so groß wie 30% zu 90% resultieren. Eine 3-fache Erhöhung der Oxidation für eine Stelle, die nur bei 1% Belegung ist, kann wenig Einfluss auf die Funktion eines Proteins haben; Eine 3-fache Erhöhung für einen Standort mit 30% Belegung im Ruhezustand kann jedoch stärker betroffen sein. Stöchiometrische Messungen, wenn sie zwischen insgesamt oxidierten Thiolen und spezifischen oxidativen Modifikationen, einschließlich Proteinglutathionylierung (SSG) und Nitrosylierung (SNO), durchgeführt werden, können Verhältnisse und quantitative Informationen in Bezug auf bestimmte Modifikationstypen aufdecken.
Da die reversible Thioloxidation typischerweise eine posttranslationale Modifikation mit geringer Häufigkeit ist, wurden mehrere Ansätze für die Anreicherung von Proteinen entwickelt, die diese Modifikationen aus biologischen Proben enthalten. Ein früher Ansatz, der von Jaffrey und anderen entwickelt wurde und als Biotin-Switch-Technik (BST)22 bezeichnet wird, umfasst mehrere Schritte, bei denen unmodifizierte Thiole durch Alkylierung blockiert werden, reversibel modifizierte Thiole zu entstehenden freien Thiolen reduziert werden, naszierende freie Thiole mit Biotin markiert werden und die markierten Proteine durch Streptavidin-Affinitätspulldown angereichert werden. Diese Technik wurde in vielen Studien verwendet, um SNO und SSG zu profilieren und kann angepasst werden, um andere Formen der reversiblen Thioloxidation23,24 zu untersuchen. Während BST verwendet wurde, um verschiedene Formen der reversiblen Thioloxidation zu untersuchen, besteht ein Problem bei diesem Ansatz darin, dass die Anreicherung durch die unspezifische Bindung von unbiotinylierten Proteinen an Streptavidin beeinflusst wird. Ein alternativer Ansatz, der in unserem Labor entwickelt wurde, genannt Resin-assisted capture (RAC)25,26 (Abbildung 1), umgeht das Problem der Anreicherung von Thiolgruppen über das Biotin-Streptavidin-System.
Nach der Reduktion reversibel oxidierter Thiole werden Proteine mit entstehenden freien Thiolen durch das Thiolaffinitätsharz angereichert, das kovalent freie Thiolgruppen einfängt, was eine spezifischere Anreicherung von Cystein-haltigen Proteinen als BST ermöglicht. Die Kopplung von RAC mit der Multiplexleistung der jüngsten Fortschritte in der isobaren Markierung und Massenspektrometrie schafft einen robusten und empfindlichen Workflow für die Anreicherung, Identifizierung und Quantifizierung reversibel oxidierter Cysteinreste auf proteomweiter Ebene. Jüngste Fortschritte in der Massenspektrometrie haben eine viel tiefere Profilierung des Thiolredoxproteoms ermöglicht und das Verständnis sowohl der Ursache als auch der Wirkung der Proteinthioloxidation verbessert27. Die aus standortspezifischen quantitativen Daten gewonnenen Informationen ermöglichen weitere Studien der mechanistischen Auswirkungen und nachgelagerten Effekte reversibler oxidativer Modifikationen28. Die Verwendung dieses Workflows hat Einblicke in die physiologischen Auswirkungen der reversiblen Cysteinoxidation in Bezug auf normale physiologische Ereignisse wie Alterung gegeben, wobei sich die SSG-Spiegel in Bezug auf das Alter unterschieden. Die Alterungseffekte auf SSG wurden teilweise mit SS-31 (Elamipretid) umgekehrt, einem neuartigen Peptid, das die mitochondriale Funktion verbessert und den SSG-Spiegel bei älteren Mäusen senkt, wodurch sie ein SSG-Profil haben, das jungen Mäusen ähnlicher ist29.
Es wurde gezeigt, dass pathophysiologische Bedingungen, die auf die Exposition von Nanopartikeln zurückzuführen sind, SSG in einem Mausmakrophagenmodell einbeziehen. Unter Verwendung von RAC in Verbindung mit Massenspektrometrie zeigten die Autoren, dass die SSG-Spiegel direkt mit dem Grad des oxidativen Stresses und der Beeinträchtigung der phagozytischen Makrophagenfunktion korrelierten. Die Daten zeigten auch wegspezifische Unterschiede in der Reaktion auf verschiedene technisch hergestellte Nanomaterialien, die unterschiedliche Grade von oxidativem Stress induzieren30. Die Methode hat sich auch bei prokaryotischen Spezies bewährt, wo sie angewendet wurde, um die Auswirkungen von Tageszyklen in photosynthetischen Cyanobakterien in Bezug auf die Thioloxidation zu untersuchen. Es wurden breite Veränderungen in der Thioloxidation über mehrere wichtige biologische Prozesse hinweg beobachtet, einschließlich Elektronentransport, Kohlenstofffixierung und Glykolyse. Darüber hinaus wurde durch orthogonale Validierung bestätigt, dass mehrere wichtige funktionelle Stellen modifiziert wurden, was auf eine regulatorische Rolle dieser oxidativen Modifikationen hindeutet6.
Hier beschreiben wir die Details eines standardisierten Workflows (Abbildung 1) und demonstrieren den Nutzen des RAC-Ansatzes für die Anreicherung von insgesamt oxidierten Cysteinthiolen von Proteinen und deren anschließende Markierung und stöchiometrische Quantifizierung. Dieser Workflow wurde in Studien des Redoxzustands in verschiedenen Probentypen implementiert, einschließlich Zellkulturen27,30 und ganzen Geweben (z. B. Skelettmuskel, Herz, Lunge)29,31,32,33. Obwohl das RAC-Protokoll hier nicht enthalten ist, kann es auch leicht für die Untersuchung spezifischer Formen reversibler Redoxmodifikationen angepasst werden, einschließlich SSG, NSO und S-Acylierung, wie bereits erwähnt25,29,34.
Protokoll
Alle im Protokoll beschriebenen Verfahren in Bezug auf tierische oder menschliche Proben/Gewebe wurden von der Ethikkommission für Human- und Tierforschung genehmigt und folgten den institutionellen Richtlinien.
1. Probenhomogenisierung/-lyse
- Gefrorene Gewebeproben
- Zerkleinern Sie gefrorenes Gewebe (~ 30 mg) auf einem Glasmikroskopobjektträger auf Trockeneis mit einer vorgekühlten Rasierklinge und einer Pinzette. Das Hackfleisch wird in ein vorgekühltes 5-ml-Polystyrolröhrchen mit rundem Boden überführt, das 700 μL Puffer A enthält (siehe Tabelle 1), und inkubiert auf Eis für 30 min lichtgeschützt.
- Brechen Sie das Gewebe für 30 s oder bis zur vollständigen Homogenisierung mit einem Handgewebehomogenisator. Die Proben auf Eis legen und den Schaum weitere 10 Minuten abklingen lassen.
HINWEIS: Ein auf Trockeneis gelegtes Aluminium-Backblech bietet eine stabile Arbeitsfläche und Plattform für die anfängliche Verarbeitung / Zerkleinerung des Gewebes.
- Alternativ können adhärente Zellkulturen in 100 mm Kulturschalen als Ausgangsmaterial verwendet werden.
- Halten Sie die Zellen auf Eis und spülen Sie die Zellen mit einer serologischen Pipette zweimal mit 10 ml eiskaltem PBS, das 100 mM NEM enthält.
- Lysieren Sie die Zellen durch Zugabe von 1 ml kaltem Homogenisierungs-/Lysepuffer und kräftiges Schaben mit einem starren Zellschaber. Das Lysat wird mit einer Mikropipette in ein 2-ml-Zentrifugenröhrchen überführt.
HINWEIS: Spülpuffer und Lysepuffer können entsprechend unterschiedlich großen Kulturgefäßen skaliert werden. Typischerweise werden 2-5 Millionen Zellen benötigt; Dies variiert jedoch je nach Lyseeffizienz und Proteinausbeute für bestimmte Zelltypen. Homogenisierungspuffer kann ohne NEM für Proben hergestellt werden, die auf Gesamtthiole analysiert werden.
- Das resultierende Homogenat (Schritt 1.1.2 oder 1.2.2) wird mit einer Mikropipette in ein 2-ml-Zentrifugenröhrchen überführt und bei voller Geschwindigkeit (≥16.000 × g) bei 4 °C für 10 min zentrifugiert.
- Der Überstand (~700 μL oder ~1 mL für Zellkultur) wird mit einer Mikropipette in ein 5 mL konisches Mikrozentrifugenröhrchen überführt und 30 min bei 55 °C im Dunkeln unter Schütteln bei 850 U/min inkubiert.
- Mit einer serologischen Glaspipette werden 4 ml eiskaltes Aceton zu den Proben gegeben und über Nacht bei -20 °C inkubiert, um das Protein auszufällen und überschüssiges N-Ethylmaleimid zu entfernen.
2. Harzgestützte Erfassung
- Die gefällten Proteinpellets werden zweimal mit Aceton gewaschen, indem Sie 10 min lang bei 20.500 × g bei 4 °C zentrifugieren, das Aceton dekantieren, das restliche Aceton mit einer Mikropipette entfernen und 3 ml frisches, eiskaltes Aceton mit einer serologischen Glaspipette hinzufügen. Mehrmals umkehren, um zu mischen. Lassen Sie die Pellets nach dem zweiten Waschen 1-2 min an der Luft trocknen und achten Sie darauf, nicht zu übertrocknen, da die Resuspension schwierig werden kann.
- Unter Verwendung einer Mikropipette 1 ml Puffer B (siehe Tabelle 1) zugeben und das Protein durch wiederholte Beschallung für jeweils 15-30 s mit einem Badsonikator mit einer Leistung von 250 W und kurzem Wirbeln lösen. Messen Sie die Proteinkonzentration mit dem Bicinchoninic Acid (BCA) Assay gemäß dem Protokoll des Herstellers.
- Um die Proteinkonzentrationen über die Proben hinweg für die weitere Verarbeitung zu standardisieren und eine vollständige Entfernung von NEM sicherzustellen, werden 500 μg Protein mit einer Mikropipette in einen 0,5 ml 10 kDa Zentrifugalfilter überführt und mit Resuspensionspuffer auf ein Endvolumen von 500 μL eingestellt.
- Zentrifugieren Sie bei 14.000 × g bei Raumtemperatur, bis das Volumen im Zentrifugalfilter weniger als 100 μl beträgt. Sammeln Sie die Proben, indem Sie den Filter in einem Sammelröhrchen umdrehen. Bei 1.000 × g für 2 min zentrifugieren und mit Puffer C auf ein Endvolumen von 500 μL einstellen (siehe Tabelle 1).
- Die Proteinthiole werden reduziert, indem 20 μL 500 mM Dithiothreitol (DTT) mit einer Mikropipette auf eine Endkonzentration von 20 mM gegeben und die Proben 30 min bei 37 °C unter Schütteln bei 850 U/min inkubiert werden.
- Nach der Reduktion werden die Proben mit einer Mikropipette auf 0,5 mL 10 kDa Zentrifugalfilter überführt und 15 min bei 14.000 × g bei Raumtemperatur oder bis das Volumen im Zentrifugalfilter weniger als 100 μL beträgt. Fügen Sie den Puffer D hinzu (siehe Tabelle 1), um das Volumen im Zentrifugalfilter auf 500 μL zu erhöhen.
- Wiederholen Sie das Zentrifugieren und die Zugabe zu 500 μL in Schritt 2.6 dreimal, und nach der vierten Zentrifugation sammeln Sie die Proben, indem Sie den Filter in einem Sammelröhrchen umdrehen und 2 min lang bei 1.000 × g zentrifugieren.
- Messen Sie die Proteinkonzentration mit dem BCA-Assay gemäß dem Protokoll des Herstellers.
- Während dieses Pufferaustauschs wird das Thiolaffinitätsharz hergestellt, indem die entsprechende Menge Harz (30 mg/Probe) mit einer Mikrowaage gewogen und in ein 50-ml-Zentrifugenröhrchen überführt wird. Dann mit einer serologischen Pipette Wasser für eine Endkonzentration von 30 mg / ml Harz hinzufügen und bei Raumtemperatur für 1 h unter Rühren für eine ordnungsgemäße Hydratation des Harzes inkubieren.
HINWEIS: Das oben erwähnte Thiol-Affinitätsharz wurde vom Hersteller eingestellt. Ein möglicher Ersatz für dieses Thiol-affine Harz ist kommerziell erhältlich. Dieser Ersatz hat jedoch eine fast 5-fach geringere Bindungskapazität (siehe Ergänzende Informationen). Alternativ kann das Thiol-affine Harz unter Verwendung von 2-(Pyridyldithio)ethylaminhydrochlorid und N-Hydroxysuccinimid-aktiviertem Harz synthetisiert werden (siehe Ergänzende Informationen).- Nach dem Hydratisieren des Harzes legen Sie die Spinsäulen auf einen Vakuumverteiler und übertragen 500 μL der Harzaufschlämmung mit einer Mikropipette auf jede Säule. Vakuum zur Entfernung von Wasser anwenden; Wiederholen Sie diesen Schritt einmal, um insgesamt 30 mg Harz pro Säule zu erhalten. Alternativ zentrifugieren Sie bei 1.000 × g für 2 min anstelle des Vakuumverteilers für diesen und alle Harzwasch- und Elutionsschritte.
HINWEIS: Das Schneiden des Endes einer 1000-μL-Pipettenspitze zur Erhöhung der Bohrungsgröße hilft beim Transfer des Harzes. Es ist wichtig, zwischen dem Pipettieren zu trituieren, um sicherzustellen, dass das Harz suspendiert bleibt und homogene und gleiche Mengen Harz auf jede Säule übertragen werden. - Waschen Sie das Harz, indem Sie 500 μL Reinstwasser mit einer Mikropipette hinzufügen und Vakuum zum Entfernen des Wassers anwenden. Wiederholen Sie dies 5 mal. Dann waschen Sie das Harz 5 mal mit 500 μL Puffer E (siehe Tabelle 1).
HINWEIS: Alternativ kann eine Zentrifugation bei 1.000 x g für 2 min anstelle eines Vakuumverteilers für alle nachfolgenden Waschschritte verwendet werden. Alle weiteren Waschschritte werden mit einem Volumen von 500 μL durchgeführt. Wenn Sie der Säule Waschpuffer hinzufügen, fügen Sie vorsichtig mit genügend Kraft hinzu, um das Harz vollständig zu resuspendieren, während Spritzer und Harzverlust vermieden werden. Dies ermöglicht eine vollständige und effiziente Reinigung des Harzes.
- Nach dem Hydratisieren des Harzes legen Sie die Spinsäulen auf einen Vakuumverteiler und übertragen 500 μL der Harzaufschlämmung mit einer Mikropipette auf jede Säule. Vakuum zur Entfernung von Wasser anwenden; Wiederholen Sie diesen Schritt einmal, um insgesamt 30 mg Harz pro Säule zu erhalten. Alternativ zentrifugieren Sie bei 1.000 × g für 2 min anstelle des Vakuumverteilers für diesen und alle Harzwasch- und Elutionsschritte.
- Mit einer Mikropipette werden 150 μg Protein aus jeder reduzierten Probe in ein neues Röhrchen überführt und auf ein Endvolumen von 120 μL Puffer C eingestellt (siehe Tabelle 1). Die Proteinlösung wird mit einer Mikropipette in eine verstopfte Spinsäule überführt, die das Harz enthält, die Kappe auf die Säule gelegt und 2 h bei Raumtemperatur unter Schütteln bei 850 U/min inkubiert.
- Waschen Sie das Harz fünfmal mit 25 mM HEPES, pH 7,0; 8 M Harnstoff; gefolgt von fünf Mal mit 2 M NaCl; gefolgt von fünfmal mit 80% Acetonitril (ACN) mit 0,1% Trifluoressigsäure (TFA); und schließlich fünfmal mit 25 mM HEPES, pH 7,7, wie in Schritt 2.8.2 beschrieben und den Stecker austauschen.
HINWEIS: Proben können hier zur Analyse auf Proteinebene eluiert werden (z. B. SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE), Western Blot), wie in Schritt 4.1 beschrieben.
3. Tryptische Aufschluss auf Harz und TMT-Markierung
- Bereiten Sie genügend modifizierte Trypsinlösung in Sequenzierungsqualität für 6-8 μg pro Probe vor, indem Sie sie in einer Konzentration von 0,5 μg/μL im Puffer C (siehe Tabelle 1) auflösen, so dass das Endvolumen mindestens 120 μL pro Probe zulässt. Mit einer Mikropipette 120 μL dieser Trypsinlösung in die Proben geben und über Nacht bei 37 °C unter Schütteln bei 850 U/min inkubieren.
HINWEIS: Um die Verdauungseffizienz zu erhöhen, kann am nächsten Tag ein zusätzlicher Verdauungsschritt durchgeführt werden, indem die Trypsinlösung entfernt und durch frische Lösung ersetzt wird und die Verdauung für 2 h fortgesetzt wird. - Waschen Sie das Harz fünfmal mit 25 mM HEPES, pH 7,0; gefolgt von fünfmal 2 M NaCl; gefolgt von fünfmal mit 80% ACN mit 0,1% TFA; gefolgt von dreimal mit 25 mM HEPES, pH 7,7. Zum Schluss waschen Sie das Harz zweimal mit 50 mM Triethylammoniumbicarbonatpuffer (TEAB) und ersetzen Sie den Stopfen.
- Bereiten Sie TMT-Markierungsreagenzien vor, indem Sie sie zuerst auf Raumtemperatur erwärmen lassen, bevor Sie sie mit einer Zentrifuge bei 16.000 × g kurz herunterdrehen. In jede Durchstechflasche mit TMT-Markierungsreagenz werden 150 μL wasserfreies ACN mit einer Mikropipette gegeben. Inkubieren Sie die Fläschchen bei Raumtemperatur auf einem Thermomixer, der auf 850 U/min eingestellt ist, für 5 Minuten, um das Reagenz vollständig aufzulösen. Kurz vortex und bei 16.000 × g herunterdrehen, um das Reagenz zu sammeln.
- Mit einer Mikropipette 40 μL 100 mM TEAB zum gewaschenen Harz geben, dann 70 μL des gelösten TMT-Reagenzes zugeben und 1 h bei Raumtemperatur unter Schütteln bei 850 U/min inkubieren. Restliches TMT-Reagenz bei -80 °C lagern.
HINWEIS: Beachten Sie die einzelnen TMT-Etiketten, die jeder biologischen Probe zugeordnet sind (Abbildung 1). - Waschen Sie das Harz fünfmal mit 80% ACN mit 0,1% TFA, dreimal mit 100 mM Ammoniumbicarbonatpuffer (ABC), pH 8,0 und zweimal mit Wasser wie zuvor beschrieben und ersetzen Sie den Stopfen.
4. Peptidelution
- Eluieren Sie die markierten Peptide durch Zugabe von 100 μL 20 mM DTT in 100 mM ABC, pH 8,0, zu jeder Säule mit einer Mikropipette und inkubieren Sie bei Raumtemperatur für 30 min auf einem Thermomixer, der auf 850 U/min eingestellt ist.
HINWEIS: Nach der Zugabe von DTT verklumpt das Harz. Das Harz kann mit einer Pipettenspitze aufgebrochen werden, um Klumpen aufzubrechen und die vollständige Elution der Peptide sicherzustellen. - Nach dieser Inkubation legen Sie die Säule auf einen Vakuumverteiler, der für die Festphasenextraktion (SPE) vorgesehen ist, wenden Sie Vakuum an und eluieren Sie die Proben in ein 5-ml-Mikrozentrifugenröhrchen. Wiederholen Sie diesen Schritt einmal.
- Zum Schluss 100 μL 80% ACN mit 0,1% TFA hinzufügen, 10 min bei Raumtemperatur inkubieren und in dasselbe 5-ml-Zentrifugenröhrchen eluieren. Sammeln Sie alle Fraktionen in derselben 5-ml-Mikrozentrifugenröhre.
HINWEIS: Um Probenverlust zu vermeiden, müssen Röhrchen mit niedriger Bindung für die Elution verwendet werden, und die Volumina müssen bei oder unter einem Volumen von 4,0 ml für ein einzelnes 5-ml-Röhrchen gehalten werden. - Legen Sie die eluierten Proben in einen Vakuumkonzentrator, bis sie trocken sind. Lagern Sie die trockenen Peptide bei -80 °C und resuspendieren Sie sie später.
HINWEIS: Proben können auch separat eluiert werden, und ein Aliquot kann entfernt und von SDS-PAGE zur Analyse auf Peptidebene analysiert werden, bevor die Proben kombiniert werden.
5. Peptidalkylierung und Entsalzung/Reinigung
- Resuspendieren Sie die getrockneten Peptide durch Zugabe eines kleinen Volumens von 100 mM ABC-Puffer, pH 8,0 (nicht größer als 500 μL), mit einer Mikropipette. Verwenden Sie wiederholte Beschallung für jeweils 15-30 s mit einem Badsonikator mit einer Leistung von 250 W und Wirbel, um zu lösen und auf eine 2-ml-Röhre zu übertragen.
HINWEIS: Das Volumen von 100 mM ABC, pH 8,0, das hinzugefügt werden soll, basiert auf dem Volumen, das benötigt wird, um das DVB-T bei einer Molarität von 150 mM zu resuspendieren. Benutzer müssen die Menge an DVB-T in ihrer Probe basierend auf dem, was ursprünglich in Schritt 4.1 hinzugefügt wurde, bestimmen. - Fügen Sie genügend konzentrierte Stammlösung (600 mM) von in ABC gelöstem Iodoacetamid (IAA) unter Verwendung einer Mikropipette hinzu, um ein 1:4-Molverhältnis von DTT:IAA zu erreichen, und inkubieren Sie die Proben bei RT für 1 h mit Schütteln bei 850 U/min.
- Die Proben werden durch Zugabe von konzentriertem TFA (10%) mit einer Mikropipette auf pH-< 3 angesäuert und die Probenentsalzung mittels Umkehrphasenreinigung gemäß den Anweisungen des Herstellers durchgeführt.
- Legen Sie die sauberen Peptide in einen Vakuumkonzentrator, bis sie trocken sind. Lagern Sie die trockenen Peptide bis zur weiteren Analyse bei -80 °C.
6. Flüssigkeitschromatographie-Tandem-Massenspektrometrie
- Resuspendieren Sie die getrockneten Peptide durch wiederholte Beschallung für jeweils 15-30 s mit einem Badesonikator mit einer Leistung von 250 W und Wirbeln in 20-40 μL Wasser mit 3% ACN. Bestimmen Sie die Peptidkonzentration, indem Sie einen BCA-Assay gemäß dem Protokoll des Herstellers durchführen.
- Trennen Sie die Proben nach Umkehrphasen-LC und MS/MS wie zuvor beschrieben6 und zeichnen Sie die MS1-Spektren über den m/z-Bereich von 400-2000 auf. Stellen Sie sicher, dass die Hochenergie-Kollisionsdissoziation (HCD) verwendet wird, um Informationen zur Reporterionenintensität für die Analyse isobar markierter Peptide zu erhalten. Weitere Informationen zu den Gerätelaufbedingungen 27,30 und der Analyse der MS-Daten 27,31 finden Sie in den Methodenabschnitten früherer Berichte.
HINWEIS: Zur Analyse der Peptidproben können unterschiedliche LC-MS/MS-Systeme oder -Einstellungen verwendet werden. Die Abdeckung und Empfindlichkeit der Peptididentifizierung hängt vom jeweiligen System und den verwendeten Einstellungen ab.
Ergebnisse
Die Fertigstellung des Protokolls wird zu einer hochspezifischen Anreicherung ehemals oxidierter Cystein-haltiger Peptide führen, oft mit >95% Spezifität 27,35,36. Einige Schlüsselschritte des Protokolls erfordern jedoch besondere Aufmerksamkeit, z. B. die anfängliche Blockierung freier Thiole vor der Probenlyse/Homogenisierung, die die künstliche Oxidation und unspezifische Anreicherung künstlich oxidierter Thiole verbietet25. Proben können in mehreren Phasen des Protokolls und mit verschiedenen Methoden analysiert werden, einschließlich SDS-PAGE-Analyse von Proteinen und Peptiden. SDS-PAGE ermöglicht die qualitative Analyse von Proben, wobei Gesamtthiolproben verhältnismetrische Vergleiche zwischen Proben ermöglichen, um verschiedene Oxidationsgrade aufgrund von Behandlungen/Stimuli zu bestimmen (Abbildung 2A). Um den Oxidationsgrad einzelner Proteine weiter zu untersuchen, können SDS-PAGE-Gele einem Western Blotting unterzogen werden36 (Abbildung 2B). Dies ermöglicht es, das Modellsystem detaillierter zu analysieren und unterstützende Daten und weitere Hypothesen über Netzwerke und biologische Pfade zu generieren. Diese Methoden/unterstützenden Daten können auch als Qualitätskontrolle verwendet werden, um die erwarteten Reaktionen vor weiteren eingehenden Analysen wie LC-MS/MS zu bestätigen. Reporterionenintensitäten von Cystein-haltigen Peptiden, die von LC-MS/MS analysiert werden, können verwendet werden, um die Thioloxidationsstöchiometrie auf einzelnen Cys-Standortebenen zu quantifizieren (Abbildung 2C,D).
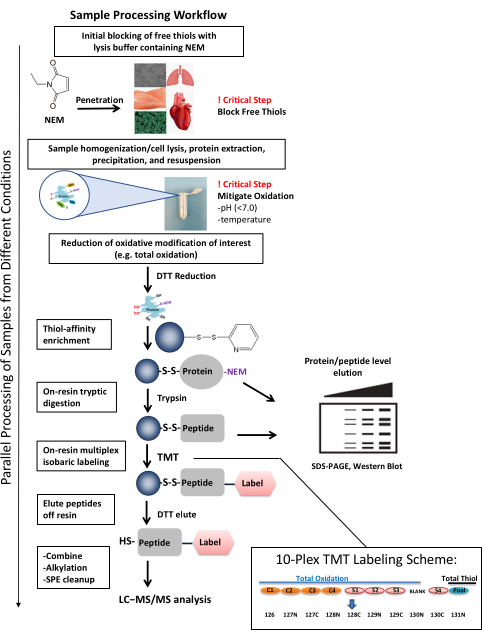
Abbildung 1: Workflow für die Probenverarbeitung. Der Probenverarbeitungs-Workflow ist anpassungsfähig, um die Thioloxidation in verschiedenen Probentypen und biologischen Systemen zu untersuchen. Der Workflow ermöglicht die Untersuchung der Oxidation sowohl auf Protein- als auch auf Peptidebene (z. B. SDS-PAGE, Western Blot) sowie eine umfassende Abdeckung für die quantitative, ortsspezifische Identifizierung einzelner Cysteinstellen mittels HPLC gekoppelt mit Massenspektrometrie. Die Probenverarbeitung kann in nur drei Tagen abgeschlossen werden, einschließlich der Durchführung mehrerer kritischer Schritte zur Generierung qualitativ hochwertiger, konsistenter Daten. Probenmultiplexing über TMT-Labeling ermöglicht die parallele Verarbeitung mehrerer Proben. Das repräsentative 10-Plex-TMT-Markierungsschema veranschaulicht, wie Proben unter Berücksichtigung des potenziellen Übersprechens aus dem Gesamtthiolkanal angeordnet werden können. Mit den Isotopenverunreinigungen der TMT-Reagenzien kann die Signalintensität eines Kanals mit hoher Intensität (z. B. Gesamtthiol) zu einem anderen Kanal mit niedriger Signalintensität beitragen und dessen Quantifizierungbeeinflussen 37. In dem Schema wird erwartet, dass ein gepoolter Gesamtthiolkanal (eine Kombination aus Kontroll- und experimentellen Proben) hohe Mengen an Cys-Peptiden enthält und mit 131N markiert ist, das ein Signal im Kanal 130N haben wird. Daher wird Kanal 130N im Experiment nicht verwendet. Die Menge an Kanalübersprechen, die von TMT-Etiketten erzeugt wird, finden Sie in den Analysenzertifikaten des Herstellers für eine entsprechende Charge des Reagens. Diese Abbildung wurde aus Guo et al., Nature Protocols, 201425 angepasst. Abkürzungen: NEM = N-ethylmaleimid; DTT = Dithiothreitol; SDS-PAGE = Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese; SPE = Festphasenextraktion; LC-MS/MS = Flüssigkeitschromatographie-Tandem-Massenspektrometrie; TMT = Tandem-Massentag. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
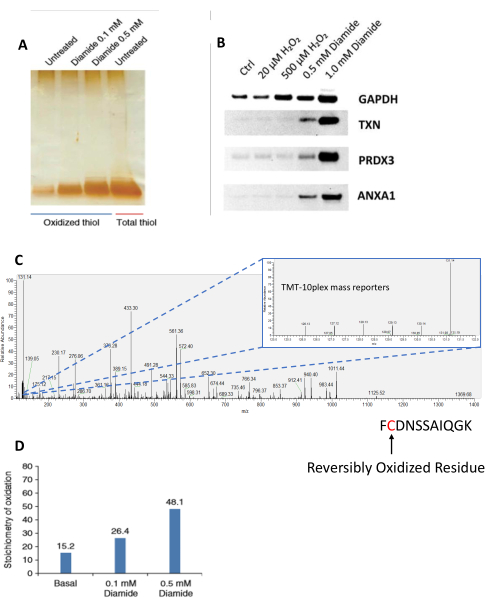
Abbildung 2: Analyse von Peptiden aus der RAC-Anreicherung. (A) SDS-PAGE Analyse von oxidierten Peptiden aus RAW 264.7 Zellen, die mit dem chemischen Oxidationsmittel Diamid für 30 min bei steigenden Konzentrationen (0,1 und 0,5 mM) und Gesamtpeptidthiolen behandelt wurden. Diese Unterfigur und Unterfigur D stammen aus Guo et al., Nature Protocols, 2014 25. Peptide wurden durch Silberfärbung sichtbar gemacht. (B) RAW 264.7-Zellen wurden mit exogenen Oxidationsmitteln (Wasserstoffperoxid und Diamid) in steigenden Konzentrationen behandelt. Das resultierende SSG-angereicherte Proteineluat wurde mittels SDS-PAGE getrennt und anschließend mittels Western Blot auf einzelne Proteine (GAPDH, TXN, PRDX3 und ANXA1) untersucht. Diese Unterfigur stammt aus Su et al., Free Radical Biology and Medicine, 201436. (C) Repräsentative MS/MS-Spektrumdaten eines Cystein-haltigen Peptids, die in der Xcalibur-Software angezeigt werden. Das eingesetzte MS/MS-Bild zeigt die entsprechenden Reporterionenintensitäten für dasselbe Peptid in jedem TMT-Kanal. In diesem Experiment wurde die Gesamtthiolprobe dem TMT-Label 131N zugeordnet, das die höchste Intensität aller im Experiment verwendeten Kanäle aufweist. (D) Stöchiometrie von iTRAQ-markierten, angereicherten, oxidierten Peptiden, gemessen mit LC-MS/MS. Der Gesamtthiolkanal wurde als Referenz verwendet, um die Stöchiometrie der Oxidation basierend auf dem Verhältnis der Reporterionenintensität jeder Probe im Vergleich zum Gesamtthiolkanal zu berechnen. Abkürzungen: RAC = resin-assisted capture; SDS-PAGE = Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese; Strg = Steuerung; GAPDH = Glycerinaldehyd-3-phosphat-Dehydrogenase; TXN = Thioredoxin; PRDX3 = Thioredoxin-abhängige Peroxidreduktase; ANXA1 = Anhang A1; LC-MS/MS = Flüssigkeitschromatographie-Tandem-Massenspektrometrie; MS/MS = Tandem-Massenspektrometrie; TMT = Tandem-Massentag; iTRAQ = isobaric tag für relative und absolute Quantifizierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Name des Puffers | Zweck | Inhalt |
| Puffer A | Lyse/Homogenisierung | 250 mM 2-(N-Morpholino)ethansulfonsäure (MES), pH 6,0; 1% Natriumdodecylsulfat (SDS); 1% Triton X-100; und 100 mM N-Ethylmaleimid (NEM) |
| Puffer B | Resuspension nach Proteinfällung und erstem Pufferaustausch | 250 mM 4-(2-hydroxyethyl)-1-piperazinethansulfonsäure (HEPES), pH 7,0; 8 M Harnstoff; 0,1% SDS |
| Puffer C | Reduktion/ Anreicherung/ Verdauung von Cystein-haltigen Proteinen | 25 mM HEPES, pH 7,7; 1 M Harnstoff; 0,1% SDS |
| Puffer D | Zweiter Pufferaustausch nach Reduktion | 25 mM HEPES, pH 7,0, 8 M Harnstoff; 0,1% SDS |
| Puffer E | Waschen des Harzes nach dem Hydratisieren | 25 mM HEPES, pH 7,7 |
Tabelle 1. Liste der Puffer
Ergänzende Informationen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die harzunterstützte Abscheidung wurde in einer Vielzahl von Probentypen und biologischen Systemen zur Untersuchung oxidativer Modifikationen von Cysteinresteneingesetzt 25,29,30. Diese Methode ermöglicht die Auswertung von Proben auf mehreren Ebenen und Auslesen, einschließlich Proteinen und Peptiden mittels SDS-PAGE und Western Blot-Analyse sowie einzelner Cysteinstellen mittels Massenspektrometrie. Unabhängig vom Probentyp oder dem endgültigen Endpunkt ermöglicht das Verfahren letztlich eine hocheffiziente und spezifische Anreicherung von Cystein-haltigen Proteinen und Peptiden38. Mit Hilfe von RAC haben wir Veränderungen im Oxidationszustand von bis zu mehreren tausend Cysteinstellen in verschiedenen Modellsystemen nach einer Störung identifiziert.
Bei Mäusen, die ermüdenden Muskelkontraktionen ausgesetzt waren, wurden 2.200 S-Glutathionylierungsstellen identifiziert, wobei mehr als die Hälfte signifikant veränderte S-Glutathionylierungsspiegel aufwiesen32. RAC wurde auch verwendet, um die reversible Thioloxidation von >2.100 Stellen in Cyanobakterien nach Exposition gegenüber einem Photosyntheseinhibitor oder verschiedenen Lichtverhältnissen zu profilieren6. Kürzlich haben wir die totale reversible Thioloxidation und S-Glutathionylierung von >4.000 Cysteinstellen in RAW 264.7-Makrophagenzellen unter Ruhebedingungen27 profiliert. In ähnlicher Weise quantifizierten Behring et al. die Oxidation von ~4.200 Cysteinstellen in A431-Zellen nach epidermaler Wachstumsfaktorstimulation39. Diese Studien zeigen die Robustheit von RAC, um viele Cysteinstellen (mindestens mehrere tausend) zu identifizieren, die einer reversiblen Thioloxidation unterzogen werden. Darüber hinaus kann die Fraktionierung von Proben die Abdeckung von Peptiden aus einem Experiment verbessern.
Außerhalb von experimentellen Kontrollen, bei denen entweder positive oder negative Kontrollproben verwendet werden können, um die biologischen Reaktionen des Modellsystems zu bestätigen, kann die Gesamtthiolanreicherung parallel zur Oxidation von Thiolen durchgeführt werden. Diese Gesamtthiolprobe liefert sowohl stöchiometrische Vergleiche als auch eine Basislinie, von der aus experimentelle oder behandelte Proben verglichen werden können. Kurz gesagt, diese Gesamtthiolprobe liefert eine Messung der Gesamtzahl der Cysteinthiole für eine bestimmte Cys-Stelle in einer bestimmten Probe. Dieses Konzept wurde auch von der OxiTMT-Methode übernommen, die Proben erzeugt, die völlig reduzierte Thiole enthalten, die den "Gesamtcysteingehalt" zum Vergleich mit oxidierten Cysteindarstellen 40.
Im Gegensatz zu OxiTMT ist RAC nicht durch die Plexzahl von iodoTMT eingeschränkt und kann daher mehr Gesamtthiolkanäle enthalten, um den Thiolgehalt mehrerer Probentypen, die in einer Studie verwendet werden, besser darzustellen. Darüber hinaus kann die Vorbereitung einer globalen Probe (ohne Anreicherung) parallel zum Thiol-Redox-Proteomik-Workflow erforderlich sein, um zu überprüfen, ob die Proteinhäufigkeiten in verschiedenen Probentypen verändert sind. Da die Methode an mehrere Arten von Redoxmodifikationen angepasst werden kann, müssen geeignete Kontrollen für die spezifische Modifikation von Interesse in Betracht gezogen werden. Zum Beispiel sind ultraviolettes Licht und Quecksilberchlorid beide wirksam bei der Abspaltung von SNO aus Proteinen, wodurch eine effektive Negativkontrolle für die Messung von SNO 7,25 entsteht. Eine wirksame Kontrolle zur Untersuchung von SSG-modifizierten Proteinen ist das Weglassen des Enzyms Glutardedoxin aus dem Reduktionscocktail während des Reduktionsschritts. Aufgrund der relativ hohen Spezifität von Glutaredoxin eliminiert sein Weglassen die Reduktion von SSG-modifizierten Proteinen und verhindert, dass sie einen Disulfidaustausch durchlaufen und schließlich in der Endanalyse angereichert werden36.
Es gibt mehrere Schritte innerhalb des Workflows für RAC, die für die Generierung qualitativ hochwertiger, reproduzierbarer Daten von grundlegender Bedeutung sind. Einer der ersten entscheidenden und wichtigsten Schritte ist die Alkylierung/Blockierung freier Thiole mit dem membrandurchlässigen Alkylierungsmittel N-Ethylmaleimid (NEM), das über einen breiten pH-Bereich41,42 schnell reagiert. Dieser Schritt verhindert, dass entstehende Thiole während der Probenverarbeitung oxidiert werden, und mildert die unspezifische Anreicherung dieser künstlich oxidierten Thiole während der Disulfidaustauschanreicherung. Eine unzureichende Alkylierung führt zu einem erhöhten Hintergrund- und falsch-positiven Signal, wie in einem früheren Bericht6 festgestellt wurde.
Aufgrund seiner hohen Reaktivität und seiner Fähigkeit, freie Thiole zu blockieren, ist jedoch auch Vorsicht geboten, um sicherzustellen, dass es vor der Anreicherung vollständig aus den Proben entfernt wird, wo verbleibendes NEM binden und die Harzkopplung stören kann, was letztendlich zum Signalverlust aufgrund einer Abnahme der Proteinbindung führt. Dies wird durch Acetonfällung und mehrere Runden Pufferaustausch mit Molekulargewichts-Cut-off-Filtern erreicht. Die Überwachung und Aufrechterhaltung des richtigen pH-Werts während des gesamten Protokolls ist ebenfalls von entscheidender Bedeutung. Ein pH-Wert von 6,0 wird aufrechterhalten, um das Mischen von Disulfid und die Bildung von gemischten Disulfiden vor der Anreicherung zu mildern. Andere Schritte, bei denen besondere Vorsicht geboten ist, sind die Anreicherungs- und Elutionsschritte, wobei pH-Werte von 7,7 bzw. 8,0 für eine ordnungsgemäße Anreicherung bzw. Elution erforderlich sind. Falsche pH-Werte während dieser Schritte führen zu einer Abnahme oder einem Verlust des Signals.
Bis heute gibt es neben RAC viele chemiebasierte Methoden, die zur Untersuchung der Cysteinthioloxidation weit verbreitet sind, einschließlich der am häufigsten verwendeten Methode, der Biotin-Switch-Technik43,44. Allen diesen Methoden, einschließlich RAC, ist gemeinsam, dass sie auf indirekten Methoden zum Nachweis von oxidierten Cysteinen basieren. Sie sind auf chemisch modifizierte Zwischenprodukte des ursprünglichen oxidierten Thiols zum Nachweis angewiesen. Ein Schlüsselmerkmal, das RAC von anderen Methoden unterscheidet, ist jedoch die Fähigkeit, gemultiplexte, quantitative Daten über spezifische Cysteinstellen oxidierter Thiole zu sammeln.
Das Verfahren wird mit kovalent an das Harz gebundenen Proteinen/Peptiden durchgeführt, wodurch weitere Schritte (z. B. Reduktion, Markierung, Waschen, Aufschluss) ohne weitere Handhabung durchgeführt werden können. Durch die Durchführung von LC-MS/MS an gemultiplexten Proben werden Datensätze generiert, die proteomweite Entdeckungen ermöglichen. Die Auswirkungen einer bestimmten Behandlung oder Reize über mehrere Stichprobengruppen hinweg werden auf globaler Ebene beobachtet, was die Entdeckung neuer Mechanismen und Wege ermöglicht. Der grundlegende Workflow ist in hohem Maße an die spezifischen Bedürfnisse und Interessengebiete der Endbenutzer anpassbar. Die orthogonale Validierung von Befunden, die in massenspektrometrischen Daten beobachtet wurden, bleibt eine Herausforderung. Die ortsgerichtete Mutagenese eines bestimmten Standorts und die Verwendung von Assays, die die Folgewirkungen untersuchen, ist ein üblicher, aber arbeitsintensiver Ansatz.
Um Kandidatenstandorte zu untersuchen, die biologisch signifikant sein können, können bioinformatische Studien verwendet werden, um mehr über die Eigenschaften eines Standorts mit einem hohen Oxidationsgrad zu erfahren, wie z. B. die Nähe eines Standorts zu einem aktiven Standort oder einer Sekundärstruktur27. Molekulardynamik-Simulationen könnten sich in zukünftigen Studien als sehr wertvoll erweisen, da sie die Auswirkungen von Redoxmodifikationen auf die Proteinstruktur modellieren und Aufschluss darüber geben können, wie die Funktion eines Proteins beeinflusst werden kann13,45. Durch die Umsetzung dieser robusten Strategie hoffen wir, dass die wissenschaftliche Gemeinschaft davon profitieren wird, indem sie diese Methode an ihr eigenes einzigartiges Modellsystem anpasst und das aktuelle Wissen über die Redoxbiologie über viele verschiedene Modelle und biologische Systeme erweitert.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte, weder finanziell noch anderweitig.
Danksagungen
Teile der Arbeit wurden durch NIH Grants R01 DK122160, R01 HL139335 und U24 DK112349 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-(Pyridyldithio)ethylamine hydrochloride | Med Chem Express | HY-101794 | Reagent for in-house resin synthesis |
| 2.0 mL LoBind centrifuge tubes | Eppendorf | 22431048 | |
| 5.0 mL LoBind centrifuge tubes | Eppendorf | 30108310 | |
| 5.0 mL round bottom tubes | Falcon | 352054 | |
| Acetone | Fisher Scientific | A949-1 | |
| Acetonitrile | Sigma Aldrich | 34998 | |
| Activated Thiol–Sepharose 4B | Sigma Aldrich | T8512 | Potential replacement for thiol-affinity resin |
| Amicon Ultra 0.5 mL centrifugal filter | Millipore Sigma | UFC5010BK | |
| Ammonium bicarbonate | Sigma Aldrich | 09830 | |
| Bicinchonicic acid (BCA) | Thermo Scientific | 23227 | Protein Assay Reagent |
| Centrifuge | Eppendorf | 5810R | |
| Centrifuge | Eppendorf | 5415R | |
| Dithiothreitol (DTT) | Thermo Scientific | 20291 | |
| EDTA | Sigma Aldrich | E5134 | |
| HEPES buffer | Sigma Aldrich | H4034 | |
| Homogenizer | BioSpec Products | 985370 | |
| Iodoacetimide (IAA) | Sigma Aldrich | I1149 | |
| N-ethylmaleimide | Sigma Aldrich | 4259 | |
| NHS-Activated Sepharose 4 Fast Flow | Cytiva | 17-0906-01 | Reagent for in-house resin synthesis |
| QIAvac 24 Plus vacuum manifold | Qiagen | 19413 | |
| Sodium chloride | Sigma Aldrich | S3014 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | L6026 | |
| Sonicator | Branson | 1510R-MT | |
| Spin columns | Thermo Scientific | 69705 | |
| Strata C18-E reverse phase columns | Phenomenex | 8B-S001-DAK | Peptide desalting |
| Thermomixer | Eppendorf | 5355 | |
| Thiopropyl Sepharose 6B | GE Healthcare | 17-0420-01 | Thiol-affinity resin; *Production of Thiopropyl Sepharose 6B resin has been discontinued by the manufacturer (see protocol for details). |
| TMT isobaric labels (16 plex) | Thermo Scientific | A44522 | Peptide labeling reagent; available in multiple formats |
| Triethylammonium bicarbonate buffer (TEAB) | Sigma Aldrich | T7408 | |
| Trifluoroacetic acid (TFA) | Sigma Aldrich | T6508 | |
| Triton X-100 | Sigma Aldrich | T8787 | |
| Trypsin | Promega | V5820 | |
| Urea | Sigma Aldrich | U5378 | |
| Vacufuge Plus speedvac | Eppendorf | 22820001 | vacuum concentrator |
| Vortex mixer | Scientific Industries | SI-0236 |
Referenzen
- Sies, H., Jones, D. P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nature Reviews Molecular Cell Biology. 21 (7), 363-383 (2020).
- Adams, L., Franco, M. C., Estevez, A. G. Reactive nitrogen species in cellular signaling. Experimental Biology and Medicine. 240 (6), 711-717 (2015).
- Olson, K. R. The biological legacy of sulfur: A roadmap to the future. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 252, 110824 (2021).
- Sies, H. Oxidative eustress: on constant alert for redox homeostasis. Redox Biology. 41, 101867 (2021).
- Poole, L. B. The basics of thiols and cysteines in redox biology and chemistry. Free Radical Biology & Medicine. 80, 148-157 (2015).
- Guo, J., et al. Proteome-wide light/dark modulation of thiol oxidation in cyanobacteria revealed by quantitative site-specific redox proteomics. Molecular & Cellular Proteomics. 13 (12), 3270-3285 (2014).
- Shi, X., Qiu, H. Post-translational S-nitrosylation of proteins in regulating cardiac oxidative stress. Antioxidants. 9 (11), 1051 (2020).
- Fra, A., Yoboue, E. D., Sitia, R. Cysteines as redox molecular switches and targets of disease. Frontiers in Molecular Neuroscience. 10, 167 (2017).
- Klomsiri, C., Karplus, P. A., Poole, L. B. Cysteine-based redox switches in enzymes. Antioxidants & Redox Signaling. 14 (6), 1065-1077 (2011).
- Go, Y. M., Jones, D. P. The redox proteome. Journal of Biological Chemistry. 288 (37), 26512-26520 (2013).
- Bak, D. W., Bechtel, T. J., Falco, J. A., Weerapana, E. Cysteine reactivity across the subcellular universe. Current Opinion in Chemical Biology. 48, 96-105 (2019).
- Skryhan, K., et al. The role of cysteine residues in redox regulation and protein stability of Arabidopsis thaliana starch synthase 1. PLoS One. 10 (9), 0136997 (2015).
- Su, Z., et al. Global redox proteome and phosphoproteome analysis reveals redox switch in Akt. Nature Communications. 10 (1), 5486 (2019).
- Liebthal, M., Schuetze, J., Dreyer, A., Mock, H. -. P., Dietz, K. -. J. Redox conformation-specific protein-protein interactions of the 2-cysteine peroxiredoxin in Arabidopsis. Antioxidants. 9 (6), 515 (2020).
- Pace, N. J., Weerapana, E. Zinc-binding cysteines: diverse functions and structural motifs. Biomolecules. 4 (2), 419-434 (2014).
- Schwartz, P. A., et al. Covalent EGFR inhibitor analysis reveals importance of reversible interactions to potency and mechanisms of drug resistance. Proceedings of the National Academy of Sciences of the United States of America. 111 (1), 173 (2014).
- Sevilla, E., Bes, M. T., González, A., Peleato, M. L., Fillat, M. F. Redox-based transcriptional regulation in prokaryotes: revisiting model mechanisms. Antioxidants & Redox Signaling. 30 (13), 1651-1696 (2018).
- Topf, U., et al. Quantitative proteomics identifies redox switches for global translation modulation by mitochondrially produced reactive oxygen species. Nature Communications. 9 (1), 324 (2018).
- Gao, X. -. H., et al. Discovery of a redox thiol switch: implications for cellular energy metabolism. Molecular & Cellular Proteomics. 19 (5), 852-870 (2020).
- Prus, G., Hoegl, A., Weinert, B. T., Choudhary, C. Analysis and interpretation of protein post-translational modification site stoichiometry. Trends in Biochemical Sciences. 44 (11), 943-960 (2019).
- Zhang, T., Gaffrey, M. J., Li, X., Qian, W. J. Characterization of cellular oxidative stress response by stoichiometric redox proteomics. American Journal of Physiology. Cell Physiology. 320 (2), 182-194 (2021).
- Jaffrey, S. R., Erdjument-Bromage, H., Ferris, C. D., Tempst, P., Snyder, S. H. Protein S-nitrosylation: a physiological signal for neuronal nitric oxide. Nature Cell Biology. 3 (2), 193-197 (2001).
- Alcock, L. J., Perkins, M. V., Chalker, J. M. Chemical methods for mapping cysteine oxidation. Chemical Society Reviews. 47 (1), 231-268 (2018).
- Li, R., Kast, J. Biotin switch assays for quantitation of reversible cysteine oxidation. Methods in Enzymology. 585, 269-284 (2017).
- Guo, J., et al. Resin-assisted enrichment of thiols as a general strategy for proteomic profiling of cysteine-based reversible modifications. Nature Protocols. 9 (1), 64-75 (2014).
- Liu, T., et al. High-throughput comparative proteome analysis using a quantitative cysteinyl-peptide enrichment technology. Analytical Chemistry. 76 (18), 5345-5353 (2004).
- Duan, J., et al. Stochiometric quantification of the thiol redox proteome of macrophages reveals subcellular compartmentalization and susceptibility to oxidative perturbations. Redox Biology. 36, 101649 (2020).
- Mitchell, A. R., et al. Redox regulation of pyruvate kinase M2 by cysteine oxidation and S-nitrosation. Biochemical Journal. 475 (20), 3275-3291 (2018).
- Campbell, M. D., et al. Improving mitochondrial function with SS-31 reverses age-related redox stress and improves exercise tolerance in aged mice. Free Radical Biology & Medicine. 134, 268-281 (2019).
- Duan, J., et al. Quantitative profiling of protein S-glutathionylation reveals redox-dependent regulation of macrophage function during nanoparticle-induced oxidative stress. ACS Nano. 10 (1), 524-538 (2016).
- Wang, J., et al. Protein thiol oxidation in the rat lung following e-cigarette exposure. Redox Biology. 37, 101758 (2020).
- Kramer, P. A., et al. Fatiguing contractions increase protein S-glutathionylation occupancy in mouse skeletal muscle. Redox Biology. 17, 367-376 (2018).
- Chiao, Y. A., et al. Late-life restoration of mitochondrial function reverses cardiac dysfunction in old mice. Elife. 9, 55513 (2020).
- Forrester, M. T., et al. Site-specific analysis of protein S-acylation by resin-assisted capture. Journal of Lipid Research. 52 (2), 393-398 (2011).
- Su, D., et al. Quantitative site-specific reactivity profiling of S-nitrosylation in mouse skeletal muscle using cysteinyl peptide enrichment coupled with mass spectrometry. Free Radical Biology & Medicine. 57, 68-78 (2013).
- Su, D., et al. Proteomic identification and quantification of S-glutathionylation in mouse macrophages using resin-assisted enrichment and isobaric labeling. Free Radical Biology & Medicine. 67, 460-470 (2014).
- Searle, B. C., Yergey, A. L. An efficient solution for resolving iTRAQ and TMT channel cross-talk. Journal of Mass Spectrometry. 55 (8), 4354 (2020).
- Duan, J., Gaffrey, M. J., Qian, W. J. Quantitative proteomic characterization of redox-dependent post-translational modifications on protein cysteines. Molecular BioSystems. 13 (5), 816-829 (2017).
- Behring, J. B., et al. Spatial and temporal alterations in protein structure by EGF regulate cryptic cysteine oxidation. Science Signaling. 13 (615), 7315 (2020).
- Shakir, S., Vinh, J., Chiappetta, G. Quantitative analysis of the cysteine redoxome by iodoacetyl tandem mass tags. Analytical and Bioanalytical Chemistry. 409 (15), 3821-3830 (2017).
- Gorin, G., Martic, P. A., Doughty, G. Kinetics of the reaction of N-ethylmaleimide with cysteine and some congeners. Archives of Biochemistry and Biophysics. 115 (3), 593-597 (1966).
- Hsu, M. -. F., et al. Distinct effects of N-ethylmaleimide on formyl peptide- and cyclopiazonic acid-induced Ca2+ signals through thiol modification in neutrophils. Biochemical Pharmacology. 70 (9), 1320-1329 (2005).
- Li, R., Huang, J., Kast, J. Identification of total reversible cysteine oxidation in an atherosclerosis model using a modified biotin switch assay. Journal of Proteome Research. 14 (5), 2026-2035 (2015).
- Wang, J., et al. Integrated dissection of cysteine oxidative post-translational modification proteome during cardiac hypertrophy. Journal of Proteome Research. 17 (12), 4243-4257 (2018).
- Patra, K. K., Bhattacharya, A., Bhattacharya, S. Molecular dynamics investigation of a redox switch in the anti-HIV protein SAMHD1. Proteins. 87 (9), 748-759 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten