Method Article
Cattura assistita da resina accoppiata con etichettatura isobarica Tandem Mass Tag per la quantificazione multiplexata dell'ossidazione del tiolo proteico
In questo articolo
Riepilogo
L'ossidazione del tiolo proteico ha implicazioni significative in condizioni fisiologiche e fisiopatologiche normali. Descriviamo i dettagli di un metodo di proteomica redox quantitativa, che utilizza la cattura assistita da resina, la marcatura isobarica e la spettrometria di massa, consentendo l'identificazione sito-specifica e la quantificazione dei residui di cisteina ossidati in modo reversibile delle proteine.
Abstract
Modificazioni ossidative reversibili sui tioli proteici sono recentemente emerse come importanti mediatori della funzione cellulare. Qui descriviamo la procedura dettagliata di un metodo di proteomica redox quantitativa che utilizza la cattura assistita da resina (RAC) in combinazione con la marcatura isobarica tandem mass tag (TMT) e la cromatografia liquida-spettrometria di massa tandem (LC-MS / MS) per consentire la quantificazione stechiometrica multiplata dei tioli proteici ossidati a livello di proteoma. Le informazioni quantitative sito-specifiche sui residui di cisteina ossidati forniscono ulteriori informazioni sugli impatti funzionali di tali modifiche.
Il flusso di lavoro è adattabile a molti tipi di campioni, comprese le cellule in coltura (ad esempio, mammiferi, procarioti) e interi tessuti (ad esempio, cuore, polmone, muscolo), che sono inizialmente lisati / omogeneizzati e con tioli liberi alchilati per prevenire l'ossidazione artificiale. I tioli proteici ossidati vengono quindi ridotti e catturati da una resina di affinità tiolica, che ottimizza e semplifica le fasi del flusso di lavoro consentendo l'esecuzione delle procedure di digestione, etichettatura e lavaggio senza ulteriore trasferimento di proteine / peptidi. Infine, i peptidi marcati vengono eluiti e analizzati da LC-MS/MS per rivelare cambiamenti stechiometrici completi relativi all'ossidazione del tiolo attraverso l'intero proteoma. Questo metodo migliora notevolmente la comprensione del ruolo della regolazione redox-dipendente negli stati fisiologici e fisiopatologici correlati all'ossidazione del tiolo proteico.
Introduzione
In condizioni omeostatiche, le cellule generano specie reattive di ossigeno, azoto o zolfo che aiutano a facilitare i processi, come il metabolismo e la segnalazione 1,2,3, estendendosi sia ai procarioti che agli eucarioti. I livelli fisiologici di queste specie reattive sono necessari per il corretto funzionamento cellulare, noto anche come "eustress"1,4. Al contrario, un aumento degli ossidanti che porta a uno squilibrio tra ossidanti e antiossidanti può causare stress ossidativo, o "distress"1, che porta a danni cellulari. Gli ossidanti trasducono i segnali ai percorsi biologici modificando diverse biomolecole, tra cui proteine, DNA, RNA e lipidi. In particolare, i residui di cisteina delle proteine sono siti altamente reattivi inclini all'ossidazione a causa del gruppo tiolo sulla cisteina, che è reattivo verso diversi tipi di ossidanti5. Ciò dà origine a una vasta gamma di modificazioni post-traduzionali reversibili a base redox (PTM) per la cisteina, tra cui nitrosilazione (SNO), glutationilazione (SSG), solfenilazione (SOH), persolfurazione (SSH), polisolfurazione (SSnH), acilazione e disolfuri. Le forme irreversibili di ossidazione della cisteina includono la sulfinilazione (SO2H) e la sulfonilazione (SO3H).
Le modificazioni ossidative reversibili dei residui di cisteina possono svolgere ruoli protettivi che impediscono un'ulteriore ossidazione irreversibile o servire come molecole di segnalazione per le vie cellulari a valle 6,7. La reversibilità di alcuni PTM redox tiolici consente ai siti della cisteina di funzionare come "interruttori redox"8,9, in cui i cambiamenti nello stato redox di questi siti alterano la funzione proteica per regolare il loro ruolo nei processi transitori. Gli effetti modulatori dei PTM redox10 sono stati osservati in molti aspetti della funzione proteica 11, tra cui la catalisi 12, le interazioni proteina-proteina 13, il cambiamento di conformazione 14, la coordinazione degli ioni metallici 15 o il legame dell'inibitore farmacologico 16. Inoltre, i PTM redox sono coinvolti nei siti di cisteina delle proteine che regolano percorsi come la trascrizione 17, la traduzione18 o il metabolismo19. Dato l'impatto che i PTM redox hanno sulla funzione proteica e sui processi biologici, è importante quantificare l'entità dell'ossidazione che un sito di cisteina subisce in risposta a una perturbazione dello stato redox.
L'identificazione di siti di cisteina con stati redox alterati è focalizzata sul confronto dello stato di ossidazione a livello sito-specifico tra condizioni normali e perturbate. Le misurazioni del cambiamento di piega sono spesso utilizzate per determinare quali siti sono significativamente alterati in quanto ciò aiuta gli utenti a interpretare quali siti di cisteina possono essere fisiologicamente significativi per lo studio. In alternativa, le misurazioni stechiometriche dell'ossidazione tiolicica reversibile in un tipo specifico di campione forniscono un quadro generale dello stato fisiologico rispetto all'ossidazione cellulare, una misura importante che viene spesso trascurata e sottoutilizzata. La stechiometria di modifica si basa sulla quantificazione della percentuale di tiolo modificato in rapporto al tiolo proteico totale (modificato e non modificato)20,21. Di conseguenza, le misurazioni stechiometriche offrono una misurazione più precisa rispetto al cambio di piega, specialmente quando si utilizza la spettrometria di massa. Il significato dell'aumento dell'ossidazione può essere più facilmente accertato utilizzando la stechiometria per determinare l'occupazione PTM di un particolare sito di cisteina. Ad esempio, un aumento di 3 volte dell'ossidazione del tiolo potrebbe derivare da una transizione da un minimo dell'1% al 3% o dal 30% al 90%. Un aumento di 3 volte dell'ossidazione per un sito che è solo all'1% di occupazione può avere un impatto minimo sulla funzione di una proteina; Tuttavia, un aumento di 3 volte per un sito con un'occupazione del 30% allo stato di riposo può essere influenzato in modo più sostanziale. Le misure stechiometriche, quando eseguite tra tioli ossidati totali e specifiche modificazioni ossidative, tra cui la glutationilazione proteica (SSG) e la nitrosilazione (SNO), possono rivelare rapporti e informazioni quantitative rispetto a specifici tipi di modificazione.
Poiché l'ossidazione reversibile del tiolo è tipicamente una modifica post-traduzionale a bassa abbondanza, sono stati sviluppati diversi approcci per l'arricchimento di proteine contenenti queste modifiche da campioni biologici. Un primo approccio ideato da Jaffrey e altri, chiamato biotina switch technique (BST)22, prevede più passaggi in cui i tioli non modificati sono bloccati attraverso l'alchilazione, i tioli modificati in modo reversibile sono ridotti a tioli liberi nascenti, i tioli liberi nascenti sono etichettati con biotina e le proteine marcate sono arricchite dal pulldown dell'affinità streptavidina. Questa tecnica è stata utilizzata per profilare SNO e SSG in molti studi e può essere adattata per sondare altre forme di ossidazione reversibile del tiolo23,24. Mentre la BST è stata utilizzata per sondare diverse forme di ossidazione reversibile del tiolo, una preoccupazione con questo approccio è che l'arricchimento è influenzato dal legame non specifico delle proteine non biotinilate alla streptavidina. Un approccio alternativo sviluppato nel nostro laboratorio, denominato cattura assistita da resina (RAC)25,26 (Figura 1), aggira il problema dell'arricchimento dei gruppi tiolici attraverso il sistema biotina-streptavidina.
In seguito alla riduzione dei tioli ossidati in modo reversibile, le proteine con tioli liberi nascenti vengono arricchite dalla resina di affinità tiolica, che cattura covalentemente i gruppi tiolici liberi, consentendo un arricchimento più specifico delle proteine contenenti cisteina rispetto alla BST. L'accoppiamento di RAC con il potere multiplexante dei recenti progressi nella marcatura isobarica e nella spettrometria di massa crea un flusso di lavoro robusto e sensibile per l'arricchimento, l'identificazione e la quantificazione di residui di cisteina ossidati in modo reversibile a livello di proteoma. I recenti progressi nella spettrometria di massa hanno permesso una profilazione molto più profonda del proteoma redox del tiolo, aumentando la comprensione sia della causa che dell'effetto dell'ossidazione del tiolo proteico27. Le informazioni ottenute dai dati quantitativi sito-specifici consentono ulteriori studi sugli impatti meccanicistici e sugli effetti a valle delle modificazioni ossidative reversibili28. L'utilizzo di questo flusso di lavoro ha fornito informazioni sugli impatti fisiologici dell'ossidazione reversibile della cisteina rispetto ai normali eventi fisiologici come l'invecchiamento, in cui i livelli di SSG differivano rispetto all'età. Gli effetti dell'invecchiamento su SSG sono stati parzialmente invertiti utilizzando SS-31 (elamipretide), un nuovo peptide che migliora la funzione mitocondriale e riduce i livelli di SSG nei topi anziani, causando loro un profilo SSG più simile ai topi giovani29.
È stato dimostrato che le condizioni fisiopatologiche attribuite all'esposizione alle nanoparticelle coinvolgono SSG in un modello di macrofago murino. Utilizzando RAC accoppiato con spettrometria di massa, gli autori hanno dimostrato che i livelli di SSG erano direttamente correlati al grado di stress ossidativo e compromissione della funzione fagocitaria dei macrofagi. I dati hanno anche rivelato differenze specifiche del percorso in risposta a diversi nanomateriali ingegnerizzati che inducono diversi gradi di stress ossidativo30. Il metodo ha anche dimostrato la sua utilità nelle specie procariotiche, dove è stato applicato per studiare gli effetti dei cicli diurni nei cianobatteri fotosintetici rispetto all'ossidazione del tiolo. Sono stati osservati ampi cambiamenti nell'ossidazione del tiolo in diversi processi biologici chiave, tra cui il trasporto di elettroni, la fissazione del carbonio e la glicolisi. Inoltre, attraverso la validazione ortogonale, è stato confermato che diversi siti funzionali chiave sono stati modificati, suggerendo ruoli regolatori di queste modificazioni ossidative6.
Qui descriviamo i dettagli di un flusso di lavoro standardizzato (Figura 1), dimostrando l'utilità dell'approccio RAC per l'arricchimento di tioli totali ossidati di cisteina delle proteine e la loro successiva marcatura e quantificazione stechiometrica. Questo flusso di lavoro è stato implementato in studi sullo stato redox in diversi tipi di campioni, comprese le colture cellulari27,30 e tessuti interi (ad esempio, muscolo scheletrico, cuore, polmone)29,31,32,33. Sebbene non incluso qui, il protocollo RAC è anche facilmente adattabile per lo studio di forme specifiche di modificazioni redox reversibili, tra cui SSG, SNO e S-acilazione, come precedentemente menzionato25,29,34.
Protocollo
Tutte le procedure descritte nel protocollo relative a campioni/tessuti animali o umani sono state approvate e hanno seguito le linee guida istituzionali del comitato etico per la ricerca umana e animale.
1. Omogeneizzazione/lisi del campione
- Campioni di tessuto congelati
- Tritare il tessuto congelato (~ 30 mg) su un vetrino da microscopio su ghiaccio secco usando una lama di rasoio prerefrigerata e una pinza. Trasferire il tessuto tritato in un tubo di polistirene a fondo tondo da 5 mL prerefrigerato contenente 700 μL di tampone A (vedi Tabella 1) e incubare su ghiaccio per 30 minuti, al riparo dalla luce.
- Interrompere il tessuto per 30 secondi o fino a completa omogeneizzazione con un omogeneizzatore di tessuto portatile. Posizionare i campioni sul ghiaccio e lasciare che la schiuma si plachi per altri 10 minuti.
NOTA: Una teglia in alluminio posta su ghiaccio secco fornisce una superficie di lavoro stabile e una piattaforma per la lavorazione iniziale / tritatura del tessuto.
- In alternativa, utilizzare colture cellulari aderenti in piatti di coltura da 100 mm come materiale di partenza.
- Tenere le cellule sul ghiaccio e utilizzare una pipetta sierologica per sciacquare le cellule due volte con 10 ml di PBS ghiacciato contenente 100 mM NEM.
- Lisare le cellule aggiungendo 1 mL di tampone di omogeneizzazione/lisi a freddo e raschiando vigorosamente con un raschietto cellulare rigido. Trasferire il lisato in una provetta da centrifuga da 2 mL utilizzando una micropipetta.
NOTA: Il tampone di risciacquo e il tampone di lisi possono essere scalati di conseguenza a recipienti di coltura di dimensioni diverse. In genere, sono necessarie 2-5 milioni di cellule; Tuttavia, questo varia a seconda dell'efficienza della lisi e della resa proteica per specifici tipi di cellule. Il tampone di omogeneizzazione può essere preparato senza NEM per i campioni analizzati per i tioli totali.
- Trasferire l'omogenato risultante (fase 1.1.2 o 1.2.2) in una provetta da centrifuga da 2 mL utilizzando una micropipetta e centrifugare a piena velocità (≥16.000 × g) a 4 °C per 10 minuti.
- Trasferire il surnatante (~700 μL o ~1 mL per la coltura cellulare) utilizzando una micropipetta in una provetta conica da microcentrifuga da 5 mL e incubare per 30 minuti a 55 °C al buio agitando a 850 giri/min.
- Utilizzando una pipetta sierologica di vetro, aggiungere 4 ml di acetone ghiacciato ai campioni e incubare a -20 °C per una notte per la precipitazione delle proteine e la rimozione dell'eccesso di N-etilmaleimide.
2. Cattura assistita da resina
- Lavare due volte i pellet proteici precipitati con acetone centrifugando a 20.500 × g a 4 °C per 10 minuti, travasando l'acetone, rimuovendo l'acetone rimanente con una micropipetta e aggiungendo 3 ml di acetone fresco ghiacciato utilizzando una pipetta sierologica di vetro. Capovolgere più volte per mescolare. Dopo il secondo lavaggio, lasciare asciugare il pellet all'aria per 1-2 minuti, facendo attenzione a non asciugare eccessivamente poiché la risospensione potrebbe diventare difficile.
- Utilizzando una micropipetta, aggiungere 1 mL di tampone B (vedere Tabella 1) e solubilizzare la proteina usando una sonicazione ripetuta per 15-30 s alla volta usando un sonicatore da bagno con una potenza di 250 W e un breve vortice. Misurare la concentrazione proteica utilizzando il test dell'acido bicinconinico (BCA) secondo il protocollo del produttore.
- Per standardizzare le concentrazioni proteiche tra i campioni per un'ulteriore elaborazione e garantire la rimozione completa di NEM, trasferire 500 μg di proteine in un filtro centrifugo da 0,5 mL 10 kDa utilizzando una micropipetta e regolare a un volume finale di 500 μL con tampone di risospensione.
- Centrifugare a 14.000 × g a temperatura ambiente fino a quando il volume nel filtro centrifugo è inferiore a 100 μL. Raccogliere i campioni capovolgendo il filtro in una provetta di raccolta. Centrifugare a 1.000 × g per 2 minuti e regolare fino a un volume finale di 500 μL utilizzando il tampone C (vedere Tabella 1).
- Ridurre i tioli proteici aggiungendo 20 μL di ditiotreitolo (DTT) da 500 mM utilizzando una micropipetta a una concentrazione finale di 20 mM e incubando i campioni per 30 minuti a 37 °C agitando a 850 giri/min.
- Dopo la riduzione, trasferire i campioni utilizzando una micropipetta a 0,5 mL di filtri centrifughi da 10 kDa e centrifugare per 15 minuti a 14.000 × g a temperatura ambiente o fino a quando il volume nel filtro centrifugo è inferiore a 100 μL. Aggiungere il tampone D (vedere Tabella 1) per portare il volume nel filtro centrifugo a 500 μL.
- Ripetere la centrifugazione e l'aggiunta a 500 μL nel punto 2.6 tre volte e, dopo la quarta centrifugazione, raccogliere i campioni invertendo il filtro in una provetta di raccolta e centrifugando a 1.000 × g per 2 minuti.
- Misurare la concentrazione proteica utilizzando il test BCA secondo il protocollo del produttore.
- Durante questo scambio tampone, preparare la resina di affinità tiolica pesando la quantità appropriata di resina (30 mg/campione) utilizzando una microbilancia e trasferendola in una provetta da centrifuga da 50 ml. Quindi, utilizzando una pipetta sierologica, aggiungere acqua per una concentrazione finale di 30 mg/ml di resina e incubare a temperatura ambiente per 1 ora agitando per una corretta idratazione della resina.
NOTA: La resina di affinità tiolo sopra menzionata è stata interrotta dal produttore. Un possibile sostituto di questa resina di affinità tiolica è disponibile in commercio. Tuttavia, questa sostituzione ha una capacità di rilegatura quasi 5 volte inferiore (vedere Informazioni supplementari). In alternativa, la resina di affinità tiolica può essere sintetizzata utilizzando 2-(piridilditio) etilammina cloridrato e resina attivata con N-idrossisuccinimide (vedere Informazioni supplementari).- Dopo l'idratazione della resina, posizionare le colonne di rotazione su un collettore a vuoto e trasferire 500 μL del liquame di resina utilizzando una micropipetta su ciascuna colonna. Applicare il vuoto per la rimozione dell'acqua; Ripetere questo passaggio una volta per ottenere un totale di 30 mg di resina per colonna. In alternativa, centrifugare a 1.000 × g per 2 minuti invece di utilizzare il collettore sottovuoto per questo e tutte le fasi di lavaggio ed eluizione della resina.
NOTA: tagliare l'estremità di una punta di pipetta da 1000 μL per aumentare la dimensione del foro aiuta con il trasferimento della resina. È importante triturare tra un pipettaggio e l'altro per garantire che la resina rimanga sospesa e che quantità omogenee e uguali di resina vengano trasferite a ciascuna colonna. - Lavare la resina aggiungendo 500 μL di acqua ultrapura con una micropipetta e applicando il vuoto per la rimozione dell'acqua; Ripeti questa operazione 5 volte. Quindi, lavare la resina 5 volte con 500 μL di tampone E (vedere Tabella 1).
NOTA: In alternativa, è possibile utilizzare la centrifugazione a 1.000 x g per 2 minuti al posto di un collettore a vuoto per tutte le fasi di lavaggio successive. Tutte le fasi di lavaggio vengono eseguite con un volume di 500 μL. Quando si aggiungono tamponi di lavaggio alla colonna, aggiungere con attenzione con forza sufficiente a risospendere completamente la resina evitando schizzi e perdita di resina; Ciò consente un lavaggio completo ed efficiente della resina.
- Dopo l'idratazione della resina, posizionare le colonne di rotazione su un collettore a vuoto e trasferire 500 μL del liquame di resina utilizzando una micropipetta su ciascuna colonna. Applicare il vuoto per la rimozione dell'acqua; Ripetere questo passaggio una volta per ottenere un totale di 30 mg di resina per colonna. In alternativa, centrifugare a 1.000 × g per 2 minuti invece di utilizzare il collettore sottovuoto per questo e tutte le fasi di lavaggio ed eluizione della resina.
- Utilizzando una micropipetta, trasferire 150 μg di proteine da ciascun campione ridotto a una nuova provetta e regolare a un volume finale di 120 μL di tampone C (vedere Tabella 1). Trasferire la soluzione proteica utilizzando una micropipetta su una colonna di centrifuga ostruita contenente la resina, posizionare il tappo sulla colonna e incubare per 2 ore a temperatura ambiente agitando a 850 giri/min.
- Lavare la resina cinque volte con 25 mM HEPES, pH 7,0; 8 M urea; seguito da cinque volte con 2 M NaCl; seguito da cinque volte con l'80% di acetonitrile (ACN) con lo 0,1% di acido trifluoroacetico (TFA); e infine cinque volte con 25 mM HEPES, pH 7,7, come descritto al punto 2.8.2 e sostituire la spina.
NOTA: I campioni possono essere eluiti qui per l'analisi a livello proteico (ad esempio, elettroforesi su gel di poliacrilammide SDS (SDS-PAGE), western blot) come descritto al punto 4.1.
3. Digestione triptica su resina ed etichettatura TMT
- Preparare una quantità sufficiente di soluzione di tripsina modificata sequenziale per 6-8 μg per campione solubilizzandola ad una concentrazione di 0,5 μg/μL nel tampone C (vedere Tabella 1) in modo che il volume finale consenta almeno 120 μL per campione. Utilizzando una micropipetta, aggiungere 120 μL di questa soluzione di tripsina ai campioni e incubare per una notte a 37 °C agitando a 850 giri/min.
NOTA: Per aumentare l'efficienza della digestione, un ulteriore passaggio di digestione può essere incluso il giorno successivo rimuovendo la soluzione di tripsina e sostituendola con soluzione fresca e continuando la digestione per 2 ore. - Lavare la resina cinque volte con 25 mM HEPES, pH 7,0; seguito da cinque volte 2 M NaCl; seguito da cinque volte con l'80% ACN con lo 0,1% TFA; seguito da tre volte con 25 mM HEPES, pH 7,7. Infine, lavare la resina due volte con tampone bicarbonato trietilammonico da 50 mM (TEAB) e sostituire il tappo.
- Preparare i reagenti di etichettatura TMT prima lasciandoli riscaldare a temperatura ambiente prima di centrifugare brevemente utilizzando una centrifuga a 16.000 × g. Aggiungere 150 μL di ACN anidro a ciascun flaconcino di reagente di etichettatura TMT utilizzando una micropipetta. Incubare i flaconcini a temperatura ambiente su un termomiscelatore impostato a 850 rpm per 5 minuti per solubilizzare completamente il reattivo. Brevemente vortice e spin verso il basso a 16.000 × g per raccogliere il reagente.
- Utilizzando una micropipetta, aggiungere 40 μL di 100 mM TEAB alla resina lavata, quindi aggiungere 70 μL del reagente TMT disciolto e incubare per 1 ora a temperatura ambiente agitando a 850 giri/min. Conservare il reagente TMT rimanente a -80 °C.
NOTA: Prendere nota delle singole etichette TMT assegnate a ciascun campione biologico (Figura 1). - Lavare la resina cinque volte con ACN all'80% con TFA allo 0,1%, tre volte con tampone bicarbonato di ammonio (ABC) da 100 mM, pH 8,0 e due volte con acqua come descritto in precedenza e sostituire il tappo.
4. Eluizione peptidica
- Eluire i peptidi marcati aggiungendo 100 μL di 20 mM DTT in 100 mM ABC, pH 8,0, a ciascuna colonna utilizzando una micropipetta e incubare a temperatura ambiente per 30 minuti su un termomixer impostato a 850 rpm.
NOTA: Dopo l'aggiunta di DTT, la resina si aggregherà. La resina può essere interrotta con una punta di pipetta per rompere i grumi e garantire la completa eluizione dei peptidi. - Dopo questa incubazione, posizionare la colonna su un collettore sottovuoto destinato all'estrazione in fase solida (SPE), applicare il vuoto ed eluire i campioni in una provetta da microcentrifuga da 5 ml. Ripetere questo passaggio una volta.
- Infine, aggiungere 100 μL di ACN all'80% con TFA allo 0,1%, incubare per 10 minuti a temperatura ambiente ed eluire nella stessa provetta da centrifuga da 5 ml. Raccogliere tutte le frazioni nella stessa provetta da microcentrifuga da 5 ml.
NOTA: Per evitare la perdita del campione, è necessario utilizzare provette a basso legame per l'eluizione e i volumi devono essere mantenuti pari o inferiori a un volume di 4,0 ml per una singola provetta da 5 ml. - Porre i campioni eluiti in un concentratore di vuoto fino a quando non sono asciutti. Conservare i peptidi secchi a -80 °C e risospenderli in seguito.
NOTA: I campioni possono anche essere eluiti separatamente e un'aliquota può essere rimossa e analizzata da SDS-PAGE per l'analisi a livello peptidico prima di combinare i campioni.
5. Alchilazione peptidica e desalinizzazione/pulizia
- Risospendere i peptidi essiccati aggiungendo un piccolo volume di tampone ABC da 100 mM, pH 8,0 (non superiore a 500 μL), utilizzando una micropipetta. Utilizzare la sonicazione ripetuta per 15-30 s alla volta utilizzando un sonicatore da bagno con un'uscita di 250 W e vortice per solubilizzare e trasferire in un tubo da 2 ml.
NOTA: Il volume di 100 mM ABC, pH 8,0 da aggiungere si basa sul volume necessario per risospendere il DTT a una molarità di 150 mM. Gli utenti dovranno determinare la quantità di DTT presente nel loro campione in base a quanto originariamente aggiunto nel passaggio 4.1. - Aggiungere una quantità sufficiente di soluzione madre concentrata (600 mM) di iodoacetammide (IAA) disciolta in ABC utilizzando una micropipetta per ottenere un rapporto molare 1:4 di DTT:IAA e incubare i campioni a RT per 1 ora agitando a 850 giri/min.
- Acidificare i campioni a pH < 3 aggiungendo TFA concentrato (10%) utilizzando una micropipetta ed eseguire la desalinizzazione del campione utilizzando la pulizia in fase inversa secondo le istruzioni del produttore.
- Mettere i peptidi puliti in un concentratore sottovuoto fino a quando non sono asciutti. Conservare i peptidi secchi a -80 °C fino a ulteriori analisi.
6. Cromatografia liquida-spettrometria di massa tandem
- Risospendere i peptidi essiccati mediante sonicazione ripetuta per 15-30 s alla volta utilizzando un sonicatore da bagno con una potenza di 250 W e vortice in 20-40 μL di acqua contenente il 3% di ACN. Determinare la concentrazione del peptide eseguendo un test BCA secondo il protocollo del produttore.
- Separare i campioni per fase inversa LC e MS/MS come precedentemente descritto6 e registrare gli spettri MS1 nell'intervallo m/z di 400-2000. Assicurarsi che la dissociazione collisionale ad alta energia (HCD) venga utilizzata per ottenere informazioni sull'intensità degli ioni reporter per l'analisi di peptidi marcati isobaricamente. Si vedano le sezioni dei metodi dei rapporti precedenti per maggiori dettagli sulle condizioni di funzionamento dello strumento 27,30 e l'analisi dei dati MS27,31.
NOTA: Diversi sistemi o impostazioni LC-MS/MS possono essere utilizzati per analizzare i campioni di peptidi. La copertura e la sensibilità dell'identificazione dei peptidi dipenderanno dal particolare sistema e dalle impostazioni utilizzate.
Risultati
Il completamento del protocollo comporterà un arricchimento altamente specifico di peptidi precedentemente ossidati contenenti cisteina, spesso con specificità del >95% 27,35,36. Tuttavia, diverse fasi chiave del protocollo richiedono un'attenzione speciale, ad esempio il blocco iniziale dei tioli liberi prima della lisi/omogeneizzazione del campione, che vieta l'ossidazione artificiale e l'arricchimento non specifico dei tioli ossidati artificialmente25. I campioni possono essere analizzati in diverse fasi del protocollo e con metodi diversi, tra cui l'analisi SDS-PAGE di proteine e peptidi. SDS-PAGE consente l'analisi qualitativa dei campioni in cui i campioni di tiolo totale consentono confronti proporzionali-metrici tra i campioni per determinare diversi livelli di ossidazione dovuti a trattamenti / stimoli (Figura 2A). Per studiare ulteriormente i livelli di ossidazione delle singole proteine, i gel SDS-PAGE possono essere sottoposti a western blotting36 (Figura 2B). Ciò consente di analizzare il sistema modello in modo più dettagliato, generando dati di supporto e ulteriori ipotesi su reti e percorsi biologici. Questi metodi/dati di supporto possono anche essere utilizzati come controllo di qualità per confermare le risposte attese prima di ulteriori analisi approfondite come LC-MS/MS. Le intensità ioniche reporter dei peptidi contenenti cisteina analizzati da LC-MS/MS possono essere utilizzate per quantificare la stechiometria di ossidazione del tiolo a livello dei singoli siti Cys (Figura 2C,D).
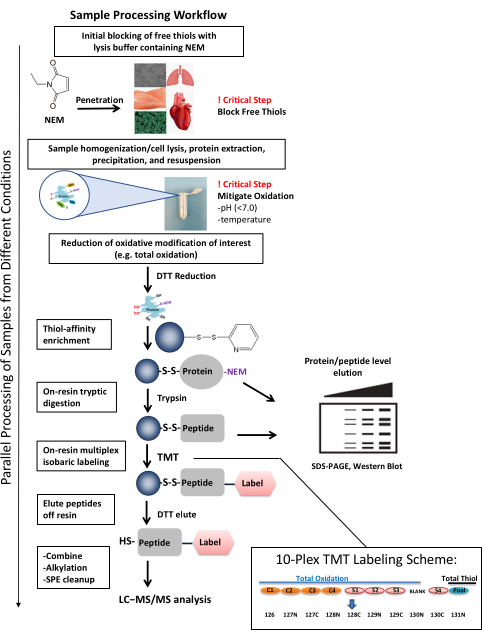
Figura 1: flusso di lavoro di elaborazione del campione. Il flusso di lavoro di elaborazione dei campioni è adattabile per studiare l'ossidazione del tiolo in vari tipi di campioni e sistemi biologici. Il flusso di lavoro consente di studiare l'ossidazione sia a livello proteico che peptidico (ad esempio, SDS-PAGE, western blot) e una copertura approfondita per l'identificazione quantitativa e sito-specifica di singoli siti di cisteina utilizzando HPLC accoppiato con spettrometria di massa. L'elaborazione dei campioni può essere completata in soli tre giorni, compreso il completamento di diversi passaggi critici per la generazione di dati coerenti e di qualità. Il multiplexing dei campioni tramite l'etichettatura TMT consente l'elaborazione di più campioni in parallelo contemporaneamente. Lo schema rappresentativo di etichettatura TMT 10-plex illustra come i campioni possono essere disposti considerando la potenziale diafonia dal canale del tiolo totale. Con le impurità isotopiche dei reagenti TMT, l'intensità del segnale di un canale ad alta intensità (come il tiolo totale) può contribuire a un altro canale con bassa intensità del segnale e influenzarne la quantificazione37. Nello schema, un canale total-tiolo aggregato (una combinazione di campioni di controllo e sperimentali) dovrebbe contenere alti livelli di Cys-peptidi ed è etichettato con 131N, che avrà un segnale nel canale 130N. Pertanto, il canale 130N non viene utilizzato nell'esperimento. La quantità di diafonia del canale creata dalle etichette TMT può essere trovata nei certificati di analisi del produttore per un lotto corrispondente del reagente. Questa figura è stata adattata da Guo et al., Nature Protocols, 201425. Abbreviazioni: NEM = N-etilmaleimide; DTT = ditiotreitolo; SDS-PAGE = elettroforesi su gel di sodio dodecilsolfato poliacrilammide; SPE = estrazione in fase solida; LC-MS/MS = cromatografia liquida-spettrometria di massa tandem; TMT = tag di massa tandem. Fare clic qui per visualizzare una versione ingrandita di questa figura.
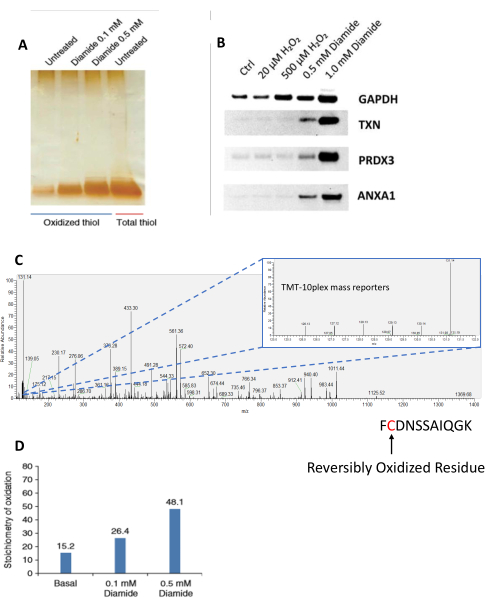
Figura 2: Analisi dei peptidi derivanti dall'arricchimento del RAC . (A) Analisi SDS-PAGE di peptidi ossidati da cellule RAW 264.7 trattate con l'ossidante chimico, diammide, per 30 minuti a concentrazioni crescenti (0,1 e 0,5 mM) e peptidi tioli totali. Questa sottofigura e sottofigura D sono adattate da Guo et al., Nature Protocols, 2014 25. I peptidi sono stati visualizzati dalla colorazione dell'argento. (B) Le cellule RAW 264.7 sono state trattate con ossidanti esogeni (perossido di idrogeno e diammide) a concentrazioni crescenti. L'eluato proteico arricchito con SSG risultante è stato separato da SDS-PAGE e successivamente sondato da western blot per singole proteine (GAPDH, TXN, PRDX3 e ANXA1). Questa sottofigura è adattata da Su et al., Free Radical Biology and Medicine, 201436. (C) Dati rappresentativi dello spettro MS/MS di un peptide contenente cisteina visto nel software Xcalibur. L'immagine MS/MS inserita mostra le intensità di ioni reporter corrispondenti per lo stesso peptide in ciascun canale TMT. In questo esperimento, il campione di tiolo totale è stato assegnato all'etichetta TMT 131N, che ha la più alta intensità di tutti i canali utilizzati nell'esperimento. (D) Stechiometria di peptidi ossidati marcati con iTRAQ, arricchiti e misurati mediante LC-MS/MS. Il canale del tiolo totale è stato utilizzato come riferimento per calcolare la stechiometria di ossidazione in base al rapporto tra l'intensità ionica reporter di ciascun campione rispetto a quella del canale del tiolo totale. Abbreviazioni: RAC = acquisizione assistita da resina; SDS-PAGE = elettroforesi su gel di sodio dodecilsolfato poliacrilammide; Ctrl = controllo; GAPDH = gliceraldeide-3-fosfato deidrogenasi; TXN = tioredossina; PRDX3 = perossido reduttasi tioredossina-dipendente; ANXA1 = annessina A1; LC-MS/MS = cromatografia liquida-spettrometria di massa tandem; MS/MS = spettrometria di massa tandem; TMT = tag di massa tandem; iTRAQ = tag isobarico per la quantificazione relativa e assoluta. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Nome buffer | Scopo | Contenuto |
| Buffer A | Lisi/omogeneizzazione | 250 mM di acido 2-(N-morfolino)etanosolfonico (MES), pH 6,0; 1% dodecilsolfato di sodio (SDS); 1% Triton X-100; e 100 mM N-etilmaleimmide (NEM) |
| Buffer B | Risospensione dopo precipitazione proteica e primo scambio tampone | 250 mM di acido 4-(2-idrossietil)-1-piperazineetanosolfonico (HEPES), pH 7,0; 8 M urea; 0,1% SDS |
| Buffer C | Riduzione/ Arricchimento/ Digestione delle proteine contenenti cisteina | 25 mM HEPES, pH 7,7; 1 M urea; 0,1% SDS |
| Buffer D | Secondo scambio di buffer dopo la riduzione | 25 mM HEPES, pH 7,0, 8 M urea; 0,1% SDS |
| Buffer E | Lavare la resina dopo l'idratazione | 25 mM HEPES, pH 7,7 |
Tabella 1. Elenco dei buffer
Informazioni supplementari. Clicca qui per scaricare questo file.
Discussione
La cattura assistita da resina è stata utilizzata in una varietà di tipi di campioni e sistemi biologici per lo studio delle modificazioni ossidative dei residui di cisteina25,29,30. Questo metodo consente la valutazione di campioni a più livelli e letture, comprese proteine e peptidi utilizzando SDS-PAGE e analisi western blot, nonché singoli siti di cisteina utilizzando la spettrometria di massa. Indipendentemente dal tipo di campione o dall'endpoint finale, il metodo consente in definitiva un arricchimento altamente efficiente e specifico di proteine e peptidi contenenti cisteina38. Utilizzando RAC, abbiamo identificato cambiamenti nello stato di ossidazione di fino a diverse migliaia di siti di cisteina in diversi sistemi modello a seguito di una perturbazione.
Nei topi sottoposti a contrazioni muscolari affaticanti, sono stati identificati 2.200 siti di S-glutationilazione, con più della metà che ha alterato significativamente i livelli di S-glutationilazione32. RAC è stato utilizzato anche per profilare l'ossidazione reversibile del tiolo di >2.100 siti nei cianobatteri dopo l'esposizione a un inibitore della fotosintesi o diverse condizioni di luce6. Recentemente, abbiamo profilato l'ossidazione totale reversibile del tiolo e la S-glutationilazione di >4.000 siti di cisteina in cellule macrofagiche RAW 264.7 in condizioni di riposo27. Allo stesso modo, Behring et al. hanno quantificato l'ossidazione di ~ 4.200 siti di cisteina nelle cellule A431 dopo stimolazione del fattore di crescita epidermico39. Questi studi dimostrano la robustezza del RAC per identificare molti siti di cisteina (almeno diverse migliaia) che subiscono ossidazione reversibile del tiolo. Inoltre, il frazionamento dei campioni può migliorare la copertura dei peptidi recuperati da un esperimento.
Al di fuori dei controlli sperimentali, in cui campioni di controllo positivi o negativi possono essere impiegati per confermare le risposte biologiche del sistema modello, l'arricchimento totale del tiolo può essere eseguito in parallelo con l'ossidazione dei tioli. Questo campione di tiolo totale fornisce sia confronti stechiometrici che una linea di base da cui confrontare campioni sperimentali o trattati. In breve, questo campione di tiolo totale fornisce una misura del numero totale di tioli di cisteina per un dato sito Cys in un dato campione. Questo concetto è stato adottato anche dal metodo OxiTMT, che genera campioni che contengono tioli totalmente ridotti che rappresentano il "contenuto totale di cisteina" per il confronto con le cisteine ossidate40.
A differenza di OxiTMT, RAC non è vincolato dal numero plex di iodoTMT e quindi può incorporare più canali tiolici totali per rappresentare meglio il contenuto di tiolo di più tipi di campioni utilizzati in uno studio. Inoltre, potrebbe essere necessario preparare un campione globale (non soggetto ad arricchimento) in parallelo con il flusso di lavoro della proteomica redox tiolica per verificare se le abbondanze proteiche sono alterate in diversi tipi di campione. Poiché il metodo è adattabile a più tipi di modifiche redox, devono essere considerati controlli appropriati per la modifica specifica di interesse. Ad esempio, la luce ultravioletta e il cloruro di mercurio sono entrambi efficaci nel scindere l'SNO dalle proteine, creando un efficace controllo negativo per la misurazione di SNO 7,25. Un controllo efficace per lo studio delle proteine modificate da SSG è l'omissione dell'enzima glutaredossina dal cocktail di riduzione durante la fase di riduzione. A causa della specificità relativamente elevata della glutaredossina, la sua omissione elimina la riduzione delle proteine modificate con SSG e impedisce loro di subire uno scambio di disolfuro e, infine, di arricchirsi in ultima analisi36.
Ci sono diversi passaggi all'interno del flusso di lavoro per RAC che sono fondamentali per la generazione di dati di qualità e riproducibili. Uno dei primi passi cruciali, e il più importante, è l'alchilazione/blocco dei tioli liberi utilizzando l'agente alchilante permeabile alla membrana, N-etilmaleimmide (NEM), che reagisce rapidamente in un ampio intervallo di pH 41,42. Questa fase impedisce ai tioli nascenti di essere ossidati durante la lavorazione del campione e mitiga l'arricchimento non specifico di questi tioli ossidati artificialmente durante l'arricchimento dello scambio disolfuro. Un'alchilazione inadeguata comporterà un aumento del background e un segnale falso positivo, come è stato identificato in un precedente rapporto6.
Tuttavia, a causa della sua elevata reattività e capacità di bloccare i tioli liberi, è necessario prestare attenzione anche per garantire la sua completa rimozione dai campioni prima dell'arricchimento, dove qualsiasi NEM rimanente può legarsi e interferire con l'accoppiamento della resina, con conseguente perdita di segnale a causa di una diminuzione del legame proteico. Ciò si ottiene eseguendo la precipitazione dell'acetone e diversi cicli di scambio tampone utilizzando filtri di cut-off del peso molecolare. Anche il monitoraggio e il mantenimento di un pH adeguato durante tutto il protocollo sono fondamentali. Viene mantenuto un pH di 6,0 per mitigare il rimescolamento dei disolfuri e la formazione di disolfuri misti prima dell'arricchimento. Altre fasi in cui è necessario prestare particolare attenzione includono le fasi di arricchimento ed eluizione, in cui sono necessari valori di pH di 7,7 e 8,0 per un corretto arricchimento ed eluizione, rispettivamente. Valori di pH errati durante queste fasi comporteranno una diminuzione o una perdita di segnale.
Ad oggi, ci sono molti metodi basati sulla chimica oltre al RAC che sono ampiamente utilizzati per studiare l'ossidazione del tiolo della cisteina, incluso il metodo più utilizzato, la tecnica di commutazione della biotina43,44. Una cosa che tutti questi metodi hanno in comune, incluso il RAC, è che si basano su metodi indiretti per la rilevazione di cisteine ossidate. Si basano su intermedi chimicamente modificati del tiolo ossidato originale per il rilevamento. Tuttavia, un attributo chiave che distingue RAC da altri metodi è la capacità di raccogliere multiplexati, dati quantitativi su specifici siti di cisteina di tioli ossidati.
Il metodo viene eseguito con proteine/peptidi legati covalentemente alla resina, che consente di eseguire fasi di avanzamento (ad esempio, riduzione, etichettatura, lavaggio, digestione) senza ulteriore manipolazione. Eseguendo LC-MS/MS su campioni multiplexati, vengono generati set di dati che consentono scoperte a livello di proteoma. Gli effetti di un trattamento o di stimoli specifici su più gruppi di campioni sono osservati a livello globale, il che consente la scoperta di nuovi meccanismi e percorsi. Il flusso di lavoro fondamentale è altamente adattabile alle esigenze specifiche degli utenti finali e alle aree di interesse. La convalida ortogonale dei risultati osservati nei dati di spettrometria di massa rimane una sfida. La mutagenesi sito-diretta di un sito specifico e l'utilizzo di saggi che studiano gli effetti conseguenti è un approccio comune ma laborioso.
Per esaminare i siti candidati che possono essere biologicamente significativi, gli studi bioinformatici possono essere utilizzati per saperne di più sulle caratteristiche di un sito con un alto livello di ossidazione, come la vicinanza di un sito a un sito attivo o a una struttura secondaria27. Le simulazioni di dinamica molecolare possono rivelarsi di grande valore in studi futuri in quanto possono modellare gli effetti delle modifiche redox sulla struttura delle proteine e fornire informazioni su come la funzione di una proteina può essere influenzata13,45. Implementando questa solida strategia, speriamo che la comunità scientifica trarrà beneficio dall'adattamento di questo metodo al proprio sistema modello unico e dall'espansione delle attuali conoscenze della biologia redox in molti modelli e sistemi biologici diversi.
Divulgazioni
Gli autori non dichiarano conflitti di interesse, finanziari o di altro tipo.
Riconoscimenti
Parti del lavoro sono state supportate da NIH Grants R01 DK122160, R01 HL139335 e U24 DK112349
Materiali
| Name | Company | Catalog Number | Comments |
| 2-(Pyridyldithio)ethylamine hydrochloride | Med Chem Express | HY-101794 | Reagent for in-house resin synthesis |
| 2.0 mL LoBind centrifuge tubes | Eppendorf | 22431048 | |
| 5.0 mL LoBind centrifuge tubes | Eppendorf | 30108310 | |
| 5.0 mL round bottom tubes | Falcon | 352054 | |
| Acetone | Fisher Scientific | A949-1 | |
| Acetonitrile | Sigma Aldrich | 34998 | |
| Activated Thiol–Sepharose 4B | Sigma Aldrich | T8512 | Potential replacement for thiol-affinity resin |
| Amicon Ultra 0.5 mL centrifugal filter | Millipore Sigma | UFC5010BK | |
| Ammonium bicarbonate | Sigma Aldrich | 09830 | |
| Bicinchonicic acid (BCA) | Thermo Scientific | 23227 | Protein Assay Reagent |
| Centrifuge | Eppendorf | 5810R | |
| Centrifuge | Eppendorf | 5415R | |
| Dithiothreitol (DTT) | Thermo Scientific | 20291 | |
| EDTA | Sigma Aldrich | E5134 | |
| HEPES buffer | Sigma Aldrich | H4034 | |
| Homogenizer | BioSpec Products | 985370 | |
| Iodoacetimide (IAA) | Sigma Aldrich | I1149 | |
| N-ethylmaleimide | Sigma Aldrich | 4259 | |
| NHS-Activated Sepharose 4 Fast Flow | Cytiva | 17-0906-01 | Reagent for in-house resin synthesis |
| QIAvac 24 Plus vacuum manifold | Qiagen | 19413 | |
| Sodium chloride | Sigma Aldrich | S3014 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | L6026 | |
| Sonicator | Branson | 1510R-MT | |
| Spin columns | Thermo Scientific | 69705 | |
| Strata C18-E reverse phase columns | Phenomenex | 8B-S001-DAK | Peptide desalting |
| Thermomixer | Eppendorf | 5355 | |
| Thiopropyl Sepharose 6B | GE Healthcare | 17-0420-01 | Thiol-affinity resin; *Production of Thiopropyl Sepharose 6B resin has been discontinued by the manufacturer (see protocol for details). |
| TMT isobaric labels (16 plex) | Thermo Scientific | A44522 | Peptide labeling reagent; available in multiple formats |
| Triethylammonium bicarbonate buffer (TEAB) | Sigma Aldrich | T7408 | |
| Trifluoroacetic acid (TFA) | Sigma Aldrich | T6508 | |
| Triton X-100 | Sigma Aldrich | T8787 | |
| Trypsin | Promega | V5820 | |
| Urea | Sigma Aldrich | U5378 | |
| Vacufuge Plus speedvac | Eppendorf | 22820001 | vacuum concentrator |
| Vortex mixer | Scientific Industries | SI-0236 |
Riferimenti
- Sies, H., Jones, D. P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nature Reviews Molecular Cell Biology. 21 (7), 363-383 (2020).
- Adams, L., Franco, M. C., Estevez, A. G. Reactive nitrogen species in cellular signaling. Experimental Biology and Medicine. 240 (6), 711-717 (2015).
- Olson, K. R. The biological legacy of sulfur: A roadmap to the future. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 252, 110824 (2021).
- Sies, H. Oxidative eustress: on constant alert for redox homeostasis. Redox Biology. 41, 101867 (2021).
- Poole, L. B. The basics of thiols and cysteines in redox biology and chemistry. Free Radical Biology & Medicine. 80, 148-157 (2015).
- Guo, J., et al. Proteome-wide light/dark modulation of thiol oxidation in cyanobacteria revealed by quantitative site-specific redox proteomics. Molecular & Cellular Proteomics. 13 (12), 3270-3285 (2014).
- Shi, X., Qiu, H. Post-translational S-nitrosylation of proteins in regulating cardiac oxidative stress. Antioxidants. 9 (11), 1051 (2020).
- Fra, A., Yoboue, E. D., Sitia, R. Cysteines as redox molecular switches and targets of disease. Frontiers in Molecular Neuroscience. 10, 167 (2017).
- Klomsiri, C., Karplus, P. A., Poole, L. B. Cysteine-based redox switches in enzymes. Antioxidants & Redox Signaling. 14 (6), 1065-1077 (2011).
- Go, Y. M., Jones, D. P. The redox proteome. Journal of Biological Chemistry. 288 (37), 26512-26520 (2013).
- Bak, D. W., Bechtel, T. J., Falco, J. A., Weerapana, E. Cysteine reactivity across the subcellular universe. Current Opinion in Chemical Biology. 48, 96-105 (2019).
- Skryhan, K., et al. The role of cysteine residues in redox regulation and protein stability of Arabidopsis thaliana starch synthase 1. PLoS One. 10 (9), 0136997 (2015).
- Su, Z., et al. Global redox proteome and phosphoproteome analysis reveals redox switch in Akt. Nature Communications. 10 (1), 5486 (2019).
- Liebthal, M., Schuetze, J., Dreyer, A., Mock, H. -. P., Dietz, K. -. J. Redox conformation-specific protein-protein interactions of the 2-cysteine peroxiredoxin in Arabidopsis. Antioxidants. 9 (6), 515 (2020).
- Pace, N. J., Weerapana, E. Zinc-binding cysteines: diverse functions and structural motifs. Biomolecules. 4 (2), 419-434 (2014).
- Schwartz, P. A., et al. Covalent EGFR inhibitor analysis reveals importance of reversible interactions to potency and mechanisms of drug resistance. Proceedings of the National Academy of Sciences of the United States of America. 111 (1), 173 (2014).
- Sevilla, E., Bes, M. T., González, A., Peleato, M. L., Fillat, M. F. Redox-based transcriptional regulation in prokaryotes: revisiting model mechanisms. Antioxidants & Redox Signaling. 30 (13), 1651-1696 (2018).
- Topf, U., et al. Quantitative proteomics identifies redox switches for global translation modulation by mitochondrially produced reactive oxygen species. Nature Communications. 9 (1), 324 (2018).
- Gao, X. -. H., et al. Discovery of a redox thiol switch: implications for cellular energy metabolism. Molecular & Cellular Proteomics. 19 (5), 852-870 (2020).
- Prus, G., Hoegl, A., Weinert, B. T., Choudhary, C. Analysis and interpretation of protein post-translational modification site stoichiometry. Trends in Biochemical Sciences. 44 (11), 943-960 (2019).
- Zhang, T., Gaffrey, M. J., Li, X., Qian, W. J. Characterization of cellular oxidative stress response by stoichiometric redox proteomics. American Journal of Physiology. Cell Physiology. 320 (2), 182-194 (2021).
- Jaffrey, S. R., Erdjument-Bromage, H., Ferris, C. D., Tempst, P., Snyder, S. H. Protein S-nitrosylation: a physiological signal for neuronal nitric oxide. Nature Cell Biology. 3 (2), 193-197 (2001).
- Alcock, L. J., Perkins, M. V., Chalker, J. M. Chemical methods for mapping cysteine oxidation. Chemical Society Reviews. 47 (1), 231-268 (2018).
- Li, R., Kast, J. Biotin switch assays for quantitation of reversible cysteine oxidation. Methods in Enzymology. 585, 269-284 (2017).
- Guo, J., et al. Resin-assisted enrichment of thiols as a general strategy for proteomic profiling of cysteine-based reversible modifications. Nature Protocols. 9 (1), 64-75 (2014).
- Liu, T., et al. High-throughput comparative proteome analysis using a quantitative cysteinyl-peptide enrichment technology. Analytical Chemistry. 76 (18), 5345-5353 (2004).
- Duan, J., et al. Stochiometric quantification of the thiol redox proteome of macrophages reveals subcellular compartmentalization and susceptibility to oxidative perturbations. Redox Biology. 36, 101649 (2020).
- Mitchell, A. R., et al. Redox regulation of pyruvate kinase M2 by cysteine oxidation and S-nitrosation. Biochemical Journal. 475 (20), 3275-3291 (2018).
- Campbell, M. D., et al. Improving mitochondrial function with SS-31 reverses age-related redox stress and improves exercise tolerance in aged mice. Free Radical Biology & Medicine. 134, 268-281 (2019).
- Duan, J., et al. Quantitative profiling of protein S-glutathionylation reveals redox-dependent regulation of macrophage function during nanoparticle-induced oxidative stress. ACS Nano. 10 (1), 524-538 (2016).
- Wang, J., et al. Protein thiol oxidation in the rat lung following e-cigarette exposure. Redox Biology. 37, 101758 (2020).
- Kramer, P. A., et al. Fatiguing contractions increase protein S-glutathionylation occupancy in mouse skeletal muscle. Redox Biology. 17, 367-376 (2018).
- Chiao, Y. A., et al. Late-life restoration of mitochondrial function reverses cardiac dysfunction in old mice. Elife. 9, 55513 (2020).
- Forrester, M. T., et al. Site-specific analysis of protein S-acylation by resin-assisted capture. Journal of Lipid Research. 52 (2), 393-398 (2011).
- Su, D., et al. Quantitative site-specific reactivity profiling of S-nitrosylation in mouse skeletal muscle using cysteinyl peptide enrichment coupled with mass spectrometry. Free Radical Biology & Medicine. 57, 68-78 (2013).
- Su, D., et al. Proteomic identification and quantification of S-glutathionylation in mouse macrophages using resin-assisted enrichment and isobaric labeling. Free Radical Biology & Medicine. 67, 460-470 (2014).
- Searle, B. C., Yergey, A. L. An efficient solution for resolving iTRAQ and TMT channel cross-talk. Journal of Mass Spectrometry. 55 (8), 4354 (2020).
- Duan, J., Gaffrey, M. J., Qian, W. J. Quantitative proteomic characterization of redox-dependent post-translational modifications on protein cysteines. Molecular BioSystems. 13 (5), 816-829 (2017).
- Behring, J. B., et al. Spatial and temporal alterations in protein structure by EGF regulate cryptic cysteine oxidation. Science Signaling. 13 (615), 7315 (2020).
- Shakir, S., Vinh, J., Chiappetta, G. Quantitative analysis of the cysteine redoxome by iodoacetyl tandem mass tags. Analytical and Bioanalytical Chemistry. 409 (15), 3821-3830 (2017).
- Gorin, G., Martic, P. A., Doughty, G. Kinetics of the reaction of N-ethylmaleimide with cysteine and some congeners. Archives of Biochemistry and Biophysics. 115 (3), 593-597 (1966).
- Hsu, M. -. F., et al. Distinct effects of N-ethylmaleimide on formyl peptide- and cyclopiazonic acid-induced Ca2+ signals through thiol modification in neutrophils. Biochemical Pharmacology. 70 (9), 1320-1329 (2005).
- Li, R., Huang, J., Kast, J. Identification of total reversible cysteine oxidation in an atherosclerosis model using a modified biotin switch assay. Journal of Proteome Research. 14 (5), 2026-2035 (2015).
- Wang, J., et al. Integrated dissection of cysteine oxidative post-translational modification proteome during cardiac hypertrophy. Journal of Proteome Research. 17 (12), 4243-4257 (2018).
- Patra, K. K., Bhattacharya, A., Bhattacharya, S. Molecular dynamics investigation of a redox switch in the anti-HIV protein SAMHD1. Proteins. 87 (9), 748-759 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon