Method Article
Hasat ve Ayrıştırma: Biyofilm Yöntemleri Araştırmalarında Gözden Kaçan Bir Adım
Bu Makalede
Özet
Bu yazıda, iki yüzey tipinde üç yaygın biyofilm toplama ve ayrıştırma tekniğini gösteren yöntemler, bir hasat yönteminin sağlamlık testi ve tekrarlanabilirliği artırmak için hasat ve ayrıştırma tekniklerini seçerken ve optimize ederken göz önünde bulundurulması gereken minimum bilgiler açıklanmaktadır.
Özet
Biyofilm yöntemleri dört ayrı adımdan oluşur: biyofilmi ilgili bir modelde büyütmek, olgun biyofilmi işlemek, biyofilmi yüzeyden toplamak ve kümeleri ayırmak ve numuneyi analiz etmek. Dört adımdan, hasat ve ayrıştırma en az çalışılan, ancak test yanlılığı potansiyeli göz önüne alındığında yine de kritik olanıdır. Bu makalede, üç farklı yüzeyde yetiştirilen biyofilm için yaygın olarak kullanılan hasat ve ayrıştırma teknikleri gösterilmektedir. Kapsamlı bir literatür taramasından toplanan üç biyofilm toplama ve ayrıştırma tekniği, vorteks ve sonikasyon, kazıma ve homojenizasyon ve kazıma, vorteks ve sonikasyonu içerir. İki yüzey tipi göz önünde bulundurulur: sert gözeneksiz (polikarbonat ve borosilikat cam) ve gözenekli (silikon). Ek olarak, izlenen hasat tekniğini bildirirken dahil edilmesi gereken minimum bilgiler ve önyargıyı kontrol etmek için eşlik eden bir yöntem için önerilerde bulunuyoruz.
Giriş
Biyofilmin tanımı son birkaç on yılda gelişmiştir ve çeşitli biyolojik ve / veya biyolojik olmayan yüzeylerle mikrobiyal ilişkiyi, bir matris içinde farklı büyüme ve genetik ekspresyon2 gösteren hücresel olmayan bileşenlerin1 dahil edilmesini kapsar. Biyofilm, kurutma gibi çevresel streslerden korunma sağlar ve kimyasal dezenfektanların etkisini mikropların hayatta kalmasına neden olacak şekilde daha az etkili hale getirebilir. Bir biyofilm içinde hayatta kalanlar, potansiyel olarak bir halk sağlığı sorunu olan patojenik mikroorganizmaların bir kaynağını sağlayabilir3.
Biyofilm yöntemleri büyüme, arıtma, örnekleme (hasat ve ayrıştırma) ve analiz olmak üzere dört adımdan oluşur. Kullanıcının organizma büyüme koşullarını, sıcaklığını, ortamını vb. belirlediği ilk adım olan büyüme, biyofilm literatüründe en çok düşünülen ve raporlanan adımdır4,5,6,7. Tedavi adımı, olgun bir biyofilme3,8,9 karşı etkinliklerini belirlemek için antimikrobiyalleri (örneğin, dezenfektanlar) değerlendirir veya antimikrobiyal, ürünün biyofilm büyümesini önleme veya azaltma yeteneğini belirlemek için yüzeye dahil edilebilir10. Üçüncü adım olan örnekleme, biyofilmi üzerinde büyüdüğü yüzeyden toplama ve çıkarılan kümeleri ayrıştırma adımlarını içerir3,8,11. Dördüncü adım olan analiz, canlı hücre sayımlarını, mikroskopiyi, floresan ölçümlerini, moleküler sonuçları ve / veya bir matris bileşeni değerlendirmesini içerebilir8,9. Verilerin değerlendirilmesi, bir deneyin sonucu hakkında bilgi sağlar. Dördü arasında, örnekleme genellikle en çok göz ardı edilen adımdır, çünkü seçilen biyofilm toplama ve / veya ayrıştırma tekniğinin, genellikle doğrulama olmadan% 100 etkili olduğunu varsayar11.
Genellikle homojen olduğu düşünülen bakterilerin planktonik süspansiyonları, analizden önce basit vorteks gerektirir. Bununla birlikte, biyofilmler mikroorganizmalardan (prokaryotik ve / veya ökaryotik), ekzopolisakkaritlerden, proteinlerden, lipitlerden, hücre dışı DNA'dan ve konakçı hücrelerden oluşan karmaşık topluluklardır12. Biyofilmi bir yüzeyden yeterince hasat etmek ve daha sonra homojen bir tek hücreli süspansiyona ayırmak için geleneksel planktonik mikrobiyolojik kültür yöntemlerinin ötesine geçen adımlara ihtiyaç vardır. Kapsamlı bir literatür taraması (bu yayında yer almayan bilgiler), çıkarma ve ayrıştırma tekniğinin seçiminin, biyofilmde bulunan türler, biyofilmin bağlı olduğu yüzey (gözeneksiz veya gözenekli), büyüme yüzeylerine erişilebilirlik (kolayca çıkarılabilir kupon veya biyofilmin büyüdüğü aparatın fiziksel tahribatı) dahil olmak üzere bir dizi faktöre bağlı olduğunu göstermiştir. yüzey geometrisi (alan ve şekil), büyüme yüzeylerinde biyofilm yoğunluğu ve mevcut laboratuvar ekipmanları.
Biyofilm bir yüzeyden toplandığında, ortaya çıkan hücre süspansiyonu heterojendir. Bu düzgün olmayan süspansiyon doğru bir şekilde numaralandırılacaksa, tek tek hücrelere ayrıştırılmalıdır. Canlı plaka sayımları, koloni oluşturan bir birimin bir bakteriden kaynaklandığını varsayar. Biyofilm agregaları büyüme ortamına yerleştirilirse, yanlış tahminlere yol açabilecek bireysel hücreleri ayırt etmek imkansızdır. Örneğin, dezenfektan etkinlik testi sırasında, bir işlem biyofilmi kontrole kıyasla bir yüzeyden çok etkili bir şekilde çıkarırsa, kütük azaltma kontrole kıyasla yapay olarak büyük görünebilir. Öte yandan, biyofilmi kontrole kıyasla bir yüzeye sabitleyen kimyasal bir dezenfektan, daha düşük bir kütük azaltma oranına sahip gibi görünecektir11. Bu tür bir senaryo, deneysel verilerin önyargılı yorumlanmasına yol açabilir.
Yayına hazırlanırken, literatürün gözden geçirilmesi, biyofilmin toplanması ve ayrıştırılmasına yönelik yaygın yaklaşımların kazıma, sürüntü alma, sonikasyon, vorteks veya bunların bir kombinasyonunu içerdiğini belirlemiştir. Kazıma, biyofilmin steril bir çubuk, spatula veya başka bir aletle yüzeylerden fiziksel olarak uzaklaştırılması olarak tanımlanır. Swabbing, biyofilmin pamuklu uçlu bir çubuk veya başka bir sabit emici malzeme ile yüzeylerden uzaklaştırılmasını ifade eder. Sonikasyon, biyofilmin su yoluyla dağıtılan ultrasonik dalgalar yoluyla yüzeylerden bozulmasını ifade eder. Vorteksing, bir tüp içindeki numunenin sıvı vorteksini elde etmek için bir karıştırıcının kullanılmasını ifade eder. Homojenizasyon, hasat edilen biyofilm kümelerini tek bir hücre süspansiyonuna kesmek için döner bıçaklar kullanır. Bu yazıda, sert/gözeneksiz ve gözenekli olmak üzere iki farklı yüzey tipi için üç hasat ve ayrıştırma yöntemi sunulmuştur.
Araştırmacıların yayınların yöntemler bölümlerine dahil etmeleri gereken önerilen asgari bilgilerin bir listesi sağlanır. Bu bilgilerin dahil edilmesinin, diğer araştırmacıların çalışmalarını yeniden üretmelerini sağladığını umuyoruz. Mükemmel bir hasat ve ayrıştırma yöntemi yoktur, bu nedenle tekniğin nasıl kontrol edileceğine dair öneriler de sağlanmaktadır.
Bu makalede, biyofilmi ortak büyüme yüzeylerinden toplamak ve ayrıştırmak için üç yaygın yöntem gösterilmiştir. Bu bilgi, araştırmacıların bir biyofilm test yönteminin genel hassasiyetini ve önyargısını daha iyi anlamalarını sağlayacaktır. Açıklanan yöntemler şunlardır: (1) CDC Biyofilm Reaktöründe yüksek sıvı makası altında polikarbonat kuponlar (sert gözeneksiz yüzey) üzerinde yetiştirilen bir Pseudomonas aeruginosa biyofilmi, biyofilm hasadı ve ayrışması elde etmek için vorteks ve sonikasyonun beş adımlı bir kombinasyonunu takiben hasat edilir ve ayrıştırılır (2) A P. aeruginosa Düşük sıvı makası altında damlama akış reaktöründe borosilikat cam kuponlarda (sert gözeneksiz yüzey) yetiştirilen biyofilm, kazıma ve homojenizasyon kullanılarak toplanır ve ayrıştırılır (3) Silikon boruda (gözenekli yüzey) yetiştirilen bir Escherichia coli biyofilmi, kazıma kullanılarak hasat edilir ve ayrıştırılır, ardından sonikasyon ve vorteks yapılır.
Protokol
1. Vorteks ve sonication
- ASTM Standardı E25622'ye göre yetiştirilen olgun bir P. aeruginosa ATCC 15442 biyofilmi yetiştirin.
- 48 saatlik büyüme süresinin sonunda, biyofilm ve numune kuponlarını ASTM Standardı E28718'e göre işlemeye hazırlanın.
- Otoklavlanmış sıçrama korumalarını, alevle sterilize edilmiş forseps kullanarak steril 50 mL konik tüplere aseptik olarak yerleştirin. Tedavi görecek tüm tüpler için tekrarlayın. Kontrol kuponları için tüplerin bir sıçrama korumasına ihtiyacı yoktur.
- CDC Biyofilm Reaktöründen rastgele seçilen bir çubuğu aseptik olarak çıkarın. Çubuğu hafifçe 30 mL steril tamponlu suya batırarak gevşek bir şekilde tutturulmuş hücreleri çıkarmak için kuponları durulayın.
- Çubuğu tezgah üstüne paralel olarak, boş, steril 50 mL konik bir tüp üzerinde tutun ve alevle sterilize edilmiş bir Allen anahtarı kullanarak, biyofilm kaplı bir kuponu tüpe düşürmek için vidayı gevşetin. İstediğiniz kupon sayısı için tekrarlayın. Sıçrama korumalarını çıkarın ve sterilizasyon için ayrı bir kaba yerleştirin.
- 5 mL'lik bir serolojik pipet kullanarak, işlemin 4 mL'sini yavaşça pipetleyin veya tüplere kontrol edin, böylece sıvı tüpün duvarının iç kısmından aşağı akar.
- Kuponun altındaki hava kabarcıklarının yer değiştirmesi için tüpün tabanına hafifçe dokunun. Her ekleme arasında 30 - 60 s izin verin.
- Belirtilen temas süresinin sonunda, 36 mL nötrleştirici pipeti, tedavinin (veya kontrolün) uygulandığı sırayla tüplere girer.
NOT: Kombine arıtma ve nötrleştiricinin son hacmi, biyofilm log yoğunluğunun doğru bir şekilde belirlenmesi için önemlidir. - Her tüpü 30 ± 5 s için en yüksek ayarda vorteksleyin. Tam bir girdabın elde edildiğinden emin olun.
NOT: Kırılmanın meydana gelebileceği cam şişelerde paslanmaz çelik gibi ağır kuponları vortekslerken dikkatli olunmalıdır. - Gerçek numuneleri işlemeden önce banyo başına en uygun tüp sayısını ve test tüpü rafına yerleştirmeyi belirleyin. Birden fazla numune işliyorsanız, sonikasyon banyosundaki su sıcaklığının 21 ± 2 oC olduğunu onaylayın.
- Tüpleri, gazdan arındırılmış sonikatörde asılı tüp rafına yerleştirin, böylece banyodaki su seviyesi tüplerdeki sıvı seviyesine eşit olur. 45 kHz'de sonikat,% 100 güç ve 30 ± 5 s için Normal işlev. Vorteks ve sonikasyon döngülerini tekrarlayın ve ardından son bir vorteks ile bitirin (toplam 5 döngü).
NOT: Hasat edilmiş ve ayrıştırılmış biyofilm içeren bu tüpler 100 veya 0 seyreltmedir. - Numuneyi tamponlanmış suda seri olarak seyreltin. Uygun kaplama yöntemi kullanılarak R2A agar üzerine plaka. 24 saat boyunca 36 ± 2 oC'de inkübe edin. Kullanılan kaplama yöntemine uygun kolonileri sayın ve verileri kaydedin.
2. Kazıma ve homojenizasyon
- ASTM Standardı E264713'e göre olgun bir P. aeruginosa ATCC 15442 biyofilm yetiştirin.
- Numune alma istasyonunu, numune alma panosu, bir beherde% 95 etanol, alkol brülörü, hemostatlar, kupon çıkarma aracı, steril seyreltme suyu içeren beherler ve kuponları durulamak için seyreltme tüpleri içerecek şekilde ayarlayın.
- Pompayı kapatın. Bir kanal kapağını çıkarın ve biyofilmi rahatsız etmemeye dikkat ederek kuponu çıkarmak için steril bir kupon çıkarma aleti ve hemostatlar kullanın.
- Kuponu, akıcı bir hareketle, 45 mL steril seyreltme suyuna (50 mL'lik bir santrifüj tüpünde bulunur) hafifçe batırarak durulayın. Kuponu kaldırmak için hareketi hemen tersine çevirin.
- Kuponu 45 mL steril seyreltme suyu içeren bir beherin içine yerleştirin. Biyofilm kaplı kupon yüzeyini, steril bir spatula veya kazıyıcı kullanarak yaklaşık 15 s boyunca aşağı doğru bir yönde kazıyın. Spatula veya kazıyıcıyı beherde karıştırarak durulayın. Kazıma ve durulama işlemini 3-4 kez tekrarlayın ve kupon yüzeyinin tam olarak kaplanmasını sağlayın.
- Kuponu steril kabın üzerinde 60°'lik bir açıyla tutarak ve kuponun yüzeyine 1 mL steril seyreltme suyu pipetleyerek durulayın. Toplam 5 durulama için tekrarlayın. Beherdeki son hacim 50 mL'dir.
NOT: Kombine arıtma ve nötrleştiricinin son hacmi, biyofilm log yoğunluğunun doğru bir şekilde belirlenmesi için önemlidir. - Kuponlar çıkarıldığında her kanal kapağını değiştirin.
- Biyogüvenlik kabininde çalışarak, kazınmış biyofilm numunesini homojenize edin. Homojenizatöre steril bir homojenizatör probu takın, prob ucunu sıvıya yerleştirin, homojenizatörü açın ve 20.500 rpm'ye kadar yükseltin.
- Numuneyi 30 saniye homojenize edin. RPM'leri kapatın ve homojenizatörü kapatın.
- Yukarıda açıklandığı gibi 30 s boyunca 20.500 rpm'de 9 mL'lik bir steril seyreltme boşluğunu homojenize ederek biyofilm numuneleri arasındaki probu sterilize edin. 9 mL'lik bir %70 etanol tüpünü 30 s için homojenize edin, probu ayırın ve 1 dakika boyunca etanol tüpünde bekletin. İki ek seyreltme boşluğunu homojenize edin.
NOT: Her numune için tek kullanımlık homojenizatör probu kullanılabilir. - Numuneleri tamponlanmış suda seri olarak seyreltin. Uygun kaplama yöntemini kullanarak R2A agar üzerine plaka. Plakaları 24 saat boyunca 36 ± 2oC'de inkübe edin, kolonileri kullanılan kaplama yöntemine uygun olarak sayın ve verileri kaydedin.
3. Kazıma, vorteks ve sonikasyon
- Silikon kateter tüpünde olgun bir Escherichia coli ATCC 53498 biyofilm yetiştirin10.
- Numune alma malzemeleri hazırlayın: durulama tüpleri, steril santrifüj tüpü, boş steril Petri kabı, alevle sterilize edilmiş paslanmaz çelik hemostat ve makas, zamanlayıcı ve cetvel.
- Pompa duraklatıldığında, borunun dışını temizlemek için% 70 etanol kullanın. Konektöre bağlı alandan kaçınarak uçtan 2 cm ölçün ve kesme yerlerini belirlemek için boruyu işaretleyin.
- Alevle sterilize edilmiş makasla boruyu 2 cm işareti üzerinde kesin ve segmenti boş steril Petri kabına yerleştirin. Boruyu% 70 etanol ile silin ve distal ucu atık boruya yeniden bağlayın.
- Planktonik hücreleri çıkarmak için boru segmentini durulayın. Alevle sterilize edilmiş forsepslerle, boru segmentini nazikçe 20 mL steril seyreltme suyuna batırın ve ardından hemen çıkarın. Segmenti 10 mL nötrleştiriciye yerleştirin.
- Alevle sterilize edilmiş forsepslerle, boru segmentini tutun ve borunun tüm iç alanları kazınana kadar steril ahşap aplikatör çubuğu ile kazıyın. Bazen çubuğu 10 mL nötrleştirici içinde durulayın ve segmenti numune tüpüne geri yerleştirin. Kazınmış boru segmenti 100 veya 0 seyreltmedir.
NOT: Kombine arıtma ve nötrleştiricinin son hacmi, biyofilm log yoğunluğunun doğru bir şekilde belirlenmesi için önemlidir. - Her tüpü 30 ± 5 s için en yüksek ayarda vorteksleyin. Tüpü sonikatörde asılı tüp rafına yerleştirin, böylece banyodaki su seviyesi tüplerdeki sıvı seviyesine eşit olur. 45 kHz'de,% 100 güçte ve 30 ± 5 saniye boyunca Normal işlevde sonikat. Vorteks ve sonikasyon döngülerini tekrarlayın, ardından son bir vorteks ile sona erin.
NOT: Hasat edilmiş ve ayrıştırılmış biyofilm içeren bu tüp 100 seyreltmedir. - Numuneleri tamponlanmış suda seri olarak seyreltin. Triptik Soya Agar üzerine uygun kaplama yöntemi kullanılarak plaka.
- Plakaları 24 saat boyunca 36 ± 2 oC'de inkübe edin. Kullanılan kaplama yöntemine uygun kolonileri sayın, verileri kaydedin ve aritmetik ortalamayı hesaplayın.
Sonuçlar
Bir Hasat Yönteminin Doğrulanması/Onaylanması
Laboratuvarımızda yapılan çeşitli çalışmalar, Tek Tüp Yöntemi (ASTM E2871) 8 kullanılarak biyofilm reaktöründe (ASTM E2562)2 yetiştirilen biyofilmi etkili bir şekilde hasat etmek için vorteks ve sonikasyon yeteneğini incelemiştir.
Bir P. aeruginosa ATCC 15442 biyofilmi, borosilikat cam kuponlar üzerinde ASTM E25622'ye göre yetiştirildi. 48 saat sonra, şişelere dört kupon yerleştirildi, 4 mL steril tamponlu su ile "muamele edildi" ve 36 mL 2x D / E Nötrleştirici Et Suyu ile nötralize edildi. 45 kHz,% 10 güç, Süpürme ayarı, 30 ± 5 s'lik ilk sonikasyon ayarı, biyofilmi dört kupondan üçünden toplamak ve ayrıştırmak için kullanıldı. Vorteks ve sonikasyon döngüsünün tamamlanmasının ardından, her kupon kristal menekşe ile boyandı ve fotoğraflandı. Şekil 1, kontrole kıyasla vorteks ve sonikasyondan sonra üç kuponda kalan biyofilm miktarını göstermektedir.
Bunu daha fazla test etmek için, daha önce açıklandığı gibi bir P. aeruginosa ATCC 15442 biyofilmi yetiştirildi ve iki sonikasyon ayarı karşılaştırıldı: 1) 45 kHz,% 10 güç, Süpürme ayarı, 30 ± 5 saniye ve 2) 45 kHz,% 100 güç, Normal ayar, 30 ± 5 saniye. Üçünün her setinden bir kupon BacLight Live / Dead boyası ile boyandı ve konfokal mikroskopi (CM) kullanılarak görüntülendi. Her setten kalan iki kupon seyreltildi, kaplandı ve canlı hücreler için numaralandırıldı. Uygun plaka sayımı sonuçları, 9.230 Log10 CFU / kupon ± 0.007 (SD_R) ayar için 1 ve 9.272 Log10 CFU / kupon ± 0.066 (SD_R) sonikasyon ayarı 2 idi. Bu veriler, 9.03 Log10 CFU / kupon ± 0.272 (SD_R) elde edilen 2015 EPA Tek Tüp Yöntemi İşbirliği Çalışmasını doğrulamıştır9. Uygulanabilir plaka sayımlarına göre, her üç aracın da iki hasat yöntemi arasındaki farkların daha fazla araştırılmasını gerektirmeyecek kadar benzer olduğu görülmektedir. Bununla birlikte, Şekil 2'de gösterilen mikroskobik görüntüler, ayar 1'in kullanılmasından sonra ayar 2'den daha fazla biyofilm kaldığını düşündürebilir. Kuponlarda kalan biyofilmin ölü (kırmızı renkli) göründüğünü gözlemlerken, BacLight Live / Dead lekesi kullanıldığında canlılığın yorumlanması zordur14,15. Lekeli biyofilmin canlılık etkilerine odaklanmak yerine, bu lekeyi yüzeylerde kalan biyofilmi görselleştirmek için kullandık. Ek olarak, sonikasyonun bakteriyel canlılığa zararlı olabileceğini kabul ederken, Kobayashi ve ark.16 tarafından yapılan bir 2007 yayını, 5 minuların üzerindeki artan sonikasyon süresinin canlı plaka sayılarının azalmasına neden olduğunu göstermiştir. Çalışmamız toplam 1 dakikalık bir sonikasyon kullandığından, iki sonikasyon parametresi için >9.2 LOG10 CFU / kuponları tarafından gösterildiği gibi sonikasyon yoluyla az sayıda hücrenin öldürüldüğünden eminiz. Biyofilmin yüzeyden tam olarak toplanmasının her iki yöntemle de elde edilmemesi ilginçtir. Bu bulgu, tek başına uygulanabilir plaka sayımlarının hasat ve ayrıştırma yanlılığını belirlemek için yeterli olmadığını ve bu nedenle örneğin mikroskopi gibi ek bir yöntemle eşleştirilmesi gerektiğini göstermektedir.
Sonikatör ayarlarına ek olarak, sonikasyonu etkileyen diğer önemli faktörleri araştırdık. Bunlar arasında şişelerdeki sıvı hacmi (10 veya 40 mL), şişedeki sıvının türü (tamponlanmış su veya 2X D / E Nötrleştirici Et Suyu) ve aynı anda banyoya yerleştirilen şişelerin sayısı (3 veya 12 şişe)9 vardı.
CDC Biyofilm Reaktörü kuponlarındaki P. aeruginosa biyofilmleri, sonik ayar 2 (45 kHz,% 100 güç, Normal ayar, 30 ± 5 saniye) kullanılarak sonikleştirildi. Tüm örnekler, bir seferde 3 veya 6 yerli bir tüp bağlantısı ile donatılmış bir vorteks kullanılarak bir seferde 6 vortekse edildi ve daha sonra Şekil 3'te açıklandığı gibi sonikleştirildi. Aşağıdaki kategorilerin her birinden bir kupon CM kullanılarak görüntülenmiştir (Şekil 3).
Sonikasyon parametrelerinin araştırıldığı ikinci çalışmada, mikroskobik görüntüler (Şekil 3), tüplerdeki hacmin en aza indirilmesinin, bir kerede işlenen tüp sayısının azaltılmasının ve D / E Nötrleştirici Et Suyunun (yüzey aktif madde içeren) kullanılmasının, kuponlardan gelişmiş biyofilm hasadına katkıda bulunduğunu göstermektedir.
Biyositler hasadı ve ayrışmayı pozitif veya negatif olarak artırabilir. Bir nötrleştiricinin, bir etkinlik testi yapmadan önce öldürmeyi arttırmadan aktif olanı etkili bir şekilde durdurduğunu doğrulamaya benzer şekilde, bir biyositin hasat ve ayrışmayı farklı şekilde etkilemediğini doğrulamak önemlidir. Etkinlik testi için, önyargı ancak ve ancak kontrol ve işlenmiş biyofilm numuneleri için diferansiyel uzaklaştırma varsa sonuçlanır11.

Resim 1: Artık biyofilmi gösteren kristal menekşe ile boyanmış kuponların fotoğrafları. A) Kupon reaktörden çıkarıldı ve kristal menekşe ile boyandı. B, C, D) Üç replika kupon ayrı ayrı steril tamponlu su ile "arıtıldı" ve daha sonra nötralize edildi. Hasat ve ayrıştırma için, kuponlar vortekslendi (30 ± 5 saniye) ve sonikleştirildi (45 kHz,% 10 güç, Süpürme ayarı, 30 ± 5 saniye) iki kez daha sonra son bir girdap aldı. Resimler Danielle Orr ve Blaine Fritz tarafından sağlanmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
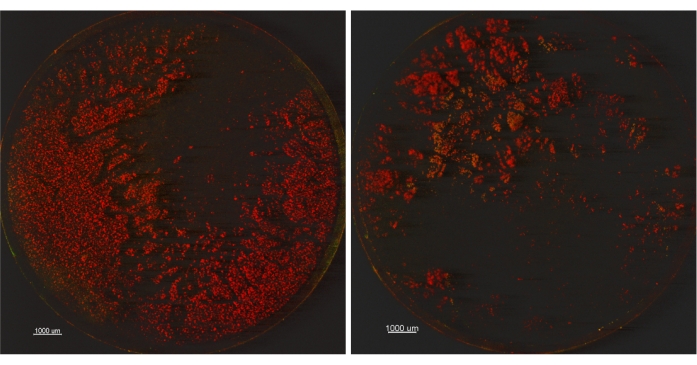
Şekil 2: İki farklı sonikasyon ayarlarını karşılaştıran kuponların konfokal mikroskopi görüntüleri. Solda sonikasyon ayarı 1 (45 kHz,% 10 güç, Süpürme ayarı) veya sağdaki sonikasyon ayarı 2 (45 kHz,% 100 güç, Normal ayar) ile işlenen kuponlar (12.5X büyütme). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
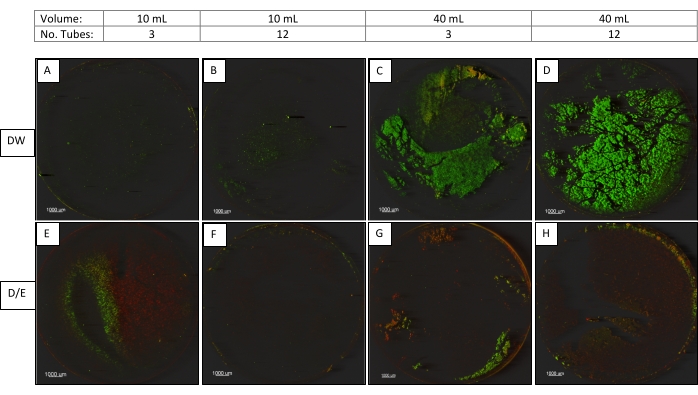
Şekil 3. Hacimleri, sonikasyon sıvısını ve tüp sayısını karşılaştıran kuponların konfokal mikroskopi görüntüleri. Kuponlar (12.5X büyütme), 10 veya 40 mL hacimlerde, seyreltme suyunda (DW) veya D / E Nötrleştirici Et Suyunda (D / E), optimize edilmiş sonikasyon ayarıyla (45 kHz,% 100 güç, Normal ayar) bir seferde 3 veya 12 tüpte işlenir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Hasat ve ayrıştırma için önemli olan temel parametreler Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Hasat ve ayrıştırma yöntemleri için minimum bilgi
Bilimsel topluluk genelinde tekrarlanabilir biyofilm verileri oluşturmak için, yazarların bir biyofilm yönteminin büyüme, tedavi, örnekleme ve analiz adımlarının her biri ile ilgili mümkün olduğunca fazla ayrıntı içermesi zorunludur. Biyofilm yöntemlerinin standardizasyonu, araştırmacının belirli bir yönteme ve ilgili değişikliklere atıfta bulunmasına izin verdiği için bu çabaya yardımcı olmuştur. Bununla birlikte, birçok makale biyofilm hasadı ve ayrıştırmayı tanımlamak için sadece bir veya iki cümle içerir. Daha iyi tekrarlanabilirlik için, biyofilm hasadı için minimum bilgilerin yayınlara dahil edilmesini öneririz. Bu, Lourenco ve ark.17 tarafından sunulan Bir Biyofilm Deneyi Hakkında Minimum Bilgi (MIABiE) girişimine dayanmaktadır. Biyofilm toplama ve ayrıştırma parametreleri için sonikasyon kullanılması durumunda, bilgiler şunları içermelidir: banyo içindeki tüplerin konumu (dönüştürücülere zarar vermemek için üreticilerin önerileri), aynı anda sonikleştirilen tüplerin sayısı, tüp malzemesi, tüpteki sıvının hacmi ve tipi, yüzey aktif maddenin varlığı, ultrasonik banyonun sıvı seviyesine göre tüplerde sıvının konumu, tüpleri banyoda tutmak için kullanılan cihaz (cam beherlere karşı test tüpü rafı), numunelerin sonikasyonundan önce su banyosunun gazdan arındırılması (gazdan arındırma bir üretici seçeneği değilse, numuneleri yerleştirmeden önce banyonun basit bir şekilde çalıştırılması, bazı çözünmüş gazların banyo sıvısından çıkarılmasına yardımcı olacaktır), su banyosunun sıcaklığı (sıcaklıklar uzun sonikasyon dönemlerinden sonra artabilir), frekans (örneğin 25 kHz veya 45 kHz), banyo işlevi (örneğin süpürme veya normal) ve dönüştürücülere verilen güç aralığı (örneğin% 10 - 100). Bu ayarlar, çalışılan biyofilm, biyofilmi büyütmek için kullanılan sistem ve ultrasonik banyonun spesifik markası / modeli için optimize edilmelidir18.
İstenilen hasat efektlerini optimize etmek için sonicator ayarları değiştirilebilir. Gazdan arındırma, banyo sıvısı içindeki çözünmüş havayı giderir ve böylece temizleme gücünü arttırır. Frekans düşük veya yüksek bir ayara ayarlanabilir. Örneğin, 25 kHz gibi düşük bir ayar, inatçı numunelerin toplanmasına yardımcı olurken, hassas numuneler için 45 kHz'lik daha yüksek bir ayar daha uygun olacaktır. Süpürme veya normal bir banyo fonksiyonu, kavitasyonun dağılmasına izin verir. Süpürme işlevi, ses basıncı maksimumunun sürekli olarak kaymasını sağlar. Normal fonksiyon, dönüştürücülerin ölü bölgelere neden olabilecek çift yarım dalga modunda çalışmasına izin verir, böylece sonikasyonu daha az etkili hale getirir. Güç aralıkları, dönüştürücülere iletilen gücün %10 - %100'ü arasında değiştirilebilir19. Sonikasyonun bakteriyel canlılığı zararlı bir şekilde etkileyebileceği bilinmektedir. Stamper ve ark.20 tarafından yapılan bir 2008 çalışması, bakteriyel öldürme eğrileri oluşturmak için zamanla ultrasonik enerjiyi arttırmaya bakteri kültürlerini maruz bıraktı. Kullanıcıların, sonikasyon ayarlarının belirli bir kombinasyonunun canlı bakterilerde bir azalmaya neden olmadığını doğrulamalarını öneririz20.
Biyofilmi toplamak ve ayrıştırmak için mükemmel bir yöntem yoktur, ancak belirli yöntemler bazı yüzeyler / mikrop kombinasyonları için diğerlerinden daha iyi çalışır. Okuyucunun, kendi biyofilm senaryosu için hangi parametrelerin önemli olduğunu belirlemesini savunuyoruz. Hasat ve ayrıştırma için önemli olan anahtar parametreler Ek Dosya 1'de yer almaktadır.
Hasat ve ayrışma yanlılığını değerlendirmek için yapılan sonikasyon çalışmaları için, sonikasyonun uygun, verimli olduğunu ve biyofilmi yüzeylerden toplamak ve ayrıştırmak için standartlaştırılabileceğini bulduk. Kuponların şişelere yerleştirilmesi, örneğin kuponların laboratuvar personeli tarafından fiziksel olarak kazındığı yöntemlerde karşılaşılacak teknisyenden teknisyene değişkenliği en aza indirir. Şişeleri sonikasyon su banyosuna yerleştirmek için yeterince basit görünse de, biyofilmin optimal hasadını elde etmek için dikkate alınması gereken birçok parametre vardır.
İki tip sonikasyon ekipmanı mevcuttur, ultrasonik banyolar ve ultrasonik problar. Bu makale öncelikle ultrasonik enerjinin yüksek (20 - 45 kHz) ila normal (40 - 60 Hz) frekans aralığında üretildiği ultrasonik banyolara odaklanmaktadır.
Bir yüzeyi temizlemek için ultrasonik bir cihaz kullanırken üç ana işlem rol oynar. Elektrik enerjisi, akıma yanıt olarak salınan piezoelektrik veya manyetostriktif bir dönüştürücüye yüksek frekanslı bir akım gönderildiğinde akustik enerjiye dönüştürülür. Salınım, sıvıda sıkıştırma (nadirlik) dalgaları üretir. Kavitasyon kabarcıkları, nadirlik sırasında negatif basınç nedeniyle oluşur. Kabarcıklar dengesiz bir boyuta ulaşana kadar büyür ve çökerek yüzeyleri temizleyen bir su jeti oluşturur21.
Bu makalede üç hasat ve ayrıştırma yaklaşımı gösterilmiştir: Tek Tüp Yöntemine göre CDC Biyofilm Reaktöründe polikarbonat kuponlarda yetiştirildiğinde biyofilmin toplanması ve ayrıştırılması için sonikasyon ve vorteks yöntemleri. Biyofilmin toplanması ve ayrıştırılması için kazıma ve homojenizasyon yöntemleri, Damlama Akışı Biyofilm Reaktörü kullanılarak cam kuponlarda yetiştirildiğinde gösterilir. Biyofilm hasadı ve ayrıştırılması için kazıma, sonikasyon ve vorteks yöntemleri, silikon tüplerde yetiştirildiğinde gösterilir.
Biyofilmi hasat etmek ve ayrıştırmak için mükemmel bir yöntem yoktur, ancak bazı yaklaşımlar farklı yüzeyler ve / veya uygulamalar için daha iyidir. Önemli olan, kullanılan yöntemi doğrulamak için zaman ayırmaktır. Bu yazıda, kristal menekşe ve mikroskopi kullanımını tartıştık, ancak gerekli duyarlılığa bağlı olarak başka seçenekler de var. Araştırma etkinlik testi içeriyorsa, antimikrobiyal6 varlığında yaklaşımın geçerliliğini doğrulamak çok önemlidir. Tüm ekipman biraz farklıdır, bu nedenle hasat ve ayrıştırma yöntemi standartlaştırılmış olsa bile, kullanılan ekipman için işlemi onaylamak hala ihtiyatlıdır. Hasat ve ayrıştırma yöntemleri, yüzeyle ilişkili ve biyofilm bakterileri için spesifiktir. Araştırmalar, yanlış seçimlerin önyargılı test sonuçlarına yol açabileceğini göstermiştir. Bununla birlikte, hasat ve ayrıştırma, biyofilm yöntemlerindeki dört adımdan en az çalışılanıdır. Aynı zamanda, yayınlanmış makalede en az bilgi bulunan ve süreci farklı bir laboratuvarda çoğaltmayı zorlaştıran doğrulanmamış bir adımdır (çalışma olarak kabul edilir). Bu makale ve beraberindeki video, iki yüzey türü için üç ortak yaklaşımı göstermektedir ve tek bir laboratuvar için bir yöntemin nasıl doğrulanacağını önermektedir. Bu bilgiler, araştırmacıların hangi yöntemi kullanacakları konusunda daha bilinçli kararlar vermelerine yardımcı olacak ve tekrarlanabilirliği artırmak için neyin rapor edileceği konusunda rehberlik sağlayacaktır.
Açıklamalar
Yazarların herhangi bir açıklaması yoktur.
Teşekkürler
Danielle Orr Goveia, Blaine Fritz, Jennifer Summers ve Fei San Lee'ye bu makaleye katkılarından dolayı teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 50 mL conical vials | Thermo Scientific | 339652 | |
| 100 mL glass beakers | Fisher Scientific | FB102100 | |
| 5 mL serological pipettes | Fisher Scientific | 13-678-12D | For adding treatment to vials containing coupons. |
| 50 mL serological pipettes | Fisher Scientific | 13-678-14C | For adding neutralizer to vials at the end of treatment contact time. |
| Applicator sticks | Puritan | 807 | |
| Hemostats | Fisher Scientific | 16-100-115 | |
| Metal spatula | Fisher Scientific | 14-373 | |
| PTFE policemen | Saint-Gobain | 06369-04 | |
| S 10 N - 10 G - ST Dispersing tool | IKA | 4446700 | For homogenization of biofilm samples. |
| Scissors | Fisher Scientific | 08-951-20 | |
| Silicone Foley catheter, size 16 French | Medline Industries | DYND11502 | |
| Silicone tubing, size 16 | Cole-Parmer | EW96400-16 | |
| Splash Guards | BioSurface Technologies, Inc. | CBR 2232 | |
| T 10 basic ULTRA-TURRAX Disperser | IKA | 3737001 | For homogenization of biofilm samples. |
| Tubing connectors | Cole-Parmer | EW02023-86 | |
| Ultrasonic Cleaner | Elma | TI-H15 | |
| Vortex-Genie 2 | Scientific Industries | SI-0236 | |
| Vortex-Genie 2 Vertical 50 mL Tube Holder | Scientific Industries | SI-V506 |
Referanslar
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerging Infectious Diseases. 8 (9), 881-890 (2002).
- ASTM International. ASTM Standard E2562, 2017, Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown with High Shear and Continuous Flow using CDC Biofilm Reactor. ASTM International. , (2017).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews In Microbiology. 43 (3), 313-351 (2017).
- Gomes, I. B., et al. Standardized reactors for the study of medical biofilms: a review of the principles and latest modifications. Critical Reviews in Biotechnology. 38 (5), 657-670 (2018).
- Goeres, D. M., et al., Simoes, M., et al. Design and fabrication of biofilm reactors. Recent Trends in Biofilm Sciences and Technology. , 71-88 (2020).
- Goeres, D. M., et al. A method for growing a biofilm under low shear at the air-liquid interface using the drip flow biofilm reactor. Nature Protocols. 4 (5), 783-788 (2009).
- ASTM International. ASTM Standard E2871, Standard Test Method for Determining Disinfectant Efficacy Against Biofilm Grown in the CDC Biofilm Reactor Using the Single Tube Method. ASTM International. , (2019).
- Goeres, D. M., et al. Validation of a Biofilm Efficacy Test: The Single Tube Method. Journal of Microbiological Methods. , (2019).
- The development and validation of a standard in vitro method to evaluate the efficacy of surface modified urinary catheters. Theses and Dissertations at Montana State University Available from: https://scholarworks.montana.edu/xmlui/handle/1/15149 (2019)
- Hamilton, M. A., Buckingham-Meyer, K., Goeres, D. M. Checking the Validity of the harvesting and Disaggregating Steps in Laboratory Tests of Surface Disinfectants. Journal of AOAC International. 92 (6), 1755-1762 (2009).
- Conlon, B. P., Rowe, S. E., Lewis, K., Donelli, G. Persister Cells in Biofilm Associated Infections. Biofilm-based Healthcare-associated Infections. , (2015).
- ASTM International. ASTM Standard E2647, Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown Using Drip Flow Biofilm Reactor with Low Shear and Continuous Flow. ASTM International. , (2020).
- Rosenberg, M., Azevedo, N., Ivask, A. Propidium iodide staining underestimates viability of adherent bacterial cells. Scientific Reports. , (2019).
- Stiefel, P., Schmidt-Emrich, S., Manuira-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. , (2015).
- Kobayashi, N., Bauer, T. W., Tuohy, M. J., Fujishiro, T., Procop, G. W. Brief Ultrasonication Improves Detection of Biofilm-formative Bacteria Around a Metal Implant. Clinical Orthopaedics and Related Research. 457, 210-213 (2007).
- Lourenco, A., et al. Minimum information about a biofilm experiment (MIABiE), standards for reporting experiments and data on sessile microbial communities living at interfaces. Pathogens and Disease. , 1-7 (2014).
- Nascentes, C. C., Korn, M., Sousa, C. S., Arruda, M. A. Z. Use of Ultrasonic Baths for Analytical Applications: A New Approach for Optimisation Conditions. Journal of Brazilian Chemical Society. 12 (1), 57-63 (2001).
- Elma GmbH & Co. KG TI-H Ultrasonic Cleaning Units: Operating Instructions. Elma GmbH & Co. , (2009).
- Stamper, D. M., Holm, E. R., Brizzolara, R. A. Exposure times and energy densities for ultrasonic disinfection of Escherichia coli, Pseudomonas aeruginosa, Enterococcus avium and sewage. Journal of Environmental Engineering and Science. 7 (2), 139-146 (2008).
- Suslick, K. S. Sonochemistry. Science. 247 (4949), (1990).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır