Method Article
الحصاد والتصنيف: خطوة مهملة في أبحاث أساليب البيوفيلم
In This Article
Summary
تفصل هذه الورقة الطرق التي توضح ثلاث تقنيات شائعة لحصاد الأغشية الحيوية وتصنيفها على نوعين من الأسطح ، واختبار الصلابة لطريقة الحصاد والحد الأدنى من المعلومات التي يجب مراعاتها عند اختيار وتحسين تقنيات الحصاد والتصنيف لزيادة قابلية التكاثر.
Abstract
تتكون طرق البيوفيلم من أربع خطوات متميزة: زراعة البيوفيلم في نموذج ذي صلة ، ومعالجة البيوفيلم الناضج ، وحصاد البيوفيلم من السطح وتصنيف الكتل ، وتحليل العينة. من بين الخطوات الأربع ، يعد الحصاد والتصنيف الأقل دراسة ولكنه مع ذلك حاسم عند النظر في إمكانية التحيز في الاختبار. توضح هذه المقالة تقنيات الحصاد والتصنيف الشائعة الاستخدام للأغشية الحيوية المزروعة على ثلاثة أسطح مختلفة. وتشمل تقنيات حصاد وتصنيف الأغشية الحيوية الثلاثة، المستقاة من مراجعة واسعة النطاق للأدبيات، الدوامة والصوتنة، والكشط والتجانس، والكشط والدوامة والصوتنة. يتم النظر في نوعين من الأسطح: الصلبة غير المسامية (زجاج البولي والبورسليكات) والمسامية (السيليكون). بالإضافة إلى ذلك ، نقدم توصيات للحد الأدنى من المعلومات التي يجب تضمينها عند الإبلاغ عن تقنية الحصاد المتبعة وطريقة مصاحبة للتحقق من التحيز.
Introduction
وقد تطور تعريف الأغشية الحيوية على مدى العقود القليلة الماضية ويشمل الارتباط الميكروبي مع مجموعة متنوعة من الأسطح البيولوجية و/أو غير البيولوجية، وإدراج المكونات غير الخلوية1 التي تظهر نموا مختلفا وتعبيرا جينيا2 داخل مصفوفة. يوفر البيوفيلم الحماية من الضغوط البيئية مثل التجفيف وقد يجعل عمل المطهرات الكيميائية أقل فعالية مما يؤدي إلى بقاء الميكروبات. يمكن للناجين داخل الفيلم الحيوي أن يوفروا مصدرا للكائنات الحية الدقيقة المسببة للأمراض التي تشكل مصدر قلق للصحة العامة3.
تتكون طرق الأغشية الحيوية من أربع خطوات ، النمو ، العلاج ، أخذ العينات (الحصاد والتصنيف) ، والتحليل. النمو ، الخطوة الأولى ، حيث يحدد المستخدم ظروف نمو الكائن الحي ، ودرجة الحرارة ، والوسائط ، وما إلى ذلك ، هو الأكثر مراعاة والإبلاغ عنه في أدبيات البيوفيلم4،5،6،7. تقوم خطوة العلاج بتقييم مضادات الميكروبات (مثل المطهرات) لتحديد فعاليتها إما ضد الأغشية الحيوية الناضجة3،8،9 أو يمكن دمج مضادات الميكروبات في السطح لتحديد قدرة المنتج على منع أو تقليل نمو الأغشية الحيوية10. تتضمن الخطوة الثالثة ، أخذ العينات ، خطوات لحصاد البيوفيلم من السطح الذي كان ينمو عليه وتصنيف الكتل التي تمت إزالتها3،8،11. قد تتضمن الخطوة الرابعة ، التحليل ، تعداد الخلايا القابلة للحياة ، والفحص المجهري ، وقياسات التألق ، والنتائج الجزيئية ، و / أو تقييم مكون المصفوفة8,9. يوفر تقييم البيانات معلومات حول نتائج التجربة. ومن بين الخطوات الأربعة، غالبا ما يكون أخذ العينات هو الخطوة الأكثر تجاهلا لأنه يفترض أن تقنية حصاد الأغشية الحيوية المختارة و/أو تصنيفها فعالة بنسبة 100٪، وغالبا ما تكون دون تحقق11.
تتطلب المعلقات العوالق للبكتيريا ، التي غالبا ما تعتبر متجانسة ، دوامة بسيطة قبل التحليل. ومع ذلك، فإن الأغشية الحيوية هي مجتمعات معقدة تتكون من الكائنات الحية الدقيقة (بدائية النواة و/أو حقيقية النواة)، والسكريات الخارجية، والبروتينات، والدهون، والحمض النووي خارج الخلية، والخلايا المضيفة12. هناك حاجة إلى خطوات تتجاوز طرق الاستزراع الميكروبيولوجي التقليدية للعوالق من أجل حصاد الأغشية الحيوية بشكل كاف من سطح ما ثم تقسيمها إلى تعليق متجانس للخلية الواحدة. أظهر استعراض واسع النطاق للأدبيات (معلومات غير مدرجة في هذا المنشور) أن اختيار تقنية الإزالة والتصنيف يعتمد على عدد من العوامل ، بما في ذلك الأنواع الموجودة في البيوفيلم ، والسطح الذي يرتبط به البيوفيلم (غير مسامي أو مسامي) ، وإمكانية الوصول إلى أسطح النمو (قسيمة قابلة للإزالة بسهولة أو تدمير مادي للجهاز الذي ينمو فيه البيوفيلم) ، هندسة السطح (المساحة والشكل) ، وكثافة الأغشية الحيوية على أسطح النمو ، والمعدات المختبرية المتاحة.
عندما يتم حصاد البيوفيلم من سطح ، يكون تعليق الخلية الناتج غير متجانس. وإذا أريد تعداد هذا التعليق غير المنتظم بدقة، فيجب تصنيفه إلى خلايا فردية. تفترض أعداد الصفائح القابلة للحياة أن وحدة تشكيل المستعمرة تنشأ من بكتيريا واحدة. إذا تم وضع مجاميع من البيوفيلم على وسط النمو ، فمن المستحيل التمييز بين الخلايا الفردية التي يمكن أن تؤدي إلى تقديرات غير دقيقة. على سبيل المثال ، أثناء اختبار فعالية المطهر ، إذا كان العلاج يزيل الأغشية الحيوية بشكل فعال للغاية من سطح مقارنة بالتحكم ، فقد يظهر تقليل السجل كبيرا بشكل مصطنع مقارنة بالتحكم. من ناحية أخرى، يبدو أن المطهر الكيميائي الذي يثبت الأغشية الحيوية على سطح مقارنة بعنصر التحكم لديه انخفاض أقل في السجل11. يمكن أن يؤدي هذا النوع من السيناريوهات إلى تفسير متحيز للبيانات التجريبية.
واستعدادا للنشر، خلص استعراض للأدبيات إلى أن النهج الشائعة لحصاد الأغشية الحيوية وتصنيفها تشمل الكشط أو المسح أو الصوتنة أو الدوامة أو مزيج من هذه النهج. يعرف الكشط بأنه الإزالة الفيزيائية للفيلم الحيوي من الأسطح باستخدام عصا معقمة أو ملعقة أو أداة أخرى. يشير المسح إلى إزالة البيوفيلم من الأسطح باستخدام عصا قطنية مائلة أو غيرها من المواد الماصة الثابتة. يشير الصوتنة إلى تعطيل الأغشية الحيوية من الأسطح عبر الموجات فوق الصوتية الموزعة عبر الماء. يشير الدوامة إلى استخدام خلاط لتحقيق دوامة سائلة للعينة داخل أنبوب. يستخدم التجانس شفرات دوارة لقص كتل الأغشية الحيوية التي يتم حصادها في تعليق خلية واحدة. في هذه الورقة ، نقدم ثلاث طرق للحصاد والتصنيف لنوعين مختلفين من الأسطح ، صلبة / غير مسامية ومسامية.
يتم توفير قائمة بالحد الأدنى من المعلومات الموصى بها التي يجب على الباحثين تضمينها في أقسام الأساليب في المنشورات. نأمل أن يؤدي تضمين هذه المعلومات إلى تمكين الباحثين الآخرين من إعادة إنتاج عملهم. لا توجد طريقة مثالية للحصاد والتصنيف ، لذلك ، يتم أيضا تقديم توصيات حول كيفية التحقق من هذه التقنية.
يتم توضيح ثلاث طرق شائعة لحصاد وتصنيف الأغشية الحيوية من أسطح النمو الشائعة في هذه المقالة. ستمكن هذه المعلومات الباحثين من فهم الدقة والتحيز بشكل عام لطريقة اختبار الأغشية الحيوية بشكل أفضل. الطرق الموصوفة هي كما يلي: (1) يتم حصاد وتصنيف الأغشية الحيوية Pseudomonas aeruginosa المزروعة على كوبونات البولي كربونات (سطح صلب غير مسامي) تحت قص عالي السوائل في مفاعل البيوفيلم CDC وتصنيفها بعد مزيج من خمس خطوات من الدوامة والصوتنة لتحقيق حصاد الأغشية الحيوية وتصنيفها (2) A P. aeruginosa يتم حصاد الأغشية الحيوية المزروعة على كوبونات زجاجية البورسليكات (سطح صلب غير مسامي) في مفاعل التدفق بالتنقيط تحت قص منخفض السوائل وتصنيفها باستخدام الكشط والتجانس (3) يتم حصاد الأغشية الحيوية الإشريكية القولونية المزروعة في أنابيب السيليكون (سطح مسامي) وتصنيفها باستخدام الكشط ، تليها الصوتنة والدوامة.
Protocol
1. دوامة وصوتنة
- تنمو ناضجة P. aeruginosa ATCC 15442 البيوفيلم نمت وفقا لمعيار ASTM E25622.
- في نهاية فترة النمو 48 ساعة ، استعد لمعالجة البيوفيلم وكوبونات العينات وفقا لمعيار ASTM E28718
- أدخل واقيات رذاذ معقمة معقمة في أنابيب مخروطية معقمة سعة 50 مل باستخدام ملقط معقم باللهب. كرر ذلك لجميع الأنابيب التي ستتلقى العلاج. لا تحتاج أنابيب كوبونات التحكم إلى واقي من الرذاذ.
- قم بإزالة قضيب تم اختياره عشوائيا من مفاعل البيوفيلم CDC بشكل معقم. شطف كوبونات لإزالة الخلايا المرفقة بشكل فضفاض عن طريق غمس القضيب بلطف في 30 مل من الماء المخزن مؤقتا المعقم.
- أمسك القضيب بالتوازي مع سطح المقعد ، فوق أنبوب مخروطي فارغ ومعقم بسعة 50 مل وباستخدام وجع ألين معقم باللهب ، قم بفك المسمار لإسقاط قسيمة مغلفة بالأغشية الحيوية في أنبوب. كرر ذلك للعدد المطلوب من القسائم. قم بإزالة واقيات الرذاذ وضعها في حاوية منفصلة للتعقيم.
- باستخدام ماصة مصلية سعة 5 مل ، قم ببطء بماصة 4 مل من المعالجة أو التحكم في الأنابيب بحيث يتدفق السائل إلى داخل جدار الأنبوب.
- اضغط برفق على الجزء السفلي من الأنبوب بحيث يتم تشريد أي فقاعات هواء أسفل القسيمة. اسمح ب 30 - 60 ثانية بين كل إضافة.
- في نهاية وقت التلامس المحدد ، قم بماصة 36 مل من المعادل في الأنابيب بنفس الترتيب الذي تم به تطبيق العلاج (أو التحكم).
ملاحظة: الحجم النهائي للمعالجة المدمجة والمحايد مهم لتحديد كثافة سجل الأغشية الحيوية بدقة. - دوامة كل أنبوب على أعلى إعداد لمدة 30 ± 5 ثانية. تأكد من تحقيق دوامة كاملة.
ملاحظة: يجب توخي الحذر عند دوامة القسائم الثقيلة مثل الفولاذ المقاوم للصدأ في قوارير زجاجية حيث يمكن أن يحدث كسر. - حدد العدد الأمثل للأنابيب لكل حمام ووضعها داخل رف أنبوب الاختبار قبل معالجة العينات الفعلية. في حالة معالجة عينات متعددة ، تأكد من أن درجة حرارة الماء في حمام الصوتنة هي 21 ± 2 درجة مئوية.
- ضع الأنابيب في رف الأنبوب معلقا في سونيكتور منزوع الغاز بحيث يكون مستوى الماء في الحمام مساويا لمستوى السائل في الأنابيب. سونيكات عند 45 كيلو هرتز ، طاقة 100٪ ووظيفة عادية لمدة 30 ± 5 ثوان. كرر دورات الدوامة والصوتنة ثم تنتهي بدوامة نهائية (إجمالي 5 دورات).
ملاحظة: هذه الأنابيب مع البيوفيلم المحصود والمفصل هي التخفيف 100 أو 0. - عينة مخففة بشكل متسلسل في الماء العازل. لوحة على R2A أجار باستخدام طريقة الطلاء المناسبة. احتضان في 36 ± 2 درجة مئوية لمدة 24 ساعة. عد المستعمرات حسب الاقتضاء لطريقة الطلاء المستخدمة وتسجيل البيانات.
2. كشط وتجانس
- تنمو البيوفيلم الناضج P. aeruginosa ATCC 15442 وفقا لمعيار ASTM E264713.
- قم بإعداد محطة أخذ العينات لتشمل لوحة أخذ العينات ، والإيثانول بنسبة 95٪ في الكأس ، وموقد الكحول ، ومرقئ الدم ، وأداة إزالة القسيمة ، والأكواب مع مياه تخفيف معقمة وأنابيب تخفيف لشطف القسائم.
- أوقف تشغيل المضخة. قم بإزالة غطاء القناة واستخدم أداة إزالة قسيمة معقمة ومرقئ لإزالة القسيمة ، مع الحرص على عدم إزعاج البيوفيلم.
- شطف القسيمة عن طريق الغمر بلطف ، مع حركة سائلة ، في 45 مل من ماء التخفيف المعقم (الموجود في أنبوب طرد مركزي 50 مل). عكس الحركة على الفور لإزالة القسيمة.
- ضع القسيمة في كوب يحتوي على 45 مل من ماء التخفيف المعقم. كشط سطح القسيمة المغطى بالبيوفيلم في اتجاه هبوطي لمدة 15 ثانية تقريبا ، باستخدام ملعقة معقمة أو مكشطة. شطف ملعقة أو مكشطة عن طريق تحريكها في دورق. كرر عملية الكشط والشطف 3-4 مرات ، مما يضمن التغطية الكاملة لسطح القسيمة.
- شطف القسيمة عن طريق الاحتفاظ بها بزاوية 60 درجة فوق الكأس المعقمة وسحب 1 مل من ماء التخفيف المعقم على سطح القسيمة. كرر ذلك لما مجموعه 5 شطف. الحجم النهائي في الكأس هو 50 مل.
ملاحظة: الحجم النهائي للمعالجة المدمجة والمحايد مهم لتحديد كثافة سجل الأغشية الحيوية بدقة. - استبدل كل غطاء قناة عند إزالة القسائم.
- العمل في خزانة السلامة الأحيائية ، تجانس عينة الأغشية الحيوية المكشطة. قم بتوصيل مسبار مجانس معقم بالمجانس ، وضع طرف المسبار في السائل ، قم بتشغيل المجانس وتسلق ما يصل إلى 20500 دورة في الدقيقة.
- تجانس العينة لمدة 30 ثانية. قم بإيقاف تشغيل RPMs وقم بإيقاف تشغيل المجانس.
- قم بتعقيم المسبار بين عينات الأغشية الحيوية عن طريق تجانس 9 مل من التخفيف المعقم الفارغ عند 20500 دورة في الدقيقة لمدة 30 ثانية كما هو موضح أعلاه. تجانس أنبوب 9 مل من الإيثانول 70 ٪ لمدة 30 ثانية ، وفصل المسبار والسماح للوقوف في أنبوب الإيثانول لمدة 1 دقيقة. تجانس فراغين إضافيين للتخفيف.
ملاحظة: يمكن استخدام مسبار مجانس يمكن التخلص منه لكل عينة. - قم بتخفيف العينات بشكل متسلسل في الماء العازل. لوحة على R2A أجار باستخدام طريقة الطلاء المناسبة. احتضان الصفائح عند 36 ± 2 درجة مئوية لمدة 24 ساعة ، وعد المستعمرات حسب الاقتضاء لطريقة الطلاء المستخدمة وتسجيل البيانات.
3. كشط ، دوامة وصوتنة
- تنمو الإشريكية القولونية ATCC 53498 البيوفيلم ناضجة في أنابيب قسطرة السيليكون10.
- تحضير مواد أخذ العينات: أنابيب الشطف ، أنبوب الطرد المركزي المعقم ، طبق بتري المعقم الفارغ ، مرقئ ومقص من الفولاذ المقاوم للصدأ معقم باللهب ، مؤقت ، ومسطرة.
- مع إيقاف المضخة مؤقتا ، استخدم 70٪ من الإيثانول لتنظيف الجزء الخارجي من الأنابيب. قم بقياس 2 سم من النهاية ، وتجنب المنطقة المتصلة بالموصل ، ووضع علامة على الأنبوب لتحديد مواقع القطع.
- باستخدام مقص معقم باللهب ، اقطع الأنبوب على علامة 2 سم وضع الجزء في طبق بتري معقم فارغ. امسح الأنابيب بنسبة 70٪ من الإيثانول وأعد توصيل الطرف البعيد بأنابيب النفايات.
- شطف جزء الأنابيب لإزالة الخلايا العوالق. باستخدام ملقط معقم باللهب ، اغمر مقطع الأنابيب بلطف في 20 مل من ماء التخفيف المعقم ثم قم بإزالته على الفور. ضع الجزء في 10 مل من المحايد.
- باستخدام ملقط معقم باللهب ، أمسك جزء الأنابيب وكشطه بعصا قضيب خشبية معقمة حتى يتم كشط جميع المناطق الداخلية للأنابيب. في بعض الأحيان شطف العصا في 10 مل من المعادل ووضع الجزء مرة أخرى في أنبوب العينة. جزء الأنابيب المكشطة هو التخفيف 100 أو 0.
ملاحظة: الحجم النهائي للمعالجة المدمجة والمحايد مهم لتحديد كثافة سجل الأغشية الحيوية بدقة. - دوامة كل أنبوب على أعلى إعداد لمدة 30 ± 5 ثانية. ضع الأنبوب في رف الأنبوب المعلق في سونيكتور بحيث يكون مستوى الماء في الحمام مساويا لمستوى السائل في الأنابيب. سونيكات عند 45 كيلو هرتز ، طاقة 100٪ ووظيفة عادية لمدة 30 ± 5 ثوان. كرر دورات الدوامة والصوتنة ثم تنتهي بدوامة نهائية.
ملاحظة: هذا الأنبوب مع البيوفيلم المحصود والمفصل هو التخفيف 100 . - قم بتخفيف العينات بشكل متسلسل في الماء العازل. لوحة على تريبتيك الصويا أجار باستخدام طريقة الطلاء المناسبة.
- احتضان الألواح عند 36 ± 2 درجة مئوية لمدة 24 ساعة. عد المستعمرات حسب الاقتضاء لطريقة الطلاء المستخدمة ، وتسجيل البيانات وحساب المتوسط الحسابي.
النتائج
التحقق من صحة / تأكيد طريقة الحصاد
فحصت العديد من الدراسات التي أجريت في مختبرنا قدرة الدوامة والصوتنة على حصاد الأغشية الحيوية المزروعة في مفاعل الأغشية الحيوية (ASTM E2562)2 بشكل فعال باستخدام طريقة الأنبوب الواحد (ASTM E2871)8.
تم زراعة البيوفيلم الحيوي P. aeruginosa ATCC 15442 وفقا ل ASTM E25622 على كوبونات زجاج البورسليكات. بعد 48 ساعة ، تم وضع أربع قسائم في قوارير ، "معالجة" بماء مخزن مؤقت معقم 4 مل وتحييدها ب 36 مل من مرق تحييد 2x D / E. تم استخدام إعداد الصوتنة الأولي البالغ 45 كيلو هرتز ، وطاقة 10٪ ، وإعداد الاجتياح ، و 30 ± 5 ثانية لحصاد وتصنيف البيوفيلم من ثلاثة من القسائم الأربعة. عند الانتهاء من دورة الدوامة والصوتنة ، تم تلطيخ كل قسيمة باللون البنفسجي البلوري وتصويرها. يوضح الشكل 1 كمية البيوفيلم المتبقية على القسائم الثلاثة بعد الدوامة والصوتنة مقارنة بالتحكم.
لاختبار ذلك بشكل أكبر ، تم زراعة فيلم حيوي P. aeruginosa ATCC 15442 كما هو موضح سابقا وتمت مقارنة إعدادين للصوتنة: 1) 45 كيلو هرتز ، طاقة 10٪ ، إعداد الاجتياح ، 30 ± 5 ثوان و 2) 45 كيلو هرتز ، طاقة 100٪ ، إعداد عادي ، 30 ± 5 ثوان. تم تلطيخ قسيمة واحدة من كل مجموعة من المجموعات الثلاث ببقعة BacLight Live / Dead وتم تصويرها باستخدام المجهر البؤري (CM). تم تخفيف القسيمتين المتبقيتين من كل مجموعة وطهيهما وتعدادهما للخلايا القابلة للحياة. كانت نتائج عدد اللوحات القابلة للتطبيق 9.230 Log10 CFU / قسيمة ± 0.007 (SD_R) لإعداد 1 و 9.272 Log10 CFU / قسيمة ± 0.066 (SD_R) لإعداد الصوتنة 2. أكدت هذه البيانات دراسة تعاونية لطريقة الأنبوب الواحد لوكالة حماية البيئة لعام 2015 حيث تم تحقيق 9.03 Log10 CFU / قسيمة ± 0.272 (SD_R) 9. وفقا لأعداد الألواح القابلة للتطبيق ، يبدو أن جميع الوسائل الثلاث متشابهة بما يكفي لعدم تبرير إجراء مزيد من التحقيق في الاختلافات بين طريقتي الحصاد. ومع ذلك، قد تشير الصور المجهرية المبينة في الشكل 2 إلى أن عددا أكبر من الأغشية الحيوية بقي بعد استخدام الإعداد 1 أكثر من الإعداد 2. بينما نلاحظ أن البيوفيلم المتبقي على القسائم يبدو ميتا (أحمر اللون) ، فإن تفسير الجدوى عند استخدام بقعة BacLight Live / Dead أمر صعب14,15. بدلا من التركيز على الآثار المترتبة على الجدوى للفيلم الحيوي الملون ، استخدمنا هذه البقعة لتصور البيوفيلم المتبقي على الأسطح. بالإضافة إلى ذلك ، في حين أننا نعترف بأن الصوتنة يمكن أن تكون ضارة بصلاحية البكتيريا ، فقد أظهر منشور صدر عام 2007 عن Kobayashi et al.16 أن زيادة وقت الصوتنة بعد 5 دقائق أدى إلى انخفاض عدد الصفائح القابلة للحياة. نظرا لأن دراستنا استخدمت ما مجموعه 1 دقيقة صوتنة ، فنحن واثقون من أن عددا قليلا من الخلايا قد قتل عن طريق الصوتنة كما هو موضح في >9.2 LOG10 CFU / كوبونات لمعلمتي الصوتنة. من المثير للاهتمام أن حصادا كاملا للفيلم الحيوي من السطح لم يتحقق بأي من الطريقتين. توضح هذه النتيجة أن عدد الصفائح القابلة للحياة وحده غير كاف لتحديد تحيز الحصاد والتصنيف ، وبالتالي يجب إقرانه بطريقة إضافية ، الفحص المجهري ، على سبيل المثال.
بالإضافة إلى إعدادات الصوتنة ، قمنا بالتحقيق في العوامل المهمة الأخرى التي تؤثر على الصوتنة. وشملت هذه العوامل حجم السائل في القوارير (10 أو 40 مل)، ونوع السائل في القارورة (الماء المخزن مؤقتا أو مرق تحييد 2X D/E) وعدد القوارير الموضوعة في الحمام في نفس الوقت (3 أو 12 قارورة)9.
تم صوتنة الأغشية الحيوية P. aeruginosa على كوبونات مفاعل CDC Biofilm باستخدام إعداد سونيكتور 2 (45 كيلو هرتز ، طاقة 100٪ ، إعداد عادي ، 30 ± 5 ثوان). تم تدوير جميع العينات إما 3 في وقت واحد أو 6 في وقت واحد باستخدام دوامة مزودة بملحق أنبوب من 6 أماكن ثم صوتية كما هو موضح في الشكل 3. تم تصوير قسيمة واحدة من كل فئة من الفئات التالية باستخدام CM (الشكل 3).
في الدراسة الثانية حيث تم التحقيق في معلمات الصوتنة ، تشير الصور المجهرية (الشكل 3) إلى أن تقليل الحجم في الأنابيب ، وتقليل عدد الأنابيب المعالجة في وقت واحد واستخدام مرق تحييد D / E (الذي يحتوي على الفاعل بالسطح) كلها تساهم في تعزيز حصاد الأغشية الحيوية من القسائم.
قد تعزز المبيدات الحيوية بشكل إيجابي أو سلبي الحصاد والتصنيف. على غرار التأكيد على أن المعادل يوقف النشاط بشكل فعال مع عدم زيادة القتل قبل إجراء اختبار الفعالية ، من المهم التأكد من أن المبيد الحيوي لا يؤثر بشكل تفاضلي على الحصاد والتصنيف. بالنسبة لاختبار الفعالية، ينتج التحيز إذا وفقط إذا كان هناك إزالة تفاضلية للتحكم مقابل عينات الأغشية الحيوية المعالجة11.

الشكل 1: صور لكوبونات ملطخة بالبنفسج البلوري توضح البيوفيلم المتبقي. أ) إزالة القسيمة من المفاعل وتلطيخها باللون البنفسجي البلوري. ب ، ج ، د) تم "معالجة" ثلاث قسائم مكررة بشكل منفصل بالماء المخزن المؤقت المعقم ثم تحييدها. للحصاد والتقسيم ، تم دوامة القسائم (30 ± 5 ثوان) وصوتنة (45 كيلو هرتز ، طاقة 10٪ ، إعداد الاجتياح ، 30 ± 5 ثوان) مرتين ثم تلقت دوامة نهائية. الصور مقدمة من دانييل أور وبلين فريتز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
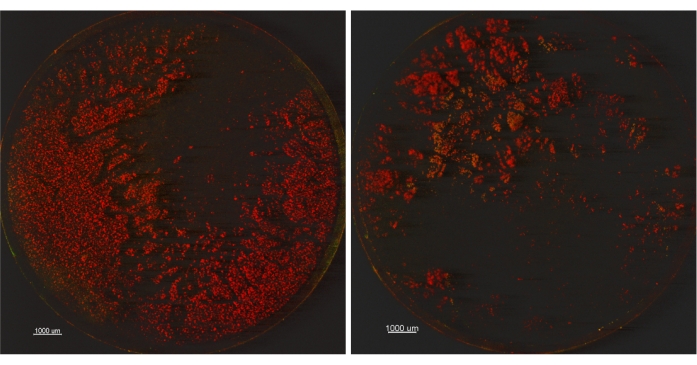
الشكل 2: صور مجهرية متحدة البؤرة للكوبونات تقارن بين إعدادين مختلفين للصوتنة. تتم معالجة القسائم (تكبير 12.5X) عبر إعداد الصوتنة 1 (45 كيلو هرتز ، طاقة 10٪ ، إعداد الكنس) على اليسار أو إعداد الصوتنة 2 (45 كيلو هرتز ، طاقة 100٪ ، إعداد عادي) على اليمين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
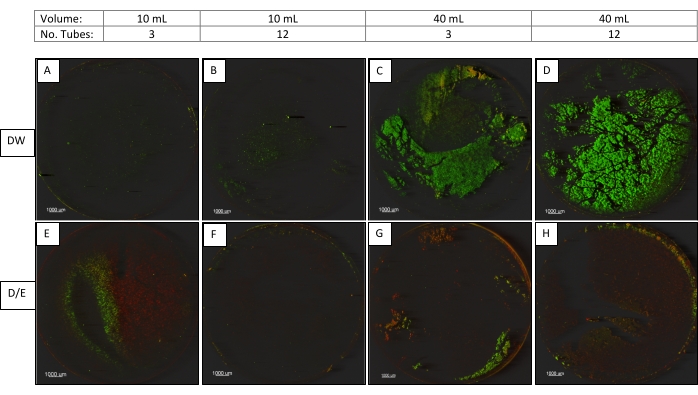
الشكل 3. صور المجهر البؤري للكوبونات التي تقارن بين الأحجام وسائل الصوتنة وعدد الأنابيب. كوبونات (تكبير 12.5X) تتم معالجتها في أحجام 10 أو 40 مل ، في ماء التخفيف (DW) أو D / E Neutralizing Broth (D / E) ، 3 أو 12 أنبوبا في وقت واحد مع إعداد صوتنة محسن (45 كيلو هرتز ، طاقة 100٪ ، إعداد عادي). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الملف التكميلي 1: المعلمات الرئيسية ذات الأهمية للحصاد والتصنيف يرجى النقر هنا لتنزيل هذا الملف.
Discussion
الحد الأدنى من المعلومات لطرق الحصاد والتصنيف
لإنشاء بيانات بيوفيلم قابلة للتكرار عبر المجتمع العلمي ، من الضروري أن يدرج المؤلفون أكبر قدر ممكن من التفاصيل فيما يتعلق بكل خطوة من خطوات النمو والمعالجة وأخذ العينات والتحليل لطريقة البيوفيلم. وقد ساعد توحيد أساليب البيوفيلم في هذا المسعى لأنه يسمح للباحث بالرجوع إلى طريقة محددة وأي تعديلات ذات صلة. ومع ذلك ، فإن العديد من الأوراق تتضمن جملة أو جملتين فقط لوصف حصاد الأغشية الحيوية وتصنيفها. ولتحسين إمكانية التكرار، نوصي بإدراج الحد الأدنى من المعلومات المتعلقة بحصاد الأغشية الحيوية في المنشورات. ويستند ذلك إلى مبادرة الحد الأدنى من المعلومات حول تجربة البيوفيلم (MIABiE) التي قدمها لورينكو وآخرون 17. في حالة استخدام الصوتنة لحصاد الأغشية الحيوية ومعلمات التصنيف ، يجب أن تشمل المعلومات: موضع الأنابيب داخل الحمام (توصيات الشركات المصنعة لتجنب إتلاف محولات الطاقة) ، وعدد الأنابيب الصوتية في نفس الوقت ، ومواد الأنبوب ، وحجم ونوع السائل في الأنبوب ، ووجود الفاعل بالسطح ، وموضع السائل في الأنابيب بالنسبة لمستوى السائل في الحمام بالموجات فوق الصوتية ، جهاز يستخدم لحمل الأنابيب في الحمام (أكواب زجاجية مقابل رف أنبوب اختبار) ، وتفريغ الغاز من الحمام المائي قبل صوتنة العينات (إذا لم يكن إزالة الغاز خيارا من خيارات الشركة المصنعة ، فإن التشغيل البسيط للحمام قبل إدخال العينات سيساعد على إزالة بعض الغازات الذائبة من سائل الحمام) ، ودرجة حرارة الحمام المائي (يمكن أن ترتفع درجات الحرارة بعد فترات طويلة من الصوتنة) ، التردد (25 كيلو هرتز أو 45 كيلو هرتز ، على سبيل المثال) ، وظيفة الحمام (الاجتياح أو العادي ، على سبيل المثال) ونطاق الطاقة الذي يتم تسليمه إلى محولات الطاقة (10 - 100٪ ، على سبيل المثال). يجب تحسين هذه الإعدادات للفيلم الحيوي الذي تتم دراسته ، والنظام المستخدم لزراعة البيوفيلم وصنع / نموذج محدد للحمام بالموجات فوق الصوتية 18.
قد يتم تغيير إعدادات سونيكتور لتحسين تأثيرات الحصاد المطلوبة. يزيل تفريغ الغاز الهواء المذاب داخل سائل الحمام وبالتالي يعزز قوة التنظيف. يمكن ضبط التردد على إعداد منخفض أو مرتفع. فالإعداد المنخفض مثل 25 كيلو هرتز، على سبيل المثال، من شأنه أن يساعد في حصاد العينات العنيدة في حين أن الإعداد الأعلى البالغ 45 كيلو هرتز سيكون أكثر ملاءمة للعينات الحساسة. تسمح وظيفة الحمام من الاجتياح أو العادي بتوزيع التجويف. تخلق وظيفة الكنس تحولا مستمرا في الحد الأقصى لضغط الصوت. تسمح الوظيفة العادية لمحولات الطاقة بالعمل في وضع نصف موجة مزدوج مما قد يؤدي إلى مناطق ميتة ، مما يجعل الصوتنة أقل فعالية. يمكن تغيير نطاقات الطاقة من 10 إلى 100٪ من الطاقة التي يتم توصيلها إلى محولات الطاقة19. من المعروف أن الصوتنة يمكن أن تؤثر بشكل ضار على الجدوى البكتيرية. عرضت دراسة أجريت عام 2008 من قبل Stamper et al.20 الثقافات البكتيرية لزيادة الطاقة فوق الصوتية بمرور الوقت لإنشاء منحنيات قتل بكتيرية. نوصي المستخدمين بالتأكد من أن مجموعة معينة من إعدادات الصوتنة لا تسبب انخفاضا في البكتيريا القابلة للحياة20.
لا توجد طريقة واحدة مثالية لحصاد وتصنيف الأغشية الحيوية ، ولكن هناك طرق معينة تعمل بشكل أفضل لبعض الأسطح / مجموعات الميكروبات من غيرها. نحن ندعو القارئ إلى تحديد المعلمات المهمة لسيناريو البيوفيلم الخاص به. وترد البارامترات الرئيسية ذات الأهمية للحصاد والتصنيف في الملف التكميلي 1.
بالنسبة لدراسات الصوتنة التي أجريت لتقييم تحيز الحصاد والتصنيف ، وجدنا أن الصوتنة مريحة وفعالة وقادرة على أن تكون موحدة لحصاد وتصنيف الأغشية الحيوية من الأسطح. إن وضع القسائم في قوارير يقلل من التباين بين الفني والفني الذي قد تتم مواجهته في الطرق التي يتم فيها كشط القسائم ماديا من قبل موظفي المختبر ، على سبيل المثال. على الرغم من أنه يبدو بسيطا بما يكفي لوضع القوارير في حمام مائي صوتي ، إلا أن هناك العديد من المعلمات التي يجب مراعاتها لتحقيق الحصاد الأمثل للفيلم الحيوي.
يتوفر نوعان من معدات الصوتنة ، حمامات بالموجات فوق الصوتية ومجسات بالموجات فوق الصوتية. تركز هذه الورقة في المقام الأول على حمامات الموجات فوق الصوتية حيث يتم توليد الطاقة بالموجات فوق الصوتية في نطاق تردد عال (20 - 45 كيلو هرتز) إلى تردد عادي (40 - 60 هرتز).
هناك ثلاث عمليات رئيسية قيد التشغيل عند استخدام جهاز بالموجات فوق الصوتية لتنظيف السطح. يتم تحويل الطاقة الكهربائية إلى طاقة صوتية عندما يتم إرسال تيار عالي التردد إلى محول كهرضغطي أو مغناطيسي يتأرجح استجابة للتيار. يولد التذبذب موجات ضغط (فصيل نادر) في السائل. تتشكل فقاعات التجويف بسبب الضغط السلبي أثناء الفصيل النادر. تنمو الفقاعات حتى تصل إلى حجم غير مستقر وتنهار ، مما يخلق نفاثة مائية تنظف الأسطح21.
يتم توضيح ثلاثة أساليب للحصاد والتصنيف في هذه المقالة: طرق الصوتنة والدوامة لحصاد وتصنيف البيوفيلم عند زراعتها على كوبونات البولي كربونات في مفاعل البيوفيلم CDC وفقا لطريقة الأنبوب الواحد. يتم عرض طرق الكشط والتجانس لحصاد وتصنيف البيوفيلم عند زراعتها على كوبونات زجاجية باستخدام مفاعل البيوفيلم بالتنقيط. يتم عرض طرق الكشط والصوتنة والدوامة لحصاد وتصنيف الأغشية الحيوية عند زراعتها في أنابيب السيليكون.
لا توجد طريقة مثالية لحصاد وتصنيف الأغشية الحيوية ، ولكن بعض الأساليب أفضل للأسطح و / أو التطبيقات المختلفة. المهم هو أن تأخذ الوقت الكافي للتحقق من صحة الطريقة المستخدمة. في هذه الورقة ، ناقشنا استخدام البنفسج البلوري والمجهري ، ولكن توجد خيارات أخرى اعتمادا على الحساسية المطلوبة. إذا كان البحث يتضمن اختبار الفعالية ، فمن الأهمية بمكان تأكيد صحة النهج في وجود مضادات الميكروبات6. تختلف جميع المعدات قليلا ، لذلك حتى لو تم توحيد طريقة الحصاد والتصنيف ، فلا يزال من الحكمة تأكيد عملية المعدات المستخدمة. طرق الحصاد والتصنيف محددة للبكتيريا المرتبطة بالسطح والأغشية الحيوية. أظهرت الأبحاث أن الخيارات غير الصحيحة قد تؤدي إلى نتائج اختبار متحيزة. ومع ذلك ، فإن الحصاد والتصنيف هما الأقل دراسة من بين الخطوات الأربع في طرق البيوفيلم. وهي عموما أيضا الخطوة التي لم يتم التحقق من صحتها (التي تعتبر أمرا مفروغا منه على أنها تعمل) مع أقل قدر من المعلومات الموجودة في ورقة منشورة مما يجعل من الصعب إعادة إنتاج العملية في مختبر مختلف. تعرض هذه الورقة والفيديو المصاحب لها ثلاثة أساليب شائعة لنوعين من الأسطح وتقترح كيفية التحقق من صحة طريقة لمختبر فردي. ستساعد هذه المعلومات الباحثين على اتخاذ قرارات أكثر استنارة بشأن الطريقة التي يجب استخدامها وتوفر إرشادات حول ما يجب الإبلاغ عنه لتحسين قابلية التكرار.
Disclosures
ليس لدى المؤلفين أي إفصاحات.
Acknowledgements
ونود أن نعرب عن تقديرنا لدانييل أور غوفيا، وبلين فريتز، وجنيفر سامرز، وفاي سان لي على مساهماتهم في هذه الورقة.
Materials
| Name | Company | Catalog Number | Comments |
| 50 mL conical vials | Thermo Scientific | 339652 | |
| 100 mL glass beakers | Fisher Scientific | FB102100 | |
| 5 mL serological pipettes | Fisher Scientific | 13-678-12D | For adding treatment to vials containing coupons. |
| 50 mL serological pipettes | Fisher Scientific | 13-678-14C | For adding neutralizer to vials at the end of treatment contact time. |
| Applicator sticks | Puritan | 807 | |
| Hemostats | Fisher Scientific | 16-100-115 | |
| Metal spatula | Fisher Scientific | 14-373 | |
| PTFE policemen | Saint-Gobain | 06369-04 | |
| S 10 N - 10 G - ST Dispersing tool | IKA | 4446700 | For homogenization of biofilm samples. |
| Scissors | Fisher Scientific | 08-951-20 | |
| Silicone Foley catheter, size 16 French | Medline Industries | DYND11502 | |
| Silicone tubing, size 16 | Cole-Parmer | EW96400-16 | |
| Splash Guards | BioSurface Technologies, Inc. | CBR 2232 | |
| T 10 basic ULTRA-TURRAX Disperser | IKA | 3737001 | For homogenization of biofilm samples. |
| Tubing connectors | Cole-Parmer | EW02023-86 | |
| Ultrasonic Cleaner | Elma | TI-H15 | |
| Vortex-Genie 2 | Scientific Industries | SI-0236 | |
| Vortex-Genie 2 Vertical 50 mL Tube Holder | Scientific Industries | SI-V506 |
References
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerging Infectious Diseases. 8 (9), 881-890 (2002).
- ASTM International. ASTM Standard E2562, 2017, Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown with High Shear and Continuous Flow using CDC Biofilm Reactor. ASTM International. , (2017).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews In Microbiology. 43 (3), 313-351 (2017).
- Gomes, I. B., et al. Standardized reactors for the study of medical biofilms: a review of the principles and latest modifications. Critical Reviews in Biotechnology. 38 (5), 657-670 (2018).
- Goeres, D. M., et al., Simoes, M., et al. Design and fabrication of biofilm reactors. Recent Trends in Biofilm Sciences and Technology. , 71-88 (2020).
- Goeres, D. M., et al. A method for growing a biofilm under low shear at the air-liquid interface using the drip flow biofilm reactor. Nature Protocols. 4 (5), 783-788 (2009).
- ASTM International. ASTM Standard E2871, Standard Test Method for Determining Disinfectant Efficacy Against Biofilm Grown in the CDC Biofilm Reactor Using the Single Tube Method. ASTM International. , (2019).
- Goeres, D. M., et al. Validation of a Biofilm Efficacy Test: The Single Tube Method. Journal of Microbiological Methods. , (2019).
- The development and validation of a standard in vitro method to evaluate the efficacy of surface modified urinary catheters. Theses and Dissertations at Montana State University Available from: https://scholarworks.montana.edu/xmlui/handle/1/15149 (2019)
- Hamilton, M. A., Buckingham-Meyer, K., Goeres, D. M. Checking the Validity of the harvesting and Disaggregating Steps in Laboratory Tests of Surface Disinfectants. Journal of AOAC International. 92 (6), 1755-1762 (2009).
- Conlon, B. P., Rowe, S. E., Lewis, K., Donelli, G. Persister Cells in Biofilm Associated Infections. Biofilm-based Healthcare-associated Infections. , (2015).
- ASTM International. ASTM Standard E2647, Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown Using Drip Flow Biofilm Reactor with Low Shear and Continuous Flow. ASTM International. , (2020).
- Rosenberg, M., Azevedo, N., Ivask, A. Propidium iodide staining underestimates viability of adherent bacterial cells. Scientific Reports. , (2019).
- Stiefel, P., Schmidt-Emrich, S., Manuira-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. , (2015).
- Kobayashi, N., Bauer, T. W., Tuohy, M. J., Fujishiro, T., Procop, G. W. Brief Ultrasonication Improves Detection of Biofilm-formative Bacteria Around a Metal Implant. Clinical Orthopaedics and Related Research. 457, 210-213 (2007).
- Lourenco, A., et al. Minimum information about a biofilm experiment (MIABiE), standards for reporting experiments and data on sessile microbial communities living at interfaces. Pathogens and Disease. , 1-7 (2014).
- Nascentes, C. C., Korn, M., Sousa, C. S., Arruda, M. A. Z. Use of Ultrasonic Baths for Analytical Applications: A New Approach for Optimisation Conditions. Journal of Brazilian Chemical Society. 12 (1), 57-63 (2001).
- Elma GmbH & Co. KG TI-H Ultrasonic Cleaning Units: Operating Instructions. Elma GmbH & Co. , (2009).
- Stamper, D. M., Holm, E. R., Brizzolara, R. A. Exposure times and energy densities for ultrasonic disinfection of Escherichia coli, Pseudomonas aeruginosa, Enterococcus avium and sewage. Journal of Environmental Engineering and Science. 7 (2), 139-146 (2008).
- Suslick, K. S. Sonochemistry. Science. 247 (4949), (1990).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved