Method Article
Сбор и дезагрегирование: упущенный шаг в исследовании методов биопленки
В этой статье
Резюме
В настоящем документе подробно описываются методы, демонстрирующие три распространенных метода сбора и дезагрегирования биопленки на двух типах поверхностей, испытания на прочность метода сбора урожая и минимальную информацию, которую следует учитывать при выборе и оптимизации методов сбора и дезагрегирования для повышения воспроизводимости.
Аннотация
Методы биопленки состоят из четырех различных этапов: выращивание биопленки в соответствующей модели, обработка зрелой биопленки, сбор биопленки с поверхности и дезагрегирование сгустков, а также анализ образца. Из четырех этапов сбор урожая и дезагрегирование являются наименее изученными, но, тем не менее, критическими при рассмотрении возможности систематической проверки. В этой статье демонстрируются широко используемые методы сбора и дезагрегирования биопленки, выращенной на трех разных поверхностях. Три метода сбора и дезагрегирования биопленки, почерпнутые из обширного обзора литературы, включают вихри и обработку ультразвуком, скребок и гомогенизацию, а также соскоб, вихрь и обработку ультразвуком. Рассматриваются два типа поверхностей: твердые непористые (поликарбонатное и боросиликатное стекло) и пористые (силиконовое). Кроме того, мы предоставляем рекомендации по минимальной информации, которая должна быть включена при сообщении о применяемой технике сбора урожая, и сопутствующем методе проверки на предвзятость.
Введение
Определение биопленки эволюционировало за последние несколько десятилетий и охватывает микробную ассоциацию с различными биологическими и/или небиологическими поверхностями, включая неклеточные компоненты1, которые демонстрируют различный рост и генетическую экспрессию2 в матрице. Биопленка обеспечивает защиту от экологических стрессов, таких как сушка, и может сделать действие химических дезинфицирующих средств менее эффективным, что приводит к выживанию микробов. Выжившие в биопленке потенциально могут стать источником патогенных микроорганизмов, которые являются проблемой общественного здравоохранения3.
Методы биопленки состоят из четырех этапов: рост, обработка, отбор проб (сбор и дезагрегирование) и анализ. Рост, первый шаг, где пользователь определяет условия роста организма, температуру, среды и т.д., является наиболее рассмотренным и описанным в литературе по биопленке4,5,6,7. На этапе обработки оценивают противомикробные препараты (например, дезинфицирующие средства) для определения их эффективности либо против зрелой биопленки3,8,9, либо противомикробное средство может быть включено в поверхность для определения способности продукта предотвращать или уменьшать рост биопленки10. Третий этап, отбор проб, включает этапы сбора биопленки с поверхности, на которой она росла, и дезагрегирования удаленных комков3,8,11. Четвертый этап, анализ, может включать в себя количество жизнеспособных клеток, микроскопию, измерения флуоресценции, молекулярные результаты и/или оценку компонента матрицы8,9. Оценка данных дает информацию о результатах эксперимента. Из четырех отбор проб часто является наиболее упускаемым из виду шагом, поскольку он предполагает, что выбранный метод сбора и/или дезагрегирования биопленки эффективен на 100%, часто без проверки11.
Планктонные суспензии бактерий, часто считающиеся однородными, требуют простого вихря перед анализом. Биопленки, однако, представляют собой сложные сообщества, состоящие из микроорганизмов (прокариотических и/или эукариотических), экзополисахаридов, белков, липидов, внеклеточной ДНК и клеток-хозяев12. Необходимы шаги, выходящие за рамки традиционных планктонных микробиологических методов культивирования, чтобы адекватно собирать биопленку с поверхности, а затем дезагрегировать ее в однородную одноклеточную суспензию. Обширный обзор литературы (информация, не включенная в эту публикацию) показал, что выбор метода удаления и дезагрегирования зависит от ряда факторов, включая виды, присутствующие в биопленке, поверхность, к которой прикреплена биопленка (непористая или пористая), доступность к поверхностям роста (легко снимаемый купон или физическое разрушение аппарата, в котором растет биопленка), геометрия поверхности (площадь и форма), плотность биопленки на поверхностях роста и имеющееся лабораторное оборудование.
Когда биопленка собирается с поверхности, полученная клеточная суспензия является гетерогенной. Для того чтобы эта неравномерная подвеска была точно перечислена, она должна быть дезагрегирована на отдельные ячейки. Количество жизнеспособных пластин предполагает, что колониеобразующая единица происходит от одной бактерии. Если на питательную среду поместить агрегаты биопленки, невозможно различить отдельные клетки, что может привести к неточным оценкам. Например, во время тестирования эффективности дезинфицирующих средств, если обработка очень эффективно удаляет биопленку с поверхности по сравнению с контролем, уменьшение бревна может показаться искусственно большим по сравнению с контролем. С другой стороны, химическое дезинфицирующее средство, которое фиксирует биопленку на поверхности по сравнению с контролем, будет иметь более низкое сокращение log11. Такой сценарий может привести к предвзятой интерпретации экспериментальных данных.
В ходе подготовки к публикации обзор литературы определил, что общие подходы к сбору и дезагрегированию биопленки включают соскоб, мазок, обработку ультразвуком, вихрь или их комбинацию. Соскоб определяется как физическое удаление биопленки с поверхностей стерильной палочкой, шпателем или другим инструментом. Тампонирование относится к удалению биопленки с поверхностей с помощью палочки с хлопковым наконечником или другого неподвижного абсорбирующего материала. Обработка ультразвуком относится к разрушению биопленки с поверхностей с помощью ультразвуковых волн, распространяемых через воду. Вихрь относится к использованию смесителя для достижения жидкого вихря образца внутри трубки. Гомогенизация использует вращающиеся лопасти для сдвига собранных сгустков биопленки в одну клеточную суспензию. В этой статье мы представляем три метода сбора и дезагрегирования для двух различных типов поверхностей: твердых/непористых и пористых.
Приведен перечень рекомендуемой минимальной информации, которую исследователи должны включать в разделы методов публикаций. Мы надеемся, что включение этой информации позволит другим исследователям воспроизвести свою работу. Идеального метода сбора и дезагрегирования не существует, поэтому также даются рекомендации по проверке техники.
В этой статье демонстрируются три распространенных метода сбора и дезагрегирования биопленки из общих поверхностей роста. Эта информация позволит исследователям лучше понять общую точность и предвзятость метода тестирования биопленки. Описаны следующие способы: (1) Биопленка Pseudomonas aeruginosa , выращенная на поликарбонатных купонах (твердая непористая поверхность) под высоким сдвигом жидкости в реакторе биопленки CDC, собирается и дезагрегируется после пятиступенчатой комбинации вихрей и обработки ультразвуком для достижения сбора и дезагрегирования биопленки (2) A P. aeruginosa биопленка, выращенная на купонах боросиликатного стекла (твердая непористая поверхность) в реакторе капельного потока при низком сдвиге жидкости, собирается и дезагрегируется с использованием соскоба и гомогенизации (3) Биопленка Escherichia coli , выращенная в силиконовых трубках (пористая поверхность), собирается и дезагрегируется с использованием соскоба, с последующим ультразвуком и вихрем.
протокол
1. Вихрь и обработка ультразвуком
- Вырастите зрелую биопленку P. aeruginosa ATCC 15442, выращенную в соответствии со стандартом ASTM E25622.
- В конце 48-часового периода роста подготовьтесь к обработке биопленки и пробных купонов в соответствии со стандартом ASTM E28718
- Асептически вставьте автоклавные брызговики в стерильные конические трубки объемом 50 мл с помощью пламенно-стерилизованных щипцов. Повторить для всех трубок, которые будут получать лечение. Трубки для управления купонами не нуждаются в брызговике.
- Асептически извлеките случайно выбранный стержень из биопленочного реактора CDC. Промойте купоны, чтобы удалить слабо прикрепленные ячейки, осторожно окунув стержень в 30 мл стерильной буферной воды.
- Держите стержень параллельно столешнице, над пустой, стерильной конической трубкой объемом 50 мл и, используя огненно стерилизованный гаечный ключ Allen, ослабьте установленный винт, чтобы бросить купон с биопленочным покрытием в трубку. Повторите для нужного количества купонов. Снимите брызговики и поместите в отдельный контейнер для стерилизации.
- Используя серологическую пипетку 5 мл, медленно пипетку 4 мл обработки или контроля в трубки, чтобы жидкость стекала по внутренней части стенки трубки.
- Осторожно постучите по дну трубки так, чтобы любые пузырьки воздуха под купоном были смещены. Позвольте 30 - 60 с между каждым добавлением.
- В конце указанного времени контакта пипетка 36 мл нейтрализатора попадает в пробирки в том же порядке, в котором применялась обработка (или контроль).
ПРИМЕЧАНИЕ: Конечный объем комбинированной обработки и нейтрализатора важен для точного определения плотности бревна биопленки. - Вихрь каждой трубки на самом высоком уровне в течение 30 ± 5 с. Убедитесь, что достигнут полный вихрь.
ПРИМЕЧАНИЕ: Следует соблюдать осторожность при вихре тяжелых купонов, таких как нержавеющая сталь, в стеклянных флаконах, где может произойти поломка. - Определите оптимальное количество пробирок на ванну и размещение в стойке для пробирок до обработки фактических образцов. При обработке нескольких образцов подтвердите, что температура воды в ванне с ультразвуком составляет 21 ± 2 oC.
- Поместите трубки в трубчатую стойку, подвешенную в дегазированном ультразвуковом аппарате таким образом, чтобы уровень воды в ванне был равен уровню жидкости в трубках. Ультразвук при 45 кГц, 100% мощности и нормальной функции в течение 30 ± 5 с. Повторите циклы вихря и обработки ультразвуком, а затем закончите последним вихрем (всего 5 циклов).
ПРИМЕЧАНИЕ: Эти пробирки с собранной и дезагрегированной биопленкой представляют собой 100 или 0 разбавления. - Последовательно разбавляйте образец в буферной воде. Пластина на агаре R2A с использованием соответствующего метода покрытия. Инкубировать при 36 ± 2 oC в течение 24 ч. Подсчитывайте колонии в соответствии с используемым методом покрытия и записывайте данные.
2. Выскабливание и гомогенизация
- Вырастите зрелую биопленку P. aeruginosa ATCC 15442 в соответствии со стандартом ASTM E264713.
- Настройте станцию отбора проб, чтобы включить в нее плату для отбора проб, 95% этанол в стакане, спиртовую горелку, гемостаты, инструмент для удаления купонов, стаканы со стерильной разбавленной водой и разбавляющие трубки для промывки купонов.
- Выключите насос. Снимите крышку канала и используйте стерильный инструмент для удаления купона и гемостаты, чтобы удалить купон, стараясь не потревожить биопленку.
- Промойте купон, осторожно погружая движением жидкости в 45 мл стерильной разбавляющей воды (содержащейся в 50 мл центрифужной трубки). Немедленно отмените движение, чтобы удалить купон.
- Поместите купон в стакан, содержащий 45 мл стерильной разбавляющей воды. Соскоблите покрытую биопленкой поверхность купона в направлении вниз в течение примерно 15 с, используя стерильный шпатель или скребок. Промойте шпатель или скребок, перемешав его в стакане. Повторите процесс выскабливания и промывки 3-4 раза, обеспечив полное покрытие поверхности купона.
- Промойте купон, удерживая его под углом 60° над стерильным стаканом и пипеткой 1 мл стерильной разбавляющей воды над поверхностью купона. Повторите в общей сложности 5 полосканий. Конечный объем в стакане составляет 50 мл.
ПРИМЕЧАНИЕ: Конечный объем комбинированной обработки и нейтрализатора важен для точного определения плотности бревна биопленки. - Замените каждую крышку канала по мере удаления купонов.
- Работая в шкафу биобезопасности, гомогенизируйте соскобленный образец биопленки. Прикрепите к гомогенизатору стерильный гомогенизатор, поместите наконечник зонда в жидкость, включите гомогенизатор и увеличьте до 20 500 оборотов в минуту.
- Гомогенизируйте образец в течение 30 с. Выключите обороты и выключите гомогенизатор.
- Дезинфицируйте зонд между образцами биопленки путем гомогенизации 9 мл стерильной заготовки для разбавления при 20 500 об/мин в течение 30 с, как описано выше. Гомогенизируйте 9 мл пробирки 70% этанола в течение 30 с, отсоедините зонд и оставьте в этанольной трубке в течение 1 мин. Гомогенизируйте две дополнительные заготовки для разбавления.
ПРИМЕЧАНИЕ: Для каждого образца может использоваться одноразовый гомогенизаторный зонд. - Последовательно разбавляйте образцы в буферной воде. Пластина на агар R2A с использованием соответствующего метода покрытия. Инкубируйте пластины при 36 ± 2oC в течение 24 ч, подсчитывайте колонии в соответствии с используемым методом покрытия и записывайте данные.
3. Выскабливание, вихрь и обработка ультразвуком
- Вырастите зрелую биопленку Escherichia coli ATCC 53498 в силиконовой катетерной трубке10.
- Подготовьте образцы материалов: промывные трубки, стерильную центрифужную трубку, пустую стерильную чашку Петри, гемостат и ножницы из нержавеющей стали, таймер и линейку.
- Когда насос приостановлен, используйте 70% этанола для очистки внешней стороны трубки. Измерьте 2 см от конца, избегая области, прикрепленной к разъему, и отметьте трубку, чтобы определить места резки.
- Стерилизованными ножницами нарежьте трубку на отметке 2 см и поместите сегмент в пустую стерильную чашку Петри. Протрите трубку 70% этанолом и снова подключите дистальный конец к отработанной трубке.
- Промыть сегмент трубки для удаления планктонных клеток. С помощью пламенных стерилизованных щипцов аккуратно погрузить сегмент трубки в 20 мл стерильной разбавленной воды, а затем немедленно удалить. Поместите сегмент в 10 мл нейтрализатора.
- С помощью пламенных стерилизованных щипцов удерживайте сегмент трубки и соскребайте стерильной деревянной палочкой аппликатора до тех пор, пока все внутренние участки трубки не будут соскоблены. Время от времени промывайте палочку в 10 мл нейтрализатора и поместите сегмент обратно в пробирку. Сегмент скребковых труб представляет собой разбавление 100 или 0.
ПРИМЕЧАНИЕ: Конечный объем комбинированной обработки и нейтрализатора важен для точного определения плотности бревна биопленки. - Вихрь каждой трубки на самом высоком уровне в течение 30 ± 5 с. Поместите трубку в трубчатую стойку, подвешенную в ультразвуковом аппарате, так, чтобы уровень воды в ванне был равен уровню жидкости в трубках. Обработка ультразвуком на частоте 45 кГц, 100% мощность и нормальная функция в течение 30 ± 5 секунд. Повторите циклы вихря и обработки ультразвуком, а затем закончите последним вихрем.
ПРИМЕЧАНИЕ: Эта трубка с собранной и дезагрегированной биопленкой представляет собой 100 разбавление. - Последовательно разбавляйте образцы в буферной воде. Тарелка на триптическом соевом агаре используется с использованием соответствующего метода покрытия.
- Инкубировать пластины при 36 ± 2 oC в течение 24 ч. Подсчитывайте колонии в соответствии с используемым методом покрытия, записывайте данные и вычисляйте среднее арифметическое.
Результаты
Валидация/подтверждение метода сбора урожая
В нескольких исследованиях, которые были проведены в нашей лаборатории, изучалась способность вихрей и обработки ультразвуком эффективно собирать биопленку, выращенную в реакторе биопленки (ASTM E2562)2 с использованием однотрубного метода (ASTM E2871)8.
Биопленка P. aeruginosa ATCC 15442 была выращена в соответствии с ASTM E25622 на купонах из боросиликатного стекла. Через 48 часов четыре купона помещали во флаконы, «обрабатывали» стерильной буферной водой объемом 4 мл и нейтрализовали 36 мл 2x D/E нейтрализующего бульона. Первоначальная настройка обработки ультразвуком 45 кГц, мощность 10%, настройка Sweep, 30 ± 5 с использовалась для сбора и дезагрегирования биопленки из трех из четырех купонов. По завершении цикла вихрей и обработки ультразвуком каждый купон окрашивался кристаллическим фиолетовым цветом и фотографировался. На рисунке 1 показано количество биопленки, оставшейся на трех купонах после вихрей и обработки ультразвуком, по сравнению с контролем.
Чтобы проверить это дальше, биопленку P. aeruginosa ATCC 15442 выращивали, как описано ранее, и сравнивали две настройки обработки ультразвуком: 1) 45 кГц, мощность 10%, настройка sweep, 30 ± 5 секунд и 2) 45 кГц, 100% мощность, нормальная настройка, 30 ± 5 секунд. Один купон из каждого набора из трех был окрашен пятном BacLight Live/Dead и изображен с помощью конфокальной микроскопии (CM). Оставшиеся два купона из каждого набора были разбавлены, покрыты и перечислены для жизнеспособных ячеек. Жизнеспособными результатами подсчета пластин были 9,230 Log10 CFU / купон ± 0,007 (SD_R) для установки 1 и 9,272 Log10 CFU / купон ± 0,066 (SD_R) для установки ультразвука 2. Эти данные подтвердили совместное исследование EPA по методу одной трубы 2015 года, в котором было достигнуто 9,03 Log10 CFU / купон ± 0,272 (SD_R)9. Судя по количеству жизнеспособных пластин, все три средства достаточно похожи, чтобы не оправдывать дальнейшего изучения различий между двумя методами сбора урожая. Однако микроскопические изображения, показанные на фиг.2, могут свидетельствовать о том, что после использования установки 1 осталось больше биопленки, чем установки 2. Хотя мы наблюдаем, что биопленка, оставшаяся на купонах, кажется мертвой (красного цвета), интерпретация жизнеспособности при использовании пятна BacLight Live/Dead затруднена14,15. Вместо того, чтобы сосредоточиться на последствиях жизнеспособности окрашенной биопленки, мы использовали это пятно для визуализации биопленки, остающейся на поверхностях. Кроме того, хотя мы признаем, что обработка ультразвуком может быть вредной для жизнеспособности бактерий, публикация 2007 года Kobayashi et al.16 продемонстрировала, что увеличение времени обработки ультразвуком более 5 минут привело к снижению количества жизнеспособных пластин. Поскольку в нашем исследовании использовалась в общей сложности 1-минутная обработка ультразвуком, мы уверены, что несколько клеток были убиты с помощью обработки ультразвуком, как показано >9,2 LOG10 КОЕ / купоны для двух параметров обработки ультразвуком. Интересно, что полный сбор биопленки с поверхности не был достигнут ни одним из методов. Этот вывод показывает, что одного лишь жизнеспособного количества пластин недостаточно для определения смещения сбора урожая и дезагрегирования и поэтому должно сочетаться с дополнительным методом, например, микроскопией.
В дополнение к настройкам ультразвука, мы исследовали другие важные факторы, которые влияют на обработку ультразвуком. К ним относятся объем жидкости во флаконах (10 или 40 мл), тип жидкости во флаконе (буферная вода или 2X D/E нейтрализующий бульон) и количество флаконов, помещенных в ванну одновременно (3 или 12 флаконов)9.
Биопленки P. aeruginosa на купонах реактора CDC Biofilm были обработаны ультразвуком с использованием установки ультразвука 2 (45 кГц, 100% мощность, нормальная настройка, 30 ± 5 секунд). Все образцы были вихревыми либо по 3 за раз, либо по 6 за раз с использованием вихревого вихря, оснащенного 6-х местом трубчатого крепления, а затем обрабатывают ультразвуком, как описано на рисунке 3. Один купон из каждой из следующих категорий был изображен с помощью CM (рисунок 3).
Во втором исследовании, где были исследованы параметры обработки ультразвуком, микроскопические изображения (рисунок 3) показывают, что минимизация объема в пробирках, уменьшение количества пробирок, обработанных одновременно, и использование нейтрализующего бульона D / E (который содержит поверхностно-активное вещество) способствуют улучшению сбора биопленки из купонов.
Биоциды могут положительно или отрицательно улучшать сбор и дезагрегацию. Подобно подтверждению того, что нейтрализатор эффективно останавливает актив, не увеличивая при этом убой до проведения теста на эффективность, важно подтвердить, что биоцид не оказывает дифференцированного воздействия на сбор и дезагрегацию. Для тестирования эффективности предвзятость приводится тогда и только тогда, когда имеет место дифференциальное удаление для контрольного контроля по сравнению с обработанными образцами биопленки11.

Рисунок 1: Фотографии купонов, окрашенных кристаллическим фиолетовым цветом, демонстрирующие остаточную биопленку. А) Купон снимается с реактора и окрашивается кристаллическим фиолетовым цветом. B, C, D) Три реплицированных купона были отдельно «обработаны» стерильной буферной водой, а затем нейтрализованы. Для сбора урожая и дезагрегирования купоны были вихревыми (30 ± 5 секунд) и обработанными ультразвуком (45 кГц, мощность 10%, настройка Sweep, 30 ± 5 секунд) дважды, а затем получили окончательный вихрь. Изображения любезно предоставлены Даниэль Орр и Блейном Фрицем. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
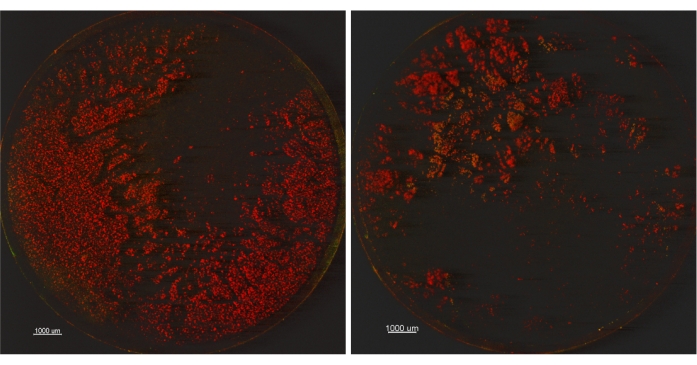
Рисунок 2: Конфокальные микроскопические изображения купонов, сравнивающих две разные настройки обработки ультразвуком. Купоны (увеличение 12,5X) обрабатываются с помощью настройки ультразвука 1 (45 кГц, мощность 10%, настройка sweep) слева или настройка ультразвука 2 (45 кГц, 100% мощность, нормальная настройка) справа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
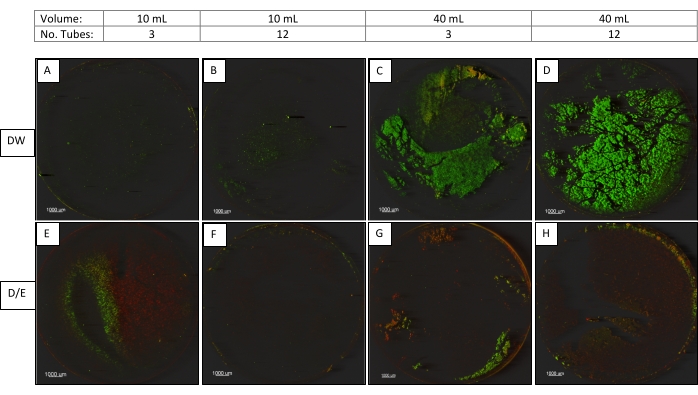
Рисунок 3. Конфокальная микроскопия изображений купонов, сравнивающих объемы, ультразвуковую жидкость и количество пробирок. Купоны (увеличение 12,5 раз), обработанные в объемах 10 или 40 мл, в разбавляющей воде (DW) или нейтрализующем бульоне D / E (D / E), 3 или 12 трубок за раз с оптимизированной настройкой ультразвука (45 кГц, 100% мощность, нормальная настройка). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Ключевые параметры, важные для сбора урожая и дезагрегирования Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Минимальная информация для методов сбора урожая и дезагрегирования
Для создания воспроизводимых данных биопленки в научном сообществе крайне важно, чтобы авторы включили как можно больше деталей относительно каждого из этапов роста, обработки, отбора проб и анализа метода биопленки. Стандартизация методов биопленки помогла в этом начинании, поскольку она позволяет исследователю ссылаться на конкретный метод и любые соответствующие модификации. Тем не менее, многие статьи включают только одно или два предложения для описания сбора и дезагрегирования биопленки. Для лучшей воспроизводимости мы рекомендуем включать в публикации минимальную информацию о сборе биопленки. Это основано на инициативе «Минимальная информация об эксперименте с биопленкой» (MIABiE), представленной Lourenco et al.17. В случае использования ультразвука для сбора и дезагрегирования биопленки информация должна включать: положение труб внутри ванны (рекомендации производителей, чтобы избежать повреждения преобразователей), количество трубок, обработанных ультразвуком одновременно, материал трубки, объем и тип жидкости в трубке, наличие поверхностно-активного вещества, положение жидкости в трубках относительно уровня жидкости ультразвуковой ванны, устройство, используемое для удержания трубок в ванне (стеклянные стаканы против стойки пробирки), дегазации водяной бани перед обработкой образцами ультразвуком (если дегазация не является вариантом производителя, простая работа ванны перед вставкой образцов поможет удалить некоторые растворенные газы из жидкости ванны), температура водяной бани (температура может повышаться после длительных периодов обработки ультразвуком), частота (например, 25 кГц или 45 кГц), функция ванны (например, развертка или нормальная) и диапазон мощности, подаваемой на преобразователи (10 - 100%, например). Эти настройки должны быть оптимизированы для изучаемой биопленки, системы, используемой для выращивания биопленки, и конкретной марки/модели ультразвуковой ванны18.
Настройки sonicator могут быть изменены для оптимизации желаемых эффектов сбора урожая. Дегазация удаляет растворенный воздух в жидкости ванны, тем самым повышая очищающую способность. Частота может быть отрегулирована на низкую или высокую настройку. Например, низкая настройка, такая как 25 кГц, поможет в сборе цепких образцов, в то время как более высокая настройка 45 кГц будет более подходящей для чувствительных образцов. Функция ванны развертки или нормы позволяет распределить кавитацию. Функция развертки создает непрерывное смещение максимумов звукового давления. Нормальная функция позволяет преобразователям работать в режиме двойной полуволны, что может привести к мертвым зонам, тем самым делая обработку ультразвуком менее эффективной. Диапазоны мощности могут быть изменены от 10 до 100% мощности, подаваемой на преобразователи19. Известно, что обработка ультразвуком может пагубно влиять на жизнеспособность бактерий. Исследование 2008 года Stamper et al.20 подвергло бактериальные культуры увеличению энергии ультрасониса с течением времени для создания кривых уничтожения бактерий. Мы рекомендуем пользователям подтвердить, что определенная комбинация настроек обработки ультразвуком не вызывает снижения жизнеспособных бактерий20.
Не существует единого идеального метода сбора и дезагрегирования биопленки, но конкретные методы работают лучше для некоторых комбинаций поверхностей / микробов, чем для других. Мы выступаем за то, чтобы читатель определил, какие параметры важны для их конкретного сценария биопленки. Ключевые параметры, имеющие важное значение для сбора урожая и дезагрегирования, включены в Дополнительный файл 1.
Для исследований по обработке ультразвуком, проведенных для оценки смещения сбора и дезагрегирования, мы обнаружили, что обработка ультразвуком удобна, эффективна и может быть стандартизирована для сбора и дезагрегирования биопленки с поверхностей. Размещение купонов во флаконах сводит к минимуму изменчивость между техническими специалистами, которая может возникнуть при методах, когда купоны физически соскребаются лабораторным персоналом, например. Хотя кажется достаточно простым поместить флаконы на ванну с ультразвуковой водой, есть много параметров, которые необходимо учитывать для достижения оптимального сбора биопленки.
Доступны два типа оборудования для обработки ультразвуком: ультразвуковые ванны и ультразвуковые зонды. В данной работе основное внимание уделяется ультразвуковым ваннам, где ультразвуковая энергия генерируется в диапазоне от высокой (20 - 45 кГц) до нормальной (40 - 60 Гц) частоты.
Три основных процесса играют роль при использовании ультразвукового устройства для очистки поверхности. Электрическая энергия преобразуется в акустическую энергию, когда ток высокой частоты посылается на пьезоэлектрический или магнитострикционный преобразователь, который колеблется в ответ на ток. Колебание генерирует волны сжатия (разрежения) в жидкости. Кавитационные пузырьки образуются из-за отрицательного давления при разрежении. Пузырьки растут до тех пор, пока не достигнут нестабильного размера и не коллапсируют, создавая струю воды, которая очищает поверхности21.
В этой статье демонстрируются три подхода к сбору и дезагрегации: методы обработки ультразвуком и вихрей для сбора и дезагрегирования биопленки при выращивании на поликарбонатных купонах в реакторе CDC Biofilm в соответствии с однотрубным методом. Показаны методы выскабливания и гомогенизации для сбора и дезагрегирования биопленки при выращивании на стеклянных купонах с использованием реактора капельной биопленки. Методы выскабливания, обработки ультразвуком и вихря для сбора и дезагрегирования биопленки показаны при выращивании в силиконовых трубках.
Не существует идеального метода сбора и дезагрегирования биопленки, но некоторые подходы лучше подходят для различных поверхностей и / или применений. Важно потратить время на проверку используемого метода. В этой статье мы обсудили использование кристаллической фиолетовой и микроскопии, но существуют и другие варианты в зависимости от требуемой чувствительности. Если исследования включают тестирование эффективности, то крайне важно подтвердить обоснованность подхода в присутствии противомикробного препарата6. Все оборудование немного отличается, поэтому, даже если метод сбора и дезагрегирования был стандартизирован, все равно разумно подтвердить процесс для используемого оборудования. Методы сбора и дезагрегирования специфичны для бактерий, связанных с поверхностью, и биопленочных бактерий. Исследования показали, что неправильный выбор может привести к предвзятым результатам испытаний. Тем не менее, сбор и дезагрегирование являются наименее изученными из четырех этапов в методах биопленки. Как правило, это также непроверенный шаг (принимаемый как само собой разумеющееся как рабочий) с наименьшей информацией, присутствующей в опубликованной статье, что затрудняет воспроизведение процесса в другой лаборатории. В этом документе и сопроводительном видео показаны три общих подхода для двух типов поверхностей и предложено, как проверить метод для отдельной лаборатории. Эта информация поможет исследователям принимать более обоснованные решения о том, какой метод использовать, и предоставит рекомендации о том, что сообщать для улучшения воспроизводимости.
Раскрытие информации
Авторы не раскрывают информацию.
Благодарности
Мы хотели бы выразить признательность Даниэль Орр Говейя, Блейну Фрицу, Дженнифер Саммерс и Фэй Сан Ли за их вклад в подготовку настоящего документа.
Материалы
| Name | Company | Catalog Number | Comments |
| 50 mL conical vials | Thermo Scientific | 339652 | |
| 100 mL glass beakers | Fisher Scientific | FB102100 | |
| 5 mL serological pipettes | Fisher Scientific | 13-678-12D | For adding treatment to vials containing coupons. |
| 50 mL serological pipettes | Fisher Scientific | 13-678-14C | For adding neutralizer to vials at the end of treatment contact time. |
| Applicator sticks | Puritan | 807 | |
| Hemostats | Fisher Scientific | 16-100-115 | |
| Metal spatula | Fisher Scientific | 14-373 | |
| PTFE policemen | Saint-Gobain | 06369-04 | |
| S 10 N - 10 G - ST Dispersing tool | IKA | 4446700 | For homogenization of biofilm samples. |
| Scissors | Fisher Scientific | 08-951-20 | |
| Silicone Foley catheter, size 16 French | Medline Industries | DYND11502 | |
| Silicone tubing, size 16 | Cole-Parmer | EW96400-16 | |
| Splash Guards | BioSurface Technologies, Inc. | CBR 2232 | |
| T 10 basic ULTRA-TURRAX Disperser | IKA | 3737001 | For homogenization of biofilm samples. |
| Tubing connectors | Cole-Parmer | EW02023-86 | |
| Ultrasonic Cleaner | Elma | TI-H15 | |
| Vortex-Genie 2 | Scientific Industries | SI-0236 | |
| Vortex-Genie 2 Vertical 50 mL Tube Holder | Scientific Industries | SI-V506 |
Ссылки
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerging Infectious Diseases. 8 (9), 881-890 (2002).
- ASTM International. ASTM Standard E2562, 2017, Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown with High Shear and Continuous Flow using CDC Biofilm Reactor. ASTM International. , (2017).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews In Microbiology. 43 (3), 313-351 (2017).
- Gomes, I. B., et al. Standardized reactors for the study of medical biofilms: a review of the principles and latest modifications. Critical Reviews in Biotechnology. 38 (5), 657-670 (2018).
- Goeres, D. M., et al., Simoes, M., et al. Design and fabrication of biofilm reactors. Recent Trends in Biofilm Sciences and Technology. , 71-88 (2020).
- Goeres, D. M., et al. A method for growing a biofilm under low shear at the air-liquid interface using the drip flow biofilm reactor. Nature Protocols. 4 (5), 783-788 (2009).
- ASTM International. ASTM Standard E2871, Standard Test Method for Determining Disinfectant Efficacy Against Biofilm Grown in the CDC Biofilm Reactor Using the Single Tube Method. ASTM International. , (2019).
- Goeres, D. M., et al. Validation of a Biofilm Efficacy Test: The Single Tube Method. Journal of Microbiological Methods. , (2019).
- The development and validation of a standard in vitro method to evaluate the efficacy of surface modified urinary catheters. Theses and Dissertations at Montana State University Available from: https://scholarworks.montana.edu/xmlui/handle/1/15149 (2019)
- Hamilton, M. A., Buckingham-Meyer, K., Goeres, D. M. Checking the Validity of the harvesting and Disaggregating Steps in Laboratory Tests of Surface Disinfectants. Journal of AOAC International. 92 (6), 1755-1762 (2009).
- Conlon, B. P., Rowe, S. E., Lewis, K., Donelli, G. Persister Cells in Biofilm Associated Infections. Biofilm-based Healthcare-associated Infections. , (2015).
- ASTM International. ASTM Standard E2647, Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown Using Drip Flow Biofilm Reactor with Low Shear and Continuous Flow. ASTM International. , (2020).
- Rosenberg, M., Azevedo, N., Ivask, A. Propidium iodide staining underestimates viability of adherent bacterial cells. Scientific Reports. , (2019).
- Stiefel, P., Schmidt-Emrich, S., Manuira-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. , (2015).
- Kobayashi, N., Bauer, T. W., Tuohy, M. J., Fujishiro, T., Procop, G. W. Brief Ultrasonication Improves Detection of Biofilm-formative Bacteria Around a Metal Implant. Clinical Orthopaedics and Related Research. 457, 210-213 (2007).
- Lourenco, A., et al. Minimum information about a biofilm experiment (MIABiE), standards for reporting experiments and data on sessile microbial communities living at interfaces. Pathogens and Disease. , 1-7 (2014).
- Nascentes, C. C., Korn, M., Sousa, C. S., Arruda, M. A. Z. Use of Ultrasonic Baths for Analytical Applications: A New Approach for Optimisation Conditions. Journal of Brazilian Chemical Society. 12 (1), 57-63 (2001).
- Elma GmbH & Co. KG TI-H Ultrasonic Cleaning Units: Operating Instructions. Elma GmbH & Co. , (2009).
- Stamper, D. M., Holm, E. R., Brizzolara, R. A. Exposure times and energy densities for ultrasonic disinfection of Escherichia coli, Pseudomonas aeruginosa, Enterococcus avium and sewage. Journal of Environmental Engineering and Science. 7 (2), 139-146 (2008).
- Suslick, K. S. Sonochemistry. Science. 247 (4949), (1990).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены