Method Article
Ernte und Disaggregation: Ein übersehener Schritt in der Erforschung von Biofilmmethoden
In diesem Artikel
Zusammenfassung
Dieses Papier beschreibt Methoden, die drei gängige Biofilmernte- und Disaggregationstechniken auf zwei Oberflächentypen demonstrieren, Robustheitstests einer Erntemethode und Mindestinformationen, die bei der Auswahl und Optimierung von Ernte- und Disaggregationstechniken zur Erhöhung der Reproduzierbarkeit zu berücksichtigen sind.
Zusammenfassung
Biofilmmethoden bestehen aus vier verschiedenen Schritten: Züchtung des Biofilms in einem relevanten Modell, Behandlung des reifen Biofilms, Ernte des Biofilms von der Oberfläche und Disaggregation der Klumpen und Analyse der Probe. Von den vier Schritten sind Ernte und Disaggregation die am wenigsten untersuchten, aber dennoch kritisch, wenn man das Potenzial für Testverzerrungen berücksichtigt. Dieser Artikel demonstriert häufig verwendete Ernte- und Disaggregationstechniken für Biofilme, die auf drei verschiedenen Oberflächen gezüchtet werden. Die drei Biofilmernte- und Disaggregationstechniken, die aus einer umfangreichen Literaturrecherche stammen, umfassen Vortexing und Beschallung, Scraping und Homogenisierung sowie Scraping, Vortexing und Beschallung. Es werden zwei Oberflächentypen berücksichtigt: hartes, nicht poröses (Polycarbonat und Borosilikatglas) und poröses (Silikon). Darüber hinaus geben wir Empfehlungen für die Mindestinformationen, die bei der Berichterstattung über die befolgte Erntetechnik enthalten sein sollten, sowie eine begleitende Methode zur Überprüfung auf Verzerrungen.
Einleitung
Die Definition von Biofilm hat sich in den letzten Jahrzehnten weiterentwickelt und umfasst die mikrobielle Assoziation mit einer Vielzahl von biologischen und/oder nicht-biologischen Oberflächen, einschließlich nichtzellulärer Komponenten1, die ein unterschiedliches Wachstum und eine unterschiedliche genetische Expression2 innerhalb einer Matrix aufweisen. Biofilm bietet Schutz vor Umweltbelastungen wie Trocknung und kann die Wirkung chemischer Desinfektionsmittel weniger wirksam machen, was zum Überleben von Mikroben führt. Die Überlebenden in einem Biofilm können möglicherweise eine Quelle für pathogene Mikroorganismen darstellen, die ein Problem für die öffentliche Gesundheit darstellen3.
Biofilmmethoden bestehen aus vier Schritten: Wachstum, Behandlung, Probenahme (Ernte und Disaggregation) und Analyse. Das Wachstum, der erste Schritt, bei dem der Benutzer die Wachstumsbedingungen, die Temperatur, die Medien usw. des Organismus bestimmt, wird in der Biofilmliteratur am meisten berücksichtigt und berichtet4,5,6,7. Der Behandlungsschritt bewertet antimikrobielle Mittel (z. B. Desinfektionsmittel), um ihre Wirksamkeit entweder gegen einen reifen Biofilm3,8,9 zu bestimmen, oder das antimikrobielle Mittel kann in die Oberfläche eingearbeitet werden, um die Fähigkeit des Produkts zu bestimmen, das Wachstum von Biofilmen zu verhindern oder zu reduzieren10. Der dritte Schritt, die Probenahme, umfasst Schritte zur Ernte des Biofilms von der Oberfläche, auf der er wuchs, und zur Disaggregation der entfernten Klumpen3,8,11. Der vierte Schritt, die Analyse, kann lebensfähige Zellzahlen, Mikroskopie, Fluoreszenzmessungen, molekulare Ergebnisse und/oder eine Matrixkomponentenbewertung umfassen8,9. Die Auswertung der Daten gibt Aufschluss über das Ergebnis eines Experiments. Von den vier ist die Probenahme oft der am meisten übersehene Schritt, da davon ausgegangen wird, dass die gewählte Biofilmernte- und / oder Disaggregationstechnik zu 100% wirksam ist, oft ohne Überprüfung11.
Planktonische Suspensionen von Bakterien, die oft als homogen angesehen werden, erfordern vor der Analyse eine einfache Wirbelung. Biofilme sind jedoch komplexe Gemeinschaften, die aus Mikroorganismen (prokaryotisch und/oder eukaryotisch), Exopolysacchariden, Proteinen, Lipiden, extrazellulärer DNA und Wirtszellen bestehen12. Schritte über traditionelle planktonische mikrobiologische Kulturmethoden hinaus sind erforderlich, um Biofilm von einer Oberfläche adäquat zu ernten und dann in eine homogene Einzelzellsuspension zu disaggregieren. Eine umfangreiche Literaturrecherche (Informationen, die nicht in dieser Veröffentlichung enthalten sind) zeigte, dass die Wahl der Entfernungs- und Disaggregationstechnik von einer Reihe von Faktoren abhängt, einschließlich der im Biofilm vorhandenen Arten, der Oberfläche, an der der Biofilm befestigt ist (nicht porös oder porös), der Zugänglichkeit zu Wachstumsoberflächen (leicht entfernbarer Gutschein oder physische Zerstörung der Vorrichtung, in der der Biofilm wächst), Oberflächengeometrie (Fläche und Form), Dichte des Biofilms auf Wachstumsflächen und verfügbare Laborgeräte.
Wenn Biofilm von einer Oberfläche geerntet wird, ist die resultierende Zellsuspension heterogen. Soll diese ungleichmäßige Suspension genau aufgezählt werden, muss sie in einzelne Zellen disaggregiert werden. Lebensfähige Plattenzählungen gehen davon aus, dass eine koloniebildende Einheit aus einem Bakterium stammt. Wenn Aggregate von Biofilm auf dem Wachstumsmedium platziert werden, ist es unmöglich, einzelne Zellen zu unterscheiden, was zu ungenauen Schätzungen führen könnte. Wenn beispielsweise während der desinfizierenden Wirksamkeitsprüfung der Behandlung der Biofilm im Vergleich zur Kontrolle sehr effektiv von einer Oberfläche entfernt wird, könnte die logarithmische Reduktion im Vergleich zur Kontrolle künstlich groß erscheinen. Auf der anderen Seite scheint ein chemisches Desinfektionsmittel, das Biofilm auf einer Oberfläche fixiert, im Vergleich zur Kontrolle eine geringere Log-Reduktion zu haben11. Diese Art von Szenario könnte zu einer verzerrten Interpretation experimenteller Daten führen.
In Vorbereitung auf die Veröffentlichung wurde in einer Literaturübersicht festgestellt, dass gängige Ansätze zur Ernte und Disaggregation von Biofilmen Scraping, Swabbing, Beschallung, Vortexing oder eine Kombination davon umfassen. Scraping ist definiert als die physikalische Entfernung von Biofilm von Oberflächen mit einem sterilen Stab, Spatel oder einem anderen Werkzeug. Tupfen bezieht sich auf das Entfernen von Biofilm von Oberflächen mit einem Baumwollstab oder einem anderen festen saugfähigen Material. Beschallung bezieht sich auf die Störung des Biofilms von Oberflächen durch Ultraschallwellen, die durch Wasser verteilt werden. Vortexing bezieht sich auf die Verwendung eines Mischers, um einen flüssigen Wirbel der Probe in einem Rohr zu erreichen. Bei der Homogenisierung werden rotierende Schaufeln verwendet, um geerntete Biofilmklumpen in eine Einzelzellsuspension zu scheren. In diesem Artikel stellen wir drei Ernte- und Disaggregationsmethoden für zwei verschiedene Oberflächentypen vor, hart/porös und porös.
Eine Liste der empfohlenen Mindestinformationen, die Forscher in die Methodenabschnitte von Publikationen aufnehmen sollten, wird bereitgestellt. Wir hoffen, dass die Einbeziehung dieser Informationen es anderen Forschern ermöglicht, ihre Arbeit zu reproduzieren. Es gibt keine perfekte Ernte- und Disaggregationsmethode, daher werden auch Empfehlungen zur Überprüfung der Technik gegeben.
Drei gängige Methoden zur Ernte und Disaggregation von Biofilmen von gemeinsamen Wachstumsoberflächen werden in diesem Artikel demonstriert. Diese Informationen werden es den Forschern ermöglichen, die Gesamtpräzision und -verzerrung einer Biofilmtestmethode besser zu verstehen. Die beschriebenen Methoden sind wie folgt: (1) Ein Pseudomonas aeruginosa-Biofilm , der auf Polycarbonat-Kupons (harte, nicht poröse Oberfläche) unter hoher Flüssigkeitsscherung im CDC-Biofilmreaktor gezüchtet wird, wird nach einer fünfstufigen Kombination von Vortexing und Beschallung geerntet und disaggregiert, um Biofilmernte und -disaggregation zu erreichen (2) A P. aeruginosa Biofilm, der auf Borosilikatglas-Coupons (harte, nicht poröse Oberfläche) im Tropfstromreaktor unter geringer Flüssigkeitsscherung gezüchtet wird, wird durch Schaben und Homogenisierung geerntet und disaggregiert (3) Ein Escherichia coli-Biofilm , der in Silikonschläuchen (poröse Oberfläche) gezüchtet wird, wird geerntet und durch Schaben disaggregiert, gefolgt von Beschallung und Vortexing.
Protokoll
1. Vortexing und Beschallung
- Züchten Sie einen reifen P. aeruginosa ATCC 15442 Biofilm, der gemäß ASTM-Standard E25622 angebaut wird.
- Bereiten Sie am Ende der 48-stündigen Wachstumsperiode die Behandlung des Biofilms und der Probencoupons gemäß ASTM-Standard E28718 vor
- Aseptisch führen Sie autoklavierte Spritzschutzvorrichtungen mit flammensterilisierten Pinzetten in sterile konische 50-ml-Schläuche ein. Wiederholen Sie dies für alle Tuben, die behandelt werden. Rohre für Steuercoupons benötigen keinen Spritzschutz.
- Entfernen Sie aseptisch einen zufällig ausgewählten Stab aus dem CDC Biofilm Reactor. Spülen Sie Coupons, um lose gebundene Zellen zu entfernen, indem Sie den Stab vorsichtig in 30 ml steriles gepuffertes Wasser tauchen.
- Halten Sie die Stange parallel zur Tischplatte, über ein leeres, steriles konisches 50-ml-Rohr und lösen Sie mit einem flammensterilisierten Inbusschlüssel die Stellschraube, um einen biofilmbeschichteten Coupon in das Rohr fallen zu lassen. Wiederholen Sie den Vorgang für die gewünschte Anzahl von Gutscheinen. Entfernen Sie den Spritzschutz und legen Sie ihn zur Sterilisation in einen separaten Behälter.
- Mit einer serologischen 5-ml-Pipette werden langsam 4 ml der Behandlung oder Kontrolle in die Röhrchen pipettiert, so dass die Flüssigkeit die Innenseite der Rohrwand hinunterfließt.
- Klopfen Sie vorsichtig auf den Boden des Rohres, damit Luftblasen unter dem Gutschein verdrängt werden. Erlauben Sie 30 - 60 s zwischen jeder Addition.
- Am Ende der angegebenen Kontaktzeit pipettieren Sie 36 ml Neutralisator in die Röhrchen in der gleichen Reihenfolge, in der die Behandlung (oder Kontrolle) angewendet wurde.
HINWEIS: Das endgültige Volumen der kombinierten Behandlung und des Neutralisators ist wichtig für die genaue Bestimmung der Biofilm-Log-Dichte. - Wirbeln Sie jedes Rohr auf der höchsten Stufe für 30 ± 5 s ein. Stellen Sie sicher, dass ein vollständiger Wirbel erreicht wird.
HINWEIS: Vorsicht ist geboten, wenn schwere Coupons wie Edelstahl in Glasfläschchen vorgewirbelt werden, bei denen Bruch auftreten könnte. - Bestimmen Sie die optimale Anzahl von Röhrchen pro Bad und Platzierung im Reagenzglasgestell, bevor Sie die eigentlichen Proben verarbeiten. Wenn Sie mehrere Proben verarbeiten, vergewissern Sie sich, dass die Wassertemperatur im Beschallungsbad 21 ± 2 oC beträgt.
- Platzieren Sie die Rohre im Rohrgestell, das im entgasten Ultraschallgerät aufgehängt ist, so dass der Wasserstand im Bad dem Flüssigkeitsstand in den Rohren entspricht. Beschallung bei 45 kHz, 100% Leistung und Normalfunktion für 30 ± 5 s. Wiederholen Sie Wirbel- und Beschallungszyklen und enden Sie dann mit einem endgültigen Wirbel (insgesamt 5 Zyklen).
HINWEIS: Diese Röhrchen mit dem geernteten und disaggregierten Biofilm sind die 100 oder 0 Verdünnung. - Probe in gepuffertem Wasser seriell verdünnen. Platte auf R2A-Agar mit geeigneter Beschichtungsmethode. Inkubieren bei 36 ± 2 oC für 24 h. Zählen Sie Kolonien entsprechend der verwendeten Plattierungsmethode und zeichnen Sie Daten auf.
2. Schaben und Homogenisieren
- Züchten Sie einen reifen P. aeruginosa ATCC 15442 Biofilm gemäß dem ASTM-Standard E264713.
- Richten Sie die Probenahmestation so ein, dass sie Probenahmetafel, 95% Ethanol in einem Becherglas, Alkoholbrenner, Hämostate, Coupon-Entfernungswerkzeug, Bechergläser mit sterilem Verdünnungswasser und Verdünnungsröhrchen zum Spülen der Coupons enthält.
- Schalten Sie die Pumpe aus. Entfernen Sie eine Kanalabdeckung und verwenden Sie ein steriles Coupon-Entfernungswerkzeug und Hämostate, um den Coupon zu entfernen, wobei Sie darauf achten, den Biofilm nicht zu stören.
- Spülen Sie den Coupon ab, indem Sie vorsichtig mit einer flüssigen Bewegung in 45 ml steriles Verdünnungswasser (enthalten in einem 50 ml Zentrifugenröhrchen) eintauchen. Kehren Sie die Bewegung sofort um, um den Gutschein zu entfernen.
- Legen Sie den Gutschein in ein Becherglas, das 45 ml steriles Verdünnungswasser enthält. Schaben Sie die mit Biofilm überzogene Couponoberfläche mit einem sterilen Spatel oder Schaber etwa 15 s lang nach unten. Spülen Sie den Spatel oder Schaber ab, indem Sie ihn im Becherglas umrühren. Wiederholen Sie den Schaben- und Spülvorgang 3-4 Mal, um eine vollständige Abdeckung der Couponoberfläche zu gewährleisten.
- Spülen Sie den Coupon aus, indem Sie ihn in einem Winkel von 60° über das sterile Becherglas halten und 1 ml steriles Verdünnungswasser über die Oberfläche des Coupons pipettieren. Wiederholen Sie dies für insgesamt 5 Spülungen. Das endgültige Volumen im Becherglas beträgt 50 ml.
HINWEIS: Das endgültige Volumen der kombinierten Behandlung und des Neutralisators ist wichtig für die genaue Bestimmung der Biofilm-Log-Dichte. - Ersetzen Sie jede Kanalabdeckung, wenn die Coupons entfernt werden.
- Homogenisieren Sie in der Biosicherheitskabine die geschabte Biofilmprobe. Befestigen Sie eine sterile Homogenisatorsonde am Homogenisator, legen Sie die Sondenspitze in die Flüssigkeit, schalten Sie den Homogenisator ein und fahren Sie bis zu 20.500 U / min hoch.
- Homogenisieren Sie die Probe für 30 s. Drehen Sie die Drehzahl herunter und schalten Sie den Homogenisator aus.
- Desinfizieren Sie die Sonde zwischen Biofilmproben, indem Sie einen 9 ml sterilen Verdünnungsrohling bei 20.500 U / min für 30 s wie oben beschrieben homogenisieren. Homogenisieren Sie ein 9 ml Rohr aus 70% Ethanol für 30 s, lösen Sie die Sonde und lassen Sie es 1 min im Ethanolrohr stehen. Homogenisieren Sie zwei zusätzliche Verdünnungsrohlinge.
HINWEIS: Für jede Probe kann eine Einweg-Homogenisatorsonde verwendet werden. - Verdünnen Sie die Proben seriell in gepuffertem Wasser. Platte auf R2A-Agar mit der entsprechenden Beschichtungsmethode. Inkubieren Sie Platten bei 36 ± 2oC für 24 h, zählen Sie Kolonien entsprechend der verwendeten Beschichtungsmethode und zeichnen Sie Daten auf.
3. Scraping, Vortexing und Beschallung
- Züchten Sie einen reifen Escherichia coli ATCC 53498 Biofilm in Silikonkatheterschläuchen10.
- Bereiten Sie Probenahmematerialien vor: Spülröhrchen, steriles Zentrifugenröhrchen, leere sterile Petrischale, flammensterilisierte Hämostat und Schere aus Edelstahl, Timer und Lineal.
- Wenn die Pumpe pausiert ist, verwenden Sie 70% Ethanol, um die Außenseite des Schlauches zu reinigen. Messen Sie 2 cm vom Ende aus, vermeiden Sie den am Stecker befestigten Bereich, und markieren Sie den Schlauch, um die Schnittstellen zu bestimmen.
- Schneiden Sie mit einer flammsterilisierten Schere den Schlauch auf die 2 cm Markierung und legen Sie das Segment in eine leere sterile Petrischale. Wischen Sie den Schlauch mit 70% Ethanol ab und verbinden Sie das distale Ende wieder mit Abfallschläuchen.
- Spülen Sie das Schlauchsegment, um Planktonzellen zu entfernen. Tauchen Sie mit einer flammensterilisierten Pinzette vorsichtig in 20 ml steriles Verdünnungswasser ein und entfernen Sie es dann sofort. Legen Sie das Segment in 10 ml Neutralisator.
- Mit flammensterilisierten Pinzetten das Schlauchsegment halten und mit sterilem hölzernem Applikatorstab kratzen, bis alle inneren Bereiche des Schlauches abgekratzt sind. Spülen Sie den Stick gelegentlich im 10 ml Neutralisator ab und legen Sie das Segment wieder in das Probenröhrchen. Das geschabte Rohrsegment ist die 100- oder 0-Verdünnung .
HINWEIS: Das endgültige Volumen der kombinierten Behandlung und des Neutralisators ist wichtig für die genaue Bestimmung der Biofilm-Log-Dichte. - Wirbeln Sie jedes Rohr auf der höchsten Stufe für 30 ± 5 s ein. Legen Sie das Rohr in ein Rohrgestell, das im Ultraschallgerät aufgehängt ist, so dass der Wasserstand im Bad dem Flüssigkeitsstand in den Rohren entspricht. Beschallung bei 45 kHz, 100% Leistung und Normalfunktion für 30 ± 5 Sekunden. Wiederholen Sie den Wirbel und die Beschallungszyklen und enden Sie dann mit einem letzten Wirbel.
HINWEIS: Dieses Rohr mit dem geernteten und disaggregierten Biofilm ist die 100-Verdünnung . - Verdünnen Sie die Proben seriell in gepuffertem Wasser. Platte auf Tryptic Soja-Agar mit der entsprechenden Beschichtungsmethode.
- Inkubieren Sie Platten bei 36 ± 2 oC für 24 h. Zählen Sie die Kolonien entsprechend der verwendeten Plattierungsmethode, zeichnen Sie Daten auf und berechnen Sie das arithmetische Mittel.
Ergebnisse
Validierung/Bestätigung einer Erntemethode
Mehrere Studien, die in unserem Labor durchgeführt wurden, untersuchten die Fähigkeit von Vortexing und Beschallung, Biofilm, der im Biofilmreaktor (ASTM E2562)2 gezüchtet wurde, effektiv mit der Single Tube Method (ASTM E2871)8 zu ernten.
Ein P. aeruginosa ATCC 15442 Biofilm wurde nach ASTM E25622 auf Borosilikatglas-Coupons gezüchtet. Nach 48 Stunden wurden vier Coupons in Fläschchen gelegt, mit 4 mL sterilem gepuffertem Wasser "behandelt" und mit 36 ml 2x D/E Neutralisationsbrühe neutralisiert. Die anfängliche Beschallungseinstellung von 45 kHz, 10% Leistung, Sweep-Einstellung, 30 ± 5 s wurde verwendet, um den Biofilm aus drei der vier Coupons zu ernten und zu disaggregieren. Nach Abschluss des Wirbel- und Beschallungszyklus wurde jeder Coupon mit Kristallviolett gefärbt und fotografiert. Abbildung 1 zeigt die Menge an Biofilm, die nach dem Vortexing und der Beschallung im Vergleich zur Kontrolle auf den drei Coupons verbleibt.
Um dies weiter zu testen, wurde ein P. aeruginosa ATCC 15442 Biofilm wie zuvor beschrieben gezüchtet und zwei Beschallungseinstellungen verglichen: 1) 45 kHz, 10% Leistung, Sweep-Einstellung, 30 ± 5 Sekunden und 2) 45 kHz, 100% Leistung, Normaleinstellung, 30 ± 5 Sekunden. Ein Gutschein aus jedem Satz der drei wurde mit BacLight Live / Dead-Fleck gefärbt und mit konfokaler Mikroskopie (CM) abgebildet. Die verbleibenden zwei Coupons aus jedem Satz wurden verdünnt, plattiert und für lebensfähige Zellen aufgezählt. Die brauchbaren Ergebnisse der Plattenzählung betrugen 9,230 Log10 CFU/Coupon ± 0,007 (SD_R) für die Einstellung 1 und 9,272 Log10 CFU/Coupon ± 0,066 (SD_R) für die Beschallungseinstellung 2. Diese Daten bestätigten eine EPA Single Tube Method Collaborative Study aus dem Jahr 2015, in der 9,03 Log10 CFU/Coupon ± 0,272 (SD_R) erreicht wurden9. Nach den brauchbaren Plattenzählungen scheint es, dass alle drei Mittel ähnlich genug sind, um keine weitere Untersuchung der Unterschiede zwischen den beiden Erntemethoden zu rechtfertigen. Die in Abbildung 2 gezeigten mikroskopischen Bilder können jedoch darauf hindeuten, dass nach der Verwendung von Einstellung 1 mehr Biofilm übrig blieb als nach Einstellung 2. Während wir beobachten, dass Biofilm, der auf den Gutscheinen verbleibt, tot erscheint (rote Farbe), ist die Interpretation der Lebensfähigkeit bei der Verwendung von BacLight Live / Dead Fleck schwierig14,15. Anstatt uns auf die Auswirkungen des gefärbten Biofilms auf die Lebensfähigkeit zu konzentrieren, verwendeten wir diesen Fleck, um den auf den Oberflächen verbleibenden Biofilm zu visualisieren. Während wir anerkennen, dass die Beschallung schädlich für die bakterielle Lebensfähigkeit sein könnte, zeigte eine Veröffentlichung von Kobayashi et al.16 aus dem Jahr 2007, dass eine erhöhte Beschallungszeit über 5 Minuten hinaus zu einer verringerten Anzahl lebensfähiger Platten führte. Da unsere Studie insgesamt 1-minütige Beschallung verwendete, sind wir zuversichtlich, dass nur wenige Zellen durch Beschallung getötet wurden, wie die >9.2 LOG10 CFU/Coupons für die beiden Beschallungsparameter zeigen. Es ist interessant, dass eine vollständige Ernte des Biofilms von der Oberfläche mit keiner der beiden Methoden erreicht werden konnte. Dieser Befund zeigt, dass brauchbare Plattenzahlen allein nicht ausreichen, um Ernte- und Disaggregationsverzerrungen zu bestimmen, und daher mit einer zusätzlichen Methode, beispielsweise der Mikroskopie, gepaart werden müssen.
Zusätzlich zu den Sonicator-Einstellungen untersuchten wir andere wichtige Faktoren, die die Beschallung beeinflussen. Dazu gehörten das Flüssigkeitsvolumen in den Durchstechflaschen (10 oder 40 ml), die Art der Flüssigkeit in der Durchstechflasche (gepuffertes Wasser oder 2X D/E Neutralisationsbrühe) und die Anzahl der gleichzeitig in der Badewanne befindlichen Durchstechflaschen (3 oder 12 Durchstechflaschen)9.
P. aeruginosa Biofilme auf CDC Biofilm Reactor Coupons wurden mit der Sonikatoreinstellung 2 (45 kHz, 100% Leistung, Normaleinstellung, 30 ± 5 Sekunden) beschallt. Alle Proben wurden entweder 3 auf einmal oder 6 auf einmal mit einem Wirbel mit einem 6-fachen Röhrchenaufsatz beworfen und dann wie in Abbildung 3 beschrieben beschallt. Ein Coupon aus jeder der folgenden Kategorien wurde mit CM abgebildet (Abbildung 3).
In der zweiten Studie, in der Beschallungsparameter untersucht wurden, deuten die mikroskopischen Bilder (Abbildung 3) darauf hin, dass die Minimierung des Volumens in den Röhrchen, die Verringerung der Anzahl der gleichzeitig verarbeiteten Röhrchen und die Verwendung von D / E-Neutralisationsbrühe (die Tensid enthält) zu einer verbesserten Biofilmgewinnung aus den Gutscheinen beitragen.
Biozide können die Ernte und Disaggregation positiv oder negativ verbessern. Ähnlich wie bei der Bestätigung, dass ein Neutralisator den Wirkstoff effektiv stoppt, während er die Abtötung vor der Durchführung eines Wirksamkeitstests nicht erhöht, ist es wichtig zu bestätigen, dass ein Biozid die Ernte und Disaggregation nicht unterschiedlich beeinflusst. Für Wirksamkeitstests ergeben sich Bias-Ergebnisse, wenn und nur wenn eine differentielle Entfernung für die Kontroll- und die behandelten Biofilmproben vorliegt11.

Abbildung 1: Fotos von Coupons, die mit Kristallviolett gefärbt sind und den verbleibenden Biofilm zeigen. A) Kupon, der aus dem Reaktor entfernt und mit Kristallviolett angefärbt wurde. B, C, D) Drei Replikatgutscheine wurden separat mit sterilem gepuffertem Wasser "behandelt" und dann neutralisiert. Um zu ernten und zu disaggregieren, wurden die Coupons zweimal vortexed (30 ± 5 Sekunden) und beschallt (45 kHz, 10% Leistung, Sweep-Einstellung, 30 ± 5 Sekunden) und erhielten dann einen letzten Wirbel. Bilder mit freundlicher Genehmigung von Danielle Orr und Blaine Fritz. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
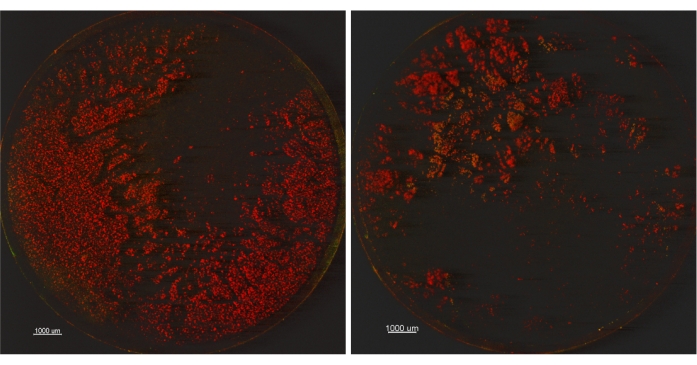
Abbildung 2: Konfokale Mikroskopiebilder von Coupons, die zwei verschiedene Beschallungseinstellungen vergleichen. Coupons (12,5-fache Vergrößerung) werden über die Beschallungseinstellung 1 (45 kHz, 10 % Leistung, Sweep-Einstellung) auf der linken Seite oder die Beschallungseinstellung 2 (45 kHz, 100 % Leistung, normale Einstellung) auf der rechten Seite verarbeitet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
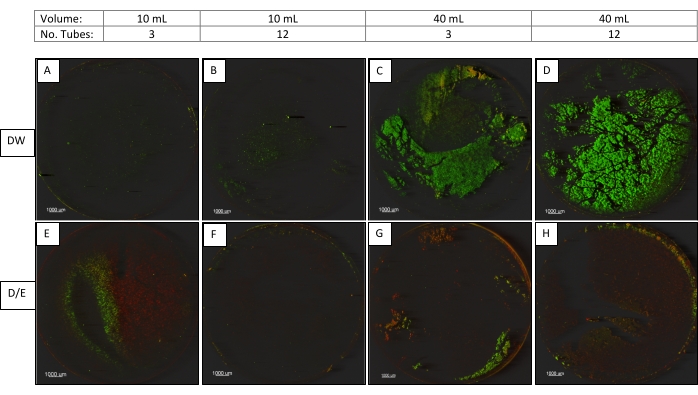
Abbildung 3. Konfokale Mikroskopiebilder von Coupons, die Volumina, Beschallungsflüssigkeit und Anzahl der Röhrchen vergleichen. Coupons (12,5-fache Vergrößerung), verarbeitet in 10 oder 40 ml Volumen, in Verdünnungswasser (DW) oder D/E Neutralisationsbrühe (D/E), 3 oder 12 Röhrchen gleichzeitig mit optimierter Beschallungseinstellung (45 kHz, 100% Leistung, Normaleinstellung). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Datei 1: Schlüsselparameter von Bedeutung für Ernte und Disaggagregation Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Mindestinformationen für Ernte- und Disaggregationsmethoden
Um reproduzierbare Biofilmdaten in der gesamten wissenschaftlichen Gemeinschaft zu erstellen, ist es unerlässlich, dass die Autoren so viele Details wie möglich über jeden der Wachstums-, Behandlungs-, Probenahme- und Analyseschritte einer Biofilmmethode angeben. Die Standardisierung von Biofilmmethoden hat bei diesem Bestreben geholfen, da sie es dem Forscher ermöglicht, auf eine bestimmte Methode und alle relevanten Modifikationen zu verweisen. Viele Arbeiten enthalten jedoch nur ein oder zwei Sätze, um die Ernte und Disaggregation von Biofilmen zu beschreiben. Zur besseren Reproduzierbarkeit empfehlen wir, Mindestangaben für die Biofilmgewinnung in Publikationen aufzunehmen. Dies baut auf der Initiative Minimum Information About a Biofilm Experiment (MIABiE) auf, die von Lourenco et al.17 vorgestellt wurde. Im Falle der Verwendung der Beschallung für Biofilmernte- und Disaggregationsparameter sollten die Informationen Folgendes umfassen: Position der Röhrchen innerhalb des Bades (Empfehlungen der Hersteller, um eine Beschädigung der Wandler zu vermeiden), Anzahl der gleichzeitig beschallten Röhrchen, Rohrmaterial, Volumen und Art der Flüssigkeit im Rohr, Vorhandensein von Tensid, Position der Flüssigkeit in den Röhrchen relativ zum Flüssigkeitsstand des Ultraschallbades, Vorrichtung zum Halten der Röhrchen im Bad (Glasbecher vs. Reagenzglasgestell), Entgasung des Wasserbades vor der Beschallung der Proben (wenn die Entgasung keine Herstelleroption ist, hilft die einfache Bedienung des Bades vor dem Einsetzen der Proben), einige gelöste Gase aus der Badeflüssigkeit zu entfernen), Temperatur des Wasserbades (Temperaturen können nach langen Beschallungsperioden ansteigen), Frequenz (z. B. 25 kHz oder 45 kHz), Badfunktion (z. B. Sweep oder Normal) und Leistungsbereich für Wandler (z. B. 10 - 100 %). Diese Einstellungen sollten für den zu untersuchenden Biofilm, das System zum Züchten des Biofilms und die spezifische Marke/das Modell des Ultraschallbades18 optimiert werden.
Die Sonicator-Einstellungen können geändert werden, um die gewünschten Ernteeffekte zu optimieren. Die Entgasung entfernt gelöste Luft in der Badeflüssigkeit und erhöht so die Reinigungskraft. Die Frequenz kann auf eine niedrige oder hohe Einstellung eingestellt werden. Eine niedrige Einstellung wie beispielsweise 25 kHz würde bei der Ernte hartnäckiger Proben helfen, während eine höhere Einstellung von 45 kHz für empfindliche Proben besser geeignet wäre. Eine Badfunktion von Sweep oder Normal ermöglicht die Verteilung der Kavitation. Die Sweep-Funktion erzeugt eine kontinuierliche Verschiebung der Schalldruckmaxima. Die normale Funktion ermöglicht es den Wandlern, im Doppelhalbwellenmodus zu arbeiten, was zu toten Zonen führen kann, wodurch die Beschallung weniger wirksam wird. Leistungsbereiche können von 10 - 100% der an die Wandler abgegebenen Leistung geändert werden19. Es ist bekannt, dass die Beschallung die bakterielle Lebensfähigkeit nachteilig beeinflussen kann. Eine Studie von Stamper et al.20 aus dem Jahr 2008 setzte Bakterienkulturen im Laufe der Zeit einer zunehmenden ultrasonice Energie aus, um bakterielle Abtötungskurven zu erzeugen. Wir empfehlen Benutzern, zu bestätigen, dass eine bestimmte Kombination von Beschallungseinstellungen nicht zu einer Abnahme lebensfähiger Bakterien führt20.
Es gibt keine perfekte Methode, um Biofilm zu ernten und zu disaggregieren, aber bestimmte Methoden funktionieren für einige Oberflächen / Mikrobenkombinationen besser als andere. Wir setzen uns dafür ein, dass der Leser feststellt, welche Parameter für sein jeweiliges Biofilmszenario wichtig sind. Schlüsselparameter, die für die Ernte und Disaggregation von Bedeutung sind, sind in der Ergänzungsdatei 1 enthalten.
Für die Ultraschallstudien, die zur Beurteilung der Ernte- und Disaggregationsverzerrung durchgeführt wurden, fanden wir heraus, dass die Beschallung bequem, effizient und in der Lage ist, für die Ernte und Disaggregation von Biofilm von Oberflächen standardisiert zu werden. Das Platzieren von Coupons in Fläschchen minimiert die Variabilität von Techniker zu Techniker, die bei Methoden auftreten würde, bei denen Coupons beispielsweise von Laborpersonal physisch abgekratzt werden. Obwohl es einfach genug erscheint, Fläschchen in ein Ultraschallwasserbad zu legen, gibt es viele Parameter, die berücksichtigt werden müssen, um eine optimale Ernte von Biofilm zu erreichen.
Es stehen zwei Arten von Beschallungsgeräten zur Verfügung, Ultraschallbäder und Ultraschallsonden. Dieses Papier konzentriert sich hauptsächlich auf Ultraschallbäder, bei denen Ultraschallenergie im Bereich von hoher (20 - 45 kHz) bis normaler (40 - 60 Hz) Frequenz erzeugt wird.
Drei Hauptprozesse sind im Spiel, wenn ein Ultraschallgerät zum Reinigen einer Oberfläche verwendet wird. Elektrische Energie wird in akustische Energie umgewandelt, wenn ein hochfrequenter Strom an einen piezoelektrischen oder magnetostriktiven Wandler gesendet wird, der als Reaktion auf den Strom schwingt. Die Schwingung erzeugt Kompressionswellen (Verdünnungswellen) in der Flüssigkeit. Kavitationsblasen bilden sich durch Unterdruck während der Verdünnung. Die Blasen wachsen, bis sie eine instabile Größe erreichen und kollabieren, wodurch ein Wasserstrahl entsteht, der Oberflächen reinigt21.
In diesem Artikel werden drei Ernte- und Disaggregationsansätze demonstriert: Beschallungs- und Vortexing-Methoden zur Ernte und Disaggregation von Biofilmen, wenn sie auf Polycarbonat-Coupons im CDC-Biofilmreaktor nach der Single-Tube-Methode gezüchtet werden. Schaben- und Homogenisierungsmethoden zur Ernte und Disaggregation von Biofilm werden gezeigt, wenn sie mit dem Drip Flow Biofilm Reactor auf Glascoupons gezüchtet werden. Kratz-, Beschallungs- und Vortexing-Methoden zur Ernte und Disaggregation von Biofilmen werden gezeigt, wenn sie in Silikonschläuchen gezüchtet werden.
Es gibt keine perfekte Methode, um den Biofilm zu ernten und zu disaggregieren, aber einige Ansätze eignen sich besser für verschiedene Oberflächen und / oder Anwendungen. Wichtig ist, sich die Zeit zu nehmen, die verwendete Methode zu validieren. In diesem Artikel haben wir die Verwendung von Kristallviolett und Mikroskopie diskutiert, aber je nach erforderlicher Empfindlichkeit gibt es andere Möglichkeiten. Wenn die Forschung Wirksamkeitstests umfasst, ist es wichtig, die Gültigkeit des Ansatzes in Gegenwart des antimikrobiellen Mittels zu bestätigen6. Alle Geräte sind etwas anders, so dass es selbst wenn die Ernte- und Disaggregationsmethode standardisiert wurde, immer noch ratsam ist, den Prozess für die verwendete Ausrüstung zu bestätigen. Ernte- und Disaggregationsmethoden sind spezifisch für oberflächenassoziierte und Biofilmbakterien. Die Forschung hat gezeigt, dass falsche Entscheidungen zu verzerrten Testergebnissen führen können. Nichtsdestotrotz sind Ernte und Disaggregation der am wenigsten untersuchte der vier Schritte in Biofilmmethoden. Es ist im Allgemeinen auch der nicht validierte Schritt (der als selbstverständlich angesehen wird) mit den wenigsten Informationen, die in veröffentlichten Papieren vorhanden sind, was es schwierig macht, den Prozess in einem anderen Labor zu reproduzieren. Dieses Papier und das begleitende Video zeigen drei gängige Ansätze für zwei Oberflächentypen und schlagen vor, wie eine Methode für ein einzelnes Labor validiert werden kann. Diese Informationen werden den Forschern helfen, fundiertere Entscheidungen darüber zu treffen, welche Methode verwendet werden soll, und bieten Anleitungen, was zu berichten ist, um die Reproduzierbarkeit zu verbessern.
Offenlegungen
Die Autoren haben keine Offenlegungen.
Danksagungen
Wir möchten Danielle Orr Goveia, Blaine Fritz, Jennifer Summers und Fei San Lee für ihre Beiträge zu diesem Papier danken.
Materialien
| Name | Company | Catalog Number | Comments |
| 50 mL conical vials | Thermo Scientific | 339652 | |
| 100 mL glass beakers | Fisher Scientific | FB102100 | |
| 5 mL serological pipettes | Fisher Scientific | 13-678-12D | For adding treatment to vials containing coupons. |
| 50 mL serological pipettes | Fisher Scientific | 13-678-14C | For adding neutralizer to vials at the end of treatment contact time. |
| Applicator sticks | Puritan | 807 | |
| Hemostats | Fisher Scientific | 16-100-115 | |
| Metal spatula | Fisher Scientific | 14-373 | |
| PTFE policemen | Saint-Gobain | 06369-04 | |
| S 10 N - 10 G - ST Dispersing tool | IKA | 4446700 | For homogenization of biofilm samples. |
| Scissors | Fisher Scientific | 08-951-20 | |
| Silicone Foley catheter, size 16 French | Medline Industries | DYND11502 | |
| Silicone tubing, size 16 | Cole-Parmer | EW96400-16 | |
| Splash Guards | BioSurface Technologies, Inc. | CBR 2232 | |
| T 10 basic ULTRA-TURRAX Disperser | IKA | 3737001 | For homogenization of biofilm samples. |
| Tubing connectors | Cole-Parmer | EW02023-86 | |
| Ultrasonic Cleaner | Elma | TI-H15 | |
| Vortex-Genie 2 | Scientific Industries | SI-0236 | |
| Vortex-Genie 2 Vertical 50 mL Tube Holder | Scientific Industries | SI-V506 |
Referenzen
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerging Infectious Diseases. 8 (9), 881-890 (2002).
- ASTM International. ASTM Standard E2562, 2017, Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown with High Shear and Continuous Flow using CDC Biofilm Reactor. ASTM International. , (2017).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews In Microbiology. 43 (3), 313-351 (2017).
- Gomes, I. B., et al. Standardized reactors for the study of medical biofilms: a review of the principles and latest modifications. Critical Reviews in Biotechnology. 38 (5), 657-670 (2018).
- Goeres, D. M., et al., Simoes, M., et al. Design and fabrication of biofilm reactors. Recent Trends in Biofilm Sciences and Technology. , 71-88 (2020).
- Goeres, D. M., et al. A method for growing a biofilm under low shear at the air-liquid interface using the drip flow biofilm reactor. Nature Protocols. 4 (5), 783-788 (2009).
- ASTM International. ASTM Standard E2871, Standard Test Method for Determining Disinfectant Efficacy Against Biofilm Grown in the CDC Biofilm Reactor Using the Single Tube Method. ASTM International. , (2019).
- Goeres, D. M., et al. Validation of a Biofilm Efficacy Test: The Single Tube Method. Journal of Microbiological Methods. , (2019).
- The development and validation of a standard in vitro method to evaluate the efficacy of surface modified urinary catheters. Theses and Dissertations at Montana State University Available from: https://scholarworks.montana.edu/xmlui/handle/1/15149 (2019)
- Hamilton, M. A., Buckingham-Meyer, K., Goeres, D. M. Checking the Validity of the harvesting and Disaggregating Steps in Laboratory Tests of Surface Disinfectants. Journal of AOAC International. 92 (6), 1755-1762 (2009).
- Conlon, B. P., Rowe, S. E., Lewis, K., Donelli, G. Persister Cells in Biofilm Associated Infections. Biofilm-based Healthcare-associated Infections. , (2015).
- ASTM International. ASTM Standard E2647, Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown Using Drip Flow Biofilm Reactor with Low Shear and Continuous Flow. ASTM International. , (2020).
- Rosenberg, M., Azevedo, N., Ivask, A. Propidium iodide staining underestimates viability of adherent bacterial cells. Scientific Reports. , (2019).
- Stiefel, P., Schmidt-Emrich, S., Manuira-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. , (2015).
- Kobayashi, N., Bauer, T. W., Tuohy, M. J., Fujishiro, T., Procop, G. W. Brief Ultrasonication Improves Detection of Biofilm-formative Bacteria Around a Metal Implant. Clinical Orthopaedics and Related Research. 457, 210-213 (2007).
- Lourenco, A., et al. Minimum information about a biofilm experiment (MIABiE), standards for reporting experiments and data on sessile microbial communities living at interfaces. Pathogens and Disease. , 1-7 (2014).
- Nascentes, C. C., Korn, M., Sousa, C. S., Arruda, M. A. Z. Use of Ultrasonic Baths for Analytical Applications: A New Approach for Optimisation Conditions. Journal of Brazilian Chemical Society. 12 (1), 57-63 (2001).
- Elma GmbH & Co. KG TI-H Ultrasonic Cleaning Units: Operating Instructions. Elma GmbH & Co. , (2009).
- Stamper, D. M., Holm, E. R., Brizzolara, R. A. Exposure times and energy densities for ultrasonic disinfection of Escherichia coli, Pseudomonas aeruginosa, Enterococcus avium and sewage. Journal of Environmental Engineering and Science. 7 (2), 139-146 (2008).
- Suslick, K. S. Sonochemistry. Science. 247 (4949), (1990).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten