Method Article
Viral Kaynaklı Nöroinflamatuar Yanıtları İncelemek Için Fare Ayak Takımı Aşılama Modeli
Bu Makalede
Özet
Ayak takımı aşılama modeli in vivo viral kaynaklı nöroinflamatuar yanıtları karakterize etmek için değerli bir araçtır. Özellikle, viral kinetik ve ilgili immünopatolojik süreçlerin periferik sinir sisteminde başlatılan net bir değerlendirme sağlar.
Özet
Bu protokol farelerde alfaherpesvirus enfeksiyonu sırasında nöroinflamatuar yanıtların başlatılması ve geliştirilmesi için kullanılan bir footpad aşılama modeli açıklar. Alfaherpesvirüsler periferik sinir sisteminin ana işgalciler ilerler gibi (PNS), Bu model viral çoğaltma kinetik karakterize etmek için uygundur, CNS PNS onun yayılması, ve ilişkili nöroinflamatuar yanıtlar. Ayak takımı aşılama modeli virüs parçacıkları nın ayak takımı epidermisindeki birincil enfeksiyon bölgesinden epidermisin, ter bezlerini ve dermisi innerve eden duyusal ve sempatik sinir liflerine yayılmasını sağlar. Enfeksiyon dorsal kök gangliyonu siyatik sinir yoluyla yayılır (DRG) ve sonuçta beyne omurilik yoluyla. Burada, bir fare footpad pseudorabies virüs (PRV), bir alfaherpesvirüs yakından herpes simpleks virüsü (HSV) ve varisella-zoster virüsü (VZV) ile ilgili aşılanır. Bu model PRV enfeksiyonu ciddi inflamasyon neden olduğunu göstermektedir, ayak ve DRG nötrofil infiltrasyon ile karakterize. Yüksek inflamatuar sitokin konsantrasyonları daha sonra ELISA tarafından homojendokularda saptanır. Buna ek olarak, DRG'de PRV geni ile protein ekspresyonu (qPCR ve IF boyama yoluyla) ile pro-inflamatuar sitokin üretimi arasında güçlü bir korelasyon gözlenmektedir. Bu nedenle, ayak takımı aşılama modeli alfaherpesvirüs kaynaklı nöropatilerin altında yatan süreçlerin daha iyi anlaşılmasını sağlar ve yenilikçi tedavi stratejilerinin geliştirilmesine yol açabilir. Buna ek olarak, model periferik nöropatiler üzerinde araştırma rehberlik edebilir, multipl skleroz ve PNS ilişkili viral kaynaklı hasar gibi. Sonuçta, uyuşturucu gelişimi için bir maliyet-etkin in vivo aracı olarak hizmet verebilir.
Giriş
Bu çalışma, PNS'den CNS'ye ve ilişkili nöroinflamatuar yanıtlara kadar virüslerin replikasyonve yayılmasını araştırmak için bir footpad aşılama modelini açıklamaktadır. Ayak takımı aşılama modeli yoğun nöronlarda alfahiçvirüs enfeksiyonu çalışmak için kullanılmıştır1,2,3. Bu modelin temel amacı nörotropik virüsler CNS ulaşmadan önce PNS ile maksimal bir mesafe seyahat etmek için izin vermektir. Burada, bu model psödorabis virüsü (PRV) ile enfekte farelerde belirli bir nöropati (nöropatik kaşıntı) gelişiminde yeni anlayışlar elde etmek için kullanılır.
PRV birkaç iyi bilinen patojenler ile ilgili bir alfaherpesvirus (yani, herpes simpleks tip 1 ve 2 [HSV1 ve HSV2] ve varisella-zoster virüsü [VZV]), hangi soğuk yaralar, genital lezyonlar ve su çiçeği neden, sırasıyla4. Bu virüslerin hepsi pantropik ve belirli bir doku tipi için yakınlık göstermeden birçok farklı hücre tipleri enfekte edebiliyoruz. Ancak, hepsi ev sahibi türlerin PNS (ve bazen, CNS) işgal ederek karakteristik bir nörotropizm sergiler. Doğal konak domuz, ama PRV en memeliler bulaştırmak olabilir. Bu doğal olmayan konaklarda, PRV PNS enfekte ve şiddetli bir pruritus indükler "deli kaşıntı", perakut ölüm takip5,6. PRV enfeksiyonunun klinik sonucu ve patogenezinde nöroimmün yanıtın rolü tam olarak anlaşılamamıştır.
Ayak takımı aşılama modeli PRV footpad epidermal hücrelerde enfeksiyon başlatmak için izin verir. Daha sonra, enfeksiyon epidermis innerve duyusal ve sempatik sinir lifleri içine yayılır, ter bezleri, ve dermis. Enfeksiyon yaklaşık 60 saat içinde DRG siyatik sinir yoluyla hareket eden virüs parçacıkları tarafından yayılır. Enfeksiyon omurilik yoluyla yayılır, sonuçta hayvanlar moribund (82 h post-enfeksiyon) haline geldiğinde arka beyne ulaşan. Bu süre zarfında doku örnekleri toplanabilir, işlenebilir ve virüs replikasyonu ve immün yanıt ın belirteçleri için analiz edilebilir. Örneğin, PRV patogenezinde klinik, virolojik ve nöroinflamatuar süreçlerin başlatılması ve gelişimi arasında korelasyon lar kurmak için farklı dokularda histolojik inceleme ve viral yük nicelliği yapılabilir.
Ayak takımı aşılama modeli kullanılarak farelerde PRV'ye bağlı pruritusun hücresel ve moleküler mekanizmaları araştırılabilir. Ayrıca, Bu model herpesvirus enfeksiyonları sırasında virüs kaynaklı nöroinflamasyon başlatılması ve gelişimi içine yeni bir fikir sağlayabilir. Alfaherpesvirüs kaynaklı nöropatilerin altında yatan süreçlerin daha iyi anlaşılması yenilikçi tedavi stratejilerinin geliştirilmesine yol açabilir. Örneğin, bu model post-herpezik lezyonları olan hastalarda nöropatik kaşıntı mekanizmaları araştırmak için yararlıdır (örneğin, herpes zoster, zona) ve ilgili insan hastalıkları için farelerde yeni terapötik hedefleri test.
Protokol
Tüm hayvan deneyleri Princeton Üniversitesi Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından gözden geçirilip onaylanan bir protokole (sayı 2083-16 ve 2083-19) uygun olarak yapılmıştır. Bu çalışma, Princeton Üniversitesi biyogüvenlik komitesi tarafından onaylanmış tam donanımlı bir laboratuarımız olan biyogüvenlik seviyesi-2 (BSL-2) gerekliliklerini sıkı bir şekilde izleyerek yapılmıştır. Fare ayak takımı aşınması, viral aşılama, fare diseksiyonu ve doku toplama gibi işlemler Princeton Üniversitesi biyo-çevreleme hayvan tesis odasında bir biyolojik güvenlik kabininde (BSC) gerçekleştirildi. Prosedürü gerçekleştirenler tek kullanımlık gece elbiseleri, baş örtüsü, göz koruması, steril eldivenler, cerrahi maskeler ve ayakkabı kılıfları giydiler.
1. Fare ayak takımı aşınması
- Bir C57BL/6 fare anestezi (5-7 hafta eski) izofluran gaz anesteziile, küçük bir anestezi sistemi (oda) ile% 3 dozda teslim.
- Fareyi, aşıdan önce arka ayak altlığı nda, cerrahi anestezi düzlemine yerleştirin. Fareye diyaframlı bir burun konisi (hayvanın namlusuna uyacak kadar büyük bir yarık) takın ve sabit dozda izofluran gazı anestezik %1,5-2,0 oranında anestezi kağıda takın.
- Başparmak forseps ile güçlü çimdikleme tarafından oluşturulan ağrılı uyarıcı bir yanıt için yakından fareyi izleyin.
- Hafifçe düz forceps ile bir arka ayak takımı kavramak.
- Yavaşça arka ayak takımı glabrous cilt aşındırın yaklaşık 20x, topuk ve yürüyüş pedleri arasında, bir emery kurulu (100-180 kum). Çok sık abrading veya çok fazla basınç uygulayarak kanama neden etmeyin.
- İnce forceps kullanarak, yavaş yavaş stratum basale ortaya çıkarmak için aşınma ile ayrılmış stratum korneum soyma.
2. PRV ayak takımı aşısı
- % 2 fetal sığır serumu (FBS) ve % 1 penisilin/streptomisin içeren DMEM ortamlarında istenilen titreye seyreltilmiş virüs inokülünü hazırlayın (Malzeme Tablosu).
- PK15 hücrelerindeki virüs stoğundaki plak oluşturan birimlerin (PFU) sayısını hesaplayın ve standartlaştırın ve viral inokülü buna göre seyreltin.
NOT: Bu çalışmada 8 x 106 PFU dozunda İİV (PRV-Becker) öldürücü suşu kullanılmıştır. Bu doz, tüm aşılanmış hayvanların 82 saat post-inoülzyon (hpi) klinik semptomlar gösterdisağlamak için önceki bir ön deneyde optimize edilmiştir. - Buz üzerinde virüs inoculum tutun ve kullanmadan önce yavaşça karıştırın.
- PK15 hücrelerindeki virüs stoğundaki plak oluşturan birimlerin (PFU) sayısını hesaplayın ve standartlaştırın ve viral inokülü buna göre seyreltin.
- Abraded pad (topikal uygulama) üzerine virüs inoculum (8 x 106 PFU) bir 20 μL damlacık ekleyin. Sahte aşıları (sadece orta) paralel olarak gerçekleştirin.
- Virüsün adsorpsiyonuna yardımcı olmak için 10 x'i iğnenin şaftına hafifçe sürtün. İğne ucu ile çizilmekaçının. Bu adımı her 10 dakikada bir tekrarlayın.
- Abraded ayak takımı kuruyana kadar fareyi 30 dk anestezi altında tutun.
- Anesteziyi durdurduktan sonra fareyi sternal recumbency'yi koruyana kadar izleyin ve klinik takip ve örnekleme için ayrı bir kafese yerleştirin.
3. Fare diseksiyonu ve doku toplama
- Enfeksiyon dan sonra uygun zamanlarda, fareyi boğulma yöntemi (CO2) ile ötenaziedin.
NOT: Bu çalışmada, PRV-Becker enfekte fareler için insancıl uç nokta (hayvanlar terminal belirtileri göstermeye başladığınızda) 82 hpi olduğunu. Ötenazi kontrol hayvanları paralel olarak. - İğneler/iğneler kullanarak fare nin ventral tarafını cerrahi bir paspasın üzerine yerleştirin. Farenin uzuvlarını iğnelerle cerrahi bir köpük tahtasına sabitle. Kürk kontaminasyonunu en aza indirmek için farenin ventral tarafını %70 etanol ile ıslayın.
- Forceps kullanarak kürk ve cilt dış tabaka çimdik ve üretral açılış yakınındaki ince makas kullanarak küçük bir başlangıç kesi yapmak.
- Bu açıklıktan çeneye kadar orta ventral taraftaki kesite devam edin.
- Ön ekstremitelerin ve arka ekstremitelerin ekstremitelerine doğru iki lateral kesi uzatın.
- Altta yatan kas tabakasından cildi ayırın ve yan aşağı pin.
- Karın boşluğuaçın ve toraks tabanına kadar eğim. İki transversal kesi yaparak karın boşluğunun açılmasını tamamlayın.
- Her iki yan tarafta diyafram ve kaburga keserek torasik boşluğu açın.
NOT: Göğüs kafesinin kenarlarının kesilmesi kalbi kesme riskini önler. - Kalp, akciğerler, dalak, pankreas, karaciğer, böbrekler ve mesane gibi açık organları 1,5 mL mikrotüpler de toplayın. Tüpleri buzda tut.
- Topuk ve yürüyüş pedleri arasında abraded footpad kesin ve adım 3.3.6 açıklandığı gibi bir tüp doku parçası yerleştirin.
- Fare nin yan tarafını yukarı yerleştirin ve kürkü %70 etanolile ısla. Vertebral sütun ortaya çıkarmak için deri tabakası nı kesin.
- Pelvis bölgesinde küçük bir kesi yapın. Arka bacaklardan baş doğru deri şerit.
- Bacakları ve kolları, her iki taraftaki omurilik kolonuna paralel ve yakın bir makasla keserek çıkarın.
- Kafatasının tabanında (C1-C2 seviyesi) kafa kes.
- Foramen magnumdan frontal kemiğe kadar olan makasla kafatasını kesin.
- Kafatasını forceps kullanarak yanal yönlerde çekin.
- Yavaşça forceps kullanarak beyin dışarı kepçe ve adım 3.3.6 açıklandığı gibi devam edin.
- Kavisli makas kullanarak kas, yağ ve yumuşak dokuları keserek omurilik temizleyin. Kuyruğunu kes. Bozulmamış omurgayı steril buz gibi fosfat tamponlu salin (PBS) içeren 15 mL'lik bir tüpe yerleştirin. Omurilik ve DRG daha fazla diseksiyon kadar buz tüpleri tutun.
4. Omurilik ve DRG ekstraksiyonu
NOT: Fare diseksiyonundan hemen sonra vertebra kolonundan omurilik ve DRG alın. Omurilik ve DRG ekstraksiyon için protokol bir önceki yayın dan uyarlanmıştır7.
- Buz gibi PBS tüpünden vertebra kolonunu çıkarın ve soğutmadan sonra daha kolay hale gelen kalan yumuşak dokuları çıkarın.
- Bir jilet kullanarak omurlar (T1, L1 ve S2 seviyeleri) aracılığıyla sütunda üç enine kesim yapın. Üç parçayı steril buz gibi PBS içeren 15 mm'lik Petri kabına yerleştirin. Daha sonraki çözümlemeiçin segmentlerin kökenini takip edin ve işaretleyin.
- Bir segment alın ve forceps arasında güvenli, sırt tarafı yukarı bakacak şekilde. Bir jilet kullanarak orta hattan tek bir uzunlamasına keserek sütunu iki eşit yarıya bölün.
- Her iki yarıya da yeni steril buz gibi PBS içeren yeni bir Petri kabına yerleştirin. Sol ve sağ tarafları ayırt edebilmek için segmentin doğru yönünü sağlayın.
- Bir diseksiyon mikroskop altında, yavaşça ince forceps kullanarak bir rostral için bir rostral her yarısından vertebra sütunundan omurilik soyma.
- 500 μL steril buz gibi PBS içeren 1,5 mL mikrotüplerde her iki omurilik yarılarını toplayın. Tüpleri buzda tut.
- Yavaşça DRG ortaya çıkarmak için omurilik bir tarafında diğer menenjler kaldırın.
- Maruz kalan spinal sinir kavrayarak ayrı ayrı her DRG çıkarın ve omurilik yavaşça dışarı çekin. Toplanan DRG'yi buz gibi PBS içeren 15 mm'lik Petri kabına yerleştirin. Tüm ipsilateral ve kontralateral DRG'yi omurilik segmentinden ayrı olarak hasat edin ve adım 4.5'te açıklandığı gibi ilerleyin.
NOT: DRG beyaz spinal sinir boyunca yuvarlak şeffaf bir yapı olarak görülebilir. - Diğer iki spinal kolon segmentini kullanarak 4.3-4.7 adımlarını 30-45 dk içinde tekrarlayın.
- Tüm tüpleri 4 °C'de 3 dk yüksek hızda (17.900 x g)santrifüj edin.
- Sıvı nitrojen de süpernatant ve flash-freeze tüpleri aspire. Daha fazla doku homojenizasyonu için tüpleri -80 °C'de saklayın.
- Alternatif olarak, 4.9 adımdan sonra histopatolojik analizler ve/veya immünororeskans boyamaiçin temizlenmiş DRG ve diğer fare dokularını düzeltin ve kesitleyin.
5. Doku homojenizasyonu
- Buz üzerinde dondurulmuş doku örnekleri içeren tüpleri eritin.
- 100 mg doku tartın ve steril çelik boncuk ve 0,5 M EDTA (pH = 8,0), 1 M Tris-HCl (pH = 8,0), 5 M NaCl, %10 SDS içeren 2 mL mikrosantrifüj tüpüne yerleştirin ve kokteyl inhibitörü tabletleri proteaz edin.
- 2 dk için 20 döngü/s'de homogenizer kullanarak oda sıcaklığında (RT) dokuları bozun, ardından 1 dk bekleme süresi, ardından 2 dk için 20 döngü/s.
- Tüpü rt'de 10 dk yüksek hızda (17.900 x g)santrifüj edin.
- Yeni bir tüpte süpernatant (500 μL) toplayın ve inflamatuar belirteçleri ve viral yükleri ölçmek için ELISA ve qPCR yapana kadar -20 °C'de saklayın.
NOT: QPCR için, RNase içermeyen malzeme (yani, boncuk, tüp, vb) ile tüm örnekleri toplamak ve% 1 betamercaptoetanol içeren RNA lysis tampon ile dokuları bozabilir (Malzeme Tablosu).
6. Dondurulmuş DRG bölümlerinin hazırlanması ve immünofloresan boyanmesi
- Doku işleme
- Parçalara dolanve temizlenmiş DRG'yi %1 paraformaldehit (PFA) ile 2 saat BOYUNCA RT'de sabitleyin.
- PBS'de %10 sakaroz ile 15 mL'lik bir tüpe doku aktarın. Gece boyunca 4 °C'de kuluçkaya yatırın.
- PBS'de %20 sakaroz ile 15 mL'lik bir tüpe doku aktarın. Gece boyunca 4 °C'de kuluçkaya yatırın.
- PBS%30 sakaroz ile 15 mL tüp içine doku aktarın. Gece boyunca 4 °C'de kuluçkaya yatırın.
- Bir kriyomold kullanarak OCT dokular gömmek ve hızlı dondurma için kuru buz blokları yerleştirin.
- Numuneleri kullanıma kadar -80 °C'de saklayın.
- Kriyoding hazırlığı
- -80 °C'den donmuş bloğu çıkarın ve 30 dakika boyunca kriyostat oda sıcaklığında dengelemesine izin verin.
- 15 μm kalınlığında DRG cryosection ve slaytlar üzerine bölümleri monte.
- Slayta monte edilmiş dokunun etrafına hidrofobik bir daire çizmek için bir kalem kullanın.
- Slaytları 4 °C'de boyama ya da boyama kadar tutun.
- İmmünofloresan boyama
- DRG bölümlerini 3x PBS'de 10 dakika boyunca RT'de yıkayın.
- 37 °C'de 1 saat boyunca istenilen primer antikor (örneğin, PRV glikoprotein B'ye karşı fare antikoru) ile 100 μL'lik kesitleri kuluçkaya yatırın. % 10 negatif keçi serumu içeren PBS primer antikor seyreltin.
- Adımı 6.3.1'i tekrarlayın.
- 37 °C'de 50 dakika boyunca istenilen ikincil antikor (keçi anti-fare Alexa Fluor 488) 100 μL ile bölümleri kuluçkaya yatırın. Sadece PBS'de sekonder antikor seyreltin.
- Bölüme PBS'de seyreltilmiş 100 μL DAPI (4′,6-diamidino-2-fenilindole) boya ekleyin. Daha fazla kuluçka numunesi 37 °C'de 10 dk.
- Adımı 6.3.1'i tekrarlayın.
- Örnekleri floresan montaj ortamı nı kullanarak cam kaydıraklarüzerine monte edin ve kapak lı olarak emniyete alayın ve örtün.
7. Parafin gömülü doku kesitlerinin hazırlanması ve H&E boyandırı
- 4 °C'de 24 saat boyunca %10 formalin ile dokuyu düzeltin.
- Parafin katıştırma ve sabit dokuların kesiti için standart işlem çizelgesi ni gerçekleştirin. Transfer sabit dokular 70% etanol ve süreç yükseltilmiş alkoller ile ksilen ve parafin takip, daha önce açıklandığı gibi8.
NOT: Kasetlerin içinde DRG gibi küçük doku örneklerini saklamak için polyester süngerkullanın. - Standart deparafinizasyon yapın ve ardından doku kesitlerinin H&E boyantisyonu, daha önce açıklandığı gibi9.
Sonuçlar
Fare ayak takımı aşılama modeli in vivo alfaherpesvirus enfeksiyonunun immünopatogenezinin karakterizasyonuna olanak sağlar, buna inolanmış ayak lıktan sinir sistemine enfeksiyonun replikasyonu ve yayılması ve spesifik nöroinflamatuar yanıtların indüksiyonu da dahil olmak üzere.
Bu çalışmada, ilk olarak fare arka ayak takımı aşılanmış ve ya mock-aşılanmış ya da PRV (PRV-Becker) öldürücü bir suşu ile aşılanmış aşılanmış. Aşınma yeri kontrol ayak takımı görünür oldu. İyileşme sürecinin bir parçası olarak aşınma yerinde bir kabuk oluşmuştur(Şekil 1, siyah ok). Buna karşılık, PRV ile aşılanmış fareler insancıl uç noktada şiddetli inflamasyon gösterdi (82 hpi), ayak takımı şişmesi ve kızarıklık ile karakterize.
Öldürücü PRV-Becker suşu ile footpad aşılama sonrasında, fareler klinik işaretler göstermeye başladı 72 hpi, aşılanmış ayak takımı şişmesi ve giderek daha sık titreme ile karakterize. 82 hpi ile, PRV-Becker enfekte fareler aşılanmış bacak ve belirgin PRV belirtileri sürekli titreme gösterdi, yoğun çizilme ve ayak ısırma dahil. Ayak altlığında da şiddetli inflamasyon gözlendi. PRV enfeksiyonu sırasında indüklenen inflamatuar yanıt daha sonra karakterize edildi, dokulara bağışıklık hücrelerinin infiltrasyonu da dahil olmak üzere.
Aşılanmış ayak takımı ve DRG dahil olmak üzere çeşitli dokuların histopatolojik incelemesi yapıldı ve ardından parafinle gömülü doku kesitlerinin H&E boyanması yapıldı. PRV enfekte ayak kesitlerinde epidermal nekroz ve şiddetli dermal inflamasyon (ödem ve fibrin) gözlendi(Şekil 2A, panel b). Enfekte farelerin epidermis, dermis ve bağ dokuları siyah oklarla işaretlenmiş nötrofillerin (çok loblu çekirdekleri ile tanımlanan) büyük bir infiltrasyon gösterdi. Kontrol farelerinin ayak takımları normaldi (Şekil 2A, panel a). PRV-enfekte DRG kontrol farelerin DRG normal iken enfekte farelerde minimal nöronal nekroz ve karışık inflamasyon gösterdi(Şekil 2B, paneller a ve b). Karışık inflamasyon infiltrasyon nötrofiller ve lenfositler ağırlıklı olarak oluşuyordu.
Daha sonra PRV ayak takımı aşısı sonrası fare dokusunda inflamatuar sitokin üretiminin kinetikleri oluşturuldu. Spesifik inflamatuar sitokin düzeyleri, kontrol ve PRV enfekte farelerden toplanan ve homojenize edilen çeşitli dokulardan (yani interlökin-6 [IL-6] ve granülosit-koloni uyarıcı faktörü [G-CSF]) ölçüldü. Sonuçlar, 7 hpi ve 82 hpi(Şekil 3A)kontrollerine kıyasla ayak ve DRG'de G-CSF düzeylerinde önemli bir artış olduğunu göstermiştir. Prv enfekte farelerin omurilik, beyin, kalp ve karaciğer dokusunda kontrollere göre 82 hpi'de anlamlı G-CSF düzeyleri gözlendi. Ayrıca PRV enfekte farelerin tüm dokularında 24 hpi 'den başlayan kontrollere kıyasla anlamlı IL-6 düzeyleri saptandı (Şekil 3B).
Footpad aşılama modeli daha PRV replikasyon araştırmak için kullanılan ve PNS ve CNS aşılanmış ayak takımı ve nöroinflamatuar yanıt gelişimi ile potansiyel korelasyon yayıldı. PRV yükleri qPCR tarafından çeşitli homojen dokularda PRV DNA'sını yükseltmek için ölçüldü. DNA konsantrasyonu daha sonra10açıklandığı gibi, PFU dönüştürüldü. 24 hpi (~1 x 104 PFU/mg doku) başlayan ayak altlığında ve 60 hpi 'den başlayan DRG'de (~1 x 103 PFU/mg doku; veriler gösterilmedi) PRV yükleri tespit edildi.
Bir moribund durumda (82 hpi), PRV footpad tespit edildi, DRG, omurilik, ve beyin, DRG PRV en yüksek konsantrasyonu ile (~ 1 x 105 PFU / doku mg; Şekil 4). DRG'nin PRV enfeksiyonu DRG kriyokesitlerinin dolaylı immünoresans boyaması ile doğrulandı. DRG nöronlarında anti-PRV gB antikor kullanılarak PRV enfeksiyonu saptırıldı. PRV glikoprotein gB enfekte hücrelerin sitoplazmasında enfeksiyonun geç evrelerinde ifade edildi. Beklendiği gibi, PRV gB sitoplazmik ekspresyonu (yeşil) enfekte DRG'de doğrulanmış, kontrol örneklerinde gB ifade edilmemiştir(Şekil 5). Hücre çekirdekleri DAPI boyama (mavi) ile tanımlanmış.

Şekil 1: PRV aşılama sonra fare sağ arka pençeleri temsili görüntüler. Fareler ya sahte aşılanır ya da aşılı sağ arka ayak altlığı nda PRV ile aşılanır. PRV-aşılanmış footpad iltihap belirtileri gösterir, kızarıklık ve insancı uç noktasında şişme de dahil olmak üzere (82 hpi). Kontrol farelerinin ayak takımı, abraded bölgesinde koyu kırmızı bir kabukla normal görünür ve yaranın iyileştiğini gösterir. Siyah oklar aşınma nın olduğu yeri gösterir. Bu rakam önceki bir yayın11değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: PRV ayak takımı aşısı sonrası ped ve DRG histopatolojik bulgular. Hematoksilin ve eozin (H&E) boyama (A) fare aşılanmış ayak takımları ve (B) ve ipsilateral DRG kontrolden (panel a) ve PRV-enfekte (panel b) fareler 82 hpi. PRV-enfekte dokularda (epidermal ve nöronal nekroz ve nötrofil infiltrasyonu) gözlenen histopatolojik bulgular incelenen tüm sahte enfekte farelerde bulunmamaktadır. Sonuçlar, belirli bir doku tipi için üç biyolojik kopyayı temsil eder. Siyah oklar bağışıklık hücresi infiltrasyonu ile iltihabı temsil alanları gösterir. Ölçek çubukları (50 μm) her resim için gösterilir. Bu rakam11'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: PRV ayak takımı aşısı sonrası homojenleştirilmiş fare dokularında inflamatuar sitokin üretiminin kinetik. (A) G-CSF ve (B) IL-6 protein düzeyleri PRV-enfekte (kırmızı) ve kontrol (siyah) fare farklı hpi dokularda homojenize dokularda saptanır. Protein düzeyleri ELISA ile ölçülür ve homojenize doku miligram başına pikogram (pg) (mg) olarak ifade edilir (grup başına n = 5, *p < 0.05, ns = anlamlı değildir). Bu rakam önceki biryayın12değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
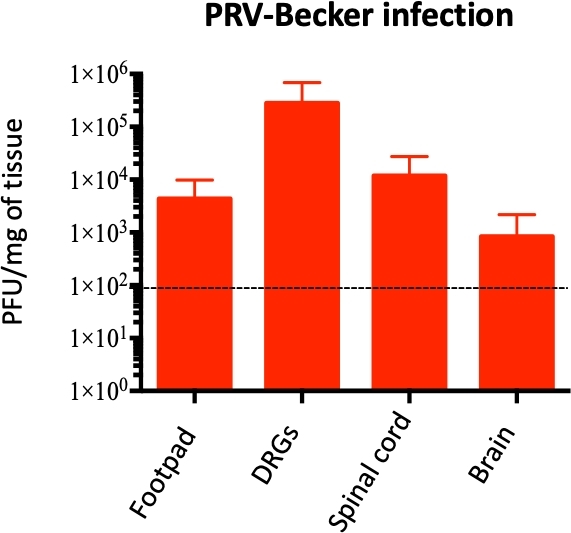
Şekil 4: Fare homojenize dokularda PRV genomunun nicelleştirilmesi. PRV DNA, homojenize fare dokularında PRV UL54 astarları kullanılarak qPCR ile ölçülür. PRV yükleri doku mg başına plak oluşturan birimler (PFU) olarak ifade edilir. PRV DNA sadece ayak, DRG, omurilik ve beyinde (diğer dokularda değil), n = 10 grup başına saptanır. Noktalı çizgi algılama sınırını gösterir. Bu rakam önceki bir yayın11değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: DRG nöronlarında PRV enfeksiyonunun immünororesans boyama ile değerlendirilmesi. PrV gB 'ye özgü bir fare antikoru kullanılarak immünororesans boyama sonrası sahte ve PRV enfekte DRG nöronların Confocal Z-stack görüntüleri (yeşil). Hücre çekirdekleri DAPI ile boyanmıştır (mavi, paneller a ve c). Panel d gB (beyaz oklar) ifade birkaç PRV enfekte nöronlar gösterir. Kontrol DRG bölümlerinde (panel b) gB ekspresyonu saptanmaz. Ölçek çubukları (50 μm) her resim için gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan ayak takımı aşılama modeli alfaherpesvirüs enfeksiyonu sırasında nöroinflamatuar yanıtların başlatılması ve gelişimini araştırmak için yararlıdır. Ayrıca, bu in vivo modeli çoğaltma kinetik kurmak ve PNS CNS alfaherpesvirus yayılması nı kurmak için kullanılır. Bu diğer aşılama modelleri için bir alternatif, yan deri aşılama modeli gibi, hangi derin dermal çizilme dayanır13, veya intrakranial rota, doğrudan CNS içine virüs tanıttı14,15,16. Sonuç olarak, footpad modeli ile, bu replikasyon viral kinetik daha ayrıntılı bir değerlendirme elde etmek mümkündür ve sinir sisteminde ilişkili lokal ve uzak immünopatolojik süreçler ile yayıldı11,12.
Bu protokolde, ayak takımı aşınmave sonraki viral aşılama önemli adımlardır. Gerçekten de, stratum korneum tamamen başarılı enfeksiyon için viral inokül stratum basale maruz bırakmak için yeterli aşınma sonra kaldırılması gerekir. Ancak, aşınma nazik olmalı ve kanamaneden değil, Bu kan dolaşımının enfeksiyonu önlemeye yardımcı olur gibi. Müstakil stratum korneum ışık mikroskobu altında H & E boyama ile görselleştirilmiş olabilir. Stratum korneumda bulunan korneositler çekirdeksiz düz, eozinofilik hücrelerdir. Viral inoculum (20 μL damlacık) hacmi, damlacık ayak üzerinde kalır ve abraded site kapsar sağlamak için optimize edilmiştir. İnoculum damlacıkını abraded footpad'e hafifçe sürtünmek, etkili viral penetrasyon için gereklidir. Anesteziyi durdurmak ve hayvanı yeni bir kafese yerleştirmek için ayak takımı tamamen kuruyana kadar beklemeniz önerilir. Bu adım, farenin abraded footpad kapalı viral inoculum yalama önleyecektir. Aynı anda anestezi ye maruz bırakmak için ayarlanmış bir burun konisi kullanarak, aynı anda üç fareler en fazla işlenmesi tavsiye edilir.
Fare diseksiyonu yaparken, omurilik ve ilişkili DRG hasarı önler vertebra sütun, paralel kesim yapmak önemlidir. Ayrıca omurilik içine kazara kesme azaltmak ve orta hat kesmeden önce forseps ile kolon segmentinde daha iyi bir kavrama kolaylaştırmak için mümkün olduğunca çok yağ, kas ve yumuşak doku kaldırmak için önerilmektedir.
Ayrıca, temizlenmiş kolon segmentleri üretmek ve DRG çiftleri zarar riskini sınırlamak için diskler arasında vertebra sütun u ğrıltıları ile enine kesim yapılması tavsiye edilir. Omuriliği çevreleyen ve DRG'yi kaplayan menenjler, DRG'nin tanımlanmasını ve çıkarılmasını kolaylaştırmak için tamamen çıkarılmalıdır. DRG, omurilik kolonundan, çersepsten zarar vermeden dikkatlice çıkarılmalıdır. DRG'nin H&E ve immünoresans boyama için bozulmadan kalması önemlidir. Zamanlama bu in vivo deneyin verimliliği için önemlidir, ve fare diseksiyonu ve omurilik / DRG ekstraksiyon mümkün olduğunca taze doku toplamak için ardışık yapılmalıdır.
Burada açıklanan doku homojenizasyon yöntemi, çok sayıda heterojen doku örneğinin etkin bir şekilde bozulmasını sağlamak için optimize edilmiştir. ELISA ve qPCR sonuçlarının numuneler arasında doğrudan karşılaştırılmasına olanak tanıyan kullanılan doku miktarını standartlaştırmak çok önemlidir. Örneğin, her homojenizasyon işlemi için doku 100 mg tartmak için önerilmektedir. Her doku örneği bütünüyle homojenize edilmeli ve artıklar dondurulmamalı-çözülmemelidir. Homojenizasyon sırasında herhangi bir kontaminasyonu önlemek için çelik boncuk ve forcepleri kullanmadan önce otoklavlamak önemlidir. 500 μL'lik bir hacim, 100 mg doku örneğinin homojenizasyonunu sağlamak için en uygun uyguluyor. Bu sınırlı hacmin, numune başına yalnızca üç ila dört ELISA kitlerinin işlenmesine olanak sağladığını unutmayın.
Ayak takımı aşılama modeli kullanılarak, farelerde PRV enfeksiyonu ciddi inflamasyon neden olduğu gösterilmiştir, ayak takımı ve DRG nötrofil infiltrasyon ile karakterize. ELISA kullanılarak birçok homojen dokuda yüksek inflamatuar sitokin konsantrasyonları G-CSF ve IL-6 saptandı. Buna ek olarak, DRG'de PRV geni ve protein ekspresyonu (qPCR ve IF boyama ile) ile pro-inflamatuar sitokinlerin üretimi arasında güçlü bir korelasyon saptandı.
Bu model viral replikasyon kinetik karşılaştırmak için uygundur / yayılması yanı sıra farklı alfaherpesvirüs enfeksiyonları arasında nöroinflamatuar yanıtları. Örneğin, VZV ile ilgili olarak, sınırlı konak özgüllüğü ve klinik hastalık eksikliği hayvan modellerinin kullanımını sınırlı17. Bu nedenle, fare ayak takımı PRV aşılama modeli post-herpezik lezyonları olan hastalarda nöropatik pruritus sorumlu hücresel ve moleküler mekanizmaların çalışması için yeni bir hayvan modeli temsil edebilir. VZV ve PRV arasındaki klinik bulgular, patogenez ve genomlar daki benzerliklere dayanarak, bu fare modelinin VZV patogenezinin anlaşılmasını artıracağına ve yenilikçi tedavi stratejilerindeki gelişmelere yol açacağına inanılmaktadır.
Son olarak, model periferik nöropatiler üzerinde araştırma rehberlik edecek, multipl skleroz ve PNS ilişkili viral kaynaklı hasar gibi18. PNS bulaştırmak için bilinen çeşitli nörotropik virüslerin patogenezi (yani, kuduz virüsü, çocuk felci virüsü, Batı Nil virüsü, Zika virüsü), ayrıca bu model kullanılarak incelenebilir19,20,21,22. Footpad aşılama modeli ilaç geliştirme için olası bir maliyet-etkin araç olarak kullanılabilir. Örneğin, viral kaynaklı periferik nöropatileri önlemek için tasarlanmış anti-inflamatuar ve antiviral ilaçların etkinliğini taramak ve test etmek için bir platform olarak hizmet verebilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar histopatoloji analizleri yürüten mükemmel teknik destek için Charles River laboratuvarları kabul. Bu çalışma Ulusal Nörolojik Bozukluklar ve İnme Enstitüsü (NINDS) (RO1 NS033506 ve RO1 NS060699) tarafından finanse edilmiştir. Fon layıcıların çalışma tasarımı, veri toplama ve analiz, makalenin yayımlama kararı veya hazırlanmasında hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antibody anti-PRV gB | Made by the lab | 1/500 dilution | |
| Aqua-hold2 pap pen red | Fisher scientific | 2886909 | |
| Compact emery boards-24 count (100/180 grit nail files) | Revlon | ||
| Complete EDTA-free Protease Inhibitor Cocktail | Sigma-Aldrich | 11836170001 | |
| C57BL/6 mice (5-7 weeks) | The Jackson Laboratories | ||
| DAPI solution (1mg/ml) | Fisher scientific | 62248 | 1/1000 dilution |
| Disposable sterile polystyrene petri dish 100 x 15 mm | Sigma-Aldrich | P5731500 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Hyclone, GE Healthcare life Sciences | SH30022 | |
| Dulbecco's Phophate Buffer Saline (PBS) solution | Hyclone, GE Healthcare life Sciences | SH30028 | |
| Fetal bovine serum (FBS) | Hyclone, GE Healthcare life Sciences | SH30088 | |
| Fine curved scissors stainless steel | FST | 14095-11 | |
| Fluoromount-G mounting media | Fisher scientific | 0100-01 | |
| Formalin solution, neutral buffered 10% | Sigma-Aldrich | HT501128 | |
| Isothesia Isoflurane | Henry Schein | NDC 11695-6776-2 | |
| Microcentrifuge tube 2ml | Denville Scientific | 1000945 | |
| Microtube 1.5ml | SARSTEDT | 72692005 | |
| Negative goat serum | Vector | S-1000 | |
| Penicillin/Streptomycin | Gibco | 154022 | |
| Precision Glide needle 18G | BD | 305196 | |
| Razor blades steel back | Personna | 9412071 | |
| RNA lysis buffer (RLT) | Qiagen | 79216 | |
| Stainless Steel Beads, 5 mm | Qiagen | 69989 | |
| Superfrost/plus microscopic slides | Fisher scientific | 12-550-15 | |
| Tissue lyser LT | Qiagen | 69980 | |
| Tissue-Tek OCT | Sakura | 4583 | |
| 488 (goat anti-mouse) | Life Technologies | A11029 | 1/2000 dilution |
Referanslar
- Field, H. J., Hill, T. J. The pathogenesis of pseudorabies in mice following peripheral inoculation. Journal of General Virology. 23 (2), 145-157 (1974).
- Engel, J. P., Madigan, T. C., Peterson, G. M. The transneuronal spread phenotype of herpes simplex virus type 1 infection of the mouse hind footpad. Journal of Virology. 71 (3), 2425-2435 (1997).
- Guedon, J. M., et al. Neuronal changes induced by Varicella Zoster Virus in a rat model of postherpetic neuralgia. Virology. 482, 167-180 (2015).
- Pomeranz, L. E., Reynolds, A. E., Hengartner, C. J. Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine. Microbiology and Molecular Biology Reviews. 69 (3), 462-500 (2005).
- Wittmann, G., Rziha, H. J., Knipe, D. M., Howley, P. M. Aujeszky's disease (pseudorabies) in pigs. Herpesvirus diseases of cattle, horses and pigs. 9, 230-325 (1989).
- Leman, A. D., Glock, R. D., Mengeling, W. L., Penny, R. H. C., Scholl, E., Straw, B. . Diseases of swine, 6th ed. , 209-223 (1986).
- Sleigh, J. N., Weir, G. A., Schiavo, G. A simple, step-by-step dissection protocol for the rapid isolation of mouse dorsal root ganglia. BMC Research Notes. 9, 82 (2016).
- Sands, S. A., Leung-Toung, R., Wang, Y., Connelly, J., LeVine, S. M. Enhanced Histochemical Detection of Iron in Paraffin Sections of Mouse Central Nervous System Tissue: Application in the APP/PS1 Mouse Model of Alzheimer's Disease. ASN Neuro. 8 (5), (2016).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor Protocols. 2014 (6), 655-658 (2014).
- Koyuncu, O. O., MacGibeny, M. A., Hogue, I. B., Enquist, L. W. Compartmented neuronal cultures reveal two distinct mechanisms for alpha herpesvirus escape from genome silencing. PLoS pathogens. 13 (10), 1006608 (2017).
- Laval, K., Vernejoul, J. B., Van Cleemput, J., Koyuncu, O. O., Enquist, L. W. Virulent Pseudorabies Virus Infection Induces a Specific and Lethal Systemic Inflammatory Response in Mice. Journal of Virology. 92 (24), 01614-01618 (2018).
- Laval, K., Van Cleemput, J., Vernejoul, J. B., Enquist, L. W. Alphaherpesvirus infection of mice primes PNS neurons to an inflammatory state regulated by TLR2 and type I IFN signaling. PLoS Pathogens. 15 (11), 1008087 (2019).
- Brittle, E. E., Reynolds, A. E., Enquist, L. W. Two modes of pseudorabies virus neuroinvasion and lethality in mice. Journal of Virology. 78 (23), 12951-12963 (2004).
- Mancini, M., Vidal, S. M. Insights into the pathogenesis of herpes simplex encephalitis from mouse models. Mammalian Genome: Official Journal of the International Mammalian Genome Society. 29 (7-8), 425-445 (2018).
- Kopp, S. J., et al. Infection of neurons and encephalitis after intracranial inoculation of herpes simplex virus requires the entry receptor nectin-1. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17916-17920 (2009).
- Wang, J. P., et al. Role of specific innate immune responses in herpes simplex virus infection of the central nervous system. Journal of Virology. 86 (4), 2273-2281 (2012).
- Haberthur, K., Messaoudi, I. Animal models of varicella zoster virus infection. Pathogens. 2 (2), 364-382 (2013).
- Sarova-Pinhas, I., Achiron, A., Gilad, R., Lampl, Y. Peripheral neuropathy in multiple sclerosis: a clinical and electrophysiologic study. Acta Neurologica Scandinavia. 91 (4), 234-238 (1995).
- MacGibeny, M. A., Koyuncu, O. O., Wirblich, C., Schnell, M. J., Enquist, L. W. Retrograde axonal transport of rabies virus is unaffected by interferon treatment but blocked by emetine locally in axons. PLoS Pathogens. 14 (7), 1007188 (2018).
- Hunsperger, E. A., Roehrig, J. T. Temporal analyses of the neuropathogenesis of a West Nile virus infection in mice. Journal of Neurovirology. 12 (2), 129-139 (2006).
- Swartwout, B. K., et al. Zika Virus Persistently and Productively Infects Primary Adult Sensory Neurons In Vitro. Pathogens. 6 (4), 49 (2017).
- Racaniello, V. R. One hundred years of poliovirus pathogenesis. Virology. 344 (1), 9-16 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır