Method Article
Modèle d’inoculation de tapis de souris pour étudier les réponses neuroinflammatoires virales induites
Dans cet article
Résumé
Le modèle d’inoculation de la carte de pied est un outil précieux pour caractériser les réponses neuroinflammatoires induites par le virus in vivo. En particulier, il fournit une évaluation claire de la cinétique virale et des processus immunopathologiques associés initiés dans le système nerveux périphérique.
Résumé
Ce protocole décrit un modèle d’inoculation de pied-pad utilisé pour étudier l’initiation et le développement des réponses neuroinflammatoires pendant l’infection d’alphaherpesvirus chez la souris. Comme les alphaherpesvirus sont les principaux envahisseurs du système nerveux périphérique (PNS), ce modèle est approprié pour caractériser la cinétique de la réplication virale, sa propagation du PNS au SNC, et les réponses neuroinflammatoires associées. Le modèle d’inoculation de la carte de pied permet aux particules virales de se propager d’un site d’infection primaire dans l’épiderme du pavé du pied aux fibres nerveuses sensorielles et sympathiques qui innervate l’épiderme, les glandes sudoripares et le derme. L’infection se propage par l’intermédiaire du nerf sciatique aux ganglions de racine dorsale (DRG) et finalement par la moelle épinière au cerveau. Ici, un tapis de souris est inoculé avec le virus pseudorabies (PRV), un alphaherpesvirus étroitement lié au virus de l’herpès simplex (HSV) et au virus varicelle-zoster (VZV). Ce modèle démontre que l’infection de PRV induit l’inflammation grave, caractérisée par l’infiltration de neutrophile dans le pavé et le DRG. Des concentrations élevées de cytokines inflammatoires sont par la suite détectées dans les tissus homogénéisés par ELISA. En outre, une forte corrélation est observée entre le gène PRV et l’expression des protéines (via qPCR et si coloration) dans DRG et la production de cytokines pro-inflammatoires. Par conséquent, le modèle d’inoculation de la piéillère permet de mieux comprendre les processus sous-jacents aux neuropathies induites par l’alphaherpesvirus et peut mener à l’élaboration de stratégies thérapeutiques novatrices. En outre, le modèle peut guider la recherche sur les neuropathies périphériques, telles que la sclérose en plaques et les dommages induits par le virus associés à la PNS. En fin de compte, il peut servir d’outil in vivo rentable pour le développement de médicaments.
Introduction
Cette étude décrit un modèle d’inoculation de la paillère pour étudier la réplication et la propagation des virus du SNP au SNC et les réponses neuroinflammatoires associées. Le modèle d’inoculation de la passerelle a été intensivement utilisé pour étudier l’infection à l’alphaherpesvirus dans les neurones1,2,3. L’objectif principal de ce modèle est de permettre aux virus neurotropes de parcourir une distance maximale à travers le PNS avant d’atteindre le SNC. Ici, ce modèle est utilisé pour obtenir de nouvelles idées dans le développement d’une neuropathie particulière (démangeaisons neuropathiques) chez les souris infectées par le virus pseudorabies (PRV).
Le PRV est un alphaherpesvirus lié à plusieurs agents pathogènes bien connus (c.-à-d. l’herpès simplex de type 1 et 2 [HSV1 et HSV2] et le virus varicelle-zoster [VZV]), qui causent respectivement des boutons de fièvre, des lésions génitales et lavaricelle, respectivement 4. Ces virus sont tous pantropes et capables d’infecter de nombreux types de cellules différents sans montrer d’affinité pour un type de tissu spécifique. Cependant, ils présentent tous un neurotropisme caractéristique en envahissant le PNS (et parfois, le SNC) des espèces hôtes. L’hôte naturel est le porc, mais le PRV peut infecter la plupart des mammifères. Dans ces hôtes non naturels, prv infecte le PNS et induit un prurit sévère appelé la « émite foll », suivie par la mort peracute5,6. Le rôle de la réponse neuroimmune dans les résultats cliniques et la pathogénie de l’infection de PRV a été mal compris.
Le modèle d’inoculation de la héliporte permet au PRV d’initier l’infection dans les cellules épidermiques du pavé. Ensuite, l’infection se propage dans les fibres nerveuses sensorielles et sympathiques qui innervate l’épiderme, les glandes sudoripares, et le derme. L’infection se propage par des particules virales se déplaçant via le nerf sciatique au DRG dans environ 60 h. L’infection se propage par la moelle épinière, atteignant finalement le cerveau postérieur lorsque les animaux deviennent moribondes (82 h après l’infection). Pendant cette période, des échantillons de tissus peuvent être prélevés, traités et analysés pour la réplication du virus et les marqueurs de la réponse immunitaire. Par exemple, l’examen histologique et la quantification de charge virale peuvent être exécutés dans différents tissus pour établir des corrélations entre l’initiation et le développement des processus cliniques, virologiques, et neuroinflammatoires dans la pathogénie de PRV.
À l’aide du modèle d’inoculation du pavé de pieds, les mécanismes cellulaires et moléculaires du prurit induit par le PRV chez la souris peuvent être étudiés. En outre, ce modèle peut fournir un nouvel aperçu de l’initiation et le développement de la neuroinflammation induite par le virus pendant les infections à herpèsvirus. Une meilleure compréhension des processus sous-jacents aux neuropathies induites par l’alphaherpesvirus peut mener à l’élaboration de stratégies thérapeutiques novatrices. Par exemple, ce modèle est utile pour étudier les mécanismes de démangeaisons neuropathiques chez les patients présentant des lésions post-herpétiques (par exemple, herpès zoster, zona) et tester de nouvelles cibles thérapeutiques chez les souris pour les maladies humaines correspondantes.
Protocole
Toutes les expériences animales ont été réalisées conformément à un protocole (numéro 2083-16 et 2083-19) examiné et approuvé par l’Institution Animal Care and Use Committee (IACUC) de l’Université de Princeton. Ce travail a été effectué en suivant strictement les exigences de niveau de biosécurité 2 (BSL-2), auxquelles nous disposons d’un laboratoire entièrement équipé approuvé par le comité de biosécurité de l’Université de Princeton. Les procédures, y compris l’abrasion du tapis de souris, l’inoculation virale, la dissection de souris et la collecte des tissus, ont été effectuées dans un cabinet de sécurité biologique (BSC) dans la salle des installations pour animaux de biocontainment de l’Université de Princeton. Ceux qui effectuaient la procédure portaient des robes jetables, un couvre-chef, une protection oculaire, des gants stériles, des masques chirurgicaux et des couvre-chaussures.
1. Abrasion de tapis de souris
- Anesthésiez une souris C57BL/6 (5 à 7 semaines) avec anesthésique au gaz isoflurane, livré à une dose de 3% via un petit système d’anesthésie (chambre).
- Placez la souris dans le plan chirurgical de l’anesthésie sur son dos, avant l’inoculation, dans le pavé arrière. Attachez un cône de nez avec un diaphragme (une fente suffisamment dimensionnée pour s’adapter au museau de l’animal) à la souris et délivrez un anesthésique au gaz isoflurane à une dose constante de 1,5%–2,0%.
- Surveillez de près la souris pour une réponse à un stimulus douloureux créé par le pincement puissant de l’orteil avec des forceps.
- Saisissez légèrement un pavé arrière avec des forceps plats.
- Abrade doucement la peau glabrous du pavé arrière environ 20x, entre le talon et les garnitures de marche, avec une planche d’émeri (100–180 grain). N’induisez pas de saignements en abrasant trop fréquemment ou en appliquant trop de pression.
- À l’aide de forceps fines, éplucher lentement le corneum de strate détaché par abrasion pour exposer la couche basale.
2. Inoculation de la hpv
- Préparer le virus inoculum dilué au ditre souhaité dans les milieux DMEM contenant 2% de sérum bovin fœtal (FBS) et 1% de pénicilline/streptomycine (Tableau des matériaux).
- Quantiter le nombre d’unités de formation de plaques (PFU) dans le stock de virus sur les cellules PK15 pour calculer et normaliser la dose virale et diluer l’inoculum viral en conséquence.
NOTE : Dans cette étude, la souche virulente de PRV-Becker a été employée à une dose de 8 x 106 PFU. Cette dose a été optimisée dans une expérience préliminaire précédente pour s’assurer que tous les animaux inoculés ont montré des symptômes cliniques à 82 h après l’inoculation (hpi). - Gardez le virus inoculum sur la glace et mélangez doucement avant utilisation.
- Quantiter le nombre d’unités de formation de plaques (PFU) dans le stock de virus sur les cellules PK15 pour calculer et normaliser la dose virale et diluer l’inoculum viral en conséquence.
- Ajouter une gouttelette de virus de 20 μL (8 x 106 PFU) sur le pavé abrasé (administration topique). Effectuer des inoculations simulées (moyennes seulement) en parallèle.
- Frottez doucement 10x avec l’arbre d’une aiguille pour faciliter l’adsorption du virus. Évitez de gratter avec le point d’aiguille. Répétez cette étape toutes les 10 minutes.
- Gardez la souris sous anesthésie pendant 30 min jusqu’à ce que le pavé est sec.
- Après l’arrêt de l’anesthésie, surveiller la souris jusqu’à ce qu’elle puisse maintenir le réumbétrie sternale et la placer dans une cage individuelle pour le suivi clinique et l’échantillonnage.
3. Dissection de souris et collecte de tissus
- Aux moments appropriés après l’infection, euthanasier la souris par la méthode d’asphyxie (CO2).
NOTE : Dans cette étude, le critère d’évaluation humain (lorsque les animaux commencent à présenter des symptômes terminaux) pour les souris infectées par le PRV-Becker est de 82 hpi. Euthanasier les animaux de contrôle en parallèle. - Placez le côté ventral de la souris vers le haut sur un tapis chirurgical à l’aide d’aiguilles/broches. Fixer les membres de la souris avec des épingles à une planche de mousse chirurgicale. Mouiller le côté ventral de la souris avec 70% d’éthanol pour minimiser la contamination par la fourrure.
- Pincez la couche externe de fourrure et de peau à l’aide de forceps et faites une petite incision initiale à l’aide de ciseaux fins près de l’ouverture urétrale.
- De cette ouverture, continuer l’incision sur le côté ventral milieu jusqu’au menton.
- Étendre deux incisions latérales vers les extrémités des membres antérieurs et des membres postérieurs.
- Séparez la peau de la couche musculaire sous-jacente et épinglez vers le bas sur le côté.
- Ouvrez la cavité abdominale et incisez jusqu’à la base du thorax. Terminez l’ouverture de la cavité abdominale en faisant deux incisions transversales.
- Ouvrez la cavité thoracique en coupant le diaphragme et les côtes des deux côtés latéraux.
REMARQUE : Couper les côtés de la cage thoracique empêche le risque de couper le cœur. - Recueillir les organes exposés, y compris le cœur, les poumons, la rate, le pancréas, le foie, les reins et la vessie dans des microtubes de 1,5 mL. Gardez les tubes sur la glace.
- Coupez le pavé abrasé entre le talon et les coussinets de marche et placez le morceau de tissu dans un tube tel que décrit à l’étape 3.3.6.
- Placez le côté dorsal de la souris vers le haut et mouillez la fourrure avec 70% d’éthanol. Coupez la couche cutanée pour exposer la colonne vertébrale.
- Faire une petite incision dans la région du bassin. Dépouiller la peau des membres postérieurs vers la tête.
- Retirez les jambes et les bras en coupant avec des ciseaux parallèles et proches de la colonne vertébrale des deux côtés.
- Couper la tête à la base du crâne (niveau C1–C2).
- Ouvrez le crâne avec des ciseaux du magnum foramen à l’os frontal.
- Ouvrez le crâne dans des directions latérales à l’aide de forceps.
- Retirez doucement le cerveau à l’aide de forceps et procédez comme décrit à l’étape 3.3.6.
- Nettoyez la colonne vertébrale en coupant les muscles, les graisses et les tissus mous à l’aide de ciseaux incurvés. Coupez la queue. Placez la colonne vertébrale intacte dans un tube de 15 ml contenant de la solution saline stérile tamponnée au phosphate (PBS) Gardez les tubes sur la glace jusqu’à ce que la dissection de la moelle épinière et DRG.
4. Extraction de la moelle épinière et du DRG
REMARQUE : Extraire la moelle épinière et le DRG de la colonne des vertèbres suivant directement la dissection de souris. Le protocole pour l’extraction de la moelle épinière et du DRG a été adapté d’une publication précédente7.
- Retirez la colonne des vertèbres du tube de PBS glacé et retirez les tissus mous restants, ce qui devient plus facile après la réfrigération.
- Faire trois coupes transversales dans la colonne à travers les vertèbres (niveaux T1, L1 et S2) à l’aide d’une lame de rasoir. Placer les trois morceaux dans une boîte de Pétri de 15 mm contenant des PBS stériles glacés. Gardez une trace et marquez l’origine des segments pour une analyse ultérieure.
- Prenez un segment et fixez-le entre les forceps, côté dorsal orienté vers le haut. Faire une coupe simple et longitudinale à travers la ligne médiane à l’aide d’une lame de rasoir, en divisant la colonne en deux moitiés égales.
- Placer les deux moitiés dans une nouvelle boîte de Pétri contenant de nouveaux PBS stériles glacés. Assurez-vous de l’orientation correcte du segment pour être en mesure de distinguer les côtés gauche et droit.
- Sous un microscope disséquant, peler doucement la moelle épinière de la colonne des vertèbres de chaque moitié dans une direction rostral à caudale en utilisant des forceps fins.
- Recueillir les deux moitiés de la moelle épinière dans des microtubes de 1,5 mL contenant 500 μL de PBS stériles glacés. Gardez les tubes sur la glace.
- Retirez doucement les méninges d’un côté de la colonne vertébrale à l’autre pour exposer le DRG.
- Retirez chaque DRG individuellement en saisissant le nerf spinal exposé et tirez-le doucement hors de la colonne vertébrale. Placez le DRG collecté dans une boîte de Pétri de 15 mm contenant du PBS glacé. Récoltez tous les DRG ipsilateral et contralatéral séparément du segment de la colonne vertébrale et procédez comme décrit à l’étape 4.5.
REMARQUE : Le DRG est visible sous forme de structure transparente ronde le long du nerf rachidien blanc. - Répétez les étapes 4.3–4.7 à l’aide des deux autres segments de colonne vertébrale dans un délai de 30 à 45 min.
- Centrifuge tous les tubes à grande vitesse (17 900 x g)pendant 3 min à 4 °C.
- Remplacer les tubes supernatants et le gel éclair dans l’azote liquide. Conserver les tubes à -80 °C pour d’autres homogénéisations tissulaires.
- Alternativement, fixer et sectionr le DRG nettoyé et d’autres tissus de souris pour les analyses histopathologiques et/ou la coloration d’immunofluorescence après l’étape 4.9.
5. Homogénéisation des tissus
- Décongeler les tubes contenant des échantillons de tissus congelés sur la glace.
- Pesez 100 mg de tissu et placez-le dans un tube de microcentrifuge de 2 ml contenant une perle d’acier stérile et 500 μL de tampon RIPA contenant 0,5 M EDTA (pH = 8,0), 1 M Tris-HCl (pH = 8,0), 5 M NaCl, 10% SDS, et comprimés de cocktail protease.
- Perturber les tissus à température ambiante (RT) à l’aide d’un homogénéisant à 20 cycles/s pendant 2 min, suivi d’une période d’attente de 1 min, puis 20 cycles/s pendant 2 min.
- Centrifuger le tube à grande vitesse (17 900 x g)pendant 10 min à RT.
- Recueillir le supernatant (500 μL) dans un nouveau tube et le stocker à -20 °C jusqu’à ce qu’il effectue des ELISA et des qPCR pour quantifier les marqueurs inflammatoires et les charges virales, respectivement.
REMARQUE : Pour qPCR, prélever tous les échantillons avec du matériel sans RNase (c.-à-d. perles, tubes, etc.) et perturber les tissus avec tampon de lyse d’ARN contenant 1% de bêtamercaptoéthanol (Table des matériaux).
6. Coloration de préparation et d’immunofluorescence des sections congelées de DRG
- Traitement des tissus
- Fixer le DRG disséqué et nettoyé dans 1% de paraformaldéhyde (PFA) pendant 2 h à RT.
- Transférer le tissu dans un tube de 15 ml avec 10% de saccharose dans PBS. Incuber toute la nuit à 4 °C.
- Transférer le tissu dans un tube de 15 ml avec 20% de saccharose dans PBS. Incuber toute la nuit à 4 °C.
- Transférer le tissu dans un tube de 15 ml avec 30% de saccharose dans PBS. Incuber toute la nuit à 4 °C.
- Incorporer les tissus dans les PTOM à l’aide d’un cryomold et placer des blocs dans de la glace sèche pour un gel rapide.
- Conserver les échantillons à -80 °C jusqu’à l’utilisation.
- Préparation de cryosection
- Retirer le bloc gelé de -80 °C et laisser équilibrer à la température de la chambre cryostat pendant 30 min.
- Cryosection du DRG à une épaisseur de 15 μm et monter les sections sur des lames.
- Utilisez un stylo pour dessiner un cercle hydrophobe autour du tissu monté sur diapositives.
- Conserver les lames à 4 °C jusqu’à ce qu’elles soient tachées.
- Coloration d’immunofluorescence
- Laver les sections DRG 3x dans PBS pendant 10 min à RT.
- Incuber les sections avec 100 μL d’anticorps primaires désirés (p. ex., anticorps de souris contre la glycoprotéine B de PRV) pendant 1 h à 37 °C. Diluer l’anticorps primaire dans pbs contenant 10% de sérum de chèvre négatif.
- Répétez l’étape 6.3.1.
- Incuber les sections avec 100 μL d’anticorps secondaires désirés (anti-souris de chèvre Alexa Fluor 488) pendant 50 min à 37 °C. Diluer l’anticorps secondaire dans PBS seulement.
- Ajouter 100 μL de colorant DAPI (4′,6-diamidino-2-phénylindole) dilué dans PBS sur la section. D’autres échantillons d’incubation 10 min à 37 °C.
- Répétez l’étape 6.3.1.
- Monter les échantillons à l’aide d’un milieu de montage de fluorescence sur des lames de verre et fixer et couvrir avec couvercle.
7. Préparation et coloration H&E des sections de tissus incorporés paraffine
- Fixer le tissu dans 10% de formaline pendant 24 h à 4 °C.
- Effectuer un calendrier de traitement standard pour l’incorporation et la section de tissus fixes paraffine. Transférer les tissus fixes à 70 % d’éthanol et les traiter par des alcools améliorés en xylène suivis de la paraffine, comme décrit précédemment8.
REMARQUE : Utilisez des éponges en polyester pour conserver de petits échantillons de tissus tels que DRG à l’intérieur des cassettes. - Effectuer la déparaffinisation standard suivie de la coloration H&E des sections de tissus, comme décrit précédemment9.
Résultats
Le modèle d’inoculation du tapis de souris permet la caractérisation de l’immunopathogenèse de l’infection à l’alphaherpesvirus in vivo, y compris la réplication et la propagation de l’infection du pavé de pied inoculé au système nerveux et l’induction de réponses neuroinflammatoires spécifiques.
Dans cette étude, nous avons d’abord abrasé le tapis arrière de souris et soit simulé-inoculé ou inoculé la région abrasée avec une souche virulente de PRV (PRV-Becker). Le site de l’abrasion était visible dans le pavé de commande. Une croûte s’est formée au site d’abrasion dans le cadre du processus de guérison (figure 1, flèche noire). En revanche, les souris inoculées avec le PRV ont montré l’inflammation grave au point d’évaluation humain (82 hpi), caractérisé par l’enflure du pavé et la rougeur.
Après l’inoculation de pied avec la souche virulente de PRV-Becker, les souris ont commencé à montrer des signes cliniques à 72 hpi, caractérisés par l’enflure du pavé de pied inoculé et des tremblements de plus en plus fréquents. Par 82 hpi, les souris infectées par PRV-Becker ont montré des tremblements constants dans la jambe inoculée et les symptômes distinctifs de PRV, y compris le grattage intense et la morsure du pied. Une inflammation grave a également été observée dans le pavé. La réponse inflammatoire induite pendant l’infection de PRV a alors été encore caractérisée, y compris l’infiltration des cellules immunitaires dans les tissus.
L’examen histopathologique de plusieurs tissus a été effectué, y compris le pavé de pied inoculé et le DRG, suivi de la coloration de H&E des sections de tissu incorporées de paraffine. Des nécroses épidermiques et une inflammation cutanée grave (œdème et fibrine) ont été observées dans les sections du pied infectées par le PRV (Figure 2A, panneau b). L’épiderme, le derme et les tissus conjonctifs des souris infectées ont montré une infiltration massive de neutrophiles (identifiés par des noyaux multilobés) marqués de flèches noires. Les tapis de pied des souris témoins étaient normaux (Figure 2A, panneau a). DRG infecté par le PRV a montré une nécrose neuronale minimale et une inflammation mixte chez les souris infectées tandis que le DRG des souris témoins était normal (figure 2B, panneaux a et b). L’inflammation mélangée s’infiltre principalement des neutrophiles et des lymphocytes.
Ensuite, la cinétique de la production inflammatoire de cytokine dans le tissu de souris après l’inoculation de pied de PRV ont été établies. Les niveaux de cytokines inflammatoires spécifiques ont été quantifiés (c.-à-d. interleukine-6 [IL-6] et facteur stimulant granulocyte-colonie [G-CSF]) de plusieurs tissus recueillis et homogénéisés à partir de souris témoins et infectées par le PRV. Les résultats ont démontré une augmentation significative des niveaux de G-CSF dans le pavé et le DRG par rapport aux commandes à 7 hpi et 82 hpi (Figure 3A). Des niveaux significatifs de G-CSF ont été observés à 82 hpi dans la moelle épinière, le cerveau, le coeur, et le tissu de foie des souris MRV-infectées comparées aux contrôles. En outre, des niveaux significatifs d’IL-6 ont été détectés dans tous les tissus de souris infectées par le PRV par rapport aux témoins commençant à 24 hpi (figure 3B).
Le modèle d’inoculation du pavé de pieds a été utilisé plus avant pour étudier la réplication du PRV et la propagation du pavé de pied inoculé au PNS et au SNC et les corrélations potentielles avec le développement de la réponse neuroinflammatoire. Les charges de PRV ont été quantifiées dans plusieurs tissus homogénéisés par qPCR pour amplifier l’ADN de PRV. La concentration d’ADN a ensuite été convertie en PFU, comme décrit précédemment10. Des charges de PRV ont été détectées dans le pavé à partir de 24 hpi (~1 x 104 PFU/mg de tissu) et dans DRG à partir de 60 hpi (~1 x 103 PFU/mg de tissu; données non montrées).
Dans un état moribond (82 hpi), le PRV a été détecté dans le pavé, le DRG, la moelle épinière et le cerveau, avec la plus forte concentration de PRV dans le DRG (~1 x 105 PFU/mg de tissu ; Figure 4). L’infection de PRV de DRG a été confirmée par la coloration indirecte d’immunofluorescence des cryosections de DRG. L’infection de PRV a été détectée dans les neurones de DRG utilisant l’anticorps de gB anti-PRV. Le gB de glycoprotéine de PRV a été exprimé pendant les stades avancés de l’infection dans le cytoplasme des cellules infectées. Comme prévu, l’expression cytoplasmique du GB PRV (vert) a été confirmée dans le DRG infecté, tandis qu’aucun gB n’a été exprimé dans les échantillons témoins (figure 5). Les noyaux cellulaires ont été identifiés avec la coloration DAPI (bleu).

Figure 1 : Images représentatives des pattes arrière droites de la souris après l’inoculation du PRV. Les souris sont soit simulées ou inoculées avec du PRV dans le pavé arrière droit abrasé. Le pavé de pied inoculé par le PRV montre des signes d’inflammation, y compris des rougeurs et de l’enflure à un point d’évaluation humain (82 hpi). Le pavé de souris témoins semble normal avec une croûte rouge foncé au site abrasé, indiquant que la blessure se cicatrisation. Les flèches noires indiquent le site de l’abrasion. Ce chiffre a été modifié à partir d’une publication précédente11. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Résultats histopathologiques dans le pavé de pied et le DRG après l’inoculation de pied de PRV. La coloration de l’hématoxyline et de l’éosine (H&E) des (A) des tapis de pied inoculés de souris et (B) et de la DRG ipsilateral des souris témoins (panneau a) et infectés par le PRV (panel b) à 82 hpi. Les manifestations histopathologiques observées dans les tissus infectés par le PRV (nécrose épidermique et neuronale et infiltration de neutrophile) sont absentes de toutes les souris infectées par simulation examinées. Les résultats sont représentatifs de trois répliques biologiques pour un type donné de tissu. Les flèches noires indiquent des zones représentatives de l’inflammation avec l’infiltration de cellules immunitaires. Des barres d’échelle (50 μm) sont indiquées pour chaque image. Ce chiffre a été modifié à partir de11. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Cinétique de la production inflammatoire de cytokine dans les tissus homogénéisés de souris après l’inoculation de la héliporte PRV. (A) G-CSF et (B) IL-6 niveaux de protéine détectés dans les tissus homogénéisés de souris infectés par le PRV (rouge) et témoins (noirs) à différents hpi. Les niveaux de protéines sont quantifiés par ELISA et exprimés en picogramme (pg) par milligramme (mg) de tissu homogénéisé (n = 5 par groupe, *p < 0,05, ns = non significatif). Ce chiffre a été modifié à partir d’une publication précédente12. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
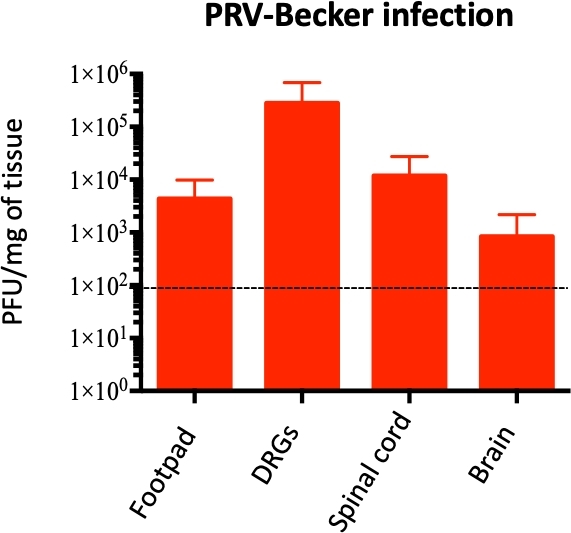
Figure 4 : Quantification du génome du PRV dans les tissus homogénéisés de souris. L’ADN de PRV est quantifié dans les tissus homogénéisés de souris par qPCR utilisant des amorces DE PRV UL54. Les charges de PRV sont exprimées en unités de formation de plaque (PFU) par mg de tissu. L’ADN de PRV est détecté seulement dans le pied, le DRG, la moelle épinière, et le cerveau (et pas dans d’autres tissus), n = 10 par groupe. La ligne pointillée montre la limite de détection. Ce chiffre a été modifié à partir d’une publication précédente11. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Évaluation de l’infection par le VPR dans les neurones du DRG par coloration d’immunofluorescence. Confocale Z-pile des images de neurones de DRG infectés par la maquette et le PRV après la coloration de l’immunofluorescence à l’aide d’un anticorps de souris spécifique pour le GB PRV (vert). Les noyaux cellulaires sont tachés de DAPI (bleu, panneaux a et c). Le panneau d montre plusieurs neurones infectés par le PRV exprimant gB (flèches blanches). Aucune expression gB n’est détectée dans les sections DRG de contrôle (panneau b). Des barres d’échelle (50 μm) sont indiquées pour chaque image. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Le modèle d’inoculation de la piétinement décrit ici est utile pour étudier l’initiation et le développement de réponses neuroinflammatoires pendant l’infection à alphaherpesvirus. En outre, ce modèle in vivo est utilisé pour établir la cinétique de la réplication et la propagation de l’alphaherpesvirus du PNS au SNC. Il s’agit d’une alternative à d’autres modèles d’inoculation, tels que le modèle d’inoculation de la peau du flanc, qui repose sur le grattage dermique profond13, ou la voie intracrânienne, qui introduit directement le virus dans le SNC14,15,16. En conséquence, avec le modèle de pavé de pied, il est possible d’obtenir une évaluation plus détaillée de la cinétique virale de la réplication et de la propagation avec les processus immunopathologiques locaux et éloignés associés dans le système nerveux11,12.
Dans ce protocole, l’abrasion du pavé et l’inoculation virale subséquente sont des étapes cruciales. En effet, le cornée de strate doit être complètement enlevé après abrasion adéquate afin d’exposer le basale de strate à l’inoculum viral pour l’infection réussie. Cependant, l’abrasion doit être douce et ne pas induire des saignements, car cela aide à prévenir l’infection de la circulation sanguine. Le cornée de strate détaché peut être visualisé par la coloration de H&E sous la microscopie légère. Les corneocytes présents dans la strate corneum sont des cellules plates et éosinophiles qui n’ont pas de noyaux. Le volume de l’inoculum viral (20 gouttelettes μL) a été optimisé pour s’assurer que la gouttelette reste sur le pavé et couvre le site abrasé. Frotter doucement la gouttelette d’inoculum sur le pavé abrasé est essentiel pour une pénétration virale efficace. Il est recommandé d’attendre que le pavé est complètement sec pour arrêter l’anesthésie et placer l’animal dans une nouvelle cage. Cette étape évitera à la souris de lécher l’inoculum viral sur le pavé de pied abrams. Il est recommandé de traiter un maximum de trois souris à la fois, à l’aide d’un cône de nez qui est réglé pour les exposer simultanément à l’anesthésie.
Lors de l’exécution de la dissection de la souris, il est important de faire des coupures parallèles à la colonne des vertèbres, ce qui empêche les dommages à la moelle épinière et le DRG associé. Il est également suggéré d’enlever autant de graisse, de muscle, et de tissu mou que possible pour réduire la coupe accidentelle dans la colonne vertébrale et faciliter une meilleure adhérence sur le segment de colonne avec des forceps avant de couper la ligne médiane.
Il est également recommandé d’effectuer des coupes transversales à travers la colonne des vertèbres entre les disques afin de produire des segments de colonne nettoyés et de limiter le risque d’endommager les paires DRG. Les méninges entourant la moelle épinière et couvrant le DRG doivent être complètement enlevées pour faciliter l’identification et l’extraction du DRG. Le DRG doit être retiré soigneusement de la colonne vertébrale sans dommages des forceps. Il est important que le DRG reste intact pour les taches H&E et immunofluorescence. Le moment est essentiel pour l’efficacité de cette expérience in vivo, et la dissection de souris et l’extraction de moelle épinière/DRG devraient être exécutées consécutivement afin de recueillir des tissus aussi frais que possible.
La méthode d’homogénéisation des tissus décrite ici a été optimisée pour assurer une perturbation efficace d’un grand nombre d’échantillons de tissus hétérogènes. Il est primordial de normaliser la quantité de tissu utilisé, ce qui permet de comparer directement les résultats elisa et qPCR entre les échantillons. Par exemple, il est suggéré de peser 100 mg de tissu pour chaque procédure d’homogénéisation. Chaque échantillon de tissu doit être homogénéisé dans son intégralité, et les restes ne doivent pas être congelés. Il est important d’autoclaver les perles d’acier et les forceps avant d’être utilisés pour éviter toute contamination lors de l’homogénéisation. Un volume de 500 μL est optimal pour assurer une homogénéisation complète d’un échantillon de tissu de 100 mg. Il est important de noter que ce volume limité ne permet que le traitement de trois à quatre kits ELISA par échantillon.
En utilisant le modèle d’inoculation de la piéillère, il a été démontré que l’infection de PRV chez la souris induit l’inflammation grave, caractérisée par l’infiltration de neutrophile dans le pavé et le DRG. Des concentrations élevées de cytokines inflammatoires G-CSF et IL-6 ont également été détectées dans de nombreux tissus homogénéisés utilisant ELISA. En outre, une forte corrélation a été trouvée entre le gène de PRV et l’expression de protéine (par qPCR et la coloration de IF) dans DRG et la production des deux cytokines pro-inflammatoires.
Ce modèle est approprié pour comparer la cinétique de la réplication virale / propagation ainsi que les réponses neuroinflammatoires entre les différentes infections alphaherpesvirus. Par exemple, en ce qui concerne le VZV, la spécificité restreinte de l’hôte et l’absence de maladie clinique ont limité l’utilisation des modèles animaux17. Par conséquent, le modèle d’inoculation de PRV de pied de souris peut représenter un nouveau modèle animal pour l’étude des mécanismes cellulaires et moléculaires responsables du prurit neuropathique dans les patients présentant des lésions post-herpetic. En se basant sur les similitudes dans les signes cliniques, la pathogénie et les génomes entre VZV et PRV, on croit que ce modèle de souris permettra d’améliorer la compréhension de la pathogénie VZV et de conduire à l’évolution des stratégies thérapeutiques innovantes.
Enfin, le modèle guidera la recherche sur les neuropathies périphériques, telles que la sclérose en plaques et les dommages induits par le virus associés au PNS18. La pathogénie de plusieurs virus neurotropes (c.-à-d. virus de la rage, poliovirus, virus du Nil occidental, virus Zika), qui sont connus pour infecter le PNS, peut également être étudiée à l’aide de ce modèle19,20,21,22. Le modèle d’inoculation de la barre des pieds peut être utilisé comme un outil rentable possible pour le développement de médicaments. Par exemple, il peut servir de plate-forme pour dépister et tester l’efficacité des médicaments anti-inflammatoires et antiviraux conçus pour prévenir les neuropathies périphériques induites par le virus.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs reconnaissent les laboratoires charles river pour leur excellent soutien technique exécutant les analyses d’histopathologie. Ces travaux ont été financés par le National Institute of Neurological Disorders and Stroke (NINDS) (RO1 NS033506 et RO1 NS060699). Les bailleurs de fonds n’ont joué aucun rôle dans la conception de l’étude, la collecte et l’analyse de données, la décision de publier ou la préparation du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Antibody anti-PRV gB | Made by the lab | 1/500 dilution | |
| Aqua-hold2 pap pen red | Fisher scientific | 2886909 | |
| Compact emery boards-24 count (100/180 grit nail files) | Revlon | ||
| Complete EDTA-free Protease Inhibitor Cocktail | Sigma-Aldrich | 11836170001 | |
| C57BL/6 mice (5-7 weeks) | The Jackson Laboratories | ||
| DAPI solution (1mg/ml) | Fisher scientific | 62248 | 1/1000 dilution |
| Disposable sterile polystyrene petri dish 100 x 15 mm | Sigma-Aldrich | P5731500 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Hyclone, GE Healthcare life Sciences | SH30022 | |
| Dulbecco's Phophate Buffer Saline (PBS) solution | Hyclone, GE Healthcare life Sciences | SH30028 | |
| Fetal bovine serum (FBS) | Hyclone, GE Healthcare life Sciences | SH30088 | |
| Fine curved scissors stainless steel | FST | 14095-11 | |
| Fluoromount-G mounting media | Fisher scientific | 0100-01 | |
| Formalin solution, neutral buffered 10% | Sigma-Aldrich | HT501128 | |
| Isothesia Isoflurane | Henry Schein | NDC 11695-6776-2 | |
| Microcentrifuge tube 2ml | Denville Scientific | 1000945 | |
| Microtube 1.5ml | SARSTEDT | 72692005 | |
| Negative goat serum | Vector | S-1000 | |
| Penicillin/Streptomycin | Gibco | 154022 | |
| Precision Glide needle 18G | BD | 305196 | |
| Razor blades steel back | Personna | 9412071 | |
| RNA lysis buffer (RLT) | Qiagen | 79216 | |
| Stainless Steel Beads, 5 mm | Qiagen | 69989 | |
| Superfrost/plus microscopic slides | Fisher scientific | 12-550-15 | |
| Tissue lyser LT | Qiagen | 69980 | |
| Tissue-Tek OCT | Sakura | 4583 | |
| 488 (goat anti-mouse) | Life Technologies | A11029 | 1/2000 dilution |
Références
- Field, H. J., Hill, T. J. The pathogenesis of pseudorabies in mice following peripheral inoculation. Journal of General Virology. 23 (2), 145-157 (1974).
- Engel, J. P., Madigan, T. C., Peterson, G. M. The transneuronal spread phenotype of herpes simplex virus type 1 infection of the mouse hind footpad. Journal of Virology. 71 (3), 2425-2435 (1997).
- Guedon, J. M., et al. Neuronal changes induced by Varicella Zoster Virus in a rat model of postherpetic neuralgia. Virology. 482, 167-180 (2015).
- Pomeranz, L. E., Reynolds, A. E., Hengartner, C. J. Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine. Microbiology and Molecular Biology Reviews. 69 (3), 462-500 (2005).
- Wittmann, G., Rziha, H. J., Knipe, D. M., Howley, P. M. Aujeszky's disease (pseudorabies) in pigs. Herpesvirus diseases of cattle, horses and pigs. 9, 230-325 (1989).
- Leman, A. D., Glock, R. D., Mengeling, W. L., Penny, R. H. C., Scholl, E., Straw, B. . Diseases of swine, 6th ed. , 209-223 (1986).
- Sleigh, J. N., Weir, G. A., Schiavo, G. A simple, step-by-step dissection protocol for the rapid isolation of mouse dorsal root ganglia. BMC Research Notes. 9, 82 (2016).
- Sands, S. A., Leung-Toung, R., Wang, Y., Connelly, J., LeVine, S. M. Enhanced Histochemical Detection of Iron in Paraffin Sections of Mouse Central Nervous System Tissue: Application in the APP/PS1 Mouse Model of Alzheimer's Disease. ASN Neuro. 8 (5), (2016).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor Protocols. 2014 (6), 655-658 (2014).
- Koyuncu, O. O., MacGibeny, M. A., Hogue, I. B., Enquist, L. W. Compartmented neuronal cultures reveal two distinct mechanisms for alpha herpesvirus escape from genome silencing. PLoS pathogens. 13 (10), 1006608 (2017).
- Laval, K., Vernejoul, J. B., Van Cleemput, J., Koyuncu, O. O., Enquist, L. W. Virulent Pseudorabies Virus Infection Induces a Specific and Lethal Systemic Inflammatory Response in Mice. Journal of Virology. 92 (24), 01614-01618 (2018).
- Laval, K., Van Cleemput, J., Vernejoul, J. B., Enquist, L. W. Alphaherpesvirus infection of mice primes PNS neurons to an inflammatory state regulated by TLR2 and type I IFN signaling. PLoS Pathogens. 15 (11), 1008087 (2019).
- Brittle, E. E., Reynolds, A. E., Enquist, L. W. Two modes of pseudorabies virus neuroinvasion and lethality in mice. Journal of Virology. 78 (23), 12951-12963 (2004).
- Mancini, M., Vidal, S. M. Insights into the pathogenesis of herpes simplex encephalitis from mouse models. Mammalian Genome: Official Journal of the International Mammalian Genome Society. 29 (7-8), 425-445 (2018).
- Kopp, S. J., et al. Infection of neurons and encephalitis after intracranial inoculation of herpes simplex virus requires the entry receptor nectin-1. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17916-17920 (2009).
- Wang, J. P., et al. Role of specific innate immune responses in herpes simplex virus infection of the central nervous system. Journal of Virology. 86 (4), 2273-2281 (2012).
- Haberthur, K., Messaoudi, I. Animal models of varicella zoster virus infection. Pathogens. 2 (2), 364-382 (2013).
- Sarova-Pinhas, I., Achiron, A., Gilad, R., Lampl, Y. Peripheral neuropathy in multiple sclerosis: a clinical and electrophysiologic study. Acta Neurologica Scandinavia. 91 (4), 234-238 (1995).
- MacGibeny, M. A., Koyuncu, O. O., Wirblich, C., Schnell, M. J., Enquist, L. W. Retrograde axonal transport of rabies virus is unaffected by interferon treatment but blocked by emetine locally in axons. PLoS Pathogens. 14 (7), 1007188 (2018).
- Hunsperger, E. A., Roehrig, J. T. Temporal analyses of the neuropathogenesis of a West Nile virus infection in mice. Journal of Neurovirology. 12 (2), 129-139 (2006).
- Swartwout, B. K., et al. Zika Virus Persistently and Productively Infects Primary Adult Sensory Neurons In Vitro. Pathogens. 6 (4), 49 (2017).
- Racaniello, V. R. One hundred years of poliovirus pathogenesis. Virology. 344 (1), 9-16 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon