Method Article
ウイルス誘導神経炎症反応を研究するマウスフットパッド接種モデル
要約
フットパッド接種モデルは、生体内でウイルス誘発性神経炎症反応を特徴付けるための貴重なツールです。特に、末梢神経系において開始されたウイルス動態および関連する免疫病理学的プロセスの明確な評価を提供する。
要約
このプロトコルは、マウスにおけるαヘルペスウイルス感染時の神経炎症反応の開始および発達を研究するために使用されるフットパッド接種モデルを記述する。αヘルペスウイルスは末梢神経系(PNS)の主な侵略者であるため、このモデルは、ウイルス複製の運動、PNSからCNSへの広がり、および関連する神経炎症反応を特徴付けるために適している。フットパッド接種モデルにより、ウイルス粒子は、フットパッド表皮の一次感染部位から、表皮、汗腺、真皮を内面化する感覚神経線維および交感神経線維に広がる。感染は坐骨神経を介して後頭根神経節(DRG)に広がり、最終的には脊髄を介して脳に広がる。ここでは、マウスフットパッドに、シュードラビウイルス(PRV)、単純ヘルペスウイルス(HSV)および水痘帯状疱疹ウイルス(VZV)と密接に関連するアルファヘルペスウイルスを接種する。このモデルは、PRV感染がフットパッドおよびDRGにおける好中球浸潤を特徴とする重度の炎症を誘発することを示す。高濃度の炎症性サイトカインは、ELISAによってホモジナイズ組織で続いて検出される。また、DRGにおけるPRV遺伝子とタンパク質発現(qPCRおよびIF染色による)と炎症性サイトカインの産生との間には強い相関関係が認められる。したがって、フットパッド接種モデルは、αヘルペスウイルス誘導神経障害の基礎となるプロセスをよりよく理解し、革新的な治療戦略の開発につながる可能性があります。さらに、このモデルは、多発性硬化症およびPNSに関連するウイルス誘発損傷などの末梢神経障害に関する研究を導くことができる。最終的には、医薬品開発のための費用対効果の高いインビボツールとして役立ちます。
概要
本研究では、PNSからCNSへのウイルスの複製と拡散および関連する神経炎症反応を調査するためのフットパッド接種モデルについて説明する。フットパッド接種モデルは,、ニューロン1、2、32におけるαヘルペスウイルス感染を研究するために集中的1に使用されている。3このモデルの主な目的は、神経刺激性ウイルスがCNSに到達する前にPNSを通って最大距離を移動できるようにすることです。ここでは、このモデルは、疑似狂犬病ウイルス(PRV)に感染したマウスにおける特定の神経障害(神経障害性かゆみ)の発症における新たな洞察を得るために使用される。
PRVは、いくつかのよく知られた病原体(すなわち、単純ヘルペス1型および2型[HSV1およびHSV2]および水痘帯状疱疹ウイルス[VZV])に関連するアルファヘルペスウイルスであり、それぞれ4の冷たいびらん、性器病変、および水疱瘡を引き起こす。これらのウイルスは、すべてのパントトロピックと特定の組織タイプの親和性を示すことなく、多くの異なる細胞型に感染することができます.しかし、それらはすべて、宿主種のPNS(時にはCNS)に侵入することによって特徴的な神経刺激性を示す。自然宿主は豚であるが、PRVはほとんどの哺乳動物に感染する可能性がある。これらの非自然な宿主では、PRVはPNSに感染し、「狂ったかゆみ」と呼ばれる重篤な掻痒を誘発し、その後に急性期死亡55、66が続く。PRV感染の臨床結果および病因における神経免疫応答の役割は十分に理解されていない。
フットパッド接種モデルは、PRVがフットパッドの表皮細胞に感染を開始することを可能にする。その後、感染は表皮、汗腺、真皮を内面化する感覚神経線維と交感神経線維に広がる。この感染は、約60時間以内に神経坐骨神経を介してDRGに移動するウイルス粒子によって広がる。感染は脊髄を通って広がり、動物がモリバンドになると最終的に後脳に達する(感染後82時間)。この時間枠の間に、組織サンプルはウイルス複製および免疫応答のマーカーについて収集、処理、および分析することができる。例えば、組織学的検査とウイルス負荷の定量は、PRV病原性における臨床的、ウイルス学的、および神経炎症性プロセスの開始と開発との間の相関関係を確立するために、異なる組織で行うことができる。
フットパッド接種モデルを用いて、マウスにおけるPRV誘発性掻痒の細胞および分子機構を調べることができます。さらに、このモデルは、ヘルペスウイルス感染時のウイルス誘発性神経炎症の開始および発症に関する新たな洞察を提供することができる。αヘルペスウイルス誘発性神経障害の根底にあるプロセスをよりよく理解することは、革新的な治療戦略の開発につながる可能性があります。例えば、このモデルは、ヘルペス後病変(例えば、帯状疱疹、帯状疱疹)を有する患者における神経因性かゆみのメカニズムを調べ、対応するヒト疾患に対するマウスの新規治療標的を試験するのに有用である。
プロトコル
すべての動物実験は、プリンストン大学の施設動物ケアおよび使用委員会(IACUC)によってレビューされ、承認されたプロトコル(番号2083-16および2083-19)に従って行われました。この作業は、プリンストン大学のバイオセーフティ委員会によって承認された設備の整ったラボを持っているバイオセーフティレベル2(BSL-2)要件に厳密に従うことによって行われました。マウスフットパッドの擦りやウイルスの接種、マウス解剖、組織採取などの手順は、プリンストン大学の生物含有動物施設室の生物学的安全キャビネット(BSC)で行った。処置を行う人は、使い捨てガウン、ヘッドカバー、目の保護、無菌手袋、外科用マスク、靴カバーを着用していました。
1. マウスフットパッドの摩耗
- イソフルランガス麻酔薬でC57BL/6マウス(5〜7週齢)を麻酔し、小さな麻酔システム(チャンバー)を介して3%の投与量で送達します。
- マウスを麻酔の外科面に置き、接種前に後ろ足パッドに置きます。マウスにダイヤフラム(動物の銃口に合わせて十分な大きさのスリット)と鼻コーンを取り付け、1.5%〜2.0%の一定の投与量でイソフルランガス麻酔薬を送達します。
- 鉗子でつま先を強引につまんで生じる痛みを伴う刺激に対する反応をマウスに注意深く監視する。
- 1つの後ろ足パッドを平らな鉗子で軽くつかみます。
- かかとと歩行パッドの間に、エメリーボード(100-180グリット)で、約20倍の後ろのフットパッドのグラブロウスの皮膚を優しくブラドします。あまりにも頻繁にブラジングしたり、あまりにも多くの圧力を加えることによって出血を誘発しないでください。
- 細かい鉗子を使用して、角層を摩耗で剥離して層のバサレを露出させるゆっくりと角質層を剥がします。
2. PRVフットパッド接種
- 2%胎児ウシ血清(FBS)および1%ペニシリン/ストレプトマイシン(材料表)を含むDMEM培地で所望の刺激物に希釈したウイルス接種を調製する。
- PK15細胞のウイルスストック中のプラーク形成単位(PFU)の数を定量化し、ウイルス投与量を計算して標準化し、それに応じてウイルス接種を希釈する。
注:本研究では、PRV(PRV-Becker)の有害株を8 x 106 PFUの用量で使用した。この用量は、すべての接種動物が82時間の接種後(hpi)で臨床症状を示したことを確認するために、以前の予備実験で最適化されました。 - ウイルスの接種を氷の上に置いておき、使用前に穏やかに混ぜます。
- PK15細胞のウイルスストック中のプラーク形成単位(PFU)の数を定量化し、ウイルス投与量を計算して標準化し、それに応じてウイルス接種を希釈する。
- 20 μL のウイルス接種液(8 x 106 PFU)を、吸盤状のフットパッドに追加します(局所投与)。模擬接種(中程度のみ)を並行して行う。
- 10倍の針を針のシャフトで軽くこすり、ウイルスの吸着を容易にします。針の点で引っ掻くのを避けてください。このステップを 10 分ごとに繰り返します。
- マウスを麻酔下で30分間、ブラッドしたフットパッドが乾くまで保管してください。
- 麻酔を停止した後、胸骨の不順を維持し、臨床フォローアップとサンプリングのために個々のケージに入れることができるようにマウスを監視します。
3. マウス解剖と組織採取
- 感染後の適切な時期に、窒息法(CO2)によりマウスを安楽死させる。
注:この研究では、PRV-Becker感染マウスの人道的エンドポイント(動物が末期症状を示し始めるとき)は82 hpiである。コントロール動物を並行して安楽死させる。 - 針/ピンを使用して外科用マットの上にマウス腹側を向けます。外科用フォームボードにピンでマウスの手足を固定します。毛皮の汚染を最小限に抑えるために、マウスの腹側を70%エタノールで濡らします。
- 鉗子を使用して毛皮と皮膚の外層をつまみ、尿道開口部の近くに細かいはさみを使用して小さな初期切開を行います。
- この開口部から、顎まで中側腹側の切開を続ける。
- 前肢と後肢の四肢に向かって2つの横切り部を延長する。
- 根底にある筋肉層から皮膚を分離し、側面にピン留めします。
- 腹腔を開き、胸部の基部まで切開します。2つの横切り切開を行うことによって腹腔の開口部を完了します。
- 両側の横隔膜と肋骨を切断して胸腔を開きます。
注:胸部の側面を切断すると、心臓を切断するリスクを防ぐことができます。 - 1.5 mLマイクロチューブで、心臓、肺、脾臓、膵臓、肝臓、腎臓、膀胱などの露出した臓器を収集します。チューブを氷の上に置いておきなさい。
- かかとと歩行パッドの間に摩耗したフットパッドを切り、ステップ3.3.6で説明したように、チューブに組織片を入れる。
- マウスの裏側を上に置き、70%エタノールで毛皮を濡らします。皮膚層を切り倒して、椎骨柱を露出させます。
- 骨盤の領域に小さな切開を行います。後肢から頭に向かって皮膚を剥ぎ取ります。
- 両サイドの脊柱に平行かつ近いはさみで切断して脚と腕を取り除きます。
- 頭を頭蓋骨の基部(C1-C2レベル)で切り落とします。
- 頭蓋マグナムから前頭骨にはさみで頭蓋骨を切り開きます。
- 鉗子を使用して頭蓋骨を横方向に引っ張ります。
- 鉗子を使用して脳をそっとすくい取り出し、ステップ3.3.6で説明したように進みます。
- 湾曲したはさみを使用して筋肉、脂肪、軟部組織を切断することによって脊柱をきれいにします。尾を切ります。無菌の氷冷リン酸緩衝生理食塩水(PBS)を含む15 mLチューブに無傷の脊柱を入れます。脊髄とDRGがさらに解離されるまで、チューブを氷の上に置いてください。
4. 脊髄とDRGの抽出
注:マウス解剖直後に脊椎列から脊髄とDRGを抽出します。脊髄およびDRG抽出のためのプロトコルは、前の出版物7から適応された。
- 氷冷PBSチューブから椎骨柱を取り出し、残りの軟組織を取り除き、冷凍後に容易になります。
- カミソリの刃を使用して、椎骨(T1、L1、およびS2レベル)を通して柱に3つの横断カットを行います。3枚を滅菌の氷冷PBSを含む15mmのペトリ皿に入れます。後で分析するために、セグメントの原点を追跡し、マークします。
- 1つのセグメントを取り、鉗子、後側を上に向けて固定します。カミソリの刃を使用して、単一の縦方向のカットダウンを作り、列を2つの等しい半分に分割します。
- 新しい滅菌氷冷PBSを含む新しいペトリ皿に両方の半分を置きます。セグメントの正しい方向を確認して、左右の側面を区別できるようにします。
- 解剖顕微鏡の下で、細かい鉗子を使用して、各半分から両側から尾部方向から尾突方向に脊髄をそっと剥がします。
- 500 μLの無菌氷冷PBSを含む1.5 mLマイクロチューブに両方の脊髄半分を集めなさい。チューブを氷の上に置いておきなさい。
- 髄液を脊柱の片側からもう一方の側にそっと取り出し、DRGを露出させる。
- 露出した脊髄神経をつかんで各DRGを個別に取り出し、脊柱からそっと引き出します。採取したDRGを、氷冷PBSを含む15mmペトリ皿に入れます。脊柱セグメントとは別に全てのイプシラショナルおよび逆側DRGを収穫し、ステップ4.5で説明したように進む。
注:DRGは白い脊髄神経に沿って丸い透明な構造として見える。 - 30~45分以内に他の2つの脊柱セグメントを使用して、ステップ4.3~4.7を繰り返します。
- 4°Cで3分間、高速(17,900 x g)ですべてのチューブを遠心分離します。
- 液体窒素中の吸気上清およびフラッシュフリーズチューブ。チューブを-80 °Cで保管し、さらに組織均質化を行います。
- あるいは、ステップ4.9後の組織病理学的分析および/または免疫蛍光染色のために、洗浄されたDRGおよび他のマウス組織を固定および切除する。
5. 組織均質化
- 凍結した組織サンプルを含むチューブを氷の上で解凍します。
- 組織の100mgの重量を量り、0.5 M EDTA(pH = 8.0)、1 M Tris-HCl(pH = 8.0)、5 M NaCl、10%SDS、プロテアーゼカクテル阻害剤を含む無菌鋼ビーズと500μLのRIPAバッファーを含む2mLマイクロ遠心分離チューブに入れます。
- 20サイクル/sで2分間ホモジナイザーを使用して室温(RT)で組織を破壊し、続いて1分の待ち時間、20サイクル/sで2分間中断します。
- RTで10分間、高速(17,900 x g)でチューブを遠心します。
- 新しいチューブに上清(500 μL)を集め、ELISAとqPCRを実行してそれぞれ炎症性マーカーとウイルス負荷を定量化するまで-20°Cで保管します。
注:qPCRの場合、RNaseフリー材料(ビーズ、チューブなど)ですべてのサンプルを収集し、1%βmercaptoエタノールを含むRNAライシスバッファー(材料表)で組織を破壊します。
凍結したDRG切片の調製および免疫蛍光染色
- 組織処理
- 解剖し、1%パラホルムアルデヒド(PFA)でDRGを2時間RTで洗浄したDRGを固定します。
- PBSで10%スクロースを含む15 mLチューブに組織を移す。4°Cで一晩インキュベートする。
- PBSで20%スクロースを有する15 mLチューブに組織を移す。4°Cで一晩インキュベートする。
- PBSで30%スクロースを持つ15 mLチューブに組織を移す。4°Cで一晩インキュベートする。
- クリオマールを使用してOCTに組織を埋め込み、急速凍結のためにドライアイスにブロックを置きます。
- 使用するまで-80°Cでサンプルを保管してください。
- 凍結切断準備
- 冷凍ブロックを-80°Cから取り出し、クライオスタット室の温度で30分間平衡させます。
- 厚さ15μmのDRGをクライオセクションし、そのセクションをスライドに取り付けます。
- ペンを使用して、スライド取り付けされた組織の周りに疎水性円を描きます。
- スライドを染色するまで4°Cに保ちます。
- 免疫蛍光染色
- DRGセクション3xをPBSでRTで10分間洗います。
- 所望の一次抗体(例えば、PRV糖タンパク質Bに対するマウス抗体)の100μLを37°Cで1時間インキュベートする。10%陰性ヤギ血清を含むPBSで一次抗体を希釈します。
- ステップ 6.3.1 を繰り返します。
- 所望の二次抗体(ヤギ抗マウスアレクサフルオール488)の100 μLを37°Cで50分間インキュベートします。PBSのみで二次抗体を希釈。
- PBSで希釈したDAPI(4′,6-ジミジノ-2-フェニリンドール)の100 μLをセクションに加えます。さらに37°Cでサンプル10分をインキュベートする。
- ステップ 6.3.1 を繰り返します。
- ガラススライドに蛍光実装媒体を使用してサンプルを取り付け、カバースリップで固定してカバーします。
7. パラフィン埋め込み組織切片の調製とH&E染色
- 4°Cで24時間10%ホルマリンで組織を固定します。
- 固定組織のパラフィン埋め込みと切除のための標準的な処理スケジュールを実行します。固定組織を70%エタノールに移し、前述の8のように、アップグレードされたアルコールをキシレンに処理し、その後パラフィンを処理する。
注:ポリエステルスポンジを使用して、DRGなどの小さな組織サンプルをカセット内に保管してください。 - 前述の9のように、標準的な脱パラフィンを行い、続いて組織切片をH&E染色を行う。
結果
マウスフットパッド接種モデルは、インビボにおけるαヘルペスウイルス感染の免疫病原性の特徴付け、接種されたフットパッドから神経系への感染の複製および広がりおよび特定の神経炎症反応の誘導を可能にする。
本研究では、まずマウス後方のフットパッドをブラドし、PRV(PRV-Becker)の有害な株で、模擬接種または接種領域のいずれかを接種した。摩耗の部位は、コントロールフットパッドに見えました。癒しの過程の一部として、摩耗部位に地殻が形成された(図1、黒矢印)。対照的に、PRVを接種したマウスは、フットパッドの腫脹および発赤を特徴とするヒトエンドポイント(82 hpi)で重篤な炎症を示した。
毒性のPRV-ベッカー株によるフットパッドの接種後、マウスは72 hpiで臨床徴候を示し始め、接種されたフットパッドの腫脹とますます頻繁な振戦を特徴とする。82 hpiによって、PRV-Becker感染マウスは、接種された脚に一定の揺れと足の激しい引っ掻きや噛み付きを含む特徴的なPRV症状を示した。フットパッドにも重度の炎症が認められた。PRV感染時に誘発された炎症反応は、さらに特徴づけられ、免疫細胞の組織への浸潤を含む。
いくつかの組織の病理組織学的検査を行いました, 接種フットパッドとDRGを含む, パラフィン埋め込まれた組織切片のH&E染色が続きます.上皮壊死および重症の皮膚炎(浮腫およびフィブリン)は、PRV感染した足部で観察された(図2A、パネルb)。感染したマウスの表皮、真皮、および結合組織は、黒い矢印でマークされた好中球(多葉核によって同定される)の巨大な浸潤を示した。コントロールマウスのフットパッドは正常であった(図2A、パネルa)。PRV感染したDRGは、コントロールマウスのDRGが正常であった間、感染したマウスでは最小限の神経壊死および混合炎症を示した(図2B、パネルa及びb)。混合炎症は主に好中球とリンパ球からなる。
次に、PRVフットパッド接種後のマウス組織における炎症性サイトカイン産生の動態が確立された。特異的な炎症性サイトカインのレベルを定量化した(すなわち、インターロイキン-6[IL-6]および顆粒球コロニー刺激因子[G-CSF])を、コントロールおよびPRV感染マウスから採取し、均質化したいくつかの組織から。結果は、7 hpiおよび82 hpiのコントロールと比較してフットパッドおよびDRGのG-CSFレベルの有意な増加を示した(図3A)。対照と比較して、脊髄、脳、心臓、およびPRV感染マウスの肝臓組織における82 hpiで有意なG-CSFレベルが観察された。さらに、24 hpiから始まるコントロールと比較して、PRV感染マウスのすべての組織で有意なIL-6レベルが検出された(図3B)。
フットパッド接種モデルはさらにPRV複製を調査し、接種されたフットパッドからPNSおよびCNSへの広がりおよび神経炎症反応の発達との潜在的な相関関係を調査するために使用された。PRV負荷をqPCRによりいくつかの均質化組織で定量し、PRV DNAを増幅した。次に、DNA濃度をPFUに変換し、前述の10.PRV負荷は、フットパッドから24 hpi(組織の1 x 10 4 PFU/mg)から始まり、DRGでは60 hpi(約1 x 103 PFU/mgの組織;データは示されていない)から検出された。4
モリバンド状態(82 hpi)では、PRVがフットパッド、DRG、脊髄および脳で検出され、DRG中のPRV濃度が最も高い(1 x 105 PFU/mgの組織;図 4.DRGのPRV感染は、DRGクライオセクションの間接免疫蛍光染色によって確認された。PRV感染は抗PRV gB抗体を用いたDRGニューロンで検出された。PRV糖タンパク質gBは、感染細胞の細胞質における感染の後期段階で発現した。予想通り、PRVgB(緑色)の細胞質発現は、感染したDRGで確認されたが、対照サンプルではgBは発現しなかった(図5)。細胞核は、DAPI染色(青色)で同定した。

図1:PRV接種後のマウス右後足の代表的な画像。マウスは、右後方のパッドに模擬接種またはPRVを接種する。PRV接種フットパッドは、人道的エンドポイント(82 hpi)における発赤および腫脹を含む炎症の徴候を示す。コントロールマウスのフットパッドは、開耗部位に暗い赤い地殻を有して正常に見え、創傷が治癒していることを示す。黒い矢印は摩耗部位を示す。この図は、以前の文書11から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:PRVフットパッド接種後のフットパッドおよびDRGにおける病理組織学的所見ヘマトキシリンおよびエオシン(H&E)マウスの(A)マウスを接種したフットパッドおよび(B)およびイプシラショナルDRGをコントロール(パネルa)およびPRV感染(パネルb)マウスから82hpiで染色する。PRV感染組織(表皮および神経壊死および好中球浸潤)で観察された組織病理学的症状は、検査されたすべての模擬感染マウスには存在しない。結果は、特定のタイプの組織に対する3つの生物学的複製を表す。黒い矢印は、免疫細胞浸潤による炎症の代表的な領域を示す。各画像にスケールバー(50 μm)が表示されます。この図は11から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:PRVフットパッド接種後の均質化マウス組織における炎症性サイトカイン産生の動態。(A) G-CSFおよび(B)異なるhpiでPRV感染(赤)および対照(黒)マウスホモジナイズ組織で検出されたIL-6タンパク質レベル。タンパク質レベルはELISAによって定量化され、均質化された組織のミリグラム当たりピコグラム(pg)(mg)として表されます(n =5グループあたり5、*p<0.05、ns=有意ではありません)。この図は、以前の文書12から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
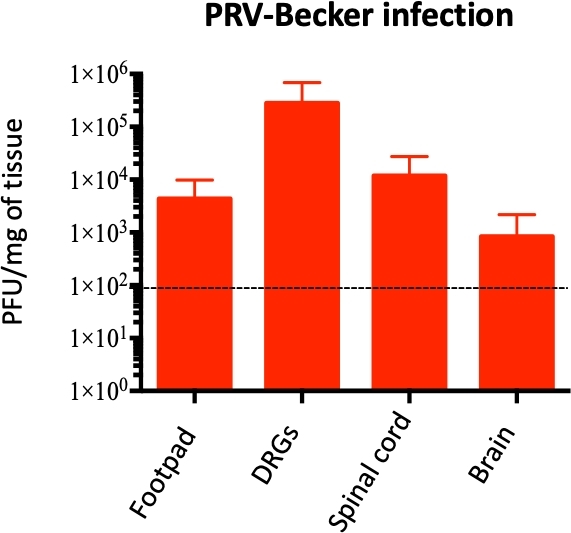
図4:マウスホモジナイズ組織におけるPRVゲノムの定量化PRV DNAは、PRV UL54プライマーを用いたqPCRによりホモジナイズマウス組織で定量される。PRV負荷は、組織のmg当たりのプラーク形成単位(PFU)として表される。PRV DNAは、足、DRG、脊髄、および脳(および他の組織では検出されない)にのみ検出され、n=10グループ当たり10個である。点線は検出限界を示す。この図は、以前の文書11から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:免疫蛍光染色によるDRGニューロンにおけるPRV感染の評価PRV gB(緑色)に特異的なマウス抗体を用いた免疫蛍光染色後のモックおよびPRV感染したDRGニューロンの共焦点Zスタック画像。細胞核はDAPI(青、パネルaおよびc)で染色される。パネルdは、gB(白矢印)を発現する複数のPRV感染ニューロンを示す。制御 DRG セクション (パネル b) では gB 式は検出されません。各画像にスケールバー(50 μm)が表示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここで説明するフットパッド接種モデルは、αヘルペスウイルス感染時の神経炎症反応の開始および発達を調べるのに有用である。さらに、このin vivoモデルは、PNSからCNSへのαヘルペスウイルスの複製および拡散の運動学を確立するために使用される。これは、深い真皮掻き傷13に依存する腹面皮膚接種モデル、またはCNS,14、15、16,15にウイルスを直接導入する頭蓋内経路などの他の接種モデルとの代替である。16その結果、フットパッドモデルを用いて、神経系11,12,12における関連局所および遠隔免疫病理学的過程での複製および感染のウイルス動態のより詳細な評価を得ることができる。
このプロトコルでは、フットパッドの摩耗とその後のウイルス接種は重要なステップです。実際、角層は、感染に成功するためにウイルス接種に層のバサレを暴露するために、十分な擦過後に完全に除去する必要があります。しかし、これは血液の感染を防ぐのに役立つので、摩耗は穏やかで、出血を誘発してはならない。剥離角質は、光顕微鏡下でH&E染色によって可視化することができる。角質層に存在する角質細胞は、核を欠く平らな好酸球細胞である。ウイルスの接種液(20 μL液滴)の容積は、液滴がフットパッドに留まり、防滴部位を覆うことを確実にするために最適化された。イノキュラム液滴を摩耗したフットパッドに優しくこすりつけ、効率的なウイルス浸透に不可欠です。麻酔を停止し、新しいケージに動物を置くためにフットパッドが完全に乾燥するまで待つことをお勧めします。このステップは、マウスが、あざけりフットパッドからウイルスの接種を舐めることを避ける。麻酔に同時に公開するように設定されたノーズコーンを使用して、一度に最大3匹のマウスを処理することをお勧めします。
マウスの解剖を行う際には、脊髄および関連するDRGの損傷を防ぐ椎骨柱と平行に切り傷を行うことが重要です。また、脊柱への偶発的な切断を減らし、正中線を切り倒す前に鉗子で列セグメントのより良いグリップを容易にするために、できるだけ多くの脂肪、筋肉、軟部組織を除去することが示唆されています。
また、クリーニングされたカラムセグメントを生成し、DRGペアを損傷するリスクを制限するために、ディスク間の椎骨カラムを通して横断的なカットを行うことをお勧めします。脊髄を取り囲み、DRGを覆う髄を完全に除去して、DRGの同定と抽出を容易にする必要があります。DRGは鉗子から損傷を受けることなく、脊柱から注意深く取り除くべきである。H&Eおよび免疫蛍光染色のためにDRGがそのまま残ることが重要である。このインビボ実験の効率にタイミングが重要であり、できるだけ新鮮な組織を収集するために、マウス解剖および脊髄/DRG抽出を連続して行う必要があります。
ここで説明する組織均質化法は、多数の異種組織サンプルの効率的な破壊を確実にするために最適化されている。使用される組織の量を標準化することが最も重要であり、サンプル間のELISAおよびqPCR結果を直接比較することが可能です。例えば、各均質化手順に対して100mgの組織を計量することが示唆される。各組織サンプルは全体で均質化する必要があり、残り物は凍結解凍されるべきではありません。均質化中の汚染を避けるために、使用前にスチールビーズと鉗子をオートクレーブすることが重要です。500 μLの容積は100 mgティッシュサンプルの完全な均質化を保障するために最適である。この限られた容積は、サンプルあたり3〜4個のELISAキットの処理のみを可能にすることに注意することが重要です。
フットパッド接種モデルを用いて、マウスにおけるPRV感染が、フットパッドおよびDRGにおける好中球浸潤を特徴とする重篤な炎症を誘発することが実証された。高濃度の炎症性サイトカインG-CSFおよびIL-6もELISAを用いた多くの均質化組織において検出された。さらに、DRGにおけるPRV遺伝子とタンパク質発現(qPCRおよびIF染色による)と、両方の炎症性サイトカインの産生との間に強い相関関係が見られた。
このモデルは、異なるαヘルペスウイルス感染の間で、ウイルス複製/広がりの運動および神経炎症反応を比較するのに適している。例えば、VZVに関しては、制限された宿主特異性および臨床疾患の欠如は、動物モデル17の使用を制限している。したがって、マウスフットパッドPRV接種モデルは、ヘルペス後病変患者における神経因性掻痒を担う細胞および分子機構の研究のための新しい動物モデルを表す可能性がある。VZVとPRVの間の臨床徴候、病因、ゲノムの類似性に基づいて、このマウスモデルはVZVの病態の理解を高め、革新的な治療戦略の発展につながると考えられています。
最後に、このモデルは、多発性硬化症およびPNS18に関連するウイルスによる損傷などの末梢神経障害に関する研究を導く。PNSに感染することが知られているいくつかの神経刺激性ウイルス(すなわち、狂犬病ウイルス、ポリオウイルス、西ナイルウイルス、ジカウイルス)の病因は、このモデル19、20、21、22,21を用いて研究することもできる。19,,22フットパッド接種モデルは、薬剤開発のための可能な費用対効果の高いツールとして使用することができます。例えば、ウイルス誘発性末梢神経障害を予防するために設計された抗炎症薬および抗ウイルス薬の有効性をスクリーニングし、テストするためのプラットフォームとして機能し得る。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、チャールズ川研究所が組織病理学分析を実行する優れた技術サポートを認めている。この研究は、国立神経疾患・脳卒中研究所(NINDS)(RO1 NS033506およびRO1 NS060699)によって資金提供されました。資金提供者は、研究デザイン、データ収集と分析、出版の決定、原稿の作成に何の役割も持っていませんでした。
資料
| Name | Company | Catalog Number | Comments |
| Antibody anti-PRV gB | Made by the lab | 1/500 dilution | |
| Aqua-hold2 pap pen red | Fisher scientific | 2886909 | |
| Compact emery boards-24 count (100/180 grit nail files) | Revlon | ||
| Complete EDTA-free Protease Inhibitor Cocktail | Sigma-Aldrich | 11836170001 | |
| C57BL/6 mice (5-7 weeks) | The Jackson Laboratories | ||
| DAPI solution (1mg/ml) | Fisher scientific | 62248 | 1/1000 dilution |
| Disposable sterile polystyrene petri dish 100 x 15 mm | Sigma-Aldrich | P5731500 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Hyclone, GE Healthcare life Sciences | SH30022 | |
| Dulbecco's Phophate Buffer Saline (PBS) solution | Hyclone, GE Healthcare life Sciences | SH30028 | |
| Fetal bovine serum (FBS) | Hyclone, GE Healthcare life Sciences | SH30088 | |
| Fine curved scissors stainless steel | FST | 14095-11 | |
| Fluoromount-G mounting media | Fisher scientific | 0100-01 | |
| Formalin solution, neutral buffered 10% | Sigma-Aldrich | HT501128 | |
| Isothesia Isoflurane | Henry Schein | NDC 11695-6776-2 | |
| Microcentrifuge tube 2ml | Denville Scientific | 1000945 | |
| Microtube 1.5ml | SARSTEDT | 72692005 | |
| Negative goat serum | Vector | S-1000 | |
| Penicillin/Streptomycin | Gibco | 154022 | |
| Precision Glide needle 18G | BD | 305196 | |
| Razor blades steel back | Personna | 9412071 | |
| RNA lysis buffer (RLT) | Qiagen | 79216 | |
| Stainless Steel Beads, 5 mm | Qiagen | 69989 | |
| Superfrost/plus microscopic slides | Fisher scientific | 12-550-15 | |
| Tissue lyser LT | Qiagen | 69980 | |
| Tissue-Tek OCT | Sakura | 4583 | |
| 488 (goat anti-mouse) | Life Technologies | A11029 | 1/2000 dilution |
参考文献
- Field, H. J., Hill, T. J. The pathogenesis of pseudorabies in mice following peripheral inoculation. Journal of General Virology. 23 (2), 145-157 (1974).
- Engel, J. P., Madigan, T. C., Peterson, G. M. The transneuronal spread phenotype of herpes simplex virus type 1 infection of the mouse hind footpad. Journal of Virology. 71 (3), 2425-2435 (1997).
- Guedon, J. M., et al. Neuronal changes induced by Varicella Zoster Virus in a rat model of postherpetic neuralgia. Virology. 482, 167-180 (2015).
- Pomeranz, L. E., Reynolds, A. E., Hengartner, C. J. Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine. Microbiology and Molecular Biology Reviews. 69 (3), 462-500 (2005).
- Wittmann, G., Rziha, H. J., Knipe, D. M., Howley, P. M. Aujeszky's disease (pseudorabies) in pigs. Herpesvirus diseases of cattle, horses and pigs. 9, 230-325 (1989).
- Leman, A. D., Glock, R. D., Mengeling, W. L., Penny, R. H. C., Scholl, E., Straw, B. . Diseases of swine, 6th ed. , 209-223 (1986).
- Sleigh, J. N., Weir, G. A., Schiavo, G. A simple, step-by-step dissection protocol for the rapid isolation of mouse dorsal root ganglia. BMC Research Notes. 9, 82 (2016).
- Sands, S. A., Leung-Toung, R., Wang, Y., Connelly, J., LeVine, S. M. Enhanced Histochemical Detection of Iron in Paraffin Sections of Mouse Central Nervous System Tissue: Application in the APP/PS1 Mouse Model of Alzheimer's Disease. ASN Neuro. 8 (5), (2016).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor Protocols. 2014 (6), 655-658 (2014).
- Koyuncu, O. O., MacGibeny, M. A., Hogue, I. B., Enquist, L. W. Compartmented neuronal cultures reveal two distinct mechanisms for alpha herpesvirus escape from genome silencing. PLoS pathogens. 13 (10), 1006608 (2017).
- Laval, K., Vernejoul, J. B., Van Cleemput, J., Koyuncu, O. O., Enquist, L. W. Virulent Pseudorabies Virus Infection Induces a Specific and Lethal Systemic Inflammatory Response in Mice. Journal of Virology. 92 (24), 01614-01618 (2018).
- Laval, K., Van Cleemput, J., Vernejoul, J. B., Enquist, L. W. Alphaherpesvirus infection of mice primes PNS neurons to an inflammatory state regulated by TLR2 and type I IFN signaling. PLoS Pathogens. 15 (11), 1008087 (2019).
- Brittle, E. E., Reynolds, A. E., Enquist, L. W. Two modes of pseudorabies virus neuroinvasion and lethality in mice. Journal of Virology. 78 (23), 12951-12963 (2004).
- Mancini, M., Vidal, S. M. Insights into the pathogenesis of herpes simplex encephalitis from mouse models. Mammalian Genome: Official Journal of the International Mammalian Genome Society. 29 (7-8), 425-445 (2018).
- Kopp, S. J., et al. Infection of neurons and encephalitis after intracranial inoculation of herpes simplex virus requires the entry receptor nectin-1. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17916-17920 (2009).
- Wang, J. P., et al. Role of specific innate immune responses in herpes simplex virus infection of the central nervous system. Journal of Virology. 86 (4), 2273-2281 (2012).
- Haberthur, K., Messaoudi, I. Animal models of varicella zoster virus infection. Pathogens. 2 (2), 364-382 (2013).
- Sarova-Pinhas, I., Achiron, A., Gilad, R., Lampl, Y. Peripheral neuropathy in multiple sclerosis: a clinical and electrophysiologic study. Acta Neurologica Scandinavia. 91 (4), 234-238 (1995).
- MacGibeny, M. A., Koyuncu, O. O., Wirblich, C., Schnell, M. J., Enquist, L. W. Retrograde axonal transport of rabies virus is unaffected by interferon treatment but blocked by emetine locally in axons. PLoS Pathogens. 14 (7), 1007188 (2018).
- Hunsperger, E. A., Roehrig, J. T. Temporal analyses of the neuropathogenesis of a West Nile virus infection in mice. Journal of Neurovirology. 12 (2), 129-139 (2006).
- Swartwout, B. K., et al. Zika Virus Persistently and Productively Infects Primary Adult Sensory Neurons In Vitro. Pathogens. 6 (4), 49 (2017).
- Racaniello, V. R. One hundred years of poliovirus pathogenesis. Virology. 344 (1), 9-16 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved