Method Article
עכבר כרית הרגליים מודל לחקר ויראלי המושרה תגובות נוירודלקתיות
In This Article
Summary
מודל החיסונים הוא כלי רב ערך לאפיון תגובות נוירודלקתיות המושרה בvivo. בפרט, היא מספקת הערכה ברורה של קינטיקה ויראלית ותהליכים immunopathological משויכים המופעלים במערכת העצבים ההיקפית.
Abstract
פרוטוקול זה מתאר מודל החיסון לשימוש לימוד ייזום ופיתוח של תגובות נוירודלקתיות במהלך זיהום וירוס אלפא בעכברים. כמו אלפא וירוסים הם הפולשים העיקריים של מערכת העצבים ההיקפית (היקפית), מודל זה מתאים לאפיין את קינטיקה של שכפול נגיפי, התפשטות שלו מ היקפית ל-CN, ותגובות נוירודלקתיות הקשורים. מודל כרית הרגליים מאפשר חלקיקי וירוס להתפשט מאתר זיהום ראשוני באפידרמיס הfootpad לסיבי עצב חושי ואוהד הinnervate את האפידרמיס, בלוטות זיעה, ו dermis. הזיהום מתפשט דרך העצב המגיד לגנגוליה השורש (DRG) ובסופו של דבר דרך חוט השדרה אל המוח. כאן, footpad העכבר הוא מחוסן עם וירוס פסבדו אקראי (PRV), וירוס אלפהרתקרוב הקשורות וירוס הרפס (HSV) אבעבועות רוח-זוסטר וירוס (VZV). מודל זה ממחיש כי זיהום PRV מעורר דלקת חמורה, מאופיין הסתננות נויטרופילים ב footpad ו DRG. ריכוזים גבוהים של ציטוקינים דלקתיים מזוהים לאחר מכן ברקמות הומוגניים על ידי אליסה. בנוסף, מתאם חזק הוא הבחין בין הגן PRV וביטוי חלבון (דרך qPCR ו IF כתמים) ב DRG וייצור ציטוקינים פרו דלקתיים. לכן, מודל החיסון העצמי מספק הבנה טובה יותר של התהליכים הבסיסיים המושרה על ידי הנגיף אלפא, ועלול להוביל לפיתוח אסטרטגיות טיפוליות חדשניות. בנוסף, המודל יכול להנחות מחקר על neuropathies היקפית, כגון טרשת נפוצה ונזק המושרה ויראלי הקשורים היקפית. בסופו של דבר, זה יכול לשמש ככלי חסכוני vivo לפיתוח התרופה.
Introduction
מחקר זה מתאר מודל כרית החיסון כדי לחקור את השכפול והתפשטות של וירוסים מ היקפית ל-CN ותגובות נוירודלקתיות הקשורים. מודל footpad החיסון השתמשו באופן אינטנסיבי כדי לחקור את הזיהום וירוס אלפא בנוירונים1,2,3. המטרה העיקרית של מודל זה היא לאפשר וירוסים נוירוטרופי לנסוע במרחק מקסימלי דרך היקפית לפני שהגיע ל-CN. כאן, מודל זה משמש כדי להשיג תובנות חדשות בפיתוח נוירופתיה מסוימת (גירוד נוירופתי) בעכברים נגועים בווירוס פסבדו אקראי (PRV).
PRV היא וירוס אלפא הקשורים מספר פתוגנים ידועים (קרי, הרפס סוג 1 ו 2 [HSV1 and HSV2] ו אבעבועות רוח-zoster וירוס [VZV]), אשר גורמות פצעים קרים, נגעים באברי המין, ואבעבועות עוף, בהתאמה4. וירוסים אלה הם כל pantropic ומסוגל להדביק סוגים רבים של תאים שונים מבלי להציג אהדה עבור סוג הרקמה הספציפית. עם זאת, הם כולם מוצגים נוירוטרוזם אופייני על ידי הפולשים היקפית (ולפעמים, ה-CN) של המינים המארחים. הפונדקאי הטבעי הוא חזיר, אבל PRV יכול להדביק את רוב היונקים. במחשבים מארחים לא טבעיים אלה, prv מדביק את היקפית ומשרה מתחריטוס חמור שנקרא "גירוד מטורף", ואחריו מוות בחריפות5,6. התפקיד של התגובה נוירוחיסונית בתוצאה הקלינית בפתוגנזה של זיהום PRV כבר הבינו היטב.
מודל החיסון מאפשר PRV ליזום זיהום בתאים באפידרמיס של footpad. לאחר מכן, הזיהום מתפשט לתוך סיבים עצביים חושים וסימפטיים הinnervate את האפידרמיס, בלוטות זיעה, ו dermis. הזיהום מתפשט על ידי חלקיקי וירוס נע דרך העצב הגיד כדי DRG בתוך כ 60 h. הזיהום מתפשט דרך חוט השדרה, בסופו של דבר להגיע המוח המבוקר כאשר בעלי חיים הופכים מורבנד (82 h לאחר ההדבקה). במהלך הזמן הזה חלון, דגימות רקמות ניתן לאסוף, מעובד, וניתח עבור שכפול וירוסים סמנים של התגובה החיסונית. למשל, בדיקה היסטולוגית וכימות העמסה ויראלי ניתן לבצע ברקמות שונות כדי ליצור מערכת יחסים בין ייזום ופיתוח של קליני, virological, ו דלקתיות תהליכים בפתוגנזה PRV.
באמצעות מודל החיסונים, המנגנונים הסלולאריים והמולקולריים של הפרוריטוס המושרה בעכברים ניתן לחקור. יתר על כן, מודל זה יכול לספק תובנה חדשה לתוך ייזום ופיתוח של דלקת נוירודלקתיות המושרה במהלך דלקות הרפס. הבנה טובה יותר של התהליכים הבסיסיים המושרה על ידי הנגיף האנטי-וירוס עלולה להוביל לפיתוח אסטרטגיות טיפוליות חדשניות. למשל, מודל זה שימושי כדי לחקור את המנגנונים של גירוד נוירופתי בחולים עם נגעים פוסט herpetic (למשל, הרפס zoster, רעפים) ולבדוק מטרות טיפוליות הרומן בעכברים עבור מחלות האדם המקביל.
Protocol
כל ניסויי בעלי חיים בוצעו בהתאם לפרוטוקול (מספר 2083-16 ו 2083-19) שנבדקו ואושרו על ידי הוועדה לטיפול בבעלי חיים המוסד (IACUC) של אוניברסיטת פרינסטון. עבודה זו נעשתה על ידי בקפדנות הדרישות ברמת בטיחות 2 (BSL-2), אשר יש לנו מעבדה מאובזר באופן מלא אושרה על ידי ועדת אוניברסיטת פרינסטון בטיחות הוועדה. ההליכים כולל שחיקה באמצעות העכבר, החיסון הנגיפי, ניתוח העכבר, ואוסף רקמות בוצעו בארון בטיחות ביולוגי (תואר ראשון) בחדר מתקן ביולוגי באוניברסיטת פרינסטון. אלה המבצעים את ההליך לבשו שמלות חד פעמיות, כיסוי ראש, הגנת עיניים, כפפות סטרילי, מסכות כירורגיות וכיסויי נעליים.
1. משטח העכבר שחיקה
- הרדמה לעכבר C57BL/6 (5 – 7 שבועות) עם מהרדמה גז isofלאנה, נמסר במינון של 3% באמצעות מערכת הרדמה קטנה (קאמרית).
- הניחו את העכבר במישור הכירורגי של ההרדמה על גבו, לפני החיסון, בתוך הרגליים האחוריות. חברו חרוט אף עם דיאפרגמה (סדק בגודל מספיק כדי להתאים את הלוע של בעל החיים) לעכבר ולספק isofלוריאן גז הרדמה במינון קבוע של 1.5% – 2.0%.
- לעקוב בקפדנות את העכבר לתגובה גירוי מכאיב שנוצר על ידי צובט חזק של הבוהן עם מלקחיים.
- לתפוס בקלות אחד footpad האחוריות עם מלקחיים שטוח.
- בעדינות את העור מגלפת של הרגליים האחוריות כ 20x, בין העקב ורפידות הליכה, עם הלוח נייל (100 – 180 חצץ). אין לגרום לדימום על ידי שהוא שולל לעתים קרובות מדי או להחיל יותר מדי לחץ.
- באמצעות מלקחיים עדינים, לקלף לאט את הרובד הקרנית מנותקת על ידי שחיקה כדי לחשוף את הרובד basale.
2. כרית הרגל PRV
- הכן את הנגיף מדולל לתוך סיכוייו הרצוי במדיה dmem המכיל 2% סרום העוברי (fbs) ו 1% פניצילין/סטרפטומיצין (טבלת חומרים).
- בקוונטייט מספר יחידות להרכיב פלאק (PFU) במניה וירוס על PK15 תאים כדי לחשב ולתקנן את המינון הנגיפי ולדלל את הנרשת ויראלי בהתאם.
הערה: במחקר זה, זן מודבק של PRV (PRV-בקר) שימש במינון של 8 x 106 pfu. מינון זה היה אופטימיזציה בניסוי ראשוני קודם כדי להבטיח כי כל בעלי החיים מחוסן הראו סימפטומים קליניים ב 82 h לאחר החיסון (hpi). - לשמור על הנגיף הנרשת על קרח ולערבב בעדינות לפני השימוש.
- בקוונטייט מספר יחידות להרכיב פלאק (PFU) במניה וירוס על PK15 תאים כדי לחשב ולתקנן את המינון הנגיפי ולדלל את הנרשת ויראלי בהתאם.
- הוספה של 20 μL droplet של וירוס הנרשת (8 x 106 pfu) אל הfootpad המנוסות (מינהל אקטואלי). לבצע החיסונים מבוים (בינוני בלבד) במקביל.
- שפשף בעדינות 10x עם מוט של מחט כדי להקל על ספיחה של הווירוס. הימנע מגירוד עם נקודת המחט. חזור על שלב זה כל 10 דקות.
- לשמור על העכבר תחת הרדמה במשך 30 דקות עד כרית הרגליים שנוצר יבש.
- לאחר הפסקת ההרדמה, לפקח על העכבר עד שהוא יכול לשמור על שכיבה משנית ולמקם אותו בכלוב יחיד עבור מעקב קליני ודגימה.
3. אוסף העכבר לנתיחה ורקמות
- בזמנים מתאימים לאחר זיהום, המתת החסד של העכבר על ידי שיטת חנק (CO2).
הערה: במחקר זה, נקודת הקצה ההומאנית (כאשר בעלי חיים מתחילים להפגין תסמיני הטרמינל) עבור העכברים הנגועים PRV-בקר הוא 82 hpi. המתת חסד שליטה בעלי חיים במקביל. - מניחים את העכבר בצד הגחוני מול על מחצלת כירורגית באמצעות מחטים/פינים. לאבטח את הגפיים של העכבר עם פינים ללוח קצף כירורגי. להרטיב את הצד הגחוני של העכבר עם 70% אתנול כדי למזער את זיהום הפרווה.
- לצבוט את השכבה החיצונית של פרווה ועור באמצעות מלקחיים ולעשות חתך הראשונית קטן באמצעות מספריים עדינים ליד פתיחת השופכה.
- מתוך פתיחה זו, להמשיך את החתך על הצד השני באמצע עד הסנטר.
- הרחב שני חתכים לרוחב לכיוון הגפיים של הגפיים האחוריות.
- הפרידו את העור משכבת השרירים הבסיסית והצמד מטה אל הצד.
- פתחו את חלל הבטן. והכול עד לבסיס החזה להשלים את הפתיחה של חלל הבטן על ידי ביצוע שני חתכים נוגדים.
- פתח את חלל החזה על ידי חיתוך הסרעפת וצלעות על שני הצדדים הצדדיים.
הערה: גזירת צלעות הצלעות מונעת את הסיכון לחתוך את הלב. - איסוף איברים חשופים, כולל לב, ריאות, טחול, לבלב, כבד, כליות, ושלפוחית השתן ב 1.5 mL מיקרוצינוריות. . השאר את הצינורות על הקרח
- חותכים את הרגל השורק בין העקב לבין רפידות הליכה ומניחים את פיסת הרקמה בצינור כמתואר בשלב 3.3.6.
- מניחים את העכבר הצידה והרטיב את הפרווה עם 70% אתנול. חותכים את שכבת העור כדי לחשוף את העמודה החוליות.
- לעשות חתך קטן באזור האגן. להסיר את העור מן הגפיים האחוריות לעבר הראש.
- הסר את הרגליים ואת הידיים על ידי גזירה עם מספריים מקבילים עם וקרוב עמוד השדרה משני הצדדים.
- חותכים את הראש בבסיס הגולגולת (רמה C1-C2).
- תחתוך את הגולגולת עם מספריים. מגנום האמן לעצם הקדמית
- למשוך לפתוח את הגולגולת בכיוונים לרוחב באמצעות מלקחיים.
- בעדינות לגרוף את המוח באמצעות מלקחיים ולהמשיך כמתואר בשלב 3.3.6.
- לנקות את עמוד השדרה על ידי גזירה שרירים, שומן ורקמות רכות באמצעות מספריים מעוקל. . תחתוך את הזנב מניחים את עמוד השדרה ללא שינוי בצינור 15 מ ל המכיל תמיסת מלח סטרילית באגירה מפוספרת קרח (PBS). שמרו על הצינורות בקרח עד לניתוח נוסף של חוט השדרה ו-DRG.
4. חוט השדרה והוצאת DRG
הערה: לחלץ את חוט השדרה ואת DRG מן החוליה החוליות ישירות בעקבות לנתיחה העכבר. הפרוטוקול עבור חוט השדרה וחילוץ DRG כבר הותאם מהפרסום הקודם7.
- הסר את העמודה חוליות מצינור הקרח קר PBS ולהסיר את הרקמות הרכות הנותרות, אשר הופך להיות קל יותר לאחר הקירור.
- לעשות שלוש חתכים רוחבי בעמודה דרך החוליות (T1, L1, ו-S2 רמות) באמצעות להב תער. הניחו את שלושת החלקים בצלחת פטרי בעלת 15 מ"מ המכילה PBS קר-קרח סטרילי. שמור על מעקב אחר וסמן מקור של מקטעים לניתוח מאוחר יותר.
- לקחת קטע אחד ולאבטח אותו בין מלקחיים, הצד השני פונה כלפי מעלה. לעשות בודד, חתך האורך דרך קו האמצע באמצעות להב תער, פיצול העמודה בשני חצאים שווים.
- מניחים את שני החצאים בצלחת פטרי חדשה המכילה מחדש סטרילי קר קרח PBS. ודא שהכיוון הנכון של המקטע יוכל להבחין בין צד שמאל לימין.
- תחת מיקרוסקופ מבתר, בעדינות לקלף את חוט השדרה מתוך הטור חוליות מכל חצי rostral לכיוון caudal באמצעות מלקחיים עדינים.
- לאסוף את שני החצאים חוט השדרה במיקרוצינורות 1.5 mL המכילים 500 μL של הקרח סטרילי קר-PBS. . השאר את הצינורות על הקרח
- להסיר בעדינות את קרום הקרומי מצדו האחד של עמוד השדרה לשני כדי לחשוף את DRG.
- הסר כל DRG בנפרד על ידי אוחז בעצב השדרה חשוף למשוך אותו בעדינות מתוך עמוד השדרה. מניחים את DRG שנאסף ב 15 מ"מ צלחת פטרי המכיל הקרח קר PBS. הקציר כל ipsilateral ו מוחלק מצלעות DRG בנפרד מקטע עמוד השדרה ולהמשיך כמתואר בשלב 4.5.
הערה: DRG הוא גלוי כמו מבנה שקוף עגול לאורך העצב השדרה הלבנה. - חזור על שלבים 4.3 – 4.7 בשני מקטעי עמוד השדרה האחרים בתוך 30 – 45 דקות.
- צנטריפוגה את כל הצינורות במהירות גבוהה (17,900 x g) עבור 3 דקות ב 4 ° c.
- . וצינורות הקפאה בחנקן נוזלי לאחסן צינורות ב-80 ° צ' לצורך המגון רקמות נוסף.
- לחילופין, לתקן ולחלק את DRG ניקה ורקמות העכבר האחרים עבור ניתוחים histopathological ו/או immunofluorescence כתמים לאחר שלב 4.9.
5. הומורקמה
- להפשיר את הצינורות המכילים. דגימות רקמות קפואות על הקרח
- שוקלים 100 מ"ג של רקמות ומניחים אותו בצינור מיקרוצנטריפוגה 2 mL המכיל חרוז פלדה סטרילית ו 500 μL של מאגר ריפה המכיל 0.5 M EDTA (pH = 8.0), 1 M טריס-HCl (pH = 8.0), 5 M הנאל, 10% SDS, ו לוחות מעכבי קוקטייל פרוטאז.
- לשבש את הרקמות בטמפרטורת החדר (RT) באמצעות הומוגניצר ב 20 מחזורים/s עבור 2 דקות, ואחריו 1 דקות המתנה תקופה, אז 20 מחזורים/s עבור 2 דקות.
- צנטריפוגה את הצינור במהירות גבוהה (17,900 x g) עבור 10 דקות ב RT.
- לאסוף supernatant (500 μL) בצינור חדש ולאחסן אותו ב-20 ° c עד ביצוע אליסה ו qPCR כדי לכמת סמנים דלקתיים עומסים ויראלי, בהתאמה.
הערה: עבור qPCR, לאסוף את כל הדגימות עם RNase-חומר חינם (כלומר, חרוזים, צינורות, וכו ') ולשבש רקמות עם מאגר לפירוק RNA המכיל 1% betamercaptoethanol (טבלת חומרים).
6. הכנת כתמים של מחלקי DRG קפואים
- עיבוד רקמה
- לתקן את הגזור וניקה DRG ב 1% פאראמפורמלדהיד (בארה ב) עבור 2 h ב RT.
- העבירו את הרקמה לצינור של 15 מ ל עם 10% סוכרוז ב-PBS. המלון משלב בין לילה ב -4 ° c.
- העבירו את הרקמה לצינור של 15 מ ל עם 20% סוכרוז ב-PBS. המלון משלב בין לילה ב -4 ° c.
- העבירו את הרקמה לתוך שפופרת של 15 מ ל עם 30% סוכרוז ב-PBS. המלון משלב בין לילה ב -4 ° c.
- להטביע רקמות ב-OCT באמצעות cryomold ובלוקים במקום קרח יבש להקפאה מהירה.
- אחסן את הדגימות ב-80 ° צ' עד השימוש.
- הכנה להקפאה
- להסיר את הבלוק הקפוא מ-80 ° צ' ולאפשר לו להאביק בטמפרטורת החדר קריוסטט עבור 30 דקות.
- קריודור the drg בעובי של 15 יקרומטר ו הר את הסעיפים על שקופיות.
- השתמש בעט כדי לצייר מעגל הידרופובי סביב הרקמה רכוב שקופיות.
- שמור את השקופיות ב-4 ° צלזיוס עד לצביעת.
- כתמים אימונולואורונסנציה
- לשטוף את הסעיפים DRG 3x ב PBS עבור 10 דקות ב RT.
- דגירה הסעיפים עם 100 μL של הנוגדן העיקרי הרצוי (למשל, נוגדן העכבר נגד PRV גליקופרוטאין B) עבור 1 h ב 37 ° c. לדלל את הנוגדן העיקרי ב-PBS המכיל 10% סרום עז שלילי.
- חזור על שלב ה6.3.1.
- מעכטה את הסעיפים עם 100 μL של הנוגדן המשני הרצוי (עז נגד עכבר אלקסה Fluor 488) עבור 50 דקות ב 37 ° c. . לדלל נוגדן משני ב-PBS בלבד
- הוסף 100 μL של DAPI (4 ′, 6-diamidino-2-פניינילידול) צבע מדולל ב PBS על הסעיף. עוד דגימות הדגירה 10 דקות ב 37 ° c.
- חזור על שלב ה6.3.1.
- הר את הדגימות באמצעות מדיום הרכבה הזריחה על שקופיות זכוכית מאובטח ולכסות עם coverslip.
7. הכנה ו-H & E כתמים של משטחי פרפין-רקמה מוטבעת
- לתקן את הרקמה ב 10% פורמאלין עבור 24 שעות ב 4 ° c.
- בצע עיבוד לוח זמנים סטנדרטי עבור הטבעה פרפין והסרת רקמות קבועות. העברת רקמות קבועות ל 70% אתנול ותהליך באמצעות אלכוהול משודרג כדי קסילן ואחריו פרפין, כפי שמתואר בעבר8.
הערה: שימוש ספוגים פוליאסטר לשמור דגימות רקמה קטנה כגון DRG בתוך קלטות. - בצע את הפעולות היחידות הרגילות ואחריו H & E כתמים של מקטעי רקמות, כפי שמתואר בעבר9.
תוצאות
העכבר הfootpad המודל מאפשר אפיון של הimmunopathogenesis של דלקת וירוס אלפא בvivo, כולל שכפול והתפשטות של הזיהום מתוך footpad מחוסן למערכת העצבים אינדוקציה של תגובות נוירודלקתיות ספציפיות.
במחקר זה, אנחנו הראשון שבשנו את העכבר האחוריות footpad ו או ללעוג מחוסן או מחוסן האזור השורק עם זן השני של PRV (PRV-בקר). האתר של שחיקה היה גלוי הfootpad השליטה. קרום נוצר באתר השחיקה כחלק מתהליך הריפוי (איור 1, חץ שחור). לעומת זאת, עכברים שחוסנו עם PRV הראו דלקת חמורה בנקודת הקצה ההומאנית (82 hpi), המאופיינת נפיחות של footpad ואדמומיות.
בעקבות footpad עם מאמץ PRV-בקר מדבק, עכברים החלו להראות שלטים קליניים ב 72 hpi, מאופיין נפיחות של footpad מחוסן ורעידות תכופות יותר ויותר. על-ידי 82 hpi, PRV-בקר העכברים נגועים הראה רעידות מתמדת ברגל מחוסן הסימפטומים PRV ייחודי, כולל גירוד אינטנסיבי נושך של כף הרגל. דלקת חמורה נצפתה גם במשטח הכדורגל. התגובה הדלקתית הנגרמת במהלך זיהום PRV היה אז מאופיין יותר, כולל חדירה של תאים חיסוניים לתוך רקמות.
הבדיקה histopathological של מספר רקמות בוצע, כולל footpad מחוסן DRG, ואחריו H & E כתמים של מקטעי הרקמה מוטבע של פרפין. נמק באפידרמיס ודלקת עורי חמורה (בצקת ו פיברוב) נצפו בסעיפים כף רגל נגועים PRV (איור 2, פאנל b). האפידרמיס, dermis, ורקמות החיבור של עכברים נגועים הראו חדירה מסיבית של נויטרופילים (מזוהה על ידי גרעיני multilobed) מסומן עם חיצים שחורים. Footpads של עכברים שליטה היו נורמליים (איור 2א, פאנל A). PRV-נגוע DRG מינימלי נמק נוירואליות ודלקת מעורבת בעכברים נגועים בעוד DRG של עכברים שליטה היו נורמליים (איור 2B, פאנלים a ו-B). לחדור דלקת מעורבת כללה בעיקר של נויטרופילים ו לימפוציטים.
הבא, קינטיקה של ייצור ציטוקינים דלקתית ברקמת העכבר לאחר prv כרית footpad חיסון הוקמו. רמות של ציטוקינים דלקתיים ספציפיים היו כמותית (כלומר, interleukin-6 [IL-6] ו-גרנציט המושבה גורם מגרה [G-שדרתי]) מתוך כמה רקמות שנאספו הומוגניים מתוך שליטה ועכברים נגועים PRV. התוצאות הפגינו גידול משמעותי של רמות השדרתי של G-התחתית ב footpad ו DRG בהשוואה לפקדים ב 7 hpi ו 82 hpi (איור 3A). רמות ג'י-שדרתי משמעותיות נצפו ב 82 hpi בחוט השדרה, המוח, הלב, רקמת הכבד של עכברים נגועים PRV לעומת פקדים. יתר על כן, רמות IL-6 משמעותיות זוהו בכל הרקמות של עכברים נגועים PRV לעומת שולטת החל 24 hpi (איור 3B).
מודל כרית הרגליים היה בשימוש נוסף כדי לחקור שכפול PRV והתפשט מן footpad מחוסן אל היקפית ו-CN ואת היחסים הפוטנציאליים עם פיתוח תגובה נוירודלקתית. המון PRV היו לכמת בכמה רקמות הומוגניים על ידי qPCR כדי להגביר את ה-DNA PRV. ריכוז DNA לאחר מכן הוסב PFU, כפי שתוארה בעבר10. טוען PRV זוהו ב footpad החל 24 hpi (~ 1 x 104 pfu/mg של רקמות) ו drg החל ב 60 hpi (~ 1 x 103 pfu/mg של רקמות; נתונים לא מוצגים).
במצב מורבונד (82 hpi), PRV זוהה ב footpad, DRG, חוט השדרה, ואת המוח, עם הריכוז הגבוה ביותר של PRV ב-DRG (~ 1 x 105 pfu/mg של רקמה; איור 4). הזיהום PRV של DRG אושרה על ידי כתמים עקיפים חיסונית עקיף של DRG קריודורים. זיהום PRV זוהה בנוירונים DRG באמצעות נוגדן נגד PRV gB. PRV גליקופרוטאין gB התבטא בשלבים מאוחרים של זיהום בציטופלסמה של תאים נגועים. כצפוי, הביטוי cytoplasmic של PRV gB (ירוק) אושרה ב-DRG נגוע, בעוד ששום ג'יגה-בתים לא התבטא בדגימות שליטה (איור 5). גרעיני התא זוהו עם צביעת DAPI (כחול).

איור 1: תמונות מייצגות של כפות הרגליים האחוריות של העכבר לאחר PRV החיסון. עכברים הם או ללעוג מחוסן או מחוסן עם PRV ב הרגליים האחוריות הימנית. PRV-מחוסן footpad מראה סימנים של דלקת, כולל אדמומיות ונפיחות בנקודת קצה הומאני (82 hpi). Footpad של עכברים שליטה נראה נורמלי עם קרום אדום כהה באתר מודגש, המציין כי הפצע הוא ריפוי. חיצים שחורים מציינים את האתר של שחיקה. איור זה השתנה מפרסום קודם של11. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: ממצאים Histopathological ב footpad ו DRG אחרי PRV footpad החיסון. המטאוקסילין ואאוזין (H & E) כתמים של (A) העכבר מחוסן אפם ו (ב) ו ipsilateral drg מ שליטה (פאנל A) ו prv-נגוע (פאנל B) עכברים ב 82 hpi. ביטויים histopathological נצפתה ב-PRV הנגועים ברקמות (נמק ובאפידרמיס והסתננות נויטרופילים) נעדרים מכל העכברים שנבדקו מבוים. תוצאות מייצגות שלושה משכפל ביולוגי עבור סוג נתון של רקמה. חיצים שחורים מציינים אזורים מייצגים של דלקת עם חדירת תאים חיסוניים. סרגלי קנה מידה (50 μm) מצוינים עבור כל תמונה. . הדמות הזו השתנתה מ-11 אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: קינטיקה של ייצור ציטוקין דלקתיים ברקמות הומוגניים העכבר לאחר PRV footpad. (A) G-שדרתיו (ב) IL-6 רמות חלבון שזוהו prv-נגוע (אדום) ושליטה (שחור) העכבר המהומוגניים רקמות ב-hpi שונים. רמות החלבון מושמעות על ידי אליסה ומתבטאת כpicogram (pg) לכל מיליגרם (mg) של רקמת הומוגניים (n = 5 לכל קבוצה, * p < 0.05, ns = לא משמעותי). איור זה השתנה מפרסום קודם של12. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
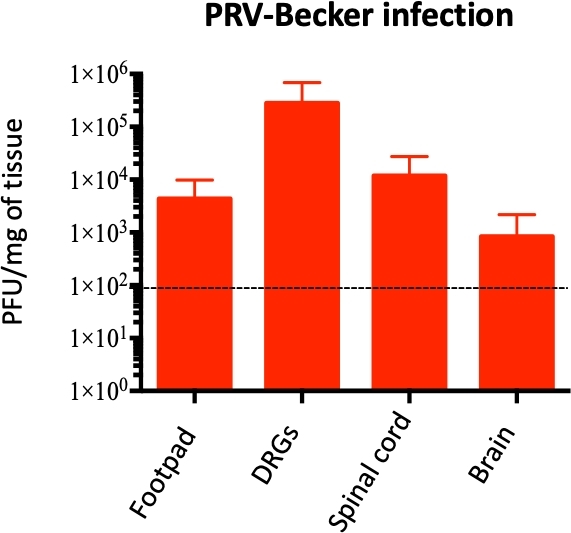
איור 4: קוונפיקציה של הגנום PRV בתוך העכבר רקמות הומוגניים. ה-DNA PRV הוא ככמת ב הומוגניים רקמות העכבר על ידי qPCR באמצעות PRV UL54 התחל. טעינות PRV מבוטאים כמו פלאק להרכיב יחידות (PFU) לכל מ ג של רקמות. ה-DNA PRV מזוהה רק ברגל, DRG, חוט השדרה, ואת המוח (ולא ברקמות אחרות), n = 10 לכל קבוצה. קו מנוקד מציג את מגבלת הזיהוי. איור זה השתנה מפרסום קודם של11. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: הערכה של זיהום PRV ב-DRG נוירונים באמצעות כתמים immunofluorescence. Confocal יקוד Z-מחסנית תמונות של מבוים-ו PRV-מזוהם הנוירונים מזוהמים לאחר כתמים מimmunofluorescence באמצעות נוגדן העכבר ספציפי PRV gB (ירוק). גרעין התאים מוכתם ב-DAPI (כחול, חלוניות a ו-c). פאנל d מראה מספר הנוירונים הנגועים PRV המבטא gB (חיצים לבנים). ביטוי ללא gB מזוהה במקטעי DRG של הפקד (החלונית b). סרגלי קנה מידה (50 μm) מצוינים עבור כל תמונה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
מודל החיסונים שמתואר כאן הוא שימושי כדי לחקור את ייזום ופיתוח של תגובות נוירודלקתיות במהלך זיהום וירוס אלפא. יתר על כן, זה במודל vivo משמש כדי ליצור את קינטיקה של שכפול והתפשטות של אלפא וירוס מהיקפית ל-CN. זהו חלופה לדגמים אחרים, כגון העור אגף החיסון, אשר מסתמך על גירוד בעורי עמוק13, או את התוואי התוך-גולגולתי, אשר מציג ישירות את הווירוס לתוך ה-cn14,15,16. כתוצאה מכך, עם דגם footpad, ניתן להשיג הערכה מפורטת יותר של קינטיקה ויראלית של שכפול והתפשטות עם תהליכים immunopathological מקומיים ורחוקים הקשורים במערכת העצבים11,12.
בפרוטוקול זה, השחיקה של כרית הרגליים והחיסונים הנגיפיים הבאים הם צעדים מכריעים. ואכן, הרובד הקרניות צריך להיות מסולק לחלוטין לאחר שחיקה נאותה על מנת לחשוף את הרובד באסי לזיהומים ויראליות לזיהום מוצלח. עם זאת, שחיקה חייב להיות עדין ולא לגרום דימום, כמו זה עוזר למנוע זיהום של זרימת הדם. הרובד הפרטי של הקרנית יכול להיות מדמיין על ידי H & E מכתים תחת מיקרוסקופ אור. הקרניות הקיימות ברובד הקרנית הן תאים שטוחים, אאוזינופילית שאין בהם גרעינים. הנפח של האינווירוסים (20 μL droplet) כבר אופטימיזציה כדי להבטיח את ה-droplet נשאר על footpad ומכסה את האתר שנוצר. שפשף בעדינות את ה-droplet על כרית הרגליים השאבפת חיונית לחדירה ויראלית יעילה. מומלץ לחכות עד footpad יבש לחלוטין כדי לעצור את ההרדמה ולמקם את החיה בכלוב חדש. צעד זה ימנע את העכבר מללקק את האינויוות הנגיפי מתוך footpad שבשלה. מומלץ לעבד מקסימום שלושה עכברים בבת אחת, באמצעות חרוט אף שנקבע לחשוף אותם בו להרדמה.
בעת ביצוע לנתיחה העכבר, חשוב לעשות חתכים במקביל לטור חוליות, אשר מונע נזק לחוט השדרה ו DRG הקשורים. זה גם הציע להסיר כמו שומן הרבה, שריר, רקמות רכות ככל האפשר כדי להפחית את החיתוך בשוגג לתוך עמוד השדרה ולהקל על אחיזה טובה יותר על קטע העמודה עם מלקחיים לפני חיתוך למטה קו האמצע.
כמו כן, מומלץ לבצע חתכים רוחביים דרך עמודת החוליות בין הדיסקים על מנת ליצור פלחי טורים מנוקים ולהגביל את הסיכון של זוגות DRG שפוגעים בנזק. קרומי הקרום סביב חוט השדרה וכיסוי DRG חייב להיות מוסר לחלוטין כדי להקל על זיהוי וחילוץ של DRG. DRG יש להסיר בזהירות מעמוד השדרה ללא נזק מלקחיים. חשוב כי DRG נשאר שלם עבור H & E ו אימונוofor, כתמים. העיתוי הוא קריטי ליעילות של זה בניסוי vivo, ואת לנתיחה העכבר חוט השדרה/DRG החילוץ צריך להתבצע ברציפות כדי לאסוף רקמות כי הוא טרי ככל האפשר.
שיטת ההעצמה של רקמות שתוארה כאן כבר ממוטבת כדי להבטיח שיבוש יעיל של מספר רב של דגימות רקמות הטרוגניים. הוא בעל חשיבות עליונה לתקנן את כמות הרקמה המשמשת, דבר המאפשר השוואה ישירה של התוצאות של אליסה ו-qPCR בין דגימות. למשל, זה הציע לשקול 100 מ"ג של רקמות עבור כל הליך המאבל. כל דגימת רקמות חייבת להיות הומוגניים בשלמותו, ואין להקפיא שאריות. חשוב להשתמש בעזרת החרוזים והמלקחיים מפלדה לפני השימוש כדי למנוע זיהום במהלך הומוגון. נפח של 500 μL הוא אופטימלי כדי להבטיח הומוגון מלאה של דגימת רקמות 100 mg. חשוב לציין כי אמצעי אחסון מוגבל זה מאפשר רק עיבוד של שלוש עד ארבע ערכות אליסה לכל מדגם.
באמצעות מודל החיסון הרגליים, זה הוכח כי זיהום PRV בעכברים גורם לדלקת חמורה, מאופיין הסתננות נויטרופילים ב footpad ו DRG. ריכוזים גבוהים של ציטוקינים דלקתיים G-שדרתי ו-IL-6 זוהו גם ברקמות הומוגניים רבים באמצעות אליסה. בנוסף, מתאם חזק נמצא בין הגן PRV וביטוי חלבון (על ידי qPCR ו IF כתמים) ב DRG ו הייצור של שני ציטוקינים פרו דלקתיים.
מודל זה מתאים להשוות את הקינטיקה של שכפול ויראלי והתפשטות, כמו גם תגובות נוירודלקתיות בקרב זיהומים אלפא הרפס שונים. למשל, לגבי VZV, המארח המוגבל-ספציפיות וחוסר מחלות קליניות הגבילו את השימוש במודלים לבעלי חיים17. לכן, מודל העכבר PRV החיסון עשוי לייצג מודל חדש בעלי חיים לחקר המנגנון הסלולר והמולקולרי האחראי על מחלות נוירופתיים בחולים עם נגעים פוסט herpetic. מבוסס על הדמיון בסימנים קליניים, פתוגנזה, ו גנום בין vzv ו prv, הוא האמין כי מודל זה העכבר ישפר את ההבנה של הפתוגנזה vzv ולהוביל ההתפתחויות אסטרטגיות טיפוליות חדשניות.
לבסוף, המודל ינחה מחקר על neuropathies היקפית, כגון טרשת נפוצה ונזק המושרה ויראלי הקשורים היקפית18. הפתוגנזה של מספר וירוסים נוירוטרופיים (כלומר, וירוס כלבת, פוליאווירוס, וירוס הנילוס המערבי, וירוס zika), אשר ידועים להדביק את היקפית, ניתן ללמוד גם באמצעות מודל זה19,20,21,22. מודל החיסונים יכול לשמש ככלי אפשרי לפיתוח התרופה. למשל, זה עשוי לשמש פלטפורמה למסך ולבדוק את היעילות של תרופות אנטי דלקתיות ואנטי מתוכנן כדי למנוע neuropathies היקפיים המושרה.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
המחברים מכירים במעבדות של שארל ריבר על התמיכה הטכנית המצוינת שלהם ביצוע ניתוחי histopathology. עבודה זו ממומנת על ידי המכון הלאומי של הפרעות נוירולוגיות שבץ (NINDS) (RO1 NS033506 ו RO1 NS060699). לתורמים לא היה כל תפקיד בתכנון לימוד, איסוף נתונים וניתוח, החלטה לפרסם או הכנת כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| Antibody anti-PRV gB | Made by the lab | 1/500 dilution | |
| Aqua-hold2 pap pen red | Fisher scientific | 2886909 | |
| Compact emery boards-24 count (100/180 grit nail files) | Revlon | ||
| Complete EDTA-free Protease Inhibitor Cocktail | Sigma-Aldrich | 11836170001 | |
| C57BL/6 mice (5-7 weeks) | The Jackson Laboratories | ||
| DAPI solution (1mg/ml) | Fisher scientific | 62248 | 1/1000 dilution |
| Disposable sterile polystyrene petri dish 100 x 15 mm | Sigma-Aldrich | P5731500 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Hyclone, GE Healthcare life Sciences | SH30022 | |
| Dulbecco's Phophate Buffer Saline (PBS) solution | Hyclone, GE Healthcare life Sciences | SH30028 | |
| Fetal bovine serum (FBS) | Hyclone, GE Healthcare life Sciences | SH30088 | |
| Fine curved scissors stainless steel | FST | 14095-11 | |
| Fluoromount-G mounting media | Fisher scientific | 0100-01 | |
| Formalin solution, neutral buffered 10% | Sigma-Aldrich | HT501128 | |
| Isothesia Isoflurane | Henry Schein | NDC 11695-6776-2 | |
| Microcentrifuge tube 2ml | Denville Scientific | 1000945 | |
| Microtube 1.5ml | SARSTEDT | 72692005 | |
| Negative goat serum | Vector | S-1000 | |
| Penicillin/Streptomycin | Gibco | 154022 | |
| Precision Glide needle 18G | BD | 305196 | |
| Razor blades steel back | Personna | 9412071 | |
| RNA lysis buffer (RLT) | Qiagen | 79216 | |
| Stainless Steel Beads, 5 mm | Qiagen | 69989 | |
| Superfrost/plus microscopic slides | Fisher scientific | 12-550-15 | |
| Tissue lyser LT | Qiagen | 69980 | |
| Tissue-Tek OCT | Sakura | 4583 | |
| 488 (goat anti-mouse) | Life Technologies | A11029 | 1/2000 dilution |
References
- Field, H. J., Hill, T. J. The pathogenesis of pseudorabies in mice following peripheral inoculation. Journal of General Virology. 23 (2), 145-157 (1974).
- Engel, J. P., Madigan, T. C., Peterson, G. M. The transneuronal spread phenotype of herpes simplex virus type 1 infection of the mouse hind footpad. Journal of Virology. 71 (3), 2425-2435 (1997).
- Guedon, J. M., et al. Neuronal changes induced by Varicella Zoster Virus in a rat model of postherpetic neuralgia. Virology. 482, 167-180 (2015).
- Pomeranz, L. E., Reynolds, A. E., Hengartner, C. J. Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine. Microbiology and Molecular Biology Reviews. 69 (3), 462-500 (2005).
- Wittmann, G., Rziha, H. J. Aujeszky's disease (pseudorabies) in pigs. Herpesvirus diseases of cattle, horses and pigs. Knipe, D. M., Howley, P. M. 9, Kluwer Academic Publishers. Boston, Mass. 230-325 (1989).
- Diseases of swine, 6th ed. Leman, A. D., Glock, R. D., Mengeling, W. L., Penny, R. H. C., Scholl, E., Straw, B. , Iowa State University Press. Ames, Iowa. 209-223 (1986).
- Sleigh, J. N., Weir, G. A., Schiavo, G. A simple, step-by-step dissection protocol for the rapid isolation of mouse dorsal root ganglia. BMC Research Notes. 9, 82(2016).
- Sands, S. A., Leung-Toung, R., Wang, Y., Connelly, J., LeVine, S. M. Enhanced Histochemical Detection of Iron in Paraffin Sections of Mouse Central Nervous System Tissue: Application in the APP/PS1 Mouse Model of Alzheimer's Disease. ASN Neuro. 8 (5), (2016).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor Protocols. 2014 (6), 655-658 (2014).
- Koyuncu, O. O., MacGibeny, M. A., Hogue, I. B., Enquist, L. W. Compartmented neuronal cultures reveal two distinct mechanisms for alpha herpesvirus escape from genome silencing. PLoS pathogens. 13 (10), 1006608(2017).
- Laval, K., Vernejoul, J. B., Van Cleemput, J., Koyuncu, O. O., Enquist, L. W. Virulent Pseudorabies Virus Infection Induces a Specific and Lethal Systemic Inflammatory Response in Mice. Journal of Virology. 92 (24), 01614-01618 (2018).
- Laval, K., Van Cleemput, J., Vernejoul, J. B., Enquist, L. W. Alphaherpesvirus infection of mice primes PNS neurons to an inflammatory state regulated by TLR2 and type I IFN signaling. PLoS Pathogens. 15 (11), 1008087(2019).
- Brittle, E. E., Reynolds, A. E., Enquist, L. W. Two modes of pseudorabies virus neuroinvasion and lethality in mice. Journal of Virology. 78 (23), 12951-12963 (2004).
- Mancini, M., Vidal, S. M. Insights into the pathogenesis of herpes simplex encephalitis from mouse models. Mammalian Genome: Official Journal of the International Mammalian Genome Society. 29 (7-8), 425-445 (2018).
- Kopp, S. J., et al. Infection of neurons and encephalitis after intracranial inoculation of herpes simplex virus requires the entry receptor nectin-1. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17916-17920 (2009).
- Wang, J. P., et al. Role of specific innate immune responses in herpes simplex virus infection of the central nervous system. Journal of Virology. 86 (4), 2273-2281 (2012).
- Haberthur, K., Messaoudi, I. Animal models of varicella zoster virus infection. Pathogens. 2 (2), Basel, Switzerland. 364-382 (2013).
- Sarova-Pinhas, I., Achiron, A., Gilad, R., Lampl, Y. Peripheral neuropathy in multiple sclerosis: a clinical and electrophysiologic study. Acta Neurologica Scandinavia. 91 (4), 234-238 (1995).
- MacGibeny, M. A., Koyuncu, O. O., Wirblich, C., Schnell, M. J., Enquist, L. W. Retrograde axonal transport of rabies virus is unaffected by interferon treatment but blocked by emetine locally in axons. PLoS Pathogens. 14 (7), 1007188(2018).
- Hunsperger, E. A., Roehrig, J. T. Temporal analyses of the neuropathogenesis of a West Nile virus infection in mice. Journal of Neurovirology. 12 (2), 129-139 (2006).
- Swartwout, B. K., et al. Zika Virus Persistently and Productively Infects Primary Adult Sensory Neurons In Vitro. Pathogens. 6 (4), Basel, Switzerland. 49(2017).
- Racaniello, V. R. One hundred years of poliovirus pathogenesis. Virology. 344 (1), 9-16 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved