Method Article
Akışkan Cihazların Mikroskopi ve Akış Sitometrisi ile Birleştirilmesi, Mekansal Ölçekler Arasında Gözenekli Ortamda Mikrobiyal Taşımayı İncelemek
Bu Makalede
Özet
Çığır açan eğriler (BTC'ler), gözenekli ortamda bakterilerin taşınmasını incelemek için etkili araçlardır. Burada, BTC'ler elde etmek için mikroskopik ve akış sitometrik sayma ile birlikte akışkan cihazlara dayalı araçlar sıyoruz.
Özet
Mikroorganizmaların gözenekli ortamda taşınması, dağılması ve birikintisi anlamak hidrodinamik, ekoloji ve çevre mühendisliği gibi çeşitli konuları içeren karmaşık bir bilimsel görevdir. Farklı mekansal ölçeklerde gözenekli ortamlarda bakteri taşımacılığının modellanması, bakteri taşımacılığının sonuçlarını daha iyi tahmin etmek için önemlidir, ancak mevcut modeller genellikle laboratuvardan saha koşullarına kadar büyük ölçekte başarısız olur. Burada, gözenekli ortamda iki mekansal ölçekte bakteri naklini incelemek için deneysel araçlar sıyoruz. Bu araçların amacı, şeffaf gözenekli matrislere enjekte edilen bakterilerin makroskopik gözlemlenebilirlerini (çığır açan eğriler veya biriktirme profilleri gibi) elde etmektir. Küçük ölçekte (10-1000 μm), mikroakışkan cihazlar optik video-mikroskopi ve görüntü işleme ile buluşarak çığır açan eğriler elde eder ve aynı zamanda gözenek ölçeğinde tek tek bakteri hücrelerini izler. Daha büyük ölçekte, akış sitometri atılım eğrileri elde etmek için kendi kendine yapılmış bir robot dağıtıcı ile birleştirilir. Bakterilerin akarsuların hiporomakkuşağı gibi karmaşık gözenekli ortamda nasıl taşındığını daha iyi anlamak için bu araçların yararını gösteriyoruz. Bu araçlar ölçekler arasında eşzamanlı ölçümler sağladığından, yükseltme için kritik öneme yönelik mekanizma tabanlı modellerin önünü açıyorlar. Bu araçların uygulanması sadece yeni biyoremediasyon uygulamalarının geliştirilmesine katkıda bulunmakla kalmamış, aynı zamanda gözenekli yüzeyleri kolonize eden mikroorganizmaların ekolojik stratejilerine de yeni bir ışık tutabilir.
Giriş
Gözenekli medya yoluyla mikropların taşınmasını anlamayı amaçlayan çalışmalar esas olarak kontaminasyon endişeleri tarafından tahrik edilmiştir1, hastalık iletimi2 ve biyoremediasyon3. Bu bağlamda bakteriler çoğunlukla taşımamodellerinde 4 partikül olarak ele alınmış ve filtrasyon, gerilme, yerçekimsel yerleşme veya biyofilmlerden yeniden mobilizasyon gibi süreçler mikropların elde tutulması veya taşınmasının sürücüleri olarak tanımlanmıştır5. Ancak, gözenekli manzaralar aracılığıyla bakterilerin taşınması incelenmesi de bu karmaşık ortamlarda başarılarını destekleyen ekolojik stratejiler hakkında bizi bilgilendirebilir. Ancak, bu yeni deneyler ve matematiksel modeller tek hücre, nüfus veya mikrobiyal topluluk düzeyinde çalışma gerektirir.
Akarsu ve nehirlerin hiporomakkuşağında bulunanlar gibi doğal gözenekli ortamlar, biyofilm oluşturan mikropların çeşitli toplulukları tarafından yoğun bir şekilde kolonize edilmektedir6. Biyofilmler sıvı faz7,8bakteri akışı ve böylece taşıma ve dağılım değiştirmek yapılar oluşturur. Gözenek ölçeğinde bakterilerin taşınması gözenekli matris ve hareketlilik ile ilgili dağılım kısıtlı alan durumu bağlıdır daha az yoğun nüfuslu alanlarda kaynaklar için azaltılmış rekabet yoluyla bireysel fitness artırmak için etkili bir yol olabilir. Öte yandan, hareketli bakteriler de gözenekli matris daha izole bölgelere ulaşabilir ve bu alanların genişletilmiş keşif hareketli popülasyonlar için ekolojik fırsatlar sağlayabilir10. Daha büyük mekansal ölçeklerde, biyofilm büyümesi de gözeneklerin (kısmi) tıkanmasına ve böylece, daha kanalize ve heterojen akış koşullarının kurulmasına yol açan akış yollarını yönlendirir11. Bu besin temini ve dağılım kapasitesi, frekans ve mesafe için sonuçları vardır. Tercihli akış, örneğin, sözde "hızlı parça" üretebilir ve hareketli bakteriler bu parça12boyunca yerel akış daha yüksek hızlara ulaşabilirsiniz. Bu, yeni habitatların keşfini artırmanın etkili bir yoludur.
Çeşitli araçlar gözenekli ortamda hareketli ve hareketli olmayan bakterilerin (ve parçacıkların) taşınması çalışmaları için kendilerini boşuna. Sayısal modeller uygulamalar için önemli büyük tahmin kapasiteleri var, ancak genellikle doğal varsayımlar ile sınırlıdır4. Laboratuvar ölçekli deneyler13,14 atılım eğrisi ile birlikte (BTC) modelleme verim15yapışma için bakteri hücre yüzey özelliklerinin önemi önemli anlayışlar sağlamıştır. Tipik olarak, BTC'ler (yani, sabit bir yerde parçacık konsantrasyonu kez serisi) sabit oranlı salınımlar ve deneysel cihazın çıkışında hücre numaralarının ölçümü yoluyla elde edilir. Bu bağlamda, BTC'ler gözenekli matristeki bakterilerin advection-dispersiyon dinamiklerini yansıtır lar ve ek için bir lavabo terimi ile genişletilebilirler. Ancak, BTC'lerin tek başına modelilmesi, taşıma işlemleri için gözenekli substrat veya biyofilmin mekansal organizasyonunun rolünü çözmez. Dağılım veya biriktirme profilleri gibi diğer makroskopik gözlemlenebilirlerin mekansal dağılım veya korunan parçacıklar veya büyüyen topluluklar hakkında önemli bilgiler sağladığı kanıtlanmıştır. Mikroakışkanmikroskop araştırma9,,12,16tarafından gözenekli ortamda taşıma eğitimi sağlayan bir teknolojidir , ve son bir çalışma dışında10, deneysel sistemler genellikle çözünürlük tek bir uzunluk ölçeğine kısıtlanır, yani, gözenek ölçeği veya tüm akışkan cihaz ölçeği.
Burada, farklı ölçeklerde gözenekli manzaralarda hareketli ve hareketli olmayan bakterilerin taşınması nı incelemek için bir dizi kombine yöntem sıyoruz. Gözenek ölçeğinde bakteriyel taşıma gözlemlerini BTC analizi ile daha büyük ölçekte ki bilgilerle birleştiriyoruz. Polidimethylsiloxane (PDMS) kullanılarak yumuşak litografiden üretilen mikroakışkan cihazlar biyo-uyumludur, çeşitli kimyasallara karşı dayanıklıdır, düşük maliyetlerle çoğaltılabilirliğe izin verir ve mikroskobik gözlem için kritik olan düşük otofloresans ın yanı sıra mükemmel optik saydamlık sağlar. PDMS'ye dayalı mikroakışkanlar daha önce basit kanallarda mikropların taşınması nı incelemek için kullanılmıştır17 veya daha karmaşık geometriler12. Ancak, tipik olarak mikroakışkan deneyler kısa vadeli ufuklara odaklanır ve canlı hücrelerin epi-floresan mikroskobik gözlemi genellikle genetiği değiştirilmiş suşlarla sınırlıdır (örn. GFP etiketli suşlar). Burada, pdms tabanlı mikroakışkan cihazları kullanarak, akış sitometrisi ile birlikte poli (metil metakrilat) (PMMA, pleksiglas olarak da bilinir) imal edilen daha büyük cihazlar la birlikte bakteriyel taşımayı incelemek için araçlar salıyoruz. PDMS ve PMMA gaz geçirgenliği ve yüzey özellikleri açısından farklılık gösterir, böylece bakteriyel taşıma yı incelemek için tamamlayıcı fırsatlar sunar. Mikroakışkan cihaz daha kontrollü bir ortam sağlarken, daha büyük cihaz uzun süre ler boyunca deneylere veya doğal bakteri topluluklarına izin verir. PDMS tabanlı mikroakışkan cihazda BTC elde etmek için özel bir alanda yüksek zamansal çözünürlükte mikroskobik sayma kullanılır. PMMA tabanlı cihazdan BTC modellemeiçin hücre sayımları elde etmek için, akış sitometrisi ile birlikte kendi kendine inşa edilmiş otomatik sıvı dağıtıcısı salıyoruz. Bu kurulumda, hücreler akışkan cihazı geçer ve ardışık olarak 96 kuyu plakasına dağıtılır. Zamansal çözünürlük doğru dağıtılabilir minimum hacim ve böylece akışkan cihaz aracılığıyla orta akış hızı ile sınırlıdır. Kuyularda fiksatif büyümeyi önler ve aşağı akış akışı-sitometrik numaralandırma için DNA boyama kolaylaştırır. Taşıma deneyleri sırasında bakteri üremesini önlemek için minimal bir ortam (motilite tamponu olarak adlandırılır) kullanırız.
Farklı ölçeklerde akışkan cihazların hazırlanmasına yönelik protokoller hazır olduğundan, bu tür cihazları üretme tekniklerini kısaca tanıtıyoruz ve btc'leri kaydetmek için deneysel prosedürlere odaklanıyoruz. Benzer şekilde, mikropların akış sitometrik numaralandırması için çeşitli rutinler mevcuttur ve kullanıcılar akış sitometrisi tarafından elde edilen sonuçları yorumlamak için uzman bilgiye ihtiyaç duyarlar. Floresan etiketli hücrelerin BTC'lerini kaydetmek için mikroskobik görüntüleme ile birlikte mikroakışkan cihazların yeni kullanımını rapor ediyoruz. Gözenek ölçeğinde, yerel hızlar ve yörüngeler görüntü işleme yoluyla elde edilir. Ayrıca, bir pmma tabanlı akışkan cihaz akışı-sitometrik sayma ile birlikte gözenekli ortamlarda hareketli ve non-motile hücrelerin bakteriyel taşıma gözlemlemek için bir yerli akım biyofilm tarafından kolonize olduğunu göstermektedir.
Protokol
1. Bakteri kültürü koşulları
- Bir laminar akış kaputu altında çalışmak, GFP etiketli Pseudomonas putida KT2440 (1 × 107 mL-1, -80 °C'de depolanan gliserol stokunun 100 μL'sini kullanarak Luria-Bertani (LB) ortamının 5 mL'ini aşılamak için kullanın. Bir gecede 250 rpm'de sallayarak 30 °C'de kuluçkaya yatırın.
- Ertesi gün, 5 mL LB orta ve 5h (üstel faz) için aynı koşullar altında kuluçka gece kültürünün 100 μL yeniden askıya. 2 mL'lik bir tüpe 1 mL aliquot numune alın, oda sıcaklığına (~15 dk) ve santrifüje (5 dk için 2300 x g) soğumasını bekleyin.
- Supernatant çıkarın ve pelet için 1 mL motilite tampon ekleyin. Girdap kısaca örnek homojenize etmek. Seyreltmek istenilen hücre konsantrasyonuna ulaşmak için, örneğin, 5 x 105 mL-1.
- Akarsulardan elde edilenler gibi doğal toplulukları içeren deneyler için seçici olmayan bir yetiştirme ortamı hazırlayın. Örneğin, steril filtreli ve otoklavlı akarsu suyu veya karmaşık bir karbon kaynağı (LB orta) ile değiştirilmiş yapay bir akarsu suyu ortamı kullanın.
2. Polidimetilsiloksane (PDMS) mikroakışkan bir cihazın hazırlanması
- Yarıçap büyüklüğü ve merkez koordinatları ile tanımlanan, daire matrisinden (akış için geçirimsiz engel olan) bilgisayar destekli taslak (CAD) yazılımı18ile istenilen gözenekli geometriyi tasarlayın.
NOT: Şekil 1A'darandomize tane ve gözenek boyutlarına sahip gözenekli geometri örneği verilmiştir. Çıkışa yakın engelleri olmayan bir gözlem kanalı BTC'lerin edinimi kolaylaştırır. - Seçilen geometriye göre, standart SU-8-fotolitografi18kullanarak bir kalıp hazırlayın.
NOT: Alternatif olarak, kalıplar da özel mikrofabrikasyon tesisinden sipariş edilebilir. Yatay düzlemde heterojen sıvı akışı elde etmek için, ortalama gözenek boğaz boyutu olarak büyüklük aynı sırada mikroakışkan odası kalınlığı tasarımı önemlidir. Ancak, mikroakışkan cihazın boyutlarının mikroskop altında gözlem için uygun olduğundan emin olun (örn. mikroskop slaytları üzerinde çalışın). - İğnesiz bir şırınga kullanarak elastomerin %90'ına çapraz linker (dimetil, metilhidrojen siloksane kopolimer) %10'u ekleyerek 50 g PDMS hazırlayın. Temiz koşullarda çalışın ve mümkün olduğunca tozdan kaçının. İki reaktifi temiz bir tek kullanımlık kapta karıştırın ve çözünmüş havayı ve kabarcıkları viskoz PDMS'den temizlemek için 30 dk vakum (100 mbar) uygulayın.
- Kalıbı petri kabına yerleştirin (100 mm çapında, 15 mm yüksekliğinde). PDMS'yi kalıbın üzerine istenilen yüksekliğe (örneğin, 2-5 mm) dökün. Petri kabının üzerini kapatın ve tedavisi için 4 saat (daha kalın tabakalar için bir gecede) için 60 °C'de tutun.
NOT: Görselleştirme amacıyla, ışık PDMS'den geçebilmeli, böylece 2 mm ile 5 mm arasında ince bir tabaka tercih edilir. Daha kalın tabakalar (>5 mm) cihazın saydamlığını azaltır ve uygulama sırasında daha ince olanlar deformasyona maruz kalır. - Kalıbı fırından çıkarın ve mikroakışkan cihazın oda sıcaklığına soğumasını bekleyin. Soğuduktan sonra PDMS'nin istenilen kısmını neşterle dikkatlice çıkarın.
NOT: Küf üzerindeki güçlü basınçlar küf kırıklarına neden olamaz. Parmak izleri optik saydamlığı etkileyeceğinden, PDMS'ye çıplak elle dokunmayın. - PDMS kanalının alt kısmını (istenilen geometrinin kazındığı) bantla geçici olarak kapatın. 0,5 mm çapında biyopsi zımba ile, bir giriş ve 0,5 mm (iç çap) boru uygun bir çıkış oluşturmak için mikroakışkan kanal delmek.
NOT: PDMS'nin yumuşak yapısı, tüp takıldığında sıkılık sağlayacaktır. PDMS cama mühürlendikten sonra giriş ve çıkış kanalları yapılamaz. - Mikroakışkan kanalı yüksek frekanslı jeneratör (plazma bonder, Malzeme Tablosu)kullanarak oksijen plazma yapıştırma yoluyla kapatın. Bunun için silikat cam bir kaydırağı (25 mm x 75 mm) etanolile temizleyin ve kurumasını bekleyin. PDMS kanalından teyp çıkarın ve gözenekli tarafı yukarı bakacak şekilde kanalı yerleştirin. Silikat cam kaydırağı ve PDMS yüzeylerini oda sıcaklığında yaklaşık 45 s plazma ile tedavi edin.
- PDMS kanalını silikat cam kaydırağa yerleştirin ve 100 °C'de 30 dk sıcak bir plaka üzerinde ısıtın.
- Mikroakışkan cihazı sıcak plakadan çıkarın ve oda sıcaklığına kadar soğutun. PDMS kanal girişini tüple bağlayın. PDMS'den havayı çıkarmak için 30 dakika boyunca vakum uygulayın, bu da sıvılar için neredeyse geçirimsizdir, ancak gazla geçirilebilir.
- 100 mL motilite tamponu (10 mM potasyum fosfat, 0.1 mM EDTA, %1 w/v glukoz, pH 7.0 ile takviye edilmiştir) hazırlayın ve 10 μL min-1'deçalıştırılan bir şırınga pompası kullanarak mikroakışkan cihaza 1 mL enjekte edin.
NOT: PDMS gaz az doymuş olduğundan (önceki vakum adım nedeniyle), kabarcıklar ~ 30 dakika içinde kaybolur.
3. Poli sıvı bir cihazın hazırlanması (metil metakrilat)
- CAD yazılımı ile istenilen geometriyi tasarla. Varsa, boyutların mikroskop altında gözlem için uygun olduğundan emin olun (örn. uygun bir tutucu ile birlikte standart 96 kuyu plakasının boyutları). Akışkan cihaz bir baz (127 × 127 × 12 mm) ve bir kapak (127 × 127 × 12 mm) PMMA oluşur.
NOT: CAD yazılımı ile uzmanlık önerilir. Örnek bir teknik çizim Şekil 1A'daverilmiştir. - Gözenek bölmesi üretmek için, yüksek hassasiyetli mikrofreze (WF31SA, Mikron) ile alt PMMA tabakasından 0,5 mm çıkarın ve kauçuk o-halkaiçin bir oluk (1,1 × 1,1 mm) frezeleyin. Matkap 12 dişli delik (M5). Bu akışkan cihazın temeli olarak hizmet edecektir.
NOT: Akışkan cihazın boyutlarının mikroskop aşamasına ve odak uzaklığına uyacak şekilde ayarlanması gerekir. Şekil S1'deteknik bir çizim sağlanır. - Akışkan cihazın üst kısmına giriş ve çıkış için iki dişli delik (tip 1/4-28UNF) ve vidalar için 12 delik (5,5 mm) delin. Bu akışkan cihazın kapağı olarak hizmet edecektir.
NOT: Mikro frezeleme de uzmanlık tavsiye edilir; yazarlar özel bir atölye desteği kullanın. - Her kullanımdan önce ve sonra akışkan cihazı temizlemek ve sterilize etmek için, akışkan cihazın tabanını ve kapağını %7 HCl'de ıslatın ve deiyonize suyla üç kez durulayın.
- Vida tabanı ve kapağı birlikte 12 dişli delikleri kullanarak.
4. Otomatik dispanser kurulumu
NOT: Ticari olarak kullanılabilen sıvı dağıtıcılar pahalıdır ve genellikle akışkan cihazın çıkışından doğrudan dağıtım esnekliği sunmaz. Bu nedenle, xy plotter robot (Malzeme Tablosu) ucuz ve esnek robotik dispanser sistemi montajı tavsiye edilir.
- Akışkan cihazdan 96 kuyu plakasına çıkış sağlamak için robotik dağıtıcıyı PMMA plakasına ve 85,8 x 128 mm'lik freze boşluklarına monte edin ve 1 mm derinliğinde birkaç 96 kuyu plakası tutun.
- Akışkan cihazın çıkış tüpünü dağıtıcının robotik koluna takın.
- Github gelen robot dağıtıcı indirmek bCNC çalıştırmak için: https://github.com/vlachoudis/bCNC ve programı yüklemek için yönergeleri izleyin.
- Bu makalenin destekleyici materyalinden dispenser.py indirin.
NOT: Bu python kodu basit bir robot dağıtıcı düzeni için bCNC bir eklenti sağlar. - Robot dağıtıcıyı bCNC çalıştıran bilgisayara bağlayın ve doğru COM bağlantı noktasını tanımlayın.
- bCNC'de, robot dağıtıcısını ana konuma döndürmek için ana ekran düğmesini tıklatın.
NOT: Homing robotik dağıtıcıyı bilinen bir konuma (x=0, y=0) döndürür ve bu nedenle dağıtıcının doğruluğunu artırır. - Deneyden önce, uygun miktarda fiksatif (örneğin, son konsantrasyon %3,7 formaldehit) içeren kuyularla yeterli sayıda 96 kuyu plakası hazırlayın.
NOT: Örneğin, 0,2 mL mn-1, 100 μL akış hızında her 30 s'lik her kuyuya dağıtılır. Bu nedenle, her kuyuya %37 formaldehit 10°L ekleyin ve %2 ile %4 arasında son bir formaldehit konsantrasyonuna ulaşın. Sekiz adet 96 kuyu plakası kullanarak, toplam 768 veri noktasıyla denemenin 6 saatten fazla çalışmasına olanak sağlayacaktır. Ayrıca, GFP etiketli hücrelerin formaldehit kullanarak fiksasyon dan sonra floresan sinyalini kaybedebileceğini unutmayın.
5. PDMS mikroakışkan cihazlar kullanarak bakteri naklini analiz edin
- PDMS mikroakışkan cihazı daha önce mikroskop aşamasına motilite arabelleği ile doymuş yerleştirin. Sahne hareketi sırasında akış bozulmasını en aza indirmek için tüpü düzeltmek için bandı kullanın.
- Mikroskop aşamasını priz yakınına kadar gözlem kanalına taşıyın. Parlak alan mikroskobu veya faz kontrastı kullanarak, gözlem kanalının merkezine odaklanın ve tek tek bakteri hücrelerini görselleştirmek için büyütmeyi ayarlayın.
- Işık yolu ayarlarını floresan mikroskobuyla değiştirin ve tek tek bakteri hücrelerini (örn. 100 ms) veya hücrelerin floresan sinyallerinin arka plan gürültüsünden en az 3 kat daha güçlü olduğunu çözmek için kameranın maruz kalma süresini ayarlayın.
- Daha sonra, giriş tüpünü bakteriyel süspansiyon içeren 2 mL'lik bir tüpe takın. Ters pompa yönü ve 1 μL min-1akış hızında süspansiyon çekilmeye başlayın.
- Tüm gözlem kanalının kesitini tarayabilirsiniz ve deney boyunca her 2 dakikada bir kompozit bir resim kaydedin.
6. Temel görüntü işleme
NOT: Bu temel görüntü işleme rutinlerinin amacı, kaydedilen görüntülerdeki bakteri sayısını saymaktır. Optimum işleme prosedürleri mikroskop ve kameranın teknik özelliklerine ve deneyde kullanılan bakteri suşunun floresan özelliklerine bağlıdır ve bu nedenle ayarlanması gerekir.
- İlk .tiff biçiminde ki görüntüleri dışa aktarın.
- Görüntüleri istenilen yazılım platformuna (örneğin, MATLAB, ImageJ, R veya Python) aktarın.
- Görüntülerdeki piksel yoğunluğunun rasgele bir varyasyonu olan ve optik sapma için doğru olan kamera gürültüsünü kaldırın. Bu, her resme Gaussfiltresi uygulayarak yapılabilir: filtrenin boyutu kamera sensörünün kalitesine (örneğin CCD veya CMOS) bağlıdır. Optik sapma, aynı optik konfigürasyona sahip numunenin yokluğunda toplanan bir referans görüntü ile her resmin normalleştirilmesiyle kaldırılabilir.
- Görüntüleri ilgi çeken bir bölgeye kırpın.
- Eşiğin üzerindeki değerler bakteri hücrelerini içerecek şekilde bir eşik değeri (piksel yoğunluğu) tanımlayın.
NOT: Görüntülerin düzensiz bir şekilde aydınlatılması durumunda (optik sapma veya gürültü nedeniyle) yerel ortalama yoğunluklarına dayalı bir eşik değeri seçen uyarlanabilir bir eşik uygulamak yararlı olabilir. - Her resimden yukarıda tanımlanan eşik çıkarın.
- Ortaya çıkan görüntüyü binarize, bakteri hücreleri 1 değeri alır, arka plan ise 0 değeri alır.
- En küçük bakteri hücresi boyutundan daha küçük bir alana sahip kümeleri çıkarın.
- Kalan kümelerin toplam piksel sayısını elde etmek için binarized görüntüyü topleyin. Piksel sayısını bir bakteri hücresinin ortalama boyutuna (piksel olarak) bölün: bu, toplam hücre sayısının tahminini sağlar.
- Görüş derinliğini ve araştırma alanını bilerek, sayıları konsantrasyona dönüştürür (mL-1parçacıkları).
- Bu enjekte bakteri süspansiyon konsantrasyonu belirlemek için temeldir. Bunu yapmak için, temiz bir mikroakışkan cihazın gözlem kanalına bakteri kültürü süspansiyon bir şırınga 1 mL enjekte. Görüntüyü kaydedin ve yukarıda açıklandığı gibi etkili bakteri konsantrasyonu (C0)(6.1- 6.10) hesaplayın.
- Etkili bakteri konsantrasyonu (C0)ile atık bakteri konsantrasyonu (C) normalleştirerek BTC'leri analiz edin ve C/C0'ı zamana karşı planlandırın.
7. Gözenek ölçeğinde bakteri taşıma analiz
- Gözenekli matris ile taşınan bakterilerin yerel hızlarını ve yörüngelerini analiz etmek için mikroskop aşamasını ilgi bölgesine taşıyın ve odağı mikroakışkan cihazın merkezine ayarlayın.
- Mikroskobu parlak alan veya faz kontrastına ayarlayın.
NOT: Bu sadece bakteri hücresinin floresan sinyalinin pozlama süresinde ortalama bakteri süresinden daha kısa görüntü kaydetmesine izin vermemeleri durumunda, floresan mikroskopi kullanılır. - Bakteri deplasmanını yakalayan pozlama sırasında (nesne boyutundan daha küçük bir dizi pikselüzerinden ortalama yer değiştirmeden daha kısa) ve bakteri hücre algılamayı optimize eden (örn. 20 ms ve her 50 ms'de kaydedilen görüntülerin açığa çıkması) zaman atlamalı görüntüleri kaydedin. En yavaş yörüngelerin (örneğin 3 dakika) yeterli sayıda (istatistiksel olarak temsil edilmesi) kaydedilmesi için yeterli süre içinde resimleri kaydedin.
NOT: Bilgisayarın yeterli disk alanına sahip olduğundan emin olun. - Arka plan gürültüsünü kaldırmak için, her görüntüden kaydedilen tüm görüntülerin ortalamasını çıkarın. Bunu yapmak için, sonucu her piksel için tüm görüntülerin yoğunluğunun toplamı olan bir matris oluşturun ve görüntü sayısına bölün.
- İşlenmiş görüntüden (Im), sayısal degradenin modülünü belirleyin
 ve aşağıda tanımlandığı gibi maksimum değerine(max)göre normalleştirin.
ve aşağıda tanımlandığı gibi maksimum değerine(max)göre normalleştirin.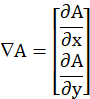

- Yoğunluk eşiği ile B matrisini binarize edin, 6.7-6.8 adımlarını görün.
- Her zaman noktası için, bakteri koordinatlarını (piksel veya mm'deki x, y) ve görüntü edinme süresini üç sütunlu bir dosyaya kaydedin.
- Son olarak, kaydedilen verileri işlemek ve bakterilerin yörüngelerini hesaplamak için bir parçacık izleme komut dosyası uygulayın. Örneğin, kurulan protokol19'uve serbestçe kullanılabilen Matlab Partikül İzleme Kodu'nu kullanın: (http://site.physics.georgetown.edu/matlab/).
8. Biriktirme profilleri ile bakteriyel filtrasyon çalışması
- Fötrasyon mikroskopisi ile GFP etiketli P. putida KT2440 hücrelerinin biriktirme profillerini elde etmek için, önce tüm gözenekli kanalın kompozit bir görüntüsünü kaydedin, yani arka plan, ve mikroakışkan cihaz yoluyla bakteriyel süspansiyon enjeksiyonu sonra. Sinyali beyazlatmadan bakteriyel floresan sinyali (örn. 100 ms) elde etmenizi sağlayan bir pozlama süresi kullanın.
- Görüntüleri dışa aktarın ve istenilen yazılım platformunda içe aktarın (bkz. 6.1-6.2).
- Bakteri enjeksiyonundan sonra kaydedilen görüntülerden arka planı çıkarın.
- Gözenekli kanalın transversal bölümleri boyunca tutulan bakterilerin toplam floresan sinyalini entegre edin.
- Biriktirme profilini hesaplamak için, entegre floresan sinyalini gözenekli kanal uzunluğuna göre çizin.
9. PMMA akışkan cihazlar ve akış sitometri kullanarak bakteriyel taşıma analiz
- Peristaltik pompayı 50 cm (1 mm iç çap) boru kullanarak girişle ve aynı boruyu kullanarak otomatik dispanserle çıkışı bağlayın (50 cm, bkz. bölüm 4).
NOT: Pompayı ekim ortamı dağıtmak ve bakteri hücrelerini enjekte etmek için kullanın. Sabit hızlı salınım sırasında orta ve bakteriyel süspansiyon arasında geçiş yapmak için Luer-lock konektörleri ve üç yönlü vanalar kullanın. - Akışkan cihazda pompa yetiştirme ortamı. Robotik dağıtıcıya sabitlenmiş outlet borularına ortamın gelişine dikkat edin.
- 0,2 mL mn-1akış hızında PMMA akışkan cihaz ile bakteriyel süspansiyon enjekte etmeye başlayın,
- Bakteriler akışkan cihaza ulaştığında otomatik dağıtıcıyı açar.
- Darbe enjeksiyonu yapmak için, bazı gözenek hacimleri için bakteriyel süspansiyon enjekte edin (örn. 30), ve sonra deney sonuna kadar enjeksiyonu ekim ortamına geçirin.
NOT: Akışkan cihazın gözenek hacmi yaklaşık 0,2 mL'dir, bu nedenle her dakika prosed akış hızında bir gözenek hacmi değiştirilir. - 96 kuyuluk plaka tamamlandıktan sonra, buharlaşmayı azaltmak için plakayı kapatın ve 4 °C'de saklayın.
- Kurulan protokolleri izleyerek, akış sitometrisi ile bakteri bolluğunu analizedin 20.
NOT: Örneğin, her kuyuya 0,025 mM 'de (ultra saf suda) yeşil floresan nükleik asit lekesi (Malzeme Tablosu) 25 μL ekleyin. BakteriDNA'sını lekeler, böylece akış sitometrisi ile ölçülmesine izin verir. Karanlıkta 15 dakika boyunca inkübat örnekleri ve daha sonra 515 nm bir 488 nm lazer ve dedektörler ile donatılmış bir akış sitometre kullanarak analiz. - BTC analizinden önce, fiksatif ve leke ilavesi nedeniyle numunenin seyreltilmesini göz önünde bulundurun. Fiksatif ve leke için hesap 1,35 bir faktör ile doğru bakteriyel bolluk.
Sonuçlar
Sunulan iş akışının işlevselliğini göstermek için, biyoremediasyon ve biyoteknoloji için önemli olan bir gram negatif hareketli bakteri olan genetiği değiştirilmiş Pseudomonas putida KT2440 kullanarak deneyler yaptık. GFP üretimini ifade eden bu suş genetiği değiştirilmiş sürümleri ticari olarak mevcuttur. P. putida KT2440'ın hareketli olmayan bir türü dürbün için ilgili yapısal ve düzenleyici genlerden yoksundur. Hem, hareketli ve non-motile GFP etiketli P. putida KT2440 kullanarak, pdms mikroakışkan cihazlarda rasgele bir sütun dizisi(Şekil 1B)ve kaydedilmiş BTC'ler(Şekil 2A)ile sıralı deneyler gerçekleştirdik. BTC'ler enjekte edilen hücrelerin konsantrasyonuna göre normalleştirilmiştir (C0). Aynı anda, gözenek ölçeğindeki bakteriyel yörüngeler yukarıda açıklandığı gibi görüntü işleme ve parçacık takibi yoluyla görselleştirildi (Şekil 2B).
Daha sonra, PMMA(Şekil 1A)öğütülmüş büyük ölçekli akışkan cihazlarla deneyler yaptık. Hareketli ve hareketli olmayan P. putida KT2440 (floresan olmayan) düzenli aralıklı gözenekli bir matris içine enjekte edildi ve BTC'ler yukarıda açıklandığı gibi sıvı dispanser ve akış sitometrisi kullanılarak elde edildi(Şekil 3A). Çarpıcı, biyofilm yoksun gözenekli bir ortamda, hareketli ve non-hareketli P. putida KT2440 belirgin bir farklı ulaşım davranışı gösterdi. Karmaşık bir akış biyofilm topluluğu ile 48h için kolonize gözenekli bir matris olarak, hareketli ve non-motile P. putida KT2440 arasındaki BTC bu farklılıklar kayboldu(Şekil 3B.)

Şekil 1: Gözenekli ortamda mikrobiyal taşımayı inceleyen akışkan cihazlar (A) PMMA'dan öğütülmüş akışkan bir cihazın çizimi. Gözenekli matris cihazın taban tabakasına öğütülür, kapak vidalar kullanılarak kapatılır. Bir kesit akışkan cihaz içinde sütunların düzenlenmesigösterir. Kesici uç, sütunların düzenli aralıklı ızgarası ve ilgili hız akış alanına sahip gözenekli bir matris gösterir. (B) PDMS cihazı mikroskopi cam slayt üzerine monte edilir. Gösterilen giriş ve çıkış, orta rezervuar ve şırınga pompası bağlı, sırasıyla. Mikroskobik sayma için gözlem odası, gözenekli bir matris olmadan ayrı bir oda olarak aynı mikroskop slaytÜzerine yerleştirilir. Kesici uç, rasgele bir sütun dizisi (çap ve aralık) içeren gözenekli bir matris gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
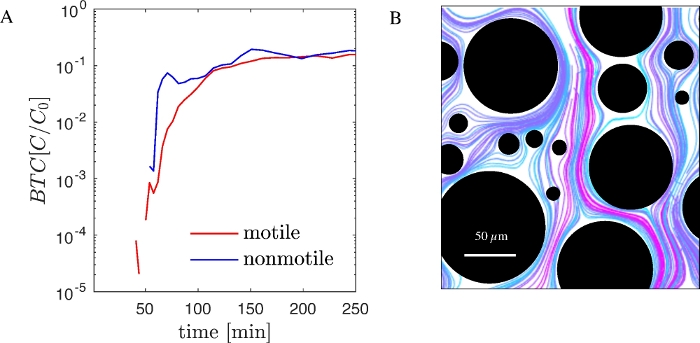
Şekil 2: PDMS akışkan cihazında kanal ve gözenek ölçeğinde bakteriyel taşıma (A) MOTIle ve non-motile P. putida KT2440 (GFP etiketli) BTC'leri PDMS mikroakışkan cihaz ve mikroskobik sayma ile elde edilir. (B) Gözenek ölçeğinde hareketli olmayan hücrelerin yörüngeleri. Renkler yörüngelerin farklılaşmasını artırmak için seçilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: PMMA akışkan cihazında kanal ve gözenek ölçeğinde bakteriyel taşıma (A) MOTIle ve non-motile P. putida KT2440 (etiketli olmayan) BTCs pmma akışkan cihaz ve akış-sitometri sayma kullanılarak elde. (B) Akışkan cihaz 2 gün boyunca doğal bir akım topluluğu tarafından kolonize edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: PMMA akışkan cihazın teknik çizimleri. Cihaz gözenekli matris içeren bir taban ünitesi ve giriş ve çıkış için delikler içeren bir kapak ünitesi oluşur. Cihaz 12 vida ve O-ring kullanılarak kapatılır. Bu rakamı indirmek için lütfen tıklayınız.
Tartışmalar
Burada mikropların tek hücreli ve popülasyon düzeyinde gözenekli sistemler le taşınmasını incelemek için iki araç öneriyoruz. BTC modelleme sat›nal›n›zla›ş fenomenlerinin incelenmesi, ekosistem ölçeklerinde patojenlerin veya kirleticilerin yay›nt›s›na dair de›f bilgiler sa›rken, laboratuvar deneylerinden saha koşla›ma kadar ölçeklendirme de zorluklar› hala mevcutolmuştur. Burada açıklanan araçlar, araştırmacıların gözenekli ortamlarda taşınması için ilgili mikropların ekolojik stratejilerini daha iyi anlamak için mekansal ve zamansal ölçekleri deneysel olarak çözmelerine olanak tanır. Deneyciler bu sistemleri, kemotaksis veya çoğunluk algılaması gibi hareketlilik dışındaki diğer mikrobiyal özellikleri incelemek veya gözenekli matrisin geometrisini veya diğer habitat özelliklerini değiştirmek için kullanabilir veya değiştirebilirler. Ayrıca, bu sistemleri kullanarak bakteri taşıma davranışı kolayca kolonileşme desenleri içine önemli anlayışlar sağlamak ve biyofilmlerin yerel akış alanları değiştirmek nasıl anlamak için kritik biriktirme profilleri, birleştiğinde olabilir. Gözenekli medyayı dağıtmak ve kolonize etmek için mikrobiyal stratejilerin daha iyi anlaşılmasının model tahminlerini iyileştireceğini ve böylece patojen yayılımı nın veya kirletici çevrelemenin yönetimine katkıda bulunacağını öngörüyoruz. Sistemin daha fazla modifikasyonları da hücrelerin fiziksel olarak ayrılması gereken yeni filtrasyon cihazları veya biyoteknoloji araçlarının geliştirilmesine katkıda bulunabilir.
Daha küçük, daha kısa süreli deneyler veya yüksek zamansal çözünürlük kritik olduğunda, büyük ve uzun vadeli deneyler ve PDMS tabanlı aygıtlar için PMMA tabanlı aygıtlar öneririz. Bu iki malzeme farklı özelliklere sahip olduğu unutulmamalıdır. Örneğin PDMS oksijen gibi gaza geçirilebilir, PMMA ise gaz geçirmezdir. Bu fark PMMA senaryosunda gaz tüketimini incelemek için kullanılabilirken, PDMS bakteriyel solunumla ilgili oksijen sınırlamalarının istenmediği deneyler için daha uygun olabilir.
Genel olarak, burada açıklanan protokoller kolayca tekrarlanabilir ve bu araçlar kullanılarak elde edilen veriler, hareketli ve hareketli olmayan bakterilerin taşınmasındaki farklılıkları sürekli olarak ortaya koymaktadır. Kendi kendine yapılan sıvı dağıtıcı, ticari olarak kullanılabilen bir alternatifle değiştirilebilir. Ancak, çok yönlülük ve maliyet etkinliği nedenleriyle burada açıklanan bir öneririz. Protokoldeki kritik adımlar esas olarak akışkan cihazların kullanımı ve görüntü işleme deneyimi ile ilgilidir. Görüntü analizi yoluyla elde edilen verilerin kalitesi görüntü kalitesine (esas olarak odaklanma ve pozlama süresine göre belirlenir) ve uygun bir eşik stratejisine bağlıdır. Akış-sitometrik sayma ile elde edilen veri kalitesi, hücrelerin etkili bir şekilde sabitlenmesi ve boyanmasına ve akış-sitometri sonuçlarının yorumlanmasındaki uzmanlığa bağlıdır.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ediyor.
Teşekkürler
Biz robotik dağıtıcı ve dispenser.py komut kurulumu ile Antoine Wiedmer yardım kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| EDTA | Sigma | ||
| Elastomer Sylgard 184 | Dowsil | 101697 | |
| Flow cytometer NovoCyte | Acea | ||
| Glucose | Sigma | https://www.makeblock.com/project/xy-plotter-robot-kit | |
| LB broth | BD | ||
| Liquid dispenser, XY Plotter Robot Kit | makeblock | ||
| Microscope Axio Imager | Zeiss | ||
| Microscope AxioZoom v16 | Zeiss | ||
| Microscope slides, 75 mm × 25 mm | Corning | ||
| Minipuls 3 peristaltic pump | Gilson | ||
| Plasma bonder Corona SB | BlackHole Lab | ||
| Potassium phosphate | Sigma | ||
| Syringe pump New Era NE 4000 | New Era | ||
| Syto 13 Green Fluorescent Nucleic Acid Stain | Molecular Probes, Invitrogen | ||
| Tygon tubing | Ismatec | ||
| WF31SA universal milling machine | Mikron |
Referanslar
- Stevik, K., Aa, K., Ausland, G., Fredrik Hanssen, J. Retention and removal of pathogenic bacteria in wastewater percolating through porous media: a review. Water Research. 38 (6), 1355-1367 (2004).
- Ribet, D., Cossart, P. How bacterial pathogens colonize their hosts and invade deeper tissues. Microbes and Infection. 17 (3), 173-183 (2015).
- Ginn, T. R., Wood, B. D., Nelson, K. E., Scheibe, T. D., Murphy, E. M., Clement, T. P. Processes in microbial transport in the natural subsurface. Advances in Water Resources. 25 (8), 1017-1042 (2002).
- Tufenkji, N. Modeling microbial transport in porous media: Traditional approaches and recent developments. Advances in Water Resources. 30 (6-7), 1455-1469 (2007).
- Foppen, J. W., Van, M. H., Schijven, J. Measuring and modelling straining of Escherichia coli in saturated porous media. Journal of contaminant hydrology. 93 (1-4), 236-254 (2007).
- Battin, T. J., Besemer, K., Bengtsson, M. M., Romani, A. M., Packmann, A. I. The ecology and biogeochemistry of stream biofilms. Nature Reviews Microbiology. 14 (4), 251-263 (2016).
- Scheidweiler, D., Peter, H., Pramateftaki, P., Anna, P., de Battin, T. J. Unraveling the biophysical underpinnings to the success of multispecies biofilms in porous environments. The ISME Journal. 1, (2019).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Bhattacharjee, T., Datta, S. S. Bacterial hopping and trapping in porous media. Nature Communications. 10 (1), 2075(2019).
- Scheidweiler, D., Miele, F., Peter, H., Battin, T. J., de Anna, P. Trait-specific dispersal of bacteria in heterogeneous porous environments: from pore to porous medium scale. Journal of The Royal Society Interface. 17 (164), 20200046(2020).
- Morales, V. L., Parlange, J. Y., Steenhuis, T. S. Are preferential flow paths perpetuated by microbial activity in the soil matrix? A review. Journal of Hydrology. 393 (1), 29-36 (2010).
- Creppy, A., Clément, E., Douarche, C., D'Angelo, M. V., Auradou, H. Effect of motility on the transport of bacteria populations through a porous medium. Physical Review Fluids. 4 (1), 013102(2019).
- Camesano, T. A., Logan, B. E. Influence of Fluid Velocity and Cell Concentration on the Transport of Motile and Nonmotile Bacteria in Porous Media. Environmental Science & Technology. 32 (11), 1699-1708 (1998).
- Lutterodt, G., Basnet, M., Foppen, J. W. A., Uhlenbrook, S. The effect of surface characteristics on the transport of multiple Escherichia coli isolates in large scale columns of quartz sand. Water Research. 43 (3), 595-604 (2009).
- Bozorg, A., Gates, I. D., Sen, A. Impact of biofilm on bacterial transport and deposition in porous media. Journal of Contaminant Hydrology. 183 (Supplement C), 109-120 (2015).
- Long, T., Ford, R. M. Enhanced Transverse Migration of Bacteria by Chemotaxis in a Porous T-Sensor. Environmental Science & Technology. 43 (5), 1546-1552 (2009).
- Rusconi, R., Garren, M., Stocker, R. Microfluidics Expanding the Frontiers of Microbial Ecology. Annual Review of Biophysics. 43 (1), 65-91 (2014).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Materials Science. 28 (1), 153-184 (1998).
- Crocker, J. C., Grier, D. G. Methods of Digital Video Microscopy for Colloidal Studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- del Giorgio, P. A., Bird, D. F., Prairie, Y. T., Planas, D. Flow cytometric determination of bacterial abundance in lake plankton with the green nucleic acid stain SYTO 13. Limnology and Oceanography. 41 (4), 783-789 (1996).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır