Method Article
Combiner des dispositifs fluides avec la microscopie et la cytométrie de débit pour étudier le transport microbien dans les médias poreux à travers les échelles spatiales
Dans cet article
Résumé
Les courbes révolutionnaires sont des outils efficaces pour étudier le transport des bactéries dans les médias poreux. Ici, nous introduisons des outils basés sur des dispositifs fluidiques en combinaison avec la microscopie et le comptage cytométrique de flux pour obtenir des BTCs.
Résumé
Comprendre le transport, la dispersion et le dépôt des micro-organismes dans les milieux poreux est une tâche scientifique complexe comprenant des sujets aussi divers que l’hydrodynamique, l’écologie et l’ingénierie environnementale. La modélisation du transport bactérien dans des environnements poreux à différentes échelles spatiales est essentielle pour mieux prévoir les conséquences du transport bactérien, mais les modèles actuels ne parviennent souvent pas à se mettre à l’échelle des conditions de laboratoire à des conditions sur le terrain. Ici, nous introduisons des outils expérimentaux pour étudier le transport bactérien dans les médias poreux à deux échelles spatiales. L’objectif de ces outils est d’obtenir des observables macroscopiques (comme des courbes révolutionnaires ou des profils de dépôt) de bactéries injectées dans des matrices poreuses transparentes. À petite échelle (10-1000 μm), les dispositifs microfluidiques sont combinés avec la vidéo-microscopie optique et le traitement d’image pour obtenir des courbes révolutionnaires et, en même temps, pour suivre les cellules bactériennes individuelles à l’échelle des pores. À plus grande échelle, la cytométrie d’écoulement est combinée avec un distributeur robotique self-made pour obtenir des courbes révolutionnaires. Nous montrons l’utilité de ces outils pour mieux comprendre comment les bactéries sont transportées dans des médias poreux complexes tels que la zone hyporhéique des cours d’eau. Comme ces outils fournissent des mesures simultanées à travers les échelles, ils ouvrent la voie à des modèles basés sur des mécanismes, d’une importance cruciale pour le haut de gamme. L’application de ces outils peut non seulement contribuer au développement de nouvelles applications de bioremédiation, mais aussi jeter un nouvel éclairage sur les stratégies écologiques des micro-organismes colonisant les substrats poreux.
Introduction
Les études visant à comprendre le transport des microbes à travers les médias poreux ont principalement été motivées par des préoccupations de contamination1, la transmission de lamaladie 2 et la biorémédiation3. À cet égard, les bactéries ont surtout été traitées comme des particules dans les modèles de transport4 et des processus tels que la filtration, la tension, le décantation gravitationnelle ou la remobilisation à partir de biofilms ont été identifiés comme des moteurs de rétention ou de transport des microbes5. Toutefois, l’étude du transport des bactéries à travers les paysages poreux peut également nous renseigner sur les stratégies écologiques qui sous-tendent leur succès dans ces environnements complexes. Pourtant, cela nécessite de nouvelles expériences et des modèles mathématiques fonctionnant au niveau de la cellule unique, de la population ou de la communauté microbienne.
Les milieux poreux naturels, tels que ceux que l’on trouve dans la zone hyporhéique des cours d’eau et des rivières, sont densément colonisés par diverses communautés de microbes formant des biofilms6. Les biofilms forment des structures qui modifient le flux et donc le transport et la dispersion des bactéries dans la phaseliquide 7,8. Le transport des bactéries à l’échelle des pores dépend de la disponibilité limitée de l’espace dans la matrice poreuse et la dispersion liée à la motilité peut être un moyen efficace d’augmenter la condition physique individuelle grâce à une concurrence réduite pour les ressources dans les zones moins densément peuplées. D’autre part, les bactéries motiles peuvent également atteindre des régions plus isolées de la matrice poreuse et l’exploration prolongée de ces zones peut offrir des possibilités écologiques aux populationsmotiles 10. À de plus grandes échelles spatiales, la croissance des biofilms détourne les trajectoires d’écoulement, ce qui entraîne également un obstruement (partiel) des pores et, par conséquent, l’établissement de conditions d’écoulement encore plus canalisées ethétérogènes11. Cela a des conséquences sur l’approvisionnement en éléments nutritifs et la capacité de dispersion, la fréquence et la distance. Le flux préférentiel, par exemple, peut générer ce qu’on appelle des « voies rapides » et les bactéries motiles peuvent atteindre des vitesses encore plus élevées que le débit local le long de cesvoies 12. Il s’agit d’un moyen efficace d’accroître l’exploration de nouveaux habitats.
Une variété d’outils se servent pour l’étude du transport des bactéries motiles et non motiles (et des particules) dans les médias poreux. Les modèles numériques ont de grandes capacités prédictives importantes pour les applications, mais sont souvent limités par des hypothèsesinhérentes 4. Les expériences àl’échelle de laboratoire 13,14 combinées à la modélisation révolutionnaire de la courbe (BTC) ont fourni des aperçus importants de l’importance des propriétés bactériennes de surface cellulaire pour collerl’efficacité 15. En règle générale, les CTC (c.-à-d. séries de temps de concentration de particules à un endroit fixe) sont obtenus au moyen de rejets à taux constant et de la mesure des nombres cellulaires à l’extérieur du dispositif expérimental. Dans ce contexte, les BTC reflètent la dynamique d’advection-dispersion des bactéries dans la matrice poreuse et peuvent être prolongés par un terme d’évier tenant compte de l’attachement. Toutefois, la modélisation des CTC à elle seule ne résout pas le rôle de l’organisation spatiale du substrat poreux ou du biofilm pour les processus de transport. Il a été prouvé que d’autres observables macroscopiques comme les profils de dispersion ou de dépôt fournissent des informations importantes sur la distribution spatiale ou les particules retenues ou les communautés en croissance. La microfluidique est une technologie qui permet d’étudier le transport dans les médias poreux par microscopieenquête 9,12,16, et à l’exception d’un travail récent10, les systèmes expérimentaux sont généralement limités à une seule échelle de longueur de résolution, c’est-à-dire l’échelle pore ou l’échelle de l’appareil fluide ensemble.
Ici, nous introduisons une série de méthodes combinées pour étudier le transport des bactéries motiles et non motiles dans les paysages poreux à différentes échelles. Nous combinons les observations du transport bactérien à l’échelle des pores avec des informations à plus grande échelle, au moyen d’une analyse BTC. Les dispositifs microfluidiques construits à partir de lithographie douce à l’aide de polydimethylsiloxane (PDMS) sont biocompatibles, résistants à une gamme de produits chimiques, permettent une réplicabilité à faible coût et offrent une excellente transparence optique ainsi qu’une faible autofluorescence critique pour l’observation microscopique. Les microfluidiques basés sur le PDMS ont déjà été utilisés pour étudier le transport des microbes dans des canaux simples17 ou dans des géométries plus complexes12. Toutefois, les expériences typiquement microfluidiques se concentrent sur des horizons à court terme et l’observation microscopique d’épi fluorescence des cellules vivantes est généralement limitée aux souches génétiquement modifiées (p. ex., souches étiquetées GFP). Nous présentons ici des outils pour étudier le transport bactérien à l’aide d’appareils microfluidiques à base de PDMS en combinaison avec la microscopie et les dispositifs plus grands fabriqués à partir de poly(méthyle méthacrylate) (PMMA, également connu sous le nom de plexiglas) en combinaison avec la cytométrie du flux. Pdms et PMMA diffèrent dans la perméabilité du gaz et les propriétés de surface, offrant ainsi des possibilités complémentaires d’étudier le transport bactérien. Bien que le dispositif microfluidique offre un environnement plus contrôlé, le dispositif plus grand permet des expériences sur de longues périodes de temps ou en utilisant des communautés bactériennes naturelles. Le comptage par microscopie à haute résolution temporelle dans une zone dédiée est utilisé pour obtenir le BTC dans le dispositif microfluidique à base de PDMS. Pour obtenir le nombre de cellules pour la modélisation BTC à partir de l’appareil à base de PMMA, nous introduisons un distributeur automatique de liquide auto-construit en combinaison avec la cytométrie d’écoulement. Dans cette configuration, les cellules passent le dispositif fluidique et sont consécutivement distribuées dans 96 plaques de puits. La résolution temporelle est limitée par le volume minimum qui peut être distribué avec précision et donc le débit moyen à travers le dispositif fluide. Fixatif dans les puits empêche la croissance et facilite la coloration de l’ADN pour l’énumération en aval du débit cytométrique. Pour prévenir la croissance bactérienne pendant les expériences de transport, nous utilisons un milieu minimal (appelé tampon de motilité).
Étant donné que les protocoles de préparation des dispositifs fluidiques à différentes échelles sont facilement disponibles, nous n’introduisons que brièvement les techniques de production de tels dispositifs et nous nous concentrons plutôt sur les procédures expérimentales d’enregistrement des CFC. De même, diverses routines existent pour l’énumération cytométrique du flux des microbes et les utilisateurs ont besoin de connaissances spécialisées pour interpréter les résultats obtenus par cytométrie de flux. Nous rapportons l’utilisation nouvelle des dispositifs microfluidiques en combination avec la formation image microscopique pour enregistrer des BTCs des cellules fluorescentes-marquées. À l’échelle des pores, les vitesses et trajectoires locales sont obtenues au moyen du traitement d’image. De plus, nous démontrons l’utilisation d’un dispositif fluidique à base de PMMA en combinaison avec le comptage flow-cytométrique pour observer le transport bactérien de cellules motiles et non motiles dans des environnements poreux colonisés par un biofilm de cours d’eau indigène.
Protocole
1. Conditions de culture bactérienne
- En travaillant sous un capot d’écoulement laminaire, utiliser 100 μL d’un stock de glycérol de Pseudomonas putida KT2440 marqué GFP (1 ×10 7 mL-1, stocké à -80 °C) pour inoculer 5 mL de milieu Luria-Bertani (LB). Incuber à 30 °C tout en secouant à 250 rpm pendant la nuit.
- Le lendemain, resuspendez 100 μL de la culture nocturne en moyenne LB de 5 mL et incubez dans les mêmes conditions pendant 5h (phase exponentielle). Dégustez un aliquot de 1 mL dans un tube de 2 mL, laissez refroidir à température ambiante (~15 min) et centrifugeuse (2300 x g pendant 5 min).
- Retirer le supernatant et ajouter 1 mL de tampon de motilité à la pastille. Vortex brièvement pour homogénéiser l’échantillon. Diluer pour atteindre la concentration cellulaire désirée, p. ex., 5 x 105 mL-1.
- Pour les expériences impliquant des communautés naturelles, telles que celles dérivées des cours d’eau, préparer un milieu de culture non sélectif. Par exemple, utilisez de l’eau de cours d’eau filtrée stérile et autoclavée ou un milieu artificiel d’eau de cours d’eau modifié avec une source de carbone complexe (moyenne LB).
2. Préparation d’un dispositif microfluidique en polydimethylsiloxane (PDMS)
- Concevoir la géométrie poreuse souhaitée au moyen du logiciel de rédaction assistée par ordinateur (CAD)18, qui se compose d’une matrice de cercles (c’est-à-dire l’obstacle imperméable au flux), décrite par la taille du rayon et les coordonnées du centre.
REMARQUE : La figure 1Aest un exemple d’une géométrie poreuse avec des tailles randomisées de grains et de pores. Un canal d’observation sans obstacles à proximité de la sortie facilite l’acquisition de BTC. - Basé sur la géométrie choisie, préparez un moule en utilisant su-8-photolithographiestandard 18.
REMARQUE : Alternativement, des moules peuvent également être commandés à partir de l’installation dédiée de microfabrication. Afin d’obtenir un flux de fluide hétérogène dans le plan horizontal, il est important de concevoir l’épaisseur de la chambre microfluidique du même ordre de grandeur que la taille moyenne de la gorge des pores. Toutefois, assurez-vous que les dimensions du dispositif microfluidique conviennent à l’observation au microscope (p. ex., travailler sur des diapositives au microscope). - Préparer 50 g de PDMS en ajoutant 10% du lien croisé (diméthyle, méthylhydrogène siloxane copolymer) à 90% de l’élastomère par poids, à l’aide d’une seringue sans aiguille. Travaillez dans des conditions propres et évitez autant que possible la poussière. Mélanger les deux reagents dans un récipient jetable propre et appliquer le vide (100 mbar) pendant 30 min pour enlever l’air dissous et les bulles du PDMS visqueux.
- Placer le moule dans une boîte de Pétri (100 mm de diamètre, 15 mm de haut). Verser le PDMS sur le moule à la hauteur désirée (p. ex., 2 à 5 mm). Couvrir la boîte de Pétri et la garder à 60 °C pendant 4 h (toute la nuit pour des couches plus épaisses) pour la guérir.
REMARQUE : À des fins de visualisation, la lumière devrait pouvoir passer à travers le PDMS, de ce fait, une mince couche entre 2 mm et 5 mm est souhaitable. Des couches plus épaisses (>5 mm) réduisent la transparence de l’appareil et les couches plus minces sont soumises à des déformations pendant l’application. - Retirer le moule du four et laisser refroidir le dispositif microfluidique à température ambiante. Une fois refroidi, retirer délicatement la partie désirée de PDMS avec un scalpel.
REMARQUE : De fortes pressions sur le moule entraînent des fractures de moisissures. Ne touchez pas le PDMS à mains nues, car les empreintes digitales affecteront la transparence optique. - Sceller temporairement le fond du canal PDMS (où la géométrie désirée a été gravée) avec du ruban adhésif. À l’aide d’un poinçonneur de biopsie de 0,5 mm de diamètre, percer le canal microfluidique pour créer une entrée et une prise raccordant le tube de 0,5 mm (diamètre intérieur).
REMARQUE : La douceur du PDMS assurera l’étanchéité une fois que le tube sera inséré. Les canaux d’entrée et de sortie ne peuvent pas être fabriqués après que le PDMS a été scellé au verre. - Sceller le canal microfluidique par liaison plasmatique à l’aide du générateur à haute fréquence (liaison plasmatique, tableau des matériaux). Pour cela, nettoyez une glissière en verre silicate (25 mm x 75 mm) avec de l’éthanol et laissez-la sécher. Retirez le ruban du canal PDMS et placez le canal avec le côté poreux orienté vers le haut. Traitez la glissière en verre silicate et les surfaces PDMS avec du plasma pendant environ 45 s à température ambiante.
- Placer le canal PDMS sur la glissière en verre silicate et chauffer à 100 °C pendant 30 min sur une plaque chauffante.
- Retirer le dispositif microfluidique de la plaque chaude et le refroidir à température ambiante. Connectez l’entrée du canal PDMS à la tuyauterie. Appliquer le vide pendant 30 min pour enlever l’air du PDMS, qui est presque imperméable aux fluides mais perméable au gaz.
- Préparer 100 mL de tampon de motilité (10 mM de phosphate de potassium, 0,1 mM d’EDTA, complété par 1% de glucose w/v, pH 7,0) et injecter 1 mL de celui-ci dans le dispositif microfluidique à l’aide d’une pompe à seringues fonctionnant à 10 μL min-1.
REMARQUE : Comme le PDMS est sous-saturé en gaz (en raison de l’étape précédente du vide), les bulles disparaîtront dans les ~30 min.
3. Préparation d’un dispositif fluidique en poly (méthacrylate méthyle)
- Concevez la géométrie désirée avec le logiciel CAO. Le cas échéant, assurez-vous que les dimensions conviennent à l’observation au microscope (p. ex., dimensions d’une plaque de puits standard 96 en combinaison avec un support approprié). Le dispositif fluide est composé d’une base (127 × 127 × 12 mm) et d’un couvercle (127 × 127 × 12 mm) de PMMA.
REMARQUE : L’expertise avec le logiciel CAO est recommandée. Un exemple de dessin technique est fourni à la figure 1A. - Pour produire le compartiment poreux, au moyen d’un micromillage de haute précision (WF31SA, Mikron), retirez 0,5 mm de la couche inférieure pmma et moudre une rainure (1,1 × 1,1 mm) pour un anneau O en caoutchouc. Percer 12 trous filetés (M5). Cela servira de base à l’appareil fluide.
REMARQUE : Les dimensions de l’appareil fluidique doivent être ajustées pour s’adapter au stade du microscope et à la distance focale. Un dessin technique est fourni dans la figure S1. - Percer deux trous filetés (type 1/4-28UNF) pour l’entrée et la sortie dans la partie supérieure de l’appareil fluidique, et 12 trous (5,5 mm) pour les vis. Cela servira de couvercle de l’appareil fluide.
REMARQUE : L’expertise en micro-fraisage est conseillée; les auteurs utilisent le soutien d’un atelier spécialisé. - Afin de nettoyer et de stériliser l’appareil fluidique avant et après chaque utilisation, tremper la base et le couvercle de l’appareil fluidique dans HCl 7% et rincer trois fois à l’eau déionisée.
- Visser la base et le couvercle ensemble à l’aide des 12 trous filetés.
4. Configuration d’un distributeur automatisé
REMARQUE : Les distributeurs liquides disponibles dans le commerce sont coûteux et n’offrent souvent pas la souplesse nécessaire pour se passer directement de l’écoulement de l’appareil fluide. Par conséquent, l’assemblage d’un système de distributeur robotique bon marché et flexible à partir d’un robot Traceur XY (Table of Materials) est recommandé.
- Afin de distribuer l’écoulement de l’appareil fluidique dans 96 plaques de puits, montez le distributeur robotique sur une plaque PMMA et des cavités de moulin de 85,8 x 128 mm avec une profondeur de 1 mm pour contenir plusieurs plaques de puits 96.
- Fixez le tube de sortie de l’appareil fluide au bras robotique du distributeur.
- Pour faire fonctionner le distributeur robotique télécharger bCNC à partir de github: https://github.com/vlachoudis/bCNC et suivre les instructions pour installer le programme.
- Téléchargez dispenser.py du matériel de soutien de cet article.
REMARQUE : Ce code python fournit un plugin à bCNC pour une disposition robotique simple de distributeur. - Connectez le distributeur robotique à l’ordinateur fonctionnant sous bCNC et identifiez le bon port COM.
- Dans bCNC, cliquez sur le bouton d’accueil pour retourner le distributeur robotique à la position de la maison.
REMARQUE : Homing ramène le distributeur robotique à une position connue (x=0, y=0) et améliore donc la précision du distributeur. - Avant l’expérience, préparer un nombre suffisant de 96 plaques de puits, avec des puits contenant une quantité appropriée de fixatif (p. ex., concentration finale de formaldéhyde à 3,7 %).
REMARQUE : Par exemple, à un débit de 0,2 mL min-1, 100 μL sont distribués dans chaque puits tous les 30 s. Par conséquent, ajouter 10 μL de formaldéhyde de 37 % à chaque puits pour atteindre une concentration finale de formaldéhyde comprise entre 2 et 4 %. L’utilisation de huit plaques de puits 96 permettra de faire fonctionner l’expérience pendant plus de 6 h avec un total de 768 points de données. De plus, notez que les cellules étiquetées GFP peuvent perdre leur signal fluorescent après fixation à l’aide de formaldéhyde.
5. Analyser le transport bactérien à l’aide d’appareils microfluidiques PDMS
- Placez le dispositif microfluidique PDMS précédemment saturé avec le tampon de motilité sur l’étape du microscope. Utilisez du ruban adhésif pour fixer le tube afin de minimiser les perturbations de l’écoulement pendant le mouvement de l’étape.
- Déplacez l’étape du microscope vers le canal d’observation près de la prise. À l’aide d’une microscopie de champ lumineux ou d’un contraste de phase, concentrez-vous au centre du canal d’observation et ajustez le grossissement pour visualiser les cellules bactériennes individuelles.
- Passez les paramètres du chemin lumineux à la microscopie de fluorescence et ajustez le temps d’exposition de la caméra pour résoudre les cellules bactériennes individuelles (p. ex. 100 ms), ou de sorte que les signaux de fluorescence des cellules sont au moins 3 fois plus forts que le bruit de fond.
- Ensuite, insérez le tube d’entrée dans un tube de 2 mL contenant la suspension bactérienne. Inverser la direction de la pompe et commencer à retirer la suspension à un débit de 1 μL min-1.
- Scannez la section transversale de l’ensemble du canal d’observation en enregistrant une image composite toutes les 2 minutes, sur toute la durée de l’expérience.
6. Traitement d’image de base
REMARQUE : Le but de ces routines de traitement d’image de base est de compter le nombre de bactéries dans les images enregistrées. Les procédures de traitement optimales dépendent des spécifications techniques du microscope et de la caméra, ainsi que des propriétés de fluorescence de la souche bactérienne utilisée dans l’expérience et doivent donc être ajustées.
- Premières images d’exportation .tiff format.
- Importer des images sur une plate-forme logicielle désirée (p. ex., MATLAB, ImageJ, R ou Python).
- Supprimer le bruit de la caméra, qui est une variation aléatoire de l’intensité des pixels dans les images et corriger pour aberration optique. Cela peut être fait en appliquant un filtre gaussien à chaque image: la taille du filtre dépend de la qualité du capteur de la caméra (par exemple CCD ou CMOS). L’aberration optique peut être supprimée en normalisant chaque image par une image de référence recueillie en l’absence du spécimen avec la même configuration optique.
- Recadrer les images dans une région d’intérêt.
- Identifier une valeur seuil (intensité pixel), de sorte que les valeurs au-dessus du seuil comprennent les cellules bactériennes.
REMARQUE : Dans le cas où les images sont inégalement éclairées (en raison d’une aberration optique ou d’un bruit), il peut être utile d’appliquer un seuil adaptatif, qui choisit une valeur seuil basée sur les intensités moyennes locales. - Soustrayez de chaque image le seuil défini ci-dessus.
- Binarize l’image résultante, de sorte que les cellules bactériennes prennent une valeur de 1, tandis que le fond prend une valeur de 0.
- Enlevez les grappes dont la superficie est plus petite que la plus petite taille de cellules bactériennes.
- Sum l’image binariée pour obtenir le nombre total de pixels des clusters restants. Divisez le nombre de pixels par la taille moyenne (en pixels) d’une cellule bactérienne : cela fournit une estimation du nombre total de cellules.
- Connaissant la profondeur de la vue et la zone d’investigation, transformez les comptes en concentration (particules mL-1).
- Il est fondamental d’identifier la concentration de la suspension des bactéries injectées. Pour ce faire, injectez avec une seringue 1 mL de suspension de culture bactérienne dans le canal d’observation d’un dispositif microfluidique propre. Enregistrez l’image et calculez la concentration bactérienne influente (C0)décrite ci-dessus (6,1 à 6,10).
- Analyser les CTC en normalisant la concentration bactérienne des effluents (C) avec une concentration bactérienne influente (C0)et une parcelle C/C0 par rapport au temps.
7. Analyser le transport bactérien à l’échelle des pores
- Afin d’analyser les vitesses locales et les trajectoires des bactéries transportées à travers la matrice poreuse, déplacez le stade du microscope vers la région d’intérêt et ajustez l’accent au centre du dispositif microfluidique.
- Réglez le microscope au champ lumineux ou au contraste de phase.
REMARQUE : Ce n’est que dans le cas où le signal de fluorescence des cellules bactériennes ne permet pas d’enregistrer des images à un moment d’exposition plus court que le temps bactérien moyen, sinon d’utiliser la microscopie par fluorescence. - Enregistrez des images en accéléré, au moment de l’exposition qui capture le déplacement des bactéries (plus courte que le déplacement moyen sur un certain nombre de pixels plus petits que la taille de l’objet), et qui optimise la détection des cellules bactériennes (p. ex. exposition de 20 ms et images enregistrées toutes les 50 ms). Enregistrez des images sur une quantité suffisante de temps afin d’enregistrer suffisamment (pour être statistiquement représentatif) des trajectoires les plus lentes (p. ex. 3 min).
REMARQUE : Assurez-vous que l’ordinateur dispose de suffisamment d’espace disque. - Pour supprimer le bruit de fond, soustrayez de chaque image la moyenne de toutes les images enregistrées. Pour ce faire, créez une matrice dont le résultat est la somme d’intensité de toutes les images, pour chaque pixel, et divisez-la par le nombre d’images.
- À partir de l’image traitée (Im), déterminer le module du gradient numérique et
 le normaliser par sa valeur maximale (max), tel que défini ci-dessous.
le normaliser par sa valeur maximale (max), tel que défini ci-dessous.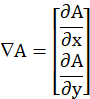

- Binarize la matrice B par seuil d’intensité, voir les étapes 6.7-6.8.
- Pour chaque point de temps, enregistrez les coordonnées des bactéries (x, y en pixel ou mm) et l’heure de l’acquisition de l’image dans un fichier à trois colonnes.
- Enfin, appliquez un script de suivi des particules pour traiter les données enregistrées et calculer les trajectoires des bactéries. Par exemple, utilisez le protocoleétabli 19, et le code de suivi des particules Matlab librement disponible : (http://site.physics.georgetown.edu/matlab/).
8. Étudier la filtration bactérienne au moyen de profils de dépôt
- Pour obtenir des profils de dépôt des cellules P. putida KT2440 taguées par fluorescence, enregistrez une image composite de l’ensemble du canal poreux avant, c’est-à-dire l’arrière-plan, et après injection de suspension bactérienne par le dispositif microfluidique. Utilisez un temps d’exposition qui permet d’acquérir un signal fluorescent bactérien (p. ex. 100 ms), sans blanchir le signal.
- Exporter des images et importer dans la plate-forme logicielle souhaitée (voir 6.1-6.2).
- Retirez l’arrière-plan des images enregistrées après l’injection bactérienne.
- Intégrer le signal de fluorescence total des bactéries retenues le long des sections transversales du canal poreux.
- Afin de calculer le profil de dépôt, tracez le signal de florescence intégré par rapport à la longueur poreuse du canal.
9. Analyser le transport bactérien à l’aide de dispositifs fluidiques PMMA et de cytométrie d’écoulement
- Connectez la pompe périssaltique à l’entrée à l’aide d’un tube de 50 cm (1 mm de diamètre intérieur) et à l’écoulement avec le distributeur automatisé à l’aide du même tube (50 cm, voir la section 4).
REMARQUE : Utilisez la pompe pour distribuer des supports de culture et injecter des cellules bactériennes. Utilisez des connecteurs luer-lock et des valves à trois sens pour passer d’une suspension moyenne à une suspension bactérienne pendant la libération à taux constant. - Pomper le milieu de culture dans l’appareil fluidique. Notez l’arrivée du milieu à la tuyauterie de sortie fixée au distributeur robotique.
- Commencez à injecter la suspension bactérienne par l’intermédiaire de l’appareil fluidique PMMA à un débit de 0,2 mL min-1,
- Lorsque les bactéries atteignent l’entrée de l’appareil fluidique, allumez le distributeur automatisé.
- Afin de faire une injection d’impulsions, injecter une suspension bactérienne pour certains volumes de pores (p. ex. 30), puis passer à l’injection dans les médias de culture jusqu’à la fin de l’expérience.
REMARQUE : le volume poreux de l’appareil fluidique est d’environ 0,2 mL, donc au débit prosed chaque minute un volume de pore entier est échangé. - Une fois qu’une plaque de puits de 96 est terminée, couvrir la plaque pour réduire l’évaporation et la conserver à 4 °C.
- Analyser l’abondance bactérienne par cytométrie de débit, suivant les protocolesétablis 20.
REMARQUE : Par exemple, ajouter 25 μL de la tache d’acide nucléique vert-fluorescent (tableau des matériaux) à 0,025 mM (dans de l’eau ultrapure) à chaque puits. Il tache l’ADN bactérien, permettant ainsi de quantifier par cytométrie de flux l’abondance bactérienne. Incuber des échantillons pendant 15 min dans l’obscurité, puis analyser à l’aide d’un cytomètre d’écoulement équipé d’un laser de 488 nm et des détecteurs à 515 nm. - Avant l’analyse BTC, considérez la dilution de l’échantillon en raison de l’ajout de fixatif et de tache. Corriger l’abondance bactérienne par un facteur de 1,35 pour tenir compte du fixatif et de la tache.
Résultats
Pour illustrer la fonctionnalité du flux de travail présenté, nous avons effectué des expériences à l’aide de Pseudomonas putida KT2440 génétiquement modifié, une bactérie motile gram négative importante pour la bioresamédiation et la biotechnologie. Les versions génétiquement modifiées de cette souche qui expriment la production de GFP sont disponibles dans le commerce. Une souche non motile de P. putida KT2440 qui n’a pas les gènes structurels et réglementaires pertinents pour la motilité est également disponible. En utilisant à la fois, motile et non motile GFP marqué P. putida KT2440, nous avons effectué des expériences séquentielles dans les dispositifs microfluidiques PDMS avec un éventail aléatoire de piliers (Figure 1B) et enregistré BTCs (Figure 2A). Les CTC ont été normalisés à la concentration de cellules injectées (C0). Simultanément, les trajectoires bactériennes à l’échelle des pores ont été visualisées au moyen du traitement d’images et du suivi des particules tel que décrit ci-dessus (figure 2B).
Ensuite, nous avons effectué des expériences avec des dispositifs fluidiques à grande échelle usinés à partir de PMMA( Figure 1A). Motile et non-motile P. putida KT2440 (non fluorescent) ont été injectés dans une matrice poreuse régulièrement espacée et btcs ont été obtenus en utilisant le distributeur liquide et le comptage de cytométrie d’écoulement tel que décrit ci-dessus (Figure 3A). Étonnamment, dans un environnement poreux dépourvu de biofilm, motile et non motile P. putida KT2440 a montré un comportement de transport nettement différent. Dans une matrice poreuse colonisée pendant 48h avec une communauté complexe de biofilms de flux, ces différences de BTC entre motile et non motile P. putida KT2440 ont disparu (Figure 3B.)

Figure 1: Dispositifs fluidiques pour étudier le transport microbien dans les médias poreux (A) Illustration d’un dispositif fluidique moulu à partir de PMMA. La matrice poreuse est moulue dans la couche de base de l’appareil, le couvercle est fermé à l’aide de vis. Une section transversale montre l’agencement des piliers à l’intérieur du dispositif fluide. L’insert montre une matrice poreuse avec une grille espacée régulière de piliers et le champ d’écoulement de vitesse respectif. (B) Le dispositif PDMS est monté sur une toboggan en verre microscopie. On y voit l’entrée et la sortie, reliées respectivement au réservoir moyen et à la pompe à seringues. La chambre d’observation pour le comptage microscopique est placée comme une chambre séparée sans matrice poreuse sur la même glissière de microscope. L’insert montre une matrice poreuse avec un éventail aléatoire de piliers (en diamètre et en espacement). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
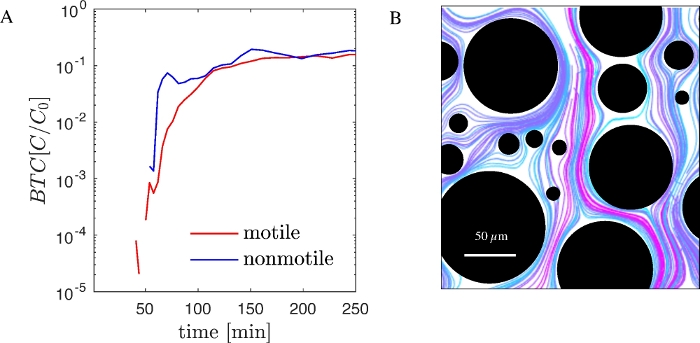
Figure 2: Transport bactérien à l’échelle des canaux et des pores dans le dispositif fluidique PDMS (A) BTCs de motile et non motile P. putida KT2440 (GFP marqué) obtenu avec un dispositif microfluidique PDMS et un comptage microscopique. (B) Trajectoires des cellules non motiles à l’échelle des pores. Les couleurs sont choisies pour améliorer la différenciation des trajectoires. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3: Transport bactérien à l’échelle du chenal et de la pore dans le dispositif fluidique PMMA (A) BTCs de motile et non motile P. putida KT2440 (non marqué) obtenu à l’aide d’un dispositif fluidique PMMA et d’un comptage flux-cytométrie. (B) Le dispositif fluidique a été colonisé par une communauté naturelle de cours d’eau pendant 2 jours. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Figure supplémentaire 1 : Dessins techniques de l’appareil fluidique PMMA. L’appareil est composé d’une unité de base contenant la matrice poreuse et d’une unité de couvercle comportant les trous pour l’entrée et la sortie. L’appareil est scellé à l’aide de 12 vis et d’un anneau O. S’il vous plaît cliquez ici pour télécharger ce chiffre.
Discussion
Ici, nous suggérons deux moyens d’étudier le transport des microbes à travers des systèmes poreux au niveau d’une seule cellule et au niveau de la population. Bien que l’étude des phénomènes de transport à l’aide de la modélisation BTC ait fourni des informations précieuses sur la propagation des agents pathogènes ou des contaminants à l’échelle de l’écosystème, il existe encore des difficultés à passer des expériences de laboratoire aux conditions sur le terrain. Les outils décrits ici permettent aux chercheurs de résoudre expérimentalement les échelles spatiales et temporelles afin de mieux comprendre les stratégies écologiques des microbes pertinents pour le transport dans des environnements poreux. Les expérimentateurs peuvent utiliser ou modifier ces systèmes pour étudier d’autres caractéristiques microbiennes que la motilité, comme la chimiotaxis ou la détection du quorum ou modifier la géométrie ou d’autres caractéristiques de l’habitat de la matrice poreuse. En outre, en utilisant ces systèmes, le comportement de transport bactérien peut être facilement couplé à des profils de dépôt, qui fournissent des informations importantes sur les modèles de colonisation et sont essentiels pour comprendre comment les biofilms modifient les champs d’écoulement locaux. Nous prévoyons qu’une meilleure compréhension des stratégies microbiennes visant à disperser et à coloniser les médias poreux améliorera les prédictions des modèles et contribuera ainsi à la gestion de la propagation des pathogènes ou du confinement des contaminants. D’autres modifications du système peuvent également contribuer au développement de nouveaux dispositifs de filtration ou d’outils biotechnologiques dans lesquels les cellules doivent être physiquement séparées.
Nous recommandons des dispositifs basés sur la PMMA pour des expériences à long terme et des dispositifs basés sur le PDMS pour des expériences plus petites et à court terme ou lorsque la haute résolution temporelle est critique. Il faut garder à l’esprit que les deux matériaux ont des propriétés différentes. Par exemple, pdms est perméable au gaz comme l’oxygène, tandis que PMMA est étanche au gaz. Cette différence pourrait être utilisée pour étudier la consommation de gaz dans le scénario PMMA, tandis que PDMS pourrait être plus approprié pour l’expérience où les limitations d’oxygène liées à la respiration bactérienne ne sont pas désirées.
En général, les protocoles décrits ici sont facilement reproductibles et les données obtenues à l’aide de ces outils révèlent constamment des différences dans le transport des bactéries motiles et non motiles. Le distributeur de liquide auto-fabriqué peut être remplacé par une alternative disponible dans le commerce. Toutefois, pour des raisons de polyvalence et de rentabilité, nous recommandons celle décrite ici. Les étapes critiques du protocole concernent principalement la manipulation des appareils fluidiques et l’expérience du traitement de l’image. La qualité des données obtenues grâce à l’analyse d’images dépend de façon critique de la qualité de l’image (principalement déterminée par le temps de mise au point et d’exposition) et d’une stratégie de seuil appropriée. La qualité des données obtenues par le comptage flow-cytométrique dépend de façon critique de la fixation et de la coloration efficaces des cellules et de l’expertise dans l’interprétation des résultats de la cytométrie des flux.
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a pas de conflit d’intérêts.
Remerciements
Nous reconnaissons l’aide d’Antoine Wiedmer avec la mise en place du distributeur robotique et le dispenser.py script.
matériels
| Name | Company | Catalog Number | Comments |
| EDTA | Sigma | ||
| Elastomer Sylgard 184 | Dowsil | 101697 | |
| Flow cytometer NovoCyte | Acea | ||
| Glucose | Sigma | https://www.makeblock.com/project/xy-plotter-robot-kit | |
| LB broth | BD | ||
| Liquid dispenser, XY Plotter Robot Kit | makeblock | ||
| Microscope Axio Imager | Zeiss | ||
| Microscope AxioZoom v16 | Zeiss | ||
| Microscope slides, 75 mm × 25 mm | Corning | ||
| Minipuls 3 peristaltic pump | Gilson | ||
| Plasma bonder Corona SB | BlackHole Lab | ||
| Potassium phosphate | Sigma | ||
| Syringe pump New Era NE 4000 | New Era | ||
| Syto 13 Green Fluorescent Nucleic Acid Stain | Molecular Probes, Invitrogen | ||
| Tygon tubing | Ismatec | ||
| WF31SA universal milling machine | Mikron |
Références
- Stevik, K., Aa, K., Ausland, G., Fredrik Hanssen, J. Retention and removal of pathogenic bacteria in wastewater percolating through porous media: a review. Water Research. 38 (6), 1355-1367 (2004).
- Ribet, D., Cossart, P. How bacterial pathogens colonize their hosts and invade deeper tissues. Microbes and Infection. 17 (3), 173-183 (2015).
- Ginn, T. R., Wood, B. D., Nelson, K. E., Scheibe, T. D., Murphy, E. M., Clement, T. P. Processes in microbial transport in the natural subsurface. Advances in Water Resources. 25 (8), 1017-1042 (2002).
- Tufenkji, N. Modeling microbial transport in porous media: Traditional approaches and recent developments. Advances in Water Resources. 30 (6-7), 1455-1469 (2007).
- Foppen, J. W., Van, M. H., Schijven, J. Measuring and modelling straining of Escherichia coli in saturated porous media. Journal of contaminant hydrology. 93 (1-4), 236-254 (2007).
- Battin, T. J., Besemer, K., Bengtsson, M. M., Romani, A. M., Packmann, A. I. The ecology and biogeochemistry of stream biofilms. Nature Reviews Microbiology. 14 (4), 251-263 (2016).
- Scheidweiler, D., Peter, H., Pramateftaki, P., Anna, P., de Battin, T. J. Unraveling the biophysical underpinnings to the success of multispecies biofilms in porous environments. The ISME Journal. 1, (2019).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Bhattacharjee, T., Datta, S. S. Bacterial hopping and trapping in porous media. Nature Communications. 10 (1), 2075(2019).
- Scheidweiler, D., Miele, F., Peter, H., Battin, T. J., de Anna, P. Trait-specific dispersal of bacteria in heterogeneous porous environments: from pore to porous medium scale. Journal of The Royal Society Interface. 17 (164), 20200046(2020).
- Morales, V. L., Parlange, J. Y., Steenhuis, T. S. Are preferential flow paths perpetuated by microbial activity in the soil matrix? A review. Journal of Hydrology. 393 (1), 29-36 (2010).
- Creppy, A., Clément, E., Douarche, C., D'Angelo, M. V., Auradou, H. Effect of motility on the transport of bacteria populations through a porous medium. Physical Review Fluids. 4 (1), 013102(2019).
- Camesano, T. A., Logan, B. E. Influence of Fluid Velocity and Cell Concentration on the Transport of Motile and Nonmotile Bacteria in Porous Media. Environmental Science & Technology. 32 (11), 1699-1708 (1998).
- Lutterodt, G., Basnet, M., Foppen, J. W. A., Uhlenbrook, S. The effect of surface characteristics on the transport of multiple Escherichia coli isolates in large scale columns of quartz sand. Water Research. 43 (3), 595-604 (2009).
- Bozorg, A., Gates, I. D., Sen, A. Impact of biofilm on bacterial transport and deposition in porous media. Journal of Contaminant Hydrology. 183 (Supplement C), 109-120 (2015).
- Long, T., Ford, R. M. Enhanced Transverse Migration of Bacteria by Chemotaxis in a Porous T-Sensor. Environmental Science & Technology. 43 (5), 1546-1552 (2009).
- Rusconi, R., Garren, M., Stocker, R. Microfluidics Expanding the Frontiers of Microbial Ecology. Annual Review of Biophysics. 43 (1), 65-91 (2014).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Materials Science. 28 (1), 153-184 (1998).
- Crocker, J. C., Grier, D. G. Methods of Digital Video Microscopy for Colloidal Studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- del Giorgio, P. A., Bird, D. F., Prairie, Y. T., Planas, D. Flow cytometric determination of bacterial abundance in lake plankton with the green nucleic acid stain SYTO 13. Limnology and Oceanography. 41 (4), 783-789 (1996).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon