Method Article
将流体设备与显微镜和流式细胞学相结合,研究跨空间尺度的多孔介质中的微生物传输
摘要
突破性曲线 (BTC) 是研究多孔介质中细菌运输的高效工具。在这里,我们介绍基于流体器件的工具,结合显微镜和流动细胞测量计数,以获得BTC。
摘要
了解多孔介质中微生物的传输、分散和沉积是一项复杂的科学任务,包括流体动力学、生态学和环境工程等不同主题。在不同空间尺度的多孔环境中对细菌运输进行建模对于更好地预测细菌运输的后果至关重要,但当前的模型往往无法从实验室到现场条件进行扩展。在这里,我们介绍实验工具,以两个空间尺度研究多孔介质中的细菌运输。这些工具的目的是获得注入透明多孔基质的细菌的宏观可观测(如突破性曲线或沉积剖面)。在小规模(10-1000 μm)下,微流体器件与光学视频显微镜和图像处理相结合,获得突破性曲线,同时在孔隙尺度上跟踪单个细菌细胞。在更大的尺度上,流式细胞仪与自制的机器人分配器相结合,获得突破性曲线。我们演示了这些工具的效用,以更好地了解细菌是如何在复杂的多孔介质中(如溪流的低血区)中运输的。由于这些工具提供跨比例的同步测量,因此它们为基于机制的模型铺平了道路,对于上小范围至关重要。这些工具的应用不仅有助于新型生物修复应用的发展,而且为多孔基材的微生物殖民化生态策略提供了新的阐明。
引言
旨在了解微生物通过多孔介质的运输的研究主要受到污染1、疾病2和生物修复3的传播的关注。在这方面,细菌大多在运输模型4中被当作粒子处理,生物膜的过滤、应变、重力沉降或再移动化等过程被确定为微生物5的保留或运输的驱动因素。然而,研究细菌通过多孔景观的运输也可以告诉我们的生态策略,支撑他们成功地在这些复杂的环境中。然而,这需要新的实验和数学模型在单细胞,种群或微生物群落水平运行。
天然多孔环境,如在溪流和河流低血区发现的环境,由不同群落的生膜形成微生物6密集地殖民。生物膜形成结构,改变流动,从而在液体阶段,7,8中运输和分散细菌。以孔隙尺度运输细菌取决于多孔基质中空间有限,而与运动相关的分散可能是通过减少人口较少地区的资源竞争来提高个体 体质的有效方法。另一方面,动体细菌也可以到达多孔基质的更孤立的区域,而对这些地区的扩展探索可能为10个活动种群提供生态机会。在较大的空间尺度上,生物膜的生长也会转移流动路径,也导致(部分)毛孔堵塞,从而形成更通道化和异构的流动条件11。这对营养供应和分散能力、频率和距离有影响。例如,优先流动可以产生所谓的"快速通道",移动细菌可以达到比沿这些轨道12的局部流动更高的速度。这是增加对新生境探索的有效方法。
各种工具可用于研究多孔介质中移动细菌和非动性细菌(和颗粒)的运输。数字模型具有强大的预测能力,对于应用非常重要,但通常受到固有假设4 的有限限制。实验室规模实验13、14和突破性曲线(BTC)建模为细菌细胞表面特性粘附效率15的重要性提供了重要的见解。13,通常,BTC(即固定位置的粒子浓度时间序列)是通过恒定速率释放和测量实验设备流出时细胞数获得的。在这种情况下,BTC 反映了多孔基质中细菌的对流分散动力学,并且可以通过一个入汇术语来扩展附着。然而,仅对BTC进行建模并不能解决多孔基板或生物膜在运输过程中的空间组织作用。其他宏观观测,如分散性或沉积剖面,已被证明提供了有关空间分布或保留的粒子或生长群落的重要信息。微流体是一种技术,它允许通过显微镜调查9,12,16,12,16研究多孔介质的传输,除了最近的工作10,实验系统通常被限制在一个单一长度的分辨率尺度,即孔隙刻度或整个流体器件尺度。
在这里,我们介绍一套组合方法,研究不同尺度的多孔景观中莫蒂细菌和非动性细菌的运输。通过BTC分析,我们将孔径尺度细菌运输的观测与较大规模的信息相结合。使用聚二甲基硅氧烷 (PDMS) 的软光度印刷制造的微流体器件与生物相容,耐多种化学品,成本低,具有极佳的光学透明度和低自荧光,对微观观察至关重要。基于PDMS的微流体以前曾用于研究简单通道17或更复杂的几何体12 中微生物的传输。然而,通常微流体实验侧重于短期视界,活细胞的荧光显微观察通常仅限于转基因菌株(例如,GFP标记菌株)。在这里,我们介绍的工具,使用基于PDMS的微流体设备,结合显微镜和更大的设备,由聚(甲基甲基丙烯酸酯)(PMMA,也称为有机玻璃)结合流细胞仪,研究细菌运输。PDMS 和 PMMA 在气体渗透性和表面性能方面有所不同,从而为研究细菌运输提供了互补的机会。虽然微流体器件提供了更可控的环境,但较大的设备允许在较长时间内进行实验或使用天然细菌群落。在专用区域中,以高时分辨率进行显微计数用于在基于 PDMS 的微流体器件中获取 BTC。为了从基于PMMA的设备获取BTC建模的细胞计数,我们引入了一个自建的自动液体分配器,结合流式细胞仪。在此设置中,电池通过流体装置,并连续分配到 96 个孔板中。时态分辨率受可精确分配的最小体积的限制,从而通过流体装置的中流速。井中的固定剂可防止生长,并促进下游流-细胞计量枚举的DNA染色。为了防止运输实验期间细菌生长,我们使用最小的中培养液(术语运动缓冲液)。
由于不同尺度的流体器件制备协议是现成的,我们只简要介绍生产此类器件的技术,而只关注记录 BTC 的实验程序。同样,对于微生物的流动细胞学枚举存在各种程序,用户需要专业知识来解释流式细胞学获得的结果。我们报告了微流体器件与显微成像相结合的新用途,以记录荧光标记细胞的BTC。在孔隙尺度上,通过图像处理获得局部速度和轨迹。此外,我们演示了使用基于 PMMA 的流体装置与流-细胞计量计数相结合,以观察由原生流生物膜殖民的多孔环境中的动体和非动性细胞的细菌传输。
研究方案
1. 细菌培养条件
- 在层流罩下工作,使用 100 μL 的甘油库存的 GFP 标记 伪莫纳斯 putida KT2440 (1 × 107 mL-1,储存在 -80 °C) 接种 5 mL 的 Luria-Bertani (LB) 介质。在 30 °C 下孵育,同时在 250 rpm 下摇晃过夜。
- 第二天,在5 mL LB培养基中重新暂停100μL的隔夜培养,并在相同的条件下孵育5小时(指数相)。将 1 mL 等分样品取样到 2 mL 管中,冷却至室温(约 15 分钟)和离心机(2300 x g 5 分钟)。
- 取出上流液,向颗粒中加入1 mL运动缓冲液。涡流短暂地使样品均质化。稀释以达到所需的细胞浓度,例如 5 x 105 mL-1。
- 对于涉及自然群落的实验,如从溪流中提取的实验,准备非选择性栽培介质。例如,使用无菌过滤和自 <3>自 <3>化的流水或人工流水介质,用复杂的碳源(LB介质)进行修正。
2. 在聚二甲基硅氧烷(PDMS)中制备微流体装置
- 通过计算机辅助绘图 (CAD) 软件18设计所需的多孔几何体,它由圆矩阵(即流动的不可渗透障碍)组成,由半径大小和中心坐标描述。
注:图1A提供了具有随机颗粒和孔径的多孔几何 例。靠近出口处的观测通道不妨碍获取 BTC。 - 根据所选几何形状,使用标准 SU-8 光刻18准备模具。
注:或者,也可以从专用的微制造设施订购模具。为了获得水平平面的异质流体流动,设计与平均孔隙喉径相同的微流体室厚度非常重要。但是,请确保微流体装置的尺寸适合在显微镜下观察(例如,在显微镜幻灯片上工作)。 - 使用无针注射器,将 10% 的交链接器(二甲基、甲基硅氧烷共聚物)添加到 90% 的弹性体中,准备 50 g 的 PDMS。在清洁条件下工作,尽可能避免灰尘。将两种试剂混合在一个干净的一次性容器中,并应用真空(100 mbar)30分钟,以去除粘性 PDMS 中溶解的空气和气泡。
- 将模具放入培养皿中(直径 100 mm,高 15 mm)。将 PDMS 倒入模具上达到所需的高度(例如 2-5 mm)。盖上培养皿,并保持在60°C4小时(过夜较厚的层)固化。
注:为了可视化目的,光线应该能够通过 PDMS,因此,需要 2 mm 到 5 mm 之间的薄层。较厚的层(>5 mm)降低了设备的透明度,更薄的层在应用过程中会变形。 - 从烤箱中取出模具,让微流体装置冷却至室温。冷却后,用手术刀小心地取出 PDMS 所需的部分。
注:模具上的强压会导致模具断裂。不要徒手触摸 PDMS,因为指纹会影响光学透明度。 - 用胶带暂时密封 PDMS 通道的底部(在已刻上所需几何体的位置)。使用直径为 0.5 mm 的活检打孔机,刺穿微流体通道,形成入口和出口,安装 0.5 mm(内径)管。
注:一旦插入管道,PDMS 的柔软性质将确保紧固性。PDMS 密封到玻璃后,无法制造入口和出口通道。 - 使用高频发生器(等离子粘结器,材料表)通过氧等离子体粘结密封 微流体通道。为此,用乙醇清洁硅酸盐玻璃滑梯(25 mm x 75 mm),并晾干。从 PDMS 通道上拆下胶带,将通道朝上,将多孔侧朝上。在室温下用等离子体处理硅酸盐玻璃滑梯和 PDMS 表面约 45 s。
- 将 PDMS 通道放在硅酸盐玻璃滑轨上,并在 100°C 下在热板上加热 30 分钟。
- 从热板中取出微流体装置,将其冷却至室温。用管道连接 PDMS 通道入口。应用真空 30 分钟,从 PDMS 中去除空气,该气体几乎不渗透液体,但可渗透到气体中。
- 制备100 mL的动性缓冲液(10 mM磷酸钾,0.1 mM EDTA,辅以1%w/v葡萄糖,pH 7.0),并使用以10μLmin-1操作的注射器泵将其注入1 mL。
注:由于 PDMS 气体饱和不足(由于上一个真空步骤),气泡将在 +30 分钟内消失。
3. 在聚(甲基甲基丙烯酸酯)中制备流体装置
- 使用 CAD 软件设计所需的几何形状。如果适用,请确保尺寸适合在显微镜下观察(例如,标准 96 井板的尺寸与适当的支架结合使用)。流体装置由 PMMA 的底座 (127 × 127 × 12 mm) 和盖子 (127 × 127 × 12 mm) 组成。
注:建议使用 CAD 软件进行专业知识。图 1A提供了技术图示例。 - 要通过高精度微磨(WF31SA,Mikron)生产孔隙室,从底部PMMA层中去除0.5毫米,然后为橡胶O形环磨一个槽(1.1×1.1毫米)。钻 12 个螺纹孔 (M5)。这将作为流体装置的基础。
注:流体装置的尺寸需要调整,以适应显微镜级和焦距。图 S1 中提供了 技术图。 - 将两个螺纹孔(类型 1/4-28UNF)钻入流体装置的顶部和出口,为螺钉钻 12 个孔(5.5 mm)。这将作为流体装置的盖子。
注:建议在微铣刀方面提供专业知识;作者使用来自专门研讨会的支持。 - 为了在每次使用之前和之后清洁和消毒流体装置,将流体装置的底座和盖子浸泡在HCl 7%中,然后用去沉水冲洗三次。
- 使用 12 个螺纹孔将螺钉底座和盖子拧在一起。
4. 自动分配器的安装
注:商业上可用的液体分配器成本高昂,通常不能灵活地直接从流体装置的流出中分配。因此,建议从 XY 绘图仪机器人(材料表)组装一个廉价而灵活的机器人分配器系统。
- 为了将流体装置流出到 96 个孔板中,将机器人分配器安装到 85.8 x 128 mm 的 PMMA 板和磨机腔上,深度为 1 mm,以容纳多个 96 孔板。
- 将流体装置的流出管连接到分配器的机械臂上。
- 要操作机器人分配器,请从 github 下载 bCNC:https://github.com/vlachoudis/bCNC并按照说明安装程序。
- 从dispenser.py支持材料下载本文。
注:此 python 代码为 bCNC 提供了一个简单的机器人分配器布局插件。 - 将机器人分配器连接到运行 bCNC 的计算机,并确定正确的 COM 端口。
- 在 bCNC 中,单击主页按钮将机器人分配器返回到主页位置。
注:霍明将机器人分配器返回到已知位置(x=0,y=0),从而提高分配器的精度。 - 在实验之前,准备足够数量的96个井板,井中含有适当数量的固定物(例如,最终浓度3.7%甲醛)。
注:例如,在0.2 mLmin-1的流速下,每30秒向每一个井分配100μL。因此,在每一井中加入10μL的37%甲醛,以达到甲醛的最终浓度在2%至4%之间。使用8个96孔板将允许操作实验超过6小时,共768个数据点。此外,请注意,使用甲醛固定后,带GP标记的细胞可能会失去荧光信号。
5. 使用PDMS微流体装置分析细菌运输
- 将以前饱和的 PDMS 微流体装置放在显微镜阶段。使用胶带固定管子,以尽量减少在舞台移动过程中对流量的干扰。
- 将显微镜台移动到靠近出口处的观察通道。使用明亮的场显微镜或相位对比,聚焦到观察通道的中心,并调整放大倍率,以可视化单个细菌细胞。
- 将光路设置切换到荧光显微镜,并调整相机曝光时间,以解决单个细菌细胞(例如 100 ms),或者使细胞的荧光信号至少比背景噪声强 3 倍。
- 接下来,将进气管插入含有细菌悬浮液的 2 mL 管中。反转泵方向,以 1 μL min -1 的流量开始退出悬架。
- 扫描整个观察通道的横截面,每 2 分钟扫描一次合成图像,整个实验持续时间。
6. 基本图像处理
注:这些基本图像处理程序的目标是计算记录图像中的细菌数量。最佳的处理程序取决于显微镜和照相机的技术规格,以及实验中使用的细菌菌株的荧光特性,因此需要进行调整。
- 首次导出格式.tiff图像。
- 将图像导入所需的软件平台(例如,MATLAB、ImageJ、R 或 Python)。
- 消除相机噪声,这是图像中像素强度的随机变化,并校正光学畸变。这可以通过将高斯滤镜应用于每幅图片:滤镜的大小取决于相机传感器的质量(例如 CCD 或 CMOS)。光差可以通过在没有相同光学配置的试样的情况下收集的参考图像对每幅图片进行规范化来去除。
- 将图像裁剪到感兴趣的区域。
- 确定阈值(像素强度),以便高于阈值的值包括细菌细胞。
注:如果图像照明不均匀(由于光学畸变或噪声),则应用自适应阈值可能很有用,因为自适应阈值会根据局部均值强度选择阈值。 - 从每幅图片中减去上面定义的阈值。
- 双化生成的图像,使细菌细胞的值为 1,而背景的值为 0。
- 移除面积小于最小细菌细胞大小的聚类。
- 对二进制图像进行求和,以获取剩余群集的像素总数。将像素数除以细菌细胞的平均大小(以像素为单位):这提供了细胞总数的估计值。
- 了解视野深度和调查区域,将计数转换为浓度(粒子 mL-1)。
- 识别注射细菌悬浮液的浓度至关重要。为此,用注射器注射1 mL的细菌培养悬浮液,进入清洁微流体装置的观察通道。记录图像并计算上述(6.1至6.10)的细菌浓度(C 0)。
- 通过将污水细菌浓度 (C) 与内能细菌浓度 (C0)进行标准化分析 BTC,并绘制 C/C0 与时间图。
7. 分析孔隙尺度的细菌运输
- 为了分析通过多孔基质传输的细菌的局部速度和轨迹,将显微镜阶段移动到感兴趣的区域,并调整焦点到微流体装置的中心。
- 将显微镜设置为明亮的场或相位对比度。
注:这仅在细菌细胞的荧光信号不允许在曝光时间比细菌平均时间短时记录图像的情况下,否则使用荧光显微镜。 - 记录延时图像,在曝光时间捕获细菌位移(比比物体大小小的像素数的平均位移短),并优化细菌细胞检测(例如,曝光 20 ms 和每 50 ms 记录一次的图像)。在足够多的时间内记录图片,以便记录最慢轨迹(例如 3 分钟)的足够(具有统计代表性)。
注:确保计算机有足够的磁盘空间。 - 要消除背景杂色,请从每个图像中减去所有记录图像的平均值。为此,创建一个矩阵,其结果为每个像素的所有图像的强度总和,并除以图像数。
- 从处理的图像 (Im), 确定数值梯度的模数,
 并使其按其最大值 (最大值) 进行规范化,如下所述。
并使其按其最大值 (最大值) 进行规范化,如下所述。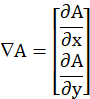

- 通过强度阈值对矩阵 B 进行双化,请参见步骤 6.7-6.8。
- 对于每个时间点,将细菌坐标(x、y(像素或毫米)和图像采集时间记录到三列文件中。
- 最后,应用粒子跟踪脚本处理记录的数据并计算细菌的轨迹。例如,使用已建立的协议19和免费提供的 Matlab 粒子跟踪代码:(http://site.physics.georgetown.edu/matlab/)。
8. 通过沉积剖面研究细菌过滤
- 要通过荧光显微镜获取GP标记 P.putida KT2440细胞的沉积图,记录之前整个多孔通道的复合图像,即背景,并通过微流体装置注射细菌悬浮液后。使用允许获取细菌荧光信号(例如 100 ms)的曝光时间,而不会漂白信号。
- 导出图像并在所需的软件平台中导入(参见 6.1-6.2)。
- 从细菌注射后记录的图像中删除背景。
- 沿多孔通道的横向部分整合保留细菌的总荧光信号。
- 为了计算沉积轮廓,绘制集成的荧光信号与多孔通道长度。
9. 使用PMMA流体装置和流式细胞学分析细菌运输
- 使用 50 厘米(1 毫米内径)管将近侧泵与入口连接,使用相同管材使用自动分配器(50 厘米,参见第 4 节)将流出泵与入口连接。
注:使用泵分配培养介质,并注射细菌细胞。在恒定速率释放过程中,使用 Luer 锁连接器和三向阀在介质和细菌悬浮液之间移动。 - 流体装置中的泵培养介质。请注意,固定在自动分配器的出水管处的介质到达。
- 开始以0.2 mLmin-1的流速通过PMMA流体装置注射细菌悬浮液,
- 当细菌到达流体装置入口时,打开自动分配器。
- 为了进行脉冲注射,注射一些孔隙体积的细菌悬浮液(例如30),然后将注射切换到培养介质,直到实验结束。
注:流体器件的孔隙体积约为0.2 mL,因此每分钟交换一个整孔径的流速。 - 完成 96 井板后,盖住板以减少蒸发并将其储存在 4°C。
- 分析细菌丰度通过流动细胞学,按照既定的协议20。
注:例如,在每一井中加入25μL的绿色荧光核酸污渍(材料表),含量为0.025 mM(超纯水)。它染色细菌DNA,从而允许通过流动细胞测量量化细菌丰度。在黑暗中孵育样品15分钟,然后使用配备488nm激光和515纳米探测器的流动细胞计进行分析。 - 在BTC分析之前,考虑由于添加固定剂和污渍而稀释样品。正确的细菌丰度1.35系数,以考虑固定和污渍。
结果
为了说明所呈现的工作流程的功能,我们使用转基因伪多莫纳斯普蒂达KT2440进行了实验,这是一种对生物修复和生物技术非常重要的克阴性动体细菌。这种表达GP生产的菌株的转基因版本是商用的。一种缺乏相关结构和调节基因的P.putida KT2440非动性菌株也可用。使用同时标记P. putida KT2440 的动量 GFP,我们在 PDMS 微流体器件中进行了连续实验,并随机排列了支柱阵列(图 1B),并记录了 BTC(图 2A)。BTC已正常化到注射细胞的浓度(C0)。同时,通过上述图像处理和粒子跟踪,对孔径尺度的细菌轨迹进行可视化(图2B)。
接下来,我们用从PMMA(图1A)铣削的大规模流体装置进行了实验。将Motile和非motile P. putida KT2440(非荧光)注入有规律的分空多孔基质中,使用上述液体分配器和流动细胞学计数获得BTC(图3A)。引人注目的是,在无生物膜的多孔环境中,运动和非动性P.putida KT2440表现出明显不同的运输行为。在具有复杂流生物膜群落的48h多孔基质中,运动和非运动P.putida KT2440之间的BTC差异消失了(图3B.)

图1:流体装置,用于研究多孔介质中的微生物 运输(A) 从PMMA中碾磨的流体装置图示。多孔基质被铣入设备的基层,盖子用螺丝关闭。横截面显示流体装置内柱的排列。该插入图显示了一个多孔矩阵,该矩阵具有柱的常规分界网格和相应的流流场。(B) PDMS 设备安装在显微镜玻璃幻灯片上。所示分别是与中储罐和注射器泵相连的流入和流出。用于显微计数的观察室作为单独的腔室放置,没有多孔基质放在同一显微镜幻灯片上。插入件显示一个多孔矩阵,该矩阵具有随机的柱阵(直径和间距)。 请单击此处查看此图的较大版本。
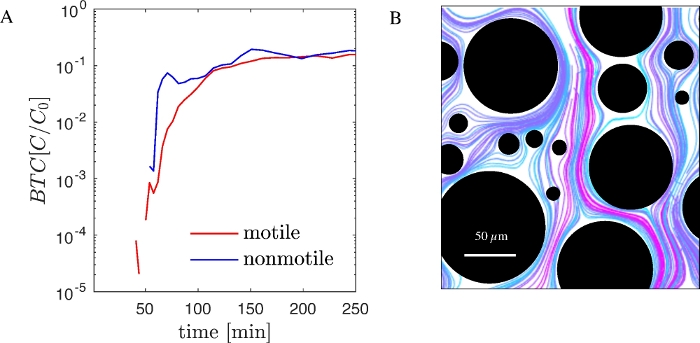
图2:用PDMS微 流体装置和微观计数获得的PDMS流体装置(A)中通道和孔径的细菌运输(A)BTC的动量和非动量 P.putida KT2440(GFP标记)。(B) 孔隙尺度上非动性细胞的轨迹。选择颜色可增强轨迹的分化。 请单击此处查看此图的较大版本。

图3:使用 PMMA流体 装置和流细胞计数获得的PMMA流体装置(A)中通道和孔隙尺度的细菌运输(A)的MOtile和非 motile P. putida KT2440(无标记)。(B) 流体装置由自然流群落殖民2天。 请单击此处查看此图的较大版本。
补充图1:PMMA流体器件的技术图纸。 该装置由包含多孔基质的基单元和带入口和出口孔的盖单元组成。该装置使用 12 个螺钉和 O 环进行密封。 请点击这里下载此图。
讨论
在这里,我们提出了两种研究微生物在单细胞和种群层面通过多孔系统的传输方法。虽然使用BTC建模对运输现象的研究为生态系统尺度上病原体或污染物的传播提供了宝贵的见解,但从实验室实验到田间条件的规模扩展方面仍然存在困难。此处描述的工具使研究人员能够实验性地解决空间和时间尺度,以便更好地了解与多孔环境中的运输相关的微生物的生态策略。实验者可以使用或修改这些系统来研究除运动性以外的其他微生物特征,如化疗或定额感应,或修改多孔基质的几何或其他生境特征。此外,使用这些系统,细菌的传输行为可以很容易地耦合到沉积剖面,这些沉积特征提供了对殖民化模式的重要见解,对于理解生物膜如何改变局部流动场至关重要。我们预计,更好地了解分散和殖民多孔介质的微生物策略将改进模型预测,从而有助于管理病原体传播或污染物控制。对系统的进一步修改也可能有助于开发新的过滤装置或生物技术工具,其中细胞需要物理分离。
我们建议使用基于 PMMA 的器件进行大型和长期实验,并建议使用基于 PDMS 的设备进行更小、更短期的实验,或在高时态分辨率至关重要时进行。必须记住,这两种材料具有不同的特性。例如,PDMS 对氧气一样渗透,而 PMMA 则是气体紧固。这种差异可用于研究PMMA场景中的气体消耗,而PDMS可能更适合与细菌呼吸有关的氧气限制不渴望的实验。
一般来说,此处描述的协议很容易重现,使用这些工具获得的数据一致地揭示了移动细菌和非移动细菌的运输差异。自制液体分配器可由市售的替代品取代。但是,出于多功能性和成本效益的原因,我们建议使用此处描述的。协议中的关键步骤主要涉及流体设备的处理和图像处理经验。通过图像分析获得的数据质量主要取决于图像质量(主要取决于对焦和曝光时间)和适当的阈值策略。通过流细胞计量计数获得的数据质量关键取决于细胞的有效固定和染色,以及解释流细胞测量结果的专业知识。
披露声明
提交人声明没有利益冲突。
致谢
我们感谢安托万·威德默在机器人分配器和dispenser.py的帮助。
材料
| Name | Company | Catalog Number | Comments |
| EDTA | Sigma | ||
| Elastomer Sylgard 184 | Dowsil | 101697 | |
| Flow cytometer NovoCyte | Acea | ||
| Glucose | Sigma | https://www.makeblock.com/project/xy-plotter-robot-kit | |
| LB broth | BD | ||
| Liquid dispenser, XY Plotter Robot Kit | makeblock | ||
| Microscope Axio Imager | Zeiss | ||
| Microscope AxioZoom v16 | Zeiss | ||
| Microscope slides, 75 mm × 25 mm | Corning | ||
| Minipuls 3 peristaltic pump | Gilson | ||
| Plasma bonder Corona SB | BlackHole Lab | ||
| Potassium phosphate | Sigma | ||
| Syringe pump New Era NE 4000 | New Era | ||
| Syto 13 Green Fluorescent Nucleic Acid Stain | Molecular Probes, Invitrogen | ||
| Tygon tubing | Ismatec | ||
| WF31SA universal milling machine | Mikron |
参考文献
- Stevik, K., Aa, K., Ausland, G., Fredrik Hanssen, J. Retention and removal of pathogenic bacteria in wastewater percolating through porous media: a review. Water Research. 38 (6), 1355-1367 (2004).
- Ribet, D., Cossart, P. How bacterial pathogens colonize their hosts and invade deeper tissues. Microbes and Infection. 17 (3), 173-183 (2015).
- Ginn, T. R., Wood, B. D., Nelson, K. E., Scheibe, T. D., Murphy, E. M., Clement, T. P. Processes in microbial transport in the natural subsurface. Advances in Water Resources. 25 (8), 1017-1042 (2002).
- Tufenkji, N. Modeling microbial transport in porous media: Traditional approaches and recent developments. Advances in Water Resources. 30 (6-7), 1455-1469 (2007).
- Foppen, J. W., Van, M. H., Schijven, J. Measuring and modelling straining of Escherichia coli in saturated porous media. Journal of contaminant hydrology. 93 (1-4), 236-254 (2007).
- Battin, T. J., Besemer, K., Bengtsson, M. M., Romani, A. M., Packmann, A. I. The ecology and biogeochemistry of stream biofilms. Nature Reviews Microbiology. 14 (4), 251-263 (2016).
- Scheidweiler, D., Peter, H., Pramateftaki, P., Anna, P., de Battin, T. J. Unraveling the biophysical underpinnings to the success of multispecies biofilms in porous environments. The ISME Journal. 1, (2019).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Bhattacharjee, T., Datta, S. S. Bacterial hopping and trapping in porous media. Nature Communications. 10 (1), 2075(2019).
- Scheidweiler, D., Miele, F., Peter, H., Battin, T. J., de Anna, P. Trait-specific dispersal of bacteria in heterogeneous porous environments: from pore to porous medium scale. Journal of The Royal Society Interface. 17 (164), 20200046(2020).
- Morales, V. L., Parlange, J. Y., Steenhuis, T. S. Are preferential flow paths perpetuated by microbial activity in the soil matrix? A review. Journal of Hydrology. 393 (1), 29-36 (2010).
- Creppy, A., Clément, E., Douarche, C., D'Angelo, M. V., Auradou, H. Effect of motility on the transport of bacteria populations through a porous medium. Physical Review Fluids. 4 (1), 013102(2019).
- Camesano, T. A., Logan, B. E. Influence of Fluid Velocity and Cell Concentration on the Transport of Motile and Nonmotile Bacteria in Porous Media. Environmental Science & Technology. 32 (11), 1699-1708 (1998).
- Lutterodt, G., Basnet, M., Foppen, J. W. A., Uhlenbrook, S. The effect of surface characteristics on the transport of multiple Escherichia coli isolates in large scale columns of quartz sand. Water Research. 43 (3), 595-604 (2009).
- Bozorg, A., Gates, I. D., Sen, A. Impact of biofilm on bacterial transport and deposition in porous media. Journal of Contaminant Hydrology. 183 (Supplement C), 109-120 (2015).
- Long, T., Ford, R. M. Enhanced Transverse Migration of Bacteria by Chemotaxis in a Porous T-Sensor. Environmental Science & Technology. 43 (5), 1546-1552 (2009).
- Rusconi, R., Garren, M., Stocker, R. Microfluidics Expanding the Frontiers of Microbial Ecology. Annual Review of Biophysics. 43 (1), 65-91 (2014).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Materials Science. 28 (1), 153-184 (1998).
- Crocker, J. C., Grier, D. G. Methods of Digital Video Microscopy for Colloidal Studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- del Giorgio, P. A., Bird, D. F., Prairie, Y. T., Planas, D. Flow cytometric determination of bacterial abundance in lake plankton with the green nucleic acid stain SYTO 13. Limnology and Oceanography. 41 (4), 783-789 (1996).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。