Method Article
Kombination von Fluidic Devices mit Mikroskopie und Durchflusszytometrie zur Untersuchung des mikrobiellen Transports in porösen Medien über räumliche Skalen hinweg
In diesem Artikel
Zusammenfassung
Durchbruchskurven (BTCs) sind effiziente Werkzeuge, um den Transport von Bakterien in porösen Medien zu untersuchen. Hier stellen wir Werkzeuge auf Basis von Fluidgeräten in Kombination mit Mikroskopie und Zytometrischer Durchflusszählung vor, um BTCs zu erhalten.
Zusammenfassung
Das Verständnis des Transports, der Dispersion und der Ablagerung von Mikroorganismen in porösen Medien ist eine komplexe wissenschaftliche Aufgabe, die so unterschiedliche Themen wie Hydrodynamik, Ökologie und Umwelttechnik umfasst. Die Modellierung des bakteriellen Transports in porösen Umgebungen in unterschiedlichen räumlichen Maßstäben ist entscheidend, um die Folgen des bakteriellen Transports besser vorherzusagen, doch aktuelle Modelle verfehlen es oft, von Labor zu Feldbedingungen zu skalieren. Hier stellen wir experimentelle Werkzeuge vor, um den bakteriellen Transport in porösen Medien in zwei räumlichen Maßstäben zu untersuchen. Ziel dieser Werkzeuge ist es, makroskopische Beobachtungen (wie Durchbruchkurven oder Abscheidungsprofile) von Bakterien zu erhalten, die in transparente poröse Matrizen injiziert werden. Im kleinen Maßstab (10-1000 m) werden mikrofluidische Geräte mit optischer Videomikroskopie und Bildverarbeitung kombiniert, um bahnbrechende Kurven zu erhalten und gleichzeitig einzelne Bakterienzellen im Porenmaßstab zu verfolgen. In größerem Maßstab wird die Durchflusszytometrie mit einem selbstgebauten Roboterspender kombiniert, um bahnbrechende Kurven zu erhalten. Wir veranschaulichen den Nutzen dieser Werkzeuge, um besser zu verstehen, wie Bakterien in komplexen porösen Medien wie der hyporhoischen Zone von Strömen transportiert werden. Da diese Werkzeuge simultane Messungen über Skalen hinweg ermöglichen, ebnen sie den Weg für mechanismusbasierte Modelle, die für die Hochskalierung von entscheidender Bedeutung sind. Die Anwendung dieser Werkzeuge kann nicht nur zur Entwicklung neuartiger Biosanierungsanwendungen beitragen, sondern auch ein neues Licht auf die ökologischen Strategien von Mikroorganismen werfen, die poröse Substrate besiedeln.
Einleitung
Studien, die darauf abzielen, den Transport von Mikroben durch poröse Medien zu verstehen, wurden hauptsächlich durch Bedenken der Kontamination1, der Übertragung von Krankheit2 und der Biosanierung3 getrieben. In dieser Hinsicht wurden Bakterien in den Transportmodellen4 meist als Partikel behandelt und Prozesse wie Filtration, Belastung, Gravitationsabsetzen oder Remobilisierung aus Biofilmen wurden als Treiber der Retention oder des Transports von Mikroben identifiziert5. Die Untersuchung des Transports von Bakterien durch poröse Landschaften kann uns jedoch auch über die ökologischen Strategien informieren, die ihren Erfolg in diesen komplexen Umgebungen untermauern. Dies erfordert jedoch neuartige Experimente und mathematische Modelle, die auf der Ebene der Einzelzellen, der Population oder der mikrobiellen Gemeinschaft funktionieren.
Natürliche poröse Umgebungen, wie sie in der hyporhoischen Zone von Bächen und Flüssen gefunden werden, werden von verschiedenen Gemeinschaften von biofilmbildenden Mikroben dicht besiedelt6. Biofilme bilden Strukturen, die den Fluss und damit den Transport und die Dispersion von Bakterien in der flüssigen Phase7,8verändern. Der Transport von Bakterien im Porenmaßstab hängt von der begrenzten Raumverfügbarkeit in der porösen Matrix ab und die mit Dermotilität zusammenhängende Dispersion kann ein effektiver Weg sein, um die individuelle Fitness durch einen geringeren Wettbewerb um Ressourcen in weniger dicht besiedelten Gebieten zu erhöhen. Auf der anderen Seite können motile Bakterien auch mehr isolierte Regionen der porösen Matrix erreichen und die erweiterte Erforschung solcher Gebiete kann ökologische Möglichkeiten für motile Populationen bieten10. Bei größeren räumlichen Maßstäben lenkt das Biofilmwachstum die Strömungswege um, was auch zu (teilweiser) Verstopfung der Poren und damit zur Etablierung noch kanalisierterer und heterogener Strömungsbedingungen11führt. Dies hat Folgen für die Nährstoffversorgung und Diedispersionskapazität, Frequenz und Entfernung. Bevorzugter Fluss kann beispielsweise sogenannte "Fast-Tracks" erzeugen und motile Bakterien können noch höhere Geschwindigkeiten erreichen als der lokale Fluss entlang dieser Bahnen12. Dies ist ein effektiver Weg, um die Erforschung neuer Lebensräume zu erhöhen.
Eine Vielzahl von Werkzeugen nutzen sich für die Untersuchung des Transports von motilen und nicht-motilen Bakterien (und Partikeln) in porösen Medien. Numerische Modelle haben große Vorhersagekapazitäten, die für Anwendungen wichtig sind, werden jedoch oft durch inhärente Annahmen eingeschränkt4. Laborexperimente13,14 kombiniert mit der Modellierung von Bahnbrechenden Kurven (BTC) haben wichtige Erkenntnisse über die Bedeutung bakterieller Zelloberflächeneigenschaften für die Hafteffizienz15geliefert. Typischerweise werden BTCs (d. h. Malreihen der Partikelkonzentration an einem festen Ort) durch konstante Freisetzungen und Messung der Zellzahlen am Abfluss des Versuchsgeräts erhalten. In diesem Zusammenhang spiegeln BTCs die Advektions-Dispersionsdynamik von Bakterien in der porösen Matrix wider und können durch einen Senketerm erweitert werden, der die Anhaftung berücksichtigt. Die Modellierung von BTCs allein löst jedoch nicht die Rolle der räumlichen Organisation des porösen Substrats oder Biofilms für Transportprozesse auf. Andere makroskopische Beobachtungswerte wie Dispergivität oder Ablagerungsprofile liefern nachweislich wichtige Informationen über die räumliche Verteilung oder die zurückgehaltenen Teilchen oder wachsenden Gemeinschaften. Mikrofluidik ist eine Technologie, die das Studium des Transports in porösen Medien durch Mikroskopie Untersuchung9,12,16ermöglicht, und außer einer kürzlichen Arbeit10, experimentelle Systeme sind in der Regel auf eine einzelne Längenskala der Auflösung beschränkt, das heißt, die Porenskala oder die gesamte Fluidgeräteskala.
Hier stellen wir eine Reihe kombinierter Methoden vor, um den Transport von motilen und nicht-motilen Bakterien in porösen Landschaften in verschiedenen Maßstäben zu untersuchen. Wir kombinieren Beobachtungen des bakteriellen Transports auf der Porenskala mit Informationen in größerem Maßstab, mittels BTC-Analysen. Mikrofluidische Geräte aus weicher Lithographie mit Polydimethylsiloxan (PDMS) sind biokompatibel, resistent gegen eine Reihe von Chemikalien, ermöglichen Einereproduzierlichkeit zu niedrigen Kosten und bieten eine hervorragende optische Transparenz sowie eine geringe Autofluoreszenz, die für die mikroskopische Beobachtung entscheidend ist. Mikrofluidik auf Basis von PDMS wurde bisher verwendet, um den Transport von Mikroben in einfachen Kanälen17 oder in komplexeren Geometrien12zu untersuchen. Typischerweise konzentrieren sich Mikrofluidik-Experimente jedoch auf kurzfristige Horizonte, und die mikroskopische Beobachtung lebender Zellen durch Epifluoreszenz ist häufig auf genetisch veränderte Stämme (z. B. GFP-markierte Stämme) beschränkt. Hier stellen wir Werkzeuge zur Untersuchung des bakteriellen Transports mit MIKROfluidischen PDMS-basierten Geräten in Kombination mit Mikroskopie und größeren Geräten aus Poly (Methylmethacrylat) (PMMA, auch Plexiglas genannt) in Kombination mit Durchflusszytometrie vor. PDMS und PMMA unterscheiden sich in der Gasdurchlässigkeit und Oberflächeneigenschaften und bieten so ergänzende Möglichkeiten, den bakteriellen Transport zu untersuchen. Während das mikrofluidische Gerät eine kontrolliertere Umgebung bietet, ermöglicht das größere Gerät Experimente über einen längeren Zeitraum oder die Verwendung natürlicher Bakteriengemeinschaften. Die Mikroskopiezählung mit hoher zeitlicher Auflösung in einem speziellen Bereich wird verwendet, um BTC im PDMS-basierten mikrofluidischen Gerät zu erhalten. Um die Anzahl der Zellen für die BTC-Modellierung vom PMMA-basierten Gerät zu erhalten, führen wir einen selbstkonstruierten automatisierten Flüssigkeitsspender in Kombination mit Durchflusszytometrie ein. Bei diesem Setup passieren die Zellen das Fluidgerät und werden nacheinander in 96 Brunnenplatten abgegeben. Die zeitliche Auflösung wird durch das minimale Volumen, das genau abgegeben werden kann, und damit die mittlere Durchflussrate durch das Fluidgerät eingeschränkt. Fixativ in den Brunnen verhindert Wachstum und erleichtert DIE DNA-Färbung für die nachgeschaltete strömungszytometrische Enumeration. Um das Bakterienwachstum bei Transportexperimenten zu verhindern, verwenden wir einen minimalen mittelmäßigen Motilitätspuffer.
Da Protokolle zur Herstellung von Fluidgeräten in verschiedenen Maßstäben leicht verfügbar sind, führen wir nur kurz die Techniken zur Herstellung solcher Geräte ein und konzentrieren uns vielmehr auf die experimentellen Verfahren zur Aufzeichnung von BTCs. In ähnlicher Weise gibt es verschiedene Routinen für die zytometrische Aufzählung von Mikroben durch die Durchfluss- und Benutzer benötigen Expertenwissen, um die ergebnisse zu interpretieren, die durch die Durchflusszytometrie erzielt werden. Wir berichten über den neuartigen Einsatz von mikrofluidischen Geräten in Kombination mit mikroskopischer Bildgebung, um BTCs von fluoreszierend markierten Zellen aufzuzeichnen. Auf der Porenskala werden lokale Geschwindigkeiten und Flugbahnen mittels Bildverarbeitung ermittelt. Darüber hinaus zeigen wir den Einsatz eines PMMA-basierten Fluidgeräts in Kombination mit strömungszytometrischer Zählung, um den bakteriellen Transport von motilen und nicht-motilen Zellen in porösen Umgebungen zu beobachten, die durch einen nativen Strombiofilm besiedelt sind.
Protokoll
1. Bakterielle Kulturbedingungen
- Verwenden Sie unter einer laminaren Durchflusshaube 100 l eines Glyzerinbestands von Pseudomonas putida KT2440 (1 × 107 ml-1, bei -80 °C gelagert), um 5 ml Luria-Bertani (LB) Medium zu impfen. Bei 30 °C inkubieren und über Nacht bei 250 Umdrehungen schütteln.
- Am nächsten Tag 100 l der Übernachtungskultur in 5 ml LB-Medium wieder aufheben und unter den gleichen Bedingungen für 5h (exponentielle Phase) inkubieren. Ein 1 ml Aliquot in ein 2 ml Rohr eintauchen, auf Raumtemperatur abkühlen lassen (ca. 15 min) und Zentrifuge (2300 x g für 5 min).
- Entfernen Sie den Überstand und fügen Sie dem Pellet 1 ml Motilitätspuffer hinzu. Wirbel kurz, um die Probe zu homogenisieren. Verdünnen, um die gewünschte Zellkonzentration zu erreichen, z.B. 5 x 105 ml-1.
- Für Experimente mit natürlichen Gemeinschaften, wie sie aus Bächen gewonnen werden, wird ein nicht selektives Anbaumedium vorbereitet. Verwenden Sie beispielsweise sterilgefiltertes und autoklaviertes Bachwasser oder ein künstliches Strömungswassermedium, das mit einer komplexen Kohlenstoffquelle (LB-Medium) geändert wurde.
2. Herstellung einer mikrofluidischen Vorrichtung in Polydimethylsiloxan (PDMS)
- Entwerfen Sie die gewünschte poröse Geometrie mittels computergestützter Entwurfssoftware(CAD) 18, die aus einer Matrix von Kreisen besteht (d. h. dem undurchlässigen Strömungshindernis), beschrieben durch Radiusgröße und Mittelkoordinaten.
HINWEIS: Ein Beispiel für eine poröse Geometrie mit randomisierten Korn- und Porengrößen ist in Abbildung 1Adargestellt. Ein Beobachtungskanal ohne Hindernisse in der Nähe des Auslasses erleichtert den Erwerb von BTCs. - Basierend auf der gewählten Geometrie, bereiten Sie eine Form mit Standard SU-8-Photolithographie18.
HINWEIS: Alternativ können Formen auch in einer speziellen Mikrofabrikation bestellt werden. Um einen heterogenen Flüssigkeitsfluss in der horizontalen Ebene zu erhalten, ist es wichtig, die Dicke der mikrofluidischen Kammer in der gleichen Größenordnung wie die durchschnittliche Porenkehlgröße zu entwerfen. Stellen Sie jedoch sicher, dass die Abmessungen des mikrofluidischen Geräts für die Beobachtung unter dem Mikroskop geeignet sind (z. B. Arbeiten an Mikroskopschlitten). - Bereiten Sie 50 g PDMS vor, indem Sie 10 % des Querverdrahters (Dimethyl, Methylhydrogensiloxan-Copolymer) zu 90 GHT elastomer gewichten, indem Sie eine Spritze ohne Nadel verwenden. Arbeiten Sie unter sauberen Bedingungen und vermeiden Sie Staub so weit wie möglich. Mischen Sie die beiden Reagenzien in einem sauberen Einwegbehälter und tragen Sie Vakuum (100 mbar) für 30 min auf, um gelöste Luft und Blasen aus dem viskosen PDMS zu entfernen.
- Legen Sie die Form in eine Petrischale (100 mm Durchmesser, 15 mm hoch). Gießen Sie das PDMS auf die gewünschte Höhe (z. B. 2-5 mm). Die Petrischale abdecken und bei 60 °C für 4 h (über Nacht für dickere Schichten) zum Aushärten aufbewahren.
HINWEIS: Zur Visualisierung sollte Licht in der Lage sein, das PDMS zu passieren, daher ist eine dünne Schicht zwischen 2 mm und 5 mm wünschenswert. Dickere Schichten (>5 mm) reduzieren die Gerätetransparenz und dünnere werden während der Anwendung Verformungen ausgesetzt. - Entfernen Sie die Form aus dem Ofen und lassen Sie das mikrofluidische Gerät auf Raumtemperatur abkühlen. Sobald es abgekühlt ist, entfernen Sie vorsichtig den gewünschten Teil von PDMS mit einem Skalpell.
HINWEIS: Starker Druck auf die Form führt zu Schimmelbrüchen. Berühren Sie das PDMS nicht mit bloßen Händen, da Fingerabdrücke die optische Transparenz beeinträchtigen. - Versiegeln Sie vorübergehend den Boden des PDMS-Kanals (wo die gewünschte Geometrie eingraviert wurde) mit Klebeband. Mit einem Biopsie-Stanzer mit einem Durchmesser von 0,5 mm durchbohren Sie den mikrofluidischen Kanal, um einen Einlass und einen Auslass zu erzeugen, der die 0,5 mm (Innendurchmesser) Rohre anpasst.
HINWEIS: Die weiche Natur von PDMS sorgt für Dichtheit, sobald der Schlauch eingesetzt wird. Ein- und Auslasskanäle können nicht mehr hergestellt werden, nachdem das PDMS an das Glas versiegelt wurde. - Versiegeln Sie den mikrofluidischen Kanal über Sauerstoffplasmabindung mit dem Hochfrequenzgenerator (Plasmabonder, Materialtabelle). Dazu einen Silikatglasschlitten (25 mm x 75 mm) mit Ethanol reinigen und trocknen lassen. Entfernen Sie das Band aus dem PDMS-Kanal und platzieren Sie den Kanal mit der porösen Seite nach oben. Behandeln Sie die Silikatglasrutsche und PDMS-Oberflächen mit Plasma für ca. 45 s bei Raumtemperatur.
- Den PDMS-Kanal auf den Silikatglasschlitten legen und 30 min auf einer Kochplatte bei 100 °C erhitzen.
- Entfernen Sie das mikrofluidische Gerät von der Kochplatte und kühlen Sie es auf Raumtemperatur. Schließen Sie den PDMS-Kanaleinlass mit Schläuchen an. Vakuum für 30 min auftragen, um Luft aus PDMS zu entfernen, die fast undurchlässig für Flüssigkeiten, aber gasdurchlässig ist.
- 100 ml Motilitätspuffer (10 mM Kaliumphosphat, 0,1 mM EDTA, ergänzt mit 1% w/v Glukose, pH 7,0) vorbereiten und 1 ml davon mit einer Spritzenpumpe, die bei 10 l min-1betrieben wird, in das mikrofluidische Gerät injizieren.
HINWEIS: Da das PDMS mit Gas untergesättigt ist (aufgrund des vorherigen Vakuumschritts), verschwinden Blasen innerhalb von 30 min.
3. Herstellung einer Fluidvorrichtung in Poly (Methylmethacrylat)
- Entwerfen Sie die gewünschte Geometrie mit der CAD-Software. Stellen Sie ggf. sicher, dass die Abmessungen für die Beobachtung unter dem Mikroskop geeignet sind (z. B. Abmessungen einer Standard 96-Wellplatte in Kombination mit einem geeigneten Halter). Die Fluidvorrichtung besteht aus einer Basis (127 × 127 × 12 mm) und einem Deckel (127 × 127 × 12 mm) PMMA.
HINWEIS: Expertise mit CAD-Software wird empfohlen. Eine technische Beispielzeichnung ist in Abbildung 1Aenthalten. - Um das Porenfach mittels hochpräziser Mikrofräsen (WF31SA, Mikron) herzustellen, 0,5 mm von der unteren PMMA-Schicht zu entfernen und eine Nut (1,1 × 1,1 mm) für einen Gummi-O-Ring zu fräsen. Bohren Sie 12 Gewindebohrungen (M5). Dies dient als Basis des Fluidgeräts.
HINWEIS: Die Abmessungen des Fluidgeräts müssen an die Mikroskopstufe und den Brennweitenabstand angepasst werden. Eine technische Zeichnung ist in Abbildung S1enthalten. - Bohren Sie zwei Gewindebohrungen (Typ 1/4-28UNF) für Ein- und Auslass in den oberen Teil der Fluidvorrichtung und 12 Löcher (5,5 mm) für die Schrauben. Dies dient als Deckel des Fluidgeräts.
HINWEIS: Expertise im Bereich Mikrofräsen ist ratsam; Die Autoren nutzen die Unterstützung eines spezialisierten Workshops. - Um das Fluidgerät vor und nach jedem Gebrauch zu reinigen und zu sterilisieren, tränken Sie die Basis und den Deckel des Fluidgeräts in HCl 7% und spülen Sie dreimal mit entionisiertem Wasser ab.
- Schraube Boden und Deckel mit den 12 Gewindelöchern zusammen.
4. Einrichtung eines automatisierten Spenders
HINWEIS: Kommerziell erhältliche Flüssigkeitsspender sind teuer und bieten oft nicht die Flexibilität, direkt aus dem Abfluss des Fluidgeräts zu verzichten. Daher wird die Montage eines kostengünstigen und flexiblen Roboterspendersystems aus einem XY Plotter Roboter (Materialtabelle) empfohlen.
- Um den Abfluss aus der Fluidvorrichtung in 96 Bohrplatten zu verteilen, montieren Sie den Roboterspender auf eine PMMA-Platte und Fräshohlräume von 85,8 x 128 mm mit einer Tiefe von 1 mm, um mehrere 96 Bohrplatten zu halten.
- Befestigen Sie das Abflussrohr des Fluidgeräts am Roboterarm des Spenders.
- Um den Roboterspender zu betreiben, laden Sie bCNC von github herunter: https://github.com/vlachoudis/bCNC und befolgen Sie die Anweisungen, um das Programm zu installieren.
- Laden Sie dispenser.py aus dem Begleitmaterial dieses Artikels herunter.
HINWEIS: Dieser Python-Code bietet ein Plugin für bCNC für ein einfaches Roboter-Dispenser-Layout. - Schließen Sie den Roboterspender an den Computer mit bCNC an, und identifizieren Sie den richtigen COM-Port.
- Klicken Sie in bCNC auf die Home-Taste, um den Roboterspender in die Home-Position zurückzubekommen.
HINWEIS: Homing gibt den Roboterspender in eine bekannte Position zurück (x=0, y=0) und verbessert somit die Genauigkeit des Spenders. - Bereiten Sie vor dem Versuch eine ausreichende Anzahl von 96 Brunnenplatten vor, wobei Die Brunnen eine angemessene Menge an fixativem Gehalt enthalten (z. B. Endkonzentration 3,7 % Formaldehyd).
HINWEIS: Zum Beispiel werden bei einer Durchflussrate von 0,2 ml min-1alle 30 s 100 l in jeden Brunnen abgegeben. Fügen Sie daher jedem Brunnen 10 l 37 % Formaldehyd hinzu, um eine Endkonzentration von Formaldehyd zwischen 2 und 4 % zu erreichen. Mit acht 96 Wellplatten kann das Experiment über 6 h mit insgesamt 768 Datenpunkten betrieben werden. Beachten Sie außerdem, dass GFP-markierte Zellen ihr fluoreszierendes Signal nach der Fixierung mit Formaldehyd verlieren können.
5. Analysieren Sie den bakteriellen Transport mit mikrofluidischen PDMS-Geräten
- Stellen Sie das zuvor mit dem Motilitätspuffer gesättigte PDMS-Mikrofluidgerät auf die Mikroskopstufe. Verwenden Sie Klebeband, um die Schläuche zu fixieren, um Die Störung des Durchflusses während der Bühnenbewegung zu minimieren.
- Bewegen Sie die Mikroskopstufe in den Beobachtungskanal in der Nähe des Auslasses. Mit Der Hellenfeldmikroskopie oder dem Phasenkontrast konzentrieren Sie sich auf die Mitte des Beobachtungskanals und passen Sie die Vergrößerung an, um einzelne Bakterienzellen zu visualisieren.
- Schalten Sie die Lichtpfadeinstellungen auf die Fluoreszenzmikroskopie um und passen Sie die Belichtungszeit der Kamera an, um einzelne Bakterienzellen (z. B. 100 ms) aufzulösen, oder so, dass Fluoreszenzsignale von Zellen mindestens 3x stärker sind als Hintergrundgeräusche.
- Als nächstes legen Sie den Einlassschlauch in ein 2 ml-Rohr ein, das die bakterielle Suspension enthält. Umkehren Sie die Pumpenrichtung und beginnen Sie mit dem Zurückziehen der Suspension bei einer Durchflussrate von 1 l min-1.
- Scannen Sie den Querschnitt des gesamten Beobachtungskanals, der alle 2 Minuten über die gesamte Dauer des Experiments ein zusammengesetztes Bild aufzeichnet.
6. Grundlegende Bildverarbeitung
HINWEIS: Das Ziel dieser grundlegenden Bildverarbeitungsroutinen ist es, die Anzahl der Bakterien in den aufgezeichneten Bildern zu zählen. Optimale Verarbeitungsverfahren hängen von den technischen Spezifikationen des Mikroskops und der Kamera sowie von den Fluoreszenzeigenschaften des im Experiment verwendeten Bakterienstamms ab und müssen daher angepasst werden.
- Exportieren Sie zuerst Bilder im .tiff Format.
- Importieren Sie Bilder auf eine gewünschte Softwareplattform (z. B. MATLAB, ImageJ, R oder Python).
- Entfernen Sie Kamerarauschen, das eine zufällige Variation der Pixelintensität in Bildern darstellt und für optische Aberrationen korrigiert wird. Dies kann durch Anwenden eines Gaußschen Filters auf jedes Bild erfolgen: Die Größe des Filters hängt von der Qualität des Kamerasensors ab (z. B. CCD oder CMOS). Die optische Aberration kann entfernt werden, indem jedes Bild durch ein Referenzbild normalisiert wird, das in Abwesenheit der Probe mit der gleichen optischen Konfiguration gesammelt wurde.
- Schneiden Sie die Bilder in eine Region von Interesse.
- Identifizieren Sie einen Schwellenwert (Pixelintensität), sodass Werte oberhalb des Schwellenwerts Bakterielle Zellen enthalten.
HINWEIS: Wenn Bilder ungleichmäßig beleuchtet sind (aufgrund optischer Aberration oder Rauschen), kann es sinnvoll sein, einen adaptiven Schwellenwert anzuwenden, der einen Schwellenwert basierend auf lokalen mittleren Intensitäten wählt. - Subtrahieren Sie von jedem Bild den oben definierten Schwellenwert.
- Binarisieren Sie das resultierende Bild, so dass Bakterienzellen einen Wert von 1 annehmen, während Hintergrund einen Wert von 0 hat.
- Entfernen Sie Cluster mit einer Fläche, die kleiner als die kleinste bakterielle Zellengröße ist.
- Summieren Sie das binarisierte Bild, um die Gesamtzahl der Pixel der verbleibenden Cluster abzuerhalten. Dividieren Sie die Anzahl der Pixel durch die durchschnittliche Größe (in Pixel) einer Bakterienzelle: Dies liefert eine Schätzung der Gesamtzahl der Zellen.
- Wissend Tiefe der Sicht und Untersuchungsbereich, transformieren Zählt in Konzentration (Teilchen mL-1).
- Es ist von grundlegender Bedeutung, die Konzentration der injizierten BakterienSuspension zu identifizieren. Dazu mit einer Spritze 1 ml Bakterienkultursuspension in den Beobachtungskanal eines sauberen mikrofluidischen Geräts injizieren. Zeichnen Sie das Bild auf und berechnen Sie die zusätzlich beschriebene in fluent bakterielle Konzentration (C0) (6.1 bis 6.10).
- Analysieren Sie BTCs durch Normalisierung der bakteriellen Konzentration (C) mit einer wohlhabenden Bakterienkonzentration (C0) und der Darstellung C/C0 im Vergleich zur Zeit.
7. Analysieren Sie den bakteriellen Transport auf der Porenskala
- Um lokale Geschwindigkeiten und Flugbahnen von Bakterien zu analysieren, die durch die poröse Matrix transportiert werden, bewegen Sie die Mikroskopstufe in den Bereich des Interesses und passen Sie den Fokus auf das Zentrum des mikrofluidischen Geräts an.
- Stellen Sie das Mikroskop auf einen hellen Feld- oder Phasenkontrast ein.
HINWEIS: Dies nur, wenn das Fluoreszenzsignal der Bakterienzelle die Aufnahme von Bildern bei expositionskürzerer Zeit als die durchschnittliche bakterielle Zeit nicht zulässt, verwenden Sie ansonsten fluoreszenzmikroskopische Mikroskopie. - Zeichnen Sie Zeitrafferbilder auf, die bei der Belichtungszeit die Verschiebung von Bakterien erfassen (kürzer als die durchschnittliche Verschiebung über eine Anzahl von Pixeln kleiner als die Objektgröße), und die die Erkennung bakterieller Zellen optimiert (z. B. Belichtung von 20 ms und Alle 50 ms aufgezeichnete Bilder). Zeichnen Sie Bilder über einen ausreichenden Zeitraum auf, um genügend (statistisch repräsentativ) der langsamsten Flugbahnen (z.B. 3 min) aufzuzeichnen.
HINWEIS: Stellen Sie sicher, dass der Computer über genügend Speicherplatz verfügt. - Um Hintergrundgeräusche zu entfernen, subtrahieren Sie von jedem Bild den Durchschnitt aller aufgezeichneten Bilder. Erstellen Sie dazu eine Matrix, deren Ergebnis die Summe der Intensität aller Bilder für jedes Pixel ist, und dividieren Sie sie durch die Anzahl der Bilder.
- Bestimmen Sie aus dem verarbeiteten Bild (Im) den Modul des numerischen Farbverlaufs
 und normalisieren Sie ihn durch seinen Maximalwert (max), wie unten definiert.
und normalisieren Sie ihn durch seinen Maximalwert (max), wie unten definiert.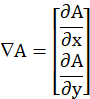

- Binarisieren Sie die Matrix B über Intensitätsschwellen, siehe Schritte 6.7-6.8.
- Zeichnen Sie für jeden Zeitpunkt Bakterienkoordinaten (x, y in Pixel oder mm) und die Zeit der Bildaufnahme in einer dreispaltigen Datei auf.
- Wenden Sie schließlich ein Partikelverfolgungsskript an, um die aufgezeichneten Daten zu verarbeiten und die Flugbahnen der Bakterien zu berechnen. Verwenden Sie beispielsweise das etablierte Protokoll19und den frei verfügbaren Matlab Particle Tracking Code: (http://site.physics.georgetown.edu/matlab/).
8. Bakterielle Filtration mittels Abscheidungsprofilen untersuchen
- Um Abscheidungsprofile von GFP-markierten P. putida KT2440-Zellen durch Fluoreszenzmikroskopie zu erhalten, zeichnen Sie ein zusammengesetztes Bild des gesamten porösen Kanals vor, d. h. dem Hintergrund, und nach der Injektion der bakteriellen Suspension durch das mikrofluidische Gerät auf. Verwenden Sie eine Belichtungszeit, die die Erfassung bakteriellen Fluoreszenzsignals (z. B. 100 ms) ermöglicht, ohne das Signal zu bleichen.
- Exportieren Sie Bilder und importieren Sie in die gewünschte Softwareplattform (siehe 6.1-6.2).
- Entfernen Sie den Hintergrund aus den Bildern, die nach der bakteriellen Injektion aufgenommen wurden.
- Integrieren Sie das gesamte Fluoreszenzsignal von zurückgehaltenen Bakterien entlang transversaler Abschnitte des porösen Kanals.
- Um das Ablagerungsprofil zu berechnen, zeichnen Sie das integrierte Blütensignal im Vergleich zur porösen Kanallänge.
9. Analysieren Sie den bakteriellen Transport mit PMMA-Fluidgeräten und Durchflusszytometrie
- Verbinden Sie peristaltische Pumpe mit dem Einlass mit 50 cm (1 mm Innendurchmesser) Schläuche, und der Abfluss mit dem automatisierten Spender mit dem gleichen Schlauch (50 cm, siehe Abschnitt 4).
HINWEIS: Verwenden Sie die Pumpe, um Kultivierungsmedien zu verteilen und Bakterienzellen zu injizieren. Verwenden Sie Luer-Lock-Steckverbinder und Dreiwegeventile, um während der Freisetzung mit konstanter Geschwindigkeit zwischen mittlerer und bakterieller Suspension zu wechseln. - Pumpenanbaumedium im Fluidgerät. Beachten Sie die Ankunft des Mediums an den auslaufgebundenen Schläuchen, die am Roboterspender befestigt sind.
- Beginnen Sie mit der Injektion der bakteriellen Suspension durch das PMMA-Fluidgerät bei einer Durchflussrate von 0,2 ml min-1,
- Wenn Bakterien den Fluidgeräte-Einlass erreichen, schalten Sie den automatisierten Spender ein.
- Um eine Pulsinjektion zu machen, injizieren Sie bakterielle Suspension für einige Porenvolumina (z.B. 30), und schalten Sie dann die Injektion auf Kultivierungsmedien bis zum Ende des Experiments um.
HINWEIS: Das Porenvolumen der Fluidvorrichtung beträgt ca. 0,2 ml, so dass bei der prosed durchgeströmten Durchflussrate jede Minute ein ganzes Porenvolumen ausgetauscht wird. - Sobald eine 96-Wellplatte fertig ist, bedecken Sie die Platte, um die Verdunstung zu reduzieren, und lagern Sie sie bei 4 °C.
- Analysieren Sie die bakterielle Fülle über die Durchflusszytometrie nach den etablierten Protokollen20.
ANMERKUNG: Fügen Sie z. B. jedem Brunnen 25 L des grünfluoreszierenden Nukleinsäureflecks (Materialtabelle) bei 0,025 mM (in Reinstwasser) hinzu. Es färbt bakterielle DNA, so dass durch Strömung zytometrie die bakterielle Fülle zu quantifizieren. Inkubieren Sie Proben für 15 min im Dunkeln und analysieren Sie dann mit einem Durchflusszytometer, der mit einem 488 nm Laser und Detektoren bei 515 nm ausgestattet ist. - Berücksichtigen Sie vor der BTC-Analyse die Verdünnung der Probe aufgrund der Zugabe von Fixativ und Fleck. Korrigieren Sie die bakterielle Fülle um den Faktor 1,35, um fixative und Flecken zu berücksichtigen.
Ergebnisse
Um die Funktionalität des vorgestellten Workflows zu veranschaulichen, führten wir Experimente mit dem gentechnisch veränderten Pseudomonas putida KT2440 durch, einem gramnegativen motile Bakterium, das für die Biosanierung und Biotechnologie wichtig ist. Gentechnisch veränderte Versionen dieses Stammes, die die GFP-Produktion ausdrücken, sind im Handel erhältlich. Ein nicht-motiler Stamm von P. putida KT2440, dem die relevanten strukturellen und regulatorischen Gene für die Beweglichkeit fehlen, ist ebenfalls verfügbar. Mit motilem und nicht-motilem GFP mit P. putida KT2440 führten wir sequenzielle Experimente an mikrofluidischen PDMS-Geräten mit einem zufälligen Array von Säulen (Abbildung 1B) und aufgezeichneten BTCs (Abbildung 2A) durch. BTCs wurden auf die Konzentration der injizierten Zellen normalisiert (C0). Gleichzeitig wurden bakterielle Flugbahnen im Porenmaßstab mittels Bildverarbeitung und Partikelverfolgung visualisiert, wie oben beschrieben (Abbildung 2B).
Als nächstes führten wir Experimente mit großen Fluidgeräten durch, die von PMMA gefräst wurden (Abbildung 1A). Motile und nicht-motile P. putida KT2440 (nicht fluoreszierend) wurden in eine regelmäßig verteilte poröse Matrix injiziert und BTCs wurden mit dem Flüssigkeitsspender und der Strömungszytometriezählung wie oben beschrieben erhalten(Abbildung 3A). Auffallend ist, dass in einer porösen Umgebung ohne Biofilm, motile und nicht-motile P. putida KT2440 ein deutlich anderes Transportverhalten zeigte. In einer porösen Matrix, die 48h lang mit einer komplexen Flussbiofilmgemeinschaft kolonisiert wurde, verschwanden diese Unterschiede in BTC zwischen motiler und nicht-motiler P. putida KT2440(Abbildung 3B.)

Abbildung 1: Fluidische Vorrichtungen zur Untersuchung des mikrobiellen Transports in porösen Medien (A) Abbildung eines fluidischen Geräts, das von PMMA gefräst wurde. Die poröse Matrix wird in die Basisschicht des Gerätes gefräst, der Deckel wird mit Schrauben geschlossen. Ein Querschnitt zeigt die Anordnung der Säulen innerhalb des Fluidgeräts. Der Einsatz zeigt eine poröse Matrix mit einem regelmäßigen Abstandsraster aus Säulen und dem jeweiligen Geschwindigkeitsflussfeld. (B) Das PDMS-Gerät ist auf einem Mikroskop-Glasschlitten montiert. Gezeigt werden der Ein- und Abfluss, der mit dem Mittleren Behälter bzw. der Spritzenpumpe verbunden ist. Die Beobachtungskammer für die mikroskopische Zählung wird als separate Kammer ohne poröse Matrix auf denselben Mikroskopschlitten gelegt. Der Einsatz zeigt eine poröse Matrix mit einem zufälligen Array von Säulen (Durchmesser und Abstand). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
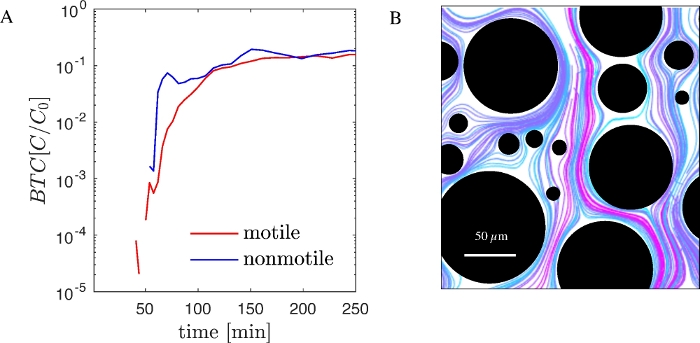
Abbildung 2:Bakterieller Transport im Kanal- und Porenmaßstab im PDMS-Fluidgerät (A) BTCs von motilem und nicht-motilem P. putida KT2440 (GFP-getaggt), die mit einem PDMS-Mikrofluidgerät und mikroskopischer Zählung erhalten wurden. (B) Flugbahnen nicht-motiler Zellen im Porenmaßstab. Farben werden gewählt, um die Differenzierung der Flugbahnen zu verbessern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3::Bakterieller Transport im Kanal- und Porenmaßstab im PMMA-Fluidgerät (A) BTCs von motilem und nicht-motilem P. putida KT2440 (nicht getaggt), die mit hilfe einer PMMA-Fluidvorrichtung und Durchflusszytometriezählung erhalten wurden. (B) Das Fluidgerät wurde von einer natürlichen Strömungsgemeinschaft für 2 Tage besiedelt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Technische Zeichnungen des FLUIDgeräts PMMA. Das Gerät besteht aus einer Basiseinheit, die die poröse Matrix enthält, und einer Deckeleinheit mit den Löchern für den Ein- und Auslass. Das Gerät wird mit 12 Schrauben und einem O-Ring versiegelt. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Diskussion
Hier schlagen wir zwei Mittel vor, um den Transport von Mikroben durch poröse Systeme auf Einzelzell- und Populationsebene zu untersuchen. Während die Untersuchung von Transportphänomenen mit Hilfe von BTC-Modellierung wertvolle Erkenntnisse über die Ausbreitung von Krankheitserregern oder Kontaminanten auf den Ökosystemskalen lieferte, gibt es nach wie vor Schwierigkeiten, von Laborexperimenten bis hin zu Feldbedingungen zu skalieren. Die hier beschriebenen Werkzeuge ermöglichen es den Forschern, die räumlichen und zeitlichen Skalen experimentell aufzulösen, um die ökologischen Strategien von Mikroben, die für den Transport in porösen Umgebungen relevant sind, besser zu verstehen. Experimentatoren können diese Systeme verwenden oder modifizieren, um andere mikrobielle Merkmale als die Beweglichkeit zu untersuchen, wie z. B. Chemotaxis oder Quorum-Erfassungen, oder die Geometrie oder andere Lebensraummerkmale der porösen Matrix zu verändern. Darüber hinaus kann das bakterielle Transportverhalten mit diesen Systemen leicht an Ablagerungsprofile gekoppelt werden, die wichtige Einblicke in Besiedlungsmuster liefern und entscheidend sind, um zu verstehen, wie Biofilme lokale Strömungsfelder verändern. Wir gehen davon aus, dass ein besseres Verständnis von mikrobiellen Strategien zur Dispergierung und Kolonisierung poröser Medien die Modellvorhersagen verbessern und somit zur Verwaltung der Ausbreitung von Krankheitserregern oder der Versanteneinschließung beitragen wird. Weitere Änderungen des Systems können auch zur Entwicklung neuartiger Filtrationsgeräte oder biotechnologischer Werkzeuge beitragen, bei denen Zellen physisch getrennt werden müssen.
Wir empfehlen PMMA-basierte Geräte für große und langfristige Experimente und PDMS-basierte Geräte für kleinere, kurzfristige Experimente oder wenn eine hohe zeitliche Auflösung kritisch ist. Es ist zu beachten, dass die beiden Materialien unterschiedliche Eigenschaften haben. Zum Beispiel ist PDMS durchlässig für Gas wie Sauerstoff, während PMMA gasdicht ist. Dieser Unterschied könnte verwendet werden, um den Gasverbrauch im PMMA-Szenario zu untersuchen, während PDMS für Experimente besser geeignet sein könnte, bei denen Sauerstoffbeschränkungen im Zusammenhang mit der bakteriellen Atmung unerwünscht sind.
Im Allgemeinen sind die hier beschriebenen Protokolle leicht reproduzierbar und die mit diesen Werkzeugen gewonnenen Daten zeigen konsistent Unterschiede beim Transport von motilen und nicht-motilen Bakterien. Der selbstgebaute Flüssigkeitsspender kann durch eine handelsübliche Alternative ersetzt werden. Aus Gründen der Vielseitigkeit und Wirtschaftlichkeit empfehlen wir jedoch die hier beschriebene. Kritische Schritte im Protokoll betreffen vor allem den Umgang mit den Fluidgeräten und Erfahrungen mit der Bildverarbeitung. Die Qualität der durch Bildanalyse gewonnenen Daten hängt entscheidend von der Bildqualität (hauptsächlich bestimmt durch Fokus und Belichtungszeit) und einer geeigneten Schwellenstrategie ab. Die durch die Strömungszytometrische Zählung gewonnene Datenqualität hängt entscheidend von der effektiven Fixierung und Färbung der Zellen und der Expertise bei der Interpretation der Ergebnisse der Strömungszytometrie ab.
Offenlegungen
Die Autoren erklären, dass es keinen Interessenkonflikt gibt.
Danksagungen
Wir würdigen die Hilfe von Antoine Wiedmer beim Aufbau des Roboterspenders und der dispenser.py Skript.
Materialien
| Name | Company | Catalog Number | Comments |
| EDTA | Sigma | ||
| Elastomer Sylgard 184 | Dowsil | 101697 | |
| Flow cytometer NovoCyte | Acea | ||
| Glucose | Sigma | https://www.makeblock.com/project/xy-plotter-robot-kit | |
| LB broth | BD | ||
| Liquid dispenser, XY Plotter Robot Kit | makeblock | ||
| Microscope Axio Imager | Zeiss | ||
| Microscope AxioZoom v16 | Zeiss | ||
| Microscope slides, 75 mm × 25 mm | Corning | ||
| Minipuls 3 peristaltic pump | Gilson | ||
| Plasma bonder Corona SB | BlackHole Lab | ||
| Potassium phosphate | Sigma | ||
| Syringe pump New Era NE 4000 | New Era | ||
| Syto 13 Green Fluorescent Nucleic Acid Stain | Molecular Probes, Invitrogen | ||
| Tygon tubing | Ismatec | ||
| WF31SA universal milling machine | Mikron |
Referenzen
- Stevik, K., Aa, K., Ausland, G., Fredrik Hanssen, J. Retention and removal of pathogenic bacteria in wastewater percolating through porous media: a review. Water Research. 38 (6), 1355-1367 (2004).
- Ribet, D., Cossart, P. How bacterial pathogens colonize their hosts and invade deeper tissues. Microbes and Infection. 17 (3), 173-183 (2015).
- Ginn, T. R., Wood, B. D., Nelson, K. E., Scheibe, T. D., Murphy, E. M., Clement, T. P. Processes in microbial transport in the natural subsurface. Advances in Water Resources. 25 (8), 1017-1042 (2002).
- Tufenkji, N. Modeling microbial transport in porous media: Traditional approaches and recent developments. Advances in Water Resources. 30 (6-7), 1455-1469 (2007).
- Foppen, J. W., Van, M. H., Schijven, J. Measuring and modelling straining of Escherichia coli in saturated porous media. Journal of contaminant hydrology. 93 (1-4), 236-254 (2007).
- Battin, T. J., Besemer, K., Bengtsson, M. M., Romani, A. M., Packmann, A. I. The ecology and biogeochemistry of stream biofilms. Nature Reviews Microbiology. 14 (4), 251-263 (2016).
- Scheidweiler, D., Peter, H., Pramateftaki, P., Anna, P., de Battin, T. J. Unraveling the biophysical underpinnings to the success of multispecies biofilms in porous environments. The ISME Journal. 1, (2019).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Bhattacharjee, T., Datta, S. S. Bacterial hopping and trapping in porous media. Nature Communications. 10 (1), 2075(2019).
- Scheidweiler, D., Miele, F., Peter, H., Battin, T. J., de Anna, P. Trait-specific dispersal of bacteria in heterogeneous porous environments: from pore to porous medium scale. Journal of The Royal Society Interface. 17 (164), 20200046(2020).
- Morales, V. L., Parlange, J. Y., Steenhuis, T. S. Are preferential flow paths perpetuated by microbial activity in the soil matrix? A review. Journal of Hydrology. 393 (1), 29-36 (2010).
- Creppy, A., Clément, E., Douarche, C., D'Angelo, M. V., Auradou, H. Effect of motility on the transport of bacteria populations through a porous medium. Physical Review Fluids. 4 (1), 013102(2019).
- Camesano, T. A., Logan, B. E. Influence of Fluid Velocity and Cell Concentration on the Transport of Motile and Nonmotile Bacteria in Porous Media. Environmental Science & Technology. 32 (11), 1699-1708 (1998).
- Lutterodt, G., Basnet, M., Foppen, J. W. A., Uhlenbrook, S. The effect of surface characteristics on the transport of multiple Escherichia coli isolates in large scale columns of quartz sand. Water Research. 43 (3), 595-604 (2009).
- Bozorg, A., Gates, I. D., Sen, A. Impact of biofilm on bacterial transport and deposition in porous media. Journal of Contaminant Hydrology. 183 (Supplement C), 109-120 (2015).
- Long, T., Ford, R. M. Enhanced Transverse Migration of Bacteria by Chemotaxis in a Porous T-Sensor. Environmental Science & Technology. 43 (5), 1546-1552 (2009).
- Rusconi, R., Garren, M., Stocker, R. Microfluidics Expanding the Frontiers of Microbial Ecology. Annual Review of Biophysics. 43 (1), 65-91 (2014).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Materials Science. 28 (1), 153-184 (1998).
- Crocker, J. C., Grier, D. G. Methods of Digital Video Microscopy for Colloidal Studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- del Giorgio, P. A., Bird, D. F., Prairie, Y. T., Planas, D. Flow cytometric determination of bacterial abundance in lake plankton with the green nucleic acid stain SYTO 13. Limnology and Oceanography. 41 (4), 783-789 (1996).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.