Method Article
Arabidopsis Çift Döllenmede Sperm Nükleer Morfolojisinin İzlenmesi ile Döllenme Durumunun Değerlendirilmesi
Bu Makalede
Özet
Arabidopsis çift döllenmede sperm nükleer morfolojisi temelinde epifloresan mikroskobu kullanılarak başarılı veya başarısız döllenmeyi belirlemek için bir yöntem gösterilmektedir.
Özet
Çiçekli bitkilerin benzersiz bir cinsel üreme sistemi 'çift döllenme' olarak adlandırılan, hangi sperm hücrelerinin her tam bir yumurta hücresi veya merkezi bir hücre ile kaynaşır. Böylece, iki bağımsız döllenme olayları hemen hemen aynı anda gerçekleşir. Döllenmiş yumurta hücresi ve merkezi hücre sırasıyla zigot ve endosperm haline gelişir. Bu nedenle, çift gübreleme nin kesin kontrolü takip eden tohum gelişimi için gereklidir. Çift döllenme kadın gametophyte oluşur (embriyo kesesi), derin gizli ve kalın ovule ve yumurtalık dokuları ile kaplı. Bu pistil doku yapısı, çift döllenmenin gözlem ve analizini oldukça zorlaştırmış ve çift gübreleme mekanizmasıile ilgili birçok sorunun cevapsız kaldığı mevcut durumu yaratmıştır. Döllenme düzenleyicisi için potansiyel bir adayın fonksiyonel değerlendirilmesi için döllenmenin henotibik analizi önemlidir. Arabidopsis thalianadöllenmenin tamamlanmasını yargılamak için, sperm çekirdeklerini etiketleyen floresan sinyallerinin şekilleri gösterge olarak kullanılır. Döllenmeyi başaramayan bir sperm hücresi dişi gametlerin dışında yoğunlaştırılmış floresan sinyali ile gösterilirken, başarılı bir şekilde döllenen bir sperm hücresi, dişi gametlerin çekirdeğiile karyogami nedeniyle yoğunlaştırılmış bir sinyalle gösterilir. Burada açıklanan yöntem in vivo koşullar altında başarılı veya başarısız döllenme belirlemek için bir araç sağlar.
Giriş
Çiçekli bitkiler çift gübreleme yoluyla tohum üretmek, doğrudan gamet plazma membran lokalize proteinler arasındaki etkileşimler tarafından kontrol edilen bir süreç1,2. Çiçekli bitki erkek gametler, sperm hücrelerinin bir çift, polen gelişir. Tozlaşma dan sonra büyüyen bir polen tüpü kadın gametler, bir yumurta hücresi ve bir embriyo kesesinde geliştirmek merkezi bir hücre, sperm hücrelerinin bir çift sunar. Erkek ve dişi gametler karşılaştıktan sonra, gamet yüzeyindeki proteinler çift döllenmeyi tamamlamak için tanıma, bağlanma ve füzyonu teşvik eder. Daha önceki çalışmalarda erkek gamet membran proteinleri GENERATIVE CELL SPECIFIC 1 (GCS1)/HAPLESS2 (HAP2)3,4 ve GAMETE EXPRESSED 2 (GEX2)5 gamet füzyonu ile ilgili döllenme düzenleyicileri olarak tanımlanmış ve sırasıyla ek. Yakın zamanda bir erkek gamet özgü membran proteini, DUF679 DOMAIN MEMBRAN PROTEIN 9 (DMP9), gamet etkileşimi dahil bir döllenme regülatörü olarak tespit. DMP9 ekspresyonundaki azalmanın A. thaliana6'da çift döllenme sırasında yumurta hücresi döllenmesinin önemli ölçüde inhibisyonuna yol açabilen bir azalma olduğunu bulduk.
Çift döllenme yumurtalık dokusu ile daha fazla sarılmış bir ovule gömülü bir embriyo kese, oluşur gibi, gözlemlemek ve çift döllenme süreçlerinin durumları analiz etmek zordur. Bu nedenle, çift döllenme kontrolü tüm mekanizmasının tam bir anlayış engelleyen birçok belirsiz noktaları hala vardır. İn vivo koşullarda çift döllenme sırasında gametlerin davranışlarını takip etmek için gözlem tekniklerinin oluşturulması, döllenme düzenleyicileri için potansiyel adayların fonksiyonel analizi için vazgeçilmezdir. Son çalışmalarda gamet alt hücreli yapıların floresan proteinlerile etiketlendiği marker çizgileri ortaya çıkar. Bu makalede, yapay tozlaşma pistillerden elde edilen bir embriyo kesesinde meydana gelen çift döllenmeyi gözlemlemek için basit ve hızlı bir protokol göstermiş bulunuyoruz. Sperm hücresi çekirdek marker hattı HTR10-mRFP7kullanılarak, her dişi gametin döllenme durumu sperm nükleer sinyal morfolojisi temelinde ayrımcılığa uğrayabilir. Döllenmede sperm çekirdeklerinin bu kadar morfolojik değişimine odaklanan protokolümüz, istatistiksel kanıt için yeterli miktarda veri elde edebilir. Tek bir döllenme paterni göstermek için erkek bitki olarak HTR10-mRFP arka planlı(DMP9KD/HTR10-mRFP)dmp9-knockdown hattı kullanılmıştır. Protokol aynı zamanda diğer gübreleme regülatörlerinin fonksiyonel analizi için de uygundur.
Protokol
1. Yapay Tozlaşma
NOT: İşleme başlamadan önce, 5 numaralı forceps bir çift gereklidir.
- A. thaliana (Col-0) 22 °C'de 16-h ışık/8-h karanlık bir döngü altında bir büyüme odasında büyüyün.
NOT: Kes ve aksiller tomurcukları gelişimini teşvik etmek makas ile ilk geliştirilen çiçek sapı kaldırın. Şiddetle büyüyen bitkiler (ilk sap kestikten 2-3 hafta sonra; bitki yüksekliği yaklaşık 25 cm) analiz için uygundur. - Emasculate için, sepal kaldırmak (Şekil 1B), yaprak (Şekil 1C), ve stamen (Şekil 1D) evre118 (Şekil1A) No 5 forceps kullanarak çiçek tomurcukları. Üst kısmında görülen yaprakları parçaları ile Tomurcuk en iyisidir.
NOT: Uygun bir kadın gamet işaretleyici hattı kullanın. Bu protokolde, kadın ebeveyn olarak yabani bir bitki kullandık. - Emasculation sonra on beş ila on sekiz saat, evre 138 bir DMP9KD/HTR10-mRFP çiçek stamen almak forceps ile filament pinching tarafından.
- Tozlaşmak için, hafifçe bir dehiscent anther ile bir hadım pistil birkaç kez stigma pat.
2. Gözlem için Ovule hazırlanması
NOT: Aşağıdaki öğeler gereklidir: çift taraflı bant takılı bir slayt cam, No. 5 forceps, 27 G enjeksiyon iğnesi, ve bir diseksiyon mikroskop.
- Tozlaşmadan (HAP) 7 ila 8 saat sonra, pistil'i toplayın ve çift taraflı bandın üzerine yerleştirin, ardından banttaki pisti düzeltmek için plasepsiyonla hafifçe bastırın (Şekil2A,A').
NOT: Bir pistil en ovules en az bir polen tüpü 10 HAP9alırsınız. İlk polen tüpünden sperm hücrelerinin her ikisi de veya herhangi biri döllenmeyi başaramazsa, ikinci bir polentüpü döllenme kurtarma sistemi nedeniyle ovule tarafından çekilir 10 . İlk polen tüpünden sperm çekirdekleri morfolojisini analiz etmek için ovule preparatını en geç 10 HAP ile tamamlaması önerilir. - Bir diseksiyon mikroskobu altında bir enjeksiyon iğnesi kullanarak yumurtalığın üst ve alt uçlarını kesin (Şekil2B,B').
- Enjeksiyon iğnesinin ucunu hareket ettirerek yumurtalık duvarını replum 'un her iki tarafı boyunca (Şekil2C,C') yarık.
NOT: Ovule'nin septumdan ayrılmasını önlemek için enjeksiyon iğnesini sığ bir şekilde yerleştirin. - Evert enjeksiyon iğnesi kullanarak yumurtalık duvarı (Şekil 2D,D').
- Ovules'in bağlı olduğu septumun tabanını çimdikle ve forsepslerle dikkatlice kaldırın (Şekil2E).
- Ovules bir slayt cam üzerinde su damlası içine aktarın ve yavaşça bir floresan mikroskobu altında gözlem için bir kapak cam ile kaplayın (Şekil2E,E').
3. Mikroskopi
NOT: Bu protokolde, floresan filtre küpü (bkz. MalzemeTablosu), bir dijital fotoğraf makinesi ve beraberindeki yazılımla donatılmış bir epifloresan mikroskobu kullandık.
- 20x veya 40x objektif lens ve donanımlı dijital fotoğraf makinesi kullanarak mRFP ile etiketlenmiş sperm çekirdekleri içeren ovules görüntüleri elde edin.
- Bir embriyo kesesinde mRFP etiketli sperm çekirdeklerinin sayısını doğrulayın.
NOT: İki mRFP etiketli sperm çekirdeği içeren ovules istatistiksel analiz için popülasyon büyüklüğüne dahil edilebilir. - Bir embriyo kesesinde mRFP etiketli her sperm çekirdeğinin şeklini ve konumunu doğrulayın.
NOT: Polen tüpünden çıktıktan hemen sonra, bir çift yoğunlaştırılmış mRFP etiketli sperm çekirdeği yumurta ile merkezi hücre arasında lokalize edilir. Chalazal end tarafında saptanan bir decondensed mRFP etiketli sperm çekirdeği merkezi hücre döllenme gösterir, örneğin. Uygun bir kadın gamet membran marker hattı kullanılarak, Ek Şekil1'de gösterildiği gibi, sperm hücresinin plazmogami geçirilip geçirilmediği (membran füzyonundan sonra ama karyogamiden önce) net bir şekilde izlenebilir.
Sonuçlar
DMP9KD/HTR10-mRFP ile tozlanmış bir pistil ovules 7-8 HAP toplandı ve gözlendi.
Ovulların çoğunda yumurta hücresi (mikropylar yan) ve merkezi hücre (charazal end side) çekirdek pozisyonlarında sırasıyla (Şekil3A)iki adet yoğuşmalı mRFP etiketli sperm çekirdeği bulunurve bu da başarılı çift döllenmeyi gösterir. Buna ek olarak, merkezi hücre çekirdeğinde dekontosi mRFP etiketli sperm çekirdeği ve yumurta hücresi dışında yoğunlaştırılmış mRFP etiketli sperm çekirdeği (Şekil3B)içeren ovulesler gözlendi ve tek döllenme görüldü. Başarısız çift döllenme durumunda, iki yoğunlaştırılmış mRFP etiketli sperm çekirdeği yumurta hücresi ve merkezi hücre sınırında gözlendi (Şekil3C), gcs1 mutant sperm hücrelerinde olduğu gibi (Şekil 3D)3,4 .
DMP9KD/HTR10-mRFP polenleri kullanılarak yapılan analizde, tek bir yoğunlaştırılmış mRFP etiketli sperm çekirdeği (Şekil4A)veya üç veya daha fazla mRFP etiketli sperm çekirdeği (Şekil4B)içeren ovuleler nadiren gözlendi.

Şekil 1: Emasculation için uygun çiçek tomurcukları. (A) 11. aşamada, üstteki yaprakların parçalarını gösteren bir çiçek ton. (B-D) Sepals kaldırıldı bir çiçek tomurcuk (B) ve yaprakları (C) ve daha sonra tamamen hadım edildi (D). Anther dehiscence henüz gerçekleşmedi. Ölçek çubuğu = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
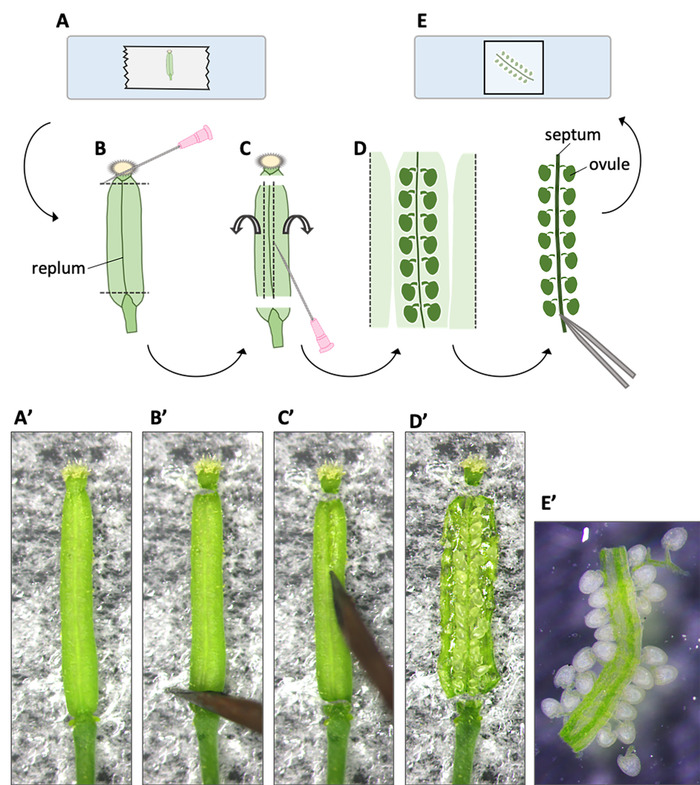
Şekil 2: Ovule numune sinin akışı. Prosedürler resimlerle (A -E) ve fotoğraflarla(A'-E'ile gösterilmiştir. (A, A') Bir sürgülü cama bağlı çift taraflı bandın üzerine bir pistil yerleştirilir ve üst ve alt uçları enjeksiyon iğnesi ile kesilir. (B, B') Yumurtalık duvarı replum her iki tarafı boyunca kesilir. (C, C') Yumurtalık duvarlarının her iki tarafı açılır, açılır ve sabitleme için bandın üzerine basılır. (D, D') Ovules'lerin diziler halinde bağlandığı septum açığa çıktı. (E, E') Septumun bir ucu sıkıştırılır ve forsepsle yukarı kaldırılır. Ovules bağlayan septum bir slayt cam üzerinde su damlasına aktarılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Sperm nükleer sinyal morfolojisi ile değerlendirilen döllenme fenotipleri ovule içinde. (A) İki decondensed mRFP etiketli sperm çekirdeği (ok başları) ile gösterilen başarılı çift döllenme. (B) DMP9KD/HTR10-mRFP sperm hücreleri tarafından tek döllenme bir decondensed mRFP etiketli sperm çekirdeği (ok ucu) ve bir yoğuşmalı mRFP etiketli sperm çekirdeği (ok) tarafından gösterilir. (C) DMP9KD/HTR10-mRFP sperm hücreleri tarafından başarısız çift döllenme iki yoğuşmalı mRFP etiketli sperm çekirdeği (ok) ile gösterilir. (D) Gcs1HTR10-mRFP sperm hücreleri tarafından başarısız çift döllenme örneği. Yumurta hücresi çekirdeğinin (EN) RFP ile etiketlendiği bir işaret hattı kullanılmıştır. İki yoğuşmalı mRFP etiketli sperm çekirdeği (oklar) 18 HAP'de döllenme olmadan tutuklanmaktadır. (E) Bir ovule şematik illüstrasyon. EC = yumurta hücresi, CC = merkezi hücre, SC = sinergid hücreleri, ES = embriyo kesesi, MP = micropyle, CHZ = chalazal end. Ölçek çubukları = 20 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Diğer potansiyel döllenme fenotipleri. DMP9KD/HTR10-mRFP ile tozlaşmış bir pistil ovules nadiren tek bir yoğunlaştırılmış mRFP etiketli sperm çekirdeği (A), veya üç veya daha fazla yoğunlaştırılmış mRFP etiketli sperm çekirdekleri (B ) (ok) içerir. Ölçek çubukları = 20 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Döllenme sırasında plazmogami de yoğunlaşmış sperm çekirdekleri, bir kadın plazma membran marker hattı ile kombinasyon ile değerlendirilir. pFWA::Merkezi hücre plazma zarının görüntülendiği GFP-PIP kadın ebeveyn (GFP) olarak kullanılmıştır. GFP-PIP de etiketler endo membranlar12. Ovule iki yoğuşmalı mRFP etiketli sperm çekirdeği içerir (oklar; RFP). Charazal end tarafında RFP sinyali (ok) merkezi hücrede gösterilir (Birleştirme), sperm çekirdeği plazmogamy olduğunu belirten (gamet membran füzyon sonra, ancak karyogamy önce). Sağdaki panel, birleştirilmiş görüntüde kesik çizgilerle çevrili alanın büyütülmesidir. Yıldız işaretiyle işaretlenmiş boş bir alan, merkezi hücre çekirdeğinin konumuna karşılık gelir. Kesikli çizgi, yumurta hücresine bakan merkezi hücrenin anahatlarını gösterir. Ölçek çubuğu = 20 μm. Bu dosyayı indirmek için lütfen buraya tıklayınız.
Tartışmalar
HTR10-mRFP etiketleri baba kromatin (yani, sperm hücre çekirdekleri görselleştirir), ve çift döllenme dinamikleri bildirilmiştir7. Polen tüpünden salındıktan hemen sonra HTR10-mRFP etiketli sperm çekirdekleri hala yoğunlaşır. Ancak, sperm çekirdeklerinin her biri gamet membran füzyon7sonra karyogamy üç ila dört saat bir döllenmiş kadın gamet çekirdeği ile birleştirme üzerine decondensed . Döllenmemiş sperm hücreleri yoğun kalır, hangi gcs1 sperm hücrelerinin döllenme olmadan tutuklanan bir embriyo kese gösterildiği gibi (Şekil3D). Genellikle, polen ebeveyni olarak doğurgan HTR10-mRFP kullanıldığında, 7-8 HAP'da ovulesin %57.9 ± %17.8'i (ortalama ± s.d.; n = 16 pistil) iki mRFP etiketli sperm çekirdeği sinyali içerir ve hemen hemen tüm sinyaller (%97.2) decondensed, başarılı çift döllenme yansıtan (benzer bir sinyal deseni Şekil 3Agösterilir). DMP9KD/HTR10-mRFPdurumunda, iki mRFP etiketli sperm çekirdeği içeren ovules HTR10-mRFPbenzer bir frekansta gözlendi , ama 17.6% bunların tek döllenme gösterdi6. HTR10-mRFP dinamiklerini, epifloresan mikroskobu kullanarak in vivo koşullar altında çok sayıda ovülzin gözlemi için benimsedik. Protokol basit ve hızlıdır, bu da istatistiksel kanıt için yeterli verilerin toplanmasını sağlar. Bu protokolüilk örnek olarak kullanarak, DMP9KD/HTR10-mRFP sperm hücreleri tarafından merkezi hücrenin tek döllenme önemi6kanıtlanmıştır.
Bir polen tüpünden elde edilen HTR10-mRFP etiketli sperm çekirdeklerinin morfolojik farklılıklarına göre, döllenme şekilleri üç fenotip olarak sınıflandırılır: (1) iki decondensed ile karakterize başarılı çift döllenme HTR10-mRFP etiketli sperm çekirdekleri (Şekil 3A); (2) tek döllenme, bir yoğuşmalı HTR10-mRFP etiketli sperm çekirdeği ve bir decondensed HTR10-mRFP etiketli sperm çekirdeği özellikleri (Şekil 3B); ve (3) iki yoğuşmalı HTR10-mRFP etiketli sperm çekirdeği olan çift döllenme başarısız (Şekil 3C).
Fenotiplerin diğer potansiyel nedenleri (2) ve (3) göz önünde bulundurulmalıdır. Bu sperm hücrelerinin sırasıyla bir yumurta hücresi veya merkezi hücre ile plazmogamy birkaç dakika yarı-in vitro kültür koşulları altında bir embriyo kesesi içine serbest bırakıldıktan sonra başladığı bildirilmiştir11. Buna ek olarak, yumurta hücresi ve merkezi hücre11döllenme sırası için bir tercih olmasına rağmen, ilk ve ikinci döllenme arasında birkaç dakika gecikme var. Bu nedenle, fenotip (2) yoğunlaşmış ve decondensed sperm çekirdekleri bir çift tek döllenme yerine döllenme ler arasında bir zaman gecikmesi gösterebilir. Fenotipte (2) önemli bir frekansta tek döllenme nin meydana gelişini doğrulamak için istatistiksel analiz için yeterli olan bir dizi örnek incelenmelidir. İki yoğun sperm çekirdeğine (Şekil3C)sahip olan fenotip (3), plazma membran füzyonu12'den önce sperm hücrelerinin hareketsizlik dönemini veya plazmogamy ile karyogami arasındaki dönemi yansıtabilir. Bu nedenle, 7-8 HAP'de iki yoğuşmalı sperm çekirdeği çift döllenmenin 'başarısızlığını' tam olarak yansıtmaz ve çift döllenmenin başarısını veya başarısızlığını değerlendirmek için tozlaşmadan sonra ovulları gözlemlemek gerekir. Bu bağlamda, 16-18 HAP'de ovule gözlemi önerilir, çünkü ovuleslerin çoğu ilk polen tüpü tarafından verilen sperm hücreleri ile çift döllenmeyi tamamlamış olur ve döllenmemiş sperm çekirdeklerinin HTR10-mRFP sinyalleri bir sonrakine kadar kalır. şekil 3D'de gösterildiği gibi tozlaşma günü.
Tek bir yoğunlaştırılmış HTR10-mRFP etiketli sperm çekirdeği (Şekil4A)bir desen nadiren tespit edildi, hangi tek döllenme sonucu döllenmiş kadın gamet başka bir baba HTR10-mRFP sinyalin hızlı kaybolması nedeniyle muhtemeldir. Bu analizde, üç veya daha fazla HTR10-mRFP etiketli sperm çekirdekleri de nadir bir olgu olarak tespit edildi (Şekil 4B), döllenme kurtarma sistemi tarafından ikinci polen tüpü kabulü nedeniyle10. Bu protokolde, bir polen tüpünden elde edilen iki sperm hücresinin davranışlarının izlenmesi doğru değerlendirme için kritik olduğundan, bu olgular verilerin dışında tutulmuşlardır.
Bir embriyo kesesinde kadın gamet pozisyonları için polarite iyi düzenlenir beri (yani, yumurta hücresi ve merkezi hücre mikropylar ve chalazal tarafında farklılaşmak, sırasıyla), hangi kadın gamet dölleniyor göreli tarafından değerlendirilebilir mRFP etiketli sperm çekirdeklerinin pozisyonları. Ancak, döllenmemiş ve plazmogamy durumları arasında ayrım bir sınırlama vardır, her iki durum yoğunlaştırılmış sperm çekirdekleri sinyali ile gösterilir çünkü. Gamet membran füzyonundan sonra plazmogaminin sperm çekirdekleri yoğunlaştığında oluşup oluşmadığını tam olarak değerlendirmek için, Takahashi et al. (2018)6tarafından bildirilen kadın gamet membran marker hatlarının kullanılması gerekmektedir. Örneğin, bir pFWA::Merkezi hücre plazma zarının görüntülendiği GFP-PIP bitkisi12 kadın ebeveyn olarak kullanıldığında, merkezi hücre ile kaynaşmış bir sperm hücresinin plazmogamy içinde olduğu açıktır (Ek Şekil 1 ).
Özetle, burada açıklanan protokolümüz, her dişi gamette başarı veya döllenme başarısızlığının istatistiksel olarak değerlendirilmesi için kullanılabilir. Plazmogami değerlendirmek için kadın plazma membran belirteci istihdamı gerekli olmasına rağmen, yöntemimiz döllenme düzenleyicisinin fonksiyonel analizi nde yararlıdır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Japonya Bilim KAKENHI hibe (JP17H05832 T. I.) teşvik için Japonya Derneği tarafından desteklenen ve Phytochemical Bitki Moleküler Bilimler Stratejik Öncelik Araştırma Tanıtım Programı fon tarafından, Chiba Üniversitesi (Japonya).
Malzemeler
| Name | Company | Catalog Number | Comments |
| BX51 | Olympus | Epifluorescence microscope | |
| Cover glass | Matsunami glass | C018181 | |
| DMP9KD/HTR10-mRFP | Arabidopsis thaliana, HTR10-mRFP background Takahashi et al. (2018)6 | ||
| Double-sided tape | Nichiban | NW-15S | 15 mm width |
| DP72 | Olympus | Degital camera | |
| Forceps | Vigor | Any No. 5 forceps are available | |
| Growth chamber | Nihonika | LPH-411PFQDT-SP | |
| HTR10-mRFP | Arabidopsis thaliana, ecotype Columbia-0 (Col-0) background Ingouff et al. (2007)7 | ||
| Injection needle | Terumo | NN-2719S | 27 gauge |
| Slide glass | Matsunami glass | S9443 | |
| SZX9 | Olympus | Dissecting microscope | |
| U-MRFPHQ | Olympus | Fluorescence Filter Cube (Excitation: BP535-555, Emission: BA570-625, Dichromatic mirror:DM565) | |
| UPlanFL N 40x | Olympus | Objective lens (NA 1.3), oil-immersion | |
| UPlanSApo 20x | Olympus | Objective lens (NA0.75), dry |
Referanslar
- Mori, T., Kawai-Toyooka, H., Igawa, T., Nozaki, H. Gamete dialogs in green lineages. Molecular Plant. 8, 1442-1454 (2015).
- Dresselhaus, T., Sprunck, S., Wessel, G. M. Fertilization mechanisms in flowering plants. Current Biology. 26, R125-R139 (2016).
- Mori, T., Kuroiwa, H., Higashiyama, T., Kuroiwa, T. GENERATIVE CELL SPECIFIC 1 is essential for angiosperm fertilization. Nature Cell Biology. 1, 64-71 (2006).
- von Besser, K., Frank, A. C., Johnson, M. A., Preuss, D. Arabidopsis HAP2 (GCS1) is a sperm-specific gene required for pollen tube guidance and fertilization. Development. 133, 4761-4769 (2006).
- Mori, T., Igawa, T., Tamiya, G., Miyagishima, S. Y., Berger, F. Gamete attachment requires GEX2 for successful fertilization in Arabidopsis. Current Biology. 24, 170-175 (2014).
- Takahashi, T., et al. The male gamete membrane protein DMP9/DAU2 is required for double fertilization in flowering plants. Development. 145, dev170076 (2018).
- Ingouff, M., Hamamura, Y., Gourgues, M., Higashiyama, T., Berger, F. Distinct dynamics of HISTONE3 variants between the two fertilization products in plants. Current Biology. 17, 1032-1037 (2007).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2, 755-767 (1990).
- Kasahara, R. D., Maruyama, D., Higashiyama, T. Fertilization recovery system is dependent on the number of pollen grains for efficient reproduction in plants. Plant Signaling & Behavior. 8, e23690 (2013).
- Kasahara, R. D., et al. Fertilization recovery after defective sperm cell release in Arabidopsis. Current Biology. 22, 1084-1089 (2012).
- Hamamura, Y., et al. Live-cell imaging reveals the dynamics of two sperm cells during double fertilization in Arabidopsis thaliana. Current Biology. 21, 497-502 (2011).
- Igawa, T., Yanagawa, Y., Miyagishima, S., Mori, T. Analysis of gamete membrane dynamics during double fertilization of Arabidopsis. Journal of Plant Research. 126, 387-394 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır