Method Article
Évaluation de l'état de fertilisation par la recherche de la morphologie nucléaire du sperme dans la double fécondation de l'arabidopsise
Dans cet article
Résumé
Nous démontrons une méthode pour déterminer la fertilisation réussie ou échouée sur la base de la morphologie nucléaire de sperme dans la double fertilisation d'Arabidopsis utilisant un microscope d'épifluorescence.
Résumé
Les plantes à fleurs ont un système unique de reproduction sexuelle appelé « double fécondation », dans lequel chacun des spermatozoïdes fusionne précisément avec un ovule ou une cellule centrale. Ainsi, deux événements de fécondation indépendants ont lieu presque simultanément. L'ovule fécondé et la cellule centrale se développent en zygote et endosperme, respectivement. Par conséquent, un contrôle précis de la double fécondation est essentiel pour le développement des semences qui s'ensuit. La double fécondation se produit dans le gamétophyte femelle (sac d'embryon), qui est profondément caché et couvert de tissus épais d'ovule et d'ovaire. Cette construction de tissu de pistil rend l'observation et l'analyse de la double fertilisation tout à fait difficile et a créé la situation actuelle dans laquelle beaucoup de questions concernant le mécanisme de double fertilisation restent sans réponse. Pour l'évaluation fonctionnelle d'un candidat potentiel pour l'organisme de réglementation de la fécondation, l'analyse phénotypique de la fécondation est importante. Pour juger de l'achèvement de la fécondation dans Arabidopsis thaliana, les formes des signaux de fluorescence étiquetant les noyaux de sperme sont utilisés comme indicateurs. Un spermatozoïde qui ne parvient pas à féconder est indiqué par un signal de fluorescence condensé à l'extérieur des gamètes femelles, tandis qu'un spermatozoïde qui féconde avec succès est indiqué par un signal décondensé dû à la karyogamy avec le noyau des gamètes femelles. La méthode décrite ici fournit un outil pour déterminer la fécondation réussie ou échouée dans des conditions in vivo.
Introduction
Les plantes à fleurs produisent des graines par double fécondation, un processus qui est directement contrôlé par les interactions entre les protéines localisées sur la membrane plasmatique gamète1,2. Les gamètes mâles de plante de floraison, une paire de spermatozoïdes, se développent dans le pollen. Un tube de pollen qui se développe après la pollinisation fournit une paire de spermatozoïdes aux gamètes femelles, un ovule et une cellule centrale, qui se développent dans un sac d'embryon. Après la rencontre des gamètes mâles et femelles, les protéines sur la surface du gamète favorisent la reconnaissance, l'attachement et la fusion pour compléter la double fécondation. Dans des études antérieures, les protéines mâles de membrane de gamètegenerative CELL SPECIFIC 1 (GCS1)/HAPLESS2 (HAP2)3,4 et GAMETE EXPRESSED 2 (GEX2)5 ont été identifiées comme régulateurs de fertilisation impliqués dans la fusion de gamètes et attachement, respectivement. Nous avons récemment identifié une protéine membranaire spécifique au gamète mâle, DUF679 DOMAIN MEMBRANE PROTEIN 9 (DMP9), en tant que régulateur de fertilisation impliqué dans l'interaction gamète. Nous avons constaté qu'une diminution de l'expression de DMP9 a comme conséquence l'inhibition significative de la fertilisation de cellules d'oeuf pendant la double fertilisation dans A. thaliana6.
Comme la double fécondation se produit dans un sac d'embryon, qui est incorporé dans un ovule qui est encore enveloppé avec le tissu d'ovaire, il est difficile d'observer et d'analyser les états des processus de double fécondation. Pour cette raison, il y a encore beaucoup de points peu clairs qui entravent une compréhension complète du mécanisme entier de contrôle de double fertilisation. La mise en place de techniques d'observation pour retracer le comportement des gamètes lors de la double fécondation dans des conditions in vivo est indispensable à l'analyse fonctionnelle des candidats potentiels pour les régulateurs de fécondation. Des études récentes ont donné des lignes de marqueur où les structures sous-cellulaires gamètes sont étiquetées avec des protéines fluorescentes. Dans cet article, nous démontrons un protocole simple et rapide pour observer la double fertilisation qui s'est produite dans un sac d'embryon dérivé des pistils artificiellement pollinisés. L'utilisation de la ligne de marqueurde noyau de cellules de sperme HTR10-mRFP 7, l'état de fertilisation de chaque gamète femelle peut être discriminé sur la base de la morphologie nucléaire de signal de sperme. Notre protocole se concentrant sur un tel changement morphologique des noyaux de sperme à la fertilisation peut obtenir efficacement une quantité suffisante de données pour la preuve statistique. Une ligne DMP9-knockdownavec hTR10-mRFP fond (DMP9KD/HTR10-mRFP) a été utilisé comme plantes mâles pour montrer un modèle de fertilisation unique. Le protocole convient également à l'analyse fonctionnelle d'autres organismes de réglementation de la fertilisation.
Protocole
1. Pollinisation artificielle
REMARQUE: Avant de commencer le processus, une paire de forceps no 5 est nécessaire.
- Cultivez A. thaliana (Col-0) à 22 oC sous un cycle sombre de 16 h/8 h dans une chambre de croissance.
REMARQUE: Couper et enlever la première tige de fleur développée avec des ciseaux pour favoriser le développement des bourgeons axillaires. Les plantes en croissance vigoureuse (2-3 semaines après la coupe de la première tige; hauteur de la plante d'environ 25 cm) sont propices à l'analyse. - Pour émasculer, enlever le sépale (figure 1B), le pétale (figure 1C) et l'étamine (figure 1D) des bourgeons floraux au stade 118 (figure 1A) à l'aide de 5 forceps. Bud avec des morceaux de pétales vus au sommet est le meilleur.
REMARQUE: Utilisez une ligne de marqueur de gamètes femelle sémino-femelle appropriée. Dans ce protocole, nous avons utilisé une plante de type sauvage comme parent femelle. - Quinze à dix-huit heures après l'émasculation, prenez l'étamine d'une fleur DMP9KD/HTR10-mRFP au stade 138 en pinçant le filament avec des forceps.
- Pour polliniser, tapoter doucement la stigmatisation d'un pistil émasculé plusieurs fois avec une anthère décente.
2. Préparation de l'Ovule pour l'observation
REMARQUE: Les éléments suivants sont nécessaires : un verre coulissant avec du ruban adhésif recto-verso, des forceps no 5, une aiguille d'injection de 27 G et un microscope à disséquer.
- 7 à 8 h après la pollinisation (HAP), recueillir le pistil et le placer sur la bande à double face, puis appuyez doucement avec des forceps pour fixer le pistil sur la bande (Figure 2A, A').
REMARQUE: La plupart des ovules dans un pistil reçoivent au moins un tube de pollen 10 HAP9. Si les deux ou l'un des spermatozoïdes du premier tube de pollen ne parviennent pas à féconder, un deuxième tube de pollen serait attiré par l'ovule en raison du système de récupération de fécondation10. Pour analyser la morphologie des noyaux de sperme à partir du premier tube de pollen, il est recommandé de terminer la préparation des ovules par 10 HAP au plus tard. - Couper les extrémités supérieure et inférieure de l'ovaire à l'aide d'une aiguille d'injection sous un microscope à disséquer (figure2B, B').
- Éteindre la paroi de l'ovaire le long des deux côtés du replum (Figure 2C, C') en déplaçant la pointe de l'aiguille d'injection.
REMARQUE: Insérez l'aiguille d'injection à peu de profond soudeur pour empêcher la séparation des ovules du septum. - Evert la paroi de l'ovaire en utilisant l'aiguille d'injection (Figure 2D, D').
- Pincez la base du septum à laquelle les ovules sont connectés, et soulevez-le soigneusement avec des forceps (Figure 2E).
- Transférer les ovules dans une goutte d'eau sur un verre coulissant, et couvrir délicatement d'un verre de couverture pour observation sous un microscope à fluorescence (Figure 2E, E').
3. Microscopie
REMARQUE: Dans ce protocole, nous avons utilisé un microscope épifluorescence équipé d'un cube de filtre à fluorescence (voir Tableau des matériaux),d'un appareil photo numérique et du logiciel d'accompagnement.
- Acquérir des images d'ovules contenant des noyaux de sperme étiquetés avec mRFP à l'aide d'une lentille objective 20x ou 40x et l'appareil photo numérique équipé.
- Confirmer le nombre de noyaux de sperme étiquetés mRFP dans un sac d'embryons.
REMARQUE: Les ovules contenant deux noyaux de sperme étiquetés mRFP peuvent être inclus dans la taille de la population pour l'analyse statistique. - Confirmer la forme et la position de chaque noyau de sperme étiqueté mRFP dans un sac d'embryon.
REMARQUE: Immédiatement après avoir été libéré d'un tube de pollen, une paire de noyaux de sperme condensés mRFP-étiquetés sont localisés entre l'oeuf et la cellule centrale. Un noyau de sperme décondensé mRFP-étiqueté détecté au côté de l'extrémité de chalazal indique la fertilisation centrale de cellules, par exemple. En utilisant une ligne de marqueur de membrane de gamète femelle appropriée, comme indiqué dans la figure supplémentaire 1, si oui ou non le spermatozoïde subit la plasmogamy (après fusion de membrane mais avant karyogamy) peut être surveillé clairement.
Résultats
Des ovules d'un pistil pollinisé avec DMP9KD/HTR10-mRFP ont été rassemblés à 7-8 HAP et observés.
La plupart des ovules contenaient deux noyaux de sperme décondensés étiquetés mRFP à l'ovule (côté micropylar) et à la cellule centrale (côté de l'extrémité charazal) positions du noyau, respectivement (Figure 3A), indiquant une double fécondation réussie. En outre, des ovules contenant un noyau de sperme décondensé étiqueté mRFP au noyau central de cellules plus un noyau condensé de sperme mRFP-étiqueté à l'extérieur de la cellule d'oeuf (figure 3B) ont été observés, indiquant la fertilisation simple. Dans le cas d'une double fécondation défaillante, deux noyaux de spermatozoïdes condensés étiquetés MRFP ont été observés à la limite de l'ovule et de la cellule centrale (Figure 3C), comme dans les spermatozoïdes mutants gcs1 (Figure 3D)3,4 .
Dans l'analyse utilisant le pollen DMP9KD/HTR10-mRFP, des ovules contenant un seul noyau de spermatozoïdes étiqueté mRFP condensé (Figure 4A) ou trois noyaux de sperme étiquetés mRFP ou plus (Figure 4B) ont été rarement observés.

Figure 1 : Les bourgeons floraux adaptés à l'émasculation. (A) Un bourgeon de fleur au stade 11, montrant des morceaux des pétales au dessus. (B-D) Un bourgeon de fleur dans lequel a été enlevé les sépales (B) et les pétales (C) et qui a ensuite été émasculé complètement (D). La déhiscence de l'anthène n'a pas encore eu lieu. Barre d'échelle de 1 mm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
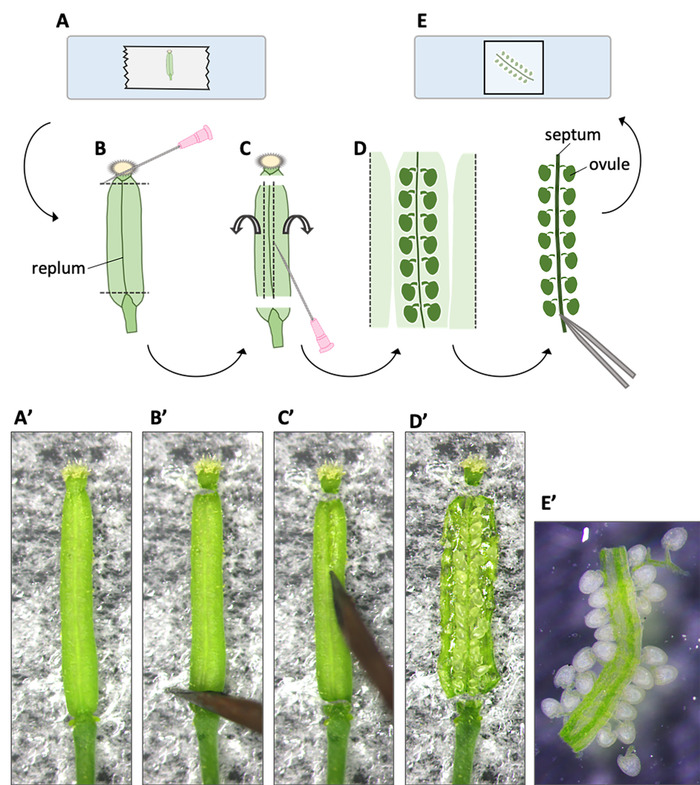
Figure 2 : Flux de préparation d'échantillons ovules. Les procédures sont montrées par des illustrations (A-E) et des photographies (A'-E'). (A, A') Un pistil est placé sur du ruban adhésif recto-verso attaché à un verre coulissant, et ses extrémités supérieures et inférieures sont coupées avec une aiguille d'injection. (B, B') La paroi de l'ovaire est incisée le long des deux côtés du replum. (C, C') Les deux côtés des murs de l'ovaire sont ouverts, everted, et pressés sur la bande pour la fixation. (D, D') Le septum où les ovules sont connectés dans les tableaux est exposé. (E, E') Une extrémité du septum est pincée et soulevée avec des forceps. Le septum avec ovules de connexion est transféré à une goutte d'eau sur un verre coulissant. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Phénotypes de fécondation jugés par morphologie du signal nucléaire spermatozoïde en ovule. (A) Double fécondation réussie indiquée par deux noyaux de sperme décondensés étiquetés mRFP (têtes de flèche). (B) Fertilisation unique par dAMP9KD/HTR10-mRFP spermatozoïdes indiqués par un noyau de spermatozoïdes décondensé étiqueté mRFP (tête de flèche) et un noyau de sperme condensé mRFP-étiqueté (flèche). (C) A échoué double fécondation par DMP9KD/HTR10-mRFP spermatozoïdes indiqués par deux noyaux de sperme condensés mRFP-étiquetés (flèches). (D) Un exemple de double fécondation échouée par les spermatozoïdes gcs1HTR10-mRFP. Une ligne de marqueur où le noyau des cellules d'oeufs (EN) est étiqueté avec La DP a été utilisée. Deux noyaux de sperme condensés étiquetés mRFP (flèches) sont arrêtés sans fécondation à 18 HAP. (E) Illustration schématique d'un ovule. EC - oeuf, CC - cellule centrale, SC - cellules synergides, ES - sac d'embryons, MP - micropyle, CHZ - fin chalazal. Barres d'échelle de 20 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Autres possibilités phénotypes de fécondation. Les ovules d'un pistil pollinisé avec DMP9KD/HTR10-mRFP contiennent rarement un seul noyau de sperme condensé mRFP-étiqueté (A), ou trois ou plus condensés mRFP-étiquetés noyaux de sperme (B) (flèches). Barres d'échelle de 20 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Figure supplémentaire 1 : noyaux condensés de sperme à la plasmogamy pendant la fertilisation, jugé par combinaison avec une ligne femelle de marqueur de membrane de plasma. pFWA::GFP-PIP où la membrane centrale de plasma cellulaire est visualisée a été employée en tant que parent féminin (GFP). GFP-PIP étiquette également les membranes endo12. L'ovule contient deux noyaux de sperme condensés étiquetés mRFP (flèches; DP). Le signal de DP au côté de l'extrémité charazal (flèche) est indiqué dans la cellule centrale (Merge), ce qui indique que le noyau du sperme est en plasmogamy (après la fusion de la membrane gamète, mais avant la karyogamie). Le panneau de droite est un grossissement de la zone entourée de lignes pointillées dans l'image fusionnée. Une zone vierge marquée par un astérisque correspond à la position du noyau cellulaire central. La ligne pointillée indique le contour de la cellule centrale faisant face à l'ovule. Barre d'échelle de 20 m. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
HTR10-mRFP étiquette la chromatine paternelle (c.-à-d., visualise les noyaux de spermatozoïdes), et la dynamique dans la double fécondation ont été rapportés7. Immédiatement après la libération d'un tube de pollen, les noyaux de sperme HTR10-mFP-étiquetés sont toujours condensés. Cependant, chacun des noyaux de sperme est décondensé en fusionnant avec un noyau de gamète femelle fertilisé à la karyogamy trois à quatre heures après fusion de membrane de gamète7. Les spermatozoïdes non fécondés restent condensés, comme le montre un sac d'embryons dans lequel les spermatozoïdes gcs1 sont arrêtés sans fécondation (Figure 3D). Habituellement, lorsque le HTR10-mRFP fertile est utilisé comme parent pollinique, 57,9 % - 17,8 % (moyenne - s.d.; n - 16 pistils) d'ovules dans un pistil à 7-8 HAP contiennent deux noyaux de sperme étiquetés mRFP, et presque tous les signaux (97,2 %) sont décondensés, ce qui reflète une double fécondation réussie (un modèle de signal similaire est indiqué à la figure 3A). Dans le cas de DMP9KD/HTR10-mRFP, ovules contenant deux noyaux de sperme mRFP-étiquetés ont été observés à une fréquence similaire à celle de HTR10-mRFP, mais 17,6% d'entre eux ont montré une fécondation unique6. Nous avons adopté la dynamique HTR10-mRFP pour l'observation d'un grand nombre d'ovules dans des conditions in vivo à l'aide d'un microscope épifluorescence. Le protocole est simple et rapide, ce qui permet la collecte de données suffisantes pour la preuve statistique. En utilisant ce protocole comme première instance, l'importance de la fécondation unique de la cellule centrale par les spermatozoïdes DMP9KD/HTR10-mRFP a été prouvée6.
Sur la base des différences morphologiques des noyaux de spermatozoïdes étiquetés HTR10-mRFP dérivés d'un tube de pollen, les modèles de fertilisation sont classés en trois phénotypes : (1) double fécondation réussie, qui se caractérise par deux Noyeuaux de sperme étiquetés HTR10-mRFP (figure 3A); (2) fertilisation unique, qui comporte un noyau de sperme hdensed HTR10-mRFP-étiqueté et un noyau de sperme HTR10-mRFP décondensé (figure 3B); et (3) a échoué la double fécondation, qui a deux noyaux de sperme condensés HTR10-mRFP-étiquetés (figure 3C).
D'autres causes potentielles de phénotypes (2) et (3) devraient être considérées. Il a été rapporté que les spermatozoïdes commencent respectivement la plasmogamy avec une cellule d'oeuf ou de cellules centrales plusieurs minutes après avoir été libérés dans un sac d'embryon dans des conditions semi-in vitro de culture11. En outre, un décalage de quelques minutes existe entre la première et la deuxième fécondations, bien qu'il n'y ait aucune préférence pour l'ordre de fécondation de l'ovule et de la cellule centrale11. Par conséquent, une paire de noyaux condensés et décondensés de sperme dans le phénotype (2) pourrait indiquer un décalage de temps entre les fertilisations au lieu de la fertilisation simple. Afin de confirmer l'occurrence de la fécondation unique à une fréquence significative dans le phénotype (2), un certain nombre d'échantillons suffisants pour l'analyse statistique devraient être examinés. Le phénotype (3), qui a deux noyaux condensés de sperme (figure 3C),pourrait refléter une période d'immobilité des spermatozoïdes avant la fusion de membrane de plasma12 ou la période entre la plasmogamy et la karyogamy. Par conséquent, deux noyaux condensés de sperme à 7-8 HAP ne reflètent pas entièrement « l'échec » de la double fécondation, et il est nécessaire d'observer les ovules à une date ultérieure après la pollinisation pour évaluer le succès ou l'échec de la double fécondation. À cet égard, l'observation des ovules à 16-18 HAP est recommandée, parce que la plupart des ovules auraient terminé la double fécondation avec les spermatozoïdes livrés par le premier tube de pollen, et les signaux HTR10-mRFP de noyaux de sperme non fécondés resteraient jusqu'à la prochaine jour de pollinisation, comme le montre la figure 3D.
Un modèle du noyau de sperme HTR10-mFP-étiqueté simple de HTR10-mFP (figure 4A) a été rarement détecté, qui était probablement dû à la disparition rapide d'un autre signal paternel de HTR10-mRFP dans le gamète femelle fertilisé en raison de la fertilisation simple. Dans cette analyse, trois noyaux de sperme étiquetés HTR10-mFP ou plus ont également été détectés comme un cas rare (Figure 4B), en raison de l'acceptation du deuxième tube de pollen par le système de récupération de fécondation10. Dans ce protocole, ces cas ont été exclus des données, parce que tracer les comportements de deux spermatozoïdes dérivés d'un tube de pollen est critique pour l'évaluation précise.
Étant donné que la polarité des positions des gamètes femelles dans un sac embryonnaire est bien réglementée (c.-à-d. que l'ovule et la cellule centrale se différencient respectivement au micropylar et au côté chalazal), quel gamète femelle féconde peut être jugé par le parent positions des noyaux de sperme étiquetés mRFP. Cependant, il y a une limite dans la distinction entre les états non fertilisés et les états de plasmogamy, parce que les deux états sont indiqués par le signal condensé de noyaux de sperme. Pour évaluer précisément si la plasmogamy après la fusion de membrane de gamète s'est produite ou pas quand les noyaux de sperme sont condensés, il est exigé d'employer les lignes femelles de marqueur de membrane de gamète, comme rapporté par Takahashi et autres (2018)6. Par exemple, lorsqu'une plante pFWA::GFP-PIP 12 dans laquelle la membrane centrale du plasma cellulaire a été visualisée a été utilisée comme parent féminin, il est clair qu'un spermatozoïde fusionné avec la cellule centrale était en plasmogamy (figuresupplémentaire 1 ).
En résumé, notre protocole décrit ici peut être utilisé pour l'évaluation statistique du succès ou de l'échec de la fécondation chez chaque gamète féminin. Bien que l'emploi du marqueur femelle de membrane de plasma soit exigé pour juger la plasmogamy, notre méthode est utile pour l'analyse fonctionnelle du régulateur de fertilisation.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu par la subvention kaKENHI de la Japan Society for the Promotion of Science (JP17H05832 à T. I.) et par le financement du Programme de promotion de la recherche prioritaire stratégique sur les sciences moléculaires des plantes phytochimiques de l'Université chiba (Japon).
matériels
| Name | Company | Catalog Number | Comments |
| BX51 | Olympus | Epifluorescence microscope | |
| Cover glass | Matsunami glass | C018181 | |
| DMP9KD/HTR10-mRFP | Arabidopsis thaliana, HTR10-mRFP background Takahashi et al. (2018)6 | ||
| Double-sided tape | Nichiban | NW-15S | 15 mm width |
| DP72 | Olympus | Degital camera | |
| Forceps | Vigor | Any No. 5 forceps are available | |
| Growth chamber | Nihonika | LPH-411PFQDT-SP | |
| HTR10-mRFP | Arabidopsis thaliana, ecotype Columbia-0 (Col-0) background Ingouff et al. (2007)7 | ||
| Injection needle | Terumo | NN-2719S | 27 gauge |
| Slide glass | Matsunami glass | S9443 | |
| SZX9 | Olympus | Dissecting microscope | |
| U-MRFPHQ | Olympus | Fluorescence Filter Cube (Excitation: BP535-555, Emission: BA570-625, Dichromatic mirror:DM565) | |
| UPlanFL N 40x | Olympus | Objective lens (NA 1.3), oil-immersion | |
| UPlanSApo 20x | Olympus | Objective lens (NA0.75), dry |
Références
- Mori, T., Kawai-Toyooka, H., Igawa, T., Nozaki, H. Gamete dialogs in green lineages. Molecular Plant. 8, 1442-1454 (2015).
- Dresselhaus, T., Sprunck, S., Wessel, G. M. Fertilization mechanisms in flowering plants. Current Biology. 26, R125-R139 (2016).
- Mori, T., Kuroiwa, H., Higashiyama, T., Kuroiwa, T. GENERATIVE CELL SPECIFIC 1 is essential for angiosperm fertilization. Nature Cell Biology. 1, 64-71 (2006).
- von Besser, K., Frank, A. C., Johnson, M. A., Preuss, D. Arabidopsis HAP2 (GCS1) is a sperm-specific gene required for pollen tube guidance and fertilization. Development. 133, 4761-4769 (2006).
- Mori, T., Igawa, T., Tamiya, G., Miyagishima, S. Y., Berger, F. Gamete attachment requires GEX2 for successful fertilization in Arabidopsis. Current Biology. 24, 170-175 (2014).
- Takahashi, T., et al. The male gamete membrane protein DMP9/DAU2 is required for double fertilization in flowering plants. Development. 145, dev170076 (2018).
- Ingouff, M., Hamamura, Y., Gourgues, M., Higashiyama, T., Berger, F. Distinct dynamics of HISTONE3 variants between the two fertilization products in plants. Current Biology. 17, 1032-1037 (2007).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2, 755-767 (1990).
- Kasahara, R. D., Maruyama, D., Higashiyama, T. Fertilization recovery system is dependent on the number of pollen grains for efficient reproduction in plants. Plant Signaling & Behavior. 8, e23690 (2013).
- Kasahara, R. D., et al. Fertilization recovery after defective sperm cell release in Arabidopsis. Current Biology. 22, 1084-1089 (2012).
- Hamamura, Y., et al. Live-cell imaging reveals the dynamics of two sperm cells during double fertilization in Arabidopsis thaliana. Current Biology. 21, 497-502 (2011).
- Igawa, T., Yanagawa, Y., Miyagishima, S., Mori, T. Analysis of gamete membrane dynamics during double fertilization of Arabidopsis. Journal of Plant Research. 126, 387-394 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon