Method Article
Phloem ve Hemipteran böcekler bitki su besleme RNA müdahale ikna etmek için çift iplikçikli RNA Oral teslim yöntemleri
Bu Makalede
Özet
Bu makalede damar doku bitkiler için RNA müdahale (RNAi) böcekler besleme phloem sap ile çift iplikçikli RNA (dsRNA) oral teslimat için geliştirilen roman tekniklerini gösterir.
Özet
Phloem ve bitki su besleme böcekler bitkileri ve meyve gıda bitkileri zarar sürecinde besin almak için bütünlüğünü istila. Hemipteran böcekler bitkilerin bitkileri zarar phloem sap üzerinde besleyerek ekonomik açıdan önemli zararlıları bir dizi hesap. Kahverengi marmorated koku hata (BMSB), Halyomorpha halys (Heteroptera: Pentatomidae) ve Asya narenciye psyllid (ACP), Diaphorina citri Kuwayama (Hemiptera: Liviidae) çoğu Kuzey Amerika'da tanıttı hemipteran böcek zararlıları nerede onlar Ne zaman onlar kapalı toplam değeri yüksek özel, satır ve elyaf bitkileri ve narenciye invaziv bir tarımsal haşere yanı sıra bir baş belası zararlı vardır. Pek çok tür böcek ilacı direniş haşere Yönetim Stratejileri alternatif yöntem geliştirme için açmıştır. Çift iplikçikli RNA (dsRNA)-aracılı RNA müdahale (RNAi) fonksiyonel genomik çalışmalar için böcek zararlıları yönetimi için bir araç olarak potansiyel uygulamalar olan mekanizma susturmak bir gen olduğunu. Exogenously sentezlenen dsRNA veya küçük müdahale RNA (siRNA) sunulan bu homolog endojen RNA bozulması ile yüksek verimli gen susturmak tetikleyebilir. Etkili ve çevresel RNAi moleküler biopesticides olarak için kullanımı biyolojik hemipteran böceklerin besleme yoluyla dsRNAs vivo içinde teslim gerektirir. Burada dsRNA teslim edilmek üzere böcekler yöntemleri göstermektedir: dsRNA yeşil fasulye daldırma tarafından yükleme ve gene özgü dsRNA yenmesi ile oral teslimat ile emici. Biz de transgenik olmayan bitki teslim yaklaşımlar yaprak Spreyleri, kök drench, gövde enjeksiyonları yanı sıra kil granülleri, tüm bunların dsRNA sürekli serbest bırakılması için gerekli olabilir kullanarak belirttiğimiz. Verimli bir şekilde teslim sözlü olarak alınan dsRNA tarafından hedeflenen genler, Juvenil hormon asit O-Metiltransferaz gibi (JHAMT) ve vitellogenin (Vg) ifadesi önemli bir azalma ikna etmek için etkili bir doz olarak teyit edildi. Bu yenilikçi yöntemler stratejileri bitki koruma kullanın ve haşere yönetimi için çevresel zorlukların üstesinden gelmek için dsRNA teslim etmek için temsil eder.
Giriş
Hemipteran böcekler bazı yüksek nüfus artışı elde ettiği ve bitki hastalık yaymak için agriculturebecause yeteneklerini en ekonomik olarak önemli zararlıları oluşturmaktadır. BMSB, H. halys Stål, yanlışlıkla Allentown, Pennsylvania (Çin, Tayvan, Kore ve Japonya) Asya'dan Batı yarımkürede 19961' de rapor ilk nişan ile kullanılmaya başlanan bir invaziv zararlı olduğunu. Yana, BMSB 43 Devletler'de, Orta Atlantik (DE, MD, PA, NJ, VA ve WV) yanı sıra Kanada ve Avrupa'da, en yüksek nüfus ile tespit etti ve tarım2için potansiyel bir tehdit temsil eder. Polyphagous baş belası BMSB elma, üzüm, süs bitkileri, tohum bitkileri, soya ve Mısır gibi yüksek değerli bitkileri de dahil olmak üzere yaklaşık 300 tanımlanan bitki ana bilgisayarlara zarar isteyip başlatabilir. Hasar nedeniyle öncelikle hayvan ana ürün erişmek için besin damar doku2,3, iğne gibi stylet ile delip geçiyor nerede lacerate ve floş olarak bilinen besleme modu neden olur. BMSB okullar gibi yaşam alanları içinde ikamet bulabilirsiniz ayrıca kapalı bir haşere ve sonbahar kış2sırasında evler. Kimyasallar ve BMSB tarafından yayımlanan aeroallergens meyve kırpma işçileri yasadışı Alerjik reaksiyon için rapor edilmiştir. BMSB de alerjik hastalık Kontakt Dermatit, konjonktivit ve duyarlı bireyler4,5rinit için katkıda bulunabilir. Başka bir hemipteran böcek, ACP, D. citri Kuwayama (Hemiptera: Liviidae), narenciye ciddi bir zararlı olduğunu ve Huanglongbing (HLB), daha çok bilinen neden phloem sınırlı bakteri (olan Liberibacter asiaticus) iletir narenciye greening hastalığı6,7olarak. HLB ilk Güney Çin bildirildi ve 40 farklı Asya, Afrika, Okyanusya, Güney ve Kuzey Amerika ülkeleri7' ye yayıldı. Narenciye greening ekonomik ve mali kayıp narenciye meyve kaybı nedeniyle tehdit ile dünya çapında bir sorundur; Bu nedenle, ACP yönetimi önlemek ve HLB denetlemek için çok önemli olarak ele alınır.
Bu böcek zararlıları etkin denetimini önlemleri genellikle gerektirir nispeten kısa kimyasal böcek ilaçları uygulanması yaşadı. Kimyasal Böcek ilacı denetim stratejileri genellikle güvenli Çevre Yönetim Stratejileri eksikliği veya duyarlılık nedeniyle pestisit direnç haşere nüfus8,9düştü. Bu nedenle, moleküler biopesticides olan biyolojik mücadele potansiyel bir alternatif, ama kullanımı genel olarak mütevazı kalır, ve parasitoids (örneğin, Trisolcus japonicus) çeşitli türlerin de doğal biyolojik etkili olabilir denetimleri. RNAi teknolojisi moleküler biopesticides10ile invaziv böcek zararlıları yönetmek için ortaya çıkan bir potansiyeldir. RNAi, endojen sonunda mRNA, gen ifadesinin düzenlenmesinde yol açar fingerprinting şekilde, dsRNAs istila yanı sıra etkili posttranscriptional gen susturulması kolaylaştırır bir de açıklanan gen düzenleyici mekanizma olduğunu seviye11,12. Eksojen dsRNA bu bidentate nükleaz RNase III süper bir üyesi tarafından çift işlenir bir hücre içine içselleştirilmiş, kısaca, evrimsel solucanlar, sinekler, bitkiler, mantarlar ve memeliler13, korunmuş Dicer aradı 14 , 15. bu 21-25 nükleotit siRNA dubleks sonra sapmasına ve RNA-induced silencing kompleksi (RISC) RNA'ların rehber olarak entegre. Bu RISC-RNA kompleksi Watson-Crick baz eşleşmesi sağlar tamamlayıcı için hedef mRNA; Bu sonunda Argonaute protein, karşılık gelen mRNA düşürür ve protein çeviri, böylece posttranscriptional gene16 susturmak için önde gelen azaltır bir RNase H benzeri etki alanı içeren bir çoklu etki alanı protein tarafından bölünme için açar , 17 , 18.
RNAi haşere yönetimi için faiz, gen susturmak için dsRNA vivo içinde giriş böylece siRNA yolu etkinleştirme gerektirir. 10,1920,21, mikroenjeksiyon22, taşıyıcılar gibi lipozomlar iliklerine kadar besleme için dsRNA teslim böcekler ve böcek hücreleri sistemik RNAi ikna etmek için kullanılmış çeşitli yöntemleri içerir 23ve diğer teknikleri24. RNAi unc-22 gen ekspresyonu yangın tarafından susturmak için ilk Caenorhabditis elegans gösterdi ve Mello25nakavt Drosophila melanogaster26frizzled genlerin ifadesinde ardından, olmuştur. İlk fonksiyonel çalışmalar mikroenjeksiyon böceklerde, Apis mellifera22,27, Acyrthosiphon pisum28, Blattella germanica29gibi dsRNA teslim etmek için kullanılan, H. halys30ve Lepidoptera böcekler (Terenius ve ark. tarafından gözden 31). mikroenjeksiyon böcek ilgi sitenin doğru ve hassas bir doz sunmak için avantajlı. De olsa böyle septik delikler ifade onun pratiklik tarım biopesticides geliştirme dışarı iktidar bağışıklık ilgili genlerin travma32, dolayısıyla, nedeniyle çıkarmak.
DsRNA vivo içinde teslim başka bir ıslatarak, hangi yenmesi veya dsRNA genellikle ekstraselüler ortamda dsRNA içeren absorpsiyonu hayvanlar veya hücrelerin süspansiyon ile ilgili bir yöntemdir. İliklerine kadar verimli bir şekilde RNAi Drosophila S2 doku kültürü hücrelerin Downstream Raf1 (DSOR1) mitojenle-aktive protein kinaz kinaz (MAPKK)20etkisizleştirmek için hem de susturmak için C. elegans ikna etmek için kullanılmıştır POS-1 gen33. Ancak, iliklerine kadar kullanılarak teslim dsRNA mikroenjeksiyon20' ye göre RNAi ikna etmek için daha az etkilidir. Aracılı RNAi çiğneme bir böcek susturmak ilk bir yapay agar diyet10dsRNA beslerken tarafından Batı Mısır rootworm (WCR) (Diabrotica virgifera virgifera) gösterildi. Önceki raporları yöntemleri doğal diyetler eklembacaklılar34için belirli infüzyon dsRNA teslim özetledik. Bu teslim yöntemi daha fazla kıyaslanabilir teslim yapay araçlarının etkili olduğu belirlenmiştir; çeçe sineği (Glossina morsitans morsitans), nerede bir bağışıklık ile ilgili gen eşit nakavt kan yemek veya microinjected35ile dsRNA ne zaman teslim edildiği gözlenmiştir olgusu gibi. Benzer şekilde, dsRNA hafif kahverengi elma güve (Epiphyas postvittana)36, diamondback güve (Plutella xylostella) larvaları37yanı sıra bal arıları38,39 damlacıklar yoluyla teslim verimli RNAi indüklenen. Oral dsRNA hemipteran böceklerde teslimini ana bitkinin Vaskular dokuları teslim edilmelidir beri zorlu çünkü en etkili RNAi deneylerde hemipteran enjeksiyon dsRNA40 kullanılan. Etkili RNAi Ayrıca gözlenen ACP ve camsı kanatlı keskin nişancı leafhopper (GWSS), Homalodisca vitripennis: dsRNA narenciye ve dsRNA kök drench, yaprak aracılığıyla damar doku içine absorbe asma aracılığıyla teslim edildi spreyler, gövde enjeksiyonları veya absorpsiyonu ile kesimler41,42,43,44,45,46. Bu da ACP (2016, bize 20170211082 A1) karşı dsRNA için ilk patent sonuçlandı. SiRNA ve dsRNA gemileri nano tanecikleri ve lipozomlar kullanarak istikrar kazandırır ve teslim edilen dsRNA etkinliği artışlar hızla23,47,48,49 ortaya çıkıyor ,50. Teslimat nanoparçacık tabanlı araçlar vitro ve in vivo uygun teslimat51vektörler gibi özellikle tedavi uygulamaları muazzam potansiyel vermek için bu özetlendiği nükleik asitler için yeni bir sınıf. Nano tanecikleri dsRNA için bir teslimat araç olarak çözünürlük, hydrophobicity veya sınırlı biyoakümülasyon52gibi dezavantajları olabilir, ama uygun polimer yardım teslim bu dezavantajları telafi. Geliştirme ve nükleotid kendi kendine teslim kullanım da 'tek iplikçikli RNA/DNA dubleks46olan denilen antianlamlı oligonucleotides', ortaya çıkıyor.
Vitellogenesis eklembacaklılar içinde bir anahtar olduğunu kontrol etmek üreme süreci ve Juvenil hormon (JH) veya ecdysone tarafından düzenlenir, vücut yağ tarafından; Vg sentezi anahtar indükleyicileri olduğu Vg sonunda Vg reseptör aracılı endositoz53ile gelişmekte olan oosit tarafından kaplıyor. VG polipeptitler bir grup büyük yumurta sarısı protein vitellin54,55, gelişimi için gerekli olan extraovarially, sentez ve bu nedenle, önemli üreme ve yaşlanma56olmasıdır. VG nematodlar57 de başarıyla susturuldu yanı sıra nerede RNAi Vg tükenmesi aracılı bal arı (Apis mellifera) Yetişkin ve yumurta22yılında gözlendi. Çünkü bu onun tükenmesi gözlemlenebilir fenotipik efekt gibi yol açacak düşünüldü aracılı posttranscriptional gen Vg susturmak test RNAi doğurganlık ve potansiyel olarak BMSB kontrol yardımcı olmak için verimlilik, azaltılmış. S-adenosyl-L-metiyonin (SAM) kodlar JHAMT gen-bağımlı JH asit O-Metiltransferaz, tromboksan JH biyosentezi yolu58son adım. Bu yolu farnesyl pirofosfat (FPP) ardışık olarak farnesol JH JHAMT tarafından metil farnesoate dönüşüm ardından farnesoic aside dönüşür. Bu yolu böcekler ve eklembacaklılar metamorfoz, developmentally hormonlar59,60,61tarafından denetlenmektedir bir işlem için özel olarak korunmuş. B. moriJHAMT gen ekspresyonu ve Corpora allata JH biyosentetik faaliyete JHAMT gen transkripsiyon bastırılması JH biyosentezi58sona erdirilmesi için çok önemli olduğunu göstermektedir. Bu nedenle, JHAMT ile Vg gen RNAi kullanarak hedeflenen tükenmesi için seçildi. RNAi Ayrıca narenciye ağaçları ACP ve GWSS kontrolü için test edildi. Narenciye ağaçları dsRNA kök drench aracılığıyla ile tedavi edildi, dsRNAs karşı böcek belirli arginin kinaz (AK) Tutanaklar42,44ile yaprak spreyleri yanı sıra dokunun (gövde enjeksiyon), kök. DsRNA topikal uygulama her yerinde bitkiler damar doku üzerinden verimli bir şekilde teslim gösteren ve ACP ve GWSS41,42, artmış mortalite sonuçlandı narenciye ağaçları, gölgelik algılandı 45.
Mevcut çalışmada, biz dsRNA gibi tedaviler için doğal diyet Teslimat yöntemi belirledik. Yeni geliştirilen bu teknik daha sonra JHAMT ve Vg susturmak için kullanılan gen belirli dsRNAs BMSB perileri kullanılarak mRNA önceki62gösterdi. Bu yeni teslim iletişim kuralları aşağıda gösterildiği topikal spreyler veya microinjections kullanmak geleneksel RNA dağıtım sistemlerinin yerini. Sebze ve meyve, kök dokunun, drenching toprak ve kil emiciler biopesticide zararlı ve hastalık yönetimi sürekli gelişimi için kritik olan dsRNA, teslimi için kullanılabilir.
Protokol
1. BMSB yetiştirme
- Arka BMSB böcekler başı olarak standart laboratuar uygulama ve yukarıda açıklanan63.
- Narenciye macrophylla üzerinde ACP (D. citri) böcekler glasshouse (22 ° C) ve doğal ışık yükseltmek. Yetişkin ACP kullanın, eclosion yaklaşık 5-7 gün sonrası.
2. çeşitli gen bölgeleri ve In Vitro dsRNA sentezi
- Genler belirli BMSB için daha önce yayımlanmış transcriptome profilleri32seçin.
- Seçili vade farkı bölgelerinde 200 ila 500 baz çifti arasında değişir emin olun.
- Polimeraz zincir tepkimesi (PCR) seçili gen genomik DNA dan ilgi ile ilişkili parçaları oluşturmak için aşağıda açıklanan koşullar kullanarak gerçekleştirin. Gene özel oligonucleotides için bkz: Tablo 1 .
- PCR reaksiyon: 0.25 mL PCR tüp 5 µL PCR tampon, 4 µL dNTP karışımı (2.5 mM her), DNA şablonunun (50 ng/µL), 2,5 µL her astar 1 ve 2 (10 µM), DNA polimeraz (5 U/µL) 0,25 µL 2 µL X 10 birleştirmek , ve Dnaz/RNase free su 50 µL.
- PCR koşulu: bölge 95 ° c 3 dk 30 98 ° C devredir 10 ardından ilgi yükseltmek için PCR reaksiyon döngüsü s, 30 55 ° C s, 1 dk. Incubate tepki bir ek 10 dk. PCR reaksiyon kullanarak arındırmak için 72 ° C'de 72° C bir Arıtma kiti.
- T7 RNA polimeraz organizatörü dizisi ile çevrili gen belirli astar ile elde edilen PCR parçaları daha da yükseltmek (5'-GAA TTA ATA CGA CTC Yasası ATA GGG AGA-3') olarak bahsedilen önceki62.
- LacZ gene bir negatif kontrol (sahte) RNAi için kullanın.
Not: LacZ β-galaktozidaz Escherichiacoli genomik DNA (kullanılan astar Tablo 1' de listelenen) güçlendirilmiş kodlar bir gen olduğunu. - Vitro transkripsiyon dsRNA açıklanan önceki62olarak vermeye gerçekleştirir.
- Dağıtılması ve 150 µL Dnaz/RNase free su elde edilen dsRNA resuspend, konsantrasyonu ölçmek ve-80 ° c ileride kullanmak üzere saklamak.
3. teslimat dsRNA kullanma yeşil fasulye
- Seçme erken 4th INSTAR BMSB perileri aynı yumurtadan kitle yumurta ve onları dsRNA besleme önce 24 h için açlıktan.
- İnce sertifikalı organik yeşil fasulye (Phaseolus vulgaris L.) seçin ve 5 min için % 0,2 sodyum hipoklorit çözüm ile yıkayın.
Not: ince yeşil fasulye fasulye 2 mL microcentrifuge tüplerde rahatça kalabileceği böylece seçildi. - GKD2ile O 3 kez yıkama ve kuru hava için sağlar.
- Calyx sonundan itibaren yeşil fasulye 7,5 cm temiz bir jilet kullanarak toplam uzunluğu için trim.
- Yıkanmış ve kesilmiş yeşil fasulye kontrol çözümü 300 µL içeren bir kap daha az 2 mL microcentrifuge tüp sokmak (1:10 yeşil gıda boyası seyreltme (malzemeler: su, propilen glikol, Fd & C sarı 5, Fd & C mavi 1 ve Propylparaben olarak koruyucu)).
- Yapmak dilutions in vitro LacZ, JHAMT veya Vg dsRNAs 5 µg sulandrarak veya 300 µL 0.017 µg/µL veya 0,067 µg/µL, son konsantrasyonları sırasıyla vermeye RNase/Dnaz ücretsiz su içinde 20 µg sentezledim.
- Yıkanmış ve kesilmiş yeşil fasulye dsRNA çözüm (Kimden adım 3.6) 300 µL içeren bir kap daha az 2 mL microcentrifuge tüp sokmak.
- Sarın ve dsRNA çözüm buharlaşma önlemek için ve hayvanlar microcentrifuge tüp girmesini önlemek için dalmış Fasulye kapsayan microcentrifuge tüpler kenarlarını kapatın.
- Bu tüpler yeşil fasulye kılcal eylem tarafından yüklenebilmesi dsRNA çözüm sağlamak 3 h için oda sıcaklığında dik bir şekilde yerleştirin.
- Bu tüpler temiz kültür gemiler (polipropilen) yerleştirin. Yerde üç 4th INSTAR BMSB perileri kültür damarlarının açlıktan.
- Üç hayvan kültür gemi her üç yeşil fasulye ile yeşil gıda renklendirme veya dsRNA çözüm içeren tedavi. 16 L: 8D photoperiod bir kuluçka altında 25 ° C ve %72 bağıl nem, böcekler korumak.
- Yeşil (dalmış ve dsRNA ile emilir) fasulye beslenirler böcekler için 5 gün izin ama 3 gün sonra dsRNA tedavi yeşil boncuk taze yiyecek ile doldurmak.
4. gerçek zamanlı kantitatif (qPCR) analizi, gen ifade aşağıdaki RNAi aracılı susturmak BMSB içinde
- QPCR tarafından transkript ifadesi düzeyi RNAi etkisini ölçmek.
- Toplam RNA tedavi dsRNA hayvanlardan yalıtmak ve cDNA62sentez.
- Bir gerçek zamanlı PCR sistemi ve Tablo 1' de listelenen primerler kullanılarak qPCR reaksiyonlar Kur. Aşağıdaki qPCR Bisiklete binme koşul kullanma: 95 ° C 10 dk ardından 40 devredir 15 95 ° c s, 60 ° C için 1 dakika, 15 95 ° C de dahil olmak üzere ayrışma adım ile birlikte s, 60 ° C için 1 dakika, 15 95 ° C s ve 60 ° C 15 s.
- QPCR standartlar belirlemek: Toplam RNA miktar için referans standart olarak normal bir hayvan izole hazırlanan cDNA seri seyreltme kullanın.
- BMSB 18s RNA bir iç standart olarak RNA kurtarma doku32farklılıkları için düzeltmek için kullanın.
5. yaprak sprey uygulama büyük saksı narenciye ağaçları ve fidan
Not: Narenciye çeşidinde 'Carrizo' citrange (Citrus sinensis XPoncirus trifoliata, Rutaceae), bitkilerin cam evdeki huysuz gibi doğal ışık ve sıcaklık, 1,2 L kaplarda yetiştirilen altında muhafaza. Bitkiler sürekli 'floş' adı verilen yeni yaprak sürgünler büyümesini teşvik için silinen. ACP yem ve narenciye64yeni büyüme üzerine oviposition için tercih ediyor.
- Bitki veya fidan seçin ve bunları 2-3 gün toprağı nemli ama tamamen kuru kurumasına izin kullanmak için önceden su değil.
- Bir el pompası sprey şişe kullanmak alt tepeye (şekil 4A) 200 mL dsRNA çözeltisi (0,5 mg/mL) uygulanır.
Not: Yukarıdaki hazırlamak Dnaz/RNase free su çözümlerinde dsRNA bahsetti. - Uygulama sonrası sprey, tamamen yaprakları tarafından absorbe edilebilir uygulanan dsRNA çözüm sağlar.
Not: Narenciye ağaçları uygulanan dsRNA emilir ve sonra yaprakları ya da yeni büyüme veya uygulama öncesinde kaplıydı dalları ayıklanır; dsRNA qPCR kullanarak tespit ve sistemik hareket ağaç üst kubbe yaprakları içine 3-4 h44,45,46de gösterdi. - 25-40 toplayarak gün yaklaşık 10 dört şubeler keyif--dan ayrıldıktan sonra daha önce tepesinde ağaçlarından yeni büyüme örnek. Toplam RNA ayıklamak ve ters transkripsiyon PCR (RT-PCR) tarafından analiz ve qPCR primerler kullanılarak uygulanan dsRNA tetikleyici varlığı için tablo 1'de listelenen ve daha önce açıklanan yöntemleri46.
Not: Örnek toplanması, toplam RNA izolasyon, RT-PCR ve qPCR yukarıda açıklanan46yapıldı. - Benzer şekilde, topikal 10 mL dsRNA bir fide veya küçük saksı ağaç yapraklar alt bölgesine sprey.
Not: Hemipteran böcekler (ACP ve GWSS) normalde 24 h beslenme erişim verildi, hangi değil doğrudan püskürtülür veya hangi hafta sonra büyüdü yeni büyüme (yaprak), ya da tüm bitki tedavisi sonrası. Bu böcekler dsRNA doğumdan 3, 6 ve 10 gün için hangi test pozitif sonrası beslenme üretti.
6. toprak/Root Drench uygulamada büyük ya da küçük narenciye ağaçları ve fidan saksı
- Bitki veya fidan seçin ve bunları 2-3 gün toprağı nemli değil kurumasına izin kullanmak için önceden su değil tamamen kuru (bu sıvı çözüm uygulanması için tutmak için hava alanı oluşturur).
- DsRNA çözüm (0.2 mg/mL) 1 L büyük Saksı bitkileri (yaklaşık 2,5 m) toprağa ekleyin ve 1 saat sonra 1 litre su (cila) ekleyin.
- 100 mL dsRNA çözeltisi (1.33 mg/mL) 1 m boyunda toprak saksı ağaçları kısmen kuru topraklarda uygula.
- Küçük Fideler için 10 mL dsRNA çözeltisi (1 mg/mL) koniler toprakta veya çıplak kökleri (şekil 4B, C) uygulanır.
- İzin almak için 30 dk emmesi için bir toprak drench olarak uygulanan dsRNA çözüm bitkiler. O zaman daha büyük bitki kapları > 1 galon Eğer absorpsiyonu kökleri (20 mL sarı kaplarda bitkiler için) veya 100 mL ile yardım etmek için düz su tek tedavi uygulanır.
Not: Yeşillik için topikal uygulanan dsRNA şube 3-6 h mesaj tedaviler, ağaçlar sistemik hareketi gösterilen içinde en distal ipuçları algılama ile sonuçlandı. Yeni büyüme dalları dsRNA 60-90 gün sonrası tedaviler, pozitif. Kupürleri böcekler (ACP ve GWSS) bir dsRNA bioassay44besleme sağlanır.
7. kök dokunun (ağaç gövde enjeksiyon) uygulamada büyük saksı narenciye ağaçları ve fidan
- Narenciye Fidan, yeni veya yaklaşık 3,5 yıl kök kullanarak dsRNA enjekte için eski bitkiler dokunun (gövde enjeksiyonları) yöntemi seçin.
- Bir matkap ve 2 cm veya kök yaklaşık yarım çap aşmayacak şekilde dikkat çekici bir 10 mm matkap biraz kullanarak narenciye bitki delik.
- Her enjektör bakır ucu ucuna yakın kaçağı önlemek için film sızdırmazlık 4 - 6 kez bir 0.6 cm (¼ inç) geniş şerit ile sarın.
- Ağaç gövde enjektörleri Dnaz/RNase free suda seyreltilmiş dsRNA çözüm 6 mL (1.7 mg/mL) ile doldurulması (ile belirtilen burada renkli çözüm olarak).
- Çözüm ağaç gövde içine enjekte ve enjektör dsRNA çözüm emilimini izin vermek 6-10 h için bagajda bırak. Böcekler 3, 10 ve 30 gün sonrası tedavi tedavi ağaçlarından kesimler üzerinde beslemek izin.
Not: gövde enjeksiyon yöntemi kullanarak enjekte dsRNA ağaçların arasında 30-60 gün41,42,44bir süre için kalıcı. Doğrulama RNAi için Tablo 1' de listelenen primerler kullanılarak qPCR tarafından gerçekleştirildi.
8. dsRNA tedavi kil granül teslim edilmek üzere böcekler aracılığıyla toprak
- Kil emici tüp 35 mL işaretine (yaklaşık 30 g kil emici) 50 mL konik tüp içine dökmek.
- 20 mL dsRNA çözeltisi (100 µg/mL) Dnaz/RNase free suda seyreltilmiş tüm emici ıslak için tüp dökün. Cap konik tüp, tüp hava kaldırmak için ipucu ve tüp kap.
- Tüp dik koyun ve 1-2 min için çözüm emmek kil parçacıkları için stand izin verin.
- Yeterli dsRNA batırılmış kil 1 galon potu doldurmak için toprak karışımı içine ekleyin.
- Mix ve el ile iyice dsRNA batırılmış kil toprak karıştırmak için toprağı.
- Bu toprak dsRNA tedavisi için seçili fidan repot için kullanın.
- Su 200 mL dsRNA olmadan sade su ile toprak. 1 h 30 dk sonra sade su ile 100 mL izleyin. 24 saat sonra normal sulama zamanlamaya göre bitki koymak.
- Tedavi Saksı bitkileri kil emiciler ve dsRNA ile 4-6 yaprakları dsRNA için her ay sonrası tedavi yeni bitki büyüme en apikal yaprakları toplayarak sınayın.
Not: Bitki veya kesimler bu tedavi bitkilerden böcekler için herhangi bir süre sonra 24 saat tedavi sonrası ve böcekler (yayınlanmamış veri) teslim RNAi için bir yıl kadar mümkün olmuştur beslenir.
Sonuçlar
Sebze aracılı dsRNA teslim BMSB 4th INSTAR perileri besleme yoluyla moleküler biopesticides RNAi invaziv böcek zararlıları için kullanarak gelişimi için test edildi. BMSBs yem olarak bilinen bir mekanizma tarafından onların iğne gibi stylets kullanarak lacerate ve floş, hangi bitkileri için önemli hasara neden olur. İnce organik yeşil fasulye, P. vulgaris L., besin veya dsRNA vivo içinde BMSB için beslenme3' ten teslim Eğer test etmek için kullanılmıştır. Yeşil fasulye segmentlerinin Dnaz/RNase free su veya su ve yeşil gıda boyası BMSB (şekil 1A) teslim test etmek için bir çözüm dalmış. Yeşil gıda boyası dsRNA taklit için görsel bir gösterge kullanıldı. Yeşil fasulye damar dokusu kılcal eylem62tarafından yeşil gıda boyası ile phloem yeşil renkli çözüme akışının nedeniyle ile doymuş. BMSB perileri yeşil fasulye (şekil 1B) damar dokuların onların stylets ekleyerek yeşil fasulye kesimlerinde besleme görüldü. Yeşil renkli salgılarının damlacıkları yeşil gıda renklendirme teslim edilen malzeme sözlü olarak yutulur ve gut boşaltım (şekil 1 c, D önce geçtiğini gösteren ile doymuş fasulye beslenen edildi böceklerde 2 ve 3 gün sonra tespit edildi ).
Eğer hedeflenen gen ekspresyonu önemli tükenmesi BMSB içinde BMSB belirli dsRNA yenmesi ile yeşil fasulye aracılı teslimini kullanarak başarılı oldu daha sonra test ettik. Yeşil fasulye kesimleri dalmış ve bir çözüm 0,067 µg/µL (300 µL Dnaz/RNase free su içinde 20 µg) veya 0.017 µg/µL (300 µL Dnaz/RNase free su içinde 5 µg) bir sentez içinde in vitro dsRNA BMSB JHAMT ve Vg özel absorbe , sırasıyla. Yeşil fasulye de su yalnız, 0,067 µg/µL veya 0.017 µg/µL LacZ dsRNA (sahte) ilgili denetimler olarak dalmış. Transkript düzeyleri JHAMT bu ifadeyi gösteren qPCR kullanarak değerlendirildi ve Vg mRNA yapıldı tarafından neredeyse 4,5 - vivo içinde önemli ölçüde azaltılmış ve 2.2-fold, sırasıyla (şekil 2A, B). Sonuç olarak, bu dsRNA başarılı RNAi ikna etmek için taze fasulye Vaskular dokuları teslim edilebilir sonuçlar gösterir.
Başka bir hemipteran pest, besin veya dsRNA tedavi başarılı teslimini sebze kullanarak teslim Eğer bitkileri de test edildi cole hasara neden Harlequin hata (HB) (Murgantia histrionica), teslimat aracılık. 4th INSTAR HB perileri bebek collard yeşillik (Brassica oleracea var. beslemek için izin verildi viridis) su veya su yeşil gıda boyası ile bir çözüm dalmış. Sonuçları HB beslenen ve açık salgılarının (şekil 3) vardı suya batırılır sebze yutulur HB ile karşılaştırıldığında onların yeşil renkli salgılarının gelen belirgin yeşil gıda boyası yutulur göstermiştir.
Ek teknikleri dsRNA püskürtme veya kök/toprak tüm bitki doku65,66dsRNA alımı sonuçları sırılsıklam geçici teslim etmek için. Sprayable RNAi bazlı ürünler geliştirme aşamasındadır ve yakında onay bekleyen bulunuyor olabilir. DsRNA spreyler veya kök drench kullanarak alanları teslimini invaziv böcekler42,67yönetiminde yardımcı olabilir. Narenciye ağaçları tam boyutlu ve fidan dsRNA için yaprak sprey veya toprak veya çıplak kök (şekil 4) sırasıyla drenching maruz bırakıldı. Sonuçları dsRNAs ya spreyler tarafından teslim veya toprak/çıplak kök drench 7 hafta yazı dsRNA422 g tek bir pozlama için narenciye bitkilerde (2.5 m boyunda) tespit edilemedi belirtti. Teslimat ve psyllid dsRNA-AK (20 ng/µL) sindirim psyllid mortalite % 30-45 (şekil 4 d)42tarafından arttı.
Transkripsiyonu vitro dsRNA verimli bir şekilde doğrudan damar doku böcekler tarafından gibi bitkilerin44 yırtıcı ne zaman elde edilebilir bitkinin kök dokunun (gövde enjeksiyonları) gen belirli dsRNA kullanarak polyphagous böcekler için teslim (Şekil 5). 7 hafta 1.7 mg/mL dsRNA 6 mL Dnaz/RNase çözümde kullanarak tek bir pozlama ücretsiz su (şekil 5A sonrası için dsRNA için gövde enjeksiyonları tarafından maruz kaldılar narenciye ağaçları için dsRNA yaşında narenciye bitkilerde (yaklaşık 1 m boyunda) tespit edilemedi B). Hemipteran böcekler phloem besleme sonra dsRNA ile tedavi bu ana bitkiler üzerinde beslemek için izin verildi. Bu dsRNA başarılı bir şekilde infüzyon ve narenciye bitkiler damar sistemi ne zaman dsRNA-AK42üzerinde fed ölüm gösterdi ACP tarafından yenmesi için taşındı varsayılır.
BİYOANALİZLER 2008'den itibaren 2012 için geliştirilen, edilmiş çok çeşitli Saksı bitkileri arasında gösterildi ve hangi bitkiler emebilir ve sistemik dsRNA yayma41,42 için dsRNA translocate bir şekilde dsRNA teslim sağlamak için gösterilen . Bir yöntem bir kil emici bileşeni dsRNA adsorpsiyon ile kil Matrix'e kullanır; Bu çok çeşitli kil, Fuller's toprak, zeolit ve diğerleri, iyi gibi diğer emici malzeme, selüloz, agars, bioplastics, olarak içerir vb aktif maddeler teslim etmek için kullanılan toz ücretsiz nükleik asit taşıyıcıları parçacıklardır kil toprak bitki alımı ve sonuçta böcekler (şekil 6) teslim için dsRNA gibi. Karmaşık kil, belirli pH veya iyonik koşullar altında dsRNA serbest bırakmak için kimyasal olarak da yapılandırılabilir. Kil teslim yöntemleri dsRNA bitkiler içine dsRNA saksı narenciye ağaçları içine ve diğer bitkiler üzerinde 14 ay (veri gösterilmez) sağlamak için gösterilmiştir. Bu dağıtım sistemi Çiçek rengi, bitki uzunluğu (dwarfing) veya diğerleri gibi bitki özellikleri değiştirmek için kullanılabilir. Şu anda, birincil bu yöntem etkili böcek haşere ve patojen (virüs) denetim veya yönetim geliştirme için kullanmaktır. Yaklaşım Kreşler ve ev sahibi için uygun maliyetli olabilir ve transgenik olmayan bir yöntemdir.

Resim 1 . Besin veya dsRNA yeşil fasulye aracılığıyla teslim. İnce organik yeşil fasulye(a)parçaları dalmış gösterip GKD2O tek başına veya GKD2O 3 h için yeşil gıda boyası ile 300 µL içeren 2 mL microcentrifuge tüp çözümde emilir. Üç 4th INSTAR BMSB perileri için 24 saat açlıktan ve kültür gemileri ile birlikte 3 yeşil fasulye gemi başına yerleştirilir. (B) BMSB yeşil fasulye fasulye besin onların stylets ile ulaşmak için üzerinden piercing tarafından suya batırılır segmentlerinin beslenir. (C) gün 2 bioassay beslenme BMSB okları salgılarının göstermek. 3. gün (D); (Okla gösterilen) artan BMSB salgılarının gözlenen GKD2O çözüm sonrası sindirim ve yeşil gıda yeşil fasulye ile boyama. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
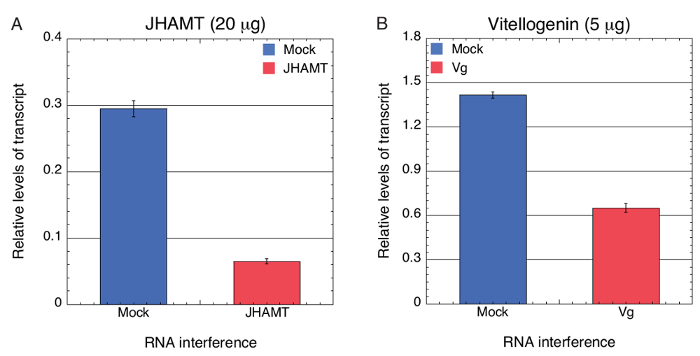
Resim 2 . Kantitatif RT-PCR analizleri RNAi aracılı tükenmesi JHAMT ve BMSB Vg sonra transkript düzeyini ölçmek için. Toplam RNA 3 bireysel BMSB 4th INSTAR perileri üzerinden beslenen JHAMT(a)20 µg (0,067 µg/µL) ve Vg (B) 5 µg (0.017 µg/µL) dsRNAs GKD2O 300 µL içinde yeşil fasulye segmentlerinin teslim, izole edildi ve transkript düzeyleri qPCR tarafından ölçüldü. LacZ dsRNA (sahte) bir negatif kontrol görev yaptı. BMSB 18s RNA RNA kurtarma doku farklılıkları için düzeltmek için bir iç standart olarak kullanılmıştır. Rapor-den sonuçlanmak are üç biyolojik çoğaltır ve hata çubukları SEM gösterir Bir tek yönlü Varyans analizi (ANOVA) veri, p < 0,0001 istatistiksel anlamlılık için test etmek için gerçekleştirildi. Güneş ve ark. yeniden sonuçları 62 Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 3 . Harlequin hata tedavisinde oral teslimat (M. histrionica ) bebek collard yeşillik kullanarak. Organik Bebek collard yeşillik % 0,2 sodyum hipoklorit ile yıkanmış, kesilmiş ve(a)Dnaz/RNase free GKD2O veya (B) Dnaz/RNase free GKD2 lik 300 µL içeren bir 2 mL kap-az microcentrifuge tüp içinde dalmış O çözüm 3 saat süreyle yeşil gıda boyası ile. Üç 4 INSTAR HB perileri 24 saat açlıktan sonra kültür damarlarının yerleştirilir ve bu collard yeşillik üzerinde 3 gün boyunca beslemek için izin. 3. gün sonrası beslenme gözlenen salgılarının beyaz okları gösterir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 4 . Kök ve yaprak sprey uygulama narenciye ağaçları ve fidan sırılsıklam. Seçilen bitki veya fidan önceden kullanmak için 2-3 gün boyunca toprağı nemli ama tamamen kuru kurumasına izin sulanan değil. (A)ilk ağaçların tepesinde ve dsRNA çözüm Dnaz/RNase ücretsiz su (0.5 mg/mL) 200 mL uygulanan el ile pompa püskürtülen ilaç şişe alt tepeye. (B) dsRNA 100 mL çözüm (1 mg/mL) Dnaz/RNase free su toprak fidan kısmen kuru topraklarda uygulandı. (C) 100 mL dsRNA çözeltisi (1 mg/mL) Dnaz/RNase ücretsiz su yaklaşık 3 h. (D) için fidan çıplak köklerine uygulanan ACP dsRNA çıplak kökleri tarafından emilir fidan beslenirler artan ACP ölüm gösterdi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 5 . Narenciye fide ağaç gövde enjeksiyon. Narenciye fide yaklaşık 1 m boyunda 1.7 mg/mL dsRNA ile enjekte edildi. (A)matkap delikleri narenciye fidan 10 mm çapı matkap enjektör bitki kök eklemek için kullanma içinde. Bakır maruz kalan her enjektör ucunu kaçağı önlemek için film sızdırmazlık ile bir 0.6 cm (¼ inç) geniş bir şerit sarılıydı. (B) enjektörleri 6 mL renkli çözeltisi ile dolu fide kök (gövde) için uygulandı. Enjektörler çözümün tam alımı için yaklaşık 6-10 h için yerinde kalmıştı. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 6 . Kil toprak değişiklik teslim dsRNA bitkiler toprak ile içine. Yeni bir satır, malzeme teslim etme: bir toz ücretsiz nükleik asit taşıyıcı toprakların anlamazdın bitkiler için dsRNA gibi aktif maddeler teslim kullanmak için kil ve sonuçta böcekler içine. (A)çiğ kil ve (B) pişmiş kil heykelde su hoşgörü/saklama. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Potansiyel H. halys hedef genlerin | |||
| Katılım | Boyutu | Gen adı/Homoloji | |
| XP_014293026.1 | 491 | Vitellogenin-A1-gibi (Vg) (Olası izoformlarının: vitellogenin 2 gibi izoformu X1 XP_014291483.1; vitellogenin-2-gibi izoformu X2 XP_014291484.1). | |
| XP_014290953.1 | 545 | Juvenil hormon asit O Metiltransferaz gibi (JHAMT) (Olası homolog: Juvenil hormon asit O-Metiltransferaz XP_014283772.1). | |
| Astar | |||
| PCR | |||
| Gen adı/Homoloji | Astar adı | Sıra | |
| VG | BMSB Vitellog P2 F | CAATTTGATCCACCGACTGTT | |
| VG | BMSB Vitellog P2 R | CCGCATGAATCTTACTCTGGA | |
| JHAMT | BMSB JH P1 F | GGATGCTTATGAATAATCCAG | |
| JHAMT | BMSB JH P1 R | GTATAGGATTGCCATTTTGG | |
| T7 PCR | |||
| VG | T7 BMSB Vitellog P2 4263 F | GAATTAATACGACTCACTATAGGGAGACCAAAGTTGGAAGGGAATGA | |
| VG | T7 BMSB Vitellog P2 4753 R | GAATTAATACGACTCACTATAGGGAGACCGCATGAATCTTACTCTGGA | |
| JHAMT | BMSB JH T7 P1 F | GAATTAATACGACTCACTATAGGGAGAGGATGCTTATGAATAATCCAG | |
| JHAMT | BMSB JH T7 P1 R | GAATTAATACGACTCACTATAGGGAGAGTATAGGATTGCCATTTTGG | |
| LacZ | T7 LacZ RNAi F | GAATTAATACGACTCACTATAGGGAGATGAAAGCTGGCTACAGGA | |
| LacZ | T7 LacZ RNAi R | GAATTAATACGACTCACTATAGGGAGAGCAGGCTTCTGCTTCAAT | |
| AK | dsAK-F | TAATACGACTCACTATAGGGAGTGGCATTCTTGTATGGCGTA | |
| AK | dsAK-R | TAATACGACTCACTATAGGGAGGCCTGCAAGAATCTGTCTCC | |
| AK | dsAK 50-F | TAATACGACTCACTATAGGGAGTGGCATTCTTGTATGGCGTA | |
| AK | dsAK 50-R | TAATACGACTCACTATAGGGAGTGAAGCCCTTGTGGTAGTC | |
| AK | dsAK 30-F | TAATACGACTCACTATAGGGAGACCCGGACTCTGGAGTAGG | |
| AK | dsAK 30-R | TAATACGACTCACTATAGGGAGGCCTGCAAGAATCTGTCTCC | |
| GFP | dsGFP-F | TAATACGACTCACTATAGGGAGCCAACACTTGTCACTACTTTCTCTT | |
| GFP | dsGFP-R | TAATACGACTCACTATAGGGAGGTAATGGTTGTCTGGTAAAAGGA | |
| qPCR | |||
| VG | RT Vitellog P2 F | TTGATAGTTGTTTGGATTTTGAAGGT | |
| VG | RT Vitellog P2 R | TCTTACTTGATCAGCGCTCAGAA | |
| JHAMT | BMSB JH RT P1 F | AGGAAAACCCAAAATGGCAAT | |
| JHAMT | BMSB JH RT P1 R | ATGTATTCTTCTTTTGGATCTTTTCTTGAG | |
| 18S | BMSB 18S F3 | ATGCCCCCGCCTGTCCTTATT | |
| 18S | BMSB 18S R3 | TGAAAGCAGCCTGAATAGTGG | |
| GFP | GFP-F | GGTAAAAGGACAGGGCCATC | |
| GFP | GFP-R | TCAAGGAGGACGGAAACATC | |
| AK | AK quant-F | CGGACTTGAGGGAGAACTGA | |
| AK | AK quant-R | GTGGTAGATACCGCGACCAG | |
| bir küvet | a-küvet-F | GCGTCTCTTCGGTTTGACGG | |
| bir küvet | a-küvet-R | CACTTCACCATCTGGTTGGC | |
Tablo 1. RNAi Oligonükleotid dizileri. Genler ve transkript düzeyleri analiz etmek için PCR parçaları, dsRNA ve qPCR astar oluşturmak için kullanılan oligonucleotides listelenmiştir.
Ek Video 1: Agars ve jelleri emiciler teslimat ve dsRNA sürekli salınması için olarak. Sentetik veya doğal agars ve jelleri yem veya diyetler çeşitli eklembacaklılar için kullanılan dsRNA çözüm ile sulu. Bu videoyu indirmek için buraya tıklayınız
Tartışmalar
RNAi gen biyolojik işlev ve düzenleme, böcek zararlıları19,68,69,70, yönetimi için kullanılmak üzere büyük potansiyeli keşfetmek için önemli bir araç olarak kanıtlamıştır 71. tasarım ve belirli bir böcek türü ve karşılık gelen dsRNA(s) böcek için teslim yöntemi susturulması için uygun bir gene(s) seçim ikisi son derece önemlidir. Bazı yöntemleri avantajları ve diğer sınırlamalar sunabilir gibi dsRNA bir böcek sunmak için en iyi yöntem ampirik olarak, göreli doz seçimi'dır, birlikte belirlenmelidir. Sonuçta çevre serbest bırakılması için uygun olabilir bir moleküler biopesticide gelişimi için mümkün, verimli ve avantajlı teslim yöntemi gereklidir. Örneğin, topikal uygulanan dsRNA dsRNA teslim narenciye için böcek kontrolü ve asma42,44için etkili olduğu göstermiştir. Yemler, sukroz çözümleri, mantar veya bakteri dsRNA üretim kullanımı için doğrudan yenmesi, dsRNA bitkiler üzerine topikal uygulama veya belirli dsRNAs tarafından değiştirilmiş transgenik bitkiler, üretim gibi yenilikçi stratejiler geliştirme gelişmiş etkili RNAi tabanlı denetimler19,72.
İyi bir örnek burada özellikle etkisi ve küresel öneme sahip bir böcek haşere azaltmak için tasarlanmış dsRNA (Resim 1 ve Şekil 2) teslim etmek için taze fasulye kullanımı ile gösterilmiştir. Yeni geliştirilmiş sebze yeşil fasulye segmentlerinin aracılı dsRNA teslim iletişim kuralı'nı dalmış ve dsRNA ile doymuş BMSB'larva geliştirmede etkili bir şekilde hedef genlerin için belirli kullanılmıştır. Yeşil fasulye bir BMSB tarafından devoured birçok sebze ve bunlar çok dsRNA teslim etmek için bir araç olarak kullanılmıştır. Diğer ortamlarda dsRNA teslimat (test verileri gösterilmez) vardı ama büyük olasılıkla vasküler doku farklılıkları nedeniyle BMSB için beslenme sağlama başarısız oldu. Bu nedenle, yeşil fasulye segmentlerinin Sentezlenmiş vitro dsRNA BMSB perileri için teslim etmek için kullanılır. Nükleik asitler bitki veya bitkisel aracılı tekniği ile teslim potansiyel olarak BMSB (Şekil 2)62 JHAMT ve Vg genlerinde tükenmesi ile burada gözlemlediği gibi seçim böcek RNAi ikna etmek mümkün olabilir.
Bu sebze aracılı dsRNA teslim iletişim kuralı başarıyla teslim stratejileri RNAi sadece BMSB zamanda HB istimal collard yeşillik (şekil 3),-se bile ikna etmek için kullanılmış ve yöntemleri her gen ve böcek için optimize edilmiş olması gerekir. Bu nedenle, bu çeşitli yöntemler'dır de ilgi birden çok gen tek tek hedef olarak veya daha iyi fenotipik alellerle elde etmek için yığın en az iki dsRNAs tarafından test edilmesi tavsiye edilir. Birkaç yöntem dsRNA teslim edilmek üzere böcekler ve76 için kullanılan böcek hücre de dahil olmak üzere13,2273,74, mikroenjeksiyon75ve diğer teknikleri iliklerine kadar besleme özetlenebilir dsRNA alımını sistemik RNAi ikna etmek için. RNAi diğer böcekler tarafından yenmesi tedavi sigara transgenik bitkiler üzerindeki ikna etmek için dsRNA, sözlü teslimi için yeni yöntemler de keşfedilmiş (şekil 4, şekil 5ve şekil 6) olmuştur. Narenciye ağaçları dsRNAs kökleri yoluyla absorbe, dokunun (gövde enjeksiyonları) veya yaprak spreyleri42,44kök için gösterilmiştir. Daha önce narenciye ağaçları ve olgun üzüm şarapları AK gen ACP ve GWSS karşılık gelen böcek belirli dsRNA ile tedavi edilmiştir. Bu tedavi bitkiler bir artış mortalite ACP ve GWSS için çeşitli uzunlukları saat41,45kadar neden oldu. Birlikte bu dsRNA okudu böceklerde belirli genlerin ifade engelleyebilir bu sonuçlar gösterilmektedir.
Başarılı gen ifadesinin susturulması etkileyen sorunları öncelikle böcekler ve tükürük salgılarını veya hangi dsRNA47 bozulması için sorumlu olabilir bağırsak pH gut dokusunun ifade dsRNA enzimler (dsRNases) benzersiz grupları içerir ,77,78. Ancak, bu tür bozulma üstesinden gelmek için sistemik RNAi verimli böcekler dsRNA daha yüksek konsantrasyonlarda kullanmak ve/veya PEG diyet gene özgü dsRNA oral teslimat için böyle kepazelik62, üstesinden gelmek için kullanarak tarafından indüklenebilir 79. teslimat ve dsRNA alımını de stabilize yardımıyla taşıyıcı moleküllerin nano tanecikleri80 kitosan48gibi lipozomlar Lipofectamine 2000 ve Metafectene76, gibi polietilen glikol79, Kil nanosheets81ve karbon kuantum nokta50. Araştırmadır dsRNA gen belirli dsRNA ile infüzyon agar ve jel parçaları kullanarak etkili teslim geliştirmek için devam eden (gösterilen değil, veriler bkz: ek Video 4). Bu teknik dsRNA etkili bir doz teslim reçine veya agar gıda olarak yuva için infüzyon dsRNA taşıyabileceği karıncalar için kullanılabilir.
DsRNA kararlılığını ek olarak, uzun vadeli kalıcı dsRNA bitki dokularında, özellikle tarımsal ürün için önem taşıyor. bitki, meyve veya sebze Vaskular dokuları dağıtılan dsRNA xylem ve phloem azaltılmış enzim aktivitesi RNAi mekanizması ikna etmek için böcekler tarafından yutulur önce birikebilir. Kesin nükleik asitler ortamında birikimi pek mümkün olur, böylece uygulamalar dsRNA için kısa bir süre için gibi 6 gündür yeşil fasulye veya uzun toprak62,82 36 h için kalıcı gerekli olabilir. Ancak, Neena vd. nanosheets erken bozulması olarak büyük dsRNAs korumak gösterdi iyi aracılık olarak sürekli salınımlarını yaprak yüzeylerde en az 30 gün81bir süre içinde.
Genel olarak burada ele dsRNA teslim stratejileri böcek belirli genler zararlı yönetimi için susturmak için kullanılabilir. DsRNA bitkiler sulama suyu, kök drench veya gövde enjeksiyon yoluyla tedarik kök besleyiciler, etkili yöntem şu anda kullanılabilir olduğu gibi zararlı böcekler için etkili bir strateji olabilir. Bir taşıyıcı ya da kil veya agar gibi orta sabitleme dsRNA teslimini doğrudan toprak alımı için bitkiler tarafından eklenebilir. Bir ana nedenlerinden aracılı RNAi moleküler biopesticides gelişimi yavaş ilerleme için verimli RNAi ve istikrar çevre koşulları83altında başlatmak için verimli bir şekilde sözlü teslim teknikleri eksikliği oldu. Burada özetlenen yöntemler gelecekte nükleik asit aracılı gen tedavileri susturmak teslim etmek için bitki için kullanılabilir oral teslimat sap besleme gibi böcekler küresel gıda üretiminde böcek hasarı azaltmak ve sürdürülebilir ekolojik haşere geliştirmek için çiğneme yönetimi.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Yazarlar, minnetle BMSB HB deneme için düzenlemek ve kolonileri korumak için Donald Weber ve Megan Herlihy (USDA, ARS Beltsville, MD) kabul edersiniz; ve Maria T. Gonzalez, Salvador P. Lopez, (USDA, ARS, Fort Pierce, FL) ve Jackie L. Metz (University of Florida, Fort Pierce, FL) koloni bakım, numune hazırlama ve analiz için.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BMSB (H. halys) insects | USDA | ||
| ACP (D. citri) insects | USDA | ||
| organic green beans | N/A | ||
| Citrus plants | USDA | ||
| sodium hypochlorite solution | J.T. Baker | ||
| green food coloring | McCormick & Co., Inc | ||
| Thermo Forma chambers | Thermo Fisher Scientific | ||
| Magenta vessel (Culture) | Sigma | ||
| Primers | IDT DNA | ||
| SensiMix SYBR | Bioline | ||
| qPCR ABI 7500 | Applied Biosystems | ||
| Spray bottle | N/A | ||
| Parafilm | American Can Company | ||
| TaKaRa Ex Taq | Clontech | ||
| QIAquick | Qiagen |
Referanslar
- Hoebeke, E. R., Carter, M. E. . Halyomorpha halys (Stǻl)(Heteroptera: Pentatomidae): a polyphagous plant pest from Asia newly detected in North America. , (2003).
- Leskey, T. C., Hamilton, G. C., et al. Pest Status of the Brown Marmorated Stink Bug, Halyomorpha Halys in the USA. Outlooks on Pest Management. 23 (5), 218-226 (2012).
- Peiffer, M., Felton, G. W. Insights into the Saliva of the Brown Marmorated Stink Bug Halyomorpha halys (Hemiptera: Pentatomidae). PloS one. 9 (2), e88483 (2014).
- Anderson, B. E., Miller, J. J., Adams, D. R. Irritant contact dermatitis to the brown marmorated stink bug, Halyomorpha halys. Dermatitis : contact, atopic, occupational, drug. 23 (4), 170-172 (2012).
- Mertz, T. L., Jacobs, S. B., Craig, T. J., Ishmael, F. T. The brown marmorated stinkbug as a new aeroallergen. The Journal of allergy and clinical immunology. 130 (4), 999-1001 (2012).
- McClean, A. P. D., Schwarz, R. E. Greening or blotchy-mottle disease of citrus. Phytophylactica. 2 (3), 177-194 (2012).
- Bové, J. M. Huanglongbing: a destructive, newly-emerging, century-old disease of citrus. Journal of Plant Pathology. 88 (1), 7-37 (2006).
- Kuhar, T., Morrison, R., Leskey, T., Aigner, J. . Integrated pest management for brown marmorated stink bug in vegetables. , (2016).
- Tiwari, S., Mann, R. S., Rogers, M. E., Stelinski, L. L. Insecticide resistance in field populations of Asian citrus psyllid in Florida. Pest management science. 67 (10), 1258-1268 (2011).
- Baum, J. A., Bogaert, T., et al. Control of coleopteran insect pests through RNA interference. Nature Biotechnology. 25 (11), 1322-1326 (2007).
- Hannon, G. J. RNA interference. Nature. 418 (6894), 244-251 (2002).
- Mello, C. C., Conte, D. Revealing the world of RNA interference. Nature. 431 (7006), 338-342 (2004).
- Macrae, I. J., Zhou, K., et al. Structural basis for double-stranded RNA processing by Dicer. Science(New York, N.Y.). 311 (5758), 195-198 (2006).
- Bernstein, E., Caudy, A. A., Hammond, S. M., Hannon, G. J. Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature. 409 (6818), 363-366 (2001).
- Ketting, R. F., Fischer, S. E., Bernstein, E., Sijen, T., Hannon, G. J., Plasterk, R. H. Dicer functions in RNA interference and in synthesis of small RNA involved in developmental timing in C. elegans. Genes & development. 15 (20), 2654-2659 (2001).
- Agrawal, N., Dasaradhi, P. V. N., Mohmmed, A., Malhotra, P., Bhatnagar, R. K., Mukherjee, S. K. RNA interference: biology, mechanism, and applications. Microbiology and molecular biology reviews : MMBR. 67 (4), 657-685 (2003).
- Martinez, J., Patkaniowska, A., Urlaub, H., Lührmann, R., Tuschl, T. Single-stranded antisense siRNAs guide target RNA cleavage in RNAi. Cell. 110 (5), 563-574 (2002).
- Bartel, D. P. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 116 (2), 281-297 (2004).
- Timmons, L., Fire, A. Specific interference by ingested dsRNA. Nature. 395 (6705), 854 (1998).
- Clemens, J. C., Worby, C. A., et al. Use of double-stranded RNA interference in Drosophila cell lines to dissect signal transduction pathways. Proceedings of the National Academy of Sciences of the United States of America. 97 (12), 6499-6503 (2000).
- Saleh, M. C., van Rij, R. P., et al. The endocytic pathway mediates cell entry of dsRNA to induce RNAi silencing. Nature cell biology. 8 (8), 793-802 (2006).
- Amdam, G. V., Simões, Z. L. P., Guidugli, K. R., Norberg, K., Omholt, S. W. Disruption of vitellogenin gene function in adult honeybees by intra-abdominal injection of double-stranded RNA. BMC biotechnology. 3, 1 (2003).
- Whyard, S., Singh, A. D., Wong, S. Ingested double-stranded RNAs can act as species-specific insecticides. Insect biochemistry and molecular biology. 39 (11), 824-832 (2009).
- Huvenne, H., Smagghe, G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: a review. Journal of Insect Physiology. 56 (3), 227-235 (2010).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391 (6669), 806-811 (1998).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Gatehouse, H. S., Gatehouse, L. N., Malone, L. A. Amylase activity in honey bee hypopharyngeal glands reduced by RNA interference. Journal of Apicultural. , (2004).
- Jaubert-Possamai, S., Le Trionnaire, G., Bonhomme, J., Christophides, G. K., Rispe, C., Tagu, D. Gene knockdown by RNAi in the pea aphid Acyrthosiphon pisum. BMC biotechnology. 7, 63 (2007).
- Martín, D., Maestro, O., Cruz, J., Mané-Padrós, D., Bellés, X. RNAi studies reveal a conserved role for RXR in molting in the cockroach Blattella germanica. Journal of Insect Physiology. 52 (4), 410-416 (2006).
- Bansal, R., Mittapelly, P., Chen, Y., Mamidala, P., Zhao, C., Michel, A. Quantitative RT-PCR Gene Evaluation and RNA Interference in the Brown Marmorated Stink Bug. PloS one. 11 (5), e0152730 (2016).
- Terenius, O., Papanicolaou, A., et al. RNA interference in Lepidoptera: an overview of successful and unsuccessful studies and implications for experimental design. Journal of Insect Physiology. 57 (2), 231-245 (2011).
- Sparks, M. E., Shelby, K. S., Kuhar, D., Gundersen-Rindal, D. E. Transcriptome of the Invasive Brown Marmorated Stink Bug, Halyomorpha halys (Stål) (Heteroptera: Pentatomidae). PloS one. 9 (11), e111646 (2014).
- Tabara, H., Grishok, A., Mello, C. C. RNAi in C. elegans: soaking in the genome sequence. Science (New York, N.Y.). 282 (5388), 430-431 (1998).
- Baum, J. A., Roberts, J. K. Chapter Five - Progress Towards RNAi-Mediated Insect Pest Management. Insect Midgut and Insecticidal Proteins. 47, 249-295 (2014).
- Walshe, D. P., Lehane, S. M., Lehane, M. J., Haines, L. R. Prolonged gene knockdown in the tsetse fly Glossina by feeding double stranded RNA. Insect Molecular Biology. 18 (1), 11-19 (2009).
- Turner, C. T., Davy, M. W., MacDiarmid, R. M., Plummer, K. M., Birch, N. P., Newcomb, R. D. RNA interference in the light brown apple moth, Epiphyas postvittana (Walker) induced by double-stranded RNA feeding. Insect Molecular Biology. 15 (3), 383-391 (2006).
- Bautista, M. A. M., Miyata, T., Miura, K., Tanaka, T. RNA interference-mediated knockdown of a cytochrome P450, CYP6BG1, from the diamondback moth, Plutella xylostella, reduces larval resistance to permethrin. Insect biochemistry and molecular biology. 39 (1), 38-46 (2009).
- Maori, E., Paldi, N., et al. IAPV, a bee-affecting virus associated with Colony Collapse Disorder can be silenced by dsRNA ingestion. Insect Molecular Biology. 18 (1), 55-60 (2009).
- Hunter, W., Ellis, J., Hayes, J., Westervelt, D., Glick, E. Large-scale field application of RNAi technology reducing Israeli acute paralysis virus disease in honey bees (Apis mellifera, Hymenoptera: Apidae). PLoS Pathogens. 6 (12), e1001160 (2010).
- Christiaens, O., Smagghe, G. The challenge of RNAi-mediated control of hemipterans. Current Opinion in Insect Science. 6, 15-21 (2014).
- Hunter, W. B., Hail, D., Tipping, C., Paldi, N. RNA interference to reduce sharpshooters, the glassy-winged sharpshooter, and the Asian citrus psyllid. Symposium. , 24-27 (2010).
- Hunter, W. B., Glick, E., Paldi, N., Bextine, B. R. Advances in RNA interference: dsRNA treatment in trees and grapevines for insect pest suppression. Southwestern Entomologist. , (2012).
- Hail, D. A., Dowd, S., Hunter, W. H., Bextine, B. R. Investigating the transcriptome of the potato psyllid (Bactericera cockerelli): toward an RNAi based management strategy. , 183-186 (2010).
- de Andrade, E. C., Hunter, W. B. RNA Interference-Natural Gene-Based Technology for Highly Specific Pest Control (HiSPeC). RNA INTERFERENCE. , (2016).
- Taning, C. N. T., Andrade, E. C., Hunter, W. B., Christiaens, O., Smagghe, G. Asian Citrus Psyllid RNAi Pathway - RNAi evidence. Scientific reports. 6, 38082 (2016).
- Andrade, E. C., Hunter, W. B. RNAi feeding bioassay: development of a non-transgenic approach to control Asian citrus psyllid and other hemipterans. Entomologia Experimentalis et Applicata. 162 (3), 389-396 (2017).
- Joga, M. R., Zotti, M. J., Smagghe, G., Christiaens, O. RNAi Efficiency, Systemic Properties, and Novel Delivery Methods for Pest Insect Control: What We Know So Far. Frontiers in physiology. 7, 553 (2016).
- Zhang, X., Zhang, J., Zhu, K. Y. Chitosan/double-stranded RNA nanoparticle-mediated RNA interference to silence chitin synthase genes through larval feeding in the African malaria mosquito (Anopheles gambiae). Insect Molecular Biology. 19 (5), 683-693 (2010).
- Li-Byarlay, H., Li, Y., et al. RNA interference knockdown of DNA methyl-transferase 3 affects gene alternative splicing in the honey bee. Proceedings of the National Academy of Sciences of the United States of America. 110 (31), 12750-12755 (2013).
- Das, S., Debnath, N., Cui, Y., Unrine, J., Palli, S. R. Chitosan, Carbon Quantum Dot, and Silica Nanoparticle Mediated dsRNA Delivery for Gene Silencing in Aedes aegypti: A Comparative Analysis. ACS applied materials & interfaces. 7 (35), 19530-19535 (2015).
- Nimesh, S. Recent patents in siRNA delivery employing nanoparticles as delivery vectors. Recent patents on DNA & gene sequences. 6 (2), 91-97 (2012).
- Draz, M. S., Fang, B. A., et al. Nanoparticle-mediated systemic delivery of siRNA for treatment of cancers and viral infections. Theranostics. 4 (9), 872-892 (2014).
- Swevers, L., Raikhel, A. S., Sappington, T. W. Vitellogenesis and post-vitellogenic maturation of the insect ovarian follicle. Comprehensive. , (2005).
- Tufail, M., Takeda, M. Molecular characteristics of insect vitellogenins. Journal of Insect Physiology. 54 (12), 1447-1458 (2008).
- Hagedorn, H. H., Kunkel, J. G. Vitellogenin and vitellin in insects. Annual review of entomology. , (1979).
- Brandt, B. W., Zwaan, B. J., Beekman, M. Shuttling between species for pathways of lifespan regulation: a central role for the vitellogenin gene family?. Bioessays. , (2005).
- Murphy, C. T., McCarroll, S. A., et al. Genes that act downstream of DAF-16 to influence the lifespan of Caenorhabditis elegans. Nature. 424 (6946), 277-283 (2003).
- Shinoda, T., Itoyama, K. Juvenile hormone acid methyltransferase: a key regulatory enzyme for insect metamorphosis. Proceedings of the National Academy of Sciences of the United States of America. 100 (21), 11986-11991 (2003).
- Bellés, X. Beyond Drosophila: RNAi in vivo and functional genomics in insects. Annual review of entomology. 55, 111-128 (2010).
- Nouzova, M., Edwards, M. J., Mayoral, J. G., Noriega, F. G. A coordinated expression of biosynthetic enzymes controls the flux of juvenile hormone precursors in the corpora allata of mosquitoes. Insect biochemistry and molecular biology. 41 (9), 660-669 (2011).
- Huang, J., Marchal, E., Hult, E. F., Tobe, S. S. Characterization of the juvenile hormone pathway in the viviparous cockroach, Diploptera punctata. PloS one. 10 (2), e0117291 (2015).
- Ghosh, S. K. B., Hunter, W. B., Park, A. L., Gundersen-Rindal, D. E. Double strand RNA delivery system for plant-sap-feeding insects. PloS one. 12 (2), e0171861 (2017).
- Khrimian, A., Zhang, A., et al. Discovery of the aggregation pheromone of the brown marmorated stink bug (Halyomorpha halys) through the creation of stereoisomeric libraries of 1-bisabolen-3-ols. Journal of natural products. 77 (7), 1708-1717 (2014).
- Hall, D. G., Richardson, M. L., El-Desouky, A., Halbert, S. E. Asian citrus psyllid, Diaphorina citri, vector of citrus huanglongbing disease. Entomologia Experimentalis et Applicata. 146 (2), 207-223 (2012).
- Murphy, K. A., Tabuloc, C. A., Cervantes, K. R., Chiu, J. C. Ingestion of genetically modified yeast symbiont reduces fitness of an insect pest via RNA interference. Scientific reports. 6, 22587 (2016).
- San Miguel, ., K, J. G., Scott, The next generation of insecticides: dsRNA is stable as a foliar-applied insecticide. Pest management science. 72 (4), 801-809 (2016).
- Li, H., Guan, R., Guo, H., Miao, X. New insights into an RNAi approach for plant defence against piercing-sucking and stem-borer insect pests. Plant, cell & environment. 38 (11), 2277-2285 (2015).
- Hull, D., Timmons, L. Methods for delivery of double-stranded RNA into Caenorhabditis elegans. Methods in molecular biology (Clifton, N.J.). 265, 23-58 (2004).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Burand, J. P., Hunter, W. B. RNAi: future in insect management. Journal of Invertebrate Pathology. 112 Suppl, S68-S74 (2013).
- Rodrigues, T. B., Figueira, A. . Management of Insect Pest by RNAi-A New Tool for Crop Protection. , (2016).
- Baumann, A. M. T., Bakkers, M. J. G., et al. 9-O-Acetylation of sialic acids is catalysed by CASD1 via a covalent acetyl-enzyme intermediate. Nature communications. 6, 7673 (2015).
- Araujo, R. N., Santos, A., Pinto, F. S., Gontijo, N. F., Lehane, M. J., Pereira, M. H. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug Rhodnius prolixus (Hemiptera: Reduviidae) by dsRNA ingestion or injection. Insect biochemistry and molecular biology. 36 (9), 683-693 (2006).
- Wuriyanghan, H., Rosa, C., Falk, B. W. Oral Delivery of Double-Stranded RNAs and siRNAs Induces RNAi Effects in the Potato/Tomato Psyllid, Bactericerca cockerelli. PloS one. 6 (11), e27736 (2011).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods (San Diego, Calif). 30 (4), 313-321 (2003).
- Yu, N., Christiaens, O., et al. Delivery of dsRNA for RNAi in insects: an overview and future directions). Insect Science. , (2012).
- Allen, M. L., Walker, W. B. Saliva of Lygus lineolaris digests double stranded ribonucleic acids. Journal of Insect Physiology. 58 (3), 391-396 (2012).
- Wynant, N., Santos, D., Verdonck, R., Spit, J., Van Wielendaele, P., Vanden Broeck, J. Identification, functional characterization and phylogenetic analysis of double stranded RNA degrading enzymes present in the gut of the desert locust, Schistocerca gregaria. Insect biochemistry and molecular biology. 46, 1-8 (2014).
- Ghosh, S. K. B., Gundersen-Rindal, D. E. Double strand RNA-mediated RNA interference through feeding in larval gypsy moth, Lymantria dispar (Lepidoptera: Erebidae). European Journal of Entomology. 114, 170-178 (2017).
- Baigude, H., Rana, T. M. Delivery of therapeutic RNAi by nanovehicles. Chembiochem : a European journal of chemical biology. 10 (15), 2449-2454 (2009).
- Mitter, N., Worrall, E. A., et al. Clay nanosheets for topical delivery of RNAi for sustained protection against plant viruses. Nature plants. 3, 16207 (2017).
- Dubelman, S., Fischer, J., et al. Environmental fate of double-stranded RNA in agricultural soils. PloS one. 9 (3), e93155 (2014).
- Kola, V. S. R., Renuka, P., Madhav, M. S., Mangrauthia, S. K. Key enzymes and proteins of crop insects as candidate for RNAi based gene silencing. Frontiers in physiology. 6, 119 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır