Method Article
Méthodes de prestation orale ARN double-brin d’induire l’interférence d’ARN dans le phloème et insectes hémiptères plante-sap-alimentation
Dans cet article
Résumé
Cet article explique les nouvelles techniques mises au point pour l’administration orale de l’ARN double brin (dsRNA) à travers les tissus vasculaires des plantes pour l’interférence ARN (ARNi) en sève nourrir les insectes.
Résumé
Phloème et plantes sève alimentation insectes envahissent l’intégrité des cultures et des fruits pour récupérer des éléments nutritifs, dans le processus d’endommager les cultures vivrières. Insectes hémiptères représentent un certain nombre de ravageurs économiquement importantes des plantes qui causent des dégâts aux cultures en se nourrissant de la sève. La punaise brune marmorated (BMSB), Halyomorpha halys (Heteroptera : Pentatomidae) et le psylle asiatique agrume (ACP), Kuwayama Diaphorina citri (Hemiptera : Liviidae) sont des insectes hémiptères introduits en Amérique du Nord, où ils sont un ravageur envahissant de spécialité de haute valeur, rangée et cultures vivrières de base et d’agrumes, ainsi qu’un ravageur de nuisance quand ils regroupent à l’intérieur. Résistance aux insecticides chez de nombreuses espèces a conduit au développement de méthodes alternatives de stratégies de lutte antiparasitaire. Double-stranded RNA (dsRNA)-médiée par l’interférence ARN (ARNi) est un gène silencieux mécanisme pour des études de génomique fonctionnelles qui a des applications potentielles comme un outil pour la gestion des ravageurs. DsRNA exogène synthétisée ou petits ARN interférents (siARN) peut déclencher silençage de génétique très efficace par le biais de la dégradation de l’ARN endogène, qui est homologue à celui présenté. Utilisation efficace et environnementale de l’ARNi comme biopesticides moléculaire pour le contrôle biologique d’insectes hémiptères exige la livraison in vivo de l’ARNdb en se nourrissant. Nous démontrons ici les méthodes pour la livraison de dsRNA aux insectes : chargement d’ARNdb en haricots verts par immersion et d’absorber de dsRNA de gène-spécifiques avec la livraison par ingestion orale. Nous avons également défini les méthodes de prestation des plantes non transgéniques à l’aide de pulvérisations foliaires, bassinage racine, injections de tronc ainsi que des granules d’argile, qui peuvent être essentielles pour la LIBERATION PROLONGEE d’ARNdb. La prestation efficace de dsRNA ingéré par voie orale a été confirmée comme un dosage efficace pour induire une diminution significative de l’expression des gènes ciblés, tels que l’hormone juvénile l’acide O-méthyltransférase (JHAMT) et de la vitellogénine (Vg). Ces méthodes novatrices représentent des stratégies pour la délivrance de dsRNA à utiliser en protection des végétaux et de surmonter les défis environnementaux pour les ravageurs.
Introduction
Insectes hémiptères comprennent certains des ravageurs plus économiquement significatifs d’agriculturebecause de leur capacité à atteindre la croissance démographique élevée et la propagation des maladies des plantes. Le BMSB, H. halys Stål, est un parasite envahissant introduite accidentellement dans l’hémisphère occidental à Allentown, en Pennsylvanie, d’Asie (Chine, Taiwan, Corée et Japon) avec la première observation en 19961. Depuis son introduction, BMSB a été détectée dans 43 États, avec des populations plus élevées dans le milieu de l’Atlantique (DE, MD, PA, New Jersey, Virginie et WV), ainsi qu’au Canada et en Europe et représente une menace potentielle pour l’agriculture2. Comme un parasite polyphage, BMSB peut susciter des dommages à environ 300 identifiés de plantes hôtes, y compris les cultures de grande valeur tels que des pommes, raisins, plantes ornementales, cultures de semences, le soja et maïs. Dommage est causé principalement due au mode d’alimentation dite de lacérer et chasse où l’animal perce la plante hôte avec son stylet aciculaires d’avoir accès aux nutriments entre les tissus vasculaires2,3. BMSB est aussi un parasite intérieur qu’ils peuvent trouver de résidence dans les bassins de vie tels que les écoles et les maisons en automne et hiver2. Produits chimiques et des aéroallergènes sortis BMSB auraient illicite réaction allergique chez les travailleurs de récolte de fruits. BMSB peuvent aussi contribuer à la maladie allergique conduisant à une dermatite de contact, conjonctivite et rhinite chez les personnes sensibles4,5. Un autre insecte hémiptère, l’ACP, d. citri Kuwayama (Hemiptera : Liviidae), est un ravageur important des agrumes et transmet les bactéries limitée dans le phloème (Candidatus Liberibacter asiaticus) provoquant le Huanglongbing (HLB), mieux connu comme citrus greening maladie6,7. HLB a été pour la première fois de la Chine du Sud et s’est propagé aux 40 différents asiatique, africain, océanien, du Sud et nord-américains pays7. Citrus greening est un problème dans le monde entier avec la menace des pertes économiques et financières en raison de la perte d’agrumes ; par conséquent, gestion des ACP est considéré comme primordial pour prévenir et contrôler la HLB.
Mesures pour un contrôle efficace de ces insectes nuisibles requiert habituellement l’application de pesticides chimiques qui sont relativement courtes a vécu. Stratégies de lutte insecticide chimique souvent manquent de stratégies de gestion de l’environnement sécuritaire ou ont diminué la sensibilité en raison de la résistance aux pesticides dans les populations de ravageurs8,9. Donc, le contrôle biologique des ravageurs avec biopesticides moléculaire est une alternative possible, mais son utilisation restera globalement modeste, et diverses espèces de parasitoïdes (p. ex., Trisolcus japonicus) peuvent également être efficaces comme biologiques naturels contrôles. Arni est un potentiel de nouvelles technologies pour la gestion des ravageurs envahissants avec biopesticides moléculaire10. Arni est un mécanisme de régulation génique bien décrite qui facilite le silence efficace génique post-transcriptionnel d’endogène ainsi que d’envahir les ARN doubles brins de façon séquence-spécifique, qui mène finalement à la régulation de l’expression génique à l’ARNm niveau11,12. En bref, lorsque dsRNA exogène est internalisé dans une cellule, qu'il est transformé en siARN par un membre de la superfamille de RNase III nucléase bidentates, appelée Dicer, évolutivement conservée en vers, mouches, plantes, champignons et mammifères13, 14 , 15. ces duplex siARN de 21 à 25 nucléotides est ensuite déroulé et intégré dans le complexe silencieux RNA-induced (RISC) comme guide RNAs. Ce complexe RISC-RNA permet l’appariement Watson-Crick base à complémentaires cibles ARNm ; Cela conduit finalement au clivage de la protéine Argonaute, une protéine de domaine multi contenant un domaine RNase H-like, qui dégrade l’ARNm correspondants et réduit la traduction des protéines, ce qui conduirait à post-transcriptionnel gene silencing16 , 17 , 18.
Arni pour la lutte antiparasitaire nécessite l’instauration d’ARNdb en vivo pour réduire au silence le gène d’intérêt, activant ainsi la voie de siARN. Diverses méthodes qui ont été utilisés pour la livraison de dsRNA aux insectes et aux cellules d’insecte pour induire RNAi systémique incluent nourrir10,19, tremper20,21,22de la microinjection, transporteurs comme les liposomes 23et autres techniques24. Arni a démontré chez Caenorhabditis elegans pour faire taire l’expression des gènes unc-22 par le feu et Mello25, suivi par précipitation dans l’expression des gènes crépus chez Drosophila melanogaster,26. Les premières études fonctionnelles utilisées microinjection pour livrer des dsRNA chez les insectes, tels que Apis mellifera22,27, Acyrthosiphon pisum,28,29de Blattella germanica, Halys H.30et lépidoptères (évaluées par Terenius et al. 31). microinjection est avantageuse pour livrer une dose précise et exacte sur le site d’intérêt chez l’insecte. Quoique ces piqûres septiques peuvent déclencher l’expression de gènes liés immunitaires due à un traumatisme32, par conséquent, écartant de sa pratique dans le développement agricole de biopesticides.
Une autre méthode de prestation des ARNdb en vivo est par trempage, qui implique ingestion ou absorption de dsRNA par suspension des animaux ou des cellules généralement dans le milieu extracellulaire contenant des ARNdb. Trempage a été utilisé pour induire efficacement Arni dans les cellules de culture de tissus Drosophila S2 pour inhiber en aval-de-Raf1 (DSOR1) mitogène-protéine kinase kinases (MAPKK)20, ainsi que chez c. elegans pour réduire au silence les POS-1 gène33. Cependant, dsRNA envoyée à l’aide de trempage est moins efficace pour induire l’ARNi contre microinjection20. Arni médiée silencieux chez un insecte à chiquer fut montrée à la chrysomèle des racines du maïs (WCR) (Diabrotica virgifera virgifera) en perfusant l’ARNdb dans une gélose artificiel alimentation10. De précédentes études ont résumé des méthodes permettant de livrer des ARNdb infusé dans les régimes naturels spécifiques aux arthropodes34. Ces méthodes de livraison ont été déterminées plus efficace comparativement à des moyens artificiels de livraison ; comme dans le cas de la mouche tsé-tsé (Glossina morsitans morsitans), où égale précipitation d’un gène du système immunitaire a été observée quand les ARNdb a été livré par la farine de sang ou micro-injection35. De même, la livraison de dsRNA par les gouttelettes dans apple brun léger moth (Epiphyas postvittana)36, larves de teigne des crucifères (Plutella xylostella)37, ainsi que miel abeilles38,39 induite par ARNi efficace. Des expériences d’Arni plus efficaces dans hémiptère ont utilisé des injection d’ARNdb40 parce que l’administration orale d’ARNdb en insectes hémiptères est ardue car il doit être livré à travers les tissus vasculaires de la plante hôte. RNAi efficace s’observe également dans les pays ACP et vitreux ailes sharpshooter cicadelle (GWSS), Homalodisca vitripennis: dsRNA a été livré à travers agrumes et de vignes qui avaient absorbé des ARNdb dans les tissus vasculaires par bassinage racine, foliaire vaporisateurs, des injections de tronc ou absorption par boutures41,42,43,44,45,46. Cela a également entraîné le premier brevet pour dsRNA contre les pays ACP (2016, nous 20170211082 A1). Livraison des siARN et dsRNA à l’aide de supports tels que des nanoparticules et liposomes confère une stabilité et augmentation inhabituelle de l’ARNdb livré émergent rapidement23,47,48,49 ,,50. Une nouvelle classe de vecteurs à base de nanoparticules d’acides nucléiques pour in vitro et in vivo qui ont été résumées spécifiquement pour des applications thérapeutiques peuvent transmettre un potentiel immense comme vecteurs de livraison adapté51. Nanoparticules comme un véhicule de livraison pour l’ARNdb peuvent avoir des inconvénients dont la solubilité, hydrophobie ou bioaccumulation limitée52, mais une livraison aider ã polymère adapté peut compenser ces inconvénients. Développement et l’utilisation de la prestation des nucléotides émergent aussi appelés « antisens », qui sont simple brin ARN/ADN duplex46.
La vitellogenèse chez les arthropodes est une clé processus contrôlant la reproduction et régulée par l’hormone juvénile (JH) ou l’ecdysone, qui sont les inducteurs principaux de synthèse de la Vg de la masse grasse ; le Vg est finalement repris par l’ovocyte en développement par l’intermédiaire de l’endocytose médiée par le récepteur Vg53. VG est un groupe de polypeptides synthétisés extraovarially, qui est essentiel pour le développement de la protéine grands oeufs jaune vitellin54,55, et par conséquent, il est important dans la reproduction et vieillissement56. VG a été réduit au silence avec succès dans les nématodes57 ainsi que dans l’abeille à miel (Apis mellifera) où par l’appauvrissement de la couche de Vg ARN a été observée chez les adultes et œufs22. Arni silençage de médiation génique post-transcriptionnel de Vg a été testé car on pensait que son appauvrissement conduirait à un effet phénotypique observable telles que réduit la fertilité et la fécondité, pour éventuellement aider à contrôle BMSB. Le gène JHAMT qui code pour la S-adénosyl-L-méthionine (SAM)-dépendante JH acide O-méthyltransférase, catalyse l’étape finale de la JH biosynthèse voie58. Dans cette voie farnésyl pyrophosphate (FPP) est séquentiellement transformé farnésol, acide farnesoic, suivie de la conversion de méthyle farnesoate JH par JHAMT. Cette voie est conservée chez les insectes et arthropodes spécifiquement pour la métamorphose, un processus développemental réglementé par hormones59,60,,61. Chez b. mori, expression des gènes JHAMT et l’activité biosynthétique JH dans les corps allates suggèrent que la répression transcriptionnelle du gène JHAMT est cruciale pour la terminaison de JH biosynthèse58. Par conséquent, les gènes JHAMT et Vg ont été sélectionnés pour épuisement ciblée utilisant l’ARNi. Arni a également été testé dans les arbres d’agrumes pour le contrôle de l’ACP et GWSS. Arbres d’agrumes ont été traités avec dsRNA par bassinage racine, la tige de robinet (injections de tronc), ainsi que les pulvérisations foliaires avec ARN doubles brins contre insectes spécifiques arginine kinase (AK) transcriptions42,44. L’application topique de dsRNA a été détectée dans la canopée des arbres d’agrumes, ce qui indique une livraison efficace à travers les tissus de plantes vasculaires et a entraîné une mortalité accrue dans les pays ACP et GWSS41,42, 45.
Dans la présente étude, nous avons identifié une méthode de livraison d’alimentation naturelle pour les traitements tels que l’ARNdb. Cette nouvelle technique a ensuite été utilisée pour faire taire le JHAMT et le Vg mRNA à l’aide de gènes spécifiques ARN doubles brins en nymphes BMSB comme démontré plus tôt62. Ces nouveaux protocoles de livraison démontrés ici remplacent des systèmes de livraison RNA conventionnels qui utilisent des sprays topiques ou des microinjections. Légumes et fruits, tige robinet, sol Drenchage et absorbants d’argile en peuvent servir pour la livraison de dsRNA, ce qui est essentiel à la poursuite du développement de la gestion des ravageurs et pathogènes des biopesticides.
Protocole
1. BMSB élevage
- Arrière BMSB insectes selon les directives de pratique de laboratoire standard et décrites précédemment63.
- Élever des insectes ACP (d. citri) sur Citrus macrophylla dans une serre (22 ° C) et de la lumière naturelle. Utiliser l’ACP adulte, environ 5-7 jours après l’éclosion.
2. sélection des régions des gènes et la synthèse In Vitro d’ARNdb
- Sélectionner des gènes spécifiques pour BMSB de transcriptome publiées antérieurement profils32.
- S’assurer que les régions d’intérêt sélectionné varient entre 200 et 500 paires de bases.
- Effectuer l’amplification génique (PCR) en utilisant les conditions décrites ci-dessous pour générer des fragments liés avec le gène sélectionné d’intérêt de l’ADN génomique. Voir le tableau 1 pour les oligonucléotides de gène-spécifique.
- Réaction de PCR : dans un tube de PCR de 0,25 mL, mélanger 5 µL de 10 X PCR tampon, 4 µL de dNTP mélange (2,5 mM), 2 µL de matrice d’ADN (50 ng/µL), 2,5 µL de chaque des amorces 1 et 2 (10 µM), 0,25 µL de l’ADN polymérase (5 U/µL) , et jusqu'à 50 µL d’eau DNase/RNase librement.
- Condition PCR : Cycle de la réaction PCR pour amplifier la région d’intérêt à 95 ° C pendant 3 min, suivi de 30 cycles de 98 ° C pendant 10 s, 55 ° C pendant 30 s, 72° C pendant 1 min. Incuber la réaction à 72 ° C pendant une 10 mn supplémentaires purifier la réaction PCR en utilisant un kit de purification.
- Amplifier les fragments PCR obtenus plus loin avec des amorces spécifiques de gènes flanqués de la séquence du promoteur T7 RNA polymérase (5'-GAA TTA ATA CGA CCT acte ATA GGG AGA-3') tel que mentionné plus tôt62.
- Utiliser le gène LacZ comme témoin négatif (mock) pour RNAi.
NOTE : LacZ est un gène qui code pour la β-galactosidase amplifié à partir de l’ADN génomique Escherichiacoli (les amorces utilisées sont répertoriés dans le tableau 1). - Effectuer en vitro transcription pour produire des ARNdb comme décrit plus tôt62.
- Dissoudre et remettre en suspension l’ARNdb résultant dans 150 µL DNase/RNase d’eau libre, mesurer la concentration et stocker à-80 ° C pour une utilisation future.
3. livraison de dsRNA haricots verts à l’aide
- Select tôt 4ème stade BMSB nymphes éclore de la même masse d’oeufs et les affamer pour 24 h avant l’ARNdb alimentation.
- Sélectionnez minces certifiés biologiques vert haricots (Phaseolus vulgaris L.) et laver avec une solution d’hypochlorite de sodium 0,2 % pendant 5 min.
Remarque : Des haricots verts minces ont été choisis afin que les haricots peuvent facilement être logés dans les tubes de microcentrifuge de 2 mL. - Laver 3 fois avec les ddH2O et laisser sécher à l’air.
- Couper les haricots verts de l’extrémité du calice d’une longueur totale de 7,5 cm à l’aide d’une lame de rasoir propre.
- Plonger les haricots verts lavés et taillés dans un tube de microcentrifuge de cap-moins 2 mL contenant 300 µL de solution de contrôle (un 01:10 dilution du colorant alimentaire vert (ingrédients : eau, Propylène Glycol, Fd & C jaune 5, Fd & C bleu 1 et Propylparaben comme agent de conservation)).
- Faire des dilutions de l' in vitro synthétisé LacZ, JHAMT ou Vg ARN doubles brins par dilution 5 µg ou 20 µg dans 300 µL d’eau libre de RNase ni DNase pour donner une concentration finale de 0,017 µg/µL ou 0,067 µg/µL, respectivement.
- Plonger les haricots verts lavés et taillés dans un tube de microcentrifuge de cap-moins 2 mL contenant 300 µL de solution de dsRNA (à l’étape 3.6).
- Emballer et sceller les bords des tubes de microcentrifuge enfermant les grains immergés pour éviter l’évaporation de la solution de l’ARNdb et à empêcher les animaux de pénétrer dans le tube de microcentrifuge.
- Placez ces tubes de manière verticale à température ambiante pendant 3 h permettre à la solution de dsRNA de charger tout au long de l’haricot vert par capillarité.
- Placer les tubes dans les récipients de culture propre (polypropylène). Place trois affaméth 4 larves de stade BMSB dans les récipients de culture.
- Traiter les trois animaux par récipient de culture chacune contenant trois haricots verts avec la solution de coloration ou de dsRNA nourriture verte. Maintenir les insectes à 25 ° C et 72 % d’humidité relative, sous une photopériode de 16 L : 8 dans un incubateur.
- Laisser les insectes pour se nourrir sur les haricots verts (immergés et absorbé avec dsRNA) pendant 5 jours mais reconstituer avec des régimes frais de dsRNA perles de traitement vert après 3 jours.
4. en temps réel Quantitative (qPCR) analyse d’Expression suivants Arni Mediated silençage génique dans BMSB
- Mesurer l’effet de l’ARNi sur les niveaux d’expression de transcription de qPCR.
- Isoler l’ARN total des animaux traité de dsRNA et synthétiser l' ADNc62.
- Configurer les réactions de qPCR utilisant un système PCR en temps réel et les amorces énumérés au tableau 1. Utilisez la condition suivante de cyclisme qPCR : 95 ° C pendant 10 min suivi de 40 cycles de 95 ° C pendant 15 s, 60 ° C pendant 1 min, ainsi que de l’étape de dissociation dont 95 ° C pendant 15 s, 60 ° C pendant 1 min, 95 ° C pendant 15 s et 60 ° C pendant 15 s.
- Déterminer les normes de qPCR : utiliser la dilution en série de l’ADNc préparé à partir d’ARN total isolé provenant d’un animal normal comme un étalon de référence pour la quantification.
- Utiliser l’ARN 18 s BMSB comme étalon interne pour corriger les différences dans la récupération de RNA de tissus32.
5. foliaire Application dans les grands arbres d’agrumes en pot et semis
Remarque : Les plantes du cultivar «Carrizo» citrange (Citrus sinensis XPoncirus trifoliata, Rutaceae), agrume ont été maintenus en serre sous la lumière naturelle et de la température, cultivés en contenants de 1,2 L. Les plantes ont été constamment taillés pour favoriser la croissance des nouvelles pousses foliaires, appelée « fleur ». ACP préfère l’alimentation et la ponte sur les nouvelles pousses des agrumes64.
- Sélectionner des plantes ou des semis et ne pas les arroser pendant 2-3 jours avant de les utiliser pour laisser le sol sécher à l’humidité, mais pas complètement secs.
- À l’aide d’un vaporisateur à pompe de main s’appliquent un 200 mL de solution de dsRNA (0,5 mg/mL) à l’aile inférieure (Figure 4 a).
NOTE : Préparez le ci-dessus mentionné dsRNA solutions dans l’eau libre de DNase/RNase. - Après application de pulvérisation, laissez agir la solution appliquée dsRNA à être complètement absorbé par les feuilles.
NOTE : Citronniers absorbé l’ARNdb appliquée, et puis les feuilles de deux nouvelles pousses ou de branches qui relevaient avant application, ont été extraits ; dsRNA était détectable à l’aide de qPCR et circulation systémique dans les feuilles arbre de la canopée supérieure dans 3-4 h44,45,46. - Déguster les nouvelles pousses des arbres précédemment surmontées après que 25-40 jours en recueillant environ 10 feuilles de l’extrémité des quatre branches. Extraire l’ARN total et de les analyser par transcription inverse PCR (RT-PCR) et qPCR pour la présence de la gâchette de dsRNA appliquée en utilisant les amorces énumérés au tableau 1 et précédemment décrit des méthodes46.
Remarque : Le prélèvement de l’échantillon total isolement d’ARN, RT-PCR et qPCR ont été réalisées comme décrit précédemment46. - De même, par voie topique pulvériser dsRNA de 10 mL pour la région du bas d’un semis ou le feuillage des petits arbres en pot.
NOTE : Insectes Hémiptères (ACP et GWSS) ont eu un accès alimentation normalement après 24 h, poste de traitements sur les nouvelles pousses (feuilles) qui n’avait pas été aspergé directement, ou qui a eu pour semaines plus tard, ou de plantes entières. Ce produit des insectes qui ont été testés positifs pour l’ARNdb à 3, 6 et 10 jours, après l’alimentation.
6. sol/racines bassinage demande en gros ou petit en pot semis et agrumes
- Sélectionner des plantes ou des semis et ne pas les arroser pendant 2-3 jours avant de les utiliser pour laisser le sol sécher à humide mais ne pas complètement secs (cela crée un espace d’air pour contenir la solution liquide à appliquer).
- Ajouter 1 L de solution de dsRNA (0,2 mg/mL) au sol de grandes plantes en pot (environ 2,5 m) et ajouter 1 L d’eau (chaser) après 1 h.
- Appliquer des arbres de 100 mL de solution de dsRNA (1,33 mg/mL) au sol de 1 m de hauteur en pot dans les sols partiellement secs.
- Pour les petites plantules, appliquer 10 mL de solution de dsRNA (1 mg/mL) au sol dans les cônes ou à racines nues (Figure 4 b, C).
- Laissez les plantes qui reçoivent la solution de dsRNA appliquée comme un bassinage sol tremper pendant 30 min. Puis appliquez seul traitement de l’eau plate pour faciliter l’absorption par les racines (20 mL pour les plantes en contenants jaunes) ou 100 mL si grandes plantes en pots sont > 1 gallon.
NOTE : Appliqué topiquement dsRNA à feuillage entraîné détection extrémité distale dans la plupart des branches au sein des traitements post 3 à 6 h, montrant la circulation systémique à travers les arbres. Nouvelles branches de croissance étaient positifs dsRNA à 60-90 jours post traitements. Boutures sont fournis aux insectes (ACP et GWSS) dans un ARNdb alimentation biologique44.
7. tige robinet (Injection de tronc d’arbre) demande, dans les grands arbres d’agrumes en pot et semis
- Sélectionnez les semis d’agrumes, nouveau ou environ 3,5 ans vieilles centrales d’injection d’ARNdb en utilisant la tige robinet méthode (injections de tronc).
- Percer des trous dans les agrumes à l’aide d’une perceuse et un foret de 10 mm, prenant soin de ne pas pour dépasser 2 cm, ou environ la moitié du diamètre de la tige.
- Enroulez le bout de cuivre de chaque injecteur 4 - 6 fois avec une bande large de 0,6 cm (¼ po) de cachetage de film pour éviter les fuites, près de la pointe.
- Verser les injecteurs de tronc d’arbre 6 mL (1,7 mg/mL) de solution de dsRNA diluée dans l’eau libre de DNase/RNase (notée ici en tant que solution colorée).
- Injecter la solution dans le tronc de l’arbre et laissez l’injecteur dans le coffre pour 6 à 10 h permettre l’absorption de la solution de dsRNA. Laisser les insectes pour se nourrir sur les boutures d’arbres traités à 3, 10 et 30 jours qui suivent le traitement.
Remarque : L’ARNdb injecté à l’aide de la méthode d’injection de tronc a persisté dans les arbres pour une période de 30 à 60 jours41,42,44. Validation d’Arni a été effectuée par qPCR utilisant les amorces énumérés au tableau 1.
8. dsRNA Granules argile traitée pour la livraison aux insectes par sol
- Versez l’argile absorbante dans un tube conique de 50 mL de la marque de 35 mL (environ 30 g d’argile absorbante) sur le tube.
- Verser 20 mL de solution de dsRNA diluée dans l’eau libre de DNase/RNase (100 µg/mL) dans le tube pour mouiller toutes les absorbants. Boucher le tube à fond conique, incliner le tube afin d’enlever l’air et bouchon du tube.
- Placer le tube droit et laissez reposer pendant 1-2 min pour les particules d’argile absorber la solution.
- Ajouter assez d’argile imbibée d’ARNdb dans le mélange de sol pour remplir un pot de 1 gallon.
- Mélanger et mettre le sol à la main pour bien mélanger l’argile imbibée d’ARNdb dans le sol.
- Utilisez ce sol pour rempoter les semis choisis pour le traitement de l’ARNdb.
- Eau du sol avec 200 mL d’eau plate sans ARNdb. Après 30 min à 1 h, suivre avec 100 mL d’eau plate. Après 24h, mettre la plante sur un calendrier d’arrosage normal.
- Test 4-6 feuilles de plantes en pot traitées avec absorbants d’argile et de dsRNA chaque mois de post traitement de dsRNA en recueillant les feuilles plus apicales de la croissance des plantes nouvelles.
NOTE : Plants ou boutures de ces végétaux traités sont nourris aux insectes n’importe quel moment après 24h post traitement et ont été capable de livraison Arni pour jusqu'à un an pour les insectes (données non publiées).
Résultats
Livraison de légumes dsRNA de médiation en se nourrissant de larves de stade BMSB 4ème a été testé pour le développement des biopesticides moléculaires à l’aide de RNAi de ravageurs envahissants. BMSBs flux à l’aide de leurs stylets aciculaires par un mécanisme appelé lacerate, puis rincez, qui provoque des dégâts considérables aux cultures. Mince de haricots verts biologiques, P. vulgaris L., ont servi à vérifier si les éléments nutritifs ou dsRNA pouvait être livré en vivo à BMSB à alimentation3. Segments de haricots verts ont été immergés dans l’eau libre de DNase/RNase ou une solution d’eau et le colorant alimentaire vert pour tester la livraison en BMSB (Figure 1 a). Le colorant alimentaire vert était utilisé comme un indicateur visuel d’imiter l’ARNdb. Le tissu vasculaire des haricots verts étaient saturés avec la coloration de nourriture verte en raison de l’écoulement de la solution de couleur verte par le phloème par action capillaire62. Nymphes BMSB ont été observées sur les segments des haricots verts d’alimentation en y insérant leurs stylets les tissus vasculaires des haricots verts (Figure 1 b). Gouttelettes d’excréments de couleur verte ont été observés après des jours 2 et 3 chez les insectes qui ont été nourris sur haricots imprégnées de nourriture verte coloration indiquant le matériel livré a été ingéré par voie orale et traversé l’intestin avant l’excrétion (Figure 1, D ).
Par la suite, nous avons testé si déplétion significative de l’expression des gènes ciblés a été réalisée à l’aide de la prestation de haricot vert médiée par des ARNdb spécifique BMSB par ingestion en BMSB. Segments de l’haricot vert ont été immergés et absorbé une solution de 0,067 µg/µL (20 µg dans 300 µL d’eau libre de DNase/RNase) ou 0,017 µg/µL (5 µg dans 300 µL d’eau libre de DNase/RNase) d' in vitro synthétisé ARNdb spécifique BMSB JHAMT et Vg , respectivement. Haricots verts étaient également immergés dans l’eau seul, 0,067 µg/µL ou 0,017 µg/µL LacZ dsRNA (Mock) comme témoins respectifs. Niveaux de transcription ont été évalués à l’aide de qPCR indiquant que l’expression de JHAMT et le Vg mRNA a été considérablement réduit en vivo de presque 4,5 - et 2.2-fold, respectivement (Figure 2 a, B). Par conséquent, les résultats indiquent que dsRNA peut être transmis à travers les tissus vasculaires des haricots verts pour induire RNAi réussie.
Un autre parasite hémiptère, le bug de l’arlequin (HB) (Murgantia histrionica), qui cause des dommages aux cultures ont aussi été testés si mise en œuvre réussie des nutriments ou des traitements de l’ARNdb ont pu être livré à l’aide de ce légume de cole médiée par livraison. Les larves de HB 4ème stade pouvaient se nourrir bébé chou vert (Brassica oleracea var. viridis) immergé dans l’eau ou une solution d’eau avec du colorant alimentaire vert. Résultats indiquent que HB nourris et ingéré la coloration de nourriture verte, qui ressortait de leurs excréments de couleurs verts, comparativement à HB qui ingéré les légumes plongés dans l’eau, qui avait clairement des excréments (Figure 3).
Techniques complémentaires pour la livraison transitoire de dsRNA de pulvérisation ou trempage résultats dsRNA absorption dans l’ensemble de l’usine tissus65,66de racine/sol. Produits à base de RNAi pulvérisables sont en développement et peuvent être disponibles bientôt en attendant l’approbation. Livraison d’ARNdb dans les champs à l’aide de sprays ou racine bassinage peut aider dans la gestion des insectes envahissants42,67. Semis et pleines de citronniers ont été exposés à l’ARNdb par pulvérisation foliaire, soit par terre ou à racines nues Drenchage, respectivement (Figure 4). Résultats indiquent qu’ARN doubles brins remises par deux pulvérisations ou sol/nu racine bassinage pu déceler dans les agrumes (2,5 m de haut) pour 7 semaines après une exposition unique de 2 g de dsRNA42. Livraison et ingestion de psylle dsRNA-AK (20 ng/µL) a augmenté la mortalité Psylle de 30 à 45 % (Figure 4)42.
In vitro transcrit ARNdb peut être fourni efficacement aux insectes polyphages à l’aide de tige de robinet (injections de tronc) du gène ARNdb spécifiques directement dans les tissus vasculaires de la plante, qui peuvent être acquis par les insectes, quand s’abattent sur ces plantes44 (Figure 5). Pour les citronniers qui ont été exposés à l’ARNdb par des injections de tronc, dsRNA pu déceler dans les agrumes âgés (environ 1 m de haut) pendant 7 semaines après une exposition unique à l’aide de 6 mL d’ARNdb 1,7 mg/ml dans une solution de DNase/RNase eau libre (Figure 5 a B). Phloème qui se nourrissent des insectes hémiptères pouvaient alors se nourrissent de ces plantes hôtes traitées avec l’ARNdb. Il est supposé que dsRNA a été infusé et traversé le système vasculaire des plantes agrumes pour l’ingestion par l’ACP, qui a démontré la mortalité lorsque se nourrissent de dsRNA-AK42avec succès.
Bioessais développé à partir de 2008 à 2012, ont été projetés à travers une grande variété de plantes en pot et semble donner des ARNdb livraison d’une manière par laquelle les plantes peuvent absorber et translocation dsRNA de dsRNA systémique diffusion41,42 . Une méthode utilise un élément absorbant de l’argile avec une adsorption d’ARNdb dans la matrice argileuse ; Cela inclut une grande variété d’argiles, de terre à foulon, zéolite et d’autres, comme ainsi que d’autres matériaux absorbants, bouillons, cellulose, bioplastiques, etc. Clay particules sont porteurs d’acides nucléiques libres de poussière qui peuvent être utilisés pour fournir les ingrédients actifs comme dsRNA aux sols pour absorption de la plante et en fin de compte la livraison aux insectes (Figure 6). L’argile complexe peut également être chimiquement configuré pour libérer l’ARNdb sous pH spécifique ou des conditions ioniques. Méthodes de prestation d’argile d’ARNdb en plantes ont démontré d’ARNdb en arbres d’agrumes en pot et autres plantes pendant plus de 14 mois (données non présentées). Ce système permet de modifier les traits de végétaux, tels que les couleurs de fleur, hauteur de la plante (nanisme) ou d’autres. Actuellement, l’utilisation principale de cette méthode est pour le développement d’un insecte efficace et le contrôle de l’agent pathogène (virus) ou la gestion. L’approche peut être rentable pour les pépinières et les propriétaires d’une maison et est une méthode non transgéniques.

Figure 1 . Livraison de nutriments ou de dsRNA par haricots verts. (A) Segments de haricots organiques minces ont été immergés et absorbé la solution dans un tube de microcentrifuge de 2 mL contenant 300 µL de ddH2O seul ou FD2O avec la coloration de nourriture verte, pendant 3 h. Trois 4ème stade larvaire BMSB nymphes étaient pendant 24 heures et placées dans des récipients de culture ainsi que 3 haricots verts par navire. (B) BMSB se nourrit des segments de haricots verts, immergés dans l’eau en perçant à travers les haricots verts pour atteindre les éléments nutritifs avec leurs stylets. (C) jour 2 de la BMSB alimentation biologique, flèches indiquent les excréments. (D) jour 3 ; Accrue des excréments BMSB (indiquées par la flèche) observés après ingestion d’une solution de ddH2O et vert colorant par le biais de haricots verts alimentaire. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
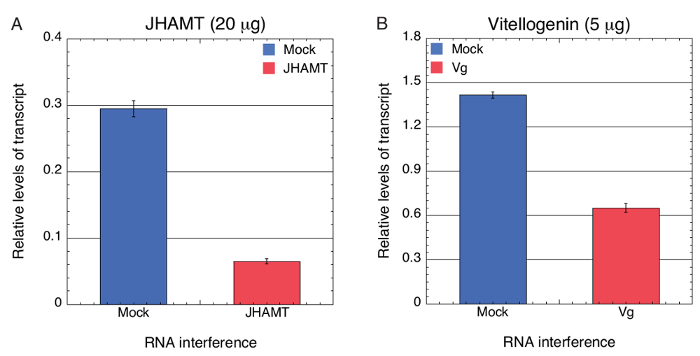
Figure 2 . Analyse de RT-PCR quantitative pour mesurer le niveau de transcription après épuisement véhiculée par ARNi de JHAMT et Vg dans BMSB. ARN total 3 individuels BMSB 4ème stade larvaire nymphes se nourrissent JHAMT (A) 20 µg (0,067 µg/µL) et Vg (B) 5 µg (0,017 µg/µL) ARNdb dans 300 µL de ddH2O offerts par l’entremise de tronçons de haricots verts, a été isolé et le niveaux de transcription ont été mesurés par qPCR. DsRNA LacZ (Mock) a servi de témoin négatif. L’ARN 18 s BMSB a été utilisé comme étalon interne pour corriger les différences dans la récupération de RNA de tissus. Les résultats fournis sont de trois réplicats biologiques et barres d’erreur indiquent SEM Une analyse de variance (ANOVA) a été effectuée pour tester la signification statistique des données, p < 0,0001. Résultats reproduits de Ghosh et al. 62 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 . Administration orale du traitement chez Harlequin bug (M. histrionica ) à l’aide de mesclun collard. Verts de collard biologiques pour bébés ont été lavés avec de l’hypochlorite de sodium 0,2 %, parés et immergés dans un tube de microcentrifuge cap-moins de 2 mL contenant 300 µL de solution de DNase et de (A) / RNase ddH gratuit2O, ou (B) DNase/RNase free ddH2 Solution de O avec la coloration de nourriture verte, pour une période de 3 h. Trois larves de HB stade 4e ont été pendant 24 heures puis placées dans des récipients de culture et a permis à ces feuilles de chou vert se nourrissent pendant 3 jours. Flèches blanches indiquent les excréments observées le jour 3 postes d’alimentation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 . Racinaire et foliaire drench demande de semis et de citronniers. Les plantes sélectionnées ou semis préalables à utiliser ne sont pas arrosées pendant 2-3 jours laisser le sol sécher à l’humidité, mais pas complètement secs. (A) les arbres étaient d’abord surmontés et 200 mL de solution de dsRNA (0,5 mg/mL) à la DNase/RNase eau libre a été appliqué à la main flacon pulvérisateur pompe à l’aile inférieure. (B), 100 mL de dsRNA solution (1 mg/mL) en eau libre de DNase/RNase a été appliquée au sol des semis dans un sol partiellement sec. (C) 100 mL de solution de dsRNA (1 mg/mL) en eau libre a été appliqué aux racines nues de semis pendant environ 3 h (D) de DNase/RNase ACP se nourrissant de semis qui avaient absorbé dsRNA par les racines nues, ont montré une mortalité accrue ACP. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 . Injection de tronc agrume semis arbre. Agrumes semis environ 1 m de haut ont été injectés avec 1,7 mg/mL d’ARNdb. (A) percer les trous dans les agrumes semis à l’aide d’une mèche de 10 mm de diamètre pour insérer la tige de la plante de l’injecteur. La pointe de cuivre exposée de chaque injecteur était enveloppée avec une bande large de 0,6 cm (¼ po) de film pour éviter les fuites d’étanchéité. Injecteurs (B) remplis de 6 mL de la solution colorée ont été appliqués à la tige (tronc) des semis. Injecteurs ont été laissés en place pendant environ 6 à 10 h pour l’absorption complète de la solution. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 . Livraison d’Amendement de sol d’argile d’ARNdb dans les usines à travers le sol. Une nouvelle ligne de livraison matériel : argile qui est un transporteur d’acides nucléiques poussière devant servir à fournir des ingrédients actifs tels que l’ARNdb aux sols pour l’absorption chez les plantes et finalement en insectes. Argile non cuite (A) et (B) cuits au four d’argile dépeignant la tolérance/rétention d’eau. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Gènes potentiels de la cible du halys H. | |||
| Adhésion | Taille | Nom/homologie de gène | |
| XP_014293026.1 | 491 | La vitellogénine-A1-like (Vg) (Isoformes possible : vitellogénine-2-comme l’isoforme X1 XP_014291483.1 ; la vitellogénine-2-comme l’isoforme X2 XP_014291484.1). | |
| XP_014290953.1 | 545 | Acide de l’hormone juvénile type O-méthyltransférase (JHAMT) (Homologue possible : hormone juvénile acide O-méthyltransférase XP_014283772.1). | |
| Amorces | |||
| PCR | |||
| Nom/homologie de gène | Nom de l’apprêt | Séquence | |
| VG | BMSB Vitellog P2 F | CAATTTGATCCACCGACTGTT | |
| VG | R Vitellog P2 BMSB | CCGCATGAATCTTACTCTGGA | |
| JHAMT | BMSB JH P1 F | GGATGCTTATGAATAATCCAG | |
| JHAMT | BMSB JH P1 R | GTATAGGATTGCCATTTTGG | |
| T7 PCR | |||
| VG | T7 BMSB Vitellog P2 4263 F | GAATTAATACGACTCACTATAGGGAGACCAAAGTTGGAAGGGAATGA | |
| VG | T7 BMSB Vitellog P2 4753 R | GAATTAATACGACTCACTATAGGGAGACCGCATGAATCTTACTCTGGA | |
| JHAMT | BMSB JH T7 P1 F | GAATTAATACGACTCACTATAGGGAGAGGATGCTTATGAATAATCCAG | |
| JHAMT | BMSB JH T7 P1 R | GAATTAATACGACTCACTATAGGGAGAGTATAGGATTGCCATTTTGG | |
| LacZ | T7 LacZ RNAi F | GAATTAATACGACTCACTATAGGGAGATGAAAGCTGGCTACAGGA | |
| LacZ | T7 LacZ RNAi R | GAATTAATACGACTCACTATAGGGAGAGCAGGCTTCTGCTTCAAT | |
| AK | dsAK-F | TAATACGACTCACTATAGGGAGTGGCATTCTTGTATGGCGTA | |
| AK | dsAK-R | TAATACGACTCACTATAGGGAGGCCTGCAAGAATCTGTCTCC | |
| AK | dsAK 50-F | TAATACGACTCACTATAGGGAGTGGCATTCTTGTATGGCGTA | |
| AK | dsAK 50-R | TAATACGACTCACTATAGGGAGTGAAGCCCTTGTGGTAGTC | |
| AK | dsAK 30-F | TAATACGACTCACTATAGGGAGACCCGGACTCTGGAGTAGG | |
| AK | dsAK 30-R | TAATACGACTCACTATAGGGAGGCCTGCAAGAATCTGTCTCC | |
| GFP | dsGFP-F | TAATACGACTCACTATAGGGAGCCAACACTTGTCACTACTTTCTCTT | |
| GFP | dsGFP-R | TAATACGACTCACTATAGGGAGGTAATGGTTGTCTGGTAAAAGGA | |
| qPCR | |||
| VG | RT Vitellog P2 F | TTGATAGTTGTTTGGATTTTGAAGGT | |
| VG | RT Vitellog P2 R | TCTTACTTGATCAGCGCTCAGAA | |
| JHAMT | BMSB JH RT P1 F | AGGAAAACCCAAAATGGCAAT | |
| JHAMT | BMSB JH RT P1 R | ATGTATTCTTCTTTTGGATCTTTTCTTGAG | |
| 486 | BMSB 18 S F3 | ATGCCCCCGCCTGTCCTTATT | |
| 486 | BMSB 18 S R3 | TGAAAGCAGCCTGAATAGTGG | |
| GFP | GFP-F | GGTAAAAGGACAGGGCCATC | |
| GFP | GFP-R | TCAAGGAGGACGGAAACATC | |
| AK | AK quant-F | CGGACTTGAGGGAGAACTGA | |
| AK | AK quant-R | GTGGTAGATACCGCGACCAG | |
| a-Tub | a-Tub-F | GCGTCTCTTCGGTTTGACGG | |
| a-Tub | a-Tub-R | CACTTCACCATCTGGTTGGC | |
Tableau 1. Séquences d’oligonucléotides d’Arni. Énumérés sont les gènes et les oligonucléotides utilisés pour générer des fragments, dsRNA et qPCR amorces PCR afin d’analyser les niveaux de transcription.
Supplémentaire vidéo 1 : bouillons et gels comme absorbants pour livraison et LIBERATION PROLONGEE de dsRNA. Des bouillons synthétiques ou naturelles hydratées et gels avec solution de dsRNA qui peut être utilisé comme appât ou diètes pour divers arthropodes. Veuillez cliquer ici pour télécharger cette vidéo
Discussion
Arni s’est avéré pour être un outil important pour explorer la fonction biologique du gène et la réglementation, avec un grand potentiel d’être utilisé pour la gestion des ravageurs19,68,69,70, 71. la conception et la sélection d’un ou plusieurs gènes appropriés pour faire taire dans une espèce donnée d’insectes et la méthode de livraison de le dsRNA(s) correspondant à l’insecte sont tous deux d’une importance capitale. La méthode optimale pour faire pénétrer des ARNdb dans un insecte doit être déterminée empiriquement, ainsi que la sélection de la dose relative pour la livraison, comme certaines méthodes peuvent offrir des avantages et autres limitations. Pour le développement d’un biopesticide à base moléculaire qui peut-être en définitive être adapté pour la dissémination dans l’environnement, il faut une méthode de livraison possible, efficace et avantageux. Par exemple, dsRNA appliqué topiquement a montré pour être efficace de dsRNA livraison pour la lutte contre les insectes aux agrumes et vigne42,44. Des stratégies novatrices telles que l’utilisation d’appâts, de solutions de saccharose, de levure ou de production de dsRNA bactérienne pour l’ingestion directe, l’application topique d’ARNdb sur les plantes, ou la production d’ARN doubles brins spécifique de plantes transgéniques modifiées, ont avancé le développement de des contrôles efficaces axées sur l’ARNi19,72.
Un bon exemple est montré ici avec l’utilisation des haricots verts pour livrer des ARNdb (Figure 1 et Figure 2) conçu spécifiquement un impact et réduire un ravageur d’importance mondiale. Le légume nouvellement développé dsRNA médiée par protocole de livraison à l’aide de segments de haricots verts immergé et imprégnée de dsRNA a servi à effectivement des gènes cibles spécifiques pour le développement larvaire dans BMSB. Haricots verts sont un des nombreux légumes qui sont dévorés par BMSB et donc ces ont été utilisés comme un moyen pour livrer l’ARNdb. Autres médiums de dsRNA livraison ont été testées (données non présentées), mais ont échoué dans la fourniture de nutrition à la BMSB probablement en raison de différences de texture vasculaire. Donc, nous avons utilisé des segments de haricots verts à livrer en vitro synthétisé dsRNA aux nymphes BMSB. Les acides nucléiques envoyées dans une usine ou une technique de médiation végétale peut être potentiellement capables d’induire des Arni chez l’insecte de choix tel qu’observé ici avec l’appauvrissement des gènes JHAMT et Vg dans BMSB (Figure 2)62.
Ce protocole de livraison légumes dsRNA de médiation a été utilisée avec succès pour induire RNAi non seulement en BMSB, mais aussi en DP à l’aide de feuilles de chou vert (Figure 3), bien que des stratégies de prestation et les méthodes doivent être optimisées pour chaque gène et les insectes. Par conséquent, il est recommandé que diverses méthodes soient testés pour livraison aussi bien quant à cibler plusieurs gènes d’intérêt individuellement ou par cumul au moins deux ARN doubles brins afin d’obtenir mieux phénotypique pénétrance. Plusieurs méthodes ont été résumées pour la livraison de dsRNA aux insectes et aux cellules d’insectes y compris l’alimentation13,22, trempage73,74,75de la microinjection et autres techniques76 utilisé pour dsRNA absorption d’induire RNAi systémique. Des méthodes plus récentes pour l’administration orale de dsRNA pour induire l’ARNi chez d’autres insectes par ingestion sur les plantes non transgéniques traitées ont également été explorés (Figure 4, Figure 5et Figure 6). Arbres d’agrumes ont été démontrés d’absorber des ARN doubles brins soit par le biais de racines, la tige du robinet (injections de tronc), ou des pulvérisations foliaires42,44. Auparavant, les citronniers et les vignes matures ont été traités avec insecte ARNdb spécifique correspondant au gène AK ACP et GWSS. Ces plantes traitées provoqua une augmentation dans la mortalité pour les ACP et GWSS pour jusqu'à diverses longueurs de temps41,45. Ensemble, ces résultats démontrent qu’ARNdb peut entraver l’expression de gènes spécifiques dans les insectes étudiés.
Les défis qui affectent le succès silencing de l’expression génique comprennent des groupes particuliers de dsRNA nucléases (dsRNases) exprimés principalement dans les tissus de l’intestin des insectes et des sécrétions salivaires ou le pH de l’intestin qui, peut être responsable de la dégradation de l’ARNdb47 ,77,,78. Cependant, pour remédier à cette dégradation, Arni systémique peut être induite efficacement chez les insectes en utilisant des concentrations plus élevées d’ARNdb et/ou en utilisant PEG dans le régime alimentaire, pour l’administration orale de dsRNA de gène-spécifique, pour surmonter cette dégradation62, 79. livraison et absorption d’ARNdb peuvent également être stabilisés à l’aide de molécules de transporteur, telles que les nanoparticules80 comme Chitosan48, liposomes comme Lipofectamine 2000 et Metafectene76, polyéthylèneglycol79, argile nanofeuillets81et carbone quantum dot50. La recherche est en cours afin d’améliorer la prestation efficace des ARNdb en utilisant des morceaux agar et gel infusés avec gène ARNdb spécifiques (données non présentées, consultez Supplemental vidéo 4). Cette technique peut être utilisée pour la livraison d’une dose efficace de dsRNA fourmis pouvant transporter l’ARNdb imprégné de résine ou la gélose au nid comme nourriture.
En plus de la stabilité des ARNdb, persistance à long terme d’ARNdb dans des tissus végétaux est d’importance, surtout pour les cultures agricoles. dsRNA distribué à travers les tissus vasculaires des plantes, des fruits ou des légumes peut-être s’accumuler dans le xylème et le phloème avec activité enzymatique réduite avant d’être ingéré par les insectes pour induire le mécanisme d’Arni. Il peut être nécessaire pour certaines applications d’avoir dsRNA persistent pendant une courte période, comme pendant 6 jours de haricots verts ou plus longs, pendant 36 h dans le sol62,82 afin que l’accumulation d’acides nucléiques dans le milieu devient peu probable. Cependant, Neena et coll. ont démontré que nanofeuillets pourrait protéger grand ARN doubles brins de dégradation prématurée comme ainsi que médiat leur libération prolongée sur la surface des feuilles sur une période d’au moins 30 jours81.
Dans l’ensemble des stratégies de livraison de dsRNA abordées ici pourraient servir à faire taire les insectes gènes spécifiques pour la lutte antiparasitaire. Approvisionnement de dsRNA aux plantes par le biais de l’eau d’irrigation, bassinage racine ou injection de tronc pourrait être une stratégie efficace pour les insectes nuisibles, tels que les mangeoires de racine, pour lesquels aucune méthode efficace de contrôle n’est actuellement disponible. Livraison d’ARNdb en utilisant un transporteur ou stabiliser le support tel que l’argile ou gélose peut être ajouté directement au sol pour l’absorption par les plantes. Une des principales causes de la lenteur des progrès dans le développement de biopesticides moléculaire Arni médiée par a été l’absence de techniques de prestation orale efficace pour initier RNAi efficace et stabilité dans des conditions environnementales83. Administration orale méthodes décrites ici peuvent à l’avenir utiliserait pour décerner acide nucléique médiation gène silencieux traitements planter sap d’alimentation ainsi que mâcher des insectes afin de réduire les dégâts d’insectes dans la production alimentaire mondiale et développement durable écologique antiparasitaire gestion.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à remercier Donald Weber et Megan Herlihy (USDA, ARS Beltsville, MD) pour offrir des BMSB et HB pour l’expérimentation et à maintenir les colonies ; et Maria T. Gonzalez, Salvador P. Lopez, (USDA, ARS, Fort Pierce, FL) et Jackie L. Metz (Université de la Floride, Fort Pierce, FL) pour l’entretien de la colonie, préparation des échantillons et des analyses.
matériels
| Name | Company | Catalog Number | Comments |
| BMSB (H. halys) insects | USDA | ||
| ACP (D. citri) insects | USDA | ||
| organic green beans | N/A | ||
| Citrus plants | USDA | ||
| sodium hypochlorite solution | J.T. Baker | ||
| green food coloring | McCormick & Co., Inc | ||
| Thermo Forma chambers | Thermo Fisher Scientific | ||
| Magenta vessel (Culture) | Sigma | ||
| Primers | IDT DNA | ||
| SensiMix SYBR | Bioline | ||
| qPCR ABI 7500 | Applied Biosystems | ||
| Spray bottle | N/A | ||
| Parafilm | American Can Company | ||
| TaKaRa Ex Taq | Clontech | ||
| QIAquick | Qiagen |
Références
- Hoebeke, E. R., Carter, M. E. . Halyomorpha halys (Stǻl)(Heteroptera: Pentatomidae): a polyphagous plant pest from Asia newly detected in North America. , (2003).
- Leskey, T. C., Hamilton, G. C., et al. Pest Status of the Brown Marmorated Stink Bug, Halyomorpha Halys in the USA. Outlooks on Pest Management. 23 (5), 218-226 (2012).
- Peiffer, M., Felton, G. W. Insights into the Saliva of the Brown Marmorated Stink Bug Halyomorpha halys (Hemiptera: Pentatomidae). PloS one. 9 (2), e88483 (2014).
- Anderson, B. E., Miller, J. J., Adams, D. R. Irritant contact dermatitis to the brown marmorated stink bug, Halyomorpha halys. Dermatitis : contact, atopic, occupational, drug. 23 (4), 170-172 (2012).
- Mertz, T. L., Jacobs, S. B., Craig, T. J., Ishmael, F. T. The brown marmorated stinkbug as a new aeroallergen. The Journal of allergy and clinical immunology. 130 (4), 999-1001 (2012).
- McClean, A. P. D., Schwarz, R. E. Greening or blotchy-mottle disease of citrus. Phytophylactica. 2 (3), 177-194 (2012).
- Bové, J. M. Huanglongbing: a destructive, newly-emerging, century-old disease of citrus. Journal of Plant Pathology. 88 (1), 7-37 (2006).
- Kuhar, T., Morrison, R., Leskey, T., Aigner, J. . Integrated pest management for brown marmorated stink bug in vegetables. , (2016).
- Tiwari, S., Mann, R. S., Rogers, M. E., Stelinski, L. L. Insecticide resistance in field populations of Asian citrus psyllid in Florida. Pest management science. 67 (10), 1258-1268 (2011).
- Baum, J. A., Bogaert, T., et al. Control of coleopteran insect pests through RNA interference. Nature Biotechnology. 25 (11), 1322-1326 (2007).
- Hannon, G. J. RNA interference. Nature. 418 (6894), 244-251 (2002).
- Mello, C. C., Conte, D. Revealing the world of RNA interference. Nature. 431 (7006), 338-342 (2004).
- Macrae, I. J., Zhou, K., et al. Structural basis for double-stranded RNA processing by Dicer. Science(New York, N.Y.). 311 (5758), 195-198 (2006).
- Bernstein, E., Caudy, A. A., Hammond, S. M., Hannon, G. J. Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature. 409 (6818), 363-366 (2001).
- Ketting, R. F., Fischer, S. E., Bernstein, E., Sijen, T., Hannon, G. J., Plasterk, R. H. Dicer functions in RNA interference and in synthesis of small RNA involved in developmental timing in C. elegans. Genes & development. 15 (20), 2654-2659 (2001).
- Agrawal, N., Dasaradhi, P. V. N., Mohmmed, A., Malhotra, P., Bhatnagar, R. K., Mukherjee, S. K. RNA interference: biology, mechanism, and applications. Microbiology and molecular biology reviews : MMBR. 67 (4), 657-685 (2003).
- Martinez, J., Patkaniowska, A., Urlaub, H., Lührmann, R., Tuschl, T. Single-stranded antisense siRNAs guide target RNA cleavage in RNAi. Cell. 110 (5), 563-574 (2002).
- Bartel, D. P. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 116 (2), 281-297 (2004).
- Timmons, L., Fire, A. Specific interference by ingested dsRNA. Nature. 395 (6705), 854 (1998).
- Clemens, J. C., Worby, C. A., et al. Use of double-stranded RNA interference in Drosophila cell lines to dissect signal transduction pathways. Proceedings of the National Academy of Sciences of the United States of America. 97 (12), 6499-6503 (2000).
- Saleh, M. C., van Rij, R. P., et al. The endocytic pathway mediates cell entry of dsRNA to induce RNAi silencing. Nature cell biology. 8 (8), 793-802 (2006).
- Amdam, G. V., Simões, Z. L. P., Guidugli, K. R., Norberg, K., Omholt, S. W. Disruption of vitellogenin gene function in adult honeybees by intra-abdominal injection of double-stranded RNA. BMC biotechnology. 3, 1 (2003).
- Whyard, S., Singh, A. D., Wong, S. Ingested double-stranded RNAs can act as species-specific insecticides. Insect biochemistry and molecular biology. 39 (11), 824-832 (2009).
- Huvenne, H., Smagghe, G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: a review. Journal of Insect Physiology. 56 (3), 227-235 (2010).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391 (6669), 806-811 (1998).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Gatehouse, H. S., Gatehouse, L. N., Malone, L. A. Amylase activity in honey bee hypopharyngeal glands reduced by RNA interference. Journal of Apicultural. , (2004).
- Jaubert-Possamai, S., Le Trionnaire, G., Bonhomme, J., Christophides, G. K., Rispe, C., Tagu, D. Gene knockdown by RNAi in the pea aphid Acyrthosiphon pisum. BMC biotechnology. 7, 63 (2007).
- Martín, D., Maestro, O., Cruz, J., Mané-Padrós, D., Bellés, X. RNAi studies reveal a conserved role for RXR in molting in the cockroach Blattella germanica. Journal of Insect Physiology. 52 (4), 410-416 (2006).
- Bansal, R., Mittapelly, P., Chen, Y., Mamidala, P., Zhao, C., Michel, A. Quantitative RT-PCR Gene Evaluation and RNA Interference in the Brown Marmorated Stink Bug. PloS one. 11 (5), e0152730 (2016).
- Terenius, O., Papanicolaou, A., et al. RNA interference in Lepidoptera: an overview of successful and unsuccessful studies and implications for experimental design. Journal of Insect Physiology. 57 (2), 231-245 (2011).
- Sparks, M. E., Shelby, K. S., Kuhar, D., Gundersen-Rindal, D. E. Transcriptome of the Invasive Brown Marmorated Stink Bug, Halyomorpha halys (Stål) (Heteroptera: Pentatomidae). PloS one. 9 (11), e111646 (2014).
- Tabara, H., Grishok, A., Mello, C. C. RNAi in C. elegans: soaking in the genome sequence. Science (New York, N.Y.). 282 (5388), 430-431 (1998).
- Baum, J. A., Roberts, J. K. Chapter Five - Progress Towards RNAi-Mediated Insect Pest Management. Insect Midgut and Insecticidal Proteins. 47, 249-295 (2014).
- Walshe, D. P., Lehane, S. M., Lehane, M. J., Haines, L. R. Prolonged gene knockdown in the tsetse fly Glossina by feeding double stranded RNA. Insect Molecular Biology. 18 (1), 11-19 (2009).
- Turner, C. T., Davy, M. W., MacDiarmid, R. M., Plummer, K. M., Birch, N. P., Newcomb, R. D. RNA interference in the light brown apple moth, Epiphyas postvittana (Walker) induced by double-stranded RNA feeding. Insect Molecular Biology. 15 (3), 383-391 (2006).
- Bautista, M. A. M., Miyata, T., Miura, K., Tanaka, T. RNA interference-mediated knockdown of a cytochrome P450, CYP6BG1, from the diamondback moth, Plutella xylostella, reduces larval resistance to permethrin. Insect biochemistry and molecular biology. 39 (1), 38-46 (2009).
- Maori, E., Paldi, N., et al. IAPV, a bee-affecting virus associated with Colony Collapse Disorder can be silenced by dsRNA ingestion. Insect Molecular Biology. 18 (1), 55-60 (2009).
- Hunter, W., Ellis, J., Hayes, J., Westervelt, D., Glick, E. Large-scale field application of RNAi technology reducing Israeli acute paralysis virus disease in honey bees (Apis mellifera, Hymenoptera: Apidae). PLoS Pathogens. 6 (12), e1001160 (2010).
- Christiaens, O., Smagghe, G. The challenge of RNAi-mediated control of hemipterans. Current Opinion in Insect Science. 6, 15-21 (2014).
- Hunter, W. B., Hail, D., Tipping, C., Paldi, N. RNA interference to reduce sharpshooters, the glassy-winged sharpshooter, and the Asian citrus psyllid. Symposium. , 24-27 (2010).
- Hunter, W. B., Glick, E., Paldi, N., Bextine, B. R. Advances in RNA interference: dsRNA treatment in trees and grapevines for insect pest suppression. Southwestern Entomologist. , (2012).
- Hail, D. A., Dowd, S., Hunter, W. H., Bextine, B. R. Investigating the transcriptome of the potato psyllid (Bactericera cockerelli): toward an RNAi based management strategy. , 183-186 (2010).
- de Andrade, E. C., Hunter, W. B. RNA Interference-Natural Gene-Based Technology for Highly Specific Pest Control (HiSPeC). RNA INTERFERENCE. , (2016).
- Taning, C. N. T., Andrade, E. C., Hunter, W. B., Christiaens, O., Smagghe, G. Asian Citrus Psyllid RNAi Pathway - RNAi evidence. Scientific reports. 6, 38082 (2016).
- Andrade, E. C., Hunter, W. B. RNAi feeding bioassay: development of a non-transgenic approach to control Asian citrus psyllid and other hemipterans. Entomologia Experimentalis et Applicata. 162 (3), 389-396 (2017).
- Joga, M. R., Zotti, M. J., Smagghe, G., Christiaens, O. RNAi Efficiency, Systemic Properties, and Novel Delivery Methods for Pest Insect Control: What We Know So Far. Frontiers in physiology. 7, 553 (2016).
- Zhang, X., Zhang, J., Zhu, K. Y. Chitosan/double-stranded RNA nanoparticle-mediated RNA interference to silence chitin synthase genes through larval feeding in the African malaria mosquito (Anopheles gambiae). Insect Molecular Biology. 19 (5), 683-693 (2010).
- Li-Byarlay, H., Li, Y., et al. RNA interference knockdown of DNA methyl-transferase 3 affects gene alternative splicing in the honey bee. Proceedings of the National Academy of Sciences of the United States of America. 110 (31), 12750-12755 (2013).
- Das, S., Debnath, N., Cui, Y., Unrine, J., Palli, S. R. Chitosan, Carbon Quantum Dot, and Silica Nanoparticle Mediated dsRNA Delivery for Gene Silencing in Aedes aegypti: A Comparative Analysis. ACS applied materials & interfaces. 7 (35), 19530-19535 (2015).
- Nimesh, S. Recent patents in siRNA delivery employing nanoparticles as delivery vectors. Recent patents on DNA & gene sequences. 6 (2), 91-97 (2012).
- Draz, M. S., Fang, B. A., et al. Nanoparticle-mediated systemic delivery of siRNA for treatment of cancers and viral infections. Theranostics. 4 (9), 872-892 (2014).
- Swevers, L., Raikhel, A. S., Sappington, T. W. Vitellogenesis and post-vitellogenic maturation of the insect ovarian follicle. Comprehensive. , (2005).
- Tufail, M., Takeda, M. Molecular characteristics of insect vitellogenins. Journal of Insect Physiology. 54 (12), 1447-1458 (2008).
- Hagedorn, H. H., Kunkel, J. G. Vitellogenin and vitellin in insects. Annual review of entomology. , (1979).
- Brandt, B. W., Zwaan, B. J., Beekman, M. Shuttling between species for pathways of lifespan regulation: a central role for the vitellogenin gene family?. Bioessays. , (2005).
- Murphy, C. T., McCarroll, S. A., et al. Genes that act downstream of DAF-16 to influence the lifespan of Caenorhabditis elegans. Nature. 424 (6946), 277-283 (2003).
- Shinoda, T., Itoyama, K. Juvenile hormone acid methyltransferase: a key regulatory enzyme for insect metamorphosis. Proceedings of the National Academy of Sciences of the United States of America. 100 (21), 11986-11991 (2003).
- Bellés, X. Beyond Drosophila: RNAi in vivo and functional genomics in insects. Annual review of entomology. 55, 111-128 (2010).
- Nouzova, M., Edwards, M. J., Mayoral, J. G., Noriega, F. G. A coordinated expression of biosynthetic enzymes controls the flux of juvenile hormone precursors in the corpora allata of mosquitoes. Insect biochemistry and molecular biology. 41 (9), 660-669 (2011).
- Huang, J., Marchal, E., Hult, E. F., Tobe, S. S. Characterization of the juvenile hormone pathway in the viviparous cockroach, Diploptera punctata. PloS one. 10 (2), e0117291 (2015).
- Ghosh, S. K. B., Hunter, W. B., Park, A. L., Gundersen-Rindal, D. E. Double strand RNA delivery system for plant-sap-feeding insects. PloS one. 12 (2), e0171861 (2017).
- Khrimian, A., Zhang, A., et al. Discovery of the aggregation pheromone of the brown marmorated stink bug (Halyomorpha halys) through the creation of stereoisomeric libraries of 1-bisabolen-3-ols. Journal of natural products. 77 (7), 1708-1717 (2014).
- Hall, D. G., Richardson, M. L., El-Desouky, A., Halbert, S. E. Asian citrus psyllid, Diaphorina citri, vector of citrus huanglongbing disease. Entomologia Experimentalis et Applicata. 146 (2), 207-223 (2012).
- Murphy, K. A., Tabuloc, C. A., Cervantes, K. R., Chiu, J. C. Ingestion of genetically modified yeast symbiont reduces fitness of an insect pest via RNA interference. Scientific reports. 6, 22587 (2016).
- San Miguel, ., K, J. G., Scott, The next generation of insecticides: dsRNA is stable as a foliar-applied insecticide. Pest management science. 72 (4), 801-809 (2016).
- Li, H., Guan, R., Guo, H., Miao, X. New insights into an RNAi approach for plant defence against piercing-sucking and stem-borer insect pests. Plant, cell & environment. 38 (11), 2277-2285 (2015).
- Hull, D., Timmons, L. Methods for delivery of double-stranded RNA into Caenorhabditis elegans. Methods in molecular biology (Clifton, N.J.). 265, 23-58 (2004).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Burand, J. P., Hunter, W. B. RNAi: future in insect management. Journal of Invertebrate Pathology. 112 Suppl, S68-S74 (2013).
- Rodrigues, T. B., Figueira, A. . Management of Insect Pest by RNAi-A New Tool for Crop Protection. , (2016).
- Baumann, A. M. T., Bakkers, M. J. G., et al. 9-O-Acetylation of sialic acids is catalysed by CASD1 via a covalent acetyl-enzyme intermediate. Nature communications. 6, 7673 (2015).
- Araujo, R. N., Santos, A., Pinto, F. S., Gontijo, N. F., Lehane, M. J., Pereira, M. H. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug Rhodnius prolixus (Hemiptera: Reduviidae) by dsRNA ingestion or injection. Insect biochemistry and molecular biology. 36 (9), 683-693 (2006).
- Wuriyanghan, H., Rosa, C., Falk, B. W. Oral Delivery of Double-Stranded RNAs and siRNAs Induces RNAi Effects in the Potato/Tomato Psyllid, Bactericerca cockerelli. PloS one. 6 (11), e27736 (2011).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods (San Diego, Calif). 30 (4), 313-321 (2003).
- Yu, N., Christiaens, O., et al. Delivery of dsRNA for RNAi in insects: an overview and future directions). Insect Science. , (2012).
- Allen, M. L., Walker, W. B. Saliva of Lygus lineolaris digests double stranded ribonucleic acids. Journal of Insect Physiology. 58 (3), 391-396 (2012).
- Wynant, N., Santos, D., Verdonck, R., Spit, J., Van Wielendaele, P., Vanden Broeck, J. Identification, functional characterization and phylogenetic analysis of double stranded RNA degrading enzymes present in the gut of the desert locust, Schistocerca gregaria. Insect biochemistry and molecular biology. 46, 1-8 (2014).
- Ghosh, S. K. B., Gundersen-Rindal, D. E. Double strand RNA-mediated RNA interference through feeding in larval gypsy moth, Lymantria dispar (Lepidoptera: Erebidae). European Journal of Entomology. 114, 170-178 (2017).
- Baigude, H., Rana, T. M. Delivery of therapeutic RNAi by nanovehicles. Chembiochem : a European journal of chemical biology. 10 (15), 2449-2454 (2009).
- Mitter, N., Worrall, E. A., et al. Clay nanosheets for topical delivery of RNAi for sustained protection against plant viruses. Nature plants. 3, 16207 (2017).
- Dubelman, S., Fischer, J., et al. Environmental fate of double-stranded RNA in agricultural soils. PloS one. 9 (3), e93155 (2014).
- Kola, V. S. R., Renuka, P., Madhav, M. S., Mangrauthia, S. K. Key enzymes and proteins of crop insects as candidate for RNAi based gene silencing. Frontiers in physiology. 6, 119 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon