Method Article
Metodi di consegna orale RNA double-stranded per indurre RNAi nel floema e insetti Pentatomomorfi pianta-sap-alimentazione
In questo articolo
Riepilogo
In questo articolo vengono illustrate le tecniche romanzo sviluppati per la consegna orale del RNA double-stranded (dsRNA) attraverso i tessuti vascolari delle piante per interferenza del RNA (RNAi) in sap floema insetti d'alimentazione.
Abstract
Floema e pianta sap alimentazione insetti invadono l'integrità delle colture e frutti per recuperare le sostanze nutrienti, nel processo di danneggiare le colture alimentari. Gli insetti Pentatomomorfi rappresentano un certo numero di parassiti economicamente sostanziali delle piante che causano danni alle colture di alimentazione su sap del floema. Il marrone marmorated stink bug (BMSB), Halyomorpha halys (Heteroptera: Pentatomidae) e l'Asian psyllid agrumi (ACP), Diaphorina citri Kuwayama (Hemiptera: Liviidae) sono parassiti di insetto ematofago introdotti in Nord America, dove essi sono un parassita agricolo dilagante di agrumi, riga e colture di base e specialità di alto valore, come pure un parassita di fastidio quando raccolgono al chiuso. Resistenza agli insetticidi in molte specie ha portato allo sviluppo di metodi alternativi di strategie di lotta. Double-stranded RNA (dsRNA)-mediata RNA interference (RNAi) è un meccanismo per studi di genomica funzionali che ha applicazioni potenziali come uno strumento per la gestione dei parassiti di insetto il silenziamento genico. DsRNA esogenicamente sintetizzato o short interfering RNA (siRNA) può innescare altamente efficiente del silenziamento genico attraverso la degradazione del RNA endogeno, che è omologo a quello presentato. Uso efficace e ambientale di RNAi come biopesticidi molecolare per biocontrollo di insetti Pentatomomorfi richiede la consegna in vivo di RNAds attraverso l'alimentazione. Qui dimostriamo metodi per la consegna di dsRNA agli insetti: caricamento di dsRNA in fagiolini per immersione e assorbimento di gene-specific del dsRNA con consegna orale attraverso l'ingestione. Inoltre abbiamo delineato non transgenica pianta approcci di recapito utilizzando spray fogliare, inzuppare di radice, iniezioni di tronco così come granuli di argilla, che può essere essenziale per il rilascio prolungato di dsRNA. Consegna efficiente di dsRNA ingerito per via orale è stata confermata come un dosaggio efficace per indurre una diminuzione significativa nell'espressione del gene targeting, come ormone giovanile l'acido O-metiltransferasi (JHAMT) e vitellogenina (Vg). Questi metodi innovativi rappresentano strategie per la consegna di dsRNA da usare nella protezione delle colture e superare le sfide ambientali per la gestione dei parassiti.
Introduzione
Gli insetti Pentatomomorfi comprendono alcuni dei parassiti economicamente più significativi di agriculturebecause delle loro capacità per conseguire crescita demografica elevata e diffondere malattie delle piante. BMSB, H. halys Stål, è un parassita invasivo che è stato accidentalmente introdotto nell'emisfero occidentale a Allentown, in Pennsylvania, dall'Asia (Cina, Taiwan, Corea e Giappone) con il primo avvistamento segnalato nel 19961. Sin dalla sua introduzione, BMSB è stato rilevato in 43 Stati, con le popolazioni più alte nel Mid-Atlantic (DE, MD, PA, NJ, VA e WV), così come in Canada e in Europa e rappresenta una potenziale minaccia per l'agricoltura2. Come un parassita polifago, BMSB possono provocare danni ai circa 300 ospiti della pianta identificati tra cui colture di alto valore come mele, uva, piante ornamentali, colture da seme, semi di soia e mais. Danno è causato soprattutto a causa della modalità di alimentazione conosciuto come lacerare e a filo, dove l'animale trafigge il raccolto di host con suo mandrino aghiformi per ottenere l'accesso alle sostanze nutrienti dai tessuti vascolari2,3. BMSB è anche un parassita coperto come essi possono trovare residenza in ambienti quali scuole e case durante l'autunno e inverno2. Prodotti chimici e aeroallergens rilasciato da BMSB sono stati segnalati per illecita reazione allergica negli operai del raccolto di frutta. BMSB può anche contribuire alla malattia allergica che porta alla dermatite da contatto, congiuntivite e rinite allergica in individui sensibili4,5. Un altro insetto ematofago, l'ACP, d. citri Kuwayama (Hemiptera: Liviidae), è un parassita serio di agrumi e trasmette i batteri limitato nel floema (Candidatus Liberibacter asiaticus) causando Huanglongbing (HLB), meglio conosciuto come citrus greening malattia6,7. HLB in primo luogo è stato segnalato dalla Cina meridionale e si è diffuso a 40 diversi asiatici, africani, dell'Oceania, Sud e nord americano Paesi7. Citrus greening è un problema in tutto il mondo con minacciose perdite economiche e finanziarie a causa della perdita di agrumi; quindi, gestione dell'ACP è considerato di estrema importanza per prevenire e controllare HLB.
Misure per un effettivo controllo di questi insetti di solito richiede l'applicazione di pesticidi chimici che sono relativamente breve vissuto. Strategie di controllo insetticida chimico spesso mancano strategie di gestione ambientale sicura o essersi ridotta suscettibilità a causa di resistenza agli antiparassitari in pest popolazioni8,9. Quindi, il controllo biologico dei parassiti con biopesticidi molecolare è un'alternativa potenziale, ma il suo utilizzo a livello mondiale rimane modesto, e varie specie di parassitoidi (ad es., Trisolcus japonicus) può anche essere efficace come naturale biologico controlli. il RNAi è un potenziale emergente tecnologia per la gestione dei parassiti di insetto invasivi con biopesticidi molecolare10. il RNAi è un meccanismo di regolazione genica descritta bene che facilita l'efficace post-trascrizionale genico di endogeno nonché invadendo dsRNA in modo sequenza-specifico, che finalmente conduce alla regolazione della espressione genica a mRNA livello11,12. Brevemente, quando dsRNA esogeno è interiorizzato in una cella che viene elaborato in siRNA da un membro della superfamiglia di RNAsi III bidentati nucleasi, chiamata Dicer, che è evolutivamente conservata in vermi, mosche, piante, funghi e mammiferi13, 14 , 15. questi duplex del siRNA di 21-25 nucleotidi sono quindi svolto e integrati nel complesso silenziamento indotto da RNA (RISC) come guida RNAs. Questo complesso RISC-RNA permette di Watson-Crick appaiamento complementare destinazione mRNA; questo alla fine porta alla scissione dalla proteina Argonaute, una proteina di dominio multi contenente un RNasi H-come dominio, che degrada il mRNA corrispondenti e riduce la traduzione della proteina, determinando così il silenziamento genico post-trascrizionale16 , 17 , 18.
RNAi per gestione dei parassiti richiede l'introduzione del dsRNA in vivo per silenziare il gene di interesse, quindi attivazione della via di siRNA. Vari metodi che sono stati utilizzati per la consegna di dsRNA per insetti e cellule di insetto per indurre RNAi sistemica includono alimentazione10,19, ammollo20,21, microinjection22, vettori quali liposomi 23e altre tecniche24. RNAi è stato prima dimostrato in Caenorhabditis elegans al silenzio unc-22 l'espressione genica di Fire e Mello25, seguita da atterramento nell'espressione dei geni frizzled in Drosophila melanogaster26. Gli studi funzionali iniziali utilizzate microiniezione per offrire dsRNA in insetti, come Apis mellifera22,27, Acyrthosiphon pisum28, Blattella germanica29, H. halys30e lepidotteri insetti (recensiti da Terenius et al. 31). microinjection è vantaggiosa per consegnare un dosaggio accurato e preciso per il sito di interesse per l'insetto. Anche se tali punture settici possono suscitare espressione dei relativi geni immuni a causa di trauma32, quindi, escludere la sua praticità nello sviluppo agricolo biopesticidi.
Un altro metodo di consegna dsRNA in vivo è di ammollo, che coinvolge ingestione o assorbimento di dsRNA da sospensione di animali o di cellule generalmente nel mezzo extracellulare contenente dsRNA. Ammollo è stato utilizzato in modo efficiente indurre RNAi in cellule di coltura del tessuto della drosofila S2 per inibire a valle-di-Raf1 (DSOR1) della proteina mitogene-attivata della chinasi della chinasi (MAPKK)20, così come in c. elegans per mettere a tacere la pos-1 gene33. Tuttavia, dsRNA recapitato tramite ammollo è meno efficace per indurre RNAi rispetto a microiniezione20. RNAi mediata silenziamento in un insetto da masticare era primo indicato nella diabrotica del mais (WCR) (Diabrotica virgifera virgifera) infondendo il dsRNA in una dieta artificiale agar10. Rapporti più iniziali sono riassunti i metodi per consegnare dsRNA infuso in diete naturali specifiche di artropodi34. Questi metodi di consegna più ulteriormente sono stati determinati per essere efficace in modo paragonabile ai mezzi artificiali di consegna; come nel caso della mosca tse-tse (Glossina glossinidius glossinidius), dove uguale colpo di un gene di immuno-correlati è stata osservata quando il dsRNA è stato consegnato tramite pasto di sangue o iniettati35. Allo stesso modo, consegna di dsRNA attraverso le goccioline in light brown apple moth (Epiphyas postvittana)36, diamondback moth (Plutella xylostella) larve37, nonché miele le API38,39 indotto RNAi efficiente. Esperimenti di RNAi più efficaci in Pentatomomorfi hanno utilizzato iniezione del dsRNA40 perché la consegna orale di dsRNA negli insetti Pentatomomorfi è ardua, poiché deve essere consegnato attraverso tessuti vascolari della pianta ospite. RNAi efficace inoltre è stata osservata nei paesi ACP e cicaline glassy-winged sharpshooter (esse), Homalodisca vitripennis: dsRNA è stato recapitato tramite agrumi e viti che avevano assorbito dsRNA nei tessuti vascolari attraverso inzuppare radice, fogliare spray, iniezioni di tronco o assorbimento di talee41,42,43,44,45,46. Ciò inoltre ha provocato il primo brevetto per dsRNA contro i paesi ACP (2016, noi 20170211082 A1). Consegna di siRNA e dsRNA utilizzando vettori come nanoparticelle e liposomi conferisce stabilità e aumenti nell'efficacia di dsRNA consegnati stanno rapidamente emergendo23,47,48,49 ,50. Una nuova classe di veicoli di consegna basato su nanoparticelle per acidi nucleici per in vitro e in vivo che è stato ricapitolato specificamente per le applicazioni terapeutiche possono conferire un potenziale immenso come adatto consegna file vettoriale51. Le nanoparticelle come un veicolo di consegna per dsRNA possono avere svantaggi tra cui solubilità, idrofobicità o bioaccumulazione limitata52, ma una consegna di favoreggiamento di polimero adatto può compensare questi svantaggi. Sviluppo e l'utilizzo di auto-consegna nucleotidi stanno emergendo anche chiamati 'oligonucleotidi antisenso', che sono single stranded RNA/DNA duplex46.
Vitellogenesi in artropodi sono un fondamentale processo di controllo della riproduzione e regolati da ormone giovanile (JH) o ecdisone, che sono il chiavi induttori di Vg sintesi del grasso di corpo; il Vg è finalmente ripreso dall'ovocita in via di sviluppo via Vg recettore mediata endocytosis53. VG è un gruppo di polipeptidi sintetizzati extraovarially, che è essenziale per lo sviluppo della proteina del tuorlo dell'uovo principali, vitellino54,55, e pertanto, è importante nella riproduzione e invecchiamento56. VG è stato silenziato con successo in nematodi57 come pure in ape del miele (mellifera di Apis) dove RNAi mediata deplezione di Vg è stato osservato in adulti e uova22. RNAi genico post-trascrizionale mediata di Vg è stato testato perché si pensava che suo svuotamento porterebbe ad un effetto fenotipico osservabile come ridotta fertilità e fecondità, per potenzialmente aiutare nel controllo BMSB. Il gene JHAMT che codifica per la S-adenosyl-L-metionina (SAM)-dipendente JH acido O-metiltransferasi, catalizza la tappa finale del JH biosintesi via58. In questo percorso Farnesil pirofosfato (FPP) in sequenza si trasforma da farnesolo, a farnesoic acido seguita dalla conversione di metile farnesoate a JH da JHAMT. Questa via è conservata in insetti e artropodi in particolare per la metamorfosi, un processo che inerente allo sviluppo è regolato da ormoni59,60,61. In b. mori, espressione genica JHAMT e l'attività biosintetica JH i Corpora allata suggeriscono che la soppressione trascrizionale del gene JHAMT è cruciale per la terminazione di JH biosintesi58. Di conseguenza, i geni JHAMT e Vg sono stati selezionati per lo svuotamento mirato mediante RNAi. RNAi è stato testato anche in alberi di agrumi per il controllo dei paesi ACP e di esse. Alberi di agrumi sono stati trattati con dsRNA attraverso inzuppare radice, gambo rubinetto (iniezioni di tronco), così come spray fogliare con RNAds contro insetti specifici arginina chinasi (AK) trascrizioni42,44. L'applicazione topica di dsRNA è stato rilevato tutto sopra il baldacchino di alberi di agrumi, che indica una consegna efficiente attraverso i tessuti di piante vascolari e ha provocato la mortalità aumentata in ACP ed esse41,42, 45.
Nello studio corrente, abbiamo identificato un metodo di consegna dieta naturale per trattamenti quali dsRNA. Questa tecnica di recente sviluppata è stato successivamente utilizzata per mettere a tacere la JHAMT e Vg mRNA mediante dsRNA specifico gene in ninfe BMSB come dimostrato precedenti62. Questi nuovi protocolli di recapito ha dimostrati qui sostituiscono convenzionali sistemi di consegna di RNA che utilizzano spray topici o microiniezioni. Verdure e frutta, staminali rubinetto, suolo inzuppando e assorbenti di argilla in possono essere utilizzati per la consegna di dsRNA, che è fondamentale per il costante sviluppo di biopesticida gestione dei parassiti e patogeni.
Protocollo
1. BMSB allevamento
- Posteriore BMSB insetti secondo la pratica di laboratorio standard e precedentemente descritti63.
- Sollevare gli insetti ACP (d. citri) su Citrus macrophylla in una serra (22 ° C) e luce naturale. Uso adulto ACP, a circa 5-7 giorni post eclosion.
2. selezione di regioni del Gene e la sintesi In Vitro di dsRNA
- Selezionare geni specifici per BMSB da precedentemente pubblicati transcriptome profili32.
- Garantire le regioni di interesse selezionato variano tra 200 e 500 paia di basi.
- Eseguire la reazione a catena della polimerasi (PCR) utilizzando le condizioni descritte di seguito per generare frammenti associate al gene selezionato di interesse da DNA genomic. Vedere la tabella 1 per gli oligonucleotidi gene-specifico.
- Reazione di PCR: In un tubo PCR di 0,25 mL, combinare 5 µ l di tampone di PCR, 4 µ l di dNTP miscela (2,5 mM), 2 µ l di templato di DNA (50 ng / µ l), 2,5 µ l di primer 1 e 2 (10 µM), 0,25 µ l di DNA polimerasi (5 U / µ l): 10x , e fino a 50 µ l di acqua gratuita di DNasi e RNasi.
- Condizione PCR: ciclo la reazione di PCR per amplificare la regione di interesse a 95 ° C per 3 min seguita da 30 cicli di 98 ° C per 10 s, 55 ° C per 30 s, 72° C per 1 min. Incubare la reazione a 72 ° C per un ulteriore 10 min purificare la reazione di PCR utilizzando un kit di purificazione.
- Amplificare i frammenti PCR ottenuti ulteriormente con i primers specifici del gene affiancato con la sequenza del promotore T7 RNA polimerasi (5'-GAA TTA ATA CGA CTC ACT ATA GGG AGA-3') come accennato precedenti62.
- Utilizzare il gene LacZ come controllo negativo (mock) per RNAi.
Nota: LacZ è un gene che codifica la β-galattosidasi amplificata da DNA genomic Escherichiacoli (primer usati sono elencati nella tabella 1). - Eseguire la trascrizione in vitro per produrre dsRNA come precedente descritto62.
- Sciogliere e risospendere il dsRNA risultante in acqua libera dnasi/RNAsi di 150 µ l, misurare la concentrazione e conservare a-80 ° C per un uso futuro.
3. consegna di dsRNA Using fagiolini
- Selezionare presto 4th instar BMSB ninfe nati dallo stesso uovo di massa e di farli morire di fame per 24 h prima dell'alimentazione del dsRNA.
- Selezionare fagioli verdi organici certificati snelli (Phaseolus vulgaris L.) e lavare con soluzione di ipoclorito di sodio 0,2% per 5 min.
Nota: Snelle fagiolini sono stati selezionati affinché i fagioli possono facilmente essere ospitati nelle provette microcentrifuga da 2 mL. - Lavare 3 volte con ddH2O e lasciare asciugare all'aria.
- Tagliare i fagiolini dall'estremità di calice per una lunghezza totale di 7,5 cm con una lama di rasoio pulita.
- Immergete i fagiolini lavati e tagliati in un tubo del microcentrifuge PAC-meno 2 mL contenente 300 µ l di soluzione di controllo (un 01:10 diluizione di colorante alimentare verde (ingredienti: acqua, glicole propilenico, Fd & C giallo 5, Fd & C Blue 1 e Propylparaben come conservante)).
- Diluizioni di marca in vitro sintetizzato RNAds LacZ, JHAMT o Vg di diluzione µ g 5 o 20 µ g a 300 µ l di acqua gratuita di RNAsi/dnasi per produrre concentrazioni finali di 0,017 µ g / µ l o 0,067 µ g / µ l, rispettivamente.
- Immergete i fagiolini lavati e tagliati in un tubo del microcentrifuge PAC-meno 2 mL contenente 300 µ l di soluzione di dsRNA (dal punto 3.6).
- Avvolgere e sigillare il bordo delle provette microcentrifuga che racchiude i fagioli immersi per evitare l'evaporazione della soluzione dsRNA e per evitare che gli animali entrino il tubo del microcentrifuge.
- Posizionare questi tubi in maniera verticale a temperatura ambiente per 3 h per consentire la soluzione di dsRNA deve essere caricato in tutto il fagiolo verde per azione capillare.
- Posizionare questi tubi in recipienti di coltura pulita (polipropilene). Posto tre affamato 4th instar ninfe BMSB in recipienti di coltura.
- Trattare tre animali per peschereccio cultura ciascuno contenente tre fagiolini con soluzione di colorazione o dsRNA cibo verde. Mantenere gli insetti a 25 ° C e il 72% di umidità relativa, sotto un fotoperiodo di 16 L: 8 in un'incubatrice.
- Consentire gli insetti per nutrirsi i fagiolini (immersi e assorbito con dsRNA) per 5 giorni ma ricostituire con diete fresche di perline di dsRNA trattamento verde dopo 3 giorni.
4. in tempo reale quantitativa (qPCR) analisi di espressione seguente RNAi mediata silenziamento genico in BMSB
- Misurare l'effetto di RNAi sui livelli di espressione della trascrizione di qPCR.
- il RNA totale dagli animali dsRNA Trattato di isolare e sintetizzare il cDNA62.
- Programma di installazione le reazioni di qPCR utilizzando un sistema PCR in tempo reale e i primer elencati nella tabella 1. Utilizzare la seguente condizione di ciclismo qPCR: 95 ° C per 10 minuti seguiti da 40 cicli di 95 ° C per 15 s, 60 ° C per 1 min, insieme con passo di dissociazione tra cui 95 ° C per 15 s, 60 ° C per 1 min, 95 ° C per 15 s e 60 ° C per 15 s.
- Determinano gli standard di qPCR: utilizzare la diluizione seriale di cDNA preparato da RNA totale isolato da un animale normale come uno standard di riferimento per la quantificazione.
- Utilizzare RNA 18s BMSB come standard interno per correggere le differenze nel recupero di RNA da tessuti32.
5. fogliari applicazione in grandi vasi di agrumi e piantine
Nota: Piante della cultivar agrumi 'Carrizo' citrange (Citrus sinensis XPoncirus trifoliata, Rutaceae), sono stati mantenuti in una serra sotto luce naturale e la temperatura, coltivate in contenitori di 1,2 L. Le piante erano costantemente potate per promuovere la crescita di nuovi germogli fogliari, chiamato 'filo'. ACP preferisce alimentazione e deposizione delle uova sulla nuova crescita di agrumi64.
- Selezionare piante o piantine e non acqua per 2-3 giorni prima dell'uso per lasci il terreno asciugarsi a umido, ma non completamente asciutto.
- Utilizzando uno spruzzatore con pompa a mano applicare un 200 mL di soluzione di dsRNA (0,5 mg/mL) per la calotta inferiore (Figura 4A).
Nota: Preparare il sopra menzionato dsRNA soluzioni in acqua libera del DNase/RNasi. - Post-applicazione a spruzzo, lasciare che la soluzione di dsRNA applicata deve essere completamente assorbita dalle foglie.
Nota: Alberi di agrumi assorbito il dsRNA applicato, e quindi le foglie da entrambi nuova crescita o dai rami che sono stati coperti prima dell'applicazione, sono stati estratti; il dsRNA era rilevabile mediante qPCR e ha mostrato il movimento sistemico nelle foglie degli alberi alto baldacchino in 3-4 h44,45,46. - Assaggiare la nuova crescita dagli alberi precedentemente conditi dopo 25-40 giorni raccogliendo circa 10 foglie dalle punte dei quattro rami. Estratto il RNA totale e analizzarlo da trascrizione d'inversione PCR (RT-PCR) e qPCR per la presenza del trigger dsRNA applicata utilizzando i primers elencati nella tabella 1 e precedentemente descritti metodi46.
Nota: La raccolta del campione, isolamento di RNA totale, RT-PCR e qPCR sono stati eseguiti come descritto in precedenza46. - Allo stesso modo, per via topica spray 10ml dsRNA nella regione inferiore di un semenzale o fogliame piccolo albero in vaso.
Nota: Gli insetti Pentatomomorfi (ACP ed esse) ci hanno dato accesso alimentazione normalmente a 24 h, post trattamenti su nuova crescita (foglie) che non era stato spruzzato direttamente, o che si è sviluppato dopo settimane, o piante intere. Questo prodotto di insetti quali testato positivo per il dsRNA a 3, 6 e 10 giorni, post allattamento.
6. suolo/radice inzuppare applicazione in grandi o piccole in vaso piante e alberi di agrumi
- Selezionare piantine o piante e non li acqua per 2-3 giorni prima dell'uso per lasci il terreno asciugarsi all'umidità ma non completamente asciutto (questo crea lo spazio aereo per contenere la soluzione liquida da applicare).
- Aggiungere 1 L di soluzione di dsRNA (0,2 mg/mL) al terreno delle grandi piante in vaso (circa 2,5 m) e 1 L di acqua (chaser) dopo 1 h.
- Applicare gli alberi di 100 mL di soluzione di dsRNA (1,33 mg/mL) al terreno di 1 m di altezza in vaso in terreni parzialmente asciutti.
- Per le piccole piantine, applicare 10 mL di soluzione di dsRNA (1 mg/mL) al suolo in coni o le radici nude (Figura 4B, C).
- Consentire le piante che ricevono la soluzione di dsRNA applicata come trattamento del suolo in ammollo per 30 min. Quindi applicare il trattamento solo acqua semplice per facilitare l'assorbimento dalle radici (20 mL per piante in contenitori gialli), o 100 se più grandi vasi della pianta sono > 1 gallone.
Nota: DsRNA d'attualità applicato a fogliame è provocato da rilevamento al più distale punte dei rami all'interno di trattamenti post 3-6 h, mostrando circolazione sistemica attraverso gli alberi. Nuovi rami di sviluppo sono risultati positivi per dsRNA a 60-90 giorni post-trattamenti. I tagli sono forniti agli insetti (ACP ed esse) in un dsRNA alimentazione analisi biologica44.
7. gambo rubinetto (iniezione del tronco di albero) applicazione in grandi vasi di agrumi e piantine
- Selezionare piantine di agrumi, nuovo, o circa 3,5 anni vecchi impianti per l'iniezione di dsRNA utilizzando il gambo tocca il metodo (iniezioni di tronco).
- Forare le piante di agrumi con un trapano e una punta di 10 mm, facendo attenzione a non superare i 2 cm, o circa la metà del diametro del gambo.
- Avvolgere la punta di rame di ogni iniettore 4 - 6 volte con una striscia di larghezza di 0,6 cm (¼ di pollice) di film per evitare perdite nei pressi della punta saldante.
- Riempire gli iniettori del tronco di albero con 6 mL (1,7 mg/mL) di soluzione di dsRNA diluito in acqua libera del DNase/RNasi (indicato qui come soluzione colorata).
- Iniettare la soluzione nel tronco dell'albero e lasciare l'iniettore nel bagagliaio per 6-10 h per consentire l'assorbimento della soluzione dsRNA. Consentire gli insetti per nutrirsi le talee da alberi trattati a 3, 10 e 30 giorni dopo il trattamento.
Nota: Il dsRNA iniettato usando il metodo di iniezione di tronco persistente tra gli alberi per un periodo di 30-60 giorni41,42,44. Convalida per RNAi è stata effettuata da qPCR utilizzando i primers elencati nella tabella 1.
8. dsRNA granuli di argilla trattata per il recapito a insetti attraverso terreno
- Versare l'argilla assorbente in una provetta conica da 50 mL fino alla tacca di 35 mL (circa 30 g di argilla assorbente) sul tubo.
- Versare 20 mL di soluzione di dsRNA diluito in acqua libera del DNase/RNasi (100 µ g/mL) nel tubo di bagnare tutto l'assorbente. Richiudere la provetta conica, punta il tubo per aiutare a rimuovere aria e richiudere la provetta.
- Disporre il tubo verticalmente e lasciar riposare per 1-2 min per le particelle di argilla di assorbire la soluzione.
- Aggiungere abbastanza argilla imbevuta di dsRNA nel suolo mix per riempire un vaso di 1 gallone.
- Mescolare e girare il terreno a mano per mescolare l'argilla imbevuta di dsRNA nel terreno.
- Utilizzare questo terreno per rinvasare semenzali selezionati per il trattamento di dsRNA.
- Acqua il terreno con 200 mL di acqua naturale senza dsRNA. Dopo 30 min a 1 h, seguire con 100 mL di acqua naturale. Dopo 24 h, mettere la pianta su un normale programma d'irrigazione.
- Test 4-6 foglie di piante in vaso trattate con sostanze assorbenti dell'argilla e dsRNA ogni trattamento post mese per dsRNA raccogliendo le foglie più apicale di nuovo sviluppo di pianta.
Nota: Piante o talee da queste piante trattate sono alimentate agli insetti qualsiasi momento dopo 24h post-trattamento e sono stati in grado di consegna RNAi per fino ad un anno agli insetti (dati non pubblicati).
Risultati
Consegna di verdure dsRNA mediata attraverso alimentazione in BMSB 4th instar ninfe è stato testato per lo sviluppo di biopesticidi molecolare mediante RNAi per parassiti di insetto invasivi. BMSBs feed utilizzando loro stiletti aghiformi da un meccanismo conosciuto come lacerare e lavare, causando notevoli danni alle colture. Fagioli verdi organici snelli, p. vulgaris L., sono stati utilizzati per verificare se le sostanze nutrienti o dsRNA poteva essere recapitata in vivo a BMSB attraverso alimentazione3. Segmenti dei fagioli verdi sono stati immersi in acqua gratuita dnasi/RNAsi o una soluzione di acqua e colorante alimentare verde per testare consegna in BMSB (Figura 1A). Il colorante alimentare verde è stato utilizzato come un'indicazione visiva di imitare dsRNA. Il tessuto vascolare dei fagioli verdi erano saturi con colorante alimentare verde a causa del flusso di soluzione colorata verde attraverso il floema di azione capillare62. Ninfe BMSB sono state osservate nutrirsi sui segmenti di fagiolini inserendo loro stiletti nei tessuti vascolari di fagiolini (Figura 1B). Le goccioline colorate verde escrementi sono state osservate dopo giorni 2 e 3 in insetti che sono stati alimentati sui fagioli saturati di cibo verde colorazione che indica il materiale consegnato era stato ingerito per via orale e passato attraverso l'intestino prima di escrezione (Figura 1, D ).
Successivamente abbiamo testato se lo svuotamento significativo dell'espressione genica mirata è stato compiuto mediante la consegna di green bean mediata di BMSB dsRNA specifico attraverso l'ingestione in BMSB. Fagiolo verde segmenti sono stati immersi e assorbito una soluzione di 0,067 µ g / µ l (20 µ g a 300 µ l di acqua gratuita DNasi/RNasi) o 0,017 µ g / µ l (5 µ g a 300 µ l di acqua gratuita DNasi/RNasi) di dsRNA in vitro sintetizzato specifico per BMSB JHAMT e Vg , rispettivamente. Fagioli verdi inoltre sono stati immersi in acqua da solo, 0,067 µ g / µ l o 0,017 µ g / µ l LacZ dsRNA (Mock) come rispettivi controlli. Livelli della trascrizione sono stati valutati usando qPCR che indica che l'espressione di JHAMT e Vg mRNA era significativamente ridotto in vivo di quasi 4,5 - e 2.2-fold, rispettivamente (Figura 2A, B). Di conseguenza, i risultati indicano che dsRNA può essere recapitato attraverso i tessuti vascolari di fagiolini per indurre RNAi successo.
Un altro parassita ematofago, il bug di Arlecchino (HB) (Murgantia histrionica), che provoca danni a cole colture sono stati testati anche se il successo della fornitura di sostanze nutritive o dsRNA trattamenti potrebbe essere trasportato utilizzando la verdura mediate consegna. Le ninfe di HB instarth 4 erano autorizzate a nutrire il verdi del cavolo riccio del bambino (Brassica oleracea var. viridis) Immerso in acqua o una soluzione di acqua con colorante alimentare verde. I risultati hanno indicato che HB nutriti e ingerito il colorante alimentare verde, che era evidente dal loro escrementi colorati verdi, rispetto al HB che hanno ingerito le verdure immersione nell'acqua, che aveva chiari escrementi (Figura 3).
Tecniche aggiuntive per la consegna transitoria di dsRNA di spruzzatura o radice/suolo ammollo risultati nell'assorbimento di dsRNA in tutta la pianta tessuti65,66. Prodotti spruzzabili basati su RNAi sono in via di sviluppo e potrebbero essere disponibili presto in attesa di approvazione. Consegna di dsRNA nei campi utilizzando inzuppare spray o radice può essere di aiuto nella gestione di insetti invasivi42,67. Piantine e alberi di agrumi full-size sono stati esposti al dsRNA spray fogliare, oppure di suolo o radice nuda inzuppando, rispettivamente (Figura 4). I risultati hanno indicato che RNAds consegnati o spruzzi o terreno/nudo inzuppare radice potrebbe essere rilevato in piante di agrumi (2,5 m di altezza) per 7 settimane post una singola esposizione di 2 g di dsRNA42. Consegna e l'ingestione di psyllid dsRNA-AK (20 ng / µ l) della psyllid mortalità aumentata di 30-45% (Figura 4)42.
In vitro trascritto dsRNA possa essere consegnato in modo efficiente agli insetti polifago utilizzando staminali rubinetto (iniezioni di tronco) di gene specifico dsRNA direttamente nei tessuti vascolari della pianta, che può essere acquisito dagli insetti quando predano tali piante44 (Figura 5). Per alberi di agrumi che sono stati esposti al dsRNA da iniezioni di tronco, il dsRNA potrebbe essere rilevato in piante di agrumi invecchiati (circa 1 m di altezza) per 7 settimane dopo una singola esposizione con 6 mL di 1,7 mg/mL di dsRNA in una soluzione di dnasi/RNAsi acqua gratuita (Figura 5A B). Floema-alimentazione insetti Pentatomomorfi quindi erano autorizzati a nutrire queste piante ospiti trattati con dsRNA. Si presume che il dsRNA è infuso con successo e spostato attraverso il sistema vascolare delle piante agrumi per ingestione di ACP, che ha dimostrato la mortalità quando alimentato il dsRNA-AK42.
Analisi biologiche sviluppato dal 2008 al 2012, sono state proiettate attraverso un'ampia varietà di piante in vaso e indicate per assicurare la consegna di dsRNA in un modo con cui piante possono assorbire e traslocano il dsRNA per diffusione sistemica dsRNA41,42 . Un metodo utilizza un componente di argilla assorbente con dsRNA adsorbimento nella matrice dell'argilla; Questo comprende una grande varietà di argille, terra di Fuller, Zeolite e altri, come anche altri materiali assorbenti, cellulosa, agar, bioplastiche, ecc argilla particelle sono portatori di acido nucleico libero di polvere che possono essere utilizzati per la consegna di principi attivi ad esempio dsRNA ai terreni per assorbimento della pianta e infine consegna agli insetti (Figura 6). L'argilla complesso chimicamente anche può essere configurato per rilasciare il dsRNA sotto pH specifici o condizioni ioniche. Metodi di consegna di argilla di dsRNA nelle piante hanno dimostrati di fornire dsRNA in vasi di agrumi e altre piante per oltre 14 mesi (dati non mostrati). Questo sistema di consegna può essere utilizzato per modificare i tratti di impianto, quali colori dei fiori, l'altezza della pianta (nanismo) o altri. Attualmente, l'utilizzo principale di questo metodo è per lo sviluppo di un efficace dei parassiti dell'insetto e controllo degli agenti patogeni (virus) o di gestione. L'approccio può essere conveniente per vivai e proprietari di case ed è un metodo non transgenica.

Figura 1 . Consegna dei nutrienti o dsRNA attraverso fagiolini. (A) segmenti di fagiolini sottili organici sono stati immersi e assorbito la soluzione in un tubo del microcentrifuge 2 mL contenente 300 µ l di ddH2O da solo o ddH2O con colorante alimentare verde, per 3 h. Tre 4th instar BMSB ninfe erano affamate per 24 h e messo in recipienti di coltura insieme 3 fagiolini per peschereccio. (B) BMSB si nutrono di segmenti di fagiolini immersi in acqua di penetrare attraverso i fagiolini per raggiungere le sostanze nutrienti con loro stiletti. (C) giorno 2 di BMSB alimentazione analisi biologica, frecce denotano gli escrementi. (D) giorno 3; Escrementi BMSB maggiore (indicati dalla freccia) osservato post ingestione di una soluzione di ddH2O e verde colorante attraverso fagiolini alimentare. Clicca qui per visualizzare una versione più grande di questa figura.
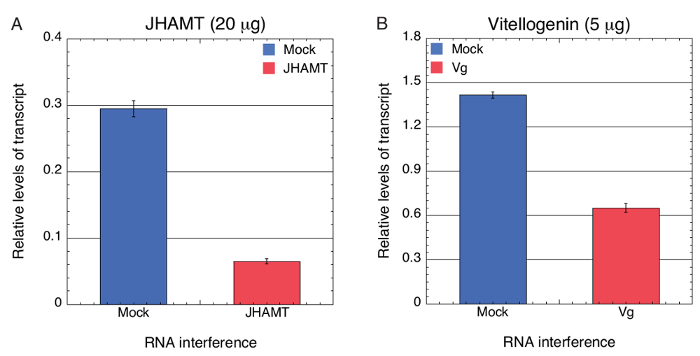
Figura 2 . Analisi di RT-PCR quantitativa per misurare il livello di trascrizione dopo svuotamento RNAi-mediata di JHAMT e Vg in BMSB. RNA totale da 3 singoli BMSB 4th instar ninfe alimentati su JHAMT (A) 20 µ g (0,067 µ g / µ l) e Vg (B) 5 µ g (0,017 µ g / µ l) RNAds a 300 µ l di ddH2O trasportati con segmenti di fagiolini, è stato isolato e la livelli della trascrizione sono stati misurati da qPCR. LacZ dsRNA (Mock) servita come controllo negativo. RNA 18s BMSB è stato usato come standard interno per correggere le differenze nel recupero di RNA dai tessuti. Risultati riportati sono da tre replicati biologici e barre di errore indicano SEM Un'analisi unidirezionale della varianza (ANOVA) è stata eseguita per verificare la significatività statistica dei dati, p < 0,0001. Risultati riprodotti da Ghosh et al. 62 Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 . La consegna orale del trattamento in Harlequin bug (M. histrionica ) utilizzando verdi del cavolo riccio bambino. Verdi del cavolo riccio biologici del bambino erano lavate con ipoclorito di sodio 0,2%, tagliati e immerso in un tubo di microcentrifuga PAC-meno di 2 mL contenente 300 µ l di soluzione di (A) dnasi/RNase free ddH2O, o (B) dnasi/RNase free ddH2 Soluzione O con colorante alimentare verde, per un periodo di 3 h. Tre 4 ° instar HB ninfe erano affamate per 24 h e quindi messo in recipienti di coltura e autorizzate a nutrire su questi verdi del cavolo riccio per 3 giorni. Frecce bianche indicano escrementi osservati il giorno 3 post allattamento. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 . Radice e spray fogliare inzuppare applicazione in alberi di agrumi e piantine. Le piante selezionate o piantine preventiva da utilizzare non sono abbeverati per 2-3 giorni a lasci il terreno asciugarsi a umido, ma non completamente asciutto. (A) gli alberi erano ricoperte prima e 200 mL di soluzione di dsRNA (0,5 mg/mL) in dnasi/RNAsi acqua gratuita era applicata a mano flacone spray pompa per la calotta inferiore. (B), 100 mL di dsRNA soluzione (1 mg/mL) in acqua libera dnasi/RNAsi è stato applicato al terreno delle piantine nei terreni parzialmente asciutti. (C) 100 mL di soluzione di dsRNA (1 mg/mL) in dnasi/RNAsi acqua gratuita è stata applicata per le radici nude delle piantine per circa 3 h. (D) ACP alimentazione su semenzali che avevano assorbito dsRNA dalle radici nude, ha mostrato un aumento della mortalità ACP. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5 . Iniezione del tronco dell'albero di agrumi Seedling. Piantine di agrumi circa 1 m di altezza sono stati iniettati con 1,7 mg/mL di dsRNA. (A) forare nei semenzali di agrumi usando un trapano di diametro di 10 mm per inserire l'iniettore nel gambo della pianta. La punta di rame esposta di ogni iniettore è stato avvolto con un nastro largo 0,6 cm (¼ di pollice) di pellicola per evitare perdite di tenuta. Iniettori (B) riempiti con 6 mL di soluzione colorata sono stati applicati al tronco (tronco) delle piantine. Gli iniettori sono stati lasciati sul posto per circa 6-10 h per l'assorbimento completo della soluzione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6 . Consegna di emendamento del suolo argilla di dsRNA nelle piante attraverso terreno. Una nuova linea di consegnare materiale: argilla che è un elemento portante libero dell'acido nucleico di polvere per uso nella realizzazione di principi attivi quali dsRNA ai terreni per l'assorbimento in piante e in definitiva in insetti. Cruda (A) e (B) al forno di argilla raffiguranti tolleranza/ritenzione di acqua. Clicca qui per visualizzare una versione più grande di questa figura.
| Geni target di potenziali H. halys | |||
| Adesione | Dimensioni | Gene nome/omologia | |
| XP_014293026.1 | 491 | Vitellogenina-A1-come (Vg) (Possibile isoforme: vitellogenina-2-come isoforma X1 XP_014291483.1; isoforma vitellogenina-2-come X2 XP_014291484.1). | |
| XP_014290953.1 | 545 | Ormone giovanile acido O-metiltransferasi-come (JHAMT) (Possibile omologo: ormone giovanile acido XP_014283772.1 O-metiltransferasi). | |
| Primer | |||
| PCR | |||
| Gene nome/omologia | Nome di primer | Sequenza | |
| VG | BMSB Vitellog P2 F | CAATTTGATCCACCGACTGTT | |
| VG | BMSB Vitellog P2 R | CCGCATGAATCTTACTCTGGA | |
| JHAMT | BMSB JH P1 F | GGATGCTTATGAATAATCCAG | |
| JHAMT | BMSB JH P1 R | GTATAGGATTGCCATTTTGG | |
| T7 PCR | |||
| VG | T7 BMSB Vitellog P2 4263 F | GAATTAATACGACTCACTATAGGGAGACCAAAGTTGGAAGGGAATGA | |
| VG | T7 BMSB Vitellog P2 4753 R | GAATTAATACGACTCACTATAGGGAGACCGCATGAATCTTACTCTGGA | |
| JHAMT | BMSB JH T7 P1 F | GAATTAATACGACTCACTATAGGGAGAGGATGCTTATGAATAATCCAG | |
| JHAMT | BMSB JH T7 P1 R | GAATTAATACGACTCACTATAGGGAGAGTATAGGATTGCCATTTTGG | |
| LacZ | T7 LacZ RNAi F | GAATTAATACGACTCACTATAGGGAGATGAAAGCTGGCTACAGGA | |
| LacZ | T7 LacZ RNAi R | GAATTAATACGACTCACTATAGGGAGAGCAGGCTTCTGCTTCAAT | |
| AK | dsAK-F | TAATACGACTCACTATAGGGAGTGGCATTCTTGTATGGCGTA | |
| AK | dsAK-R | TAATACGACTCACTATAGGGAGGCCTGCAAGAATCTGTCTCC | |
| AK | dsAK 50-F | TAATACGACTCACTATAGGGAGTGGCATTCTTGTATGGCGTA | |
| AK | dsAK 50-R | TAATACGACTCACTATAGGGAGTGAAGCCCTTGTGGTAGTC | |
| AK | dsAK 30-F | TAATACGACTCACTATAGGGAGACCCGGACTCTGGAGTAGG | |
| AK | dsAK 30-R | TAATACGACTCACTATAGGGAGGCCTGCAAGAATCTGTCTCC | |
| GFP | dsGFP-F | TAATACGACTCACTATAGGGAGCCAACACTTGTCACTACTTTCTCTT | |
| GFP | dsGFP-R | TAATACGACTCACTATAGGGAGGTAATGGTTGTCTGGTAAAAGGA | |
| qPCR | |||
| VG | RT Vitellog P2 F | TTGATAGTTGTTTGGATTTTGAAGGT | |
| VG | RT Vitellog P2 R | TCTTACTTGATCAGCGCTCAGAA | |
| JHAMT | BMSB JH RT P1 F | AGGAAAACCCAAAATGGCAAT | |
| JHAMT | BMSB JH RT P1 R | ATGTATTCTTCTTTTGGATCTTTTCTTGAG | |
| 280 | BMSB 18S F3 | ATGCCCCCGCCTGTCCTTATT | |
| 280 | R3 BMSB 18S | TGAAAGCAGCCTGAATAGTGG | |
| GFP | GFP-F | GGTAAAAGGACAGGGCCATC | |
| GFP | GFP-R | TCAAGGAGGACGGAAACATC | |
| AK | AK quant-F | CGGACTTGAGGGAGAACTGA | |
| AK | AK quant-R | GTGGTAGATACCGCGACCAG | |
| un idromassaggio | -Idromassaggio-F | GCGTCTCTTCGGTTTGACGG | |
| un idromassaggio | -Idromassaggio-R | CACTTCACCATCTGGTTGGC | |
Tabella 1. Sequenze di oligonucleotidi per RNAi. Sono elencati i geni e oligonucleotidi utilizzati per la generazione di frammenti, dsRNA e qPCR primer PCR per analizzare i livelli di trascrizione.
Supplementare Video 1: agar e gel come assorbenti per consegna e rilascio prolungato di dsRNA. Gel con soluzione di dsRNA che possono essere usati come esca o diete per vari artropodi e idratata agar sintetico o naturale. Clicca qui per scaricare questo video
Discussione
RNAi ha dimostrato di essere uno strumento importante per esplorare la funzione biologica del gene e regolazione, con un grande potenziale per essere utilizzato per la gestione dei parassiti di insetto19,68,69,70, 71. il design e la scelta di un appropriato geni per silenziamento in una determinata specie di insetti e il metodo di consegna della dsRNA(s) corrispondente all'insetto sono sia della massima importanza. Il metodo ottimo per la consegna di dsRNA in un insetto deve essere determinato empiricamente, insieme alla scelta relativa dose per la consegna, come certi metodi possono offrire vantaggi e altre limitazioni. Per lo sviluppo di un biopesticida molecolare che possono in definitiva essere adatto a rilascio nell'ambiente, è necessario un metodo di consegna fattibile, efficiente e vantaggioso. Ad esempio, dsRNA topica ha dimostrato di essere efficace per la consegna di dsRNA per controllo di insetto agli agrumi e viti42,44. Strategie innovative come l'uso di esche, soluzioni di saccarosio, lievito o produzione batterica dsRNA per ingestione diretta, applicazione topica di dsRNA sulle piante, o produzione di RNAds specifico di piante transgeniche modificate, hanno avanzato lo sviluppo di efficaci controlli basati su RNAi19,72.
Un buon esempio è dimostrato qui con l'uso di fagiolini di consegnare dsRNA (Figura 1 e Figura 2) progettato per specificamente impatto e ridurre un insetto parassita di importanza globale. La nuova concezione verdura dsRNA mediate consegna protocollo utilizzando segmenti di fagioli verdi immersi e saturata di dsRNA è stato usato per efficacemente geni target specifici per lo sviluppo larvale in BMSB. I fagioli verdi sono una delle molte verdure che sono divorate dai BMSB e così questi sono stati utilizzati come un mezzo per fornire dsRNA. Altri mezzi di dsRNA consegna sono stati testati (dati non mostrati) ma non hanno avuto successo nella fornitura di nutrizione per il BMSB probabilmente a causa di differenze nella struttura vascolare. Di conseguenza, abbiamo usato segmenti di fagiolini di consegnare in vitro sintetizzato dsRNA alle ninfe BMSB. Gli acidi nucleici consegnati attraverso una pianta o vegetale tecnica mediata può essere potenzialmente in grado di indurre RNAi nell'insetto di scelta come osservato qui con svuotamento dei geni JHAMT e Vg in BMSB (Figura 2)62.
Questo protocollo di recapito di dsRNA mediata vegetale è stato utilizzato con successo per indurre RNAi non solo in BMSB, ma anche in HB utilizzando però verdi del cavolo riccio (Figura 3), strategie e metodi devono essere ottimizzati per ogni gene e l'insetto. Pertanto, si raccomanda che venga verificata la vari metodi per la consegna anche per quanto riguarda la destinazione più geni di interesse individualmente o di impilamento RNAds almeno due per ottenere meglio penetranza fenotipica. Diversi metodi sono stati riassunti per il recapito di dsRNA a insetti e cellule di insetti tra cui13,22, ammollo73,74, microinjection75e altre tecniche di alimentazione76 utilizzato per assorbimento di dsRNA per indurre RNAi sistematica. Nuovi metodi per la consegna orale di dsRNA per indurre RNAi in altri insetti da ingestione sulle piante trattate non transgenica inoltre sono stati esplorati (Figura 4, Figura 5e Figura 6). Alberi di agrumi sono stati dimostrati per assorbire RNAds sia attraverso le radici, gambo rubinetto (iniezioni di tronco), o spray fogliare42,44. In precedenza, alberi di agrumi e vigneti maturi sono stati trattati con insetto dsRNA specifico corrispondente al gene AK ACP sia in esse. Queste piante trattate ha causato un aumento della mortalità per i paesi ACP e la esse per fino a varie lunghezze di tempo41,45. Insieme, questi risultati dimostrano che dsRNA può ostacolare l'espressione di specifici geni negli insetti studiati.
Le sfide che interessano il successo di silenziamento dell'espressione genica comprendono gruppi unici di dsRNA nucleasi (dsRNases) espresse principalmente nel tessuto dell'intestino degli insetti e secrezioni salivari o il pH dell'intestino che può essere responsabile della degradazione di dsRNA47 ,77,78. Tuttavia, per superare tale degradazione, RNAi sistemica può essere indotta in modo efficiente in insetti che utilizzano le più alte concentrazioni di dsRNA e/o utilizzando il PEG nella dieta per la consegna orale di gene-specific del dsRNA per superare tale degradazione62, 79. consegna e l'assorbimento di dsRNA può anche essere stabilizzati con l'aiuto di molecole carrier, come nanoparticelle80 come chitosano48, liposomi come Lipofectamine 2000 e Metafectene76, polietilene glicole79, argilla nanosheets81e carbonio quantum dot50. La ricerca è in corso per migliorare l'erogazione efficace di dsRNA utilizzando pezzi di agar e gel infusi con gene specifico dsRNA (dati non indicati, vedere Supplemental Video 4). Questa tecnica può essere utilizzata per la consegna di una dose efficace di dsRNA formiche che possono trasportare il dsRNA infuso resina o agar al nido come cibo.
Oltre alla stabilità del dsRNA, persistenza a lungo termine di dsRNA nei tessuti vegetali è di importanza, soprattutto per le colture agricole. dsRNA distribuito attraverso tessuti vascolari di piante, frutti o verdure può accumularsi nel xylem e floema con attività enzimatica ridotta prima di essere ingerito dagli insetti per indurre il meccanismo della RNAi. Può essere necessaria per alcune applicazioni di avere dsRNA persistono per un breve periodo, come per 6 giorni in fagiolini o più, per 36 h nel suolo62,82 affinché l'accumulo degli acidi nucleici nell'ambiente diventa improbabile. Tuttavia, Neena et al hanno dimostrato che nanosheets potrebbe proteggere grandi RNAds da degradazione prematura come così come mediare loro rilascio prolungato su superfici di foglia su un periodo di almeno 30 giorni81.
Nel complesso le strategie di consegna di dsRNA discusse qui potrebbero essere usate per silenziare insetto geni specifici per la gestione dei parassiti. Fornitura di dsRNA alle piante attraverso l'acqua di irrigazione, inzuppare di radice o iniezione del tronco potrebbe essere una strategia efficace per gli insetti parassiti, come alimentatori di radice, per cui non è attualmente disponibile alcun metodo di controllo efficiente. Consegna di dsRNA utilizzando un vettore o di stabilizzazione medio come l'argilla o agar può aggiungersi direttamente al suolo per l'assorbimento da parte delle piante. Una delle cause principali per la lentezza dei progressi nello sviluppo di RNAi mediata biopesticidi molecolare è stata la mancanza di tecniche di consegna orale efficiente per avviare RNAi efficiente e stabilità sotto condizioni ambientali83. I metodi descritti qui possono essere utilizzati in futuro per fornire trattamenti genico mediato dell'acido nucleico per piantare la consegna orale sap alimentazione così come masticazione degli insetti per ridurre il danno dell'insetto nella produzione alimentare globale e sviluppare dei parassiti ecologico sostenibili gestione.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori riconoscono con gratitudine Donald Weber e Megan Herlihy (USDA, ARS Beltsville, MD) per fornire BMSB e HB per la sperimentazione e mantenere le colonie; e Maria T. Gonzalez, Salvador P. Lopez, (USDA, ARS, Fort Pierce, FL) e Jackie L. Metz (University of Florida, Fort Pierce, FL) per manutenzione di Colonia, preparazione dei campioni e le analisi.
Materiali
| Name | Company | Catalog Number | Comments |
| BMSB (H. halys) insects | USDA | ||
| ACP (D. citri) insects | USDA | ||
| organic green beans | N/A | ||
| Citrus plants | USDA | ||
| sodium hypochlorite solution | J.T. Baker | ||
| green food coloring | McCormick & Co., Inc | ||
| Thermo Forma chambers | Thermo Fisher Scientific | ||
| Magenta vessel (Culture) | Sigma | ||
| Primers | IDT DNA | ||
| SensiMix SYBR | Bioline | ||
| qPCR ABI 7500 | Applied Biosystems | ||
| Spray bottle | N/A | ||
| Parafilm | American Can Company | ||
| TaKaRa Ex Taq | Clontech | ||
| QIAquick | Qiagen |
Riferimenti
- Hoebeke, E. R., Carter, M. E. . Halyomorpha halys (Stǻl)(Heteroptera: Pentatomidae): a polyphagous plant pest from Asia newly detected in North America. , (2003).
- Leskey, T. C., Hamilton, G. C., et al. Pest Status of the Brown Marmorated Stink Bug, Halyomorpha Halys in the USA. Outlooks on Pest Management. 23 (5), 218-226 (2012).
- Peiffer, M., Felton, G. W. Insights into the Saliva of the Brown Marmorated Stink Bug Halyomorpha halys (Hemiptera: Pentatomidae). PloS one. 9 (2), e88483 (2014).
- Anderson, B. E., Miller, J. J., Adams, D. R. Irritant contact dermatitis to the brown marmorated stink bug, Halyomorpha halys. Dermatitis : contact, atopic, occupational, drug. 23 (4), 170-172 (2012).
- Mertz, T. L., Jacobs, S. B., Craig, T. J., Ishmael, F. T. The brown marmorated stinkbug as a new aeroallergen. The Journal of allergy and clinical immunology. 130 (4), 999-1001 (2012).
- McClean, A. P. D., Schwarz, R. E. Greening or blotchy-mottle disease of citrus. Phytophylactica. 2 (3), 177-194 (2012).
- Bové, J. M. Huanglongbing: a destructive, newly-emerging, century-old disease of citrus. Journal of Plant Pathology. 88 (1), 7-37 (2006).
- Kuhar, T., Morrison, R., Leskey, T., Aigner, J. . Integrated pest management for brown marmorated stink bug in vegetables. , (2016).
- Tiwari, S., Mann, R. S., Rogers, M. E., Stelinski, L. L. Insecticide resistance in field populations of Asian citrus psyllid in Florida. Pest management science. 67 (10), 1258-1268 (2011).
- Baum, J. A., Bogaert, T., et al. Control of coleopteran insect pests through RNA interference. Nature Biotechnology. 25 (11), 1322-1326 (2007).
- Hannon, G. J. RNA interference. Nature. 418 (6894), 244-251 (2002).
- Mello, C. C., Conte, D. Revealing the world of RNA interference. Nature. 431 (7006), 338-342 (2004).
- Macrae, I. J., Zhou, K., et al. Structural basis for double-stranded RNA processing by Dicer. Science(New York, N.Y.). 311 (5758), 195-198 (2006).
- Bernstein, E., Caudy, A. A., Hammond, S. M., Hannon, G. J. Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature. 409 (6818), 363-366 (2001).
- Ketting, R. F., Fischer, S. E., Bernstein, E., Sijen, T., Hannon, G. J., Plasterk, R. H. Dicer functions in RNA interference and in synthesis of small RNA involved in developmental timing in C. elegans. Genes & development. 15 (20), 2654-2659 (2001).
- Agrawal, N., Dasaradhi, P. V. N., Mohmmed, A., Malhotra, P., Bhatnagar, R. K., Mukherjee, S. K. RNA interference: biology, mechanism, and applications. Microbiology and molecular biology reviews : MMBR. 67 (4), 657-685 (2003).
- Martinez, J., Patkaniowska, A., Urlaub, H., Lührmann, R., Tuschl, T. Single-stranded antisense siRNAs guide target RNA cleavage in RNAi. Cell. 110 (5), 563-574 (2002).
- Bartel, D. P. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 116 (2), 281-297 (2004).
- Timmons, L., Fire, A. Specific interference by ingested dsRNA. Nature. 395 (6705), 854 (1998).
- Clemens, J. C., Worby, C. A., et al. Use of double-stranded RNA interference in Drosophila cell lines to dissect signal transduction pathways. Proceedings of the National Academy of Sciences of the United States of America. 97 (12), 6499-6503 (2000).
- Saleh, M. C., van Rij, R. P., et al. The endocytic pathway mediates cell entry of dsRNA to induce RNAi silencing. Nature cell biology. 8 (8), 793-802 (2006).
- Amdam, G. V., Simões, Z. L. P., Guidugli, K. R., Norberg, K., Omholt, S. W. Disruption of vitellogenin gene function in adult honeybees by intra-abdominal injection of double-stranded RNA. BMC biotechnology. 3, 1 (2003).
- Whyard, S., Singh, A. D., Wong, S. Ingested double-stranded RNAs can act as species-specific insecticides. Insect biochemistry and molecular biology. 39 (11), 824-832 (2009).
- Huvenne, H., Smagghe, G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: a review. Journal of Insect Physiology. 56 (3), 227-235 (2010).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391 (6669), 806-811 (1998).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Gatehouse, H. S., Gatehouse, L. N., Malone, L. A. Amylase activity in honey bee hypopharyngeal glands reduced by RNA interference. Journal of Apicultural. , (2004).
- Jaubert-Possamai, S., Le Trionnaire, G., Bonhomme, J., Christophides, G. K., Rispe, C., Tagu, D. Gene knockdown by RNAi in the pea aphid Acyrthosiphon pisum. BMC biotechnology. 7, 63 (2007).
- Martín, D., Maestro, O., Cruz, J., Mané-Padrós, D., Bellés, X. RNAi studies reveal a conserved role for RXR in molting in the cockroach Blattella germanica. Journal of Insect Physiology. 52 (4), 410-416 (2006).
- Bansal, R., Mittapelly, P., Chen, Y., Mamidala, P., Zhao, C., Michel, A. Quantitative RT-PCR Gene Evaluation and RNA Interference in the Brown Marmorated Stink Bug. PloS one. 11 (5), e0152730 (2016).
- Terenius, O., Papanicolaou, A., et al. RNA interference in Lepidoptera: an overview of successful and unsuccessful studies and implications for experimental design. Journal of Insect Physiology. 57 (2), 231-245 (2011).
- Sparks, M. E., Shelby, K. S., Kuhar, D., Gundersen-Rindal, D. E. Transcriptome of the Invasive Brown Marmorated Stink Bug, Halyomorpha halys (Stål) (Heteroptera: Pentatomidae). PloS one. 9 (11), e111646 (2014).
- Tabara, H., Grishok, A., Mello, C. C. RNAi in C. elegans: soaking in the genome sequence. Science (New York, N.Y.). 282 (5388), 430-431 (1998).
- Baum, J. A., Roberts, J. K. Chapter Five - Progress Towards RNAi-Mediated Insect Pest Management. Insect Midgut and Insecticidal Proteins. 47, 249-295 (2014).
- Walshe, D. P., Lehane, S. M., Lehane, M. J., Haines, L. R. Prolonged gene knockdown in the tsetse fly Glossina by feeding double stranded RNA. Insect Molecular Biology. 18 (1), 11-19 (2009).
- Turner, C. T., Davy, M. W., MacDiarmid, R. M., Plummer, K. M., Birch, N. P., Newcomb, R. D. RNA interference in the light brown apple moth, Epiphyas postvittana (Walker) induced by double-stranded RNA feeding. Insect Molecular Biology. 15 (3), 383-391 (2006).
- Bautista, M. A. M., Miyata, T., Miura, K., Tanaka, T. RNA interference-mediated knockdown of a cytochrome P450, CYP6BG1, from the diamondback moth, Plutella xylostella, reduces larval resistance to permethrin. Insect biochemistry and molecular biology. 39 (1), 38-46 (2009).
- Maori, E., Paldi, N., et al. IAPV, a bee-affecting virus associated with Colony Collapse Disorder can be silenced by dsRNA ingestion. Insect Molecular Biology. 18 (1), 55-60 (2009).
- Hunter, W., Ellis, J., Hayes, J., Westervelt, D., Glick, E. Large-scale field application of RNAi technology reducing Israeli acute paralysis virus disease in honey bees (Apis mellifera, Hymenoptera: Apidae). PLoS Pathogens. 6 (12), e1001160 (2010).
- Christiaens, O., Smagghe, G. The challenge of RNAi-mediated control of hemipterans. Current Opinion in Insect Science. 6, 15-21 (2014).
- Hunter, W. B., Hail, D., Tipping, C., Paldi, N. RNA interference to reduce sharpshooters, the glassy-winged sharpshooter, and the Asian citrus psyllid. Symposium. , 24-27 (2010).
- Hunter, W. B., Glick, E., Paldi, N., Bextine, B. R. Advances in RNA interference: dsRNA treatment in trees and grapevines for insect pest suppression. Southwestern Entomologist. , (2012).
- Hail, D. A., Dowd, S., Hunter, W. H., Bextine, B. R. Investigating the transcriptome of the potato psyllid (Bactericera cockerelli): toward an RNAi based management strategy. , 183-186 (2010).
- de Andrade, E. C., Hunter, W. B. RNA Interference-Natural Gene-Based Technology for Highly Specific Pest Control (HiSPeC). RNA INTERFERENCE. , (2016).
- Taning, C. N. T., Andrade, E. C., Hunter, W. B., Christiaens, O., Smagghe, G. Asian Citrus Psyllid RNAi Pathway - RNAi evidence. Scientific reports. 6, 38082 (2016).
- Andrade, E. C., Hunter, W. B. RNAi feeding bioassay: development of a non-transgenic approach to control Asian citrus psyllid and other hemipterans. Entomologia Experimentalis et Applicata. 162 (3), 389-396 (2017).
- Joga, M. R., Zotti, M. J., Smagghe, G., Christiaens, O. RNAi Efficiency, Systemic Properties, and Novel Delivery Methods for Pest Insect Control: What We Know So Far. Frontiers in physiology. 7, 553 (2016).
- Zhang, X., Zhang, J., Zhu, K. Y. Chitosan/double-stranded RNA nanoparticle-mediated RNA interference to silence chitin synthase genes through larval feeding in the African malaria mosquito (Anopheles gambiae). Insect Molecular Biology. 19 (5), 683-693 (2010).
- Li-Byarlay, H., Li, Y., et al. RNA interference knockdown of DNA methyl-transferase 3 affects gene alternative splicing in the honey bee. Proceedings of the National Academy of Sciences of the United States of America. 110 (31), 12750-12755 (2013).
- Das, S., Debnath, N., Cui, Y., Unrine, J., Palli, S. R. Chitosan, Carbon Quantum Dot, and Silica Nanoparticle Mediated dsRNA Delivery for Gene Silencing in Aedes aegypti: A Comparative Analysis. ACS applied materials & interfaces. 7 (35), 19530-19535 (2015).
- Nimesh, S. Recent patents in siRNA delivery employing nanoparticles as delivery vectors. Recent patents on DNA & gene sequences. 6 (2), 91-97 (2012).
- Draz, M. S., Fang, B. A., et al. Nanoparticle-mediated systemic delivery of siRNA for treatment of cancers and viral infections. Theranostics. 4 (9), 872-892 (2014).
- Swevers, L., Raikhel, A. S., Sappington, T. W. Vitellogenesis and post-vitellogenic maturation of the insect ovarian follicle. Comprehensive. , (2005).
- Tufail, M., Takeda, M. Molecular characteristics of insect vitellogenins. Journal of Insect Physiology. 54 (12), 1447-1458 (2008).
- Hagedorn, H. H., Kunkel, J. G. Vitellogenin and vitellin in insects. Annual review of entomology. , (1979).
- Brandt, B. W., Zwaan, B. J., Beekman, M. Shuttling between species for pathways of lifespan regulation: a central role for the vitellogenin gene family?. Bioessays. , (2005).
- Murphy, C. T., McCarroll, S. A., et al. Genes that act downstream of DAF-16 to influence the lifespan of Caenorhabditis elegans. Nature. 424 (6946), 277-283 (2003).
- Shinoda, T., Itoyama, K. Juvenile hormone acid methyltransferase: a key regulatory enzyme for insect metamorphosis. Proceedings of the National Academy of Sciences of the United States of America. 100 (21), 11986-11991 (2003).
- Bellés, X. Beyond Drosophila: RNAi in vivo and functional genomics in insects. Annual review of entomology. 55, 111-128 (2010).
- Nouzova, M., Edwards, M. J., Mayoral, J. G., Noriega, F. G. A coordinated expression of biosynthetic enzymes controls the flux of juvenile hormone precursors in the corpora allata of mosquitoes. Insect biochemistry and molecular biology. 41 (9), 660-669 (2011).
- Huang, J., Marchal, E., Hult, E. F., Tobe, S. S. Characterization of the juvenile hormone pathway in the viviparous cockroach, Diploptera punctata. PloS one. 10 (2), e0117291 (2015).
- Ghosh, S. K. B., Hunter, W. B., Park, A. L., Gundersen-Rindal, D. E. Double strand RNA delivery system for plant-sap-feeding insects. PloS one. 12 (2), e0171861 (2017).
- Khrimian, A., Zhang, A., et al. Discovery of the aggregation pheromone of the brown marmorated stink bug (Halyomorpha halys) through the creation of stereoisomeric libraries of 1-bisabolen-3-ols. Journal of natural products. 77 (7), 1708-1717 (2014).
- Hall, D. G., Richardson, M. L., El-Desouky, A., Halbert, S. E. Asian citrus psyllid, Diaphorina citri, vector of citrus huanglongbing disease. Entomologia Experimentalis et Applicata. 146 (2), 207-223 (2012).
- Murphy, K. A., Tabuloc, C. A., Cervantes, K. R., Chiu, J. C. Ingestion of genetically modified yeast symbiont reduces fitness of an insect pest via RNA interference. Scientific reports. 6, 22587 (2016).
- San Miguel, ., K, J. G., Scott, The next generation of insecticides: dsRNA is stable as a foliar-applied insecticide. Pest management science. 72 (4), 801-809 (2016).
- Li, H., Guan, R., Guo, H., Miao, X. New insights into an RNAi approach for plant defence against piercing-sucking and stem-borer insect pests. Plant, cell & environment. 38 (11), 2277-2285 (2015).
- Hull, D., Timmons, L. Methods for delivery of double-stranded RNA into Caenorhabditis elegans. Methods in molecular biology (Clifton, N.J.). 265, 23-58 (2004).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Burand, J. P., Hunter, W. B. RNAi: future in insect management. Journal of Invertebrate Pathology. 112 Suppl, S68-S74 (2013).
- Rodrigues, T. B., Figueira, A. . Management of Insect Pest by RNAi-A New Tool for Crop Protection. , (2016).
- Baumann, A. M. T., Bakkers, M. J. G., et al. 9-O-Acetylation of sialic acids is catalysed by CASD1 via a covalent acetyl-enzyme intermediate. Nature communications. 6, 7673 (2015).
- Araujo, R. N., Santos, A., Pinto, F. S., Gontijo, N. F., Lehane, M. J., Pereira, M. H. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug Rhodnius prolixus (Hemiptera: Reduviidae) by dsRNA ingestion or injection. Insect biochemistry and molecular biology. 36 (9), 683-693 (2006).
- Wuriyanghan, H., Rosa, C., Falk, B. W. Oral Delivery of Double-Stranded RNAs and siRNAs Induces RNAi Effects in the Potato/Tomato Psyllid, Bactericerca cockerelli. PloS one. 6 (11), e27736 (2011).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods (San Diego, Calif). 30 (4), 313-321 (2003).
- Yu, N., Christiaens, O., et al. Delivery of dsRNA for RNAi in insects: an overview and future directions). Insect Science. , (2012).
- Allen, M. L., Walker, W. B. Saliva of Lygus lineolaris digests double stranded ribonucleic acids. Journal of Insect Physiology. 58 (3), 391-396 (2012).
- Wynant, N., Santos, D., Verdonck, R., Spit, J., Van Wielendaele, P., Vanden Broeck, J. Identification, functional characterization and phylogenetic analysis of double stranded RNA degrading enzymes present in the gut of the desert locust, Schistocerca gregaria. Insect biochemistry and molecular biology. 46, 1-8 (2014).
- Ghosh, S. K. B., Gundersen-Rindal, D. E. Double strand RNA-mediated RNA interference through feeding in larval gypsy moth, Lymantria dispar (Lepidoptera: Erebidae). European Journal of Entomology. 114, 170-178 (2017).
- Baigude, H., Rana, T. M. Delivery of therapeutic RNAi by nanovehicles. Chembiochem : a European journal of chemical biology. 10 (15), 2449-2454 (2009).
- Mitter, N., Worrall, E. A., et al. Clay nanosheets for topical delivery of RNAi for sustained protection against plant viruses. Nature plants. 3, 16207 (2017).
- Dubelman, S., Fischer, J., et al. Environmental fate of double-stranded RNA in agricultural soils. PloS one. 9 (3), e93155 (2014).
- Kola, V. S. R., Renuka, P., Madhav, M. S., Mangrauthia, S. K. Key enzymes and proteins of crop insects as candidate for RNAi based gene silencing. Frontiers in physiology. 6, 119 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon