Method Article
Yüksek çözünürlüklü Solunum Ölçümleri için Diferansiyel Santrifüj tarafından İskelet Kası Bozulmamış Mitokondri izolasyonu
Bu Makalede
Özet
Here, a quadriceps muscle specimen is taken from an anaesthetized pig and mitochondria are isolated by differential centrifugation. Then, the respiratory rates of mitochondrial respiratory chain complexes I, II and IV are determined using high-resolution respirometry.
Özet
Mitochondria are involved in cellular energy metabolism and use oxygen to produce energy in the form of adenosine triphosphate (ATP). Differential centrifugation at low- and high-speed is commonly used to isolate mitochondria from tissues and cultured cells. Crude mitochondrial fractions obtained by differential centrifugation are used for respirometry measurements. The differential centrifugation technique is based on the separation of organelles according to their size and sedimentation velocity. The isolation of mitochondria is performed immediately after tissue harvesting. The tissue is immersed in an ice-cold homogenization medium, minced using scissors and homogenized in a glass homogenizer with a loose-fitting pestle. The differential centrifugation technique is efficient, fast and inexpensive and the mitochondria obtained by differential centrifugation are pure enough for respirometry assays. Some of the limitations and disadvantages of isolated mitochondria, based on differential centrifugation, are that the mitochondria can be damaged during the homogenization and isolation procedure and that large amounts of the tissue biopsy or cultured cells are required for the mitochondrial isolation.
Giriş
Mitokondrial biyoenerji ve solunum kapasiteleri permeabilize hücrelerin veya liflerin değil, aynı zamanda izole edilmiş mitokondride sadece incelenebilir. Bu çalışmada, yüksek çözünürlüklü Solunum ölçümleri için diferansiyel santrifüj kullanılarak sağlam iskelet kası mitokondri izole etmek için bir protokol açıklar.
Respirometrik bozulmadan mitokondri izole etmek için, doku homojen hale getirilir ve mitokondri bilinen bir diferansiyel santrifügasyon yöntemi ile izole edilir. Diferansiyel santrifüj yöntemi sıralı santrifüj ilk Pallade tarafından tanıtıldı doku homojenatlarında ve işçiler neredeyse 70 yıl önce 1 (artan bir hızla bir dizi) dayanır. Doku ilk makas kullanılarak kıyılmış ve gevşek tokmak bir cam homojenizatör mekanik olarak homojenize edilir. Daha sonra Homojenat düşük hız ve kesintisiz doku içeren ortaya çıkan pelet, hücresel santrifüj edilirenkaz ve çekirdekler atılır. Daha sonra, üst faz, yüksek hızda birkaç kez santrifüj uygulanır ve mitokondriyal zenginleştirilmiş fraksiyon toplanır. diferansiyel santrifüj yöntemin avantajları mitokondrinin yönündedir izole etmek için: i) yöntemi hızlı ve mitokondri (solunum deneyler mümkün olduğunca çabuk yapılmalıdır) 1-1.5 saat içinde izole edilebilir; ii) ucuzdur; ve iii) çok verimli ve diferansiyel santrifüjleme ile elde edilen mitokondri Solunum tahlilleri için yeterince saf olan. diferansiyel santrifüj yöntemin dezavantajları mitokondrinin olan izole etmek i) mitokondri hasarlı ve homojenizasyon sırasında uncoupled alabilirsiniz; ii) diğer hücresel bileşenleri ile mitokondri (kirlenmesi daha yıkama ek santrifüj adımları ile mitokondriyal pelet) tarafından çözülebilir; iii) diferansiyel santrüfüj adımları sırasında, örneğin farklı mitokondriyal alt popülasyonlar, seçme imkanı, mitAlt Yoğun ile ochondria 7 alınmayabilir; ve iv) mitokondriyal hücresel çevre eksik sadece teorik maksimum solunum ölçülebilir. Solunum deneyleri için mitokondri izole edilmesi için bir başka yöntem, yoğunluk gradyanlı santrifüj 2'dir. göre diğer hücresel bileşenleri izole edilmesi mitokondri neden Bu teknikte, doku ekstraktı sakaroz veya (santrifüj tüpünün dibinde daha yüksek bir yoğunluğa sahip), bir Percoll gradyanı eden bir çözeltiye üzerine yayıldı ve belli bir hızda santrifüj onların yoğunlukları. Bu yöntem genellikle sinaptozomlarda çok düşük kirlenme beyin mitokondri izole etmek için kullanılır. Bununla birlikte, yoğunluk gradyan santrifüjü ile izole edilmiş sıçan karaciğeri mitokondri yüksek diğer hücresel organellerin 3 kirlenir. Bu yöntemin sınırlamaları biri santrifüj tüpünde sukroz gradient mevcut bu yüzden kopma olabilir kiBana mitokondri (ozmotik şok).
doku tipine bağlı olarak; diferansiyel santrifüj ile sağlam mitokondri izolasyonu için dikkat etmeniz gereken bazı önemli faktörler vardır. İlk gerekliliği hassas bir şekilde doku homojenize etmek. böbrek, beyin ve karaciğer gibi yumuşak dokuların homojenleştirme sırasında uygulanan hafif bir mekanik kuvvetleri gerektirir. Bu tür çok daha güçlü mekanik kuvvetler gerektiren kalp ve iskelet kası gibi sert dokularda ile çelişmektedir. Kıyılmış doku önce genelde doku yumuşatmak için homojenizasyona proteinaz ile işlenir. Homojenizasyon ve santrifüj esnasında kullanılan bütün tampon soğuk buz olabilir ve sitozol 4, 5 ile uyumlu iyonik ve ozmotik kuvveti olan bir fizyolojik olarak ilgili pH sahip olmalıdır.
izole mitokondriyal biyoenerjitiklerinin okuyan avantajlarından biri, hücresel plazma zarları permeabi olması gerekmez olmasıdırmitokondrial dış membran bütünlüğünü tehlikeye düşürecek gibi digitonin veya saponin 4, 6 gibi deterjanlar ile lized. İzole mitokondri bir başka avantajı, örneğin, oksijen tüketimi mitokondriyal işlev analizi ile müdahale diğer sitosolik faktörlere bulunmamasıdır. İzole mitokondri ile dezavantajları santrifüj adımları sırasında belirli mitokondriyal popülasyonlarının olası seçimi, homojenleştirme sırasında mitokondriye zarar ve izole mitokondri 7, 8, iyi bir verim elde etmek için biyolojik örnekler, yüksek miktarlarda şartı vardır.
İzolasyon işleminden sonra, mitokondriyal komplekslerinin solunum hızları I, II ve IV-bağımlı (Devletleri 2, 3 ve 4) Yüksek çözünürlüklü Solunum kullanılarak tespit edilir. kompleks I-odaklı solunum, glutamatve malat adenozin difosfat (ADP) eklendi edilmektedir. Kompleks II odaklı solunum için, süksinat ADP ardından eklenir. Kompleks IV odaklı solunum, askorbat ve tetramethylphenylendiamine (TMPD) ADP 9, 10, 11, 12, ardından ilave edilir. Durum 2, tek başına alt-tabakaların mevcudiyetinde oksijen tüketimi anlamına gelir. Durum 3 substratları ve ADP mevcudiyetinde oksijen tüketimi anlamına gelir. Devlet 4 ADP tükenmesi sonra oksijen tüketimi anlamına gelir. Solunum kontrol oranı (RCR) oksijen tüketimi ATP üretimi kuplajın bir dizin ve durum 3 ve durum 4 13, 15 arasındaki oran olarak hesaplanmıştır.
Özetle, biz diferansiyel santrifüj ile fonksiyonel ve sağlam iskelet kası mitokondri izole etmek ve bu izole mitochon kullanmak için bir protokol tarifyüksek çözünürlüklü Respirometrik gibi işlevsel ve biyoenerjik çalışmalar için Dria.
Protokol
kuadriseps kas biyopsisi mitokondri diferansiyel santrifüjleme ile izole edilen bir anestezi domuz, alınır. Domuz başka deney için sonradan kullanılır. Çalışma Deney hayvanlarının bakımı ve kullanımı için Sağlık kılavuzların National Institutes uyarınca ve Kanton Bern, İsviçre Hayvan Bakım Komitesi onayı ile yapılır.
1. İskelet Kası Homojenizasyon ve Mitokondrial İzolasyon
- Tüketim bir anestezi domuz 5-10 gr kuadriseps kas örneği. Bu deneyde, domuz iskelet kası kullanımı. Bu protokol, aynı zamanda, diğer türlerden mitokondri izole etmek için kullanılabilir (örneğin, sıçan, fare, insan, vb.).
NOT: Bu adım cerrahisi konusunda uzman bir tıp uzmanı tarafından yapılır.- kas içine ketamin (20 mg / kg) ve ksilazin (2 mg / kg) ile oturaklı domuz anestezi içi ile indüklenen önceVenöz midazolam (0.5 mg / kg, artı atropin, 0.02 mg / kg). Ameliyat sırasında sürekli intravenöz propofol infüzyonu (h başına 4-8 mg / kg) ve fentanil (h 30 ug / kg) ile anestezi bakımı.
- Hemen buz soğukluğunda mitokondriyal yalıtım tamponu 20 mL (Tablo 1) ihtiva eden bir beher içinde doku örneği bırakın.
Not: Tamponlar homojenleştirme sırasında ve santrüfüj soğuk buz olabilir ve sitosol ile uyumlu iyonik ve ozmotik kuvveti olan bir fizyolojik olarak ilgili pH sahip olmalıdır. - Bir analitik daralı dengesine beher doku örneği tartılır. yalıtım tamponu 20 mL beher dengesini dara.
- bir buz kovası behere koyun.
NOT: buz kovası sıcaklığında homojenizasyon işlemi için bir sonraki tüm adımları uygulayın ve buz kovası tüm tamponları tutun. - beher iskelet kası Kıyma ince SCISS kullanılarak 3-4 dakika boyunca 1-2 mm'lik küçük parçalar halinde (buz üzerinde tutulur)ors.
- buz gibi soğuk izolasyon tamponu (20 mL her yıkama basamağı) ile iki kez beher kıyılmış doku durulayın.
- 5 mg proteaz / g doku ihtiva eden doku ağırlığı (g) başına yalıtım tamponu 10 hacim doku süspanse edin.
- Manyetik karıştırıcı ile bir buz banyosu içinde beher yerleştirin ve 10 dakika süre ile karıştırıldı.
- % 0.2 (ağırlık / hacim) yağsız büyükbaş hayvan serum albümini (BSA) ile desteklenmiş doku ağırlığı (g) başına yalıtım tamponu ilave 10 hacim beherde süspansiyon seyreltilir.
- % 0.2 BSA ile takviye edilmiş yalıtım tamponu her süzün ve% 0.2 BSA (her biri 20 mL yıkama adımı) ile desteklenmiş buz soğuğu yalıtım tamponu ile iki kez beher doku yıkayın.
- yağı alınmış BSA, 0.2% ile takviye edilmiş doku ağırlığı (g) başına yalıtım tamponu 10 hacim doku yeniden süspanse edin.
- Bir gevşek havan eli (10 vuruş) ile (buz üzerinde tutulur), bir yarı-otomatik cam homojenleştirici ile doku homojenize edilir.
NOT: HomogenizAynı şekilde, her zaman doku (vuruş aynı sayıda, örneğin, 10 vuruş) e. vuruş daha yüksek sayıda hasar ve mitokondri ayrılmalıdır olabilir. Tercihen, otomatik bir homojenleştirici kullanılarak doku homojen hale getirilir. El ile (ve sübjektif) cam homojenizatör içinde homojenize doku örnekleri izole mitokondri farklı kalitelerde üretebilir. - Santrifüj 10,000 x g'de 10 dakika boyunca 4 ° C'de homojenize dokusudur.
Not: Tüm santrifüj adımları sabit açılı rotor ile santrifüj yapılmaktadır. - serolojik pipeti kullanarak süpernatant atılır ve BSA ile desteklenmiş buz soğukluğunda yalıtım ortamı içinde pelet (10 ml / g doku) tekrar süspansiyon.
- Santrifüj 350 x g'de 10 dakika boyunca 4 ° C 'de süspansiyon.
- serolojik pipet kullanarak süpernatant rezerv ve pelet (hücresel enkaz) atın.
- (17 iplik / cm2), hücre Debr kaldırmak için gazlı iki katmanı boyunca (buz üzerinde tutulur) bir beher içine süpernatant Filtreolduğunu.
- Santrifüj 7,000 x g'de 10 dakika boyunca 4 ° C de süzüldü süspansiyon.
- Süpernatant atılır ve 7,000 x g'de 10 dakika boyunca 4 ° C'de% 0.2 (ağırlık / hacim) BSA ve santrifüj süspansiyonu ile takviye yalıtım tamponu (5 ml / g doku) ham mitokondriyal pelletini.
- Süpernatantı atın ve yıkama tamponu (Tablo 1) ham mitokondriyal pelletini. Santrifüj 7,000 x g'de 10 dakika boyunca 4 ° C'de tekrar süspansiyon.
- g Süpernatant atılır ve yıkama tamponu içinde ham mitokondriyal pelletini ve x, 7,000, 10 dakika boyunca 4 ° C'de tekrar süspansiyon santrifüj.
- Süpernatantı atın ve yıkama tamponu 1.0 ml ham mitokondriyal pelletini.
- mitokondriyal süspansiyonunun protein konsantrasyonu belirlemek ve buz üzerinde konsantre mitokondriyal süspansiyon tutun.
Not: Protein konsantrasyonu, standart bir yöntem kullanılarak ölçülebilir. - hemen öncetahlilleri Solunum için, 0.4 mg / ml mitokondriyal protein içeren bir son konsantrasyona kadar solunum tamponu içinde mitokondriyal süspansiyon tekrar süspansiyon.
2. Yüksek çözünürlüklü Solunum
- Yüksek çözünürlüklü Oksigraf odası içine solunum tamponu (Tablo 1) 16 Pipet 2.1 mL sürekli kararlı bir oksijen akışının sinyaline kadar 1 saat boyunca 37 ° C 'de hazne (700 rpm) içinde mevcut bir manyetik karıştırma çubuğu kullanılarak tampon karışmaya polarografik oksijen sensörü elde edilir.
NOT: Her Oksigraf odasının içinde Polarografik oksijen elektrotları, oksijen konsantrasyonu ölçmek ve her odasının içinde oksijen tüketimini (akı) hesaplayın. oksijen konsantrasyonu ve oksijen tüketim oranları (akı) veri toplama ve analiz yazılımı kullanarak bir bilgisayarda çevrimiçi gerçek zamanlı gösterilir. Buna ek olarak, doğru ve güvenilir sonuçlar elde etmek amacıyla, enstrümantal oksijen arka plan düzeltme olmalıüreticinin talimatlarına göre gerçekleştirilmiştir.
Not: solunum tamponu Doğru 2.1 mL durdurucuların kapatılmasından sonra 2.0 mL'lik nihai bir hücre hacmine kalibrasyonu için hazneye ilave edilir. - Üreticinin protokollerine 17 göre polarografik oksijen sensörünün bir hava kalibrasyonunu gerçekleştirin.
NOT: Hava Kalibrasyon sırasında, bir gaz fazı varken, medya oksijen konsantrasyonu 15-20 dk sırasına dengelenmeye olacaktır. sıcaklık, hava basıncı, ve medya -Oksijen konsantrasyon çözünürlüğüne bağlı olarak hesaplanabilir. - Hava kalibrasyon sonra Oksigraf odasından solunum orta aspire ve Oksigraf bir bölmeye adım 1.24 izole mitokondriyal süspansiyonu (0.4 mg / ml mitokondriyal protein) 2.1 ml.
NOT: solunum tampon hacmi kurmak alet ve üreticisine bağlıdır. yüksek çözünürlüklü Respirometrik için, solunum met 2.1 mLffer durdurucuların kapatılmasından sonra 2.0 mL'lik nihai bir hücre hacmine kalibrasyonu için hazneye ilave edilir. - durdurucunun sokulmasıyla Oksigraf odası kapatın.
- sabit bir oksijen akışı sinyali elde edilinceye kadar sürekli bir 3-5 dakika boyunca başlangıçtaki 37 ° C 'de hazne (700 rpm) içinde mevcut bir manyetik karıştırma çubuğu ve kayıt hücresel solunum ile mitokondriyal süspansiyon karıştırılır.
NOT: oksijen konsantrasyonu ve oksijen akı sinyal veri toplama ve analiz 17 için yazılım kullanan bir bilgisayarda çevrimiçi gerçek zamanlı gösterilir. - Daha sonra, aşağıdaki standart protokoller kullanılarak stoper titanyum enjeksiyon portu üzerinden mitokondriyal solunum için alt tabakaların ve inhibitörlerin enjekte edin.
3. Karmaşık I-bağımlı solunum
- adımda 2.1-2.5 ve tarif edilen prosedür takip edilerek izole mitokondriyal süspansiyonu (0.4 mg / ml) ihtiva eden bir Oksigraf odası hazırlamakistikrarlı bir sinyal beklemek.
- (0.4 mg / ml), odacık durdurucu titanyum enjeksiyon ağzı vasıtası ile ve izole mitokondriyal süspansiyonu içeren Oksigraf odası içine 0.8 M malat 12.5 uL (5 mM nihai konsantrasyon) ve 2 M glutamat 10 uL (10 mM son konsantrasyon) enjekte sabit bir oksijen akışı sinyali elde edilinceye kadar 3-5 dakika boyunca hücresel solunum kaydedin.
NOT: Aşağıdaki adımlarda tüm enjeksiyonlar şırıngalar kullanılarak stoper titanyum enjeksiyon portları aracılığıyla yapılmaktadır. - Daha sonra azalır ve (3-5 dk) stabilize, oda stoper titanyum enjeksiyon portu aracılığıyla Oksigraf odasına 0.05 M ADP (0.25 mM) 10 mcL enjekte edilir ve oksijen akı sinyal artar kadar mitokondriyal solunum kaydedin.
NOT: ADP ilavesinden sonra solunum plato ADP konsantrasyonu yüksek ve doyurucu olduğunu gösterir. solunum sırasında kullanılan mitokondri miktarına bağlı olarak, ADP konsantrasyonu titre edilmelidiristikrarlı bir devlet 3 oksijen tüketimi (maksimum solunum) için. mitokondriyal süspansiyon ADP eklenmesi (devlet 3 solunum) artacak oksijen tüketiminde bir artış ve oksijen akı sinyalini neden olacaktır. ADP tükendikten sonra, oksijen akı sinyali (devlet 4 solunum) azalacak.
4. Kompleks II bağımlı solunum
- adımda 2.1-2.5 açıklanmıştır ve istikrarlı bir sinyal bekleyin prosedür takip izole mitokondriyal süspansiyonu (0.4 mg / ml) ihtiva eden bir Oksigraf gözü hazırlayın.
- bir şırınga kullanılarak odası stoper titanyum enjeksiyon portu aracılığıyla Oksigraf odasına 0.2 mM rotenone (0.2 uM) 'DİKKAT' 2 mcL enjekte edilir ve istikrarlı bir oksijen akı sinyali elde edilene kadar 3-5 dakika hücresel solunum kaydedin.
NOT: Rotenon tehlikeli bir zehir olduğunu ve insan sağlığı üzerinde önemli bir etkiye sahip olabilir. - Oksigraf ch olarak 1 M süksinat (10 mM) 20 uL enjektekehribar ve istikrarlı bir oksijen akı sinyali kadar 3-5 dakika rekor mitokondriyal solunum elde edilir.
- Daha sonra azalır ve (3-5 dk) stabilize, stabilize, oda stoper titanyum enjeksiyon portu aracılığıyla Oksigraf odasına 0.05 M ADP (0.25 mM) 10 mcL enjekte edilir ve oksijen akı sinyal artar kadar hücresel solunum kaydedin.
NOT: mitokondriyal süspansiyon ADP eklenmesi (devlet 3 solunum) artacak oksijen tüketiminde bir artış ve oksijen akı sinyalini neden olacaktır. ADP tükendikten sonra, oksijen akı sinyali (devlet 4 solunum) azalacak.
5. Karmaşık IV-bağımlı solunum
- adımları protokol 2.5'e 2.1 ve sabit bir sinyal bekleyin tarif edilen prosedür izlenerek izole mitokondriyal süspansiyonu ihtiva eden bir Oksigraf odası (0.4 mg / ml) hazırlayın.
- Daha sonra 0.8 mM askorbat 2.5 uL (1 mM) enjekte edilir. Hemen ardından 0.2 2.5 uL enjekteM TMPD (0.25 mM) ve oksijen akı sinyal artar kadar Oksigraf odası ve kayıt hücresel solunum içine 0.05 M ADP (0.25 mM) 10 uL ve (3-5 dk) stabilize eder.
- Son olarak Oksigraf odası içine 1 M sodyum azit (5 mM) 'DİKKAT' 10 uL enjekte oksijen akı sinyali düşene kadar hücresel solunum kayıt ve stabilize eder.
NOT: Sodyum azid tehlikeli bir zehir olduğunu ve insan sağlığı üzerinde önemli bir etkiye sahip olabilir.
6. Sitokrom C Testi
- adımları protokol 2.5'e 2.1 ve sabit bir sinyal bekleyin tarif edilen prosedür izlenerek izole mitokondriyal süspansiyonu ihtiva eden bir Oksigraf odası (0.4 mg / ml) hazırlayın.
- (0.4 mg / ml), odacık durdurucu titanyum enjeksiyon ağzı vasıtası ile izole mitokondriyal süspansiyonu içeren Oksigraf odası içine 0.8 M malat 12.5 uL (5 mM nihai konsantrasyon) ve 2 M glutamat 10 uL (10 mM son konsantrasyon) enjektesabit bir oksijen akışı sinyali elde edilinceye kadar 3-5 dakika boyunca hücresel solunum kaydedin.
- Daha sonra azalır ve (3-5 dk) stabilize, oksijen akı sinyal artar kadar bölme stoper ve kayıt mitokondriyal solunum titanyum enjeksiyon portu aracılığıyla Oksigraf odasına 0.5 M ADP (2.5 mM) 10 mcL enjekte edilir.
- Son olarak, Oksigraf odası içine, 4 mM sitokrom c (10 uM) ve 5 uL enjekte etmek ve sabit bir oksijen akışı sinyali elde edilinceye kadar 5 dakika boyunca hücresel solunum kaydedin.
Sonuçlar
Kompleks I bağımlı solunum
İzole mitokondriyal kompleks I-bağımlı solunum hızları (devletler 2, 3 ve 4) yüksek çözünürlüklü Solunum (Şekil 1, temsili bir diyagram) kullanılarak belirlenmiştir. Mitokondrial kompleks I alt-tabakalar, glutamat ve malat, ADP ilave edildi ilave edilir. Durum 2, tek başına alt-tabakaların mevcudiyetinde oksijen tüketimi anlamına gelir. Durum 3 substratları ve ADP mevcudiyetinde oksijen tüketimi anlamına gelir. Devlet 4 ADP tükenmesi sonra oksijen tüketimi anlamına gelir. RCR ATP üretimi için oksijen tüketimi kuplajın bir indeks olup, Şekil 1 'de gösterildiği gibi ADP mitokondriyal solunum hızı artar, hemen (durum 3 solunum) eklenmesi üzerine, durum 3 ve durum 4 arasındaki oran olarak hesaplanır ve Daha sonra seviyelere çok s (devlet 4 solunum) azalırdurum 2. edilene imilar Bu yüksek RCR gösterir ve mitokondriyal bütünlüğü de izolasyon prosedürü sırasında korunur. Şekil 2 uygunsuz ve başarısız mitokondriyal izolasyon gösteren bir yüksek devlet 4 solunum hızı ile düşük devlet 3 solunum hızı ve RCR ölçümü temsil eden bir diyagram vardır. 4. durumda yüksek solunum hızı mitokondriyal proton leakiness 15 bir göstergesidir.

Şekil 1: Başarılı mitokondriyal izolasyon: mitokondriyal bütünlüğü iyi izolasyon işlemi sırasında korunur. glutamat ve substrat olarak malat (kompleks I-bağımlı solunum) kullanılarak yüksek çözünürlüklü Respirometrik gelen iz. mavi çizgi oksijen konsantrasyonunu temsil eder. Kırmızı çizgi oksijen akışını (oksijen konsantrasyonu eğimi) temsil eder. oksiizole mitokondri mevcut oksijen kullandıkça gen konsantrasyon zamanla azalır. Oksijen tüketimi pmol / (sx mg mitokondriyal protein) olarak ifade edilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
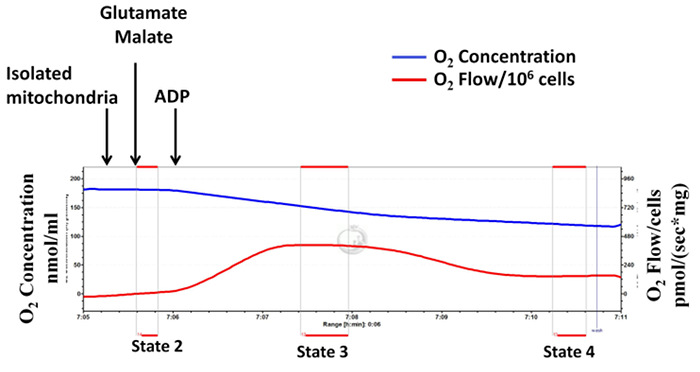
Şekil 2: Başarısız mitokondriyal izolasyon: mitokondriyal bütünlüğü de uygunsuz mitokondriyal izolasyon gösteren izolasyon işlemi sırasında korunmaz. glutamat ve substrat olarak malat (kompleks I-bağımlı solunum) kullanılarak yüksek çözünürlüklü Respirometrik gelen iz. mavi çizgi oksijen konsantrasyonunu temsil eder. Kırmızı çizgi oksijen akışını (oksijen konsantrasyonu eğimi) temsil eder. izole mitokondri uygunlğ kullandıkça oksijen konsantrasyonu zamanla azalırle oksijen. Oksijen tüketimi pmol / (sx mg mitokondriyal protein) olarak ifade edilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Kompleks II bağımlı solunum
İzole mitokondriyal kompleks II bağımlı solunum hızları (Devletleri 2, 3 ve 4) Yüksek çözünürlüklü Solunum (Şekil 3 temsili bir şeması) kullanılarak tespit edilmiştir. Bu tahlil için, mitokondriyal kompleks I rotenone eklenerek engellendi ve süksinat (karmaşık II alt-tabaka) ADP ardından eklenir. Şekil 3, ADP ilavesinden sonra, mitokondriyal solunum artar hemen sonra iyi bağlanmış mitokondri belirten durum 2'ninkine benzer seviyeleri, ve bu azalma olduğunu göstermektedirmitokondriyal bütünlüğü de izolasyon işlemi sırasında korunur. Bu tipik bir deney için hesaplanan RCR değeri mevcut literatür 10, 11, 23) 'de gösterilen değerlere yakın uyum içinde olduğu, 4.23 olduğunu. Şekil 4 uygunsuz izolasyon gösteren bir yüksek devlet 4 solunum hızı ile düşük devlet 3 solunum hızı ve RCR ölçümü temsil eden bir diyagram vardır.
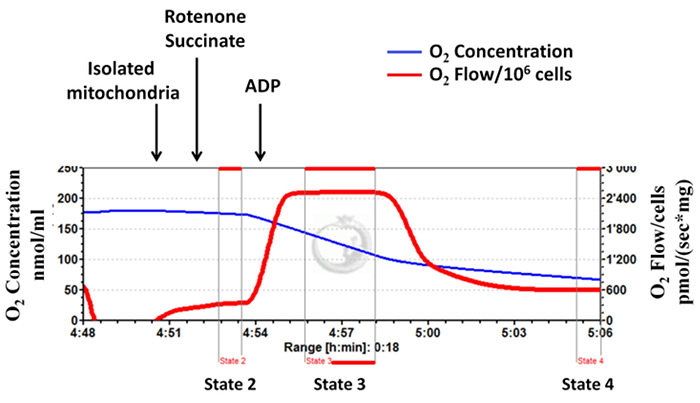
Şekil 3: Başarılı mitokondriyal izolasyon: mitokondriyal bütünlüğü iyi izolasyon işlemi sırasında korunur. Alt tabaka (kompleks II bağımlı solunum) olarak süksinat kullanılarak yüksek çözünürlüklü Respirometrik gelen iz. mavi çizgi oksijen konsantrasyonunu temsil eder. kırmızı çizgi oksijen akışını temsil (eğimoksijen konsantrasyonu). izole mitokondri mevcut oksijen kullandıkça oksijen konsantrasyonu zamanla azalır. Oksijen tüketimi pmol / (sx mg mitokondriyal protein) olarak ifade edilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 4: Başarısız mitokondriyal izolasyon: mitokondriyal bütünlüğü de uygunsuz izolasyon gösteren izolasyon işlemi sırasında korunmaz. Alt tabaka (kompleks II bağımlı solunum) olarak süksinat kullanılarak yüksek çözünürlüklü Respirometrik gelen iz. mavi çizgi oksijen konsantrasyonunu temsil eder. Kırmızı çizgi oksijen akışını (oksijen konsantrasyonu eğimi) temsil eder. oksijen konsantrasyonu izole Mitoc olarak zamanla azalırhondria mevcut oksijeni kullanırlar. Oksijen tüketimi pmol / (sx mg mitokondriyal protein) olarak ifade edilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Kompleks IV-bağımlı solunum
İzole mitokondriyal kompleks IV-bağımlı solunum oranları yüksek çözünürlüklü Solunum (Şekil 5, temsili bir diyagram) kullanılarak belirlenmiştir (3 devletler 2). Bu deney, askorbat / TMPD ADP kompleksi IV inhibe etmek için sodyum azit ve ardından, ilave edilir.
önce ve sodyum azid ilave edildikten sonra oksijen tüketimi arasındaki fark, gerçek bir kompleks IV solunum olarak yorumlanır. Şekil 5, Ağırlık, hacim, temsili bir diyagramıdırmitokondriyal bütünlüğü de izolasyon işlemi sırasında korunur belirten bir yüksek karmaşık IV-bağımlı devlet 3 solunum hızının ement. Bunun aksine, Şekil 6, uygun izolasyon gösteren düşük duruma 3 ölçümü temsil eden bir diyagramdır.

Şekil 5: Başarılı mitokondriyal izolasyon: mitokondriyal bütünlüğü iyi izolasyon işlemi sırasında korunur. Alt tabaka (kompleks IV-bağımlı solunum) olarak askorbat / TMPD kullanarak yüksek çözünürlüklü Respirometrik gelen iz. Kompleks IV solunum (devlet 3) öncesi ve sodyum azid ilave edildikten sonra oksijen tüketimini çıkarılarak yorumlanır. mavi çizgi oksijen konsantrasyonunu temsil eder. Kırmızı çizgi oksijen akışını (oksijen konsantrasyonu eğimi) temsil eder. oksijen konsantrasyonu izole mitocho olarak zamanla azalırMevcut oksijen kullanımı ndria. Oksijen tüketimi pmol / (sx mg mitokondriyal protein) olarak ifade edilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 6: Başarısız mitokondriyal izolasyon: mitokondriyal bütünlüğü de uygunsuz izolasyon gösteren izolasyon işlemi sırasında korunmaz. Alt tabaka (kompleks IV-bağımlı solunum) olarak askorbat / TMPD kullanarak yüksek çözünürlüklü Respirometrik gelen iz. Kompleks IV solunum (devlet 3) öncesi ve sodyum azid ilave edildikten sonra oksijen tüketimini çıkarılarak yorumlanır. mavi çizgi oksijen konsantrasyonunu temsil eder. Kırmızı çizgi oksijen akışını (oksijen konsantrasyonu eğimi) temsil eder. oksijen conceizole mitokondri mevcut oksijen kullandıkça ntration zaman içinde azalır. Oksijen tüketimi pmol / (sx mg mitokondriyal protein) olarak ifade edilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Mitokondrial dış membran bütünlüğünün değerlendirilmesi sitokrom c kullanarak
mitokondriyal hazırlık kalitesini değerlendirmek için, sitokrom-c testi glutamat ve malat, ADP ve sitokrom-c sonraki ilavesinden sonra mitokondriyal solunum ölçümü ile mitokondrial dış membran bütünlüğünü belirlemek için yapılır (ADP karmaşık II bağımlı devlet 3 solunum uyarılmış sitokrom c varlığı). Şekil 7 'de gösterildiği üzere, sitokrom C kompleks I bağımlı durumudur 3 Re geliştirmez İzole mitokondri Spiration vardır mitokondriyal dış membran sitokrom c kaybı ve mitokondriyal bütünlüğü korunur işaret etmektedir.
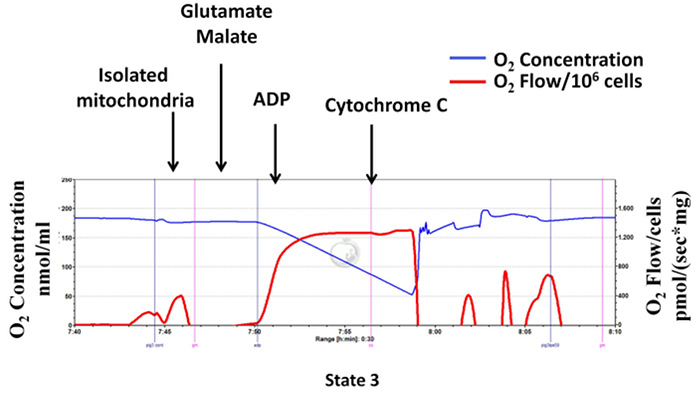
Şekil 7: Sitokrom c izole mitokondriyal solunumunu artırmak değildir: mitokondriyal bütünlüğü iyi izolasyon işlemi sırasında korunur. substrat olarak glutamat / malat (kompleks I-bağımlı solunum) kullanılarak yüksek çözünürlüklü Respirometrik gelen iz. mavi çizgi oksijen konsantrasyonunu temsil eder. Kırmızı çizgi oksijen akışını (oksijen konsantrasyonu eğimi) temsil eder. izole mitokondri mevcut oksijen kullandıkça oksijen konsantrasyonu zamanla azalır. Oksijen tüketimi pmol / (sx mg mitokondriyal protein) olarak ifade edilir.m / files / ftp_upload / 55251 / 55251fig7large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
| Mitokondriyal izolasyon tampon | |
| Kimyasal | konsantrasyon |
| KCI | 100 mM |
| MgSO 4 | 10 mM |
| morpholinopropane sülfonik asit (MOPS) | 50 mM |
| Ethylenedinitrilotetraacetic asit (EGTA), | 1.0 mM |
| ATP | 1.1 mM |
| pH 7.4 | |
| Mitokondrial yıkama tamponu | |
| Kimyasal | konsantrasyon |
| KCI | 100 mM |
| MOPS | 50 mM |
| EGTA | 0.5 mM |
| pH 7.4 | |
| Mitokondriyal solunum tampon 16 | |
| Kimyasal | konsantrasyon |
| Sakaroz | 110 mM |
| EGTA | 0.5 mM |
| MgCI2 | 3.0 mM |
| KCI | 80 mM |
| K-laktobionat | 60 mM |
| KH 2 PO 4 | 10 mM |
| boğa | 20 mM |
| Hepes | 20 mM |
| BSA | 1.0 g / l |
| pH 7.1 | |
Tablo 1: Tampon bileşimi.
Tartışmalar
Bu çalışmada, yüksek kaliteli, sağlam ve yüksek çözünürlüklü Respirometrik gibi fonksiyonel çalışmalar için kullanılabilecek diferansiyel santrifüj sıkıca bağlanmış iskelet kası mitokondri izole etmek için bir protokol açıklar.
sağlam ve sıkı birleştiğinde mitokondri izole etmek amacıyla, mevcut protokolü kapsamında dikkate alınması gereken bazı kritik noktalar vardır. iskelet dokusu hasat sonra, hemen buz gibi soğuk mitokondriyal izolasyon tampon dalmış olmalıdır. Bütün santrifüjleme aşamaları, 4 ° C'de yapılması ve mitokondriyal süspansiyon izolasyonu sırasında buz üzerinde her tutulmalıdır. izolasyon prosedürü mümkün olduğunca çabuk yapılmalıdır. Homojenat temiz deterjan içermeyen santrifüj tüplerine santrifüj edilmelidir. İşlem sonunda, mitokondriyal süspansiyon konsantre tutulmalı ve Solunum hemen önce seyreltilebilir. Solunum veriler ikinci pe başına pmol olarak ifade edilir berimitokondriyal protein r miligram, doğru izolasyondan sonra mitokondriyal protein konsantrasyonunu ölçmek için iyi bir teknik kullanmak önemlidir.
Bazı mitokondriyal izolasyon prosedürleri, mitokondrinin Kuplajsız veya yüksek çözünürlüklü Solunum kullanarak düzgün oksijen tüketmeyin yaşanabilir. Bu sorunların üstesinden gelmek için, doku, her zaman gevşek havan eli (aşama 1.12) sahip homojenleştirici kullanılarak aynı şekilde (vuruş aynı sayıda) içinde homojenize edilmesi gerekir. Burada, biz her zaman 10 vuruş ile otomatik homojenleştirici kullanılarak iskelet kas dokusunu homojenize. vuruş daha yüksek sayıda hasar ve mitokondri ayrılmalıdır olabilir. El ile (ve sübjektif) cam homojenizatör içinde homojenize doku örnekleri izole mitokondri farklı kalitelerde üretebilir. mitokondri dondurulması da Kuplajsız mitokondri neden olabilir ve bir santrüfüj ve bu te altında 4 ° C'de yapılır emin olmalısınızmperature. Tampon çözeltilerin pH değeri yanlış veya santrifüj tüpleri temiz değilse mitokondriyal bütünlüğü de tehlikeye girebilir. Bir santrifüj tüpleri, deterjan içermeyen ve düzgün yıkanmış olduğundan emin olun.
izolasyon sırasında dikkate alınması gereken ilk önemli faktörlerden biri, yumuşak bir şekilde doku homojenize etmek. Sert dokular çok daha güçlü mekanik kuvvetlerin ihtiyaç oysa yumuşak dokular, homojenizasyon sırasında uygulanan hafif mekanik kuvvetleri gerektirir. homojenizasyon ve santrifüj uygulamasında kullanılan tamponlar, soğuk buz olabilir ve sitosol ile uyumlu iyonik ve ozmotik kuvveti olan bir fizyolojik olarak ilgili pH sahip olmalıdır. İskelet kas gibi sert dokular için mekanik homojenleştirme sonrası, tripsin gibi proteazlar başka doku 4, 5 parçalamak eklenebilir.
d dayalı izole mitokondri sınırlamaları bazıları,ifferential santrifüj i) homojenizasyon ve izolasyon prosedürü 19 boyunca olası zarar mitokondri, ii) mitokondriyal izolasyonu için gerekli olan doku örneklerinin büyük miktarlarda, iii) belirli bir mitokondriyal elektron taşıma zinciri kompleksleri alt birimleri olası kaybı ve değişiklikler homojenleştirme sırasında ve vardır santrifüj 18 adımları, ve iv) mitokondriyal fonksiyon 18 engel olabilir homojenizasyon ve santrifüj adımları sırasında reaktif oksijen türlerinin, artan üretim. Dounce homojenleştirme ve diferansiyel santrifügasyon yöntemin avantajları bu yoğunluk gradyanı ile santrifüjleme 20 gibi mevcut yöntemlere göre solunum deneyler için, ham mitokondri izole etmek için bir yöntem hızlı ve mitokondri kısa bir süre içinde izole edilmektedir vardır. Bu nedenle, solunum Deney 1 içinde gerçekleştirilebilirh. Buna ek olarak, işlem çok verimli, ucuz ve diferansiyel santrifüjleme ile elde edilen mitokondri Solunum deneyleri için de kullanılabilir. İzole mitokondri kullanarak mitokondriyal oksijen tüketimi soruşturma permeabilize lifleri veya hücrelerin üzerinde çeşitli avantajlar sunmaktadır: mitokondriyal fonksiyon ve biyoenerjetik engel olabilir sitozolik proteinler ile anlamlı girişim; Hücresel permeabilization gerek; ve mitokondriyal solunum zinciri kompleksleri yüzeyler izole mitokondri doğrudan eklenebilir.
Iskelet kası mitokondriyal solunum ölçmek için alternatif yöntemlerden biri kullanımının kas lifleri 9 permeabilize olduğunu. İzole mitokondri içinde permeabilize kas liflerinin avantajlardan bazıları i) hiçbir mekanik homojenleştirme adımı gereklidir ve ii) doku (birkaç mg), çok az miktarda Solunum deneyleri için gerekli bulunmaktadır. p dezavantajıermeabilized kas lifi elyaf demeti mitokondri düşük oksijen difüzyon olduğunu. Bu difüzyon sınırlama Solunum deneyleri sırasında ADP büyük miktarda gerektirir. Diğer bir alternatif yöntem çok hızlı bir yöntem olup, mitokondri izole etmek için fark gösteren santrifüj adımlarına gerektirmeyen tüm doku homojenatlarında 22 kullanımıdır. Bütün doku homojenatının kullanımı da izolasyonu sırasında bazı mitokondri kaybını önlemek, ancak oksijen tüketimi mitokondriyal işlev analizi engelleyebilir mevcut olan diğer sitosolik faktörler olabilir.
Solunum testleri için ham mitokondri izole etmek için diferansiyel santrifüj mastering sonra, gelecekteki uygulama, mitokondriyal dış membran anti-TOM22 (dış mitokondrial membran 22 homoloğunun translocase) antikor coupl kullanarak gibi gelişmekte olan teknikler yoluyla izole mitokondri solunum kapasitelerinin araştırmaktıred manyetik boncuk 21.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This study was supported by the Swiss National Science Foundation (Grant 32003B_127619).
Malzemeler
| Name | Company | Catalog Number | Comments |
| ADP | Sigma | A 4386 | Chemical |
| Antimycin A | Sigma | A 8674 | Chemical, dissolve in ethanol |
| Ascorbate | Merck | 1.00127 | Chemical |
| ATP | Sigma | A 7699 | Chemical |
| BSA | Sigma | A 6003 | Chemical |
| EGTA | fluka | 3779 | Chemical |
| Glutamate | Sigma, | G 1626 | Chemical |
| Hepes | Sigma | H 7523 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| KH2PO4 | Merck | 1.04873 | Chemical |
| K-lactobionate | Sigma | L 2398 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Morpholinopropane sulphonic acid (MOPS) | Merck | 1.06129 | Chemical |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| Proteinase, bacterial | Sigma | P 8038 | Chemical |
| Sodium azide | Sigma | S2002 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Succinate | Sigma | S 2378 | Chemical |
| Schuett homogen-plus semiautomatic homogeniser | schuett-biotec GmbH | 3.201 011 | Tissue homogenizer |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
Referanslar
- Hogeboom, G. H., Schneider, W. C., Pallade, G. E. Cytochemical studies of mammalian tissues. I. Isolation of intact mitochondria from rat liver; some biochemical properties of mitochondria and submicroscopic particulate material. J. Biol. Chem. 172, 619-635 (1948).
- Sims, N. R. Rapid isolation of metabolically active mitochondria from rat brain and subregions using Percoll density gradient centrifugation. J. Neurochem. 55 (2), 698-707 (1990).
- Hartwig, S., et al. A critical comparison between two classical and a kit-based method for mitochondria isolation. Proteomics. 9 (11), 3209-3214 (2009).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 65, 1-35 (2001).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Niklas, J., Melnyk, A., Yuan, Y., Heinzle, E. Selective permeabilization for the high-throughput measurement of compartmented enzyme activities in mammalian cells. Anal. Biochem. 416 (2), 218-227 (2011).
- Kuznetsov, A. V., et al. Analysis of mitochondrial function in situ in permeabilized muscle fibers, tissues and cells. Nat. Protoc. 3 (6), 965-976 (2008).
- Perry, C. G., Kane, D. A., Lanza, I. R., Neufer, P. D. Methods for assessing mitochondrial function in diabetes. Diabetes. 62 (4), 1041-1053 (2013).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle: new perspectives of mitochondrial physiology. Int. J. Biochem. Cell Biol. 41 (10), 1837-1845 (2009).
- Vuda, M., et al. Effects of catecholamines on hepatic and skeletal muscle mitochondrial respiration after prolonged exposure to faecal peritonitis in pigs. Innate Immun. 18 (2), 217-230 (2012).
- Corrêa, T. D., et al. Angiotensin II in septic shock: effects on tissue perfusion, organ function, and mitochondrial respiration in a porcine model of fecal peritonitis. Crit. Care Med. 42 (8), e550-e559 (2014).
- Jeger, V., et al. Dose response of endotoxin on hepatocyte and muscle mitochondrial respiration in vitro. Biomed Res Int. 2015, 353074 (2015).
- Nicholls, D. G., Ferguson, S. J. . Bioenergetics. 3, (2002).
- Chance, B., Williams, G. R. The respiratory chain and oxidative phosphorylation. Adv. Enzymol. Relat. Subj. Biochem. 17, 65-134 (1956).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochem. J. 435 (2), 297-312 (2011).
- Gnaiger, E., Méndez, G., Hand, S. C. High phosphorylation efficiency and depression of uncoupled respiration in mitochondria under hypoxia. Proc. Natl. Acad. Sci. USA. 97 (20), 11080-11085 (2000).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol. Biol. 810, 25-58 (2012).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PLoS One. 6 (3), e18317 (2011).
- Picard, M., et al. Mitochondrial functional impairment with aging is exaggerated in isolated mitochondria compared to permeabilized myofibers. Aging Cell. 9 (6), 1032-1046 (2010).
- Graham, J. M. Purification of a crude mitochondrial fraction by density-gradient centrifugation. Curr. Protoc. Cell. Biol. Chapter 3. 3, (2001).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PLoS One. 8 (12), 382392 (2013).
- Pecinová, A., Drahota, Z., Nůsková, H., Pecina, P., Houštěk, J. Evaluation of basic mitochondrial functions using rat tissue homogenates. Mitochondrion. 11 (5), 722-728 (2011).
- Lombardi, A., et al. Characterisation of oxidative phosphorylation in skeletal muscle mitochondria subpopulations in pig: a study using top-down elasticity analysis. FEBS Lett. 475 (2), 84-88 (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır